- Преподавателю
- Химия
- Таблица реакционной способности. Методическая разработка, позволяющая повторять, закреплять знания о реакционной способности оксидов, гидроксидов и солей. Подходит в любой параллели
Таблица реакционной способности. Методическая разработка, позволяющая повторять, закреплять знания о реакционной способности оксидов, гидроксидов и солей. Подходит в любой параллели
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Григорян И.Г. |
| Дата | 16.08.2015 |
| Формат | docx |
| Изображения | Есть |
Таблица реакционной способности веществ.
оксиды
гидроксиды
соли
вода
основный
амфотерный
кислотный
основания
амфотерные
кислоты
щёлочи
нерастворимые
О
К
С
И
Д
Ы
основный
Соль ( при сплавлении)
соль
Соль+вода
Щёлочь
Амфотерный
Соль (сплавление)
соль
В сплаве-соль и вода,
В растворе- комплекс ( добавить воду)
Соль+ вода
кислотный
соль
соль
Соль+ вода
*
кислота
Гид
Рок
Си
ды
основания
щёлочи
Соль+вода ( в сплаве), комплекс в растворе
Соль +вода
Соль+вода в сплавлении;
Комплекс в растворе
Соль+вода
Новая соль и новое основание
нерастворимые
Соль+вода
Амфотерные
Соль+ вода ( в сплавлении);
Комплекс ( в растворе)
Соль+вода
кислоты
Соль+вода
Соль+вода
Соль+вода
Соль+вода
Соль+вода
Новая соль+ новая кислота.
соли
Новая соль+новое основание
Новая соль+новая кислота
Две новых соли*
гидролиз
Особые свойства:
-
Нерастворимые основания и гидроксид лития: разлагаются при нагревании до оксида металла и воды;
-
Карбонаты термически разлагаются на оксид металла и оксид углерода (IV)
-
Нитраты разлагаются термически. Продукты зависят от положения металла в ряду напряжений. Если металл расположен левее магния ( кроме лития), то продуктами разложения являются нитрит и кислород; Металлы от магния до меди ( и литий) при разложении образуют оксид металла, оксид азота(IV) и кислород; Металлы, расположенные после меди, разлагаются на металл, оксид азота ( IV) и кислород.
-
Соль реагирует только в растворах, а значит обе реагирующие соли должны быть растворимы.
-
Признаками протекания реакции являются: наличие воды, выпадение осадка или выделение газа в обменных реакциях и реакциях замещения.
-
6. Разложение нитрата аммония зависит от температуры: температура ниже 270°C:
-
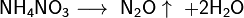 .
.
-
-
Температура выше 270 °C, или детонация:
-
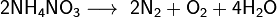
-
Соли реагируют с кислотными оксидами менее летучих кислот. Так, например, карбонаты реагируют с оксидом кремния (IV).
-
Оксиды металлов, стоящих в ряду напряжения после алюминия, реагируют с C, CO, H2 - пирометаллургический способ получения металлов.
-
Металлы, стоящие в ряду напряжения левее водорода, вытесняют его из кислот.
-
Металлы, расположенные правее магния, реагируют с растворами солей более слабых металлов.
-
-


