- Преподавателю
- Химия
- Конспект по химии: «Основные классы неорганических соединений»
Конспект по химии: «Основные классы неорганических соединений»
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Важева А.А. |
| Дата | 07.10.2013 |
| Формат | docx |
| Изображения | Есть |



 Тема №2.Основные классы неорганичеких соединений.
Тема №2.Основные классы неорганичеких соединений.
Целями всей этой темы, которую мы будем изучать, на протяжении 26 часов будет:
-определить, какие это основные классы неорганических соединений и дать им определение (чем они отличаются друг от друга);
-изучение физических свойств этих соединений;
-научиться самостоятельно, составлять химические формулы, пользуясь таблицей растворимости и Периодической системой;
-изучить химические свойства этих соединений;
-научиться самостоятельно, составлять химические реакции;
-закрепить знания решение задач по выученным формулам и научиться решать задачи по химическим уравнениям.
Урок №1.Основные классы неорганических соединений.
Целями сегодняшнего урока, определить , какие классы неорганических соединений бывают, определить, чем они отличаются между собой и дать каждому классу определение.
Если рассматривать внимательно все эти группы соединений, то можно заметить, что все они имеют ярко выраженные группы:
- Оксиды, состоят из 2-х элементов и на втором месте оксиген. Например: Na2O; SO2; Cl2O7.
-Кислоты, всегда на 1-м месте имеют гидроген, а на втором кислотный остаток. (Это все остатки, которые по таблице растворимости со знаком минус).
Например: H2SO4; HCl; H3PO4.
-Основания, всегда на 2-м месте имеют гидроксогруппу (ОН-) Например: NaOH; Cu(OH)2; Fe(OH)3.
Но есть ещё соединения, которые не имеют ярко выраженной группы - эти соединения называются солями и они состоят из катионов Kt+ металлов и анионов An-кислотного остатка.
Все «+» и «-» берём из таблицы растворимости.
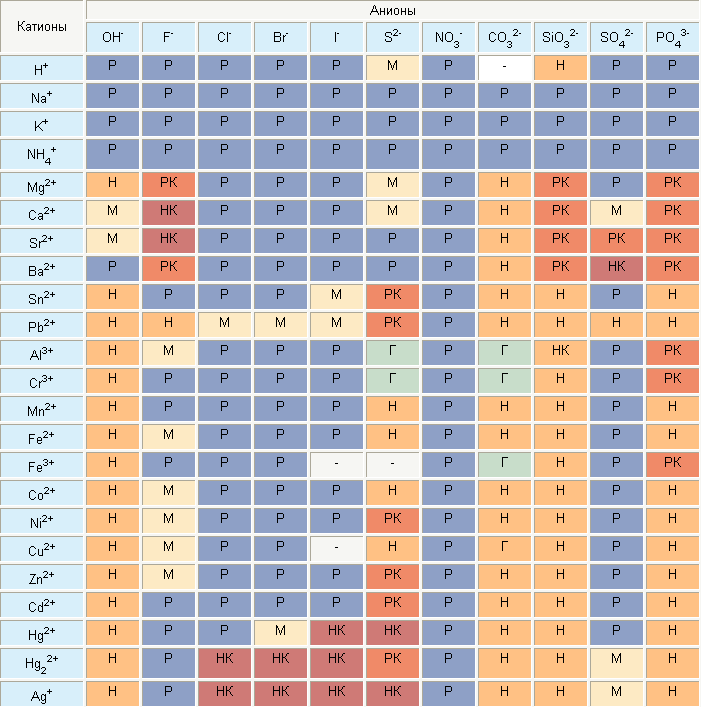
Р - растворимые, Н- нерастворимые, М- малорастворимые, но этими данными пока не пользуемся.
Составляем формулы таким же образом, как и по валентности.
Заряд вверху элемента (+ и -) обозначает степень окисления элемента и цифры, находящиеся вверху элемента, таким же образом перемемещаем вниз крест- накрест.
Например: Na+12SO-24; Са+2Сl-12.
И, сейчас мы рассмотрим некоторые образцы оксидов и определим их физические свойства.
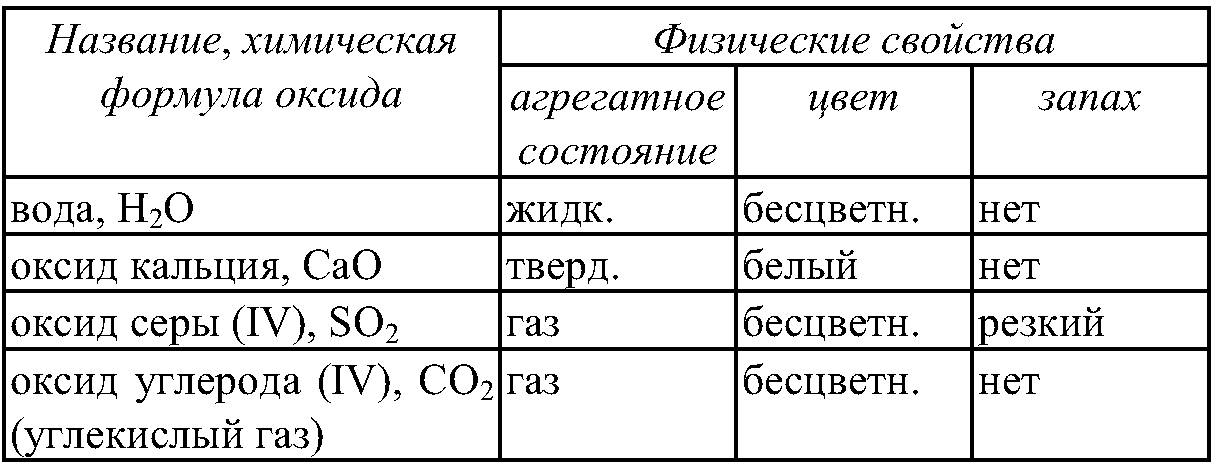
Итак, сегодня на уроке мы разобрались, чем отличаются основные классы один от одного, дали определение основным классам, на начальном уровне посмотрели, как составляются химические соединения, пользуясь, таблицей растворимости и рассмотрели, как выглядят основные классы неорганических соединений.
Урок №2. Оксиды, их состав, название и классификация оксидов.
На сегодняшнем уроке мы с вами ещё раз повторим, что мы называем оксидами, определим общую формулу оксидов и рассмотрим, какие бывают оксиды (классификацию оксидов).
Итак, давайте повторим, какие классы неорганических соединений мы с вами выучили на прошлом уроке и определим общие формулы этих соединений.
соединения
оксиды
кислоты
основания
соли
общая формула
Э+x 2О-2x
Н+1 y кислотный остаток-y
Ме+x (ОН-1)x
ме+x y (кислотный остаток)-yx
примеры
А сейчас, на основании повторения домашнего задания и определения общих формул напишем небольшую самостоятельную работу.
Сейчас давайте разберём , какие бывают оксиды, и чем они отличаются между собой.
Основные называются основными, потому, что при взаимодействии с водой образуют основание. Например:
Na2O+HOH→2NaOH(c)
Кислотные называются кислотными, потому, что при взаимодействии с водой они могут образовывать кислоты.
Например:
CO2 +HOH→H2CO3 (c)
Амфотерные оксиды - это переходные оксиды, которые в зависимости от условий могут приобретать кислотный или основной характер.
Это-Al2O3 , ZnO, Cr2O3 , SnO, Fe2O3 и т.д.
Эти соединения при взаимодействии с водой они образуют и основания, и кислоты.
Эти все оксиды называются солеобразуюшие, т. к. они все образуют соединения.
Но, есть и несолеобразующие оксиды, и они называются индиферентные.
Их надо запомнить: NO; CO; SiO; H2O.
Затем мы в различных игровых формах попробуем закрепить пройденный материал.
Итак, сегодня на уроке мы попытались повторить, что уже прошли, и выучить новое понятие, «классификация» и начали пробовать самостоятельно, составлять химические уравнения.
Урок№3. Кислоты. Их состав, названия и классификация кислот.
Целями нашего сегодняшнего урока будет повторить определение кислот, какую ярко - выраженную часть они имеют. Общую формулу , исходя из выше повторённого они имеют и выучить названия кислот и какими они бывают.
Итак, повторяем ещё раз все классы неорганических соединений и обращаем серьёзное внимание на определение кислот, вспоминаем общую формулу кислот, которую мы выводили на прошлом занятии.
Все химические соединения так же, как и вы имеют своё имя. Так все оксиды называются оксидами, только меняя элемент от которого они находятся.
Например: Na2O- оксид натрия.
SO2- оксид серы
CO2- оксид карбона.
А названия кислот надо выучить, т. к. от их будут исходить все названия солей.
Таблицу названия кислот можно взять из учебника по параграфу «Кислоты». Или из рабочей тетради на странице 14.
Итак, кислоты имеют общую формулу- Н+1 у кислотный остаток-у . Так какие е бывают кислоты?
Классификация кислот
По наличию оксигена в кислоте
- оксигеновые (кислородные): H2SO4 ; HNO3 ; H3PO4 .
- безоксигеновые (безкислородные): HCl; HBr; H2S.
По основности кислот
(основность кислот зависит от количества гидрогена в кислоте)
-одноосновновные:HCl; HNO3; HBr.
- двухосновные: H2S; H2CO3.
- трёхосновные:H3PO4.
По силе кислот:
(НО)мЭО3- очень сильные кислоты.
(НО)мЭО2-сильные кислоты.
(НО)мЭО- средние кислоты.
(НО)мЭ- слабые кислоты.
Э- это элемент, которым образована кислота.
Возвращаясь к вопросам названия кислот, мы можем вывести следующие правила и приведём с вами несколько примеров, определяя систему, которой можно придерживаться при названии кислот.
Например: кислота HF образована фтором, т.к. на первом месте у всех кислот находится Гидроген. Кислота называется фторидная.
Когда кислота безкислородная, то она имеет суффикс - ид.
Например: кислота H2SO4, такая кислота образована сульфуром. И имеет название сульфатная.
Когда кислота кислородная, то она будет иметь суффикс - ат и -ит.
При чём, если много кислорода, то суффикс - суффикс будет -ат.
А, если на один меньше, то суффикс -ит.
Например: H2SO3 - кислота сульфитная.
Подведём итоги:
H2SO4-сульфатная
H2SO3-сульфитная
H2S-сульфидная
Итак, сегодня мы с вами научились различать кислоты друг от друга и давать имена данным кислотам. А, так же повторили все определения основных классам основных неорганическим соединениям.
Урок №4. Соли (средние), их состав и названия.
Проверка домашнего задания в виде хим. диктант по формулам и классификации оксидов и кислот.
Сегодня на уроке мы с вами ещё раз повторим определение солей и вспомним общую формулу солей
Ме+х у(кислотный остаток)-у х
Как мы с вами уже говорили на прошлом занятии, что базу названий солей определяют названия кислот.
Например: НСl - кислота хлоридная
Если гидроген заменить на металл,
То образуется NaCl -хлорид натрия
H2SO4- сульфатная кислота
CaSO4 - сульфат кальция ит.д.
Но, помимо химических названий соли имеют ещё и тривиальные названия. Т. к. очень широко используются в жизни, то они и названия ещё имеют, которыми мы пользуемся в быту.
Например: NaCl- поваренная соль.
NaHCO3 - пищевая сода и т.д.
Те соли, которыми мы с вами пользуемся, называются средними.
Но, есть ещё кислые, основные, двойные, комплексные, оксисоли ит.д. Всё это имеет название классификации. Но о них мы будем говорить позже. А сейчас выполняем задание по учебнику давайте рассмотрим некоторые соли на странице 48.
А на странице 49-50 выполним следующие задания:72, 73,74,78.
Итак, сегодня на уроке мы подробнее познакомились с классом неорганических соединений - соли. Проследили взаимосвязь между названиями кислот и солей. И, вы уже сами научились составлять формулы солей.
Урок №5. Основания, их состав и названия. Классификация оснований.
В начале урока небольшая самостоятельная работа.
Сегодня мы закончим знакомиться в общем виде с классами неорганических соединений и со следующего урока мы уже начнём изучать химические свойства основных классов неорганических соединений.
Кислоты входят в состав некоторых моющих средств, но есть и моющие средства (например: для чистки плит) у которых на этикетках мы можем найти едкий натрий, едкий калий. Эти вещества не менее опасны, чем кислоты. И эти вещества противоположны по своим свойствам.
Вспомним общую формулу оснований
Ме+Х(ОН)х
Классификация оснований:
Т. е. какие они бывают
- по растворимости (по т. растворимости). Растворимые основания называют щелочами.
- по основности; основность оснований зависит от количества гидроксогрупп (ОН) в основании;
а) одноосновные: NaOH; KOH.
б) двухосновные: Ca(OH)2; Ba(OH)2.
в) трёхосновные: Fe(OH)3; Cr(OH)3.
- амфотерные: Zn(OH)2; Al(OH)3.
Вспомним, что такое амфотерность?
Амфотерность-это свойство химических соединений в зависимости от условий приобретать основной или кислотный характер.
Все основания, называются гидроксидами. Аналогично оксидам.
Например: гидроксид Na, гидроксид Ca и т.д.
Затем в различных игровых формах закрепим матеріал.
Итак, сегодня мы закончили изучать отличия между основними класами неорганических соединений и научились называть их. Со следующего урокам ы уже начнём изучать физические и химичекие свойства этих классов.
Урок №6. Физические и химичекие свойства. Оксиды в природе. Применение оксидов.
Изучая, эту тему мы попробуем разобраться с какими химическими класами химических элементов будут реагировать оксиды и, как это будет зависит от их классификации, а также рассмотрим, где мы встречаемся с оксидами в природе и, где находять своё применение оксиды.
Некоторые химичекие свойства мы уже с вами разобрали, и вы их писали уже самостоятельно.
Основные и кислотные в свою очередь реагируют между собой: Na2O+SO3→Na2SO4(c)
Первое действие ( взаимодействие с водой) мы с вами назвали, то которое мы уже проходили, когда изучали классификацию оксидов. И там мы выяснили, почему основные называются основными, а кислотные - кислотными.
Сказали, что амфотерные оксиды ведут себя, и как основные, и. как кислотные.
Здесь же мы показываем, что каждый класс реагирует с противоположным классом, и, ни в коем случае себе подобным.
Индиферентные, мы говорили, не образуют соединений. Поэтому не реагируют ни с кем.
Где же встречаются оксиды в природе.
А, вот интересные сообщения дома, где мы применяем оксиды вы можете подготовить, самостоятельно пользуясь учебником или другими средствами массовой информации.
Например, все мы с вами периодически ходим к стоматологу, но знаете ли вы, что одна из пломб, которую нам на стёклышке разводят - это оксид цинка с ортофосфорной кислотой.
Применение оксидов
Итак, сегодня на уроке, мы с вами обратили внимание, с какими классами неорганических соединений реагируют оксиды. Каким образом реагируют? Научились писать уравнения взаимодействия. Посмотрели, где мы встречаемся с оксидами в природе и, где люди находят применение им.
Урок №7. Физические и химические свойства кислот. Вытеснительный ряд металлов.
После проверки домашнего задания сегодня мы с вами определим, как надо работать с кислотами, особенность взаимодействия кислот с металлами и с основаниями, познакомимся с рядом активности металлов.
Мы первым слогом подзовем кота,
Вторым измерим с судна толщу вод,
Союз на окончание пойдет,
И целым станет слово...
(Кис-лот-а.)
Попробуем ответить на некоторые вопросы:
-почему железо ржавеет в воде?
-как металлы растворяются в кислоте?
-Почему золотые украшения не растворяются не воде, не в кислоте?
Итак, металлы реагируют со всеми классами неорганических соединений, но в зависимости от активности по- разному.
Определим, как реагируют кислоты с металлами. И о какой активности металлов идёт речь?
Активность металлов определяется по ряду активности металлов, который вывел выдающийся химик , наш соотечественник, т.к. он жил в г. Харькове - Николай Николаевич Бекетов. А сын его Алексей Николаевич был таким же выдающимся архитектором.
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Zn→Cr→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
И из этого ряда мы можем наблюдать, что до гидрогена у нас находятся активные металлы. А после гидрогена не активные. И причём стрелками указаны самые активные металлы и не активные.
1.Сейчас мы на практике это посмотрим.
Но, чтобы перейти к практике давайте все вместе определим, какой технике безопасности мы должны придерживаться при работе с кислотами.( Определяем вместе).
Не нюхать! Не пробовать! Не разливать! При попадании в глаза немедленно промыть проточной водой и сообщить учителю!!!
Ты в химкабинет пришел
Так запомни кроха
Безопасность хорошо,
Быть безруким плохо.
Ты над брюками держал
С кислотой пробирку?
Круто, парень, ты попал -
На штанишки с дыркой!
При работе с кислотой
Не нужна тревога.
С осторожностью простой
Избежишь ожога.
И, только после этого перейдём к некоторым опытам.
Каким образом ведет себя при взаимодействии с кислотами активный металл, например Zn и неактивный, например,Cu
Zn+2HCl→ZnCl2+H2, мы увидели, что выделился газ.
После написания уравнения реакции можно сказать, что это газ- водород. Такие реакции, которые происходят при взаимодействии простого и сложного соединения называются Реакциями замещения.
А при взаимодействии меди ничего не наблюдаем -реакция не происходит. И сейчас мы можем подтвердить ряд наших ответов, заданных в начале урока.
Cu+HCl→
2. Продемонстрируем взаимодействие кислоты и основания.
В небольшое количество добавим щёлочи. Что наблюдаем? Попробуем написать соответствующее уравнение реакции.
HCl+NaOH→ NaCl+HOH
Такие реакции, происходящие между двумя сложными соединениями, называются Реакциями обмена.
Такие реакции между щёлочью и кислотой, называются Реакциями нейтрализации.
3. Кислоту можно определить по среде раствора. Какую среду должна иметь кислота?
Так, вот эту среду можно определить индикатором, например, лакмусовой бумажкой. В кислой среде она приобретёт красное окрашивание.
Где же используем мы с вами кислоты в быту?
 Дом- музей Алексея Николаевича Бекетова, который родился в семье выдающегося химика Николая Николаевича Бекетова. В этом доме очень часто бывал Дмитрий Иванович Менделеев.(г.Алушта Профессорский уголок).
Дом- музей Алексея Николаевича Бекетова, который родился в семье выдающегося химика Николая Николаевича Бекетова. В этом доме очень часто бывал Дмитрий Иванович Менделеев.(г.Алушта Профессорский уголок).
Итак, сегодня мы с вами познакомились с рядом активности металлов и посмотрели, как он работает на практике, познакомились ещё с двумя типами химических реакций - это реакция обмена и реакцией замещения, а так же увидели, что такое реакция нейтрализации.
Урок №8. Решение расчётных задач по химическим уравнениям, используя расчётные формулы. Решение простых цепочек превращений.
Сегодня на уроке мы с вами уже, используем те уравнения реакций, которые мы с вами знаем в решении задач и по тем формулам, которые мы с вами выучили. А, так же встретимся с понятием «цепочка превращений» и научимся решать её. А, в конце урока напишем небольшую самостоятельную работу.
Итак, сейчас мы вспомним алгоритм решения задач, который мы с вами изучали в начале учебного года.
Алгоритм решения задач
-
Прочитать внимательно условие задачи.
-
Прочитать второй раз условие задачи, обращая внимание на цифры, чтобы правильно написать условие задачи.
-
Исходя из, того, что нам надо найти- пишем соответствующие формулы расчёта.
-
Прочитать третий раз условие задачи, не обращая внимание на цифры, а, обращая внимание,
есть ли, какое-то превращение или нет. Если есть, то пишем уравнение реакции.
-
Над уравнением пишем данные, которые по условию, а под уравнением соответствующие данные, которые мы находим через расчёты.
-
Составляем пропорцию и решаем задачу.
Задача.
Школьник Яблоков случайно уронил в нитратную кислоту кусочек оксида магния массой 80 г. Какое вещество и, какой массы получил неосторожный Яблоков. Найдите, пожалуйста, количества вещества этого вещества.
Решение:
1.Пользуясь, алгоритма читаем условие задачи, знакомясь в общем виде с ним.
2.Читаем второй раз условие задачи, и записываем условие задачи, придерживаясь, что
m- г
V - л
n - моль
Дано: 3. Читаем третий раз условие задачи и, если есть, превращение записываем уравнение реакции:
80г х г,n моль
m(MgO)=80г MgO+2HNO3 →Mg(NO3)2+H2O(c)
____________ М=40г/моль М=148г /моль
Найти:
m(в-ва)= ?
4. Над уравнением записали, те данные, которые нам даны по условию.
5. Под уравнением записали, те данные, которые мы посчитали, а именно относительную молекулярную массу, и, того вещества, которое нам дано, и которое надо нам найти.
6. Составляем пропорцию:
80г = Хг n=m/M
40г/моль 148 г /моль n=296/148=2моль (Mg(NO3)2)
X=(80*148):40=296г
Ответ: масса, полученного нитрата магния равна 296г, количество вещества нитрата магния равна 2 моль.
Вторая часть нашего урока направлена на знакомство с цепочкой превращения. Что это такое?
Цепочку превращений можно решить, зная хорошо химические свойства химических соединений.
В данном случае мы знаем только химические свойства оксидов и кислот. Поэтому, используя только свои знания пробуем решить следующую цепочку превращений:
Ca→CaO→Ca(OH)2
Алгоритм решение цепочек превращений.
-
Нумеруем действия решения (стрелочки).
1 2
Ca→CaO→Ca(OH)2
-
Используя химические свойства пишем по каждому действию уравнение реакции.
-
Записываем в каждом уравнении реакции тип химической реакции и расставляем коэффициенты.
1. 2Ca+O2→2CaO(c)
2. CaO+HOH→Ca(OH)2 (c)
Ну, а теперь вы сами сможете проверить свои знания, которые вы усвоили на самостоятельной работе.
Удачи!
Урок №8. Физические и химические свойства оснований. Техника безопасности при работе с основаниями.
На предыдущем уроке мы с вами закончили первый блок неорганических соединений и написали самостоятельную работу по темам: оксиды и кислоты. Сегодня мы познакомимся с физическими и химическими свойствами оснований. И, т.к. мы говорили, что по классификации они бывают растворимые и нерастворимые, поэтому химические свойства мы и разделим на 2 подпункта.
Вспомним общую оснований : Ме+х у(ОН)-ух
Продемонстрируем некоторые основания
Cu(OH)2- голубого цвета
Fe(OH)3- бурого цвета
Ni(OH)2- бледно- зелёного цвета.
А, теперь самостоятельно, пользуясь учебником, определите физические свойства оснований.
Теперь мы с вами перейдём к изучению химических свойств оснований.
Вспомним, что первоначально мы с вами поделили их по классификации на растворимы е и нерастворимые.
Но, основания можно, так же, как и кислоты, определить без каких-либо уравнений реакций. По индикатору можно определить щелочную среду раствора. 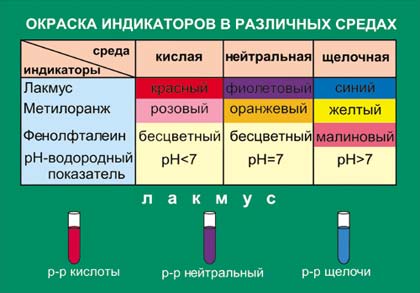 Обычный опыт, который вы можете провести дома. Бумагу, промоченную фенолфталеином (продаётся в аптеках) попрыскать содой. (Щелочная среда)
Обычный опыт, который вы можете провести дома. Бумагу, промоченную фенолфталеином (продаётся в аптеках) попрыскать содой. (Щелочная среда)
Правила т/б:
-щёлочь разъедает, кожу, древесину, бумагу, вызывает ожоги.
Не зря их называют едким натрием.
-шерстяная ткань, погружённая в щёлочь, превращается в гелеподобную массу.
-при попадании на кожу надо обильно смыть водой и протереть борнoй или уксусной кислотой.
химические свойства
Уравнение реакций давайте уже попробуем составить самостоятельно, а, также назвать все сложные соединения, которые у нас образовались, и расставить коэффициенты.
Итак, сегодня на уроке, мы с вами разобрали физические свойства оснований, посмотрели, какие они бывают. Разобрали, что общего и, что различного в химических свойствах между щелочами и не растворимыми основаниями.
Урок №9. Кислотно-основные взаимодействия.
Сегодня мы с вами ещё раз повторим, те химические свойства, которые прошли и закрепим навыки написания уравнений реакций.
Давайте устно попробуем ответить на некоторые вопросы:
-даны оксиды:CaO; K2O; Fe2O3. Каким гидроксидам они соответствуют?
-Даны оксиды:SO3 ;CO2; P2O5. Каким кислотам они соответствуют?
- Почему первые оксиды соответствовали гидроксидам, а вторые кислотам?
-Возможны ли реакции между гидроксидами и кислотами?
-Возможны ли реакции между кислотными оксидами и основными оксидами?
Отвечая, на все эти вопросы мы можем построить следующую схему себе в помощь.
Кислотно-основные взаимодействия
1.HCL+NaOH→
HCL+Na2O→
2.H2SO4+NaOH→
SO3 +NaOH→
Царь зовёт к себе Стрельца,
Удалого молодца.
И даёт ему порученье
Государственного значенья.
Чтоб я стал опять богат,
Нужен бария сульфат.
Ночь даю тебе подумать
Утром буду ждать доклад!
Не смогёшь - кого винить,
Я должон тебя казнить.
Запиши себе названье-
Чтобы в спешке не забыть.
Итак, давайте ребята попробуем помочь Стрельцу получить Бария сульфат.
Какая формула Бария сульфата?
К какому классу относится это соединение?
Из каких оксидов можно получить эту соль?
Написать уравнение реакции. И назвать тип химической реакции.
А, теперь от нас требуется расшифровать сказку.
Запишите, пожалуйста, содержание сказки с помощью формул и уравнений реакций, назовите тип химической реакции.
«Дружили Хлоридная Кислота Щёлочь - Гидроксид Натрия. Однажды Хлоридная кислота пригласила подругу в гости. Щёлочь надела своё фенолфталеиновое платье и стала малиновая. День был солнечный. Кислота решила показать подружке свой дивный сад. Вышли они в сад, но, что это? Все кусты, цветы, деревья засохли, хотят пить и просят помощи.
-Давай поможем им,- сказала кислота и задумалась.- А как?
-Я знаю, как им помочь!- воскликнула Щёлочь.- Объединить твою гидроксогруппу и мой гидроген.
- С удовольствием,- согласилась подруга.
Щёлочь обняла Кислоту и, они исчезли. Но, зато потекла вода по корням растений. Всё ожило вокруг, зазеленело, зацвело. И все поблагодарили подружек.
И, закрепим материал следующими цепочками превращений:
a) SO3→ H2SO4→ BaSO4
б) Mg→ MgSO4→ MgO→ MgCO3
Итак, как я вам сегодня в начале урока и обещала, мы закрепили уже пройденный материал и привели в систему.
Урок №10. Понятия про амфотерные основания и оксиды.
Сегодня на уроке мы ещё раз повторим понятии об амфотерных оксидах и основаниях и, посмотрим на особенности их взаимодействия с другими классами.
Вспомним, какое химическое свойство характерно для кислот?
Какое химическое свойство характерно для оснований?
Для прослеживания химических свойств амфотерных оснований мы сделаем следующий опыт.
В пробирку помещаем 1 мл щёлочи и туда же добавляем раствор соли цинка до образования белого осадка.
Написать соответствующее уравнение реакции.
Осадок делим на две порции.
В первую порцию добавим хлоридной кислоты - осадок растворится.
Напишите уравнение реакции.
Проблема:
А, будет ли этот осадок реагировать со щёлочью?
Решим эту проблему экспериментально. Добавим ко второй порции избыток щёлочи. Осадок растворится.
Напишите уравнение реакции.
Оксид цинка ведёт себя подобным образом.
Пробуем самостоятельно написать соответствующие реакции. Взаимодействия с кислотами и основаниями.

Амфотерный гидроксид (основная и кислотная форма)
Кислотный остаток и его валентность
Комплексный ион
Zn(OH)2 / H2ZnO2
ZnO2 (II)
[Zn(OH)4]2-
Al(OH)3 / HAlO2
AlO2 (I)
[Al(OH)4]-, [Al(OH)6]3-
Be(OH)2 / H2BeO2
BeO2 (II)
[Be(OH)4]2-
Sn(OH)2 / H2SnO2
SnO2 (II)
[Sn(OH)4]2-
Pb(OH)2 / H2PbO2
PbO2 (II)
[Pb(OH)4]2-
Fe(OH)3 / HFeO2
FeO2 (I)
[Fe(OH)4]-, [Fe(OH)6]3-
Cr(OH)3 / HCrO2
CrO2 (I)
[Cr(OH)4]-, [Cr(OH)6]3-
В качестве закрепления материала давайте попробуем решить следующую цепочку превращений. Al2O3 Al Al2O3 NaAlO2 AlCl3.
Сегодня мы попробовали закрепить, те знания, которые мы с вами получили на предыдущих уроках, и, усовершенствовали знания про амфотерные оксиды и гидроксиды.
Урок №11. Физические и химические свойства средних солей.
На данном уроке мы с вами закончим знакомство с химическими свойствами основным классов неорганичеких соединений. И последний класс, который мы с вами сегодня изучим - это соли.
Общая формула: Меnкислотный остатокm
Вспомним классификацию солей.
Классификация солей по составу
СОЛИ
Средние
(нормальные) -
AlCl3
Кислые(гидросоли)-
КHSO4
Основные(гидроксосоли) -
FeOHCl
Двойные -
КNaSO4
Смешанные -
CaClBr
Комплексные
[Cu(NH3)4]SO4
Физические свойства. Соли - это кристаллические вещества разных цветов и разной растворимости в воде.
Химические свойства:
-
Разложение при нагревании.
При нагревании некоторых солей они разлагаются на два оксида:
СаСO3  СаO + СО2.
СаO + СО2.
Соли бескислородных кислот при нагревании могут распадаться на простые вещества:
2AgCl  Ag + Cl2
Ag + Cl2
2) Пользуясь, рядом напряжения , более активные металлы вытесняют менее активные из солей.
Hg2+SO4
+
Sn→
Hg
+
Sn2+SO4
соль менее активного металла
более активный металл
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Zn→Cr→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
3) Обменные реакции солей.
Такие реакции могут происходить в растворах, когда соли реагируют:
а) с кислотам:
CuSO4 + H2S = CuS↓ (осадок) + H2SO4
AgNO3 + HCl = AgCl↓ (осадок) + HNO3
б) с щелочами:
FeCl3 + 3 NaOH = Fe(OH)3↓ (осадок) + 3 NaCl
CuSO4 + 2 KOH = Cu(OH)2↓ (осадок) + K2SO4
в) с другими солями.
BaCl2 + K2SO4 = BaSO4↓ (осадок) + 2 KCl
CaCl2 + Na2CO3 = CaCO3↓ (осадок) + 2 NaCl
А, теперь, попробуем самостоятельно дописать следующие обменные уравнения:
1) AgNO3 + FeCl3 =
2) Pb(NO3)2 + K2S =
3) Ba(NO3)2 + Al2(SO4)3 =
4) CaCl2 + Na3PO4 =
5) Na2S + HCl =
6) (NH4)2SO4 + KOH =
7) K2CO3 + H2SO4 =
8) Ba(HCO3)2 + H2SO4 =
9) Al2O3 + KOH (избыток) =
10) SiO2 + NaOH =
11) NaHCO3 + HCl =
12) NaHCO3 + NaOH =
Этим уроком мы и заканчиваем изучать химические свойства основных классов неорганичеких соединений.



