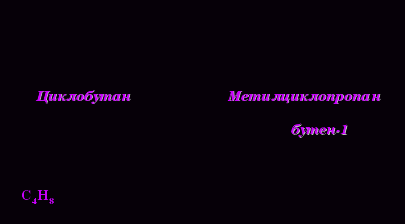- Преподавателю
- Химия
- Разработка урока по химии Алкены
Разработка урока по химии Алкены
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Воронина Г.Д. |
| Дата | 17.09.2015 |
| Формат | zip |
| Изображения | Есть |
Воронина Галина Дмитриевна, учитель химии
Муниципальное общеобразовательное учреждение средняя общеобразовательная школа с. Хмелинец Задонского муниципального района Липецкой области
Предмет: химия
Программа: О.С.Габриелян. Программа курса химии для 10-11 классов общеобразовательных учреждений (профильный уровень). М.: Дрофа, 2008
Класс: 10, профильный уровень
Урок № 9 в разделе 4 «Углеводороды»
Тема урока: «АЛКЕНЫ: СТРОЕНИЕ, СВОЙСТВА, ПОЛУЧЕНИЕ»
Урок - лекция с использованием мультимедийной презентации* (2 ч.)
-
Цели урока:
-
Воспитательные - продолжить формирование естественнонаучной картины мира, способствовать эстетическому воспитанию учащихся (оформление записей лекционного материала и т.п.)
-
Развивающие - на основе теоретических знаний развивать умения учащихся наблюдать, сравнивать, анализировать, обобщать, логически рассуждать, устанавливать взаимосвязь строения и свойств веществ.
-
Образовательные - познакомить учащихся с гомологическим рядом алкенов, рассмотреть особенности их химического и электронного строения, изомерию и номенклатуру. Развить полученные ранее теоретические представления об изомерии и умения давать названия соединений по систематической номенклатуре, умения составлять уравнения химических реакций с участием непредельных углеводородов. Рассмотреть промышленные и лабораторные способы получения алкенов, развить общие представления о типах и механизмах химических реакций на примере алкенов. Показать место и значение алкенов среди углеводородов.
2. Тип урока
Урок формирования и совершенствования знаний.
3. Методы обучения - словесные, наглядные, исследовательские. Метод проблемного изложения, диалогический метод, устный опрос, устный и письменный контроль, самоконтроль.
4. Средства обучения:
• мультимедийный проектор
• компьютер
• шаростержневые модели
Ход урока.
-
Вводная часть. Актуализация знаний обучающихся.
Сообщение темы и целей урока, мотивация учебного процесса (слайд 1, 2)
Активизация опорных знаний (слайд 3)
-
Алкены - углеводороды, содержащие в молекуле одну двойную связь между атомами углерода, а качественный и количественный состав выражается общей формулой
СnН2n, где n ≥ 2.
-
Алкены относятся к непредельным углеводородам, так как их молекулы содержат меньшее число атомов водорода, чем насыщенные.
-
Основная часть. Изучение нового материала.
-
Строение двойной связи С=С (слайд 4 - 6)
Двойная связь является сочетанием - и -связей (хотя она изображается двумя одинаковыми черточками, всегда следует учитывать их неравноценность). -Связь возникает при осевом перекрывании sp2-гибридных орбиталей, а -связь - при боковом перекрывании р-орбиталей соседних атомов углерода. Образование связей в молекуле этилена можно изобразить следующей схемой:
С=С -связь (перекрывание 2sp2-2sp2) и -связь (2рz-2рz) С-Н -связь (перекрывание 2sp2-АО углерода и 1s-АО водорода) -Связи, образуемые sp2-гибридными орбиталями, находятся в одной плоскости под углом 120. Поэтому молекула этилена имеет плоское строение.
По своей природе -связь резко отличается от -связи: -связь менее прочная вследствие меньшей эффективности перекрывания р-орбиталей. В молекуле пропилена СН2=СН-СН3 в одной плоскости лежат 6 атомов: два sp2-атома углерода и четыре связанные с ними атома (3 атома Н и атом С группы СН3). Вне этой плоскости находятся атомы водорода в метильной группе СН3, имеющей тетраэдрическое строение, т.к.этот атом углерода sp3-гибридизован. Аналогичное строение имеют другие алкены.
-
Гомологический ряд алкенов. Номенклатура (слайд 7-8)
По систематической номенклатуре названия алкеновых углеводородов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса -ан на -ен: 2 атома С этан этен; 3 атома С пропан пропен и т.д.
Главная цепь выбирается таким образом, чтобы она обязательно включала в себя двойную связь (т.е. она может быть не самой длинной). Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи. Цифра, обозначающая положение двойной связи, ставится обычно после суффикса - ен.
-
Изомерия алкенов (слайд 9 - 13)
Структурная изомерия
1. Изомерия углеродного скелета (начиная с С4Н8):
П

 римеры изомеров углеродного скелета (С5Н10)
римеры изомеров углеродного скелета (С5Н10)
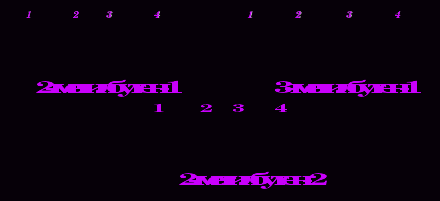
-
Изомерия положения двойной связи (начиная с С4Н8):
Примеры изомеров положения двойной связи (С5Н10)
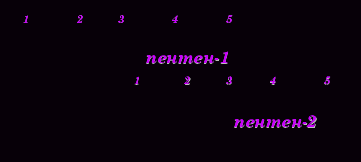
3. Межклассовая изомерия с циклоалканами, начиная с С3Н6 .
Пространственная изомерия (слайд ?)
Вращение атомов вокруг двойной связи невозможно без ее разрыва. Это обусловлено особенностями строения -связи (-электронное облако сосредоточено над и под плоскостью молекулы). Вследствие жесткой закрепленности атомов поворотная изомерия относительно двойной связи не проявляется. Но становится возможной цис-транс-изомерия. Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух пространственных изомеров, отличающихся расположением заместителей относительно плоскости -связи. Так, в молекуле бутена-2 СН3СН=СНСН3 группы СН3 могут находиться либо по одну сторону от двойной связи в цис-изомере, либо по разные стороны в транс-изомере. Цис-транс-изомерия не проявляется, если хотя бы один из атомов С при двойной связи имеет 2 одинаковых заместителя. Например, бутен-1 СН2=СНСН2СН3 не имеет цис- и транс-изомеров, т.к. 1-й атом С связан с двумя атомами Н.
Цис- и транс-изомеры отличаются не только физическими, но и химическими свойствами, т.к. сближение или удаление частей молекулы друг от друга в пространстве способствует или препятствует химическому взаимодействию.
4. Физические свойства (слайд 14)
Алкены плохо растворимы в воде, но хорошо растворяются в органических растворителях.
С увеличением молекулярной массы алкенов, в гомологическом ряду, повышаются температуры кипения и плавления, увеличивается плотность веществ.
5. Получение алкенов (слайд 15 - 21)
В природе алкены встречаются в значительно меньшей степени, чем предельные углеводороды, по-видимому, вследствие своей высокой реакционной способности. Поэтому их получают с использованием различных реакций.
I. Крекинг алканов:
t=400-700°C
С10Н22 → C5H12 + C5H10
декан пентан пентен
II. Отщепление (элиминирование) двух атомов или групп атомов от соседних атомов углерода с образованием между ними -связи.
-
Дегидрирование алканов при 500С (Pt, Ni,Al2O3,Cr2O3)
Ni, t=500°C
Н3С - СН3→Н2С = СН2 + Н2
этан этен
(этилен)
2. Дегидратация спиртов при t > 150 C в присутствии водоотнимающих реагентов H2SO4
CH3CH2OH CH2=CH2 + H2O
СH3CHOHCH2CH3 CH3CH=CHCH3 + H2O
3. Дегидрогалогенирование (отщепление галогеноводорода) :






 Brcпирт, t
Brcпирт, t
СН3СНСН2CH3 + NaOH CH3-СН=СНCH3+ NaBr+H2O
бутен - 2
Реакции элиминирования идут в соответствии с правилом Зайцева:
Отщепление атома водорода в реакциях дегалогенирования и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода.
4. Дегалогенирование:
H2СBrCH2Br+Zn H2C=CH2CH3+ZnBr2
-
Химические свойства алкенов (слайд 22 - 27)
1. Гидрирование (присоединение водорода)
Алкены взаимодействуют с водородом при нагревании в присутствии металлов Pt, Pd или Ni:
t, Ni
СН3CH=CH2 + Н2 СН3CH CH2
пропилен
Н Н
пропан
Присоединение водорода к атомам углерода в алкенах приводит к понижению степени их окисления:
-3 -1 -2 -3 -2 -3
СН3CH=CH2 + Н2 СН3CH2 CH3
Поэтому гидрирование алкенов относят к реакциям восстановления. Эта реакция используется в промышленности для получения высокооктанового топлива.
2. Галогенирование (присоединение галогенов)
Присоединение галогенов по двойной связи С=С происходит легко в обычных условиях (при комнатной температуре, без катализатора). Например, быстрое обесцвечивание красно-бурой окраски раствора брома в воде (бромной воды) служит качественной реакцией на наличие двойной связи.
СН3CH=CH2 + Br2 СН3CH CH2
пропилен
Br Br
1,2-дибромпропан
Еще легче происходит присоединение хлора:
CH2=CH2 + Сl2 Сl-СН2CH2-Сl
1,2-дихлорэтан
3. Гидрогалогенирование (присоединение галогеноводородов)
CH2=CH2 + HCl CH2 CH2
этилен
H Cl
хлорэтан
Реакция идет по механизму электрофильного присоединения с гетеролитическим разрывом связей. Электрофилом является протон Н+ в составе молекулы галогеноводорода. Направление реакции присоединения галогеноводородов к алкенам несимметричного строения (например, к пропилену CH2=CHСН3)
определяется правилом Марковникова:
В реакциях присоединения полярных молекул типа НХ к несимметричным алкенам водород присоединяется к более гидрогенизированному атому углерода при двойной связи (т.е атому углерода, связанному с наибольшим числом атомов водорода).
Так, в реакции HCl c пропиленом из двух возможных структурных изомеров
1-хлорпропана и 2-хлорпропана, образуется последний:
CH2=CHСН3 + HCl СН3CHCl CH3
пропилен 2-хлорпропан
Эта закономерность была первоначально установлена эмпирически. В современной органической химии дано теоретическое обоснование правила Марковникова на основе положения о влиянии электронного строения молекул на их реакционную способность. Следует отметить, что правило Марковникова в его классической формулировке соблюдается только для электрофильных реакций самих алкенов.
В случае некоторых производных алкенов или при изменении механизма реакции возможно несоблюдение этого правила.
4. Гидратация (присоединение воды)
t, H3PO4
CH2=CH2 + H2О CH2 CH2
этилен
H ОН
этиловый спирт
Гидратация происходит в присутствии минеральных кислот.
В реакциях несимметричных алкенов соблюдается правило Марковникова.
СН3CH=CH2 + H2О СН3CH CH2
пропилен
ОН Н
изопропиловый спирт
5. Реакция полимеризации
Полимеризация - реакция образования высокомолекулярного соединения (полимера) путем последовательного присоединения молекул низкомолекулярного вещества (мономера) по схеме:
n M M n
Число n называется степенью полимеризации. Реакции полимеризации
алкенов идут в результате присоединения по кратным связям:
кат.
n CH2=CH2 (-CH2-CH2-)n
полиэтилен
кат.
n CH2=CH (-CH2-CH-)n
СН3 СН3
пропилен полипропилен
Реакции окисления алкенов
Строение продуктов окисления алкенов зависит от условий реакции и природы окислителя.
1. Полное окисление (горение):
С2H4 + 3 O2 2 CO2 + 2 H2O + Q
Газообразные гомологи алкенов образуют с воздухом взрывчатые смеси.
2. Мягкое окисление алкенов водным раствором перманганата калия приводит
к образованию двухатомных спиртов:
KMnO4
СН2=СН2 + [O] + H2O HOCH2CH2OH
этилен этиленгликоль (этандиол)
Полное уравнение реакции:
3СН2=СН2 + 2KMnO4 + 4H2O 3HOCH2CH2OH + 2KOH + 2MnO2
(запись на доске)
В ходе этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMnO4. Поэтому она используется как качественная реакция на алкены.
3. При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде
происходит полный разрыв двойной связи:
KMnO4 (H+), t
СН3СН=СНСН3 + 4 [O] 2 СН3СООН
бутен-2 уксусная кислота
4. Промышленное значение имеет частичное окисление алкенов с образованием циклических оксидов, которые широко используются в органическом синтезе.
-
Применение алкенов ( слайд 28 - 29)
Алкены применяются в качестве исходных продуктов в производстве полимерных материалов (пластмасс, каучуков, пленок) и других органических веществ.
Этилен (этен) Н2С=СН2 используется для получения полиэтилена, политетрафторэтилена (тефлона), этилового спирта, уксусного альдегида, галогенопроизводных и других органических соединений. Применяется как средство для ускоренного созревания фруктов.
Пропилен (пропен) Н2С=СН2-СН3 и бутилены (бутен-1 и бутен-2) используются для получения спиртов и полимеров.
Изобутилен (2-метилпропен) Н2С=С(СН3)2 применяется в производстве синтетического каучука.
-
Первичное закрепление знаний (слайды 30-31)
-
Назвать приведенные вещества.
-
Дописать уравнения химических реакций.
-
Домашнее задание (слайд 32).
§ 12, стр. 24-25, № 3,4