- Преподавателю
- Химия
- Конспект РАСТВОРЕНИЕ. РАСТВОРИМОСТЬ ВЕЩЕСТВ В ВОДЕ (8 класс)
Конспект РАСТВОРЕНИЕ. РАСТВОРИМОСТЬ ВЕЩЕСТВ В ВОДЕ (8 класс)
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Конспекты |
| Автор | Гусева М.В. |
| Дата | 23.01.2016 |
| Формат | docx |
| Изображения | Есть |
Тема урока: РАСТВОРЕНИЕ. РАСТВОРИМОСТЬ ВЕЩЕСТВ В ВОДЕ.
Цель: расширить знания о процессе растворения, изучить типы растворов, факторы, влияющие на растворимость веществ в воде.
Задачи:
Образовательные:
-
Сформировать у учащихся знаний следующих основных химических понятий: раствор, растворение, гидраты, кристаллогидраты
-
Продолжить формирование умений и навыков планировать ответ, извлекать информацию при слушании и просмотре материала.
Развивающая:
-
Продолжить развивать умения сравнивать, осуществлять умственные действия по установлению сходства или различия между объектами, компактно и логически излагать свои мысли, развивать познавательный интерес учащихся к предмету при изучении типов растворов
Воспитывающая:
-
Продолжить воспитание у учащихся научного миропонимания химической картины мира, коммуникативных навыков (умение слушать и слышать);
Методы: Беседа, объяснение, рассказ, демонстрация.
Оборудование: мультимедийная установка, вода, песок, соли NaCl, 5 стаканчиков, стеклянная палочка, медный купорос CuSO4.5H2O, спиртовка, спички.
Тип урока: Изучение нового материала
Литература:
Габриелян О. С. Химия 8 класс : Учеб. для общеобразоват. учеб. заведений. - М.: Дрофа, 2010
Ход урока:
Основные этапы
Деятельность учителя
Деятельность учащихся
Организационный момент (1 - 2 мин)
Здравствуйте, ребята. Присаживайтесь. Ребята, кто сегодня дежурный? Назовите, пожалуйста, отсутвующих.
Ребята, всё ли необходимое есть на ваших столах?
Приветствие учителя.
Рапорт дежурного.
Проверяют наличие учебных принадлежностей к уроку.
Изучение нового материала
(30мин)
Тема сегодняшнего урока: «Растворение. Растворимость веществ в воде»
С растворами вы встречаетесь в жизни неоднократно. Так как они играют важную роль в природе, технике и науке.
Ребята, а где используются растворы?
Велика роль растворов в возникновении и развитии жизни на Земле. Одной из теорий возникновения организмов является теория зарождения жизни в первичном океане, который представлял собой воду с растворенными в ней веществами. Из этого раствора организмы получали необходимые для роста и развития ионы и молекулы.
В организме человека находятся физиологически важные растворы. Какие?
Различные процессы, происходящие в организме, протекают в растворах. Например, усвоение пищи связано с переводом питательных веществ в раствор.
В природе водные растворы участвуют в процессах почвообразования и снабжают растения питательными веществами.
В технике такие процессы, как получение соды, удобрений, бумаги, также протекают в растворах.
Так как растворы играют важную роль в жизни человека, изучение их свойств очень важно.
Что такое раствор и процесс растворения?
Существует несколько теорий растворов.
Представители физической теории растворов развивали такие ученые как Я.Х.Вант-Гофф, С.Аррениус, В.Оствальд. Они считали, что процесс растворения является результатом диффузии, т.е. проникновения растворенного вещества в промежутки между молекулами воды.
Сторонники химической теории, Д.И.Менделеев, И.А.Каблуков, доказывали, что растворение - это результат химического взаимодействия растворенного вещества с молекулами воды.
Доказательством химического взаимодействия служат такие признаки химических реакций как выделение или поглощение тепла при растворении.
Например, растворение серной кислоты в воде протекает с выделением большого количества тепла и раствор может закипеть.
Какое правило нужно соблюдать при смешивании раствора серной кислоты и воды?
Растворение же такого вещества как нитрата калия, сопровождается, наоборот, поглощением тепла.
В результате химического взаимодействия образуются соединения гидраты - непрочные соединения веществ с водой, существующие в растворе.
Косвенным доказательством гидратации является существование твердых кристаллогидратов.
Кристаллогидраты - соли и другие твердые вещества, в состав которых входит вода.
В этом случае вода называется кристаллизационной.
К кристаллогидратам относится хорошо известная всем соль голубого цвета - медный купорос CuSO4 . 5H2O
Демонстрация
Насыпем небольшое количество медного купороса в пробирку. Отметьте цвет вещества. Нагреем.
Что наблюдаете?
В чем причина изменения цвета?
Растворим в стаканчике с водой небольшое количество сухого сульфата меди (II). Что наблюдаете?
Изменение цвета сульфата меди (II) при растворении его в воде на синий является еще одним доказательством химической теории растворов.
В настоящее время принята теория, объединяющая обе точки зрения - физико-химическая теория Растворение - физико-химический процесс. Раствор - однородная система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия.
От чего зависит растворимость веществ в воде?
Факторы, от которых зависит растворимость веществ
Демонстрация
В пробирку с раствором ацетата свинца прильем раствор йодида калия. Что наблюдаете?
Нагреем пробирку с осадком йодида свинца. Что наблюдаете?
Поместим пробирку в холодную воду. Что наблюдаете?
Какой вывод можно сделать?
Почему мы кладем сахар в горячий чай?
Растворимость газов, напротив, с повышением температуры уменьшается. Поэтому воду можно почти полностью освободить от растворенных в ней газов кипячением.
Демонстрация
В 3 стаканчика нальем воды и добавим в 1 - нитрат натрия, во 2 - сульфат кальция, в 3 - песок. Перемешаем. Что наблюдаете?
Посмотрите в таблицу растворимости и приведите примеры растворимых, малорастворимых и нерастворимых веществ.
Из чего состоит раствор?
По содержанию растворенного вещества выделяют три типа растворов.
Типы растворов
Если растворить в данном объеме воды, например, соль при комнатной температуре, то раствориться может только определенное количество, сколько бы мы не перемешивали раствор с остатком нерастворившейся соли, больше соли не раствориться.
В этом случае говорят, что раствор насыщен этой солью при данной температуре.
Какой образуется раствор, если же при этой температуре в данном объеме воды растворить немного меньшее количество соли?
При осторожном и медленном охлаждении насыщенного раствора возникает избыток растворенного вещества, если оно не выпадает в осадок, то образуется пересыщенный раствор.
Концентрация растворов
На этикетках разнообразных растворов, используемых в быту, можно прочитать указания в них растворенного вещества. Например, уксусная кислота 70%, настойка йода 5%. Это один из способов выражения концентрации растворов, который называют массовой долей.
Как обозначают массовую долю вещества в растворе?
Данная формула необходима для практического использования при приготовлении и работе с растворами.
Записывают тему урока в тетрадь
Ответы учащихся (дома, на лабораторных занятиях)
Ответы учащихся (кровь, желудочный сок)
Записывают в тетрадь (Физическая теория, представители, Растворение - процесс диффузии)
Учащиеся записывают в тетрадь (химическая теория, представители, растворение - это результат химического взаимодействия растворенного вещества с молекулами воды.)
Слушают рассказ учителя
Сначала вода, потом кислота,
Иначе случиться большая беда!
Записывают определение (Гидраты - непрочные соединения веществ с водой, существующие в растворе.
Кристаллогидраты - соли и другие твердые вещества, в состав которых входит вода.
Отвечают учащиеся
(цвет вещества ярко синий), (вещество стало светло серого цвета), (отщепилась вода)
(раствор окрасился в синий цвет)
Учащиеся записывают в тетрадь (физико-химическая теория Растворение - физико-химический процесс. Раствор - однородная система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия.)
Наблюдают демонстрацию, отвечают на вопросы
(выпал осадок ярко желтого цвета),
(осадок растворился),
(осадок вновь выпал) (растворимость твердых веществ с повышением температуры увеличивается),
(чтобы быстрее растворился)
(NaNO3 растворился, CaSO4 частично, песок не растворился) (ученики приводят примеры)
(растворителя и растворенного вещества)
Слушают учителя
Ответ учащегося
(ненасыщенный)
Ответ ученика
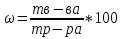
Закрепле-ние изученно-го материала
(7-10 мин.)
Ответьте на вопросы:
Что такое раствор?
Что такое растворение?
По рис. 123 учебника ответьте на вопросы:
1. Какова растворимость хлорида калия при 30 0С? (40 г)
2. Какова растворимость сульфата калия при 80 0С? (20 г)
Решите задачу:
Для консервирования огурцов приготовили рассол: на 2 л воды взяли 200 г соли, а для консервирования томатов приготовили рассол из 200 г соли и 3 л воды. Какой рассол получится более концентрированным?
Ответы учащихся
(Раствор - однородная система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия.
Растворение - физико-химический процесс.
1.40 г
2.20 г)
Решают задачу:
Дано:
V(H2O)2 = 2 л
m (соли1) = 100 г
V(H2O)2 = 3 л
m (соли2) = 100 г
ω1 - ?
ω2 - ?
Решение:
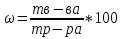
1. Найдем массу первого раствора
m (р-ра1) = m (соли1) + m(H2O)1 = 200 г + 2000 г = 2200 г
2. Определим массовую долю растворенного вещества в первом растворе.
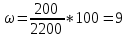
3. Найдем массу второго раствора
m (р-ра2) = m (соли2) + m(H2O)2 = 200 г + 3000 г = 3200 г
4. Определим массовую долю растворенного вещества во втором растворе.
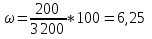
5. ω1 ˃ ω2, первый раствор более концентрированный.
Ответ: рассол для консервирования огурцов более концентрированный.
Домашнее задание
(2 мин.)
Ребята, открываем дневники и записываем домашнее задание
§ 34, упр. 5,7 (письменно).
Есть ли у вас вопросы?
Если нет вопросов, спасибо за внимание, можете быть свободны
Записывают домашнее задание в дневники


