- Преподавателю
- Химия
- ХИМИЯ МЕТОДИЧЕСКИЕ УКАЗАНИЯ ДЛЯ ПРАКТИЧЕСКИХ ЗАНЯТИЙ
ХИМИЯ МЕТОДИЧЕСКИЕ УКАЗАНИЯ ДЛЯ ПРАКТИЧЕСКИХ ЗАНЯТИЙ
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Болотина В.В. |
| Дата | 26.08.2015 |
| Формат | docx |
| Изображения | Есть |
















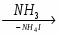
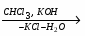
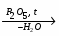
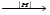
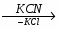
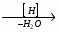
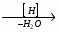
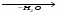
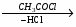
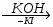
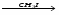
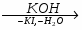
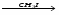
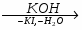
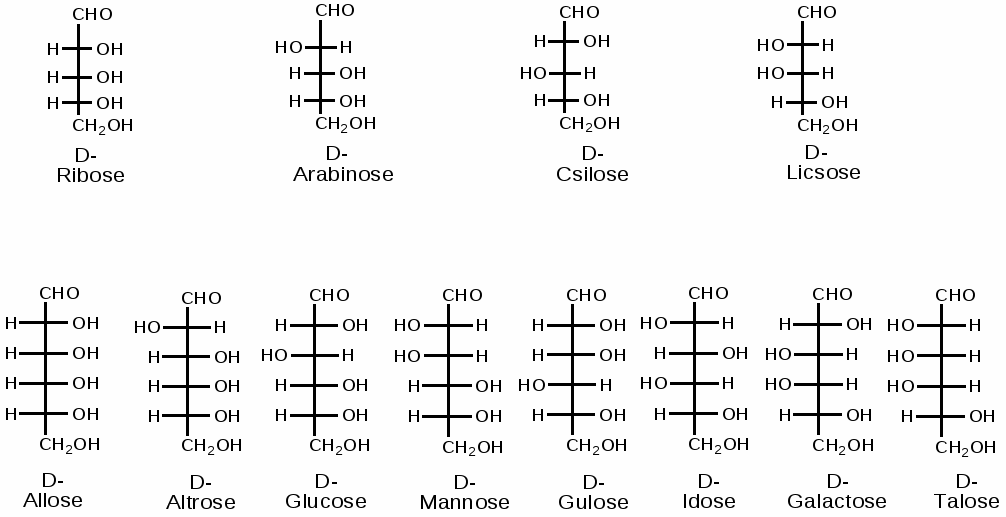
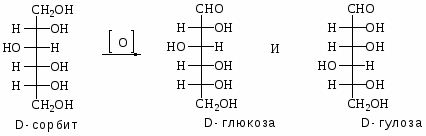
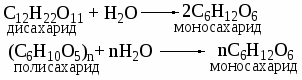
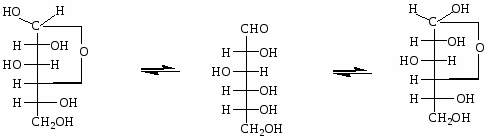
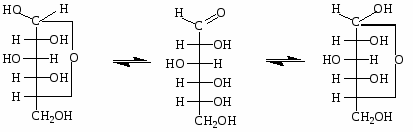
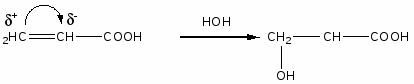
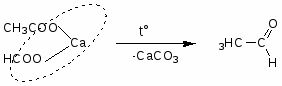
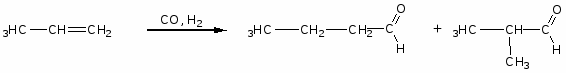
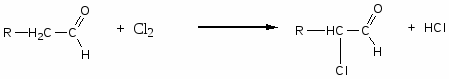
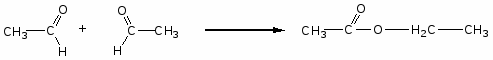
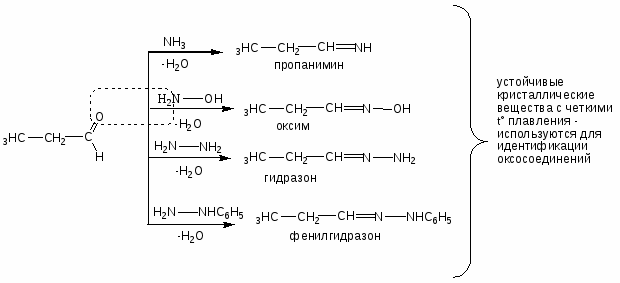
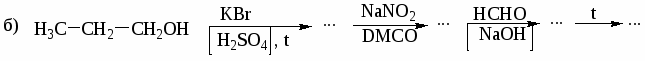
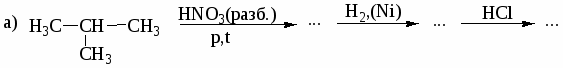
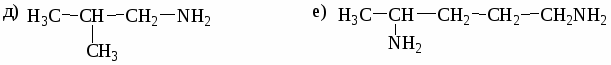
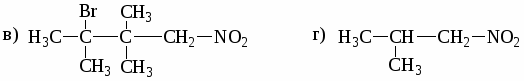
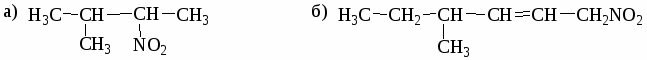
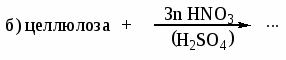
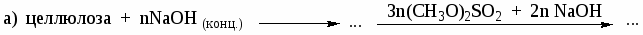
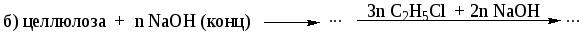
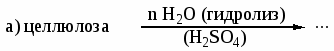
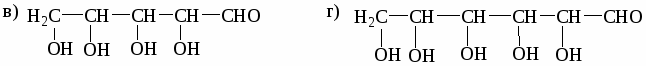

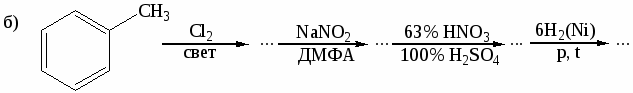
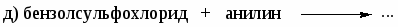
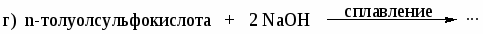
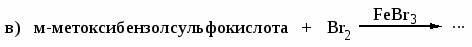
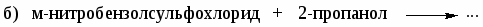

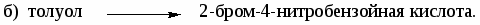
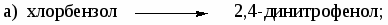
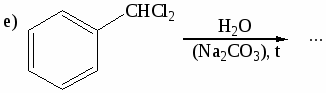
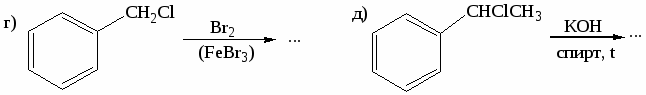
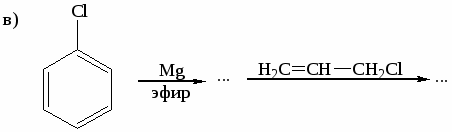
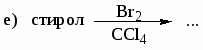
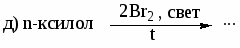
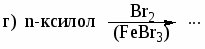
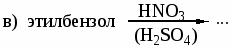
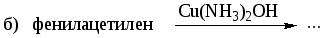
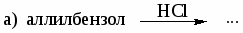
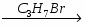
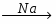
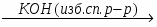

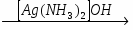



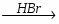
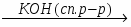
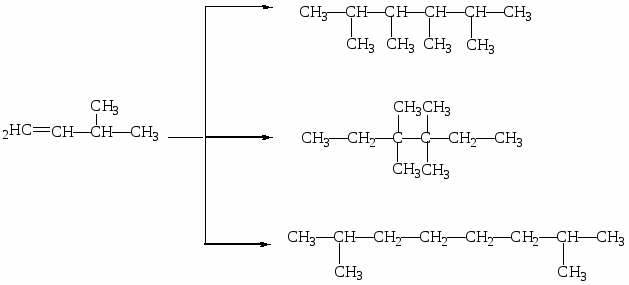
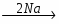
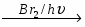
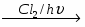
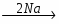
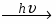
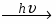
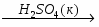
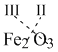
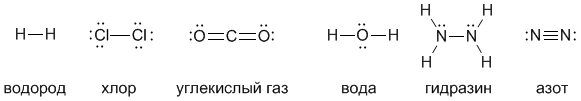
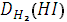
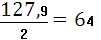
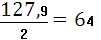
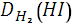
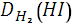
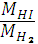
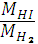
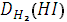
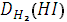
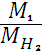
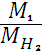
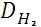
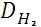
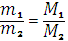
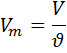

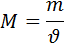
 МИНИCTEPCTBO ОБРАЗОВАНИЯ И НАУКИ
МИНИCTEPCTBO ОБРАЗОВАНИЯ И НАУКИ
РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное автономное образовательное учреждение
высшего профессионального образования
«СЕВЕРО-КАВКАЗСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ»
Институт сервиса, туризма и дизайна (филиал) СКФУ в г.Пятигорске
Политехнический колледж
ХИМИЯ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ДЛЯ ПРАКТИЧЕСКИХ ЗАНЯТИЙ
Специальности СПО
23.02.03 «Техническое обслуживание и ремонт автомобильного транспорта», 08.02.01 «Строительство и эксплуатация зданий и сооружений»,
09.02.01 «Компьютерные системы и комплексы»
Квалификация техник
Пятигорск 2015
Методические указания для практических занятий по дисциплине «Химия» предназначены для студентов, обучающихся по специальностям:
23.02.03 Техническое обслуживание и ремонт автомобильного транспорта,
08.02.01 «Строительство и эксплуатация зданий и сооружений»,
09.02.01 «Компьютерные системы и комплексы»
Рассмотрено на заседании ЦМК ИСТиД (филиала) СКФУ г. Пятигорске
Протокол №___ от «___»__________201__г.
Составитель: В.В. Болотина
Директор ПК Н.П. Константинова
Оглавление:
Введение:
Данные методические указания предназначены для закрепления теоретических знаний и приобретения необходимых практических навыков и умений по программе дисциплины "Химия" для специальностей 190631 «Техническое обслуживание и ремонт автомобильного транспорта» 270802 «Строительство и эксплуатация зданий и сооружений»
Практические занятия составлены в соответствии с требованиями «Федерального государственного образовательного стандарта среднего (полного) общего образования» (пр.№ 413 от 17.05.2012г.).
Целями проведения практических занятий являются:
-
обобщение, систематизацию, углубление, закрепление полученных теоретических знаний
-
формирование умений применять полученные знания на практике, реализацию единства интеллектуальной и практической деятельности;
-
выработку при решении поставленных задач таких профессионально значимых качеств, как самостоятельность, ответственность, точность, творческая инициатива.
Требования к знаниям и умениям при выполнении практических работ
В результате изучения учебного материала дисциплины и по ходу приобретения практических навыков работы, студент должен
уметь:
- называть изученные вещества по международной номенклатуре;
- определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, характер среды в водных растворах неорганических соединений, окислитель и восстановитель, принадлежность веществ к различным классам органических соединения;
- характеризовать: элементы малых периодов по их положению в периодической системе Д.И.Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических и органических соединений; строение и химические свойства изученных органических соединения;
- объяснять: зависимость свойств веществ от их состава и строения; природу химической связи (ионной, ковалентной, металлической), зависимость скорости химической реакции и положения химического равновесия от различных факторов;
- выполнять химический эксперимент по распознаванию важнейших неорганических и органических веществ;
- проводить самостоятельный поиск химической информации с использованием различных источников (научно - популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах;
знать:
- важнейшие химические понятия: вещество, химический элемент,
атом, молекула, относительные атомная и молекулярная массы, ион, аллотропия, изотопы, химическая связь, электропроницательность, валентность, степень окисления, моль, молярная масса, молярный объем, вещества молекулярного и немолекулярного строения, растворы, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление, тепловой эффект реакции, скорость химической реакции, катализ, химическое равновесие, углеродный скелет, функциональная группа, изомерия, гомология;
- основные законы химии: сохранения массы веществ, постоянства состава, периодический закон;
- основные теории химии: химической связи, электролитической диссоциации, строения органических соединений;
- важнейшие вещества и материалы: основные металлы и сплавы; серная, соляная, азотная и уксусная кислоты; щелочи, аммиак, минеральные удобрения, метан, этилен, ацетилен, бензол, этанол, жиры, мыла, глюкоза, сахароза, крахмал, клетчатка, белки, искусственные и синтетические волокна, каучуки, пластмассы
Требования к оформлению отчета по выполнению практической работы по химии.
• Оформление отчетов по выполнению практических работ осуществляется в тетрадях по химии.
• От предыдущей работы отступают 3-4 клетки и записывают дату выполнения работы и далее посередине следующей строки номер практической работы. Далее, каждый раз с новой строки записывают тему, цель. После строки «Ход работы» коротко поэтапно выполняется практическая работа. • Оформление отчета должно быть лаконичным. Форма отчета по выполнению практической работы не регламентируется, может быть произвольная.
• Таблицы заполняются четко и аккуратно, при этом таблица должна занимать всю ширину тетрадной страницы.
• В конце каждой практической работы обязательно записывается вывод по итогам выполненной работы (вывод формулируется исходя из цели практической работы) или приводятся ответы на контрольные вопросы .
Практическая работа № 1
Нахождение относительной молекулярной массы, определение массовой доли химических элементов в сложном веществе
Цель работы: закрепить и систематизировать знания студентов по качественному и количественному составу веществ. химическим знакам и формулам, относительным атомным и молекулярным массам, количеству вещества, закону Авогадро и следствиям из него.
Теоретический блок:
Количество вещества. Количество вещества определяется числом структурных единиц (атомов, молекул, ионов или др.) этого вещества и выражается в молях (моль).
Моль - это количество вещества, содержащее столько структурных
единиц, сколько атомов содержится в 12 г (0,012 кг) изотопа 12С.
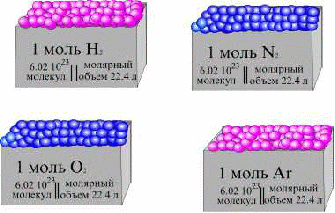
Понятие "моль" распространяется на любые структурные единицы (это могут быть реально существующие частицы, такие как атомы (К, О, С), молекулы (Н2, СО2), катионы (К+, Са2+), анионы (СО32-, I-) и любые другие.
Экспериментально установлено, что в указанном количестве изотопа 12С содержится 6,02 * 1023 атомов. Эта величина носит название число или постоянная Авогадро (NА); ее размерность - моль-1. При применении понятия "моль" надо указывать, какие структурные единицы имеются в виду.
Например, 1 моль атомов Н содержит 6,02 * 1023 атомов, 1 моль молекул Н2О содержит 6,02 * 1023 молекул , 1 моль ионов Н+ содержит 6,02 * 1023 ионов и т. д.
Рис.1. Следствие из закона Авогардо
Молярная масса
Отношение массы вещества (m) к его количеству (υ) представляет собой молярную массу вещества:
Молярная масса вещества численно равна относительной молекулярной массе этого вещества (Мr), выраженной в атомных единицах массы (а.е.м.). Так, молекула Н2О имеет массу (Мr) 18 а.е.м., а 1 моль Н2О (т.е. 6,02*1023молекул) имеет массу 18г.
Оценка величины числа Авогадро NА стала возможна после установления закона Авогадро (1811г.) : В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.
Так как 1 моль любого вещества содержит одинаковое число частиц (6,02*1023), следовательно, 1 моль любого газа при одинаковых условиях занимает одинаковый объем. Этот объем называется молярным объемом газа и при нормальных условиях (н.у.) составляет 22,4 л.
Нормальные условия по Международной системе единиц (СИ): давление 1,013*105 Па (760 мм рт.ст. = 1атм.); температура 273К (00 С).
Массовая доля элемента в данном веществе (w) - отношение относительной атомной массы данного элемента, умноженной на число его атомов в молекуле к относительной молекулярной массе вещества.
w(элемента) = (n· Ar(элемента) · 100%) / Mr(вещества)
где
w - массовая доля элемента в веществе,
n- индекс в химической формуле,
Ar- относительная атомная масса,
Mr- относительная молекулярная масса вещества.
Массовые доли выражают в процентах или в долях:
Например
Вычислите массовые доли элементов в фосфорной кислоте, имеющей простейшую химическую формулу H3 PO4, с точностью до сотых.
Дано:
Фосфорная кислота
H3 PO4
Решение:
1. Из Периодической таблицы имени Д.И.Менделеева выписываем значения относительных масс атомов элементов, входящих в состав фосфорной кислоты
Ar(H)=1
Ar(P)=31
Ar(O)=16
2. Вычисляем относительную атомную массу соединения
Mr(H3PO4) = 3·Ar(H) + Ar(P) + 4·Ar(O) = 3·1 + 31 + 4·16 = 98
3. Вычисляем массовые доли элементов по формуле:
w(элемента) = (n· Ar(элемента) · 100%) / Mr(вещества)
w(H) = n(H)·Ar(H)·100% / Mr(H3PO4) = 3·1·100% / 98 = 3,06%
w(P) = n(P)·Ar(P)·100% / Mr(H3PO4) = 1·31·100% / 98 = 31,63%
w(O) = n(O)·Ar(O)·100% / Mr(H3PO4) = 4·16·100% / 98 = 65,31%
Проверка
Сумма значений массовых долей всех элементов должна составить 100% w(H) + w(P) + w(O) = 100%
Подставляем значения,
3,06% + 31,63% + 65,31% = 100%
Таким образом, массовые доли элементов в фосфорной кислоте вычислены правильно.
Найти:
w%(H)
w%(P)
w%(O)
Ответ:
w(H) = 3,06%
w(P) = 31,63%
w(O) = 65,31%
Следствия из закона Авогадро
Из закона Авогадро следует,
-
При одинаковых условиях 1 моль любого газа занимает одинаковый объем.
-
При нормальных условиях 1 моль разных газов занимает объем - 22, 4 л (молярный объем)
-
Отношение масс объемов различных газов равно отношению их молярных масс
Отношение m1/m2 называется относительной плотностью первого газа по отношению ко второму и называется относительной плотностью. D
Относительную плотность обычно вычисляют по отношению к водороду или к воздуху.
=
=
Например:
Определите плотность иодоводорода по водороду и воздуху.
Дано:
Иодоводород
HI
Решение:
1.Находим молярную массу HI
M(HI) = 1 + 126,9= 127,9г/моль
2. М(Н2)= 2 г/моль
Мвозд. =29г/моль
3. Определяем относительную плотность иодоводорода по водороду:
=
=
4. . Определяем относительную плотность иодоводорода по воздуху:
Dв(HI)=127,9/29=4,4
Найти:
Ответ: 64, 4,4
Ход работы:
-
Решить задачи:
-
Какой объем занимает при н.у. оксид углерода (IV)массой 22г.
-
Вычислите относительную молекулярную массу оксида серы (IV)по значению его относительной плотности по водороду , равной 32.
-
Плотность галогеноводорода по воздуху - 4,41. Назовите газ и определите его плотность по водороду.
-
Массовая доля хлора в хлориде фосфора составляет 77,5 %, Определите формулу
-
Некоторая кислота содержит водород (2,2%), иод (55,7%), кислород (42,1%). Определите формулу.
-
Образец фосфора и брома массой 81,3г содержит фосфор массой 9,3г. Определите формулу.
-
Вычислите массовые доли элементов в этиловом спирте, имеющей простейшую химическую формулу С2Н5ОН с точностью до сотых.
-
Вычислите массовые доли элементов в уксусной кислоте, имеющей простейшую химическую формулу СН 3 СООН с точностью до сотых.
2 . Ответить на контрольные вопросы:
-
Дайте определения понятий:
-
Количество вещества,
-
Моль
-
Молярная масса
-
Массовая доля элемента в веществе
-
Сформулируйте закон Авогадро и следствия из него, применяемые при решении задач.
Практическая работа № 2
Электронно - графические формулы атомов элементов
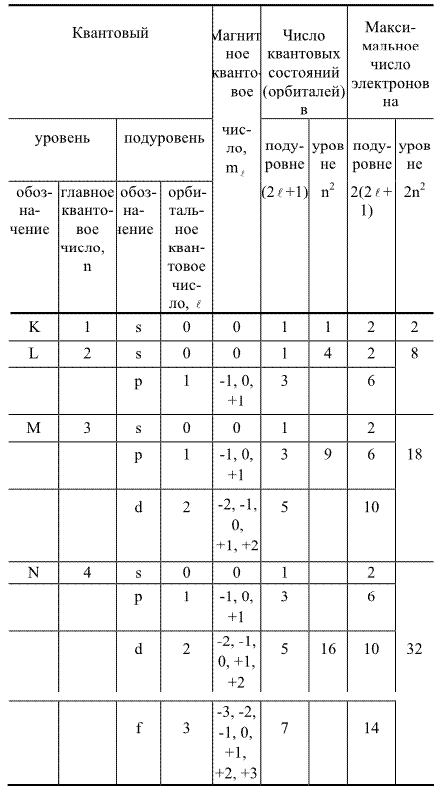
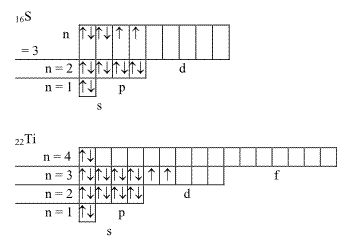
Цель работы: закрепить и систематизировать знания студентов по строению атома, состояниям электронов в атоме, формам электронных орбиталей (s, p, d, f), понятиям главное квантовое число, энергетические уровни и подуровни. Принципам построения электронно - графических формулы атомов элементов.
Теоретический блок
Составьте электронные и электронно-графические формулы атомов элементов с порядковыми номерами 16 и 22.
Решение:
Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д. И. Менделеева, то для серы -Z = 16, титана - Z = 22. Электронные формулы
имеют вид:
16S 1s ²2s² 2p ⁶3s ²3p⁴ ;
22Ti 1s ² 2s ²2p ⁶3s ²3p ⁶4s ²3d ²
Электронно-графические формулы этих атомов:
Таблица №1
Значения квантовых чисел и максимальное число электронов
на квантовых уровнях и подуровнях
Ход работы:
-
Составить электронно-графические формула для атомов с порядковыми номерами: 3,6, 45, 12, 9, 33, 21, 14.
-
Ответьте на контрольные вопросы:
-
Дать формулировку периодического закона.
-
Что называется периодом?
-
Какие периоды называются малыми?
-
Какие периоды называются большими?
-
Что называется группой?
-
На какие подгруппы делится группа?
-
Какая подгруппа называется главной?
-
Какая подгруппа называется побочной?
-
Физический смысл порядкового номера, номера группы, периода?
-
Чему равно число энергетических подуровней на каждом уровне?
-
Как обозначаются подуровни?
-
Сколько квантовых ячеек находится на s-, p-, d-, f- подуровнях?
-
Сколько электронов максимально может находиться на s-, p-, d-, f- подуровнях?
Практическая работа № 3
Определение химической связи в различных соединениях, степени окисления элемента, составление молекулярных и структурных формул
Цель работы: закрепить и систематизировать знания студентов по типам химической связи, понятиям валентность и степень окисления, отработать навыки составления молекулярных и структурных формул
Теоретический блок:
Валентность атома - это его способность образовывать определенное число химических связей с другими атомами. Например, число черточек, отходящих от символа элемента в структурных формулах, равно валентности этого элемента. Посмотрите на приведенные ниже структурные формулы некоторых веществ - из них видно, что водород и хлор одновалентны, кислород двухвалентен, углерод четырехвалентен, а азот трехвалентен.
Валентность определяется как число электронных пар, которыми данный атом связан с другими атомами.
Поскольку в химической связи участвуют только электроны внешних оболочек, такие электроны называютвалентными. Единичная (простая) связь возникает, когда атомы делят между собой одну пару валентных электронов.
Структурные формулы наглядно показывают состав вещества, последовательность связывания атомов друг с другом и валентность элементов. Но если такая подробная информация не нужна, состав вещества можно записывать в виде сокращенных химических формул:
H2 (водород) Cl2 (хлор) CO2 (углекислый газ) H2O (вода) N2H4 (гидразин) N2 (азот)
В данном случае все вещества состоят из молекул, поэтому такие формулы называют не просто сокращенными, а молекулярными. Цифра, стоящая внизу справа от символа элемента, называется индексом. Индекс показывает, сколько атомов данного элемента содержится в молекуле. Индекс 1 никогда не пишут.
Молекулярная формула показывает, сколько атомов каждого элемента входит в состав молекулы вещества.
Формулы веществ в простых случаях можно составлять по валентностям входящих в них элементов. И наоборот, зная валентности элементов, можно правильно составить из них химическую формулу.
Но как определяют валентности элементов? Для этого можно пользоваться нашими знаниями о строении внешних электронных оболочек атомов, как мы это уже делали при определении валентностей водорода, хлора, натрия, фтора, кислорода и азота в их конкретных химических соединениях.
Некоторые элементы проявляют в любых соединениях одну и ту же валентность. Таковы, например, водород, натрий, калий, серебро, фтор (валентность I); или магний, кальций (валентность II). Другие элементы могут - в зависимости от партнеров по химической реакции - проявлять несколько разных валентностей. Причину этого мы легко объясним чуть позже, исходя из строения их атомов.
В то время, когда химики еще ничего не знали о строении атомов, они успешно определили валентности многих элементов по данным химического анализа.
Анализ позволяет выяснить состав соединения, то есть численное соотношение атомов разных элементов в молекуле - молекулярную формулу. Делается это путем точного определения массы каждого элемента в образце, тщательно очищенном от примесей других веществ. С методикой анализа вы познакомитесь позже, в курсе органической химии. Сейчас же мы воспользуемся результатами уже проведенного анализа для определения валентности, например, азота.
Допустим, анализ чистого образца газа аммиака дает для его молекулы формулу NH3. Можно воспользоваться тем обстоятельством, что валентность водорода всегда I (традиционно валентность обозначают римскими цифрами). Поскольку водород всегда одновалентен, его атомы в этом соединении не могут быть связаны между собой. Значит, они связаны с азотом. Вывод: валентность азота III. Для этого соединения можно придумать единственную структурную формулу:
Еще одно наблюдение: кислород во всех соединениях двухвалентен. Поэтому, например, в соединении SO2валентность серы IV (валентность кислорода II умножить на 2 атома кислорода = 4), а в соединении SO3валентность серы - VI (валентность кислорода II умножить на 3 атома кислорода = 6).
В более сложных случаях можно дать лишь частичный ответ, но и он бывает полезен. Например, о соединении HClO4 мы можем лишь сказать, что остаток ClO4 - одновалентен (так как мы отняли от него одновалентный атом водорода). В соединении H2SO4 остаток SO4 - двухвалентен (отняли два одновалентных атома водорода). Поэтому для определения валентности какого-либо элемента годятся только его простые соединения с водородом и кислородом, содержащие только один атом изучаемого элемента. Требование простоты весьма существенно. Например, по составу соединения СН4 (метан) можно правильно заключить, что элемент углерод четырехвалентен. Но существует и более сложное соединение углерода С6Н6 (бензол), по которому судить о валентности углерода только из результатов анализа затруднительно.
Валентности некоторых элементов (традиционно записываются римскими цифрами). Для элементов с переменной валентностью первая цифра - наиболее распространенная валентность. В скобках указываются валентности, встречающиеся реже. Звездочками помечены элементы с постоянной валентностью.
Элемент
Валентность
* Водород (H)
I
* Натрий (Na)
I
* Калий (K)
I
* Серебро (Ag)
I
* Фтор (F)
I
Хлор (Cl)
I (III, V, VII)
Бром (Br)
I (III, V, VII)
Иод (I)
I (III, V, VII)
Ртуть (Hg)
I, II
Медь (Cu)
I, II
*Бериллий (Be)
II
* Магний (Mg)
II
* Кальций (Ca)
II
* Барий (Ba)
II
* Кислород (O)
II
Цинк (Zn)
II
Олово (Sn)
II (IV)
Свинец (Pb)
II (IV)
Железо (Fe)
II, III
Сера (S)
II, IV, VI
Марганец (Mn)
II, IV, VII
Хром (Cr)
III, VI
* Алюминий (Al)
III
Азот (N)
III (и другие)
Фосфор (P)
III, V
Углерод (C)
IV
Кремний (Si)
IV (II)
Например, надо записать формулу соединения железа (III) с кислородом (соединения элементов с кислородом называются оксидами). Запишем химические символы железа (Fe) и кислорода (O), а над символами поставим валентности этих элементов. Затем переместим вниз и крест-накрест значения валентностей, записав их справа (и внизу) около символов элементов в виде индексов:
Теперь сделаем проверку. Два атома трехвалентного железа дадут в сумме (2 х III = 6) свободных валентностей и столько же свободных валентностей (3 х II = 6) обеспечивают три атома двухвалентного кислорода. Свободных, неиспользованных валентностей у атомов не осталось. Значит, формула оксида железа (III) составлена правильно: Fe2O3.
Ход работы:
1. Решить задачи
-
Мы не изучаем химию элемента скандия. Тем не менее, основываясь на электронном строении атома 21Sc, сделайте следующее:
а) напишите электронную формулу скандия и определите его наиболее вероятную валентность (пользуясь правилом октета);
б) напишите формулу Льюиса для соединения скандия с хлором;
в) напишите простейшую и структурную формулы соединения скандия с хлором;
г) определите: будет ли связь Sc-Cl ковалентной (один вариант), либо (второй вариант) - полярной ковалентной или ионной. -
1) Используя валентности элементов, напишите формулы соединений: а) калия с фтором; б) магния с кислородом; в) кальция с водородом; г) алюминия с фтором; д) алюминия с кислородом.
2) Нарисуйте структурные формулы соединений и определите валентность каждого атома: а) HCl; б) BeCl2; в) AlBr3; г) PH3; д) TiCl4.
-
** 3.11. Напишите электронную формулу валентной оболочки элемента 34Se. Сколько поделенных и сколько неподеленных электронных пар в соединении H2Se? Нарисуйте его структурную формулу.
-
** 3.12. Нарисуйте структурную формулу для соединения SF6. Сколько поделенных и сколько неподеленных электронных пар в этом соединении? Примечание: фтор - сильнейший акцептор электронов, поэтому электронные пары химических связей сдвинуты от атома серы к атомам фтора. Как вы думаете, какому инертному газу "подражает" сера в этом соединении - аргону или неону?
-
Напишите формулы соединений хрома (III) и хрома (VI) с кислородом.
2. Ответить на контрольные вопросы:
-
Какая связь называется ковалентной?
-
Между атомами каких элементов образуется ковалентная связь?
-
Что называется ковалентной неполярной связью?
-
Что называется ковалентной полярной связью?
-
Что называется ионной связью? Что называется ионом?
-
Между атомами каких элементов образуется ионная связь?
-
Какая связь называется металлической?
-
Какая связь называется водородной?
-
Что называется валентностью?
Практическая работа № 4
Определение массовой доли растворенного вещества
Цель работы: закрепить и систематизировать знания студентов по теме «Растворы».
Теоретический блок:
I. Массовая доля растворённого вещества wрастворённого вещества - это безразмерная величина, равная отношению массы растворённого веществаmрастворённого вещества к общей массе раствора mраствора :
mраствора = mрастворённого вещества + mрастворителя
Массовую долю растворённого вещества (процентная концентрация) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества - CaCl2 в воде равна 0,06 или 6%. Это означает, что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
1. Расчет массовой доли растворенного вещества
Пример 1. Вычислить массовую долю хлорида натрия в растворе, если 40 г его растворено в 280 мл воды.
Решение:
ω(NaCl) =
Μΰρρΰ πΰρςβξπΰ m(π-πΰ) = m(NaCl) + m(H2O)
m(H2O) = V(H2O)•ρ(H2O) = 280 мл •1 г/мл = 280 г,
ω(NaCl) = = 0,125 или 12,5%
Ответ: ω(NaCl) = 0,125 или 12,5%.
Пример 2. В 258,3 г воды растворили 41,7 г кристаллогидрата FeSO4•7H2O. Определить массовую долю FeSO4 в полученном растворе.
Решение:
ω(FeSO4) =
Сначала рассчитываем массу раствора:
m(р-ра) = m(FeSO4•7H2O) + m(H2O) = 41,7 + 258,3 = 300 г
Далее определяем массу FeSO4:
m(FeSO4) = n(FeSO4)•M(FeSO4) = n(FeSO4•7H2O)•M(FeSO4) =
= •M(FeSO4) = = 22,8 г,
ω(FeSO4) = = 0,076 или 7,6%
Ответ: ω(FeSO4) = 0,076 или 7,6%.
Пример 3. Определить массовую долю хлороводородной кислоты, если в 1 л воды растворили 350 л HCl (н.у.).
Решение:
ω(HCl) =
Массу HCl определяем по формуле:
m(HCl) = n(HCl)•M(HCl) = •M(HCl) = •36,5 = 570,3 г.
Масса раствора m(р-ра) = m(HCl) + m(H2O) = m(HCl) + V(H2O)•ρ(H2O)
ω(HCl) = = 0,363 или 36,3%
Ответ: ω(HCl) = 0,363 или 36,3%.
Пример 4. Определите объем хлороводорода, измеренного при н.у., и объем воды, необходимые для приготовления 500 г раствора с массовой долей HCl 20%.
Решение:
Находим массу HCl:
m(HCl) = ω(HCl)•m(р-ра) = 0,2•500 = 100 г.
Рассчитываем объем HCl:
V(HCl) = n(HCl)•VM = •22,4 л/моль = 61,37 л.
Вычисляем m(H2O):
m(H2O) = m(р-ра) - m(HCl) = 500 - 100 = 400 г.
V(H2O) = = = 400 мл
Ответ: V(HCl) = 61,37 л, V(H2O) = 400 мл.
1. 1. Вычисление массы растворенного вещества или растворителя по массе раствора
Пример 5. Определите массу нитрата натрия и воды, необходимые для приготовления 800 г раствора с ω(NaNO3) = 12%.
Решение:
Масса растворенной соли:
m(NaNO3) = ω(NaNO3)•m(р-ра) = 0,12•800 = 96 г.
m(р-ра) = m(NaNO3) + m(H2O)
Отсюда
m(H2O) = m(р-ра) - m(NaNO3) = 800 - 96 = 704 г.
Ответ: m(NaNO3) = 96 г, m(H2O) = 704 г.
Пример 6. Определите массу кристаллогидрата CuSO4•5H2O и воды, необходимые для приготовления 0,4 кг раствора с ω(CuSO4) = 8%.
Решение (см. пример 2):
ω(CuSO4) = =
m(H2O) = m(р-ра) - m(CuSO4•5H2O)
m(CuSO4•5H2O) = n(CuSO4•5H2O)•M(CuSO4•5H2O)
n(CuSO4•5H2O)•= n(CuSO4) =
Находим
m(CuSO4) = ω(CuSO4)•m(р-ра) = 0,08•400 = 32 г.
n(CuSO4) = = 0,2 моль.
Отсюда m(CuSO4•5H2O) = 0,2•250 = 50 г
Масса воды m(H2O) = 400 - 50 = 350 г
Ответ: m(CuSO4•5H2O) = 50 г, m(H2O) = 350 г.
1. 2. Вычисление массы раствора определенной концентрации по заданной массе растворенного вещества или растворителя
Пример 7. Определить массу раствора с массовой долей K2SO4 10%, который можно приготовить из 200 г воды и сульфата калия.
Решение:
m(р-ра) =
Из условия задачи m(K2SO4) неизвестна, но известна масса воды, а поскольку вода - один из компонентов раствора, то:
ω(Н2О) = 100% - ω(K2SO4) = 100 - 10 = 90%
m(р-ра) = = = 222,2 г.
Ответ: можно приготовить 222,2 г раствора.
Пример 8. При растворении в 400 г воды некоторого количества CuSO4•5H2O получен раствор с массовой долей CuSO4 5%. Рассчитать массу использованного кристаллогидрата и массу полученного раствора.
Решение (см. примеры 2, 6):
m(р-ра) = =
В этом уравнении неизвестны m(р-ра) и m(CuSO4), но
m(р-ра) = m(CuSO4•5H2O) + m(H2O) = m(CuSO4•5H2O) + 400
Таким образом, неизвестны две величины: m(р-ра) и m(CuSO4•5H2O).
m(CuSO4) = n(CuSO4)•M(CuSO4)
m(CuSO4•5H2O) = n(CuSO4•5H2O)•M(CuSO4•5H2O)
M(CuSO4) = 160 г/моль, M(CuSO4•5H2O) = 250 г/моль.
Подставим эти величины в исходную формулу:
400 + n(CuSO4)•250 =
Решаем уравнение относительно n(CuSO4):
20 + 0,05•250• n(CuSO4) = n(CuSO4)•160,
n(CuSO4) = = 0,136 моль.
Отсюда
m(CuSO4•5H2O) = 0,136•250 = 34 г,
m(р-ра) = 400 + 34 = 434 г.
Возможны и другие варианты решения этой задачи:
ω(CuSO4) = =
В этом уравнении тоже два неизвестных - m(CuSO4) и m(CuSO4•5H2O), но величину m(CuSO4) можно представить в виде m(CuSO4•5H2O)•х.
Здесь х - массовая доля CuSO4 в кристаллогидрате, она равна:
х = = = 0,64
С учетом исходных данных, теперь можно записать:
0,05 =
Решаем уравнение относительно m(CuSO4•5H2O):
20 + 0,05 m(CuSO4•5H2O) = 0,66•m(CuSO4•5H2O)
m(CuSO4•5H2O) = 34 г.
Находим m(р-ра) = 400 + 34 = 434 г.
Ответ: для приготовления раствора используют 34 г CuSO4•5H2O, масса полученного раствора 434 г.
Ход работы
Решить задачи в соответствии с полученным вариантом
1. Определите массовую долю растворенного вещества (Х)% в следующих растворах:
Вариант
а
б
в
г
д
m(X), г
5
28
46,7
53,1
62,2
m(H2O), г
300
450
528
630
720
2. Рассчитать массу вещества (г), необходимую для приготовления следующих растворов:
Вариант
а
б
в
г
д
ω(Х),%
2
1
5
10
8
Объем р-ра, л
0,25
0,8
0,5
0,3
0,45
ρ, г/мл
1,015
1,007
1,046
1,090
1,067
3. Рассчитайте массу кристаллогидрата Х·nH2O (г) и объем воды (мл), необходимые для приготовления 500 мл следующих растворов:
Вариант
а
б
в
г
д
Вещество (Х·nH2O)
CuSO4·5H2O
FeSO4·7H2O
Na2SO4·10H2O
MgSO4·7H2O
AlCl3·6H2O
ω(соли),%
0,25
6
15
0,085
10
ρ, г/мл
1,06
1,11
1,13
1,04
1,02
4. Рассчитать массу кристаллогидрата Х·nH2O (г), которую надо растворить в воде для получения раствора, содержащего Х% безводной соли:
Вариант
а
б
в
г
д
Вещество (Х·nH2O)
CuSO4·5H2O
FeSO4·7H2O
Na2SO4·10H2O
MgSO4·7H2O
AlCl3·6H2O
ω(Х),%
8
15
18
6
20
Объем воды
0,66 л
400 мл
0,75 л
350 мл
900 мл
5. Сколько литров газа (н.у.) необходимо растворить в V мл воды для получения раствора с массовой долей, указанной в таблице:
Вариант
а
б
в
г
д
ω(Х),%
17
30
2
1,5
3
Вещество
NH3
HCl
CO2
SO2
H2S
V воды, мл
200
1500
900
600
1000
6. Определить объем воды, в котором надо растворить V л газа (н.у.), для получения раствора с указанной массовой долей:
Вариант
а
б
в
г
д
ω(Х),%
20
25
3
2
15
Вещество
NH3
HCl
CO2
SO2
H2S
V, л
40
56,5
3,2
12,5
1,5
Практическая работа № 5
Химические свойства классов неорганических соединений
Цель работы: закрепить и систематизировать знания студентов по номенклатуре, химическим свойствам, способам получения основных классов неорганических соединений, отработать понятие генетическая связь между классами неорганических соединений при решении задач.
Теоретический блок:
Кислотные оксиды
-
Кислотный оксид + вода = кислота (исключение - SiO2)
SO3 + H2O = H2SO4
Cl2O7 + H2O = 2HClO4 -
Кислотный оксид + щелочь = соль + вода
SO2 + 2NaOH = Na2SO3 + H2O
P2O5 + 6KOH = 2K3PO4 + 3H2O -
Кислотный оксид + основный оксид = соль
CO2 + BaO = BaCO3
SiO2 + K2O = K2SiO3
Основные оксиды
-
Основный оксид + вода = щелочь (в реакцию вступают оксиды щелочных и щелочноземельных металлов)
CaO + H2O = Ca(OH)2
Na2O + H2O = 2NaOH -
Основный оксид + кислота = соль + вода
CuO + 2HCl = CuCl2 + H2O
3K2O + 2H3PO4 = 2K3PO4 + 3H2O -
Основный оксид + кислотный оксид = соль
MgO + CO2 = MgCO3
Na2O + N2O5 = 2NaNO3
Амфотерные оксиды
-
Амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3H2O
ZnO + H2SO4 = ZnSO4 + H2O -
Амфотерный оксид + щелочь = соль (+ вода)
ZnO + 2KOH = K2ZnO2 + H2O (Правильнее: ZnO + 2KOH + H2O = K2[Zn(OH)4])
Al2O3 + 2NaOH = 2NaAlO2 + H2O (Правильнее: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]) -
Амфотерный оксид + кислотный оксид = соль
ZnO + CO2 = ZnCO3 -
Амфотерный оксид + основный оксид = соль (при сплавлении)
ZnO + Na2O = Na2ZnO2
Al2O3 + K2O = 2KAlO2
Cr2O3 + CaO = Ca(CrO2)2
Кислоты
-
Кислота + основный оксид = соль + вода
2HNO3 + CuO = Cu(NO3)2 + H2O
3H2SO4 + Fe2O3 = Fe2(SO4)3 + 3H2O -
Кислота + амфотерный оксид = соль + вода
3H2SO4 + Cr2O3 = Cr2(SO4)3 + 3H2O
2HBr + ZnO = ZnBr2 + H2O -
Кислота + основание = соль + вода
H2SiO3 + 2KOH = K2SiO3 + 2H2O
2HBr + Ni(OH)2 = NiBr2 + 2H2O -
Кислота + амфотерный гидроксид = соль + вода
3HCl + Cr(OH)3 = CrCl3 + 3H2O
2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O -
Сильная кислота + соль слабой кислоты = слабая кислота + соль сильной кислоты
2HBr + CaCO3 = CaBr2 + H2O + CO2
H2S + K2SiO3 = K2S + H2SiO3 -
Кислота + металл (находящийся в ряду напряжений левее водорода) = соль + водород
2HCl + Zn = ZnCl2 + H2
H2SO4 (разб.) + Fe = FeSO4 + H2
Важно: кислоты-окислители (HNO3, конц. H2SO4) реагируют с металлами по-другому.
Амфотерные гидроксиды
-
Амфотерный гидроксид + кислота = соль + вода
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
Be(OH)2 + 2HCl = BeCl2 + 2H2O -
Амфотерный гидроксид + щелочь = соль + вода (при сплавлении)
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O -
Амфотерный гидроксид + щелочь = соль (в водном растворе)
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Sn(OH)2 + 2NaOH = Na2[Sn(OH)4]
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
Al(OH)3 + NaOH = Na[Al(OH)4]
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Щелочи
-
Щелочь + кислотный оксид = соль + вода
Ba(OH)2 + N2O5 = Ba(NO3)2 + H2O
2NaOH + CO2 = Na2СO3 + H2O -
Щелочь + кислота = соль + вода
3KOH + H3PO4 = K3PO4 + 3H2O
Bа(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O -
Щелочь + амфотерный оксид = соль + вода
2NaOH + ZnO = Na2ZnO2 + H2O (Правильнее: 2NaOH + ZnO + H2O = Na2[Zn(OH)4]) -
Щелочь + амфотерный гидроксид = соль (в водном растворе)
2NaOH + Zn(OH)2 = Na2[Zn(OH)4]
NaOH + Al(OH)3 = Na[Al(OH)4] -
Щелочь + растворимая соль = нерастворимое основание + соль
Ca(OH)2 + Cu(NO3)2 = Cu(OH)2 + Ca(NO3)2
3KOH + FeCl3 = Fe(OH)3 + 3KCl -
Щелочь + металл (Al, Zn) + вода = соль + водород
2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2
2KOH + 2Al + 6H2O = 2K[Al(OH)4] + 3H2
Соли
-
Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота
Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3
BaCO3 + 2HCl = BaCl2 + H2O + CO2 (H2CO3) -
Растворимая соль + растворимая соль = нерастворимая соль + соль
Pb(NO3)2 + K2S = PbS + 2KNO3
СaCl2 + Na2CO3 = CaCO3 + 2NaCl -
Растворимая соль + щелочь = соль + нерастворимое основание
Cu(NO3)2 + 2NaOH = 2NaNO3 + Cu(OH)2
2FeCl3 + 3Ba(OH)2 = 3BaCl2 + 2Fe(OH)3 -
Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*)
Zn + CuSO4 = ZnSO4 + Cu
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Важно: 1) металл (**) должен находиться в ряду напряжений левее металла (*), 2) металл (**) НЕ должен реагировать с водой
Ход работы:
-
Выполнить задание
Какие из приведенных веществ генетически взаимосвязаны?
Вариант 1.Na, Ba, SO2 , HCL , Ba(NO3)2 , BaO, CO2, Ba(OH)2 , Ca(OH)2
Вариант 2.Cu, K, CO2, Cu(OH)2 , H2SO4, Cu SO4 , Zn(OH)2 ,NaNO3 , CuO
Вариант 3. .Na, NaNO3, HCL, H2SO4 , NaOH, Сu(OH)2 , Na2O, Ba(NO3)2
Вариант 4. BaO, CO2 , Mg(OH)2, HCL, Mg, , NaNO3 , MgCL2 K, MgО
Вариант 5. CO2, , Сu(OH)2 , СaCO3 , Na2O, С, Zn(OH)2 , H2СO3
Составьте уравнения реакций, подтверждающих их генетическую связь.
-
Выполнение тестовых заданий по вариантам.
Вариант I
1. Формулы только кислот приведены в ряду 1) НСl, NaCl, HNO3
2) H2SO3, H2SO4, H2S
3) Ca(OH)2, H3PO4, Ca3(PO4)2
4) Na2O, NaNO3, HNO3
2. Формулы только щелочей приведены в ряду
1) Fe(OH)2, KOH, Ва(ОН)2
2) NaOH, Ca(OH)2, Cu(OH)2
3) KOH, NaOH, LiOH
4) Fe(OH)3, Cu(OH)2, NaOH
3. Оксид, который реагирует с гидроксидом натрия, образуя соль,- это
1) Fe2O3; 2) К2О; 3) SO3; 4) BaO
4. Взаимодействие оксида с водой относится к реакциям
1) соединения; 2) обмена; 3) разложения; 4) замещения
5. Взаимодействие гидроксида меди(II) с азотной кислотой относится к
реакциям
1) соединения; 2) разложения; 3) замещения; 4) обмена
6. Индикатор фенолфталеин в щелочной среде становится
1) бесцветным; 2) малиновым; 3) красным; 4) желтым
7. Свойство, которое является общим для нерастворимых оснований и
щелочей,- это
1) взаимодействие с кислотными оксидами;
2) взаимодействие с кислотами;
3) взаимодействие с солями;
4) разложение
8. Даны формулы веществ:
FeO, K2O, CO2, MgO, CrO, CrO3, SO2, Р2О5
Выпишите формулы только основных оксидов.
Ответ:_______________________________
9. Установите соответствие между химической формулой вещества и
классом неорганических соединений, к которому оно принадлежит.
1) MgO А. кислоты
2) Н3РО4 Б. щелочи
3) Аl(ОН)3 В. оксиды
4) NaOH Г. нерастворимые основания
10. Установите соответствие между исходными веществами и продуктами
химических реакций.
1) HgO + HNO3 A. Al2(SO4)3 + Н2
2) Al + H2SO4 Б. K3РО4 + Н2О
3) Na2O + CO2 + H2O B. Hg(NO3)2+ Н2О
4) K2O + H3PO4 Г. Na2CO3 + Н2О
Вариант II
1. Формулы только солей приведены в ряду
1) K2СО3, Н2СО3, KOH
2) АlСl3, Al(NO3)3, Al2S3
3) H2S, Ba(NO3)2, BaCl2
4) Cu(OH)2, CuSO4, CuS
2. Формулы только бескислородных кислот приведены в ряду
1) НСl, HNO3, H2S
2) H2SO3, H2S, HNO2
3) Н3РО4, Н2СО3, H2S
4) H2S, HF, HCl 3. Оксид, который реагирует с кислотой, образуя соль, - это
1) Р2О5
2) СuО
3) SO2
4) СО2
4. Получение оксида металла при нагревании гидроксида металла
относится к реакциям
1) соединения; 2) обмена; 3) разложения; 4) замещения
5. Химическая реакция, уравнение которой
K2О + 2HNO3 = 2KNO3 + Н2О,
относится к реакциям
1) разложения; 2) соединения; 3) обмена; 4) замещения
6. Индикатор лакмус в щелочной среде становится
1) фиолетовым; 2) красным; 3) синим; 4) бесцветным
7. В каком ряду все основания, формулы которых приведены, разлагаются
при нагревании?
1) NaOH, Сr(ОН)2, Са(ОН)2
2) Fe(OH)3, Cu(OH)2, Fe(OH)2
3) Ва(ОН)2, Mg(OH)2, KOH
4) KOH, LiOH, Al(OH)3
8. Даны формулы веществ:
СО2, Na2O, СаО, МnО, Мn2О7, Сl2О7, Li2O, P2O5
Выпишите формулы только кислотных оксидов. Ответ: _____________________________________
9. Установите соответствие между химической формулой вещества и его
названием.
1) FeCl3 А. нитрат меди(П)
2) Cu(NO3)2 Б. карбонат калия
3) Al2(SO4)3 В. хлорид железа(III)
4) K2СО3 Г. сульфат алюминия
10. Установите соответствие между исходными веществами (веществом) и
продуктами химических реакций.
1) NaOH + СО2 A. FeO + Н2О
2) NaOH + H2SO4 Б. Na2CO3 + Н2О
3) Fe(OH)2 + НСl В. Na2SO4 + Н2О
4) Fe(OH)2 Г. FeCl2 + Н2О
Вариант 1
1 - 2)
2 - 3)
3 - 3)
4 - 1)
5 - 4)
6 - 2)
7 - 2)
8 - FeO, K2O, MgO, CrO
9. 1-В,2-А, 3-Г, 4-Б
10.1-В, 2-А, 3-Г, 4-Б
Вариант 2
1 - 2)
2 - 4)
3 - 2)
4 - 3)
5 - 3)
6 - 3)
7 - 2)
8 - CO2, Mn2O7, Cl2O7, P2O5
9. 1-В,2-А, 3-Г, 4-Б
10.1-Б, 2-В, 3-Г, 4-А
Практическая работа № 6
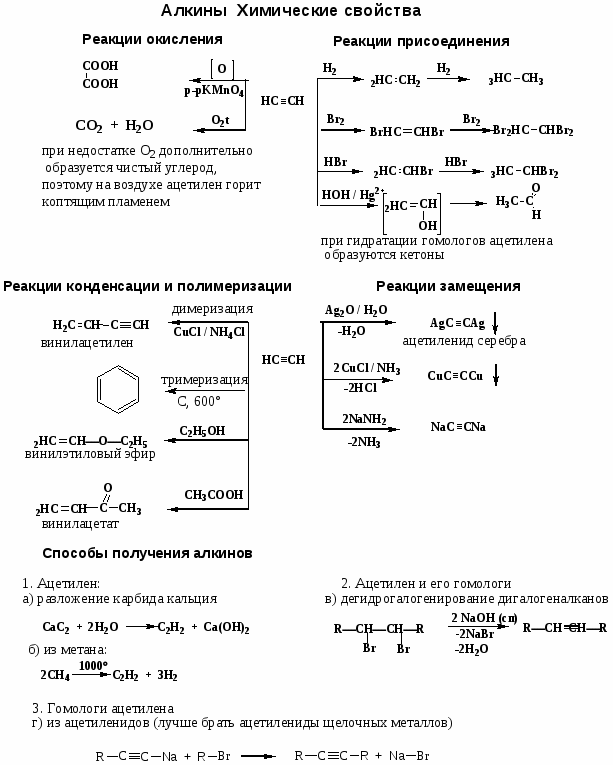
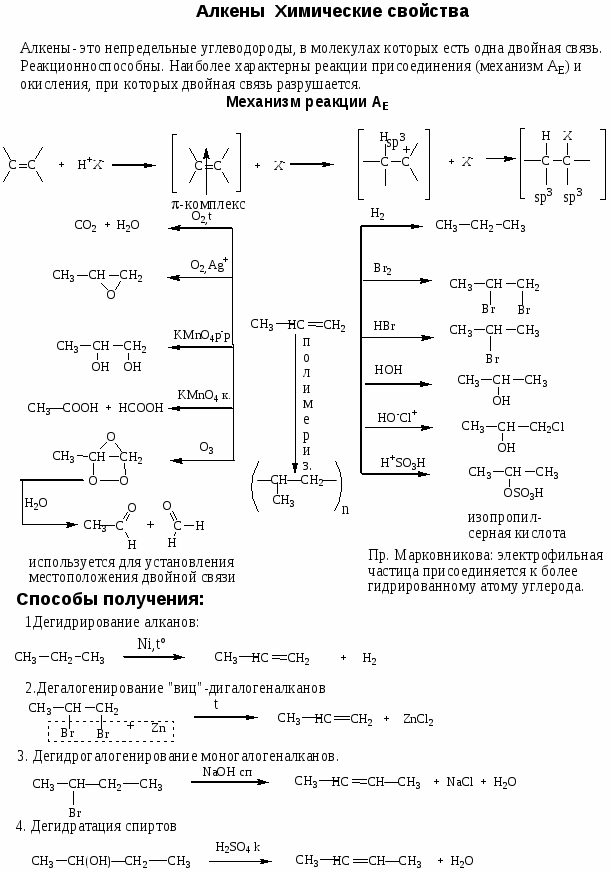
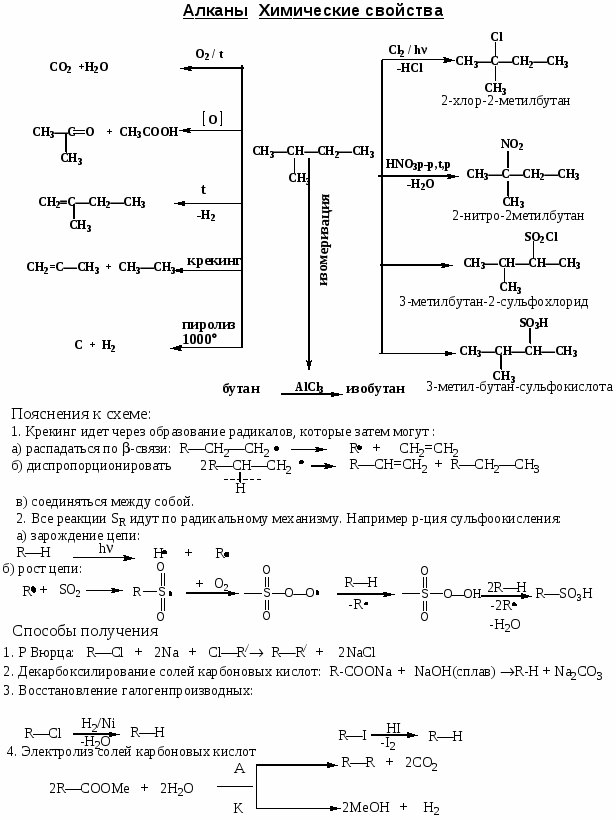
Номенклатура, химические свойства, способы получения углеводородов
Цель работы: закрепить и систематизировать знания студентов по номенклатуре, химическим свойствам, способам получения основных классов углеводородов.
Ход работы
-
Повторить основные способы получения, строения, реакционно способности, механизмов протекания химических реакции с использованием Приложения № 1
-
Решить задания:
1. Назовите по систематической номенклатуре следующие углеводороды:
а) СН3─СН─СН2─СН3 б) СН3─СН2─СН─СН2─СН3
│ │
СН3 СН─СН3
│
СН3
в) СН3─СН─СН─СН─СН3 г) СН3─СН─СН─СН─СН2─СН─СН3
│ │ │ │ │ │ │
СН3 СН3 СН3 СН2 СН3 СН3 СН2─СН3
│
СН3
Какие из вышеперечисленных углеводородов являются структурными изо-мерами? Какова их эмпирическая формула?
2. Приведите формулы соединений состава С10Н22, имеющих максимальное и минимальное число первичных атомов углерода. Назовите их.
3. Какие углеводороды получатся при действии металлического натрия на смесь:
а) метилиодида и изобутилиодида,
б) этилхлорида и изопропилхлорида,
в) пропилбромида и третбутилбромида,
г) вторбутилбромида и третбутилбромида.
4. Используя натриевую соль соответствующей карбоновой кислоты, получите 3-метилпентан. Напишите реакцию нитрования полученного углеводорода и разберите механизм реакции.
5. Получите 2,2,3-триметилпентан любым способом, напишите для него уравнения реакций галогенирования, сульфоокисления, сульфохлорирования.
6. Закончите уравнения реакций, назовите все вещества:
а) СН3─СН2─СН─СН2─СН3 + HI
│
I
б) СН3─СН─СН2─СН3 + НNO3 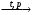
│
СН3
в) СН3─СН─Cl + 2Na + Cl─СН─СН2─СН3
│ │
СН3 СН3
г) СН3─СН─СН2─СН2─СН3
│
СН3
д) СН3─СН2─СН3 +SO2 + Cl2
е) СН3─СН2─СН2─СН2─СН2─СН3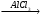
ж) СН3─СН─СН─СН3 
│ │
СН3 СН3
7. Заполните схемы превращений, назовите все вещества.
а) СН3─СН2─СН3+ Cl2 АБВ
б) СН3─СН─СООNa + NaOH А Б В
│
СН3
8. Назовите по систематической номенклатуре следующие углеводороды:
а) СН3─СН2─СН=СН─СН2─СН3 б) СН3─СН2─С=СН2
│
СН3─СН─СН2─СН3
в) СН3─СН2─С=СН─СН2─СН3 г)СН3─СН─СН2─СН=С─СН2─СН3
│ │ │
СН2─СН3 СН3 СН3
9. Напишите формулы структурных и пространственных изомеров алкена состава С4Н8. Назовите их.
10. Будут ли существовать цис - и трансизомеры у 2-метилбутена-2 и у
3-этилгексена-3?
11. Получите этиленовые углеводороды дегидратацией спиртов следующего строения:
а) СН3─СН─СН2─СН2ОН б) СН3─СН─СН2─СНОН─СН3
│ │
СН3 СН3
в) СН3─СН─СНОН─СН2─СН3
│
СН3
12. Получите этиленовые углеводороды:
-
из следующих галогенпроизводных:
а) 2-бром-2-метилгексана,
б) 3-бром-2,3-диметилпентана,
в) 4-бром-3-метилгептана.
-
из следующих дигалогенпроизводных:
а) 2,3-дибромпентана.
б) 2,3-дибром-2-метилпентана.
13. Получите 4-метилпентен-2 из 4-метилпентена-1. Напишите для полученного углеводорода реакции окисления:
а) щелочным разбавленным раствором перманганата калия,
б) концентрированным водным раствором перманганата калия.
14. Напишите схему перехода от 3-метилпентена-1 к 3-метилпентену-2 и для последнего напишите реакции с а) HCl, б) HOCl, в) H2SO4. Сформулируйте правило Марковникова. Объясните действие этого правила с точки зрения электронных эффектов в молекуле.
15. Проведите окисление бутена-1 а) кислородом воздуха без катализатора, б) кислородом воздуха в присутствии серебряного катализатора, в) хромовой смесью.
16. Получите 2,4-диметилпентен-2 и 2,2,4-триметилгексен-3 любым способом и напишите их реакции гидрирования и озонирования.
17. Напишите структурные формулы этиленовых углеводородов, озониды которых при расщеплении водой образуют:
а) формальдегид и 2-метилбутаналь, б) ацетон и пропионовый альдегид, в) метилизопропилкетон и формальдегид.
18. С помощью каких реакций можно осуществить следующие превращения:
19. Заполните схемы превращений.
а) СН3─ СН2─СН─СН3А В С
│
Cl
б) ХУпентан
20. Назовите по систематической номенклатуре следующие углеводороды:
а) СН≡С─СН─СН3 СН3
│ │
СН3 б) СН3 ─ С ─ С≡С─СН2─СН3
│
СН3 СН3
│
в) СН3─СН2─С─С≡СН
│
СН3
21. Напишите уравнения реакций, с помощью которых можно различить а) гексан, гексен-1 и гексин-1, б) пентин-1 и пентин-2, в) этилен и ацетилен,
г) смесь предельных и непредельных углеводородов?
22. Из 3,3-диметилбутанола-1 получите 3,3-диметилбутин-1. Для полученного алкина напишите реакцию гидратации.
23. Закончите уравнения реакций:
а) СН3─СН─СН─СН3
│ │
Cl Cl
б) СН3─СВr2─СН2─СН3в) СНВr2─СН2─СН─СН3
│
СН3
24.С помощью каких реактивов и в каких условиях возможно осуществить следующие превращения?
а) пентен-1пентин-1;
б) бутин-1 бутин-2;
в) ацетиленметилацетилен;
г) ацетилен4-метилпентин-1;
д) ацетиленбутан;
25. Получите любым способом 3-метил-гексин-1 и напишите для него уравнения реакций: а) с водой (в условиях реакции Кучерова), б) с аммиачным раствором окиси серебра.
26. Получите из соответствующего дигалогенпроизводного изопропилацетилен и напишите для него уравнения реакций с избытком соляной кислоты, с синильной кислотой, муравьиной кислотой, уксусным альдегидом, бутиловым спиртом.
27. Напишите для бутина-1 и для 3-метилпентина уравнения реакций со следующими веществами: водородом, в присутствии катализатора; бромом; бромоводородом; амидом натрия; уксусной кислотой.
28. Напишите уравнения реакций конденсации:
а) ацетилена с метилэтилкетоном,
б) пропина с ацетоном,
в) винилацетилена с ацетоном,
г) изопропилацетилена с продуктом его гидратации,
д)бутина-1 с формальдегидом.
29. Напишите формулы строения промежуточных и конечного продуктов в следующих схемах:
а) СН3─СН2─СН2─СН2BrАВCD
б)
СН3─СН─СН─СН2АВС
│ │ │
СН3 Br Br
Практическая работа №7
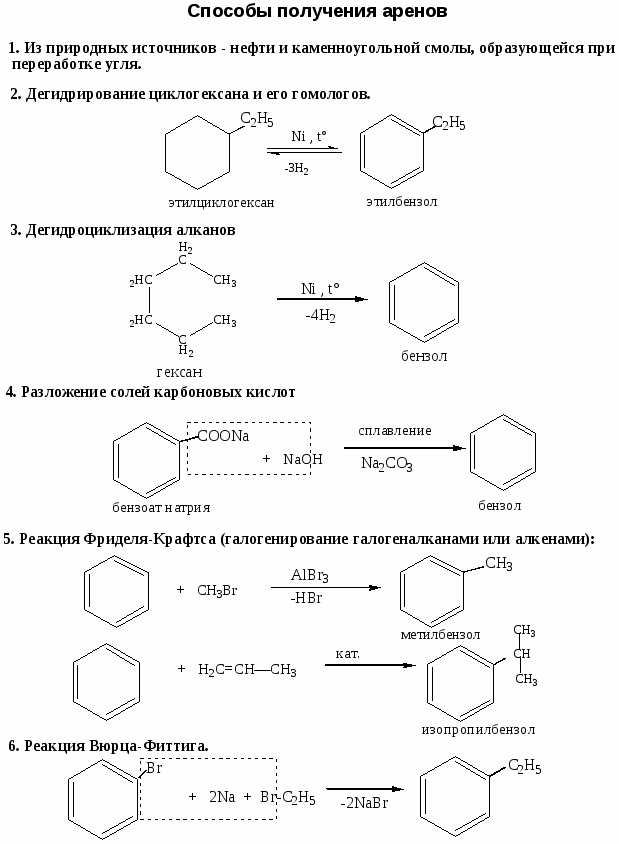
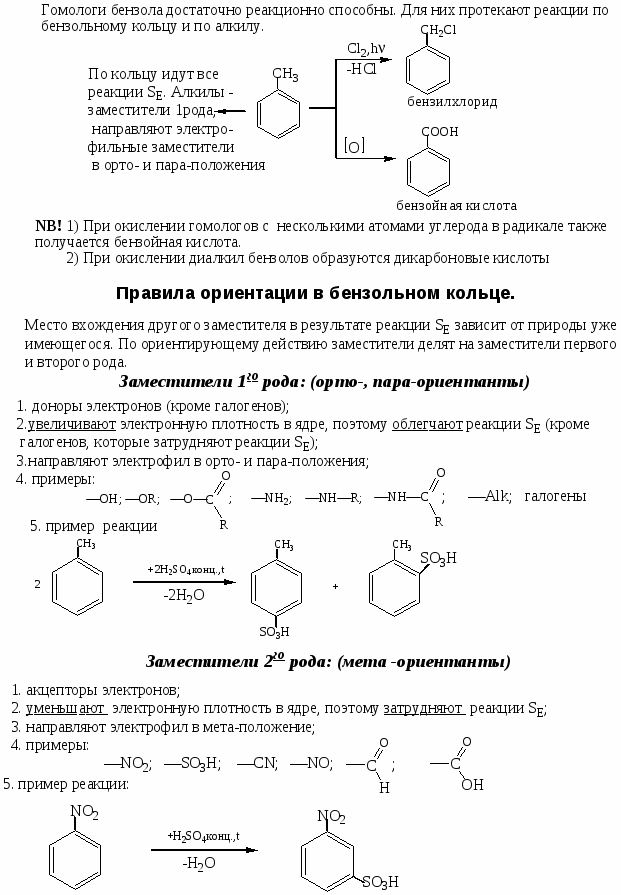
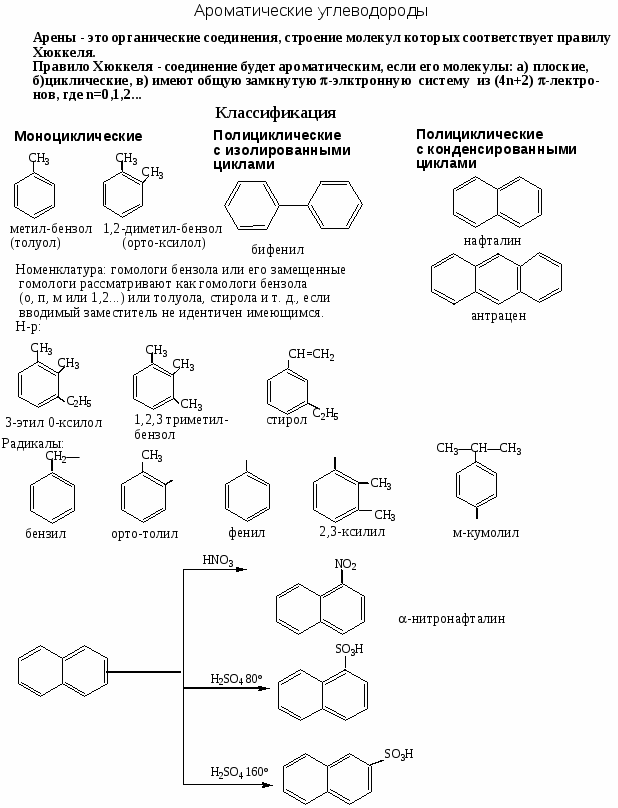
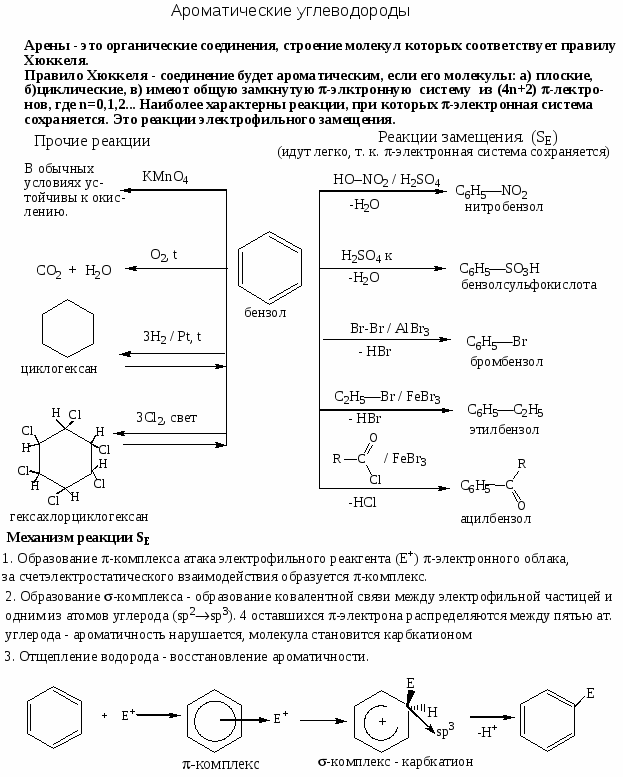
Номенклатура, химические свойства, способы получения ароматических углеводородов
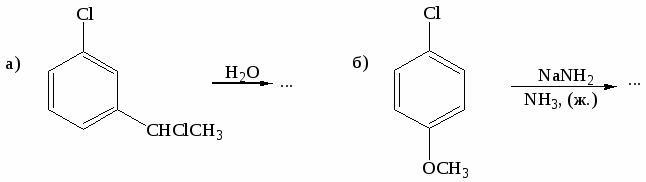
Цель работы: закрепить и систематизировать знания студентов по номенклатуре, химическим свойствам, способам получения аренов.
Ход работы
-
Повторить основные способы получения, строения, реакционно способности, механизмов протекания химических реакции с использованием Приложения №
-
Решить задания:
-
Напишите реакции толуола с указанными реагентами: а) 3Н2 (Ni), 200○С,
10 МПа; б) KMnO4 в Н2О, t; в) Cl2 (свет); г) Cl2 (Fe); д) HNO3 (H2SO4); е) CH3COCl (AlCl3). Назовите продукты реакций. -
Напишите структурные формулы главных продуктов, образующихся при взаимодействии стирола со следующими реагентами: а) Br2(CCl4); б) Br2 (Fe); в)НBr; г) KMnO4 в Н2О, 0○С; д) KMnO4 в Н2О, t; е) Н2 (Ni), 200○С, 10 МПа.
-
С помощью каких реакций можно различить следующие пары соединений:
а) этилбензол и м-ксилол; б) этилбензол и стирол; в) стирол и фенилацетилен. -
Какие соединения являются продуктами приведённых ниже реакций. Назовите продукты реакции.
-
Напишите реакции 2,4-динитрохлорбензола со следующими реагентами:
а) 10 % КОН, t; б) NH3, 1000С; в) C2H5ONa в спирте, t; г) (СН3)2NH, t; д) NaCN в спирте, t. -
Действием каких реагентов и в каких условиях можно осуществить замену атома хлора в n-метоксихлорбензоле, n-нитрохлорбензоле и n-метилбензилхлориде на следующие группы: а) ОСН3; б) N(СH3)2. Приведите схемы реакций, назовите получающиеся соединения.
-
Напишите схемы реакций. Назовите исходные и конечные соединения:
-
Осуществите указанные переходы:
-
Приведите схемы реакций n-толуолсульфокислоты со следующими реагентами. Назовите продукты: а) NaHCO3 (H2O); б) PCl5; в) СН3ОН, t; г) HNO3 (H2SO4).
-
Как химическим путём можно различить следующие пары соединений:
а) n-толуолсульфокислоту и метиловый эфир бензолсульфокислоты;
б) о-хлорбензолсульфокислоту и бензолсульфохлорид.
-
Напишите реакции:
-
Составьте схемы получения следующих веществ из толуола: а) 4-нитро-2-толуолсульфокислоты; б) 3-бром-4-метилбензолсульфокислоты; в) метил-n-толуолсульфоната.
-
Напишите реакции n-динитробензола со следующими реагентами:
а) Cl2(FeCl3); б) NaOH (H2O, t); в) CH3ONa (CH3OH, t); г) NH3 (спирт, t); д) H2SO4 (SO3, t). -
С помощью каких реакций можно отличить следующие пары соединений:
а) фенилнитрометан и n-нитротолуол; б) нитробензол и нитроциклогексан? -
Напишите реакции. Назовите образующиеся соединения:
-
Назовите соединения, образующиеся в ходе следующих превращений:
Практическая работа №8
Номенклатура, химические свойства, способы получения предельных одноатомных спиртов и оксосоединений
Цель работы: закрепить и систематизировать знания студентов по номенклатуре, химическим свойствам, способам получения предельных одноатомных спиртов и оксосоединений
Ход работы
-
Повторить основные способы получения, строения, реакционно способности, механизмов протекания химических реакции с использованием Приложения №1
-
Решить задания:
1. Назовите по систематической номенклатуре следующие соединения:
а) СН3─СН2─СН2─СН─СН─СН2─СН3 б) СН2ОН─СНОН─СН─СН3
│ │ │
ОН СН3 СН3
СН3
│
в) СН3─С─СН2─ОН г) СН2═СН─СНОН─СН3
│
СН3
д) СН3─СН─СОН─С≡СН е) СН3─О─СН─СН3
│ │ │
СН3 СН3 СН3
ж) СН3─СН2─СН─СН3
│
О─СН3
2. Напишите схему получения изопропилового спирта из соответствующего непредельного углеводорода в одну стадию и в две стадии (через галогенпроизводное).
3. Получите гидратацией соответствующих этиленовых углеводородов следующие спирты: 3,3-диметилбутанол-2, 2-метилпентанол-2, 3-метил-гексанол-2. Для полученных спиртов напишите реакции окисления, дегидрирования.
4.Какие спирты получатся при восстановлении следующих соединений:
а) СН3─ СН─СНО б) СН3─СН2─СО─СН─СН3
│ │
СН3 СН3
в) СН3─СО─СН2─СН─СН3
│
СН3
Для полученных спиртов напишите реакции дегидратации.
5. Получите спирты реакцией Гриньяра, исходя из:
а) формальдегида и изопропилмагний бромида,
б) уксусного альдегида и вторбутилмагний бромида,
в) метилэтилкетона и пропилмагний бромида.
6. Исходя из этилмагний бромида и любого подходящего компонента, получите реакцией Гриньяра:
а) пропанол-1, б) пентанол-3, в) 3-метилпентанол-3;
Для вещества а) напишите реакции с натрием, пятихлористым фосфором.
Для вещества б) - бромоводородом, уксусной кислотой (в присутствии Н2SO4).
Для вещества в) - с тионилхлоридом, с этилмагний йодидом.
7. На примере бутанола-1 опишите механизм внутри- и межмолекулярной дегидратации. Приведите строение образующихся продуктов.
8. Используя в качестве исходного вещества ацетилен, напишите схемы получения:
а) бутанола-1, б) бутанола-2, в) пропанола-1, г) изопропилового спирта.
9. Какой из спиртов - этанол или этандиол-1,2 - является более сильной кислотой? С помощью какой химической реакции их можно различить?
10. Из пропилена получите глицерин. Напишите для него реакции с уксусной и азотной кислотами.
11. Из глицерина получите аллиловый спирт, укажите области его применения.
12. На бутиловый спирт подействуйте пятихлористым фосфором, затем на полученное соединение - этилатом натрия. Напишите схему реакций полученного соединения с НI (при нагревании), металлическим натрием и НСl.
13. Заполните схемы превращений:
а) 2С2Н5Cl 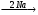 A
A 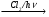 Б
Б 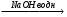 В
В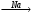 Г.
Г.
б) С2Н5MgBr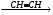 A
A 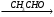 Б
Б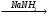 В
В 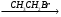 Г.
Г.
в) СН3─СН─СН2─СН2I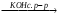 A
A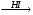 Б
Б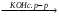 В
В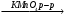 Г.
Г.
│
СН3
14. Назовите по систематической номенклатуре следующие соединения:
а) СН3─СН2─СН─СНО б) СН3─СН2─СН─СО─СН2─СН3
│ │
СН3 СН3
в) СН2═С─СН2─СНО г) СН2═СН─СО─СН3
│
СН3
д)НОС─СН2─СНО е) СН3─СО─СО─СН2─СН3
15. С помощью каких реакций можно осуществить следующие превращения:
а) СН3─СН─СН2─СН2ОН → СН3─СН─СО─СН3
│ │
СН3 СН3
б) СН3─СН─СН2─СН2─СН2ОН →СН3─СН─СН2─СО─СН3
│ │
СН3 СН3
16. Из соответствующих дигалогенпроизводных получите следующие карбонильные соединения:
а) пропаналь,
б) 2,2-диметилпропаналь,
в) 3-метилбутанон-2.
17. Получите сухой перегонкой кальциевых солей соответствующих кислот следующие соединения:
а) 2-метилпропаналь,
б) пентаналь,
в) метилизопропилкетон.
18. Какие альдегиды получатся из а) бутена-1, б) пропилена реакцией оксосинтеза? Укажите условия реакции.
19. Получите 3-метилпентаналь всеми возможными способами, напишите для него уравнения реакций с пятихлористым фосфором, хлором, синильной кислотой, аммиаком. Приведите механизм реакции 3-метилпентаналя с НСN.
20. Из бутина-1 получите бутанон и напишите для него реакции с бисульфитом натрия, хлористым тионилом, синильной кислотой, гидроксиламином. Приведите механизм последней реакции.
21. Напишите реакции альдольной, кротоновой и сложноэфирной конденсации для следующих альдегидов: пропаналя, бутаналя, метилпропаналя,
2-метилбутаналя, 2,2-диметилпропаналя. Укажите, все ли перечисленные альдегиды будут участвовать в альдольной конденсации. На одном из примеров приведите механизм альдольной конденсации.
22. С помощью последовательных реакций осуществите превращения:
а) метан →оксим уксусного альдегида,
б) бутаналь → бутанон,
в) этан →оксим уксусного альдегида,
г) пентен-1→ метил-пропилкетон.
23. Заполните схемы превращений:
а) СН3─СН2─СН─СН2─СН2─Br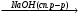 A
A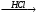 Б
Б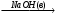 В
В
│
СН3
 Г
Г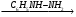 Д
Д
б) СН3─СН2─СН2─СООNa 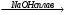 A
A 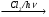 Б
Б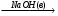 В
В
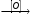 Г
Г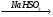 Д
Д
в) Х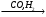 У
У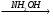 СН3─СН2─СН═NOH.
СН3─СН2─СН═NOH.
Практическая работа №9
Номенклатура, химические свойства, способы получения одноосновных карбоновых кислот
Цель работы: закрепить и систематизировать знания студентов по номенклатуре, химическим свойствам, способам получения одноосновных карбоновых кислот.
Ход работы
-
Повторить основные способы получения, строения, реакционно способности, механизмов протекания химических реакции с использованием Приложения №1
-
Решить задания:
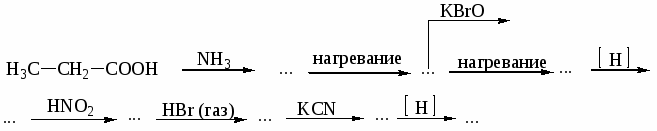
1. Назовите по систематической номенклатуре следующие соединения:
а) СН3─СН2─СН─СООН б) НООС─СН─СН2─СН2─СООН
│ │
СН3 СН3
в) СН3─СН═С─СООН г) СН3─СН2─СООС2Н5
│
СН3
д) СН3─СН─СОNH2 е) СН3─СН─СН2─СОCl
│ │
СН3 СН3
ж) СН3─СН2─СО─О─СО─СН2─СН3
2.Расположите в порядке увеличения кислотных свойств, следующие кислоты:
уксусная кислота, трихлоруксусная кислота, монохлоруксусная кислота, дихлоруксусная кислота.
3.Напишите уравнения реакций окисления следующих соединений (укажите условия реакций и окислители): этандиол, изобутиловый спирт, гексанон-2, 3-метилбутаналь, 2-метилгексен-3, 2-метилгександиол-1,5.
4.С помощью магнийорганических соединений получите следующие кислоты: а) изомасляную,
б) валериановую,
в)2-метилбутановую,
г)2,3-диметилбутановую.
5.Из соответствующих непредельных углеводородов, применяя реакцию оксосинтеза, получите следующие кислоты:
а) 2,3-диметилпентановую,
б) 3-метилпентановую,
в) 2,4-диметигексановую.
Для каждой из кислот напишите по одной реакции, характеризующей ее кислотные свойства.
6.Напишите для изовалериановой кислоты реакции образования ангидрида, хлорангидрида, амида, этилового эфира всеми возможными способами.
7. Напишите уравнения реакций гидролиза следующих соединений:
а) СН3─СООС(СН3)3 б) СН3─СН─СН2─СN
│
СН3
в)NC ─ СН2─COOC2H5 г) Н2NOC─СН2─СН2─CONH2
8. Заполните схемы превращений
а) СН3─СН═СН2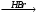 A
A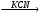 Б
Б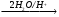 В
В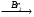 Г
Г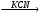 Д
Д
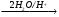 Е
Е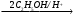 Ж
Ж
б) СН3─СН─СООН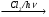 A
A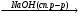 Б
Б 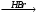 В
В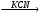 Г
Г
│
СН3
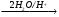 Д
Д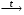 Ж
Ж
г) СН3─СН2─СО─СН3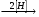 A
A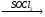 Б
Б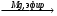 В
В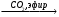 Г
Г
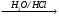 Д
Д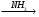 Е
Е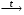 Ж
Ж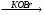 З.
З.
Практическая работа №10
Номенклатура, химические свойства, способы получения углеводов
Цель работы: закрепить и систематизировать знания студентов по номенклатуре, химическим свойствам, способам получения углеводов.
Ход работы
-
Повторить основные способы получения, строения, реакционно способности, механизмов протекания химических реакции с использованием Приложения №1
-
Решить задания:
-
Дайте определения следующим терминам: а) углеводы; б) моносахариды;
в) альдозы; г) кетозы; д) альдотетрозы; е) кетопентозы; ж) альдогексозы; з) кетогексозы. Проиллюстрируйте эти термины примерами конкретных соединений. -
Назовите следующие моносахариды по международной номенклатуре:
Классифицируйте эти моносахариды по числу атомов углерода, по наличию альдегидной или кетонной группы.
-
Приведите структурные формулы изомерных триоз. Назовите их. Укажите соединения с асимметрическим атомом углерода. Приведите для него проекционные формулы энантиомеров. Отнесите последние к D- и L- ряду.
-
Приведите структурные формулы изомерных тетроз. Назовите их. Сколько пространственных изомеров соответствует каждому структурному изомеру? Приведите их проекционные формулы и назовите. Укажите, какие из них принадлежат к L- ряду.
-
Напишите структурные формулы альдогексозы и 2-кетогексозы. Сколько стереоизомеров возможно в каждом случае? Приведите фишеровские проекции природных моносахаридов: D-глюкозы, D-галактозы, D-маннозы и D-фруктозы.
-
Напишите проекционные формулы моносахаридов, эпимерных D-глюкозе,
D-галактозе и D-альтрозе. Напишите уравнения реакций D-галактозы со следующими веществами: уксусным ангидридом, гидроксиламином, метиловым спиртом
(в присутствии HCl). -
Получите метил-β-L-фруктофуранозид из L-фруктозы и этил-α-D- маннопиранозид из Д-маннозы. Обладают ли полученные соединения мутаротацией?
-
Приведите фишеровские формулы α- и β-аномеров L-маннозы и D-галактозы. Какие соединения называют эпимерами?
-
Приведите схемы циклоцепного таутомерного превращения D-альтрозы и
D-фруктозы в водных растворах. Назовите все формы этих моносахаридов. Какое явление называют мутаротацией? -
Приведите химические реакции, которые доказывают наличие в молекуле глюкозы: а) нормальной цепи углеродных атомов; б) альдегидной группы; в) пяти гидроксильных групп; г) глюкозидного (полуацетального) гидроксила.
-
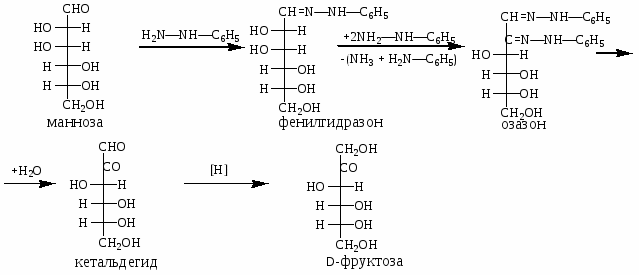
Напишите реакции глюкозы со следующими веществами: а) HBrO; б) NaBH4; в) HNO3 (конц.); г) Ag(NH3)2OH; д) C6H5NHNH2; е) (CH3CO)2O; ж) CH3OH (HCl).
В какой форме реагирует глюкоза в каждой реакции?-
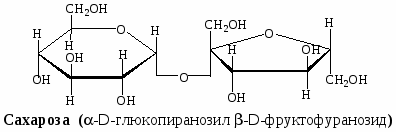
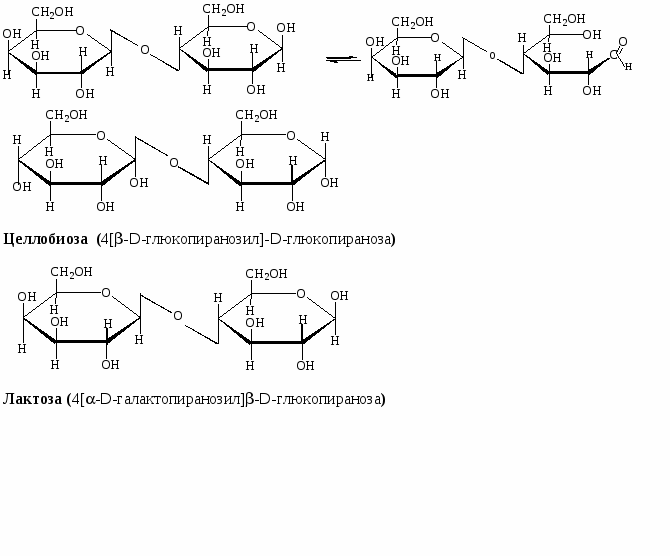
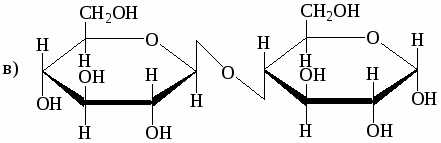
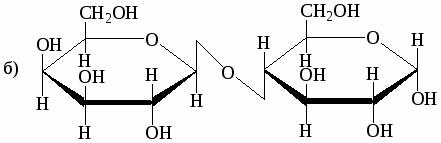
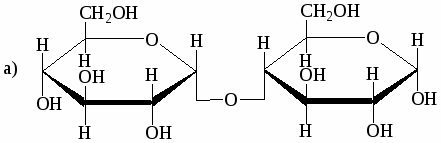
Ниже приведены формулы Хеуорзса четырёх дисахаридов. Будут ли они реагировать с реактивом Толленса? Могут ли они существовать в α- и β-формах? Назовите моносахариды, образующиеся при гидролизе этих дисахаридов:
-
мальтоза
лактоза
целлобиоза
сахароза
-
-
Напишите реакции взаимодействия лактозы со следующими веществами: уксусным ангидридом, гидроксиламином, фенилгидразином (избыток).
-
В каких растворителях растворяется целлюлоза? Каково строение целлюлозы? Назовите соединения, которые являются продуктами реакций:
-
-
-
Из каких фракций состоит крахмал, чем они отличаются друг от друга? Чем отличается гликоген - животный крахмал - от фракций крахмала? Где в аналитической химии применяется крахмал (крахмальный клейстер)?
-
Назовите соединения, которые являются продуктами реакций:
-
Где в технике применяются продукты реакций?
Практическая работа №11
Номенклатура, химические свойства, способы получения основных классов азотсодержащих органических соединений
Цель работы: закрепить и систематизировать знания студентов по номенклатуре, химическим свойствам, способам получения углеводов.
Ход работы
-
Повторить основные способы получения, строения, реакционно способности, механизмов протекания химических реакции с использованием Приложения №1
-
Решить задания:
-
Назовите следующие нитросоединения:
-
Напишите структурные формулы следующих соединений:
а) 2-нитробутан; б) 2-нитро-4,4-диметилпентан; в) 2-нитро-3,5-диметилгексан;
г) 4-нитро-2-пентен; д) 3-нитро-1-пропанол; е) 2-хлор-3-нитробутан; ж) изопентиламин; з) этилвтор-бутиламин; и) диметилизобутиламин; к) N-метил-1,1- диметилбутиламин; л) 2- метил-1,5-пентандиамин. -
Напишите структурные формулы нитросоединений состава С5Н11NO2 и назовите их. Укажите первичные, вторичные и третичные нитросоединения.
-
Напишите все возможные структурные формулы аминов состава C5H13N. Укажите первичные, вторичные и третичные амины.
-
Напишите схему перехода от метана к нитрометану. Какой продукт получится при восстановлении последнего? Для продукта восстановления напишите уравнение реакции с азотистой кислотой.
-
Используя в качестве исходного вещества этилен получите 2-нитробутан. Напишите для последнего схему реакции конденсации с масляным альдегидом и реакцию взаимодействия с NaOH.
-
С помощью каких реакций можно осуществить следующие превращения:
а) 1-нитропропана в пропаналь; б) 3-нитропентана в 3-пентанон; в) 1-нитробутана в бутановую кислоту. Укажите, какая из этих реакций используется в промышленности для получения гидроксиламина. -
Заполните следующие схемы превращений:
-
Как можно осуществить превращения:
а) 2-бутен → 2-аминобутан,
б) пропилен → 2-нитро-1,3-бутадиен,
в) пропилен → 2-амино-2-метилпентан,
г) 2-нитробутан → 2-бутанон.
-
Вещество C4H9Br при нагревании с нитритом натрия в диметилформамиде превращается в соединение C4H9NO2, которое при встряхивании с водным раствором азотистой кислоты даёт синее окрашивание. Установите строение исходного и промежуточных соединений. Напишите схемы реакций.
11. Напишите формулы промежуточных и конечных продуктов в следующей схеме:
12. Получите изобутиламин, используя следующие исходные вещества: а) изопропиловый спирт; б) изомасляную кислоту; в) изовалериановую кислоту. Для изобутиламина напишите реакции: а) с соляной кислотой; б) с уксусным ангидридом.
13. Из пропилена получите изопропиламин. Напишите для него реакции:
а) с хлороформом в щелочной среде; б) хлористым ацетилом; в) хлористым изопропилом.
14. Покажите, с помощью каких реакций можно осуществить следующие превращения: а) 1-нитропропана в 1-пропанол; б) 1-бутанамина в бутаналь; в) бутанона в 2-метилбутиламин.
15. Напишите схему превращения 1,4-дибромбутана в 1,6-гександиамин. Проведите конденсацию с 1,6-гександиамина с адипиновой кислотой и укажите применение полученного соединения.
16. На 2,2-диметил-3-пентанон подействуйте гидроксиламином, полученное соединение восстановите. Для продукта восстановления напишите уравнения реакций: а) с йодистым бутилом; б) с соляной кислотой; в) с хлористым бутирилом.
Приложение №1
Номенклатура, химические свойства, способы получения основных классов органических соединений в схемах
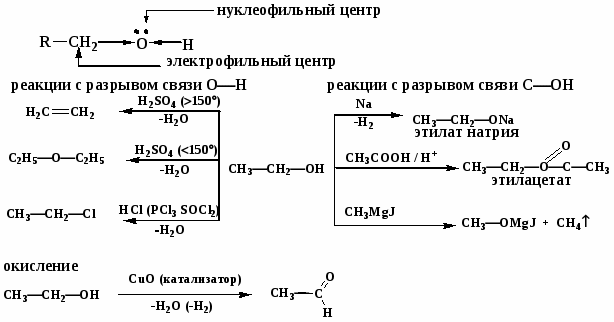
Спирты
Спирты - это производные углеводородов, в молекулах которых один или несколько атомов водорода, находящихся при sp3 гибридном атоме углерода замещены на гидроксогруппы.
Номенклатура:
-
тривиальная (древесный сп., винный сп.)
-
систематическая (№ от -ОН)
-
рациональная - спирты рассматриваются как производные метилового спирта - карбинола.
-
радикально-функциональная - называют по радикалу, связанному с -ОН
Химические свойства
Вторичные окисляются до кетонов, третичные - при более жестких условиях с разрывом цепи.
Способы получения
1. Гидратация алкенов.
2. Гидролиз галогенпроизводных.
3. Восстановление альдегидов и кетонов.
R─COH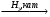 R─CH2─OH
R─CH2─OH
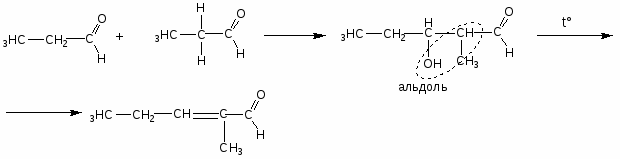
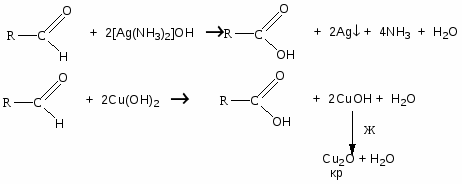
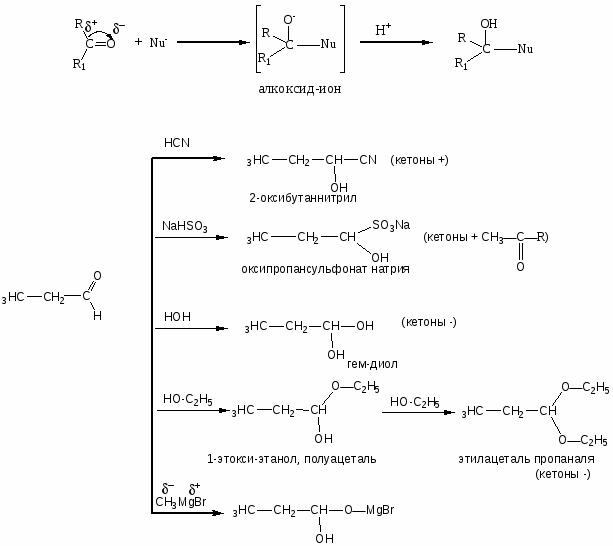
Карбонильные соединения
1. Реакции нуклеофильного присоединения (АN)
Механизм реакции
2. Реакции с азотистыми основаниями
3. Окисление (для идентификации альдегидов)
4. Реакции у α-углеродного атома.
-
альдольно-кротоновая конденсация
-
сложноэфирная конденсация
-
галогенирование
Способы получения
1. Окисление, дегидрирование спиртов.
2. Реакция Кучерова
3. Оксосинтез
4. Термическое разложение солей карбоновых кислот
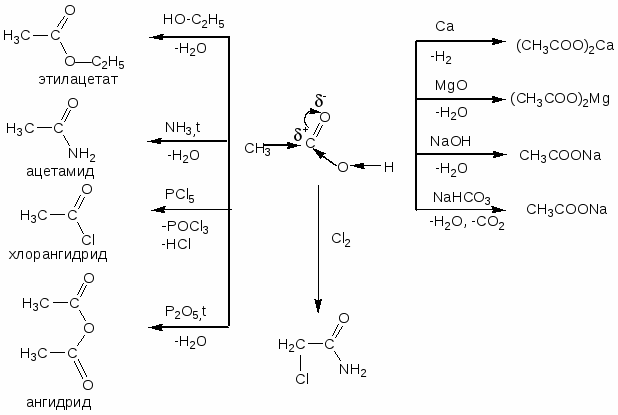
Карбоновые кислоты
Номенклатура
1. систематическая (№ от карбоксильной группы)
2. рациональная - карбоновые кислоты рассматриваются как производные уксусной кислоты
3. тривиальная
НСООН - муравьиная СН3СООН - уксусная
СН3СН2СООН - пропионовая СН3СН2СН2СООН - масляная
СН3СН2СН2СН2СООН - валериановая СН3СН2СН2СН2СООН - капроновая СН3 (СН2 )14СООН - пальмитиновая СН3 (СН2 )15СООН - стариновая СН3- (СН2 )7- СН=СН-(СН2)7СООН - олеиновая
СН3- (СН2 )4- СН=СН-СН2-СН=СН-(СН2)7СООН - линолевая
НООС-СООН - щавелевая НООС-СН2-СООН - малоновая
НООС-(СН2)2-СООН - янтарная НООС-(СН2)3-СООН - глутаровая
НООС-(СН2)4-СООН - адипиновая НООС-(СН2)5-СООН - пимелиновая
НООС-(СН2)6-СООН - пробковая
Химические свойства
Характерны реакции 1) SN - замещение ─ОН на гидроксил, 2) замещение водорода на металл - кислотные свойства, 3) реакции у α-углеродного атома
1. Кислотные свойства кислот зависят: а) от числа карбоксильных групп (дикарбоновые сильнее монокарбоновых).
б) от строения радикала. Введение в радикал электроотрицательных атомов повышает силу кислоты.
Названия солей образуются заменой -овая на -ат или используются тривиальные названия (соли муравьиной кислоты - формиаты, уксусной - ацетаты, пропионовой - пропионаты, масляной - бутираты, щавелевой - оксалаты, янтарной - сукцинаты)
2. Остаток карбоновой кислоты без -ОН называется ацил (реакция внедрения ацильного остатка - ацилирования).
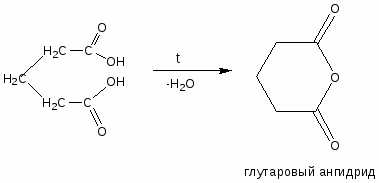
3. Для двухосновных кислот помимо вышеприведенных реакций (в зависимости от количества реагента они идут по одной или двум карбоксигруппам) возможно образование внутренних ангидридов с формированием устойчивых пяти- и шестичленных циклов.
Низшие двухосновные кислоты легко декарбоксилируются при нагревании.
НООС─СООН НСООН + СО2
4. Непредельные карбоновые кислоты вступают в реакции присоединения против правила Марковникова.
Способы получения
1. Окисление альдегидов.
2. Оксосинтез (СО + Н2О)
3. Гидролиз тригалогенпроизводных
4. Гидролиз нитрилов.
5. Магнийорганический синтез
6. Декарбоксилирование двухосновных кислот.
7. Гидролиз функциональных производных
Углеводы. Моносахариды.
Моносахариды - гетерофункциональные соединения, содержащие оксогруппу и несколько гидроксильных групп.
Классифицируются:
-
по количеству атомов углерода (триозы,тетрозы, пентозы, гексозы).
О
Н
по характеру функциональных групп:
-
альдозы СН2─СН*─СН*─СН*─С - альдопентоза,
ОН ОН ОН ОН
-
кетозы СН2─СН─СН─С─ СН2 - кетопентоза.
ОН ОН ОН О ОН
Количество стереоизомеров для альдопентоз: 23=8; для альдогексоз - 24=16.
Принадлежность к D и L- указывает предпоследний атом углерода. (см. «Стереохимический ряд моносахаридов)
Углеводы обладают рядом черт, которые долго не могли способствовать определению их строения:
-
дают не все реакции, характерные для оксогрупп,
-
первая гидроксильная группа отличается по своим химическим свойствам,
-
наблюдается явление муторатации - изменение значения удельного вращения раствора свежеприготовленного моносахарида (н-р у глюкозы ).
Это привело к выводу о существовании циклических форм у моносахаридов, образующихся в результате внутримолекулярного взаимодействия гидроксильной и оксогруппы с образованием полуацетального (гликозидного) гидроксила.
При образовании циклической структуры принимают участие оксогруппа и гидроксильная группа у С4 (образуется пятичленный фуранозный цикл) или С5 (образуется шестичленный пиранозный цикл). С1 становится при этом ассиметричным - т. е. возможно существование 2 аномеров α и β (у α - положение полуацетального гидроксила совпадает с положением -ОН в глицериновом альдегиде.)
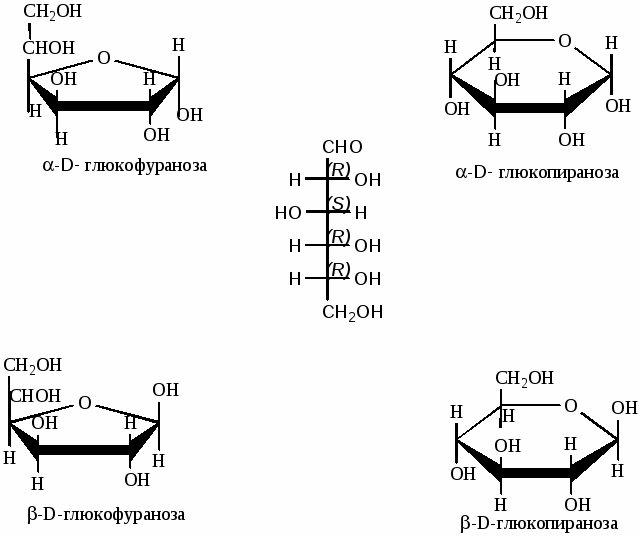
Образование циклических пиранозных форм у глюкозы
β-D-глюкопираноза α-D-глюкопираноза
Образование циклических фуранозных форм у глюкозы
β-D-глюкофураноза α-D-глюкофураноза
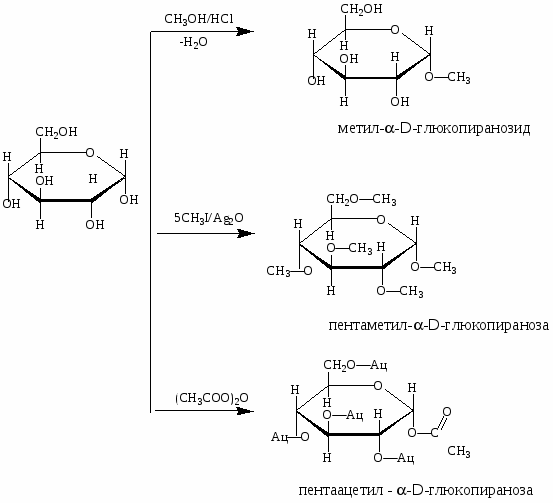
Сахара, имеющие полуацетальный гидроксил мутаротируют (т. е. циклические и открытые формы находятся в равновесии - таутомерия). Для изображения молекул углеводов пользуются перспективными формулами Хеуорса по следующим правилам:
-
у α аномеров гликозидный гидроксил находится под плоскостью кольца
-
концевой атом углерода (СН2ОН) у D ряда находится над плоскостью кольца.
-
нумерация атомов углерода ведется по часовой стрелке.
Таутомерия D-глюкозы в растворе
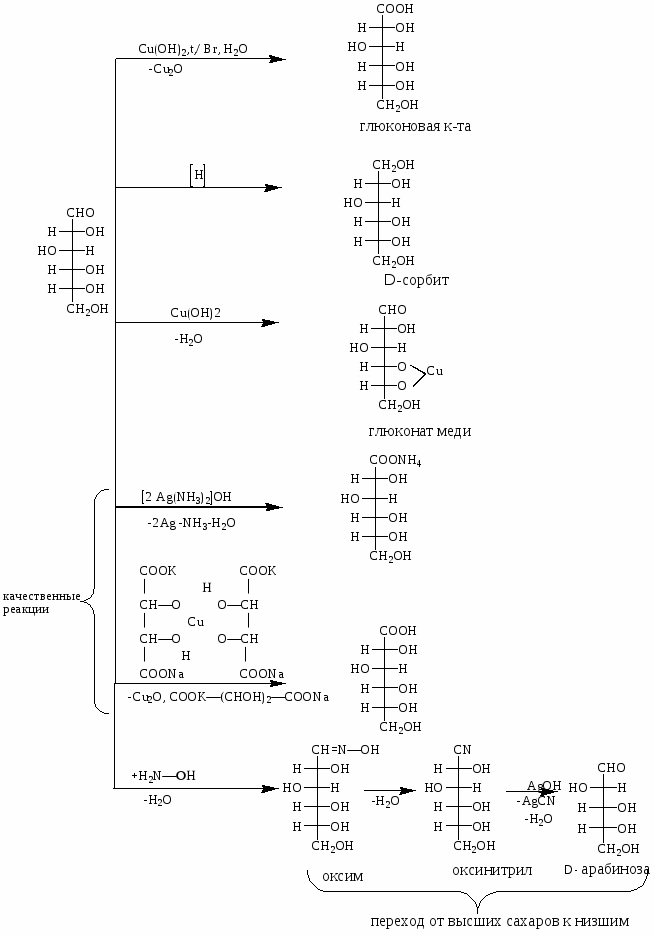
Химические свойства моносахаридов.
(на примере D-глюкозы)
1. Реакции в ациклической форме:
2. Реакции в циклической форме:
3. Дегидратация с циклизацией:
Способы получения
1. Гидролиз ди- и полисахаридов:
2.Окисление многоатомных спиртов:
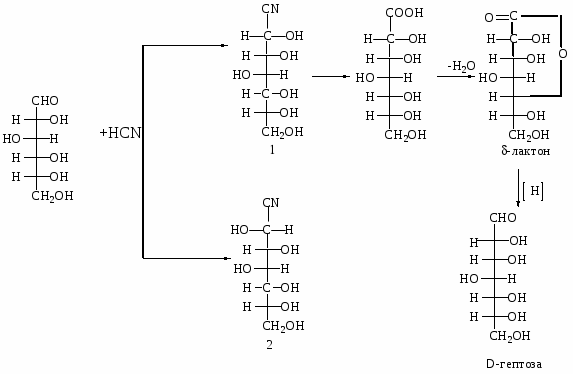
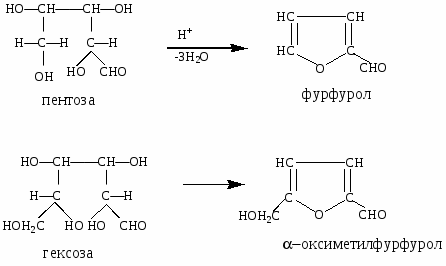
3. Оксинитрильный синтез: переход от высших сахаров к низшим.
4. Реакция с фенилгидразином: переход от альдоз к кетозам
Стереохимический ряд моносахаридов
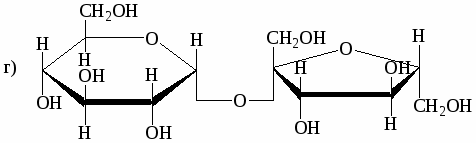
Дисахариды.
Дисахариды - производные циклической формы моносахарида, у которой атом водорода в гликозидном гидроксиле замещен остатком другой молекулы моносахарида.
1. Восстанавливающие - при образовании участвует гликозидный гидроксил одного моносахарида и гидроксил второго атома атома углерода другого моносахарида. (обладают всеми химическими свойствами, характерными для моносахаридов)
2. Невосстанавливающие - при образовании две циклические молекулы моносахаридов реагируют полуацетальными гидроксилами.
Азотсодержащие органические соединения.
Номенклатура:
-
радикально-функциональная номенклатура (для вторичных и третичных)
СН3─N─CН─ СН3
│ │ диметил-изопропил-амин
СН3СН3
-
систематическая (для первичных)
СН3─ CН─ СН2─ СН2─ СН3 пентан-амин-2
│
NН2
-
если в состав соединения входят две и более аминогрупп, то при составлении названия по заместительной номенклатуре используются приставки ди-, три - к суффиксу -амин, с последующим указанием цифрами положения аминогрупп в молекуле.
-
Неразветвленные первичные диамины называются по рационально - функциональной номенклатуре, взяв за основу число метиленовых ─СН2─ групп между двумя аминогруппами.
Н2N ─СН2─ СН2─СН2─ СН2─ NН2 - , бутандиамин-1,4. (тетраметилендиамин)
Химические свойства:
Амины являются как нуклеофилами, так и органическими основаниями (акцепторами протона)
Н нуклеофильный центр
│
R ─СН2→N:
│
Н основный центр
1.Основные свойства:
СН3─NН2 + НCl → [СН3 NН3+]Cl СН3─NН2
Реакция с азотистой кислотой:
1.1. СН3─NН2 + НО─NO → СН3─ОН+N2+Н2О
1.2. СН3─NН + НО─NO → СН3─NН─N═O + Н2О
│ │
СН3 СН3
Нитрозодиметиламин
2. Реакции аминов, как нуклеофильных реагентов:
2.1. Реакция Гофмана (применяется для синтеза вторичных и третичных аминов)
СН3─NН2[СН3─NН2─ СН3]IСН3─NН─ СН3СН3─NН─СН3 I
диметиламмоний СН3
йодид триметиламмоний
СН3 СН3 хлорид
│ │
СН3─N─ СН3 СН3─N─ СН3 I СН3─N─ СН3 ОН
│ │ │
СН3 СН3 СН3
тетраметил аммоний гидроксид (сильное основание)
2.2. Ацилирование
О
СН3─NН2СН3─С N-метиламид уксусной кислоты
NН─ СН3
-
-
Реакции взаимодействия с оксосоединениями.
-
О
С2Н5─NН2 + СН3─С → СН3─CН─NН СН3─СН═N─ С2Н5
Н основание Шиффа
ОН
аминоспирт
Способы получения:
1.Восстановление азотсодержащих орг. соединений (н-р водород в момент выделения)
О
а) СН3─С СН3─ СН2─ NН2
NН2
б) СН3─NO2 СН3─NН2
в) восстановление нитрилов
R─Cl
ОR─С≡N R─ СН2─ NН2
R─ С
NН2
г) восстановление изонитрилов
R─Cl
R─NCR─ NН─СН3
R─ NН2
2. Реакция Гофмана (см. выше)
Начало реакции: R─I +NH3 →[R─ NH3]I R─ NН2 и т. д.
3. Алкилирование аммиака спиртами
R─ОН + NH3 R─ NН2
Литература
-
Габриелян О.С. и др. Химия 10 кл. - Дрофа, 2010.
-
Габриелян О.С. и др. Химия 11 кл. - Дрофа, 2010
-
Рудзитис Г.Е., Фельдман Ф.Г. Химия. Органическая химия. 10 кл. : Учебник для общеобр. учреж-й. - М.: Просвещение, 2010.
-
Рудзитис Г.Е., Фельдман Ф.Г. Химия. Основы общей химии. 11 кл. : Учебник для общеобр.учреж-й. - М.: Просвещение, 2010.
-
Ерохин Ю.М. Химия: Учебник для СПО. - М.: Академия, 2010.
-
Ерохин Ю.М.Сборник задач по химии: Учебн.пособие для СПО. - М.: Академия, 2010.
-
Габриелян О.С. Настольная книга учителя "Химия". Химия 11 кл. ООО
Дрофа, Москва - 2004 .
-
Иванова Р.Г., Коверина А.А. Уроки химии 10-11 кл. методическое
пособие для учителя. Москва "Просвещение", 2008.
-
Магдесиева Н.Н. Учись решать задачи по химии. Москва "Новая
волна", 2009.
-
Нентвич И., Кройдер М., Химический тренажер (1, П ч.) Москва
"Мир", 2012.
-
Цветков Л.А. Органическая химия 11 кл. Москва "Просвещение", 2009-
2011.
-
auk-olymp.ru/doc.v?d=19courses.urc.ac.ru/eng/u6-7.html
-
ru.solverbook.com/
-
minispravochnik.narod.ru/
-
chemistry.videouroki.net/
-
chemistry.ru/
79


