- Преподавателю
- Химия
- Подготовка к ЕГЭ по химии. СПИРТЫ
Подготовка к ЕГЭ по химии. СПИРТЫ
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Кисакова О.А. |
| Дата | 01.12.2014 |
| Формат | doc |
| Изображения | Есть |
СПИРТЫ- это соединения, содержащие помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Классификация спиртов.
1.По числу гидроксильных групп:
-
одноатомные (одна группа -ОН).
Общая формула CnH2n+1-OH или CnH2n+2O.
-
многоатомные (две и более групп -ОН).
Общая формула CnH2n+2Om.
Современное название многоатомных спиртов - полиолы (диолы, триолы и т.д).
Двухатомный спирт - этиленгликоль (этандиол) СH2-CH2
│ │
ОН ОН
Трехатомный спирт - глицерин (пропантриол-1,2,3) СH2-СН-CH2
│ │ │
ОН ОН ОН
2. В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа:
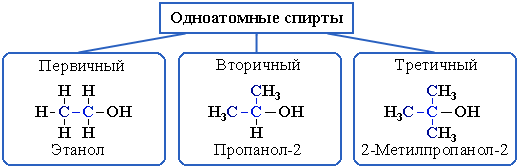
3. По строению радикалов, связанных с атомом кислорода:
-
предельные, или алканолы (например, СH3CH2-OH)
-
непредельные, или алкенолы (CH2=CH-CH2-OH)
-
ароматические (C6H5CH2-OH).
-
Фенолы (C6H5-OH).
СТРОЕНИЕ ГИДРОКСИЛЬНОЙ ГРУППЫ.
Связи О-Н и С-О - полярные ковалентные. Это следует из различий в электроотрицательности кислорода (ЭО = 3,5), водорода (ЭО = 2,1) и углерода (ЭО = 2,4).
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
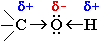
Разрыв таких связей происходит преимущественно по ионному механизму.
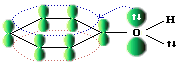
Атому кислорода в спиртах свойственна sp3-гибридизация. В образовании его связей с атомами C и H участвуют две sp3-гибридные орбитали, валентный угол C-О-H близок к тетраэдрическому.
В фенолах одна из электронных пар кислорода участвует в сопряжении с π-системой бензольного кольца:
ВОДОРОДНЫЕ СВЯЗИ И ФИЗИЧЕСКИЕ СВОЙСТВА СПИРТОВ
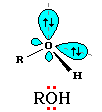
Следствием полярности связи О-Н и наличия неподеленных пар электронов на атоме кислорода является способность гидроксисоединений к образованию водородных связей:
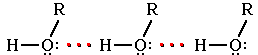
Ассоциация молекул ROH
Это объясняет, почему даже низшие спирты - жидкости с относительно высокой температурой кипения (t кип. метанола +64,5оС). При переходе от одноатомных к многоатомным спиртам или фенолам температуры кипения и плавления резко возрастают.
Образование водородных связей с молекулами воды способствует растворимости гидроксисоединений в воде:
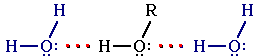
Гидратация молекул ROH
Метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин смешиваются с водой в любых соотношениях. Растворимость фенола в воде ограничена. C увеличением молярной массы растворимость спиртов в воде уменьшается.
Предельные одноатомные спирты
Общая формула - СnH2n+1OH или СnH2n+2O n>1
НОМЕНКЛАТУРА
В названии появляется суффикс: -«ОЛ» и номер атома углерода, к которому он присоединен. Нумерация ведется от ближайшего к ОН-группе конца цепи.
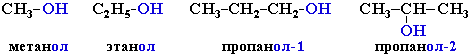
Приведенные выше соединения называют: метиловый спирт, этиловый спирт, н-пропило-вый спирт, изопропиловый спирт.
Метиловый спирт (метанол) CH3-OH
Этиловый спирт (этанол) CH3CH2-OH
В названиях многоатомных спиртов (полиолов) положение и число гидроксильных групп указывают соответствующими цифрами и суффиксами -диол (две ОН-группы), -триол (три ОН-группы) и т.д. Например:

ИЗОМЕРИЯ СПИРТОВ.
Для спиртов характерна структурная изомерия:
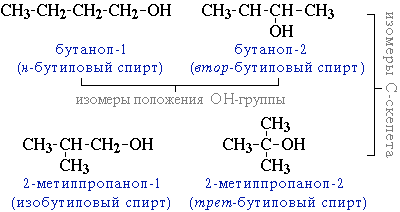
*изомерия положения ОН-группы (начиная с С3);

*углеродного скелета (начиная с С4);
например, формуле C4H9OH соответствует 4 структурных изомера:
*межклассовая изомерия с простыми эфирами
(например, этиловый спирт СН3CH2-OH и диметиловый эфир CH3-O-CH3).
Получение.
1. Щелочной гидролиз галогенпроизводных алканов.
CH3-Br + NaOH(водн.) CH3-OH +NaBr
2. Гидратация алкенов: присоединение воды к несимметричным алкенам идет по правилу Марковникова с образованием вторичных и третичных спиртов.
CH2=CH2 + H2O -(H+)CH3CH2OH
CH3-CH=CH2 + H2O-(H+)CH3CHCH3
/
ОН
ОН
/
CH3-C=CH2 + H2O -(H+)->CH3 -C-СH3
ô ô
СН3 СН3
3.Восстановление карбонильных соединений.
При гидрировании альдегидов получаются первичные спирты:
СН3-С=О + Н2 -(t,kat) CH3-CH2-OH
ô этанол
Н
При гидрировании кетонов образуются вторичные спирты:
СН3-С=О + Н2 -(t,kat) CH3-CH-OH
ô ô
СН3 СН3
пропанол-2
4. Гидролиз сложных эфиров.
CH3-C=O + H2O -(H2SO4,t)
│
OC2H5
CH3-COOH + C2H5OH
этанол
5. Получение метанола из синтез-газа.
1. Конверсия природного газа в синтез-газ: СН4 +Н2О = СО + 3Н2
2. Каталитический синтез метанола из монооксида углерода и водорода при температуре 300-400°С и давления 300-500 атм в присутствии катализатора - смеси оксидов цинка, хрома и др. Сырьем для синтеза метанола служит синтез-газ
(CO + H2), обогащенный водородом: CO + 2 H2 ⇄ CH3OH
Газ на выходе из реактора содержит 3-5% CH3OH, затем газ охлаждают и конденсируют полученный метанол, а оставшийся газ смешивают с исходным газом и направляют снова в реактор.
6. Получение этанола спиртовым брожением.
Спиртовое брожение глюкозы.
С6Н12О6 -(фермент)->2С2Н5ОН + 2СО2
ХИМИЧЕСКИЕ СВОЙСТВА.
В химических реакциях гидроксисоединений возможно разрушение одной из двух связей:
-
С-ОН с замещением или отщеплением ОН-группы
-
О-Н с замещением водорода.
1.Одноатомные спирты реагируют с активными металлами (Na, K, Mg), образуя соли - алкоголяты (алкоксиды):
Реакционная способность одноатомных спиртов в реакциях по связи О-Н:
CH3OH > первичные > вторичные > третичные.
2R-OH + 2Na 2 R-ONa + H2
2C2H5-OH + 2K 2 C2H5-OK + H2
этилат калия (алкоголят)
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла:
C2H5OК + H2O C2H5OH + КOH
Со щелочами одноатомные спирты НЕ реагируют.
2.Окисление одноатомных спиртов.
1) Горение: 2CH3OH + 3O22CO2 + 4H2O
2) Окисление первичных спиртов до альдегидов:
Реагенты - CuO (to), O2 (Cu, to), а также дегидрирование при нагревании над медной сеткой.
СН3-СН2-ОН +СuO -(to) CH3-C=O + Cu + H2O
этанол ô этаналь
H
2) Дегидрирование:
СН3-СН2-СН2-ОН -(Сu, to) CH3-CH2-C=O + H2
пропанол ô пропаналь
H
3) Окисление подкисленным раствором перманганата калия приводит к образованию карбоновых кислот:
СН3-СН2-ОН + KMnO4 + H2SO4 -> CH3-COOH + MnSO4 + K2SO4 +H2O уксусная кислота
При окислении метанола образуется углекислый газ!!!
5СН3ОН +6KMnO4 + 9H2SO4 -> 5CО2 + 6MnSO4 + 3K2SO4 +19H2O
4) При окислении вторичных спиртов любым окислителем образуются кетоны.
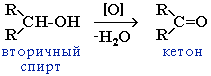
3. Реакции замещения ОН на галоген: происходит в реакции с галогеноводородами в присутствии сильной кислоты (конц. H2SO4).
Реакционная способность одноатомных спиртов в реакциях по связи С-О: третичные > вторичные > первичные > CH3OH
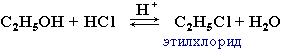
4. Образование сложных эфиров.
Спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
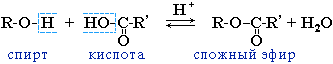
5. Реакции дегидратации спиртов.
Внутримолекулярная дегидратация: образуются алкены.
Внутримолекулярная дегидратация спиртов с образованием алкенов идет в присутствии концентрированной серной кислоты при повышенной температуре:
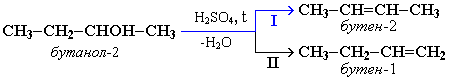
Основной продукт - бутен-2.
Правило Зайцева - водород отщепляется от менее гидрогенизированного атома углерода.
Межмолекулярная дегидратация: образуются простые эфиры.
При межмолекулярной дегидратации спиртов также происходит нуклеофильное замещение: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы.
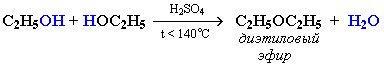
МНОГОАТОМНЫЕ СПИРТЫ.
ПОЛУЧЕНИЕ.
1.Окисление алкенов холодным водным раствором KMnO4:
R-CH=CH2 + KMnO4 + H2O R- CH-CH2 +MnO2 + KOH
алкен │ │ диол
OH OH
2. Замещение галогенов на гидроксогруппу:
СН2- СН - СН2 + 3KOH СН2- СН - СН2 + 3KCl
│ │ │ (вод.р-р) │ │ │
Cl Сl Cl OH OH OH
3.Восстановление поликарбонильных соединений:
O=CH - CH =O + H2 -(t,kat) CH2-CH2
диальдегид │ │
OH OH
ХИМИЧЕСКИЕ СВОЙСТВА.
1.Кислотные свойства. Этиленгликоль, глицерин вследствие взаимного влияния атомов (-I-эффект ОН-групп) являются более сильными кислотами, чем одноатомные спирты.
Образуют соли не только в реакциях с активными металлами, но и под действием щелочей (частично и обратимо):
HO-CH2-CH2-OH + 2Na CH2-CH2 +H2
│ │
ONa ONa
HO-CH2-CH2-OH +2NaOH ⇄ CH2-CH2 +2H2O
│ │
ONa ONa
2.Взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи, образуя комплексные соединения (качественная реакция на многоатомные спирты ):
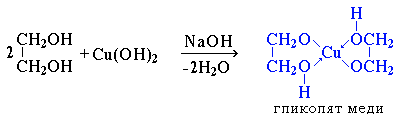
- ярко-синий раствор гликолята меди.
3.Образование сложных эфиров азотной кислоты: реакция с азотной кислотой.
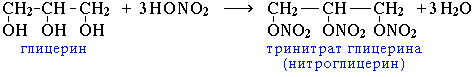
4. Замещение ОН на галоген: также, как и одноатомные спирты, реагируют с галогеноводородами.
HO-CH2-CH2-OH + 2HBr CH2-CH2 + 2H2O
│ │
Можно заместить 1 или 2 группы ОН.
5. Окисление. Так же, как и одноатомные спирты - оксидом меди или над медной сеткой многоатомные спирты окисляются в карбонильные соединения.
CH2-CH2 -(t,Сu) O=CH-CH=O + H2
│ │ диальдегид - глиоксаль
OH OH
ФЕНОЛЫ
Фенолы - гидроксисоединения, в молекулах которых ОН-группы связаны непосредственно с бензольным ядром.
Общая формула - СnH2n-7OH n>6 (для фенолов с одной ОН-группой)
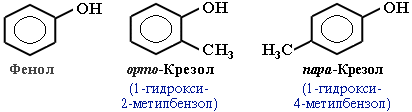
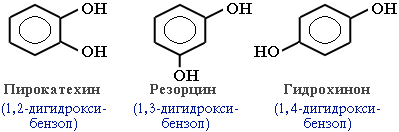
В зависимости от числа ОН-групп различают одноатомные фенолы (например, вышеприведенные фенол и крезолы) и многоатомные. Среди многоатомных фенолов наиболее распространены двухатомные:
Изомерия
1. Фенолам свойственна структурная изомерия (изомерия положения гидроксигруппы).
2. Фенолы изомерны ароматическим спиртам
C6H4(СН3)OН - крезол и C6H5-СН2-OН бензиловый спирт
ПОЛУЧЕНИЕ.
1. Из хлорбензола.
+ Cl2 -(AlCl3) C6H5Cl + HCl
Хлорбензол обрабатывают избытком щелочи, получая водный раствор фенолята натрия:
C6H5Cl + 2NaOH -(t,p)C6H5ONa + NaCl
хлорбензол фенолят натрия
Затем фенол выделяют, пропуская углекислый газ.
С6H5ONa + CO2 +H2O C6H5OH + Na2CO3
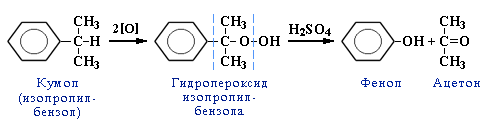
2. Из кумола.
1) Алкилирование бензола пропеном:
![]()
+ CH3-CH=CH2 -(H3PO4)
2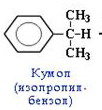 ) Окисление кумола кислородом на катализаторе:
) Окисление кумола кислородом на катализаторе:
СВОЙСТВА ФЕНОЛОВ.
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О-Н увеличивается.
Сходство и отличие фенола и спиртов.
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличие:
-фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
-фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
-фенол не вступает в реакции дегидратации.
Кислотные свойства фенолов.
1. Как и спирты, реагируют с активными металлами.
2C6H5OH + 2Na ->2C6H5ONa + H2
Феноляты легко гидролизуются:
C6H5ONa + HСl C6H5OH + NaCl
C6H5ONa +H2О +СО2 C6H5OH + NaНСО3
2. Реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли - феноляты.
C6H5OH + NaOH C6H5ONa + H2O
Реакции фенола по бензольному кольцу.
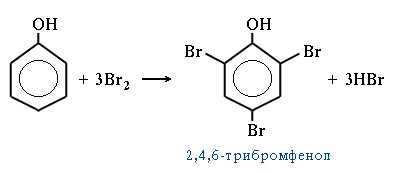
3. Галогенирование. Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол №1).
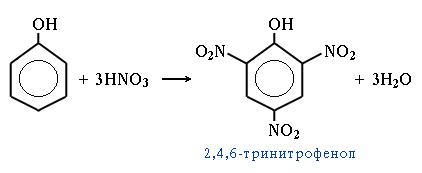
4. Нитрование. Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов. При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота).
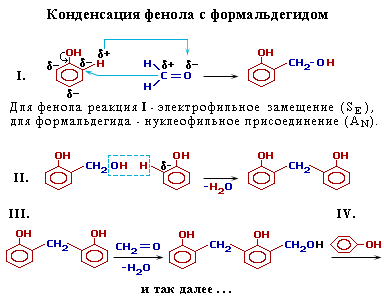
5. Конденсация с альдегидами. С формальдегидом фенол образует фенолоформальдегидные смолы.
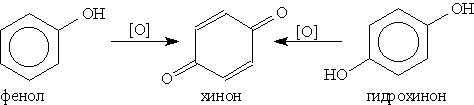
5. Окисление. Фенолы легко окисляются даже под действием кислорода воздуха.
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона образуется хинон:
6. Гидрирование (восстановление)
C6H5OН +3Н2 -(Ni) C6H11OH
циклогексанол
7. Качественная реакция на фенол №2: с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.


