- Преподавателю
- Химия
- Қысқа мерзімді жоспар химия пәнінен
Қысқа мерзімді жоспар химия пәнінен
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | КОЖАБЕКОВА А.А. |
| Дата | 03.01.2016 |
| Формат | docx |
| Изображения | Есть |
Қысқа мерзімді жоспар
-
Сабақ тақырыбы: есеп шығару
-
Мектеп:
-
Күні: 8.12.2014
-
Мұғалім ТАӘ: Кожабекова И.
-
Сынып: 12
-
Қатысқандар:
-
Келмегендер:
Оқу мақсаттары
-
Әр түрлі деңейдегі есептерді шығару
Сабақ мақсаттары
Барлық оқушылар мынаны жасай білулері керек: өз біліміне сүйене отырып оқушы есептерді тандайды, есептін ұпайына сәйкес
Тілдік міндеттер
оқушылар мынаны жасай алуы керек …
Алдыңғы білім
Сабақ барысы
Сабақ кезеңдері
Сабақта жоспарланған оқыту іс - әрекеттері
Оқыту ресурстары
0 - 2
Сабақтың мақсатымен таныстырып, оқушыларды ойын шартымен таныстыру. 23-25 балл жинаған және қолында 8-10 химоны қалған оқушы -«5» алады; 19-22 балл жинаған және қолында 6- 7 химоны қалған оқушы -«4» алады; 15-18 балл жинаған және қолында 5 химоны қалған оқушы -«3» алады. Сабақтын басында әр оқушыға 10 «химон» таратыладыХимонға көмекті мұғалім көрсетеді немесе оқушы басқа оқушыға көмек көрсете алады
3-35 мин есеп шығару
Қосымша ресурстардағы есептер. Әр оқушы өзінің деңгейіне қарай бөлініп тұрған қатардан теріс бетімен парқтағы есепті тандайды (1,2,3,4,5,6,7 баллдық есептер), шығаралмаса есеп баллы алынады.
36-40 мин
Қорытындылау және бағалау
Қосымша ақпарат
Бөліп оқыту - Көбірек қолдау көрсету үшін Сіз не істейсіз? Қабілеті жоғары оқушылар алдында қандай міндеттерді қоюды жоспарлайсыз?
Бағалау - Оқушылардың материалды меңгеру деңгейін қалайша тексеруді көздейсіз?
Пәнаралық байланыс
Денсаулық пен қауіпсіздік ережелері
АКТ
Құндылықтармен байланыс (тәрбие)
Дифференциация сабақтың көпшілігі үшін осы кезеңде жүргізіледі. Үлгерімі төмен оқушыларға үлестірме материал тарату арқылы қолдау көрсетуге болады, ал барынша үлгеретіндерге метакогнитивті сұрақ қою арқылы олардың білімдерін кеңейту қажет.
Сабақта бағалаудың әдеттегі әдістерін қолдануға болады. Алайда бағалау бұл жерде формальды емес болғаны дұрыс: мұғалім түсініктерді тереңдетуге дейін апарып, сұрақ қою арқылы оқушыларды толық сұрап шығады және жеке оқушылардың материалды меңгеру дәрежесін анықтауға тырысады.
Тапсырмаларды дифференциациялау мен бағалауға мүмкіндік бар сабақ кезеңдері жоспарда көлбеу әріппен белгіленген.
Рефлексия
Сабақ мақсаттары/оқыту мақсаттары қол жетімді болды ма? Бүгін оқушылар нені үйренді? Оқыту ортасы қандай болды? Менің бөліп оқытқаным жоспарлағандай жүзеге асты ма? Мен өз уақытымды ұтымды пайдалана алдым ба? Мен жоспарыма қандай өзгерістер енгізуім қажет және неліктен?
Берілген бөлімді өз сабағыңызға рефлексия жүргізу үшін пайдаланыңыз. Сабағыңызға қатысты сол жақта келтірілген сұрақтарға жауап беріңіз.
Қорытынды бағалау
Ең жақсы өткен екі әрекетті атап көрсетіңіз (оқытуға және үйренуге қатысты)
1:
2:
Қандай екі әрекет сабақтың одан да жақсы өтуіне ықпалын тигізуші еді? (оқытуға және үйренуге қатысты)
1:
2:
Осы сабақтың барысында менің келесі сабағыма қажет болуы мүмкін барлық сынып немесе жекелеген оқушылар туралы қандай ақпаратты алдым?
Кальций оксидінен кальций сульфатын қалай алуға болады? 2 реакция теңдеулерін жазыңыз (1балл)
____________________________________________________________________________________
Кальций оксидінен кальций карбонатын қалай алуға болады? 2 реакция теңдеулерін жазыңыз (1 балл)
__________________________________________________________________________________________
Реакцияның термохимиялық теңдеуі бойынша CaCO3= CaO + CO2 -180 kДж
200 кг кальций оксидін алу үшін қанша жылу жұмсау қажет болатынын есептендер (2балл)
____________________________________________________________________________________
Реакцияның термохимиялық теңдеуі бойынша СаО+Н2О = Ca(OH)2+67кДж
5 кг сөндірілмеген әкті сөндіру үшін қанша жылу бөлінетінін есептендер.(2 балл)
_________________________________________________________________________________________
Кальцийді, оттекті, фофсфорды қолданып, кальций фосфатын қалай алуға болады? Реакция теңдеулерін жазыңыз. (2 балл)
_____________________________________________________________________________________
Мәрмәр құрамындағы элемент атомдарының массалық қатынастарын табыңдар. (2 балл)
_______________________________________________________________________________________
Төмендегі айналымдарды:
Кальций карбонаты →кальций оксиді →кальций карбиді→ кальций гидроксиді→кальций карбонаты→кальций гидрокарбонаты
Орындауға мүмкіндік беретін реакциялардың молекулалық және иондық теңдеулерін жазыңдар . (3 балл)
________________________________________________________________________________________
Кермек суда кальций карбонаты бар екенін реактивтер қолданбай физикалық тәсілмен қалай анықтауға болады? (1 балл)
________________________________________________________________________________
Судың карбонатттық кермектігі оның құрамында гидрокарбонат иондары болуына байланысты. Суды қайнатқын кезде гидрокарбонат карбонатқа айналып, қақ түрінде ыдыстың қабырғасына қонады Са(НСО3)2 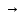 СаСО3↓ + СО2 ↑ + Н2О
СаСО3↓ + СО2 ↑ + Н2О
Құрамында 20мг/л Са2+ иондары бар 2 л суды қайнатқанда , шәйнектің түбіне кальций карбонатының қандай массасы тұнатынын табыңдар (3 балл)
___________________________________________________________________________________________
Шай қайнататын шәйнектегі қақтың құрамында карбонат бар екенін үй жағдайында қалай дәлелдеуге болады? (2 балл)
_____________________________________________________________________________________
Зат белгісі жоқ нөмірленген үш ыдыста үш зат: сода, бор және гипс берілген. Су мен тұз қышқылын ғана пайдаланып , әр заттың қай ыдыста екенін қалай анықтауға болады? Түсіндіріп, жүретін химиялық реакция теңдеулерін жазыңдар. (3 балл)
________________________________________________________________________________________
Кейбір аллергиялық және тері ауруларын емдегенде, кальций хлоридінің ерітіндісі қолданылады. 100 г суда кальций хлориді гексагидратының 11 грамм еріткенде түзілген ерітіндінің массалық үлесін және осы ерітіндіні бір рет қабылдаған 20 грамымен адам организміне қандай массасы кіретіндігін есептендер. (4 балл)
______________________________________________________________________________________
Калий силикатының тұз қышқылымен әрекеттесу реакциясының молекулалық және иондық теңдеулерін жазыңдар (2 балл)
______________________________________________________________________________________
Кальций хлоридінің балқымасын электролиздегенде , анодта 11,2 л (қ.ж) хлор бөлінді. Катодта бөлінген кальцийдің массасын табыңдар. (2 балл)
_____________________________________________________________________________________________
Кальций хлоридінің ерітіндісін электролиздегенде , анодта 11,2 л (қ.ж) газ бөлінді. Катодта бөлінген заттың массасын табыңдар. (4 балл)
_____________________________________________________________________________________
Натрий сульфатының ерітіндісін электролиздегенде , анодта 11,2 л (100,3 кПа, 200С жағдайында) газ бөлінді. Катодта бөлінген заттың массасын табыңдар. (5 балл)
Құрамында 50% қоспасы бар 240г техникалық натрий силикаты тұз қышқылымен әрекеттескенде түзілетін кремний қышқылының зат мөлшерін есептеңдер (3 балл)
_______________________________________________________________________________________
Құрамында хром (ІІІ) оксидінің массалық үлесі 80 % кеннің 20 кг-нан алюмотермиялық тәсілімен хромның қандай массасын алуға болады. (3 балл)
_____________________________________________________________________________
Массасы 75 г мәрмәр тасына тұз қышқылымен әсер еткенде, көлемі 11,2 л (қ.ж) газ бөлінді Мәрмәрдағы қоспаның массасын табыңдар (3 балл)
_________________________________________________________________________________
Алюминий мен мыстың массасы 12 г қоспасына қышқылмен әсер еткенде, 7,4 л (қ.ж.) сутек бөлінді. Қоспа құрамындағы әр металдың массалық үлесін табыңдар (3 балл)
______________________________________________________________________________________
Құрамындағы кальций карбонатының массалық үлесі 80 % массасы 6,25 г әктасты ыдыратқанда түзілген көміртек оксиді құрамында 2,25 г кальций гидроксиді бар ерітінді арқылы өткізілді. Қандай тұз (қышқылдық немесе орта) түзілгенін және олардың массалары мен формуласын табыңдар. (6 балл)
_____________________________________________________________________________________
Калий карбонаты мен натрий карбонатының массасы 8 г қоспасы күкірт қышқылымен әрекеттескенде түзілген калий мен натрий сульфаттары қоспасының массасы 10,24 г болды. Бастапқы қоспа құрамындағы тұздардың массалық үлестерін анықтаңдар. (6 балл)
_______________________________________________________________________________
1,2∙1023 атом натрийде заттың қандай мөлшері бар. (1 балл)
___________________________________________________________________________
11г көмір қышқылында (СО2) қанша молекула бар және зат мөлшерін табу ( 1 балл)
________________________________________________________________________________________
Мысты тотықтырып 40г СuО алу үшін қанша грамм оттегін қатыстыру керек.(2 балл)
______________________________________________________________________________________
Массалық үлесі 0,2 тең 100г ерітінді мен 0,32г тең 50г ерітіндіні араластырған. Алынған ерітіндінің массалық үлесін табу.(3 балл)
____________________________________________________________________________________
6,4г мыс сымының ұзындығы 1м. Бір моль мыстың мөлшері болатын мыс сымның қандай ұзындығын алуға болады? (2 балл)
________________________________________________________________________________________
Бір кг тұз сатып алынды. Ондай мөлшердің моль саны қанша. 1моль тұздың бағасы қанша? (2 балл)
_______________________________________________________________________________________
3л 50% КОН ерітіндісі (ρ=1,51г/см3) берілген. Еріген заттың массасын анықтаңдар. (2 балл)
__________________________________________________________________________________
0,2М 500мл КNО3 ерітіндісін дайындау үшін қанша грамм КNО3 алуға болады. (2 балл)
____________________________________________________________________________________
10,8г АІ тұз қышқылының әрекеттескенде қандай көлем сутегі (қ.ж.) бөлінеді. (2 балл)
_________________________________________________________________________________
1,5моль НСІ мен алюминий әрекеттескенде түзілетін тұздың массасын және сутегінің көлемін анықтаңдар. (2 балл)
______________________________________________________________________________
21,1 г смеси цинка и алюминия растворили в 565 мл раствора азотной кислоты, содержащего 20 мас. % НNО3 и имеющего плотность 1,115 г/мл. Объем выделившегося газа, являющегося простым веществом и единственным продуктом восстановления азотной кислоты, составил 2,912 л (н.у.). Определите состав полученного раствора в массовых процентах. (7 балл)
На смесь железа, алюминия и меди подействовали избытком холодной концентрированной серной кислоты. При этом часть смеси растворилась, и выделилось 5,6 л газа (н.у.). Оставшуюся смесь обработали избытком раствора едкого натра. Выделилось 3,36 л газа и осталось 3 г не растворившегося остатка. Определить массу и состав исходной смеси металлов. (7 балл)
16 г смеси цинка, алюминия и меди обработали избытком раствора соляной кислоты. При этом выделилось 5,6 л газа (н.у.) и не растворилось 5 г вещества. Определить массовые доли металлов в смеси. (6 балл)
При обработке 17,4 г смеси меди, железа и алюминия избытком концентрированной азотной кислоты выделилось 4,48 л газа (н.у.), а при действии на эту смесь такой же массы избытка хлороводородной кислоты - 8,96 л газа (н.у.). Определите состав исходной смеси (7 балл)
Смесь меди и алюминия массой 20 г обработали 96 %-ным раствором азотной кислоты, при этом выделилось 8,96 л газа (н. у.). Определить массовую долю алюминия в смеси. (4 балл)
1-2. Смесь меди и цинка массой 10 г обработали концентрированным раствором щелочи. При этом выделилось 2,24 л газа (н.y.). Вычислите массовую долю цинка в исходной смеси. (4 балл)
1-3. Смесь магния и оксида магния массой 6,4 г обработали достаточным количеством разбавленной серной кислоты. При этом выделилось 2,24 л газа (н.у.). Найти массовую долю магния в смеси. (4 балл)
1-4. Смесь цинка и оксида цинка массой 3,08 г растворили в разбавленной серной кислоте. Получили сульфат цинка массой 6,44 г. Вычислите массовую долю цинка в исходной смеси. (4 балл)
1-5. При действии смеси порошков железа и цинка массой 9,3 г на избыток раствора хлорида меди (II) образовалось 9,6 г меди. Определите состав исходной смеси. (4 балл)
1-6. Какая масса 20%-ного раствора соляной кислоты потребуется для полного растворения 20 г смеси цинка с оксидом цинка, если при этом выделился водород объемом 4,48 л (н.у.)? (4 балл)
1-7. При растворении в разбавленной азотной кислоте 3,04 г смеси железа и меди выделяется оксид азота (II) объемом 0,896 л (н.у.). Определите состав исходной смеси. (4 балл)
1-8. При растворении 1,11 г смеси железных и алюминиевых опилок в 16%-ном растворе соляной кислоты (ρ = 1,09 г/мл) выделилось 0,672 л водорода (н.у.). Найдите массовые доли металлов в смеси и определите объем израсходованной соляной кислоты.(4 балл)
2. Задачи более сложные.
2-1. Смесь кальция и алюминия массой 18,8 г прокалили без доступа воздуха с избытком порошка графита. Продукт реакции обработали разбавленной соляной кислотой, при этом выделилось 11,2 л газа (н.у.). Определите массовые доли металлов в смеси. (5 балл)
2-2. Для растворения 1,26 г сплава магния с алюминием использовано 35 мл 19,6%-ного раствора серной кислоты (ρ = 1,1 г/мл). Избыток кислоты вступил в реакцию с 28,6 мл раствора гидрокарбоната калия с концентрацией 1,4 моль/л. Определите массовые доли металлов в сплаве и объем газа (н.у.), выделившегося при растворения сплава. (5 балл)
2-3. При растворении 27,2 г смеси железа и оксида железа (II) в серной кислоте и выпаривании раствора досуха образовалось 111,2 г железного купороса - гептагидрата сульфата железа (II). Определите количественный состав исходной смеси. (5 балл)
2-4. При взаимодействии железа массой 28 г с хлором образовалась смесь хлоридов железа (II) и (III) массой 77,7 г. Вычислите массу хлорида железа (III) в полученной смеси. (5 балл)
2-5. Чему была равна массовая доля калия в его смеси с литием, если в результате обработки этой смеси избытком хлора образовалась смесь, в которой массовая доля хлорида калия составила 80%?(5 балл)
2-6. После обработки избытком брома смеси калия и магния общей массой 10,2 г масса полученной смеси твердых веществ оказалась равной 42,2 г. Эту смесь обработали избытком раствора гидроксида натрия, после чего осадок отделили и прокалили до постоянной массы. Вычислите массу полученного при этом остатка. (5 балл)
2-7. Смесь лития и натрия общей массой 7,6 г окислили избытком кислорода, всего было израсходовано 3,92 л (н.у.). Полученную смесь растворили в 80 г 24,5%-го раствора серной кислоты. Вычислите массовые доли веществ в образовавшемся растворе. (5 балл)
2-8. Сплав алюминия с серебром обработали избытком концентрированного раствора азотной кислоты, остаток растворили в уксусной кислоте. Объемы газов, выделившихся в обеих реакциях измеренные при одинаковых условиях, оказались равными между собой. Вычислите массовые доли металлов в сплаве. (5 балл)
3. Три металла и сложные задачи.
3-1. При обработке 8,2 г смеси меди, железа и алюминия избытком концентрированной азотной кислоты выделилось 2,24 л газа. Такой же объем газа выделяется и при обработке этой же смеси такой же массы избытком разбавленной серной кислоты (н.у.). Определите состав исходной смеси в массовых процентах. (7 балл)
3-2. 14,7 г смеси железа, меди и алюминия, взаимодействуя с избытком разбавленной серной кислоты, выделяет 5,6 л водорода (н.у.). Определите состав смеси в массовых процентах, если для хлорирования такой же навески смеси требуется 8,96 л хлора (н.у.). (7 балл)
3-3. Железные, цинковые и алюминиевые опилки смешаны в мольном отношении 2:4:3 (в порядке перечисления). 4,53 г такой смеси обработали избытком хлора. Полученную смесь хлоридов растворили в 200 мл воды. Определить концентрации веществ в полученном растворе. (7 балл)
3-4. Сплав меди, железа и цинка массой 6 г (массы всех компонентов равны) поместили в 18,25 % раствор соляной кислоты массой 160 г. Рассчитайте массовые доли веществ в получившемся растворе. (7 балл)
3-5. 13,8 г смеси, состоящей из кремния, алюминия и железа, обработали при нагревании избытком гидроксида натрия, при этом выделилось 11,2 л газа (н.у.). При действии на такую массу смеси избытка соляной кислоты выделяется 8,96 л газа (н.у.). Определите массы веществ в исходной смеси. (7 балл)
3-6. При обработке смеси цинка, меди и железа избытком концентрированного раствора щелочи выделился газ, а масса нерастворившегося остатка оказалась в 2 раза меньше массы исходной смеси. Этот остаток обработали избытком соляной кислоты, объем выделившегося газа при этом оказался равным объему газа, выделившегося в первом случае (объемы измерялись при одинаковых условиях). Вычислите массовые доли металлов в исходной смеси. (7 балл)
3-7. Имеется смесь кальция, оксида кальция и карбида кальция с молярным соотношением компонентов 3:2:5 (в порядке перечисления). Какой минимальный объем воды может вступить в химическое взаимодействие с такой смесью массой 55,2 г? (7 балл)
3-8. Смесь хрома, цинка и серебра общей массой 7,1 г обработали разбавленной соляной кислотой, масса нерастворившегося остатка оказалась равной 3,2 г. Раствор после отделения осадка обработали бромом в щелочной среде, а по окончании реакции обработали избытком нитрата бария. Масса образовавшегося осадка оказалась равной 12,65 г. Вычислите массовые доли металлов в исходной смеси. (7 балл)
1 химон
1 химон
1 химон
1 химон
1 химон
1 химон
1 химон
1 химон
1 химон
1 химон
1 химон
1 химон
1 химон
1 химон
1 химон
1 химон
1 химон
1 химон
Продукты восстановления азотной кислоты.
Чем активнее металл и чем меньше концентрация кислоты, тем дальше восстанавливается азот
NO2
NO
N2O
N2
NH4NO3
Неактивные металлы (правее железа) + конц. кислота
Неметаллы + конц. кислота
Неактивные металлы (правее железа) + разб. кислота
Активные металлы (щелочные, щелочноземельные, цинк) + конц. кислота
Активные металлы (щелочные, щелочноземельные, цинк) + кислота среднего разбавления
Активные металлы (щелочные, щелочноземельные, цинк) + очень разб. кислота
Пассивация: с холодной концентрированной азотной кислотой не реагируют:
Al, Cr, Fe, Be, Co.
Не реагируют с азотной кислотой ни при какой концентрации:
Au, Pt, Pd.
Продукты восстановления серной кислоты.
SO2
S
H2S
H2
Неактивные металлы (правее железа) + конц. кислота
Неметаллы + конц. кислота
Щелочноземельные металлы + конц. кислота
Щелочные металлы и цинк + концентрированная кислота.
Разбавленная серная кислота ведет себя как обычная минеральная кислота (например, соляная)
Пассивация: с холодной концентрированной серной кислотой не реагируют:
Al, Cr, Fe, Be, Co.
Не реагируют с серной кислотой ни при какой концентрации:
Au, Pt, Pd.
9


