- Преподавателю
- Химия
- Тест по химии за 1 курс
Тест по химии за 1 курс
| Раздел | Химия |
| Класс | - |
| Тип | Тесты |
| Автор | Арканова Е.И. |
| Дата | 15.01.2015 |
| Формат | doc |
| Изображения | Есть |
| ХИМИЯ , 1 КУРС, база 9 классов. Преподаватель: Арканова Елена Ивановна Условия выполнения задания: тестовые задания выполняются в учебном кабинете, для ответов на вопросы отводится время не менее 2,5 академических часов (80 вопросов* 2 мин). Задания выполняются на бланках ответов.
Вариант 1
|
| Указание В заданиях с 1 по 60 укажите единственно верный ответ
|
| Задания типа А
а) S б) Si в) Oг) Ne
а) 1 б) 3 в) 5 г) 7. 3. Число валентных электронов у атома хрома а) 1 б) 2 в) 4 г) 6. 4. Ковалентный характер связей в ряду соединений LiF - BeF2 - BF3 - CF4 - NF3 - OF2 - F2 : а) уменьшается; б) увеличивается; в) сначала увеличивается, потом уменьшается; г) не изменяется 5. Электрон - это … а) участок цепи, состоящий из последовательно соединенных элементов б) заряда атома элемента в) отрицательно заряженная частица 6. Для веществ с металлической кристаллической решеткой несвойственна: а) низкая температура кипения б) хрупкость в) теплопроводность г) пластичность 7. Гидролизу не подвергается: а) ацетат натрия б) хлорид цинка в) этанол г) жир. 8. С наибольшей скоростью при комнатной температуре идет реакция магния с: а) 1%-ным раствором HCl б) 5%-ным раствором HCl в) 10%-ным раствором HCl г) 15 %-ным раствором HCl. 9. Наиболее сильной кислотой является а) кремниевая б) серная в) ортофосфорная г) хлорная 10. Укажите формулу для определения массовой доли вещества а) = m / V б) M = m / . в) = V / Vm г) ω = Аr : Мr 11. Укажите молекулярную массу Cl 2 O7 а) 183 б) 105 в) 224 г) 97 12. Укажите массовую долю S в SO2 а) 20,13% б) 17,5% в) 22,43% г) 97% 13. При увеличении площади реагирующего вещества скорость реакции а) увеличится в) уменьшится б) не изменится г) станет равной нулю 14. Укажите единицы измерения молярной массы а) грамм на литр в) моль б) грамм г) количество n
15. Укажите, где правильно расставлены степени окисления а) K2MnO4: K+1, Mn+4, O-2; б) Ba(ClO3)2: Ba+2, Cl+5, O-2; в) F2O: F-2, O+2; 16. Укажите уравнение реакции окисления сульфита натрия до сульфата натрия:
а) 5Nа2SО3 + 2КМnО4 + ЗН2SО4 = 5Nа2SО4 + К2SО4 + 2МnSО4 + ЗН2О. б) Nа2SО3 + КМnО4 = Nа2О + К2О + МnSО3 17. Определите массу 5 моль СО2: а) 176 г.; б) 220г.; в) 47г.; 18. Укажите, какое соединение является сильным электролитом: а) Мg ОН в) Zn SO3 б) H2S г) Ba(NO3)2 19. Закончите уравнение реакции: Ca(H2PO4)2 + HCl = а) CaCl2 + 2H3PO4; б) Са ОН+ 2H3PO4; в) Са (ОН)2+ 2H3PO4; 20. Укажите, как происходит гидролиз Cr2(SO4)3: а) Cr2(SO4)3 + 2H2S = 2Cr(OH)SO3 б) Cr2(SO4)3 + 2H2O = 2Cr(OH)SO4 21. Укажите, правильно уравненную методом электронного баланса, схему реакции: а) 2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6] б) 3Al + 9NaOH + 9H2O = 3Na3[Al(OH)6] 22. Какой характер реакции среды водного раствора азотной кислоты? а) Щелочной, HNО3 = NО3+ + OH-; б) Кислый, HNО3 = H+ + NО3 -; 23. Укажите, что образуется в кислороде и воздухе при сгорании ацетилена? а) аммиак и углекислый газ; б) вода и этилен; в) вода и углекислый газ; 24. Для большинства неорганических веществ характерны реакции? а) горения; б) соединения; в) разложения; 25. В схеме превращений FeCl3 веществами «Х1» и «Х2» могут быть соответственно: а) Fe2(SO4)3 и Fe2O3 б) FePO4 и Fe3O4 в) Fe(NO3)3 и Fe2O3 г) Fe(OH)3 и Fe2(SO4)3 26.Укажите тип гибридизации ключевых атомов углерода в молекуле: СН2 СН СН3 а) sp3 б) sp в) sp2 27. Угол между осями углеродного атома для sp- гибридных орбиталей равен: а) 109 28 б)120 в) 180 28. В sp2 -гибридизации не участвуют орбитали второго энерго уровня атома углерода в количестве: а) одного б) двух в) трех 29.К классу алкенов относятся углеводороды с общей формуло: а) Сn Н 2n+2 б) Сn Н 2n в) Сn Н 2n-2 30.Соединения с замкнутой цепью атомов углерода в молекуле называются: а) ациклическими б) карбоциклическими
31. Все спирты имеют в названии суффикс: а) -ен б) -ол в) -аль 32.У изомеров одинаково: а) количество атомов б) строение молекул в) свойства 33.Вещества СН3 СН2 СН2 СН3 и СН3 СН СН3 являются: а) гомологами б) изомерами в) ни гомологами, ни изомерами 34. Раствор перманганата калия обесцвечивает: а) этилен б) этан в) 2-метилпропан г) 3,3-диметилпентан. 35.Реакция, уравнение которой СН3 СН2ОН СН2 СН2 + Н2О, относится к реакциям: а) замещения б) присоединения в) элиминирования. 36. Реакция, уравнение которой приведено выше, является реакцией: а) дегидрирования б) дегидратации в) дегидрохлорирования. 37.Алканам соответствует общая формула: а) Сn Н2n б) Сn Н2n+2 в) Сn Н2n-2 г) Сn Н2n -6 38. Гомологами являются: а) этан и этилен б) пропан и этан в) бутан и изобутан г) метан и этен 39. Изомеры отсутствуют у углеводородов: а) этилена б) пентана в) 2-метилбутана г) гексена-1 40. Атомы углерода в состоянии sp3 - гибридизации имеются в молекуле: а) пентана б) этилена в) 2-метилбутана г) н-гептана 41. Наиболее характерный тип реакции для алкенов: а) элиминирование б) изомеризация в) присоединение г) замещение 42. Для алканов характерна изомерия: а) положения функциональной группы б) углеродного скелета в) положения двойной связи г) геометрическая 43. Основную часть природного газа составляет: а) этан б) пропан в) гексан г) метан 44. Крекинг нефтепродуктов - это… а) разделение углеводородов нефти на фракции б) превращение предельных углеводородов нефти в ароматические в) термическое разложение нефтепродуктов, приводящее к образованию углеводородов с меньшим числом атомов углерода в молекуле г) превращение ароматических углеводородов нефти в предельные 45.Кратные связи отсутствуют в молекуле углеводорода: а) циклопропана б) бутадиена-1,3 в) пропина г) бензола 46. Ароматическое кольцо содержится в молекуле: а) гексана б) циклогексана в) гексена г) 1,4-диметилбензола. 47. Реакция полимеризации возможна для… а) бутадиена-1,3 б) пропана в) хлорэтана г) бензола. 48. Реакция присоединения воды к непредельным углеводородам называется… а) гидрирование б) галогенирование в) гидратация г) гидрогалогенирование. 49.Вещество, формула которого СН3СН2ОН, относится к… а) одноатомным спиртам б) фенолам в) альдегидам г) многоатомным спиртам
50. Вещество, формула которого СН3 СН СН СН СО, имеет название: | | СН3 Н а) 4-метилпентаналь б) 2-метилпентаналь в) 2-метилпентен-3-аль г) гексаналь 51. Образование ярко- синего комплексного соединения с гидроксидом меди (II) является качественной реакций на… а) альдегиды б) многоатомные спирты в) фенолы г) кетоны 52. Реакцию «серебряного зеркала» дает: а) этанол б) этандиол-1,2 в) пропантриол-1,2,3 г) этаналь. 53.К карбоновым кислотам относится вещество, формула которого… а) СН3СООН б) СН3СОН в) СН3О СН3 г) СН3СООСН3 54. Вещество, формула которого СН3 СООС2Н5 имеет название… а) диэтиловый эфир б) метилацетат в) этилацетат г) этиловый эфир муравьиной кислоты. 55. Мыло представляет собой… а) натриевую соль высшей карбоновой кислоты б) сложный эфир глицерина в) сложный эфир высшей карбоновой кислоты г) смесь высших карбоновых кислот. 56. В основе получения маргарина лежит реакция: а) гидролиза жиров б) этерификации в) омыления жиров г) гидрирования жидких жиров. 57. Является полимером: а) глюкоза б) целлюлоза в) сахароза г) фруктоза
58. В реакцию «серебряного зеркала» вступает… а) глюкоза б) фруктоза в) сахароза г) крахмал 59. Для глюкозы не характерна реакция: а) спиртового брожения б) гидролиза в) окисления г) восстановления 60. Верно следующее утверждение… а) В результате поликонденсации аминокислот образуются пептиды; б) Из аминокислот получают синтетические карбоновые кислоты; в) Аминокислоты не изменяют окраску индикаторов; г) Белки представляют из себя смесь аминокислот, связанных между собой межмолекулярными связями.
|
| Указание В вопросах с 61 по 65 установите соответствие между законом, электрической величиной и их понятием. Заполните предлагаемые формы ответов.
|
| 61. Установить соответствие между законом, теорией и их формулировкой: 1. Периодический закон Д.И.Менделеева а) Под воздействием электрического тока положительно заряженные ионы растворенного вещества движутся к катоду, отрицательно заряженные к аноду. 2. Теория химического строения органических веществ Бутлерова А.М б) Тела состоят из молекул и атомов, которые находятся в непрерывном движении, на которые действуют силы отталкивания и притяжения 3. Теория электролитической диссоциации в) Атомы углерода соединяясь в цепи образуют определенную последовательность в соответствии с валентностью, от чего и зависят их свойства 4. Атомно-молекулярное учение г)Свойства простых тел и соединений элементов находится в периодической зависимости от величины их атомных масс. 1 - … 2 - … 3 - … 4 -…
62. Установите соответствие между величиной и ее формулой 1) = а) = m / 2) = б) = V / Vm 3) ω = в) = Аr ∙ n / Мr; 4) M = г) = m / V 1 -…. 2 - …. 3 - …. 4 - …. 63. Установите соответствие между веществом и его формулой
1 -…. 2 - … 3 - … 4 - … 5- … 6- … 7- … 64. Установите соответствие между веществом и его электронно-графической схемой: 1) N а) 1s22s22p63s23p2, 2) Si б) 1s22s22p63s23p64s23d6, 3) Fе в) 1s22s22p3. 1 -…. 2 - … 3 - … 65. Установите соответствие между химической реакцией и продуктом реакции: 1) Li2О + SеО3 а) К2СО3, 2) СО2 + К2О б) Са(NО3)2 3) N2О5 + СаО в) Li2SeО4, 1 -…. 2 - … 3- …
|
| Указание В заданиях с 66 по 75 закончите начатую фразу или вставьте слова |
| 66. Выражение реакции при помощи химических формул называется … 67. Свойства элементов и их соединений находятся в … зависимости от заряда ядра 68. Тепловой эффект - количество теплоты, которое… 69. Химическое равновесие - состояние… 70. Гидролиз - процесс обменного взаимодействия соли с водой, сопровождающийся образованием … 71. Катализатор - ускоряющее реакцию вещество, не… 72. Сольватация - процесс взаимодействия молекул и ионов растворённого вещества … 73. Окислительно-восстановительные реакции состоят из двух процессов: ... и … 74. Электролиз - это процесс синтеза или разложения веществ с помощью …
|
| Указание В заданиях типа Б с 75 по 80 решите задачу и предложите правильный вариант ответа |
| Задания типа Б 75. Рассчитайте массу кислорода, прореагировавшего с органическим веществом массой 33,3 г. В результате реакции образовались следующие вещества: I) углекислый газ - (СО2) массой 52,8 г; 2) угарный газ - (СО) массой 11,2 г; 3) сажа (С) массой 2,4 г; 4) вода массой 40,5 г. 76. Определите формулу химического соединения, если массовые доли составляющих его элементов равны: Н - 2,04%, S - 32,65%, О - 65,31%. 77. Какой объем занимает кислород, выделившийся из одного моля каждого из веществ: KClO3, КMnО4, КNО3, HgО по данным ниже реакциям? 2KClO3 = 2КСl + ЗО2↑, 2КMnО4 = К2MnО4 + MnО2 + О2↑, 2КNO3 = 2КNО2 + О2↑, 2HgO = 2Нg + О2↑. 78. Составьте полные уравнения следующих реакций: 1) АlСl3 + КОН(изб.) → 2) АlСl3 + NН3(изб.) + Н2О → 3) Аl(NО3)3 + Nа2S + Н2О → 4) Nа[Аl(ОН)4] + СО2 → 79. Напишите уравнения реакций, позволяющих осуществить следующие превращения: Мg → МgSО4 → Мg(NО3)2 → МgО → (СН3СОО)2Мg. 80. Напишите структурную формулу 2,2,5,5-тетраметилгексана. Напишите формулу его изомера
|
Вариант 2
Указание
В заданиях с 1 по 60 укажите единственно верный ответ
1. Электронную конфигурацию 1s22s22p63s23p64s1 имеет атом элемента
а) K б) Ca в) Ba г) Na.
2. Число орбиталей на d -подуровне:
а) 1 б) 3 в) 5 г) 7.
3. Число валентных электронов у атома стронция
а) 1 б) 2 в) 3 г) 10.
4. Ионный характер связей в ряду соединений
Li2O - Na2O - K2O - Rb2O
а) уменьшается; б) увеличивается;
в) сначала увеличивается, потом уменьшается; г) не изменяется
5. Электронная орбиталь - это …
а) участок пути, который проходят соединенные вместе элементы вещества
б) условный путь, по которому двигается электрон вокруг ядра элемента
в) отрицательно заряженная частица
6. Что изменится при изменении последовательности атомов в молекуле:
a) количество и объем вещества,
б) количественный состав и плотность вещества,
в) масса молекулы и геометрическая форма.
г) Химическое строение и свойства
7. В каком из водных растворов щелочная среда:
а) ацетата натрия б) нитрата меди (II)
в) хлорида калия г) сульфата алюминия.
8. С наибольшей скоростью при комнатной температуре будет идти реакция:
а) цинка с серной кислотой
б) натрия с фенолом
в) железа с кислородом
г) растворов сульфата меди (II) и гидроксида калия.
9. Из перечисленных металлов самым легкоплавким является
а) медь б) ртуть в) олово г) натрий.
10. Укажите формулу для определения молярной массы вещества
а) = m / V б) M = m / . в) = V / Vm г) ω = Аr : Мr
11. Укажите массовую долю S в SO2
а) 20,13% б) 17,5% в) 22,43% г) 97%
12. Укажите молекулярную массу Cl 2 O7
а) 183 б) 105 в) 224 г) 97
13. При увеличении плотности реагирующего вещества скорость реакции
а) увеличится в) уменьшится
б) не изменится г) станет равной нулю
14. Укажите единицы измерения молярной массы
а) грамм на литр в) моль
б) грамм г) количество n
15. Укажите, где правильно расставлены степени окисления
а) Ca(NO2)2: Ca+2, N+2, O-2;
б) H2SiF2: H+1, Si+3, F-1;
в) Cr2(SO4)3: Cr+3, S+6, O-2.
16. Укажите уравнение реакции окисления дисульфида железа (II) концентрированной азотной кислотой.
а) FeS2 + 18НNО3(конц) = Fе(NО3)3 + 2Н2SО4 + 15NО2 + 7Н2О.
б) Fе(SО4)3 + НNО3(конц) = Fе(NО3)3 +Н2SО4 + NО2 + Н2О.
17. Определите массу 9 моль SО2:
а) 176 г.;
б) 220г.;
в) 576г.;
18. Укажите, какое соединение не является сильным электролитом:
а) HJ в) KOH
б) H2S г) Ba(NO3)2
19. Укажите пропущенное вещество: P2O5+...=Ca3(PO4)2+H2O
а) Са Н;
б) Са ОН;
в) Са (ОН)2;
20. Укажите, как происходит гидролиз Р2S3:
а) Р2S3 + 6H2O = 2H3PO3 + 3H2S
б) Р2SО3 + 6H = 2H3PO3 + 3H2SО3
21. Укажите, правильно уравненную методом электронного баланса,
схему реакции:
а) 3Na + 2H2O = 4 NaOH + H2
б) 2Na + H2O = 2NaOH + H2
22. Какой характер реакции среды водного раствора аммиака?
а) Щелочной, NH3 + H2O = NH4+ + OH-;
б) Кислый, NH3 + H2O = NH3+ + OH-+ H-; ;
23. Укажите, правильную, эмпирическую формулу вещества, состоящую из:
Na- 32,8%, Al - 12,9%, F - 54,3%.
а) Na2Al3F;
б) Na3AlF;
в) NaAlF;
24. Для большинства органических веществ характерны реакции?
а) горения;
б) соединения;
в) разложения;
25. В схеме превращений Al(OH)3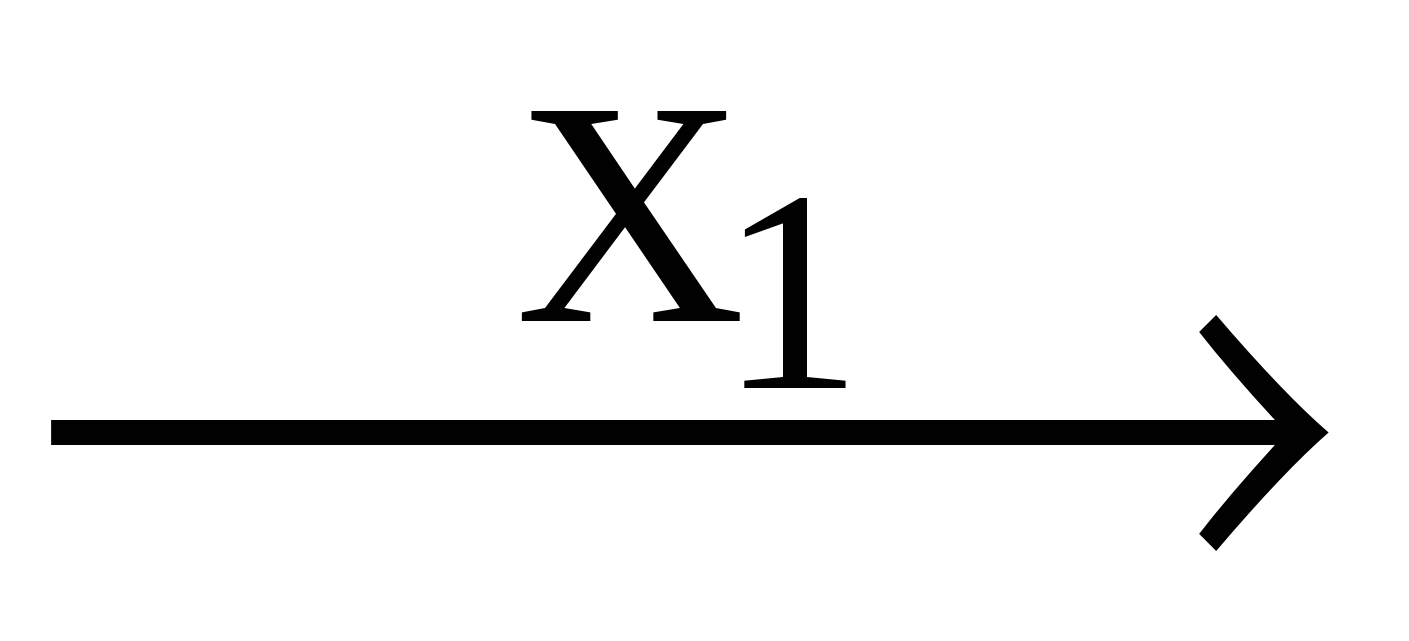 Y
Y 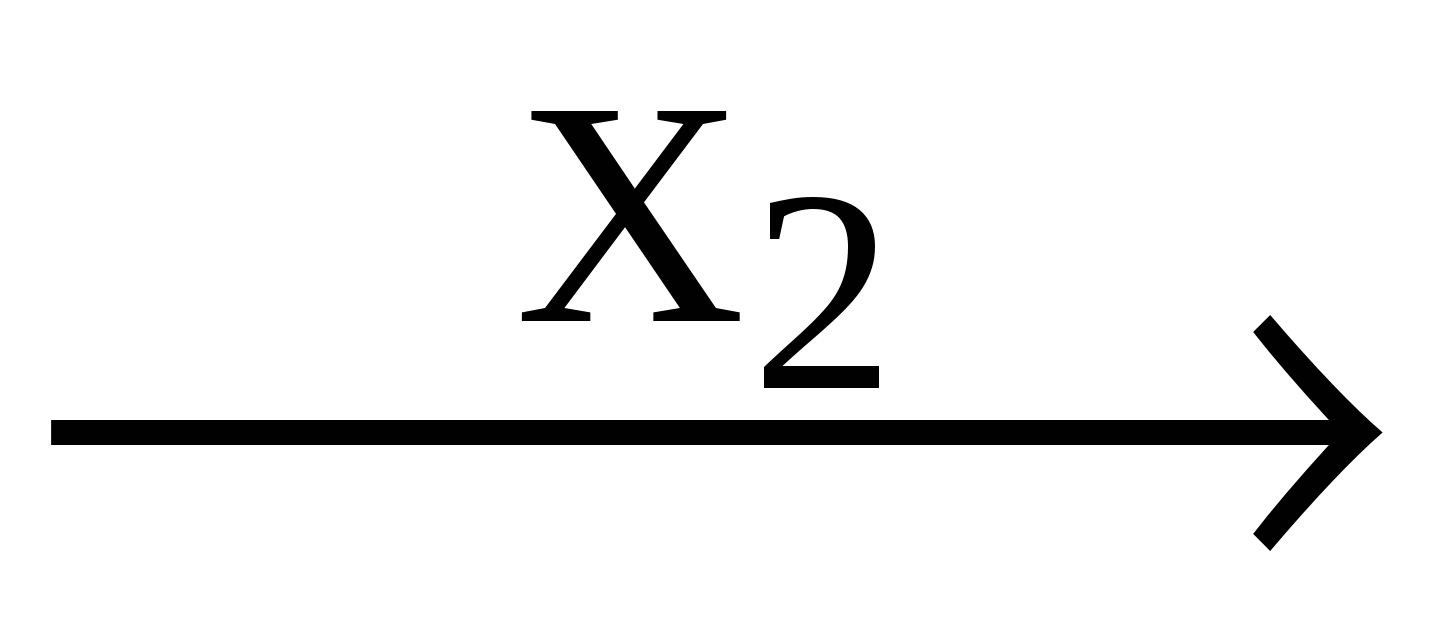 Al(OH)3
Al(OH)3
веществами «Х1» и «Х2» могут быть соответственно:
а) K2SO4 и KOH
б) NaCl и HCl
в) Na2SO4 и H2SO4
г) HNO3 и NaOH
26.Тип гибридизации атомов углерода в молекуле СН3 СН2 СН2 СН3
а) sp2 б) sp3 в) sp
27. Угол между осями атома углерода для sp3- гибридных орбиталей равен:
а) 109, 28 б)120 в) 180
28. В sp-гибридизации не участвуют орбитали второго энергетического
уровня атома углерода в количестве:
а) одного б) двух в) трех
29.К классу спиртов относятся вещества с функциональной группой…
а) СО б) -ОН в) СОНОН
30.Соединения с незамкнутой цепью атомов в молекуле, называются:
а) ациклическими
б) карбоциклическими
31. Все спирты имеют в названии суффикс…
а) -ен б) -ол в) -аль
32.Изомеры отличаются друг от друга…
а) количеством атомов
б) строением молекул и свойствами
33.Вещества СН3 СН2 СН3и СН3 СН2 СНСН3являются:
а) гомологами б) изомерами в) ни гомологами, ни изомерами.
34. Раствор перманганата калия не обесцвечивает вещество с формулой…
а) СН3 СН3 б) СН2 СН СН3
в) Н3С СН СН СН3 г) СН2 СН2
35.Реакция, уравнение которой СН3 СНСН2 + Н2СН3 СН2 СН3, относится
к реакциям:
а) замещения б) присоединения в) элиминирования.
36. Реакция, уравнение которой приведено выше, является реакцией…
а) гидрирования б) галогенирования в) полимеризации
37. Алкенам соответствует общая формула:
а) Сn Н2n б) Сn Н2n+2 в) Сn Н2n-2 г) Сn Н2n -6
38. Гомологами являются:
а) метан и хлорметан б) пропен и этен
в) этилен и бутан г) 2-метилбутан и бутан.
39. Изомеры отсутствуют у углеводородов:
а) бутена-1 б) пропана в) н-гептана г) 2-метилпентена-2
40. ¶- связь отсутствует в молекуле…
а) пропена б) 2-метилгексана в) 2-метилгексена-2 г) этилена.
41. Наиболее характерный тип реакции для алканов…
а) элиминирование б) изомеризация
в) присоединение г) замещение
42. Для алкенов характерна изомерия…
а) положения функциональной группы
б) углеродного скелета
в) положения двойной связи, геометрическая
43. Нефть по своему составу - это…
а) простое вещество
б) сложное вещество класса алкенов
в) смесь углеводородов, основу которой составляют алканы линейного и
разветвленного строения
г) смесь алкенов.
44.Перегонка нефти осуществляется с целью получения…
а) только метана и бензола
б) только бензина и метана
в) различных нефтепродуктов
г) только ароматических углеводородов.
45.Бутадиен содержит…
а) одну двойную связь
б) две двойные связи
в) одну тройную связь
г) две тройные связи.
46. Слабые кислотные свойства проявляют:
а) алкены б) алкины в) алкадиены г) арены.
47. Реакция присоединения водорода к непредельным углеводородам
называется:
а) гидрирование б) галогенирование
в) гидратация г) гидрогалогенирование.
48. Процесс получения резины из каучука называется:
а) полимеризация б) вулканизация
в) ректификация г) гидратация.
49.Вещество, формула которого СН3 СООН, относится к…
а) одноатомным спиртам б) фенолам
в) альдегидам г) многоатомным спиртам
50. Вещество, формула которого СН3 СН СН2 СН СН3, имеет название
||
ОН С2Н5
а) 2-этилпентанол-5 б) 4-этилпентанол-2
в) 3-метилгексанол-5 г) 4-метилгексанол-2
51. Образование фиолетового комплексного соединения с хлоридом железа(III)
является качественной реакций на…
а) фенол б) альдегид в) одноатомный спирт г) многоатомный спирт.
52. Благодаря реакции Кучерова можно получить:
а) этаналь б) этанол в) глицерин г) фенол.
53.К сложным эфирам относится вещество, формула которого:
а) СН3СООН
б) СН3СОН
в) СН3О СН3
г) СН3СООСН3
54. Жидкие жиры отличаются от твердых тем, что в их составе содержатся…
а) свободные гидроксильные группы
б) остатки ароматических карбоновых кислот
в) сложные эфиры высших карбоновых кислот и этиленгликоля
г) остатки непредельных карбоновых кислот.
55. Вещество, формула которого СН3СН3 ССН2 СОСН3 ОН имеет название:
а) 3-метилбутановая кислота б) 2,2-диметилбутановая кислота
в) 3,3-диметилбутановая кислота г) гексановая кислота
56. Сложные эфиры получают с помощью реакции:
а) гидратации б) этерификации в) полимеризации г) омыления.
57. Глюкоза по своим химическим свойствам является…
а) многоатомным спиртом б) альдегидом
в) альдегидоспиртом г) кислотой
58. Синее окрашивание раствором йода дает:
а) глюкоза б) крахмал в) целлюлоза г) сахароза
59. Неверно следующее из утверждений:
а) аминокислоты хорошо растворяются в воде;
б) аминокислоты получают в промышленности по реакции Зинина;
в) аминокислоты проявляют амфотерные свойства;
г) аминокислоты вступают в реакции этерификации.
60.Анилин, в отличие от фенола:
а) реагирует с бромом
б) плохо растворим в воде
в) реагирует с хлороводородной кислотой
г) горит.
Указание
В заданиях с 61 по 65 установите соответствие и заполните предложенную форму ответов
61. Установить соответствие между законом, теорией и их формулировкой:
1. Закон сохранения массы вещества а) Под воздействием электрического тока положительно заряженные ионы растворенного вещества движутся к катоду, отрицательно заряженные к аноду.
2. Закон Авогадро
б) Тела состоят из молекул и атомов, которые находятся в непрерывном движении, на которые действуют силы отталкивания и притяжения
3. Теория электролитической
диссоциации в) NA = 6,02.1023 частиц вещества. Равные объемы любых газов содержат равное число молекул.
4. Атомно-молекулярное учение г) Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции
1 - … 2 - … 3 - … 4 -…
62. Установите соответствие между величиной и ее формулой
1) = а) = m /
2) = б) = V / Vm
3) ω = в) = Аr ∙ n / Мr;
4) M = г) = m / V
1 -…. 2 - …. 3 - …. 4 - ….
63. Установите соответствие между веществом и его формулой
-
фенолы - а) CnH2n - 7OH
-
спирты - б) R1 - NH - R2
-
карбоновые кислоты- в) CnH2n+ 1NH2, R - NH2
-
сложные эфиры - г) CnH2n + 1COOHR-COOH
-
первичные амины - д) CnH2n+ 1OH, R - COH
-
вторичные амины - е) R1 - COOR2
7. третичные амины ж) R1 - N - R2
R3
1 -…. 2 - … 3 - … 4 - … 5- … 6- … 7- …
64. Установите соответствие между веществом и его электронно-графической
схемой:
1) Кr а) 1s22s22p63s23p64s23d103p65s24d105p4,
2) Те б) 1s22s22p63s23p64s23d103p65s24d105p66s24f145d4.
3) W в) 1s22s22p63s23p64s23d103p6,
1 -…. 2 - … 3 - …
65. Установите соответствие между химической реакцией и продуктом реакции:
1) СО2 + NН3 + Н2О а) 2NаНSО3.
2) SО2 + Na2SО3 + Н2О б) NН4НСО3.
3) SО3 + Н2О в) Н2SО4.
1 -…. 2 - … 3- …
Указание
В заданиях с 66 по 74 закончите начатую фразу
66. Если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, относятся между собой как небольшие целые числа - это закон …
67. Свойства веществ определяются их … и …
68.Тепловой эффект - количество теплоты, которое…
69. Химическое равновесие - состояние…
70. Гидролиз - процесс обменного взаимодействия соли с водой, сопровождающийся образованием …
71. Катализатор - ускоряющее реакцию вещество, не …
72. Окисление альдегидов аммиачным раствором оксида серебра-…
73. Общее название одноатомных спиртов - …
74. Реакция образования сложных эфиров в результате взаимодействия
спиртов с кислотами- …
Указание
В заданиях типа Б с 75 по 80 решите задачу и укажите правильный ответ
Задания типа Б
1. Рассчитайте массовые доли водорода и кислорода в пероксиде
водорода H2O2.
2. Реакция протекает по уравнению: ЗВа2+ + 2РО43- = Ва3(РO4)2↓
Напишите два разных уравнения в молекулярной форме,
соответствующих этой реакции.
3. Приведите примеры образования соли: а) из двух простых
веществ; б) из двух сложных веществ; в) из простого и
сложного вещества.
4. Составьте полные уравнения следующих реакций:
1) FеSО4 + КClO3 + Н2SО4 → ...
2) FеSО4 + КClO3 + КОН → ...
3) I2 + Ва(ОН)2 → ...
4) КВr + КВrО3 + Н2SО4 → ...
5. Напишите уравнения реакций, позволяющих осуществить
следующие превращения: NаСl → Nа → NаН → NаОН → NаНSО3.
6. Напишите структурные формулы 2.2-диметилпентана и
2.3-диметилпентана.
Показатели оценки результатов освоения дисциплины «Химия»
Оценивание знаний и умений студентов в рамках раздела дисциплины
Оценка «отлично»
91-100% правильных ответов
163 - 179
баллов
Оценка «хорошо»
76-90% правильных ответов
136 - 162 баллов
Оценка «удовлетворительно»
61-75% правильных ответов
109 - 135 баллов
Оценка «неудовлетворительно»
60% и менее правильных ответов
108 и менее баллов
Количество вариантов:
Тестовые задания состоят из 2 вариантов по 80 вопросов в каждом.
Время выполнения тестового задания:
- 160 мин
Оценки объявляются в день проведения.
Бланк ответа
(оценочный лист)
Студент _________________ группа _________ вариант___1
В вопросах с 1 по 60 укажите единственно верный ответ
вопрос
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
ответ
вопрос
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
ответ
вопрос
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
ответ
вопрос
53
54
55
56
57
58
59
60
ответ
В заданиях с 61 по 65 установите соответствие и заполните предложенную форму
вопрос
61
62
 63 64 65
63 64 65
ответ
1- 2-
3- 4-
1- 2-
3- 4-
1- 2- 3- 4- 5- 1- 2- 3- 1- 2- 3-
6- 7-
В заданиях с 66 по 74 закончите начатую фразу
вопрос
66
67
68
69
ответ


вопрос
70
71
72 73 74
ответ
В заданиях с 75 по 80 решите задачу и укажите правильный ответ
вопрос
75
ответ
вопрос
76
ответ
вопрос
77
ответ
вопрос
78
ответ
вопрос
79
ответ
вопрос
80
ответ
Итого по тесту
ОЦЕНКА
Студент ______________
(подпись)
Проверил ____________/
Бланк ответа
(оценочный лист)
Студент _________________ группа _________ вариант___2
В вопросах с 1 по 60 укажите единственно верный ответ
вопрос
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
ответ
вопрос
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
ответ
вопрос
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
ответ
вопрос
53
54
55
56
57
58
59
60
ответ
В заданиях с 61 по 65 установите соответствие и заполните предложенную форму
вопрос
61
62
 63 64 65
63 64 65
ответ
1- 2-
3- 4-
1- 2-
3- 4-
1- 2- 3- 4- 5- 1- 2- 3- 1- 2- 3-
6- 7-
В заданиях с 66 по 74 закончите начатую фразу
вопрос
66
67
68
69
ответ


вопрос
70
71
72 73 74
ответ
В заданиях с 75 по 80 решите задачу и укажите правильный ответ
вопрос
75
ответ
вопрос
76
ответ
вопрос
77
ответ
вопрос
78
ответ
вопрос
79
ответ
вопрос
80
ответ
Итого по тесту
ОЦЕНКА
Студент ______________
(подпись)
Проверил ____________/



 X1
X1