- Преподавателю
- Химия
- Рабочая тетрадь по химии
Рабочая тетрадь по химии
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Веретенникова О.М. |
| Дата | 26.02.2016 |
| Формат | docx |
| Изображения | Есть |
 ОБЛАСТНОЕ Государственное АВТОНОМНОЕ образовательное учреждение СРЕДНЕго профессионального образования
ОБЛАСТНОЕ Государственное АВТОНОМНОЕ образовательное учреждение СРЕДНЕго профессионального образования
«ВАЛУЙСКИЙ ИНДУСТРИАЛЬНЫЙ ТЕХНИКУМ»
РАБОЧАЯ ТЕТРАДЬ
по химии
для внеаудиторной самостоятельной работы студентов
23.02.03 Техническое обслуживание и ремонт автомобильного транспорта

Разработчик:
Веретенникова О.М. преподаватель
Валуйки, 2014
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Данная рабочая тетрадь разработана для студентов 1 курса (I, II семестр) специальности 23.02.03 Техническое обслуживание и ремонт автомобильного транспорта.
Целью рабочей тетради является закрепление знаний химической терминологии и приобретение навыков работы с различными источниками информации, в решении задач и упражнений по дисциплине «химия».
Рабочая тетрадь представляет собой сборник заданий для самостоятельной работы студента по основным разделам химии.
Для подготовки к занятиям рекомендуется изучить материал лекций и соответствующий материал учебника:
1. Габриелян О.С. Химия 10 класс. Базовый уровень: учеб. для общеобразоват. учреждений. - М.: Дрофа, 2013. - 191 с.: ил.
2. Габриелян О.С. Химия 11 класс. Базовый уровень: учеб. для общеобразоват. учреждений. - М.: Дрофа, 2013. - 223 с.: ил\
3. Дополнить интернет ресурсы:
Название сайта
Электронный адрес
Полезная информация по химии
alhimikov.net
Электронный учебник по органической химии
alhimikov.net/organikbook/titul.html
Химия: открытый колледж
chemistry.ru/
Органическая химия: Веб-учебник
-
chemistry.ssu.samara.ru/
Сайт о химии
xumuk.ru
Основы химии. Интернет учебник
hemi.nsu.ru
Химия - Российский общеобразовательный портал
school.edu.ru/
Раздел 1. Повторение
Тема 1 Повторение основных разделов по неорганической химии
Самостоятельная работа №1-2
Составление электронных и графических формул элементов, определение типов реакций, определение классов неорганических веществ.
Задание:
1. Зарисуйте схемы строения атома Nе и иона Мg2+; атома Аr и иона Са2+. Что общего в каждой паре частиц? В чем различие?



_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Приведенные формулы веществ распределите по классам, дать названия:
-
Оксиды
Основания
Кислоты
Соли
НNO3, CO2, KOH, P2O5, NaNO3, CaSO4, MgO, FeCl3, Cu(OH)2, SO2, HClO4, BaO, Fe2O3, LiOH, H2SiO3, Ca(OH)2, K3PO4, NaOH, Sr(OH)2.
3. Осуществите превращения, указать тип реакции:
а) FеС12 → Fе(ОН)2 → FеSО4 → Fе → FеО
│____________________↑
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Раздел 2. Органическая химия
Тема 2.1. Введение в предмет органической химии
Самостоятельная работа №3-4
Изготовление моделей молекул углеводородов и их галогенопроизводных.
Теория: На рисунке приведена шаростержневая модель молекулы метана. В ней детали, изображающие атомы, соединяются на некотором расстоянии друг от друга посредством стерженьков, символизирующих валентные связи. Такая модель дает наглядное представление о том, какие атомы, с какими соединены.
Задание: используя в качестве оборудования пластелин разных цветов и палочки соберите и зарисуйте модель молекулы хлорметана, этана, бромэтана, зная что, черный - C, белый - H, желтый - CI, красный - Br.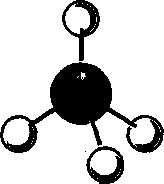
Выполнение работы:
Рис. метан
Рис. хлорметан Рис. этан Рис. бромэтан
Тема 2.2 Строение и классификация органических соединений
Самостоятельная работа №5-6
Составление формул изомеров органических веществ.
-
Напишите название вещества по его структурной формуле:
а)
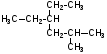 ………………………………………………………
………………………………………………………
б)
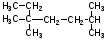 ………………………………………………………..
………………………………………………………..
-
Напишите все возможные изомеры алкана C6H14 и назовите их.
3. Напишите структурные формулы следующих соединений: 2,2,3-триметилгексан; 2,4-диметил-3-этиллгептан, 2-хлорпропан, тетрахлорметан.
Тема 2.3 Химические реакции в органической химии
Самостоятельная работа № 7-8
Решение упражнений и задач по теме.
1.Какой объем (V) воздуха потребуется для сжигания 8,4 кг пропена?
Решение:
……………………………………………………………………………..
…………………………………………………………………………….
…………………………………………………………………………….
…………………………………………………………………………….
…………………………………………………………………………….
…………………………………………………………………………….
…………………………………………………………………………….
…………………………………………………………………………….
…………………………………………………………………………….
…………………………………………………………………………….
…………………………………………………………………………….
…………………………………………………………………………….
2. Установите соответствие между схемой и типом реакции:
1. Окисления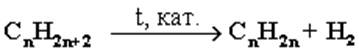
2. Дегидрирования
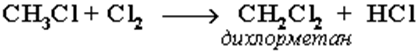
3. Замещения 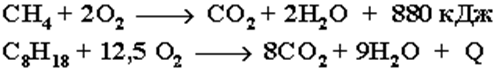
Тема 2.4 Углеводороды
Самостоятельная работа №9
Решение упражнений и задач по теме
1. Осуществите ряд превращений: CH4 → CН3СI → C2Н6 → C2Н5Вr.
А)…………………………………………………………………………...…………………………………………………………………………………..
Б)……………………………………………………………………….…….……………………………………………………………………………….
В)………………………………………………………………………………………………………………………………………………………………..
2. Составьте структурные формулы изомерных алканов, которые имеют состав С5Н12, и назовите их.
3. Какие из представленных соединений являются структурными изомерами, дайте названия веществам ?
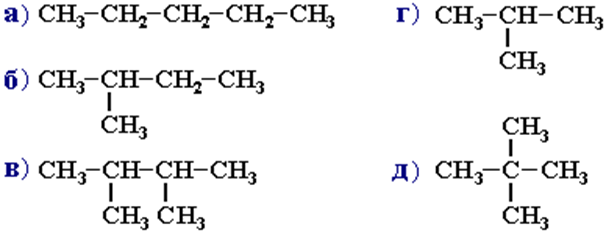
Самостоятельная работа №10
Подготовка докладов по одной из перечисленных тем.(по выбору)
1. Природные источники алканов
2. Вазелин. Вазелиновое масло, парафин
3. Природный газ.
4. Перегонка нефти.
5. Отдельные представители алканов: метан.
6. Отдельные представители: изооктан.
7. Каучуки.
8. Виды изомерии алкенов.
9. Отдельные представители: этилен.
10. Отдельные представители: пропилен.
11. Природные источники алкенов.
Самостоятельная работа №10
Разгадайте ключевое слово кроссворда. Ответы записывайте по вертикали.
-
Какое вещество является продуктом реакции полимеризации этена?
-
Для углеводородов ряда этилена характерны реакции полимеризации и _______________________.
-
Как по международной номенклатуре называется углеводород ряда этилена?
-
Назовите гомолог этилена, формула которого C4H8?
-
Как называется связь в молекуле углеводорода ряда этилена?
1
5
4
2
3
Э
Разгадайте ключевое слово кроссворда. Ответы записывайте по вертикали.
-
Атомы какого вещества, кроме водорода, входят в состав углеводородов?
-
Как называется предельный углеводород с 6-ю атомами углерода?
-
Как по-другому называются предельные углеводороды?
-
Как называется первый гомолог ряда алканов?
-
Назовите автора теории химического строения органических соединений. ?
-
Как называются молекулы алканов, отличающаяся друг от друга на группу СН2?
-
Назовите алкан, структурная формула которого С10Н22?
-
Атомы какого вещества, кроме углерода, входят в состав алканов?
-
Как называется радикал -С3Н7?
-
Назовите продукт монохлорирования метана?
-
Как называется связь в молекуле алканов?
-
5
6
8
10
3
4
9
11
1
2
7
Самостоятельная работа №12
Решение упражнений и задач по теме
1. Способы получения. Запишите уравнения реакций:
а) промышленного; б) лабораторного способов получения этилена.
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
2. Какие виды изомерии характерны для алкенов?
А) _________________________, Б) ________________________
.3. Для соединения формула которого:
СН= С - СН2 - СН2 - СН2 - СН3
составьте сокращенные структурные формулы:
а) двух изомеров (с разным типом изомерии):
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
б) двух гомологов ( с большим и меньшим числом атомов углерода):
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
4. Перед Вами ряд превращений. Составьте уравнения реакций, соответствующих данным превращениям:
Н3С-СН2ОН → СН2=СН2 → СН2Br-СН2Br→ С2Н2
А)………………………………………………………………………………………………………………………………………………………………..
Б)………………………………………………………………………………………………………………………………………………………………..
В)………………………………………………………………………………………………………………………………………………………………..
Самостоятельная работа №13
Решение упражнений и задач по теме: Арены
1. При нитровании 39 граммов бензола было получено 50 граммов нитробензола. Вычислите выход нитробензола в процентах от теоретически возможного выхода?
Решение:
…………………………………………………………………………………
…………………………………………………………………………………
…………………………………………………………………………………
…………………………………………………………………………………
…………………………………………………………………………………
…………………………………………………………………………………
…………………………………………………………………………………
…………………………………………………………………………………
…………………………………………………………………………………
…………………………………………………………………………………
…………………………………………………………………………………
…………………………………………………………………………………
2.. Перед Вами ряд превращений веществ. Составьте уравнения реакций. Укажите условия, при которых протекают реакции. Назовите все вещества.
СН4 →С2Н2 → С6Н6 → С6Н5Br
↓
С6Н12
а)
________________________________________________________
б)
_________________________________________________________
в)
_________________________________________________________
г)
_________________________________________________________
3. Напишите структурные формулы следующих веществ и дайте им другое название:
1,2-диметилбензол мета-ксилол 1,4-диметилбензол
……………………. ……………… ……………………..
Тема 2.5. Кислородосодержащие органические соединения
Самостоятельная работа №14
Решение упражнений и задач по теме: Спирты
1. Запишите определения
Функциональная группа ……………………………………………………………………………………
Предельные одноатомные спирты:
…………………………………………………………………………………………………………………………………………………………………………
Многоатомные спирты:
…………………………………………………………………………………………………………………………………………………………………………
2. Напишите структурные формулы всех изомерных спиртов состава C4H9OH. Назовите эти спирты.
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………. 3. Перечислите химические свойства спиртов, обусловленные гидроксильной группой Приведите примеры химических реакций.
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Самостоятельная работа №15
Подготовка докладов по одной из перечисленных тем.(по выбору)
1.Отдельные представители: этанол, метанол. Их свойства, применение.
2. Отдельные представители многоатомных спиртов: глицерин.
3. Непредельные спирты.
4. Ароматические спирты.
5. Фенол, его антисептические свойства.
6. Пикриновая кислота: применение
7. Отдельные представители двухатомных фенолов: пирокатехин.
8. Этиленгликоль, его применение.
9. Гидрохинон, его применение.
Самостоятельная работа №16
Составьте кроссворд не менее чем из 10 слов по теме: «Альдегиды»
Самостоятельная работа №17
Подготовка докладов по одной из перечисленных тем.(по выбору)
1. Уксусная кислота: свойства, получение, применение.
2.Муравьиная кислота: свойства, получение, применение.
3. Высшие жирные кислоты.
4. Акриловая кислота: свойства, получение, применение.
5. Олеиновая кислота: свойства, получение, применение.
Самостоятельная работа №18
Решите задачи:
-
При нагревании 200 мл 96% этанола (ρ=0,8 г/мл) и 200 г 90% уксусной кислоты с каталитическим количеством серной кислоты получили эфир с выходом 70% . Определите массу эфира.
Решение:
2. Сколько граммов гидрокарбоната натрия (питьевая сода) потребуется для нейтрализации 15 граммов уксусной кислоты?
Решение:
Самостоятельная работа №19
Решение упражнений и задач:
-
Продолжите определение: Аминами называют органические производные аммиака, в которых __________________________________________________________________
__________________________________________________________________________________________________________________________________________________________
-
Приведите примеры различных типов аминов и назовите их:
а) первичный амин………………………………. ………………………
б) вторичный амин……………………………………………………….
в) третичный амин………………………………………………………..
г) ароматические амины…………………………………………………
При сгорании первичного амина массой 62 грамма образовалось 88 граммов СО2 и 90 граммов Н2О. Найдите формулу амина.
Решение:
..........................................................................................................................................
..........................................................................................................................................
.......................................................................................................................................... .......................................................................................................................................... .......................................................................................................................................... .......................................................................................................................................... .......................................................................................................................................... .......................................................................................................................................... .......................................................................................................................................... .......................................................................................................................................... .......................................................................................................................................... .......................................................................................................................................... .......................................................................................................................................
Самостоятельная работа №20
Решение упражнений и задач:
1. Продолжите определения: Аминокислоты - это ________________________________
__________________________________________________________________________________________________________________________________________________________
2. В каких соединениях присутствует пептидная связь: а) глюкоза;
б) спирт; в) глицерин; г) крахмал; д) белок; е) дипептид? Ответ:______________
3. Напишите реакции аминоуксусной кислоты с NaOH, HCl, H2SO4
1)
2)
3)
Самостоятельная работа №21
Сбор печатных материалов о синтезе белков.
Подготовить сообщение о промышленном синтезе белков, значение и перспективы развития. Перечислить источники информации:
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Самостоятельная работа №22
Задание: Проанализируйте состав пищевых продуктов на содержание естественных растительных и животных белков, используя информацию о составе на упаковке.
Результаты оформите в таблицу:
№ п/п
Продукт
Белки в составе
Самостоятельная работа №23
Подготовка докладов по одной из перечисленных тем.(по выбору)
1. Витамины.
2.Ферменты.
3. Гормоны.
4. Лекарства
Самостоятельная работа №24
Решение упражнений и задач по теме.
1. Составьте схемы строения атомов элементов: углерода, фтора, магния, серы, кальция. Определите для атомов этих элементов число протонов и нейтронов.
2. Приведите в соответствие:
А. Электронная формула Элемент
1s22s22р63s2Cl
…3s23р63d104 s2 Мg
…3s23р6 Zn
…3s23р63d104 s24p2 Вr
…3s23р63d104 s24p5 Аr
Gе
Заполните таблицу:
-
Электронная формула
Элемент
3. Расположите элементы по возрастанию числа электронов на внешнем уровне: а) В, Н, Са, Аs; б) Мg, Р, Вr, Si; в) I, Вi, Ва, Li; г) С, Ве, Сl, Аl.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Самостоятельная работа №25
Подготовка докладов по одной из перечисленных тем.(по выбору)
1. Д.И. Менделеев- ученый с мировыми заслугами.
2. Открытие периодического закона
3. Периодическая система химических элементов Д.И. Менделеева
Самостоятельная работа №26
Решение упражнений и задач по теме.
1. Запишите определения:
Ковалентная связь - это _________________________________________________
Ионная связь - это _____________________________________________________
Металлическая связь - это_______________________________________________
Водородная связь - это__________________________________________________
2. Приведенные формулы веществ распределите по видам связи: NaCl, CS2, CH4, Cl2, BaI2, Fe, MgS, NH3, O2, Cu, SO2, P2O5, I2, CaO, HCl, NO.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. В приведенной таблице раскрасьте разным цветом клетки с формулами веществ с разным типом связи:
-
NН3
МgS
СuSО4
НNО3
Са(ОН)2
SО2
Р2О5
ВаСl2
Сl2
Н2SО4
О2
РН3
СО2
НI
N2
Приведите условные обозначения, которые вы использовали:
______________________________________________________________________
4. Из приведенного перечня выберите элементы, между атомами которых возможно образование: а) ионной связи; б) ковалентной связи:
О, К, F, С, В, Мg, Сl. Приведите примеры таких соединений.
Укажите тип связи в соединениях и механизм ее образования.
Самостоятельная работа №27 - 28
Подготовка докладов по одной из перечисленных тем.(по выбору)
1. Роль полимеров в моей будущей профессии
2.Роль полимеров в современном автомобилестроении
3. Пластмассы - современные конструкционные материалы
4. Термореактивные и термопластичные полимеры
5. Карбюраторная смесь-дисперсная система, состав и принцип работы.
Самостоятельная работа №29
Решение упражнений и задач по теме.
1. Закончите уравнения реакций. Напишите уравнения реакций в ионном виде.
СuSО4 + … = Сu(ОН)2 + ___________________________________
____________________________________________________________________________________________________________________________________________
LiОН + Н2SО4 = ________________________________________________
____________________________________________________________________________________________________________________________________________
А1(ОН)3 + … = Н2О + _________________________________________
____________________________________________________________________________________________________________________________________________
Н3РО4 + … = Са3(РО4)2 + _____________________________________
____________________________________________________________________________________________________________________________________________
Mg(OH)2 + HNO3 = _____________________________________________
____________________________________________________________________________________________________________________________________________
Na2SiO3 + … = NaCl + __________________________________________
____________________________________________________________________________________________________________________________________________
Fе2О3 + … = FеСl3 + ___________________________________________
____________________________________________________________________________________________________________________________________________
2. Составьте схемы классификации химических реакций в органической и неорганической химии. Приведите примеры реакций.
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Самостоятельная работа №30
Решение упражнений и задач по теме
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции. Определите окислитель и восстановитель.
C + CuO = Cu + CO2
____________________________________________________________________________________________________________________________________________
Al + K2Cr2O7 + H2SO4 = Al2(SO4)3 + Cr2 (SO4) 3 + K2SO4 + H2O
__________________________________________________________________________________________________________________________________________________________________________________________________________________
H3AsO3 + KMnO4 + H2SO4 = H3AsO4 + MnSO4 + K2SO4 + H2O
____________________________________________________________________________________________________________________________________________
Самостоятельная работа №31
Решение упражнений и задач по теме
Закончите уравнения реакций. Напишите уравнения реакций в ионном виде
СuSО4 + … = Сu(ОН)2 + ___________________________________________
LiОН + Н2SО4 = ________________________________________________
А1(ОН)3 + … = Н2О + _________________________________________
Сr2О3 + НNО3 = ________________________________________________
Н3РО4 + … = Са3(РО4)2 + _____________________________________
Mg(OH)2 + HNO3 = _____________________________________________
Na2SiO3 + … = NaCl + __________________________________________
Fе2О3 + … = FеСl3 + ___________________________________________
Самостоятельная работа №32
Решение упражнений и задач по теме
-
Напишите уравнения реакций гидролиза следующих солей; указать тип среды
1.K2CO3
2. Na2SO4
3. AlCl3
Самостоятельная работа №33
Решение упражнений и задач по теме
1. Допишите уравнения реакций.
Na + O2 = Mg + HCl =
Ca + S = Ca + V2O5 =
Ba + H2O = Ba + H2 =
2. Получить металлы из их оксидов: дописать уравнения, расставить коэффициенты, указать окислитель и восстановитель.
CuO + AL→
Fe2O3 + AL→
Ag2O+ AL→
Самостоятельная работа №34
Решение упражнений и задач по теме
1. Какой объем (н.у.) газа образовалось в результате реакции 200 г 6,9% - ного раствора карбоната натрия с избытком соляной кислоты?
2. Осуществите цепочку превращений, составьте уравнения реакций.
Вариант 1. Сера - сернистый газ - оксид серы (6) - серная кислота - сульфат бария
Самостоятельная работа №35
Подготовка докладов по одной из перечисленных тем.(по выбору)
1.Коррозия металлов в автомобиле
2.Свинец в бензине и экология
3. 'Металлы и сплавы в химии и технике
4.Летучие водородные соединения неметаллов
5. Принцип работы аккумулятора
6. Неорганические кислоты в быту.
Самостоятельная работа №36
Решение упражнений и задач по теме
1.Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
NaClO + P = NaCl + P2O5
P + HNO3+ H2O = H3PO4 + NO
2.Напишите молекулярные и полные ионные уравнения реакций, соответствующие сокращенным.
CaO + 2H+ = Ca2+ + H2O
Сu 2++ 2OH- = Cu(OH)2
3. решить задачу
Какая масса гидроксида меди (II) может быть получена, если взять 200 г 40%-ного раствора гидроксида натрия и избыток хлорида бария?
Самостоятельная работа №37
Подготовка докладов по одной из перечисленных тем.(по выбору)
1.Химические источники тока
2. Смазочные масла и двигатель.
3.Химия вязкостных присадок.
4.Из чего сделан автомобиль.
5.Химия в системе охлаждения двигателя.
6. Тормозная жидкость автомобиля.
7.Полимеры в автомобиле.
Самостоятельная работа №38
Подготовка докладов по одной из перечисленных тем.(по выбору)
1. Минеральные удобрения, плюсы и минусы применения.
2.Макроэменты.
3. Микроэлементы растений.
4. Химические средства защиты растений.
Самостоятельная работа №39
Подготовка докладов по одной из перечисленных тем.(по выбору)
1. Парниковый эффект. Причины и последствия.
2. Озоновые дыры. Причины и возможные последствия.
3.Кислотные дожди.
4. Химия на страже здоровья человека.
5. Химия и загрязнения окружающей среды.
6.Экскурсия по домашней аптечке.
Самостоятельная работа №40
Подготовка докладов по одной из перечисленных тем.(по выбору)
1. Цемент, его значение в жизни человека.
2.Почему клей клеит.
3.Что такое накипь и как ее удалить.
4. Химия в стиральной машине.
5. Носители запаха.
6.Из истории моющих средств.
22


