- Преподавателю
- Химия
- Сборник задач по аналитической химии
Сборник задач по аналитической химии
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Владыкина А.С. |
| Дата | 11.01.2016 |
| Формат | docx |
| Изображения | Есть |
|
КОЛЛЕДЖ ИНДУСТРИИ ПИТАНИЯ, ТОРГОВЛИ И СФЕРЫ УСЛУГ |
|
|
634062, г. Томск, ул.И.Черных, 97, тел. 8(3822) 67-58-63, ИНН 7020015463, ОГРН 1027000888749, e-mail: [email protected], college.tomsk.ru
|
Составитель: Владыкина А.С. преподаватель химии ОГБПОУ КИПТСУ
.
Сборник задач для проведения практических работ по дисциплине «Химия»
( Аналитическая химия)
для студентов 2, 3 курса
Томск 2015 г.
Сборник задач составлен для студентов очной формы обучения специальностей 19.02.10 «Технология продукции общественного питания», 19.02.03 «Технология хлеба, кондитерских и макаронных изделий», 19.02.08 «Технология мяса и мясных продуктов», изучающих дисциплину «Химия» (Аналитическая химия). Содержит решение типовых задач по основным разделам аналитической химии. Каждой теме предшествует небольшое теоретическое введение, облегчающее понимание решения задач, приводятся основные расчетные формулы.
Введение
Целью проведения практических работ является закрепление теоретических знаний, формирование у студентов умений и навыков по соответствующим разделам дисциплины.
Прежде чем приступить к выполнению практической работы студент должен изучить теоретический материал, касающийся данной работы.
При решении каждой задачи надо ясно представлять себе сущность того метода анализа или определения, к которому относится данная задача, уметь написать уравнение и понимать значение каждой величины. Поэтому, прежде чем приступить к решению задач, следует ознакомиться с соответствующими разделами качественного и количественного анализа, получить теоретическую подготовку, ознакомиться со способами вычислений в титриметрических и гравиметрических методах анализа.
Сборник задач по аналитической химии предназначен для практических занятий и самостоятельной работы студентов специальностей 19.02.10 «Технология продукции общественного питания», 19.02.03 «Технология хлеба, кондитерских и макаронных изделий», 19.02.08 «Технология мяса и мясных продуктов». Он составлен в соответствии с программой дисциплины «Химия» ( Аналитическая химия). В начале сборника даются краткие теоретические сведения по каждой изучаемой теме, а также основные расчетные формулы, с помощью которых студенты могут в дальнейшем решать задачи, рассматриваются образцы решения задач, которые могут быть полезны при самостоятельной работе студентов. В конце каждой темы предлагаются задачи для самостоятельного решения.
В сборнике представлены задачи по следующим темам: вычисление рН в растворах, на вычисление ПР, вычисление эквивалента, фактора эквивалентности, закон эквивалентов, титриметрическим методам анализа, гравиметрическим методам анализа, , др.
Порядок оформления работ
В процессе выполнения практической работы студент должен записывать решения задач в тетрадь в соответствии с требованиями, т.е. условие оформляется через запись «Дано», все единицы приводятся в системе СИ. Перед тем как приступить к решению задачи студент должен записать уравнение химической реакции (если она есть) и формулу, которую он будет использовать для решения. Все расчеты необходимо проводить в тетради.
Значение символов и коэффициентов, входящих в формулу должны быть приведены непосредственно под формулой в той последовательности, в какой они приведены в формуле.
При решении можно ограничиться решением задачи только в общем виде, т.е. довести решение до общего выражения в виде конечной формулы, не подставляя при этом числовые значения. Однако при решении задач не следует механически применять готовые формулы, не уяснив их смысл.
После решения задачи обязательно записывается ответ.
Теоретические основы качественного анализа.
1. Чувствительность
Предел обнаружения Сmin (Спред) (г/мл) - минимальная или предельная концентрация; это наименьшая концентрация иона или вещества (далее - компонента) в растворе, при которой он может быть обнаружен с помощью данной аналитической реакции с заданной доверительной вероятностью.
Предел обнаружения m (мкг) - открываемый минимум; это наименьшая масса определяемого компонента, с заданной доверительной вероятностью обнаруживаемая данной аналитической реакцией в минимальном объеме предельно разбавленного раствора.
Предельное разбавление, Vпред (мл/г) - максимальный объем раствора, в котором обнаруживается 1 г компонента с помощью данной реакции.
Минимальный объем предельно разбавленного раствора, Vmin (мл) - наименьший объем анализируемого раствора, необходимый для обнаружения компонента в данной аналитической реакции.
Требуемые величины вычисляют по формулам:
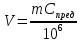 (1)
(1)
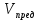 =
=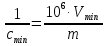 (2)
(2)
Cmin= 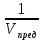 (3)
(3)
Пример 1. Предельное разбавление ионов Al3+ при обнаружении микрокристаллоскопической реакцией равно 150000 мл/г, Vmin исследуемого раствора составляет 0,06 мл. Вычислить открываемый минимум.
Р е ш е н и е . По формуле (2) находим:
m= 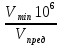 =
=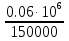 =0,4 мкг
=0,4 мкг
Задачи для самоконтроля
-
Открываемый минимум для реакции обнаружения Ti4+ с помощью хромотроповой кислоты равен 2,0 мкг при объеме 0,50 мл. Вычислить предельное разбавление и минимальную концентрацию. Ответ: 2,5105 мл/г; 4,010-6 г/мл.
-
Открываемый минимум при обнаружении ионов K+ с Na3[Co(NO2)6] равен 4 мкг, предельное разбавление раствора равно 50000 мл/г. Вычислить ми- нимальный объем раствора, необходимый для обнаружения K+ . Ответ: 0,05 мл.
-
Предельная концентрация CN- в реакции с AgNO3 1:50000 г/мл. Каков открываемый минимум, если реакция удается с каплей объемом 3,010-4 мл? Ответ: 0,006 мкг.
-
Реакция на ион SO4 2- с BaCl2 удается в 5,6·10-5 М растворе Fe2(SO4)3. Вычислить открываемый минимум, если минимальный объем равен 1,0 мл. Ответ: 16 мкг.
-
Открываемый минимум для реакции обнаружения ионов Ni2+ с помощью диметилглиоксима равен 0,003 мкг. ПДК никеля в воде 0,1 мг/л. Можно ли обнаружить ионы никеля в капле воды объемом 0,05 мл при содержании, равном ПДК? Ответ: можно, т.к. 6·10-8 г/мл < 0,1 мг/л.
-
В 1 л воды растворили 0,14 г Fe2(SO4)3·9Н2О: а) будет ли наблюдаться реакция на ион Fe3+ с реагентом К4[Fe(CN)6], если предельная концентрация ионов Fe3+ составляет 3·10-8 г/мл? б) можно ли с помощью такой реакции обнаружить железо в воде при его содержании на уровне 0,05 ПДК (ПДК составляет 0,3 мг/л)? Ответ: а) 3·10-8 г/мл < 3·10-5 г/мл (будет); б) нельзя: 3·10-8 г/мл > 0,3·0,05 мг/л; необходимо концентрирование более чем в 2 раза.
-
Реакция ионов серебра с иодидом калия удается при разбавлении 75000 мл/г. Открываемый минимум равен 0,13 мкг. Каков минимальный объем исследуемого раствора?
-
Открываемый минимум ионов Zn2+ в виде соли Zn[Hg(CNS)4] равен 0,1 мкг. Минимальный объем исследуемого раствора - 0,005 мл. Найти предельное разбавление.
-
Минимальный объем раствора, необходимый для открытия NH4+реактивом Несслера, равен 5 см3. Вычислить открываемый минимум, если предельное разбавление ионов NH4+ в растворе составляет 20 000 000 мл/г.
-
Реакция на SO42- c хлоридом кальция удается при наличии 0,21 мкг определяемого иона в объеме 0,02 мл. При каком разбавлении возможна эта реакция?
-
Вычислить минимальный объем соли Cu2+ в виде соли Cu[Fe(CN)6], если открываемый минимум равен 0,02 мкг, а предельное разбавление раствора - 2 500 000 мл/г.
-
Капельная реакция на никель с диметилглиоксимом позволяет обнаружить 0,0625 мкг никеля в капле, объемом 0,05 мл. Вычислить предельное разбавление.
-
Ион PO43- определяется из 0,005 М раствора фосфата натрия действием ацетата свинца в объеме 0,003 мл. Рассчитать открываемыйминимум иона PO43-.
-
В дм3 воды содержится 0,5 г Cu2+. Открываемый минимум иона Cu2+ с гидроксидом аммония - 0,2 мкг. Рассчитать минимальный объем раствора, содержащего открываемый минимум определяемого иона.
-
Открываемый минимум ионов Pb2+ c KI в уксуснокислой среде -0,07 мкг в объеме 0,05 мл. Вычислить предельную концентрацию и предельное разбавление исследуемого раствора.
-
Ион Ag+ с хроматом калия определяется из объема 0,001 мл 0,02 М раствора нитрата серебра. Найти предельное разбавление и открываемый минимум исследуемого раствора.
-
Открываемый минимум реакции иона калия с кобальтинитритом натрия составляет 0,12 мкг. Предельная концентрация раствора равна 1 : 8 000 г/мл. Вычислить минимальный объем.
-
Чему равен открываемый минимум реакции обнаружения иона кальция в виде оксалата, если она удается с 0,001 мл 0,001 М раствора хлорида кальция?
-
Вычислить Vmin для реакции иона CrO4 2- c карбазидом, если открываемый минимум этой реакции - 0,25 мкг, а предельная концентрация - 1/2 · 10-5 г/мл.
-
Предельная концентрация она CNS- в реакции с нитроном составляет 1: 1000 г/мл, минимальный объем - 0,001 мл. Найти открываемый минимум.
2. Закон действующих масс (ЗДМ)
Константа химического равновесия равна отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ, причем значение каждой концентрации вводится в степень, равную стехиометрическому коэффициенту перед формулой вещества в химическом уравнении.
Если в уравнении реакции имеются стехиометрические коэффициенты, например, m, n, p,d:
mА + nВ  pС + dD, (4)
pС + dD, (4)
то выражение для константы равновесия принимает вид
Кр = 
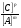
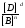 (5)
(5)
Пример 1. Равновесные концентрации водорода, иода и иодоводорода в реакции Н2 + I2 →2H I при некоторой температуре составляют по 0,03 моль/л, 0,03 моль/ли 0,04 моль/л соответственно. Вычислить константу этой реакции.
Решение:
Согласно ЗДМ Креакции = 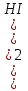 =
= 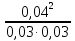 =1,77
=1,77
Ответ: Константа этой реакции Кр= 1,77
Если по условию задачи известна равновесная концентрация только одного продукта из нескольких, то перед расчетом KС необходимо вычислить незаданные равновесные концентрации продуктов по выражению
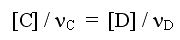 (6)
(6)
Пример 2. При некоторой температуре в системе
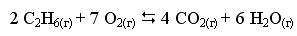
равновесные концентрации С2Н6, О2 и СО2 составили соответственно 0,22, 1,34 и 0,57 моль/л. Рассчитать KС реакции.
Решение
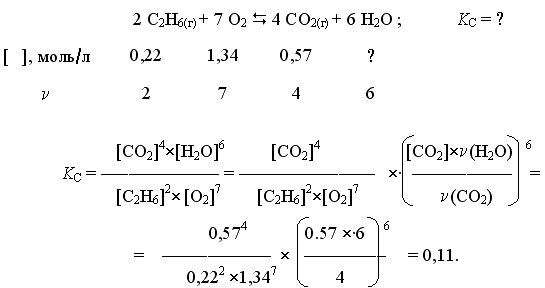
Ответ. Для данной реакции KС = 0,11.
Если в реакции участвуют жидкие и твердые вещества, то считается, что они полностью нелетучи и потому не имеют никакой концентрации в газовой фазе.
При протекании реакции в прямом направлении до состояния равновесия происходит уменьшение концентраций газообразных реагентов и увеличение концентраций газообразных продуктов, определяемые по закону сохранения выражениями:
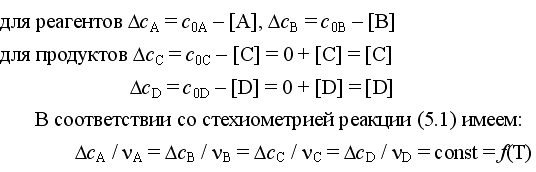 (7)
(7)
В соответсвии со стехиометрией реакции (4) имеем: 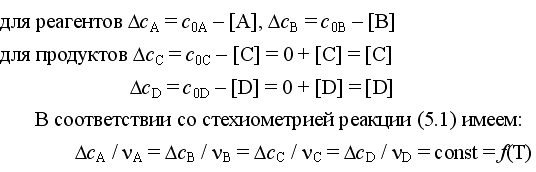 (8)
(8)
Эти выражения позволяют рассчитать равновесные концентрации веществ по начальным концентрациям реагентов при известном значении KС (и наоборот).
1. Напишите математические выражения константы равновесия реакций:
-
А(г) + 2В(Г)
 АВ2(Г)
АВ2(Г) -
2NO2(г)
 2NO(Г) + О2 (Г)
2NO(Г) + О2 (Г) -
2Н2 (Г) + О2 (Г)
 2Н2О(Г)
2Н2О(Г) -
2СО(Г)
 СО2 (Г) + С(ТВ)
СО2 (Г) + С(ТВ) -
2SO2(Г) + О2 (Г)
 2SO3(Г)
2SO3(Г) -
Н2(Г) + S(ТВ)
 Н2S(Г)
Н2S(Г) -
СО2 (Г) + С(ТВ)
 2СО(Г)
2СО(Г) -
2НСI(ТВ)
 Н2 (Г) + СI2 (Г)
Н2 (Г) + СI2 (Г) -
N2 (Г) + О2 (Г)
 2NО(Г)
2NО(Г) -
FеО(ТВ) + СО(Г)
 Fе(ТВ) + СО2(Г)
Fе(ТВ) + СО2(Г) -
N2 (Г) + 3Н2 (Г)
 2NН3 (Г)
2NН3 (Г) -
С2Н2 (Г) + 3Н2 (Г)
 2СН4 (Г)
2СН4 (Г) -
N2(г) + 3H2(г)
 2NH3(г)
2NH3(г) -
2НСI(ТВ)
 Н2 (Г) + СI2 (Г)
Н2 (Г) + СI2 (Г) -
N2(г) + O2(г)
 2NO(г)
2NO(г) -
2SO2(Г) + О2 (Г)
 2SO3(Г)
2SO3(Г) -
2Н2О(г)
 2Н2(г) + О2(г)
2Н2(г) + О2(г) -
2NH3(г)
 N2(г) + 3H2(г)
N2(г) + 3H2(г) -
Н2(г) + I2(г)
 2HI(г)
2HI(г) -
2СО(Г)
 СО2 (Г) + С(ТВ)
СО2 (Г) + С(ТВ) -
СаСО3(ТВ)
 СаО(ТВ) + СО2(г)
СаО(ТВ) + СО2(г) -
2НF(г)
 Н2(г) +F2(г)
Н2(г) +F2(г) -
3Fe(ТВ) + 4H2O(г)
 Fe3O4(ТВ) + H2(г)
Fe3O4(ТВ) + H2(г)
2. При некоторой температуре в системе
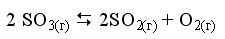
равновесные концентрации веществ равны соответственно 0,04, 0,12 и 0,06 моль/л. Рассчитать Kр реакции.
3. Вычислить константу равновесия для обратимой реакции
2NO2 + O2  2NO2,
2NO2,
если при состоянии равновесия 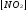 = 0,056моль/л;
= 0,056моль/л; 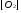 = 0,028моль/л;
= 0,028моль/л; 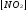 = 0,044моль/л.
= 0,044моль/л.
4. При некоторой температуре в системе
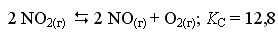
равновесная концентрация О2 составила 0,2 моль/л. Определите начальную концентрацию реагента.
5. При Т = const рассчитайте равновесные концентрации газообразных веществ в системе
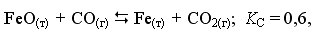
если начальная концентрация СО составляла 0,16 моль/л.
6. При синтезе аммиака равновесие установилось при следующих концентрациях реагирующих веществ: [N2] = 2,5 моль/л; [Н2] = 1,8 моль/л; [NH3] = 3,6 моль/л. Рассчитайте константу равновесия этой реакции и исходные концентрации азота и водорода.
7. Константа равновесия гомогенной системы СО(г) + H2О(г) = СО2(г) + Н2(г) при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации Cисх (СО)= 0,10 моль/л;Cисх (H2О) = 0,40 моль/л.
8. В гомогенной газовой системе CО + Н2О(r) ⇆ CО2+H2 равновесие установилось при следующих концентрациях реагирующих веществ: [CO]=4 моль/л, [H2O]=6 моль/л, [CO2]=2 моль/л, [H2]=2 моль/л. Вычислите константу равновесия и исходные концентрации H2О и CO.
9. Константа равновесия реакции СОСl2(г) ⇆ СО(г)+С12(г) равна 0,02. Исходная концентрация СОCl2 составила 1,3 моль/л. Рассчитайте равновесную концентрацию Сl2.Какую исходную концентрацию СОCl2 следует взять, чтобы увеличить выход хлора в 3 раза?
10. Равновесие реакции Н2 + Вr2 ⇄ 2НВr установилось при некоторой температуре при следующих равновесных концентрациях: [Н2 ]= 0,5 моль/л; [Вr2] = 0,1 моль/л; [НВr] = 1,6 моль/л. Найдите Кс. Определите исходные концентрации водорода и брома.
11. При некоторой температуре константа равновесия реакции N2O4 (г) ⇄2NO2 (г) равна Кс =0,05 (моль/л)-¹. Рассчитайте равновестный состав смеси, приняв, что исходная смесь содержала 1,2 моль/л N2O4 и 0,2 моль/л NO2.
12. Для реакционной системы Fe3O4(т)+H2⇄3FeO(т)+H2O начальные концентрации равны: C(H2)=0,8 моль/л, C(H2O)=0,04 моль/л. Определите равновесные концентрации веществ, если константа равновесия равна 1,03.
13. Константа равновесия гомогенной системы СО(г) + H2О(г) = СО2(г) + Н2(г) при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации C(СО)исх= 0,10 моль/л; C(H2О)исх = 0,40 моль/л. Ответ: [CO2] = [H2] = 0,08 моль/л; [CO] = 0,02 моль/л; [H2O] = 0,32 моль/л.
14. При нагревании водорода и хлора в закрытом сосуде обратимо протекает реакция по уравнению: H2+Cl2⇆2HCl. Равновесная смесь при этих условиях содержит 3,2 моль HCl, 0,06 моль Cl2 и 3,2 моль H2. Bычислить константу равновесия указанной реакции и исходные концентрации водорода и хлора.
15. Равновесие в системе 2HI(г) ⇆ H2(г) +I2(г) наступило при концентрациях [HI]=0,15 моль/л и [H2]=[I2]=0,24 моль/л. Найти константу равновесия и начальную концентрацию HI.
3. Основные положения теории электролитической диссоциации. Водородный показатель.
Вещества по способности проводить электрический ток в расплавленном и растворенном состоянии делятся на:
Электролиты - вещества, способные проводить электрический ток (соли, кислоты, основания).
Неэлектролиты - вещества, не способные проводить электрический ток (органические соединения, сахар, глюкоза).
Электропроводность электролитов объясняется тем, что их молекулы в растворах и расплавах распадаются на ионы (положительно и отрицательно заряженные).
Молекулы неэлектролитов на ионы не распадаются, поэтому их растворы не проводят электрический ток.
Электролиты обладают различной способностью к диссоциации, поэтому различают сильные и слабые электролиты.
Сильные электролиты в водных растворах диссоциируют полностью.
В растворе слабого электролита идут одновременно два процесса:
- диссоциация (распад молекул на ионы);
- ассоциация (соединение ионов в молекулы).
К сильным электролитам относятся почти все соли; многие минеральные кислоты, например H2SO4, HNO3, НСl, НВr, HI, НМnО4, НСlО4; гидроксиды щелочных и щелочноземельных металлов (щелочи).
Слабые электролиты при растворении в воде лишь частично диссоциируют на ионы. В отличие от сильных электролитов их диссоциация протекает обратимо с установлением равновесия:
КА↔К++А-
К слабым электролитам относятся органические кислоты, многие минеральные кислоты, например HCN, Н2СО3, H2SO3, H2S, HNO2, H2Si03, все гидроксиды, за исключением щелочей, амфотерные гидроксиды, например, Zn(OH)2, A1(OH)3, Sn(OH)2, Be(OH)2.
Сущность теории электролитической диссоциации по Аррениусу:
-
При растворении в воде электролиты диссоциируют на положительно и отрицательно заряженные частицы (ионы).
-
При прохождении электролитического тока через раствор или расплав электролита положительно заряженные ионы (катионы) движутся к катоду, отрицательно заряженные ионы (анионы) - к аноду. У электродов ионы разряжаются и превращаются в атомы или молекулы.
-
Степень распада зависит от природы электролита, его концентрации, температуры, от характера растворителя.
-
Процесс электролитической диссоциации обратим.
Диссоциация кислот, оснований и солей
Диссоциация кислот. Согласно теории электролитической диссоциации кислотами называют вещества, которые в водных растворах образуют в качестве катионов ионы водорода Н+.Одноосновная кислота диссоциирует на ионы в одну ступень. Например:
HCl→H+ + Cl-
Двухосновные кислоты распадаются на ионы в две ступени:
H2SO4→ H+ +HSO4-
HSO4-→ H+ +SO42-
Первая ступень диссоциации, как правило, осуществляется в большей степени, чем вторая. Из уравнений диссоциации видно, что в растворе серной кислоты имеются три вида ионов: Н+, HSO4- и SO42-
Трехосновные кислоты диссоциируют по трем ступеням: по первой ступени в большей степени, чем по второй, а по второй - в большей, чем по третьей. Например, диссоциация фосфорной кислоты протекает по схемам:
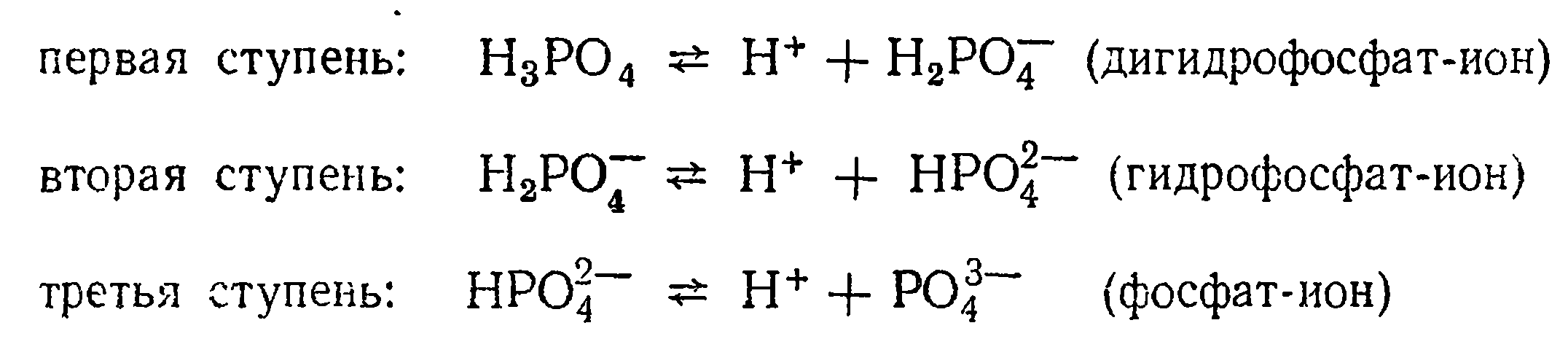
Водный раствор фосфорной кислоты содержит ионы водорода Н+, дигидрофосфата Н2РО4-, гидрофосфата НРО4-| и фосфата РО43-, причем ионов Н2РО4- больше, чем НРО4-|, а последних больше, чем РО43- .Количество ионов РО43- ничтожно мало.
Диссоциация оснований. По теории электролитической диссоциации основаниями называют вещества, которые в водных растворах в качестве анионов содержат только ионы гидроксила ОН-.
Диссоциацию оснований можно выразить, например, следующими уравнениями:
NaOH→Na+ + OH-
Ba(OH)2 → Ba2+ +2OH-
Вещества, которые диссоциируют и как кислоты и как основания, называются амфотерными соединениями или амфолитами. К ним относятся гидроксиды некоторых металлов. Например, 
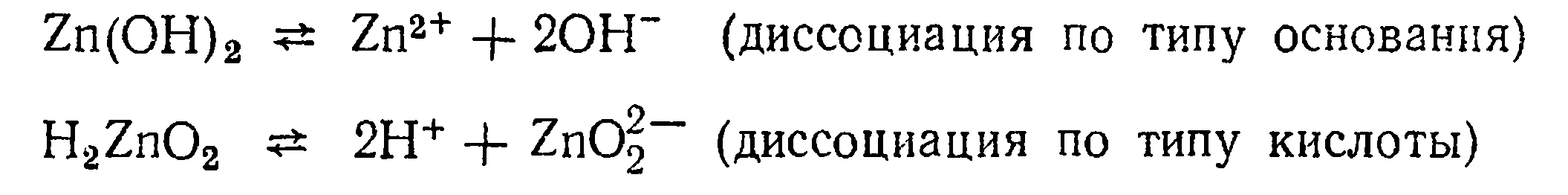
Следовательно, в растворе амфотерного соединения содержатся ионы металла, гидроксид-ионы, ионы водорода и кислотного остатка.
Вода диссоциирует по уравнению
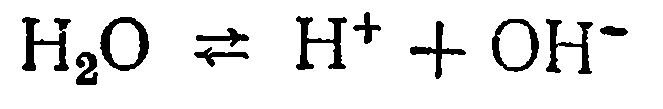
Следовательно, вода также проявляет свойства кислоты, образуя ионы Н+, и свойства основания, образуя ионы ОН-.
Диссоциация солей. Диссоциация нормальной соли. Нормальная соль диссоциирует на ион металла и ион кислотного остатка:
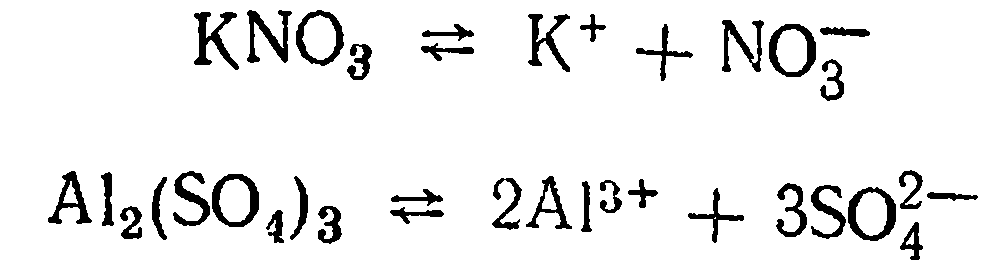
Диссоциация кислой соли. В данном случае диссоциация протекает по нескольким ступеням. Например, KHSO4 диссоциирует по двум ступеням:
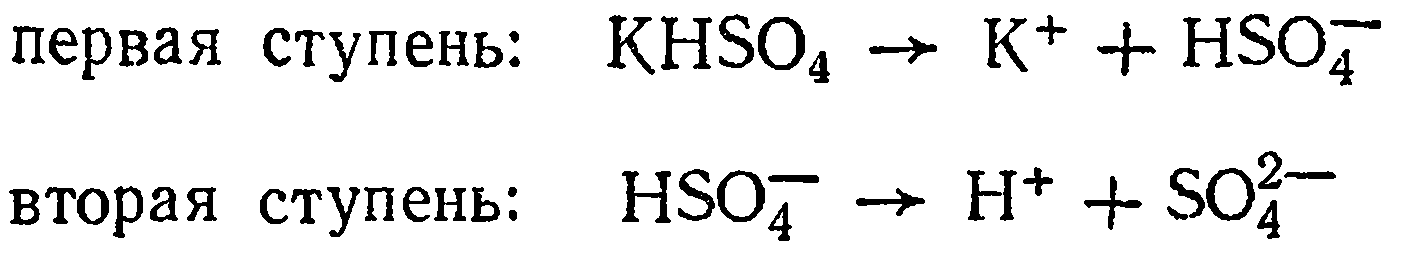
Как видно, раствор кислой соли содержит катионы водорода (как результат диссоциации по второй ступени) и металла (в отличие от кислоты, содержащей только ионы водорода).
Диссоциация основной соли. Основные соли - это соли, молекулы которых кроме ионов металла и кислотного остатка содержат ионы гидроксогруппы. Например, хлорид гидроксомагния MgOHCl.
Диссоциация этой соли протекает согласно уравнению
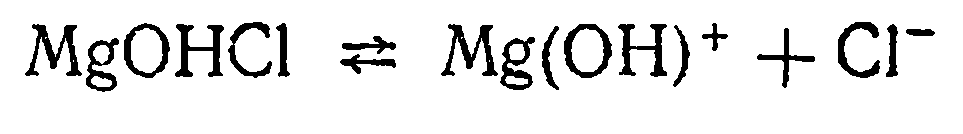
Основные соли алюминия: сульфат гидроксоалюминия AIOHSO4 и сульфат дигидроксоалюминия [A1(OH)2]2SO4, диссоциируют, как показано ниже:
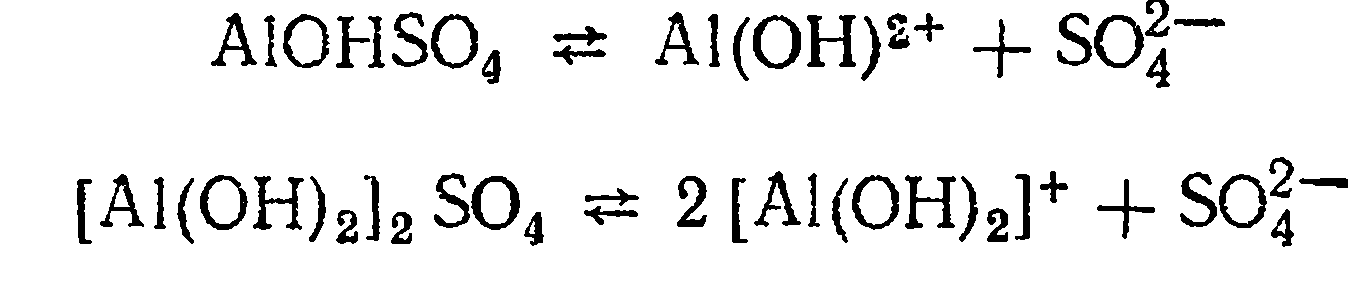
Степень диссоциации.
Количественно процесс диссоциации может быть охарактеризован рядом величин и, в частности, степенью электролитической диссоциации. Степень диссоциации α представляет собой отношение числа распавшихся на ионы молекул п к общему числу растворенных молекул N:
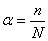 (9)
(9)
Степень диссоциации электролита определяется экспериментально и выражается в долях единицы или процентах. Если α=0, то диссоциация отсутствует, а если α=1 или 100%, то электролит диссоциирован полностью. Если же, например, α=20%, то это означает, что из каждых 100 растворенных молекул 20 диссоциированы на ионы.
Константа диссоциации
Диссоциация электролита - процесс обратимый. В растворе между концентрацией недиссоциированных молекул и концентрацией ионов существует определенная зависимость. Например, в растворе уксусной кислоты, диссоциирующей согласно уравнению
СН3СООН Н+ + СН3СОО-
Н+ + СН3СОО-
находятся недиссоциированные молекулы СНзСООН, ионы Н+ и СН3СОО-. Обозначив равновесные концентрации ионов водорода и ацетат-ионов через [Н+] и [СН3СОО~], равновесную концентрацию недиссоциированных молекул в моль/л через [СНзСООН] и применив закон действия масс к процессу диссоциации, получим следующее выражение константы равновесия, которая называется константой диссоциации:
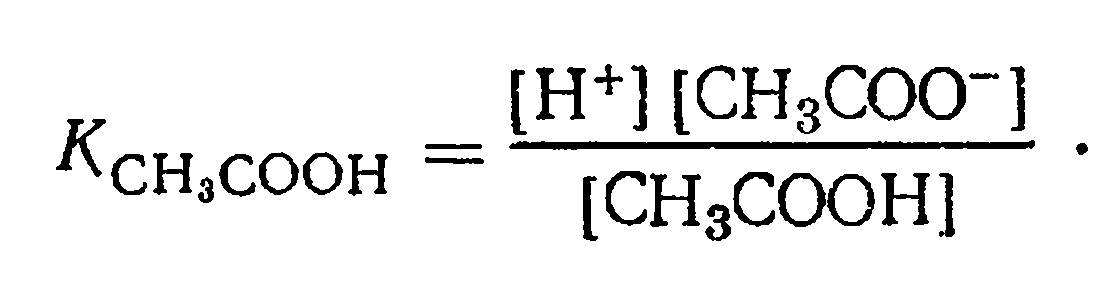 (10)
(10)
Константа диссоциации данного электролита равна отношению произведения концентрации ионов в растворе к концентрации недиссоциированных молекул этого электролита. Если в растворе СН3СООН изменить концентрацию ионов Н+ или СНзСОО-, соответственно изменится и концентрация недиссоциированных молекул СНзСООН, то отношение 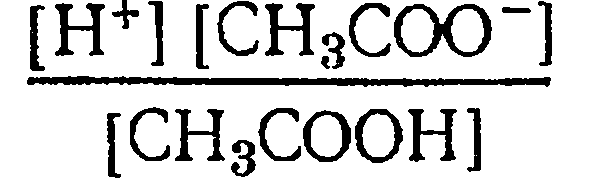 при данной температуре останется неизменным.
при данной температуре останется неизменным.
При данной температуре для одного и того же электролита константа диссоциации остается постоянной. Это пpавило применимо только к разбавленным растворам слабых электролитов.
Константу диссоциации можно рассчитать зная степень диссоциации слабого электролита:
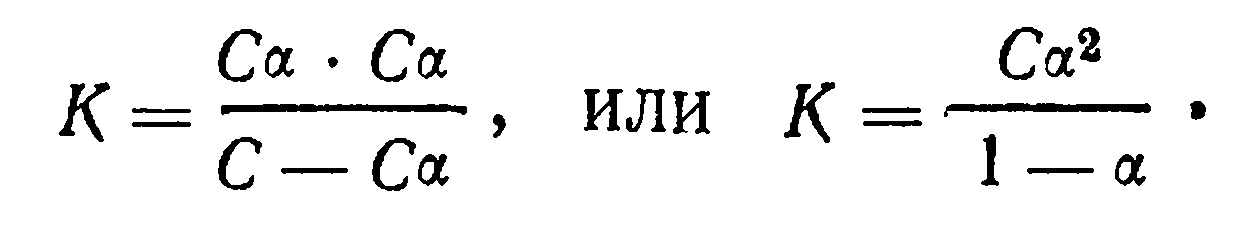 (11)
(11)
Уравнение (11) выражает закон разбавления. Он устанавливает зависимость между степенью диссоциации и концентрацией слабого электролита. С увеличением концентрации слабого электролита степень диссоциации его уменьшается, с уменьшением концентрации степень диссоциации возрастает. Для весьма слабых электролитов, степень диссоциации которых очень мала, знаменатель в уравнении (11) может быть принят равным единице. Тогда
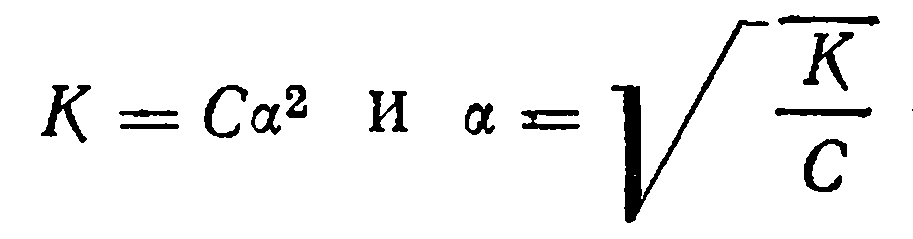 (12)
(12)
Водородный показатель рН
Чистая вода очень плохо, но проводит электрический ток, что объясняется небольшой диссоциации воды на ионы Н+ и ОН- : Н2О  Н+ + ОН-. Концентрация ионов водорода равна концентрации ионов гидроксида: [H+] = [OH-]. По закону действующих масс константа диссоциации воды
Н+ + ОН-. Концентрация ионов водорода равна концентрации ионов гидроксида: [H+] = [OH-]. По закону действующих масс константа диссоциации воды
К = 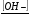 (13)
(13)
или К[H2O] = [H+] [OH-] (14)
где К - константа электролитической диссоциации;
при 240С она равна 1,8 . 10-16. Произведение К[H2O] при данной температуре постоянно и равно 1. 10-14.
она равна 1,8 . 10-16. Произведение К[H2O] при данной температуре постоянно и равно 1. 10-14.
К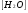 обозначают через Кн2о.
обозначают через Кн2о.
Кн2о = [H+] [OH-] - это произведение называется ионным произведением воды.
Или [H+] [OH-]=10-14 (15)
Обычно реакцию среды выражают через водородный показатель рН. Водородный показатель - это отрицательный десятичный логарифм концентрации ионов водорода:
рН = - lg[H+]. (16)
Тогда уравнение (15) запишется как
рН +рОН = 14 (17)
При рН = 7 среда нейтральная,
при рН < 7 среда кислая,
при рН > 7 среда щелочная.
Расчет рН растворов электролитов проводится по следующим (упрощенным) формулам:
сильных одноосновных кислот:
pH = - lgCкислоты (18)
слабых кислот
pH = 1/2pKкислоты - 1/2 lgCкислоты (19)
сильных однокислотных оснований
pH = 14 + lgCоснования (20)
слабых оснований
pH = 14 - 1/2pKоснования + 1/2 lgCоснования (21)
солей слабых кислот
pH = 7 + 1/2pKкислоты + 1/2 lgCсоли (22)
солей слабых оснований
pH = 7 - 1/2pKоснования - 1/2 lgCсоли (23)
Буферные растворы
Растворы слабых кислот или оснований в присутствии их солей проявляют буферное действие. Для буферного раствора, содержащего слабую кислоту и ее соль
рН = рКкислоты + lg Cсоли - lg Cкислоты
pH = pKкислоты- lg(Cкислоты / Cсоли) (24)
а для смеси из слабого основания и его соли
рН = 14 - рКоснования + lg Соснования - lg Cсоли
pH = 14 - pKоснования + lg(Cоснования /Cсоли) (25)
Пример 1. Вычислить степень диссоциации и концентрацию ионов ОН- и NH4+ в 0,001 М растворе NH4OH (при 25°С). Константа диссоциации NH4OH при указанной температуре равна 1,79∙10-5
Решение. Степень диссоциации вычисляем по формуле
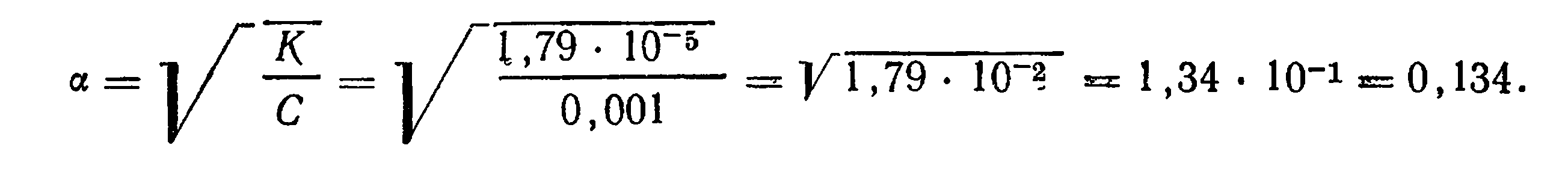
Степень диссоциации равна 0,134, или 13,4%. Концентрация ионов ОН- равняется концентрации ионов NH4+ и вычисляется по формуле
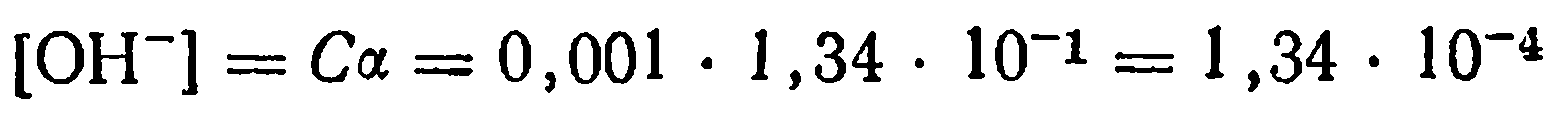
Ответ: α =0,134 ; [ОН-]=[ NH4+]=1,34∙10-4 моль/л.
Пример 2. Принимая, что серная кислота диссоциирует в растворе на ионы полностью, определите pH ее 0,05 М раствора.
Решение: Если принять, что H2SO4 сильная кислота, то
H2SO4 → 2H+ + SO42-
По уравнению диссоциации из 1 моль H2SO4 образуется 2 моль [H+]
а из 0,05 моль H2SO4 образуется Х моль [H+]
[H+] = 2∙0,05/1 =1
pH = -lg[H+] = -lg(0,1) = 1.
Пример 3. К 15 мл 0,03 М раствора муравьиной кислоты добавили 12 мл 0,15 М формиата калия. Вычислить рН раствора (КHCOOH = 1,8 · 10-4;рКHCOOH = 3,75).
Решение. Найдем концентрацию кислоты и ее соли после смешивания растворов.
Vобщ. = 12 + 15 = 27 мл;
Ссоли = 12 · 0,15 / 27 = 0,066 M;
Cкислоты = 15 · 0,03 / 27 = 0,017 M;
pH = 3,75 + lg 0,066 / 0,017 = 4,35.
Задачи для самоконтроля:
-
Вычислить рН 0,001М растворов HС1 и КОН.
-
Рассчитайте рН 0,005 моль/л раствора серной кислоты.
-
Рассчитайте рН 0,1 моль/л раствора гидроксида натрия
-
Вычислить молярную концентрацию раствора Ba(OH)2, если рН раствора составляет 12 при 298 К.
-
Рассчитайте рН, если к 2 л воды прибавили 1 мл азотной кислоты (ρ = 1,4 г/мл).
-
Рассчитайте рН, если к 1,5 л воды прибавили 0,5 мл соляной кислоты (ρ = 1,12 г/мл).
-
Рассчитайте рН, если к 500 мл воды прибавили 0,05 мл 0,1 %-ного раствора гидроксида калия.
-
Рассчитайте рН, если к 250 мл воды прибавили 0,05 мл раствора серной кислоты (ρ = 1,78 г/мл).
-
Рассчитайте рН, если к 1 л воды прибавили 0,5 мл гидроксида калия с концентрацией 0,15 %.
-
Рассчитайте рН 5% раствора серной кислоты (ρ = 1,035 г/мл).
-
Рассчитайте рН раствора гидроксида натрия, если 4 г щелочи растворили и довели водой до 1000 мл.
-
Рассчитайте рН 10% раствора гидроксида аммония (ρ = 0,958 г/мл).
-
Рассчитайте рН 10% раствора уксусной кислоты (ρ = 1,014 г/мл).
-
Вычислить рН 0,1M раствора HNO2 , если К═6,9 · 10-4. (Ответ: 2,1)
-
Вычислить рН 0.2M раствора HCN , если К═ 5 · 10-10. Ответ:5,0
-
Вычислить рН 0,01M раствора HCOOH, если К═1,8·10-4. Ответ:2,9
-
Вычислить рН 0,02M раствора CH3COOH,если К═1,74·10-5.Ответ:3,24
-
Вычислить рН 0,5M раствора NH4OH, если К═1,76·10-5.Ответ:11,03
-
Вычислить рН 0,2M раствора HJO, если К═2,3·10-11.Ответ:5,67
-
Вычислить рН 0,1M раствора хлорноватистой кислоты, если К═2,95·10-8 Ответ: 4,27.
-
Вычислить рН 0,1M раствора циановой кислоты, если К═2,7·10-4. Ответ:2,3
-
Вычислить рН 0,1M раствора CH3COONa, если
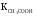 ═1,74·10-5. Ответ:8,88
═1,74·10-5. Ответ:8,88 -
Вычислить рН 0,1M раствора NH4Cl, если
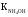 ═1,76·10-5. Ответ: 5,12
═1,76·10-5. Ответ: 5,12 -
Вычислить рН 0,1M раствора KCN, если КHCN═6.2·10-10.Ответ:11,15
-
Вычислить рН 0,1M раствора NH4CN, если КHCN═6.2·10-10. Ответ:9,27
-
Вычислить рН 0,1M раствора CH3COONH4, если
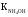 ═1,76·10-5;
═1,76·10-5; 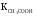 ═1,74·10-5. Ответ:7,0
═1,74·10-5. Ответ:7,0 -
Вычислить рН 0,1M раствора NaClO, если КHClO═5,0·10-8. Ответ:10,26
-
Вычислить рН 0,1M раствора NaHS, если
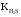 ═1,0·10-7.Ответ: 9,99
═1,0·10-7.Ответ: 9,99 -
Вычислить рН 0,1M раствора K2S, если КHS-═2.5·10-3. Ответ: 12,80
-
Вычислить рН 0,1M раствора HCOONa, если КHCOOH═4,0·10-13. Ответ:8,37
-
Какую навеску хлорида аммония следует растворить в 100 мл раствора, чтобы рН раствора был равен 6? Ответ:9,36 мг
-
В каком объеме следует растворить навеску ацетата натрия 0,03 г , чтобы получить раствор с рН═8? Ответ: 209 мл
-
Навеску Na2CO3 0,1 г растворили в 500 мл раствора. Вычислить рН. Ответ:10,80
-
Навеску NaHCO3 0,05 г растворили в 100 мл раствора. Вычислить рН. Ответ: 9,06
-
Какую навеску нитрата аммония следует растворить в 150 мл раствора, чтобы рН раствора стал равен 5? Ответ:2,1 г
-
В каком объеме следует растворить навеску соды Na2CO3 0,005 г , чтобы получить раствор с рН═9? Ответ: 9,92 мл
-
Какую навеску ацетата калия следует растворить в 500 см3 раствора, чтобы рН раствора стал равен 9? Ответ:8,59 г
-
Навеску хлорида аммония NH4 Cl 0,1 г растворили в 250 см3 раствора. Вычислить рН. Ответ:5,69
-
Вычислить рН буферной смеси, состоящей из равных объемов 1,0% растворов муравьиной кислоты и ее натриевой соли. Ответ:3,55
-
Вычислить рН буферной смеси, состоящей из равных объемов 5,0% растворов гидроокиси аммония и хлорида аммония. Ответ:9,41
-
Вычислить рН буферной смеси, состоящей из равных объемов 10,0% растворов йодноватистой кислоты и ее натриевой соли. Ответ:10,57
-
Вычислить рН буферной смеси, состоящей из 0,01 М раствора уксусной кислоты и 0,1 М раствора ее калиевой соли. Ответ:5,76
-
Вычислить рН буферной смеси, состоящей из 0,01 М раствора синильной кислоты и ее 1,0 М раствора калиевой соли. Ответ: 11,30
-
Вычислить рН буферной смеси, состоящей из 0,02 М раствора гидроксида аммония и 0,2 М раствора хлорида аммония. Ответ: 8,24
-
Вычислить рН буферной смеси, состоящей из равных объемов 5,0% растворов азотистой кислоты и ее натриевой соли: Ответ:3,12
-
Вычислить рН буферной смеси, состоящей из равных объемов 0,5% растворов бензойной кислоты и ее натриевой соли. Ответ: 4,13
-
Рассчитайте рН буферного раствора, полученного смешиванием 100 мл 0,1 моль/л раствора аммиака и 50 мл 10% раствора аммония хлорида (ρ = 1,0 г/мл).
-
Рассчитайте рН буферного раствора, полученного смешиванием 50 мл 0,1 моль/л раствора кислоты уксусной и 100 мл 0,2 моль/л раствора натрия ацетата.
-
Рассчитайте рН буферного раствора, если к 50 мл 10% раствора аммония гидроксида (ρ = 0,958 г/мл) добавили 100 мл 0,05 моль/л раствора аммония хлорида
4. Гидролиз солей.
Гидролизом называется взаимодействие ионов растворённой в воде соли с ионами воды, вызывающее обычно изменение концентрации ионов Н+ и ОН-. Хотя [H+] и [OH-] в воде очень незначительны (10-7моль/л), но эти ионы находятся в динамическом равновесии с огромным числом недиссоциированных молекул воды. Связывание одного из них (Н+ или ОН-) ионами соли сопровождается нарушением равновесия и вызывает диссоциацию новых молекул воды. В результате накапливаются в растворе значительные количества ОН- или Н+, вследствие чего раствор приобретает щелочную или кислую среду.
Гидролиз - реакция, обратная нейтрализации. Причиной его является образование малодиссоциированных молекул кислоты или основания, или то и другое вместе.
-
Гидролиз солей, образованных сильным основанием и слабой кислотой.
СН3СООNa - уксуснокислый натрий (или ацетат натрия). При растворении в воде полностью диссоциирует на ионы Na+ и СН3СОО- . Гидролиз протекает по уравнению:
СН3СООNa + НОН  СН3СООН + NaOH
СН3СООН + NaOH
или в ионной форме:
СН3СОО- + НОН  СН3СООН + ОН-
СН3СООН + ОН-
В растворе образуется избыток ОН- ионов, создаётся щелочная среда рН>7.
2. Гидролиз солей, образованных слабыми основаниями и сильными кислотами.
При растворении в воде таких солей, например, хлористого аммония NH4CI, в воде наступает равновесие
NH4CI+НОН  NH4OH+HCI
NH4OH+HCI
или в ионной форме:
NH4++HOH  NH4OH+H+
NH4OH+H+
В растворе накапливаются ионы Н+, создается кислая среда: рН<7.
3. Гидролиз солей, образованных слабыми основаниями и слабыми кислотами.
Например, уксусный аммоний СН3СООNH4. Её гидролиз протекает по уравнению:
СН3СООNH4 + НОН  CН3СООН + NH4OH
CН3СООН + NH4OH
или в ионной форме:
СН3СОО- + NH4+ + HOH  CH3COOH + NH4OH
CH3COOH + NH4OH
Происходит образование двух слабых электролитов: уксусной кислоты и гидроксида аммония.
Реакция раствора подобных солей зависит от относительной силы образующихся кислоты и основания. Если константа диссоциации основания равна диссоциации кислоты (как в данном случае), то реакция раствора будет нейтральной рН = 7. Если константа диссоциации кислоты превышает константу диссоциации основания, то раствор соли имеет слабокислую среду и, наоборот, будет иметь слабощелочную среду, если константа диссоциации основания больше константы диссоциации кислоты.
Соли, образованные слабыми многоосновными кислотами или слабыми многоатомными основаниями, гидролизуются в несколько ступеней. Например: Na2CO3 гидролизуется в две ступени.
Первая ступень:
Na2CO3 + HOH  NaHCO3 + NaOH
NaHCO3 + NaOH
Или в ионной форме:
СО32- + НОН  НСО3- + ОН-
НСО3- + ОН-
Вторая ступень:
NaHCO3 + HOH  H2CO3 + NaOH
H2CO3 + NaOH
Или в ионной форме: 
НСО3- + НОН  Н2СО3 + ОН-
Н2СО3 + ОН-
4. Соли, образованные сильными основаниями и сильными кислотами, гидролизу не подвергаются: водные растворы таких солей, например NaCl или KCl, имеют нейтральную реакцию рН = 7.
Степень гидролиза - отношение числа гидролизованных молекул соли к общему числу растворённых молекул соли в растворе:
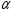 =
= 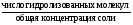 (24)
(24)
Задания для самоконтроля:
. Составить уравнения гидролиза солей, определить среду их раствора (рН):
-
КNO3, FeJ2, Li2CO3;
-
NaCl, NaNO2, CuSO4;
-
Zn(NO3)2, LiBr, K2SiO3;
-
RbCl, Mg(NO3)2, K2CO3;
-
AlCl3, BaBr2, Na2SiO3;
-
MgSO4, LiCl, K2S;
-
Na3PO4, MnCl2, KI;
-
FeCl3, Cs2SO4, NaBr;
-
ВаСl2, Cu(NO3)2, K2SO4;
-
RuNO3, ZnCl2, K3PO4;
-
NaI, Pb(NO3)2, KNO2;
-
Ba(NO3)2, FeCl2, Li2SiO3;
-
Al2(SO4)3, NaCl, BaI;
-
LiNO3, Na2S, FeSO4;
15) NaNO3, ZnSO4, LiCl.
5. Равновесие в гетерогенных системах
В насыщенном растворе малорастворимого электролита состава MmAnравновесное состояние можно схематически представить следующим образом:
MmAn ↔ mMn+ + nAm-.
Константа растворимости:
Kc = [Mn+]m · [Am-]n = ПР(MmAn). (25)
Например, для PbCl2 Kc = [Pb2+] · [Cl-]2= ПР(PbCl2).
Связь растворимости, выраженной в моль/дм3, с ПР при малом значении ионной силы описывается уравнением:
 (26)
(26)
В присутствии избытка электролита с одноименным ионом, например с
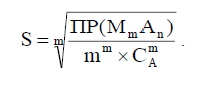 (27)
(27)
Пример 1. Произведение растворимости PbSO4 равно 2,3∙10-8.
Вычислить: а) концентрацию ионов Pb2+ и SO42-;
б) растворимость соли ( % по массе и моль/л).
Решение. 1. Запишем уравнение диссоциации
PbSO4  Pb2+ + SO42-
Pb2+ + SO42-
2. Запишем выражение для ПР
ПР(PbSO4) = [Pb2+] [SO42-].
Обозначим молярную концентрацию насыщенного раствора PbSO4 через Х. Так как растворившаяся часть соли диссоциирована нацело, то [Pb2+] = [SO42-] = Х. Подставим Х в последнее равенство:
2,3∙10-8=Х2, откуда Х =1,5∙10-4 моль/л.
Следовательно, [Pb2+]=[SO42-]=1,5∙10-4 моль/л, растворимость соли также равна 1,5∙10-4 моль/л
3. Найдем процентную (по массе) концентрацию раствора, принимая плотность разбавленного раствора равной единице (молекулярная масса PbSO4 равна 303 г/моль.):
в 1000г раствора содержится (1,5∙10-4 ∙303) г
в 100 г ----------------------------- Х г
Х = 1,5∙10-4 ∙303∙100 /1000 = 4,5 ∙10-3 % = 0,0045%
Пример 2. Растворимость фосфата серебра Ag3PO4 в воде при температуре 200C равна 6,15∙10-3 г/л. Определить произведение растворимости.
Решение. Молярная масса Ag3PO4 = 418,58 г/моль. Следовательно, раствор содержит: 6,15∙10-3 /418,58 = 1,6 ∙10-5 моль/л. Эта величина называется молярной растворимостью.
При диссоциации Ag3PO4 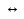 3Ag+ + PO43-
3Ag+ + PO43-
образуется три иона Ag+ и один ион (PO43-), поэтому концентрации ионов в растворе соответственно равны: [PO43-] = 1,6 ∙10-5моль/л и [Ag+] = 31,6∙10-5 моль/л. Произведение растворимости Ag3PO4 равно:
ПР(Ag3PO4)= [Ag+]3 ∙ [PO43-] = (4,8∙10-5)3 ∙(1,6∙10-5) = 1,77 ∙10-18
Пример 3. Образуется ли осадок AgCl, если к раствору, содержащему 3,4 г AgNO3 в 1 дм3, прилить равный объем раствора СNaCl = 0,02 моль/ дм3?
Решение.
Запишем диссоциацию АgCl,
АgCl 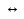 Ag+ + Cl-
Ag+ + Cl-
M(AgNO3) = 169,87 г/моль;
[AgNO3] = 3,4 / 169,87 = 0,02 моль/дм3;
[Ag+] = [AgNO3] = 0,02 моль/дм3.
После смешения равных объемов растворов концентрация ионов [Ag+] и [Cl-] уменьшится в два раза. [Ag+] · [Cl-] = 0,01 · 0,01 = 10-4;
ПР(AgCl) = 1,8 · 10-10, следовательно, осадок образуется.
Пример 4. Вычислить рН, при котором практически полностью осаждается Mg(OH)2, если ПР Mg(OH)2 = 2 · 10-11.
Решение. ПР Mg(OH)2 = [Mg2+][OH-]2.
Практической полнотой осаждения принято считать, если концентрация осаждаемого иона не превышает 10-5÷10-6 моль/дм3.
[Mg ]
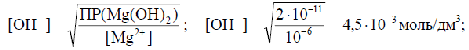
рОН = -lg [OH-] = -lg 4,5·10 -3 = 2,35;
pH = 14 - 2,35 = 11,65.
Пример 5. Смешаны равные объемы 0,001 М BaCl2 и 1,5·10-3 М Na2SO4. Вычислить [Ba2+] в растворе, если ПР(BaSO4)= 1,1 · 10 -10. Как изменится растворимость BaSO4 в этой смеси по сравнению с растворимостью в воде?
Решение. После смешивания растворов концентрации хлорида бария и сульфата натрия уменьшатся вдвое:
C (BaCl2) = 5 · 10 − 4 M;
C( Na2SO4 )= 7,5 · 10 − 4 M.
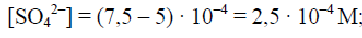
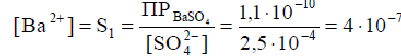
После завершения реакции: BaCl2 + Na2SO4 → BaSO4 ↓ + 2NaCl.
Растворимость BaSO4 в воде: 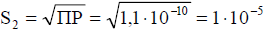
Растворимость BaSO4 в электролите, имеющем одноименный ион, уменьшилась
Пример. 6 Произведение растворимости Fe(OH)2 при 25°С равно 1,65•10-15. Выпадет ли осадок при смешивании 4 мл 0,04н. FeSO4 и 6 мл 0,01М NaOH?
Решение. Молекулярное уравнение реакции
FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
Ионно-молекулярное уравнение реакции
Fe2+ + 2OH- = Fe(OH)2
Для определения условия образования осадка необходимо рассчитать ПК
ПК(Fe(OH)2) = [Fe2+][OH-]2
Для нахождения ПК нужно найти концентрации Fe2+ и ОН- после смешивания растворов заданной концентрации. Определяем исходные концентрации ионов до сливания растворов:
NaOH → Na+ + OH- [ОН-]=0,01 моль/л
0,01 моль/л 0,01 моль/л
Для определения концентрации ионов Fe2+ нужно перевести нормальную концентрацию FeSO4 в молярную.
fэк(FeSO4) = 1/2 0,04н FeSO4 = 0,02M FeSO4
FeSO4 → Fe2+ + SO42-
0,02 моль/л 0,02 моль/л
Определяем концентрацию ионов после смешивания растворов.
Объем раствора после смешивания 4 мл FeSO4 и 6 мл NaOH стал 10 мл.
Концентрация ионов после смешивания растворов
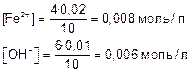
Находим произведение концентраций
ПК(Fe(OH)2) = [Fe2+][OH-]2
ПК(Fe(OH)2) = 0,008 • 0,0062 = 2,88•10-7
Сравниваем ПК с ПР (приложение)
2,88•10-7 > 1,65•10-15
Следовательно при сливании 4 мл 0,004н. раствора FeSO4 и 6 мл 0,01М раствора NaOH образуется осадок Fe(OH)2.
Контрольные задачи:
-
Рассчитайте растворимость сульфида меди (моль/л и г/л), если его произведение растворимости 6,3 * 10-36.
-
Рассчитайте растворимость оксалата серебра (моль/л и г/л), если его произведение растворимости 6,5 * 10-3.
-
Рассчитать произведение растворимости бромида серебра, если его растворимость равна 1,6*10-8моль/л.
-
Рассчитайте растворимость бария сульфата (моль/л и г/л), если его произведение растворимости 1,1 * 10-10.
-
Рассчитайте растворимость фосфата серебра (моль/л и г/л), если его произведение растворимости 1,3 * 10-20.
-
Рассчитайте растворимость сульфида меди (моль/л и г/л), если его произведение растворимости 6,3 * 10-36.
-
Рассчитайте растворимость кальция сульфата (моль/л и г/л), если его произведение растворимости 9,1 * 10-6.
-
Рассчитать произведение растворимости карбоната стронция если его растворимость равна 1,05*10-5 моль/л.
-
Рассчитать произведение растворимости оксалата кобальта, если его растворимость равна 2,51*10-4 моль/л.
-
Рассчитать произведение растворимости бария фосфата, если его растворимость равна 8,9*10-9 моль/л.
-
При некоторой температуре в 10 л воды растворяется 1,112 г хлорида свинца. Рассчитайте ПР этой соли
-
При некоторой температуре рН насыщенного раствора гидроксида кальция составляет13. Рассчитайте величину ПР этого основания.
-
При некоторой температуре в 20 л воды растворяется 4×10-3 моль фторида кальция. Рассчитайте ПР этой соли.
-
Выпадет ли осадок, если к 100 мл раствора, содержащего 0,5 моль натрия хлорида добавить 50 мл 0,01 моль/л раствора серебра нитрата?
-
Какой осадок выпадет первым, если к раствору, содержащему 0,02 моль бария нитрата и 0,01 моль кальция нитрата прибавить избыток раствора кислоты серной?
-
Какой осадок выпадет первым, если к 20 мл раствора, содержащего по 0,05 моль меди хлорида и бария хлорида, добавили избыток натрия карбоната?
-
Выпадет ли осадок, если смешать 50 мл, содержащих 0,01 моль натрия гидроксида с 50 мл, содержащих 0,01 моль олова нитрата?
-
Выпадет ли осадок, если к 100 мл 3% раствора магния сульфата (ρ = 1 г/мл) прибавить 50 мл 0,1 моль/л раствора бария хлорида?
-
Выпадет ли осадок, если смешать 50 мл, содержащих 0,1 моль раствора стронция хлорида с 50 мл, содержащих 0,1 моль раствора кислоты серной?
-
Рассчитать растворимость в моль/л и г/л, если известны значения произведений растворимости: ПР (Са3(PО4)2 = 2,0*10-29
-
. Выпадет ли осадок, если к 100 мл 0,1 моль/л раствора кальция хлорида прибавить 0,1 г серебра нитрата?
-
Какой осадок выпадет первым, если к раствору, содержащему 0,1 моль бария нитрата и 0,2 моль кальция нитрата прибавить избыток раствора кислоты серной?
-
Какой осадок выпадет первым, если к раствору, содержащему 0,1 моль натрия бромида и 0,05 моль калия иодида прибавить избыток раствора нитрата серебра?
-
Рассчитать растворимость в моль/л и г/л, если известны значения произведений растворимости: ПР (СаС2О4) = 2,3*10-9
-
Какой осадок выпадет первым, если к раствору, содержащему по 0,1 моль магния сульфата и натрия карбоната прибавить избыток раствора бария хлорида?
-
Выпадет ли осадок, если смешать 10 мл, содержащих 0,1 моль натрия хлорида и 20 мл, содержащих 0,2 моль нитрата серебра?
-
Смешали 150 мл 0,1 н раствора FeCl2 и 350 мл 0,01 М раствора NaOH. Выпадет ли осадок Fe(OH)2, если П Р(Fe(OH)2) = 1,6× 10-15. Принять, что объем полученного раствора равен 500 мл (осаждение гидроксида проводят в инертной атмосфере)
-
Какой осадок выпадет первым, если к 50 мл раствора, содержащего 0,1 моль калия хлорида и 0,3 моль калия иодида, прибавили избыток раствора нитрата серебра?
-
Какой осадок выпадет первым, если к раствору, содержащему 0,1 моль бария хлорида и 0,5 моль кальция нитрата прибавить избыток раствора кислоты серной?
-
Какой осадок выпадет первым, если к 50 мл раствора, содержащего по 0,1 моль меди нитрата и бария нитрата, добавили избыток натрия карбоната?
-
Произведение растворимости сульфата цинка ПР = 2,3∙10-8. Образуется ли осадок, если к 0,1М раствору Na2SO4 прибавить равный объем 0,1н раствора ацетата свинца Pb(CH3COO)2?
-
Во сколько раз уменьшится концентрация ионов серебра в насыщенном растворе AgCl, если прибавить к нему столько соляной кислоты, чтобы концентрация ионов Сl- в растворе стала равной 0,03 моль/л
6. Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) - это реакции, при протекании которых происходит изменение степени окисления химических элементов, входящих в состав реагентов.
Степень окисления - условный (формальный) заряд атома в химическом соединении, который находят, считая химические связи в соединении чисто ионными.
-
Окисление
потеря электронов, т.е. повышение степени окисления.Окислитель
присоединяет электроны, сам восстанавливается, понижает свою степень окисленияВосстановление
приобретение электронов, т.е. понижение степени окисления.Восстановитель
отдает электроны, сам окисляется, повышает свою степень окисленияЧисло электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем
Для составления уравнений окислительно-восстановительных реакций используют два метода подбора коэффициентов: электронного баланса и электронно-ионного баланса.
Напишем уравнение реакции между алюминием и кислородом:
Al + O2 = Al2O3
Баланс - это равенство. Поэтому следует сделать одинаковым количество электронов, которые отдает один элемент и принимает другой элемент в данной реакции. Первоначально это количество выглядит разным, что видно из разных степеней окисления алюминия и кислорода:
0
0
+3 -2
Al
+
O2
=
Al2O3
Алюминий отдает электроны (приобретает положительную степень окисления), а кислород - принимает электроны (приобретает отрицательную степень окисления). Чтобы получить степень окисления +3, атом алюминия должен отдать 3 электрона. Молекула кислорода, чтобы превратиться в кислородные атомы со степенью окисления -2, должна принять 4 электрона:
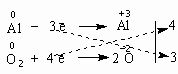
Чтобы количество отданных и принятых электронов выровнялось, первое уравнение надо умножить на 4, а второе - на 3. Для этого достаточно переместить числа отданных и принятых электронов против верхней и нижней строчки так, как показано на схеме вверху.
Если теперь в уравнении перед восстановителем (Al) мы поставим найденный нами коэффициент 4, а перед окислителем (O2) - найденный нами коэффициент 3, то количество отданных и принятых электронов выравнивается и становится равным 12. Электронный баланс достигнут. Видно, что перед продуктом реакции Al2O3 необходим коэффициент 2. Теперь уравнение окислительно-восстановительной реакции уравнено:
4Al + 3O2 = 2Al2O3
Контрольные задания
Составить электронные уравнения. Расставить коэффициенты методом электронного баланса. Указать, какое вещество является окислителем и какое восстановителем; какое вещество окисляется, и какое восстанавливается.
1. J2 + Cl2 + H2O  HJO3 + HCl;
HJO3 + HCl;
K2Cr2O7 + H3PO4 + H2SO4  Cr2(SO4)3 + H3PO4 + K2SO4 + H2O
Cr2(SO4)3 + H3PO4 + K2SO4 + H2O
2. Be(OH)2 + NaOH  Na2BeO2 + H2O;
Na2BeO2 + H2O;
FeSO4 + HNO3 + H2SO4  Fe2(SO4)3 + NO + H2O
Fe2(SO4)3 + NO + H2O
3. Na2SO3 + KMnO4 + H2SO4  Na2SO4 + MnSO4 + K2SO4 + H2O;
Na2SO4 + MnSO4 + K2SO4 + H2O;
MnCO3 + KClO3  MnO2 + KCl + CO2
MnO2 + KCl + CO2
4. Cr2S3 +O2→Cr2O3 +SO2
Fe(OH)2 + O2 + H2O  Fe(OH)3
Fe(OH)3
5. Zn(OH)2 + KOH  K2ZnO2 +H2O;
K2ZnO2 +H2O;
KCrO2 + Br2 + KOH  K2CrO4 + KBr + H2O
K2CrO4 + KBr + H2O
6. KMnO4 + H2O2 + H2SO4  MnSO4 + K2SO4 + H2O + O2;
MnSO4 + K2SO4 + H2O + O2;
FeSO4 + HNO3 + H2SO4  Fe2(SO4)3 + NO + H2O
Fe2(SO4)3 + NO + H2O
7. H2O2 + KJ + HCl  J2 + KCl + H2O;
J2 + KCl + H2O;
Al + K2Cr2O7 + H2SO4  Al2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
Al2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
8. Cr2(SO4)3 + Cl2 + KOH  K2CrO4 + KCl +Na2SO4 + H2O;
K2CrO4 + KCl +Na2SO4 + H2O;
SO2 + KMnO4 + KOH  K2SO4 + MnO2 + H2O
K2SO4 + MnO2 + H2O
9. K2Cr2O7 + H2S + H2SO4  Cr2(SO4)3 + S + K2SO4 + H2O;
Cr2(SO4)3 + S + K2SO4 + H2O;
Cr2O3 + NaOH  Na2CrO4 + H2O
Na2CrO4 + H2O
10. Cr(OH)3 + H2O2 + NaOH  Na2CrO4 + H2O;
Na2CrO4 + H2O;
H3AsO4 + Zn + H2SO4  AsH3
AsH3 + ZnSO4 + H2O
+ ZnSO4 + H2O
11. FeCl2 + Cl2  FeCl3;
FeCl3;
K2Cr2O7 + SO2 + HCl  CrCl3 + K2SO4 + H2O
CrCl3 + K2SO4 + H2O
12. FeCl3 + KJ  FeCl2 + J2 + KCl;
FeCl2 + J2 + KCl;
KMnO4 + H2S + H2SO4 K2SO4 + MnSO4 +S + H2O
K2SO4 + MnSO4 +S + H2O
13. FeCl2 + HClO3 + HCl  FeCl3 + H2O;
FeCl3 + H2O;
K2Cr2O7 +KJ + H2SO4  Cr2(SO4)3 + K2SO4 + J2 + H2O
Cr2(SO4)3 + K2SO4 + J2 + H2O
14. Zn + H2SO4  ZnSO4 + S + H2O;
ZnSO4 + S + H2O;
Na2SO3 + J2 + H2O Na2SO4 +HJ
Na2SO4 +HJ
7. Комплексные соединения
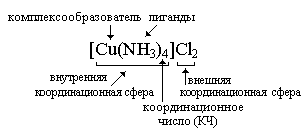
Комплексное соединение, состоит из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом.
Номенклатура комплексных соединений
Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным.
Соединения с комплексными катионами. Вначале называют внешнесферный анион, затем перечисляют лиганды, затем называют комплексообразователь в родительном падеже (ему дается русское название данного элемента). После названия комплексообразователя в скобках римской цифрой указывается его степень окисления.
К латинскому названию анионного лиганда добавляется окончание "о" (F- - фторо, Cl- -хлоро, ОН- - гидроксо, CN- - циано и т.д). Аммиак обозначают термином "аммин", СО - карбонил, NO - нитрозил, H2O - аква.
Число одинаковых лигандов называют греческим числительным: 2 -ди, 3 - три, 4 - тетра, 5 - пента, 6 - гекса, 7 - гепта и т.д.
[Cu(NH3)4]SO4 - сульфат тетраамминмеди (II),
[Ni(H2O)6]Cl2 - хлорид гексаакваникеля (II).
Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные.
[Pt(NH3)5Cl]Cl3 - хлорид хлоропентаамминплатины (IV) .
Если в комплексе имеются несколько лигандов одинакового знака заряда, то они называются в алфавитном порядке:
[CoCl2(H2O)(NH3)3]Cl - хлорид дихлороакватриамминкобальта (III).
Соединения с комплексными анионами. Вначале называют комплексный анион в именительном падеже: перечисляют лиганды, затем комплексообразователь (ему дается латинское название и к названию добавляется окончание "ат"). После названия комплексообразователя указывается его степень окисления. Затем в родительном падеже называется внешнесферный катион.
Na2[Zn(OH)4] - тетрагидроксоцинкат (II) натрия;
K4[Fe(CN)6] - гексацианоферрат (II) калия;
K2[СuCl4] - тетрахлорокупрат (II) калия.
Соединения без внешней сферы. Вначале называют лиганды, затем комплексообразователь в именительном падеже с указанием его степени окисления. Все название пишется слитно.
[Ni(CО)4] - тетракарбонилникель (0);
[Pt(NH3)2Cl4] - тетрахлородиамминплатина (IV).
Диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы. В то же время комплексный ион диссоциирует в незначительной степени как ассоциированный электролит. Количественной характеристикой диссоциации внутренней сферы в растворе является константа нестойкости, представляющая собой константу равновесия процесса диссоциации комплексного иона.
Например, в растворе комплексное соединение [Ni(NH3)6]SO4 диссоциирует следующим образом:
[Ni(NH3)6]SO4 = [Ni(NH3)6]2+ + SO42-.
Для комплексного иона [Ni(NH3)6]2+, диссоциирующего по уравнению
[Ni(NH3)6]2+  Ni2+ + 6NH3 ,
Ni2+ + 6NH3 ,
константа равновесия процесса диссоциации носит название константы нестойкости Кн. Для рассматриваемого процесса Кн равна
Величина, обратная Кн, называется константой устойчивости:
Ку = 1/Кн . (17.2)
Она представляет собой константу равновесия процесса образования комплексного иона:
Ni2+ + 6NH3  [Ni(NH3)6]2+.
[Ni(NH3)6]2+.
Пример. а) Дайте названия комплексным соединениям: [Ni(NH3)6]Cl2 , Na2[Zn(OH)4];
б) Составьте формулу комплексного соединения по его названию: гексацианоферрат (II) калия; гексатиоцианоферрат (III) калия.
Для (а) и (б) укажите центральный атом, лиганды, внутреннюю координационную сферу, внешнюю сферу. Напишите уравнения диссоциации этих соединений в водных растворах и выражения для констант нестойкости.
Решение
Формула комплексного соединения и его название
Комплексообразователь
Лиганд
Коордиvнацион-ное число
Внутренняя сфера комплексного соединения
Ионы внешней сферы
[Ni(NH3)6]Cl2
хлорид гексаамминникеля (II)
Ni2+
NH30
6
[Ni(NH3)6]2+
Cl-
Na2[Zn(OH)4]
тетрагидроксоцинкат натрия
Zn2+
OH-
4
[Zn(OH)4]2-
Na+
гексацианоферрат (II) калия K4[Fe(CN)6]
Fe2+
CN-
6
[Fe(CN)6]4-
K+
Уравнения диссоциации и выражения для расчета константы нестойкости:
1) [Ni(NH3)6]Cl2 → [Ni(NH3)6]2+ + 2Cl-
[Ni(NH3)6]2+ ↔ Ni2+ + 6NH30
[Ni2+] ∙[ NH30 ] 6
Кнест. = ------------------------
[ [Ni(NH3)6]2+ ]
2) Na2[Zn(OH)4] → 2Na+ + [Zn(OH)4]2-
[Zn(OH)4]2- ↔ Zn2+ + 4OH-
[Zn2+] ∙[ OH-]4
Кнест. = ------------------------
[[Zn(OH)4]2- ]
3) K4[Fe(CN)6] → 4K+ + [Fe(CN)6]4-
[Fe(CN)6]4- ↔ Fe2+ + 6CN-
[Fe2+] ∙[CN-] 6
Кнест. = ------------------------
[[Fe(CN)6]4-]
4) K3[Fe(SCN)6] → 3K+ + [Fe(SCN)6]3-
[Fe(SCN)6]3- ↔ Fe3+ + 6 SCN-
[Fe3+] ∙[SCN-] 6
Кнест. = ------------------------
[[Fe(SCN)6]3-]
Контрольные задания:
1. Написать координационные формулы следующих соединений:
-
тетрахлороаурат (III) калия,
-
гексагидроксохромат (III) бария,
-
хлорид нитритопентаамминхрома (III),
-
гексафтороалюминат (III) натрия,
-
тиоцианатотрицианокупрат (II) бария,
-
дихлородиамминплатина,
-
дисульфатоферрат (II) аммония,
-
гексацианокобальтат (III) калия,
-
гексацианоферрат (III) водорода,
-
гексафторосиликат (IV) водорода,
-
гидроксид гексаамминкобальта (П),
-
пентакарбонилжелезо,
-
тетратиоцианатогидраргират (II) калия,
-
бромид цианотетраамминаквакобальта (III),
-
хлорид гексааквахрома (III),
-
гексацианоферрат (П) гексаамминникеля (II),
-
дисульфатоферрат (II) аммония.
2. Назвать следующие комплексные соединения. укажите центральный атом, лиганды, внутреннюю координационную сферу, внешнюю сферу. Напишите уравнения диссоциации этих соединений в водных растворах и выражения для констант нестойкости.
-
Na2[Pt(CN)4Cl2],
-
[Cu(NH3)4](NO3)2
-
[Cu(H2O)4]SO4,
-
[Ni(NH3)6][PtCl4].
-
[Co(H2O)3Cl3],
-
K4[Fe(CN)6]
-
K3[Fe(CN)6]
-
K2[HgI4]
-
[Cu(NH3)4]Cl2
-
[Ni(NH3)6]Cl2
-
Na3[Al(OH)6]
-
Na2[Zn(OH)4]
-
Na2[Zn(CN)4]
-
K[Ag(CN)2]
-
[Cu(NH3)4]Cl2,
-
[Cr(H2O)6]Cl3;
-
K3[Fe(CN)6],
-
H2[SiF6];
-
[Co(NH3)6]
-
[Co(C2O4)3];
-
[Co(NH3)3(NO2)3]
-
[Pt(NH3)2Br4]
3. Написать уравнения возможных реакций образования новых комплексных соединений в молекулярном и ионном виде (необходимые значения константы нестойкости приведены в таблице приложения).
[Cd(NH3)4]CI2 + KCN= Na [ AuBr2] + NaCN =
K2[Hg(SCN)4] + KI = K2[CdCl4] + NH3 • H2О =
К [Cu(CN)2] + KI= [Ag(NH3)2]Cl+Na2S2О3=
4. Гидроксид меди (II) растворяется, а сульфид меди (II) не растворяется в концентрированном растворе аммиака. Объяснить наблюдаемое явление.
5. Константы нестойкости комплексных ионов [Co(CN)4]2-, [Hg(CN)4]2-, [Cd(CN)4]2- соответственно равны 8 ∙ 10-20 ; 4 ∙ 10-41 ; 1,4 ∙10-17. В каком растворе, содержащем эти ионы (при равной молярной концентрации), ионов СN- больше? Напишите выражения для констант нестойкости указанных комплексных ионов и формулы соединений, содержащих эти ионы
6. Константы нестойкости комплексных ионов: [Co(CN)4]2-; [Cd(CN)4]2-; [(Hg(CN)4]2- соответственно равны 8 ∙ 10-20 ; 4 ∙ 10-41 ; 1,4 ∙10-17. Какой из этих ионов является более прочным? Напишите выражения для констант нестойкости указанных комплексных ионов и формулы соединений, содержащих эти ионы.
7. Возможно ли в стандартном состоянии замещение:
- лиганда в гексафтороферрат (Ш)-ионе на тиоцианат-ион;
-иона-комплексообразователя в тетрацианокадмиат-ионе на катион никеля(II).
Гравеметрический метод анализа.
Основные расчетные формулы в гравиметрических методах анализа.
Содержание определяемого вещества обычно вычисляют в граммах или процентах. Расчет ведут с помощью аналитического фактора F - отношения молекулярной массы определяемого вещества (М) к молекулярной массе его гравиметрической (весовой) формы (Мгр.ф.)
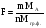 (29)
(29)
При вычислении гравиметрического фактора в числителе указывают формулу определяемого вещества, в знаменателе- формулу его весовой(гравиметрической формы), m,n-стехиометрические коэффициенты. Например,
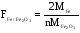
Расчет определяемого вещества в граммах
m(X)= mгр.ф∙F (30)
Расчет определяемого вещества в процентах
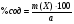 (31)
(31)
2.Объем осадителя находим по формуле
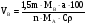 ,
,  (34)
(34)
где 1,5- const- коэффициент, найденный практическим путем
МВ- молекулярный вес осадителя;
МА- молекулярный вес определяемого вещества;
а- навеска определяемого вещества, г;
С- процентная концентрация;
ρ- плотность г/см3.
Примеры решения задач.
Пример 1
Из навески глины 0,5340 г. после соответствующей обработки получено 0,2345 г CaO. Рассчитать массовую долю CaCO3 в глине.
Решение
Найдем аналитический фактор
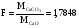
Зная аналитический фактор, можем найти % содержание
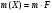
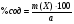
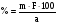
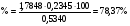
Пример 2
При определении Fe в препарате сульфата железа (III) взвешивали BaSO4 .Написать выражение для гравиметрического фактора.
Решение
Между Fe и BaSO4 существует стехиометрическое соотношение
2Fe 1Fe2(SO4)3
1Fe2(SO4)3  3SO42-
3SO42- 3BaSO4
3BaSO4
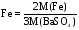
Пример 3
Навеску алюминиевого сплава массой 0,14252 г растворили в колбе вместимостью 200 мл. Из 20,00 мл этого раствора получили осадок оксихинолината алюминия Al(C9H6ON)3,массой 0,2012 г. Вычислить массовую долю (%) алюминия в сплаве.
Решение
Найдем аналитический фактор
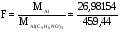
Преобразуя несколько формул, найдем % содержание алюминия в сплаве
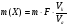
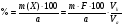
Тогда
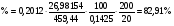
Пример 4
Вычислить число молекул воды в кристаллогидрате хлорида магния, если из навески его массой 0,5000 г. получается 0,2738 г Mg2P2 O7.
Решение
Кристаллогидрат магния: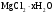
Определяемое вещество 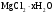
Гравиметрическая форма 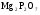
Считаем фактор пересчета
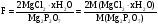
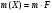
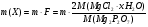
2M(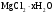 ) =
) = 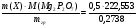
M(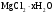 )=
)=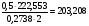
Число молекул в кристаллогидрате находим
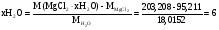
Значит соль 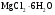
Пример 5.
Какой объем раствора карбоната натрия (массовая доля 17,7% ρ=1,19г/см3) требуется для осаждения 0,2 г. кальция при полуторакратном избытке осадителя?
Решение:
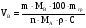
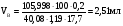 ,
,
где 105,988 - молекулярная масса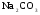 ;
;
40,08 - молекулярная масса кальция.
Задачи для самостоятельного решения
1. Вычислить фактор пересчета
Определяемое вещество Гравиметрическая форма
-
Na2S203 BaSO4
-
Ba BaSO4
-
Al Al2O3
-
Na2O NaCl
-
CaCО3 CaSO4
-
CaO CaCO3
-
Ca3(PО4)2 CaO
-
FeO Fe2O3
-
FeSO4 Fe2O3
-
H3PO4 Mg2P2O7
-
Pb3O4 PbSO4
-
Fe3O4 Fe2O3
-
N (NH)2PtCl6
-
CuO CuSCN
-
K2O K2PtCl6
-
Ag2O AgCl
-
MoO3 (NH4)3PO4·12MoO3
-
P2O5 (NH4)3PO4·12MoO3
-
K K2SO4
-
MgO Mg2P2O7
-
K K2PtCl6
-
Mg Mg2P2O7
-
SiF4 SiO2·12MoO3
Ответы: 1.0,3388; 2. 0,5885; 3.0,5294; 4. 0,7352; 5. 0,7352; 6. 0,5604; 7. 1,8439; 8. 0,8998; 9. 1,9023; 10. 0,8804; 11. 0,7536; 12. 0,9666; 13. 0,0631; 14. 0,6539; 15. 0,1938; 16. 0,8085; 17. 0,9206; 18. 0,0378;19. 0,4488; 20. 0,3622; 21. 0,1609; 22. 0,2185; 23. 0,0582;
Расчет содержания определяемого вещества и навески
-
Какую навеску латуни, содержащей 5% олова, нужно взять для определения его в виде диоксида? Ответ: 1,6 г.
-
Сколько процентов MgSO4*7H2O содержит проба технического сульфата магния; если из его навески 0,4085 г. получено 0,1800 г. Mg2P2O7?Ответ: 97,54%.
-
Какой должна быть навеска чугуна с массовой долей серы 2%, если для ее гравиметрического определения в виде сульфата бария, чтобы получить можно было при анализе 0,5 г. осадка? Ответ: 3,435 г.
-
Вычислить массовую долю меди в образце руды, если из 0,4320 г. пробы получено 0,1985 г. Cu(SCN)2. Ответ:23,89%.
-
При гравиметрическом определении свинца из 2,000 г. сплава получено 0,6048 г. PbSO4. Вычислить массовую долю свинца в сплаве. Ответ: 20,69%.
-
Какую навеску FeSO4∙7H2O нужно взять для определения в нем железа в виде окиси железа, если максимальный вес весовой формы 0,1 г.? Ответ: 0,3888 г.
-
Какую навеску соли, содержащей по массе 85% Al2(SO4)3·18H2O надо взять, чтобы получить в качестве гравиметрической формы не более 0,15 г Al2O3? Ответ: 1,15г.
-
Рассчитать массовую долю карбоната магния в известняке, если навеска его 0,9866г., а в результате анализа получено 0,4105 г. Mg2P2O7.Ответ: 31,48%.
-
Рассчитайте массу навески известняка для определения кальция в виде его оксалата, если гравиметрической формой служили: а) оксид кальция; б) сульфат кальция; Масса гравиметрической формы 0,1 г. Ответ: а) 0,50 г.; б) 0,23 г.
Расчет количества осадителя
-
Вычислить объем раствора серной кислоты с массовой долей 4% необходимый для осаждения бария из навески 0,3025 г. BaCl2· H2O.Ответ: 3,04 см3.
-
Рассчитать обьем осадителя в виде 0,05М раствора Na2HPO4 для осаждения магния в виде MgNH4PO4 из 100 см3 0,02М раствора MgCl2 с использованием осадителя до 120%.Ответ: 48 см3.
-
Какой объем раствора карбоната натрия (массовая доля 17,7%, ρ=1,19) требуется дл осаждения 0,2 г. кальция при полуторакратном избытке осадителя? Ответ: 3,77 см3.
-
Сколько мл. 1,2%-го раствора диметилглиоксима C6H8N2O2 (ρ=1) требуется для осаждения Ni2+ из раствора, содержащего 150 мг. NiCl2 (избыток осадителя 1,5%)? Ответ: 23,5 мл.
-
Сколько нужно раствора аммиака с массовой долей 2% для осаждения алюминия из раствора, в котором растворено 0,9556 г. алюмокалиевых квасцов? Ответ: 0,6 см3.
-
Сколько граммов раствора серной кислоты с массовой долей 5% для осаждения свинца из навески 0,5865 г. сплава с массовой долей свинца 12%? Ответ: 0,664 г.
-
Вычислить объем серной кислоты с массовой долей 10% для осаждения свинца из раствора, полученного растворением навески сплава 0,6856 г. с массовой долей свинца 15%.Ответ: 0,5 см3.
-
Вычислить обьем раствора Na2HPO4 с массовой долей 4% для осаждения магния в виде MgNHPO4 из раствора, содержащего 0,5228 г. MgSO4 · 7H2O.Ответ: 7,54 см3.
-
Вычислить объем раствора нитрата серебра с массовой долей 3,4% для осаждения хлорида из 200 см3раствора раствора NaCl с молярной концентрацией 0,01. Ответ: 10 см3.
-
Какой объем серной кислоты плотностью1,1 г/см3 требуется для осаждения бария из раствора 0,4880 г BaCl2 ∙ 2H2O.Ответ: 1,2см3.
-
Вычислить число молекул воды(х) в молекулах кристаллогидратов солей, указанных в таблице, если из навески кристаллогидрата массой m1 (г)получили m2 (г)гравиметрической формы
Вариант
Соль
m1(г)
Гравиметрическая форма
m2 (г)
1
2
3
4
5
6
7
8
9
10
BaCl2 ·xH2O
MgSO4 ·xH2O
Al2(SO4)3 ·H2O
CoSO4 ·x H2O
Cr2(SO4)3 ·xH2O
NH4Fe(SO4)2·xH2O
MnSO4 ·xH2O
CaCl2 ·xH2O
Na2SO4 ·xH2O
Ni(NO3)2 ·xH2O
0,3245
0,5520
0,7000
0,4800
0,8500
0,5020
0,3240
1,0000
0,4000
0,3000
BaSO4
Mg2P2O7
Al2O3
BaSO4
Cr2O3
Fe2O3
BaSO4
CaO
BaSO4
Ni(C4H7O2N2)2
0,3100
0,2492
0,1070
0,3985
0,1803
0,0831
0,3137
0,2560
0,3262
0,2980
Ответы: 1,2; 2,7;3,18;4,7;5,18;6,12;7,5;8,6;9,8;10,6
Титриметрический метод анализа ( объемный)
Способы выражения состава раствора.
КОНЦЕНТРАЦИЯ - это способ выражения количественного состава раствора. Различают следующие виды концентраций:
1. Массовая доля - это отношение массы растворенного вещества к массе раствора:
w = mв-ва / mр-ра ,
Часто массовую долю выражают в процентах. В этом случае говорят о процентной концентрации: w = mв-ва / mр-ра 100%. Смысл процентной концентрации заключается в том, что она равняется массе растворенного вещества в 100 г раствора.
2. Молярная концентрация - это количество вещества, содержащегося в 1 л раствора. Математическое выражение: 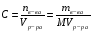 . Выражается в моль/л, удобная запись М
. Выражается в моль/л, удобная запись М
Моляльность - количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным.
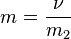 ,
,
где:
-
ν - количество растворённого вещества, моль;
-
m2 - масса растворителя, кг.
Следует обратить особое внимание, что, несмотря на сходство названий, молярная концентрация и моляльность - величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу растворителя, а не на объём раствора. Моляльность, в отличие от молярной концентрации, не зависит от температуры.
3. Мольная доля - отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
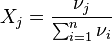 ,
,
где:
-
νi - количество i-го компонента, моль;
-
n - число компонентов;
4. Титр - масса вещества, г, содержащаяся в 1мл раствора - Т(г/мл).
Т = m / V
5. Молярная концентрация эквивалента (моль/л)- отношение количества вещества эквивалента в растворе к объёму этого раствора или количество молей эквивалента вещества в 1л раствора - С(f экв ( Х))
С(f экв Х ( Х)) = n экв/ V или
С(f экв Х ( Х)) = m / Мэкв(Х) V
Молярная масса эквивалента вещества равна произведению фактора эквивалентности fэкв(Х) на молярную массу вещества М(Х)
-
Мэкв(Х) = fэк(Х) • М(Х)
Эквивалент - это реальная или условная частица вещества, которая эквивалентна:
а) одному иону Н+ или ОН- в данной кислотно-основной реакции;
б) одному электрону в данной ОВР (окислительно-восстановительной реакции);
в) одной единице заряда в данной реакции обмена;
г) количеству монодентатных лигандов, участвующих в реакции
Химический эквивалент вещества непостоянен и зависит от типа химической реакции и конкретной реакции, поэтому всегда надо указывать, к какой именно реакции относится эквивалент.
Массу 1 эквивалента называют эквивалентной массой.
Эквивалент выражают в молях, эквивалентную массу - в г/моль. Число z, показывающее сколько химических эквивалентов содержится в структурной единице называется эквивалентным числом. Обратная ему величина является фактором эквивалентности fЭ(Х):
fэк(Х) = 1 / z
Фактор эквивалентности fэк(Х) - число, обозначающее какая доля реальной частицы вещества (Х) эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции.
Например, факторы (числа) эквивалентности H2SО3 (1), H2S (2) в различных реакциях:
1. а) в кислотно-основной:
H2SО3 + 2КОН = К2SО3 + 2Н2О fэкв.( H2SО3) = 1/2 , z = 2;
H2SО3 + КОН = КHSО3 + Н2О fэкв.( H2SО3) = 1, z = 1;
б) в окислительно-восстановительной:
H2SО3 + Cl2 + Н2О = H2SО4 + 2HCl;
SО3 2- + Н2O - 2e - = SО4 2- + 2H+ fэкв. ( H2SО3) = 1/2 , z = 2;
H2SО3 + 2Н2S = 3S + 3Н2О;
SО3 2- + 6H+ - 4e - = S + 3Н2O fэкв. ( H2SО3) = 1/4, z = 4;
2. а) в кислотно-основной:
H2S + NaOH = NaHS + H2O fэкв.= 1, z =1;
H2S + 2NaOH = Na2S + 2H2O fэкв.= 1/2, z =2;
б) в окислительно-восстановительной:
H2S + 4Cl2 + 4H2O = 8HCl + H2SO4;
H2S + 4H2O - 8е - = 10H+ + SO4 2- fэкв. = 1/8, z = 8;
2H2S + SO2 = 3S + 2H2O;
H2S + 4H2O - 2е - = 10H+ + SO4 2- fэкв. = 1/2, z =2
Молярная масса эквивалента вещества Х - (Мэ(Х)) - масса одного моля эквивалента этого вещества. Она равна произведению фактора эквивалентности на молярную массу вещества
Мэ(Х) = fэк(Х) M(Х) .
Закон эквивалентов.
Закон эквивалентов для растворов реагирующих веществ: объемы растворов реагирующих веществ обратно пропорциональны их молярным концентрациям эквивалентов:
С(f экв ( Х1)) V1 = С(f экв ( Х2)) V2,
где V1 и С(f экв ( Х1)) - объём и молярная концентрация эквивалента одного из реагирующих растворов;
V2 и С(f экв ( Х2)) - объём и молярная концентрация эквивалента второго раствора.
Задача 1. Вычислить массовую долю хлорида натрия в растворе, если 40 г его растворено в 280 мл воды.
Решение:
ω(NaCl) = 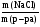
Масса раствора m(р-ра) = m(NaCl) + m(H2O)
m(H2O) = V(H2O)·ρ(H2O) = 280 мл ·1 г/мл = 280 г,
ω(NaCl) = 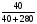 = 0,125 или 12,5%
= 0,125 или 12,5%
Ответ: ω(NaCl) = 0,125 или 12,5%.
Задача 2. Определите массу нитрата натрия и воды, необходимые для приготовления 800 г раствора с ω(NaNO3) = 12%.
Решение:
Масса растворенной соли:
m(NaNO3) = ω(NaNO3)·m(р-ра) = 0,12·800 = 96 г.
m(р-ра) = m(NaNO3) + m(H2O)
Отсюда
m(H2O) = m(р-ра) - m(NaNO3) = 800 - 96 = 704 г.
Ответ: m(NaNO3) = 96 г, m(H2O) = 704 г.
Задача 3. Определить массу раствора с массовой долей K2SO4 10%, который можно приготовить из 200 г воды и сульфата калия.
Решение:
m(р-ра) = 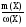
Из условия задачи m(K2SO4) неизвестна, но известна масса воды, а поскольку вода - один из компонентов раствора, то:
ω(Н2О) = 100% - ω(K2SO4) = 100 - 10 = 90%
m(р-ра) = 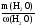 =
= 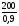 = 222,2 г.
= 222,2 г.
Ответ: можно приготовить 222,2 г раствора.
Задача 4. К 50 мл раствора H2SO4 (ω1 = 48%, ρ = 1,38 г/мл) добавили 950 мл воды. Определить массовую долю H2SO4 в полученном растворе.
Решение:
ω2(H2SO4) = 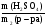
m2(р-ра) = m1(р-ра) + m(H2O)
m(H2O) = V(H2O)·ρ(H2O) = 950·1 = 950 г
m1(р-ра) = V1(р-ра)·ρ(р-ра) = 50·1,38 = 69 г
m1(H2SO4) = m1(р-ра) ω1(H2SO4) = 69·0,48 = 33,12г
ω2(H2SO4) = 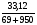 = 0,032 или 3,2%
= 0,032 или 3,2%
Ответ: ω(H2SO4) в новом растворе 0,032 или 3,2%.
Задача 5. Определить массовую долю HNO3 в растворе, полученном при смешивании 100 мл раствора с ω1(HNO3) = 10% (ρ1 = 1,05 г/мл) и 150 мл раствора с ω2(HNO3) = 20% (ρ2 = 1,12 г/мл).
Решение:
ω(HNO3) = 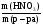 =
= 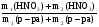
Находим
m1(р-ра) = V1(р-ра)·ρ1(р-ра) = 100·1,05 = 105 г
m2(р-ра) = V2(р-ра)·ρ2(р-ра) = 150·1,12 = 168 г
m1(HNO3) = m1(р-ра)·ω1(р-ра) = 105·0,1 = 10,5 г
m2(HNO3) = m2(р-ра)·ω2(р-ра) = 168·0,2 = 33,6 г
Рассчитываем
ω(HNO3) = 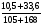 = 0,162 или 16,2%
= 0,162 или 16,2%
Ответ: массовая доля HNO3 в растворе после смешения равна 0,162 или 16,2%.
Задача 6. Какой объем воды необходимо добавить к 100 мл раствора азотной кислоты (ρ = 1,1 г/мл, ω1 = 20%), чтобы получить раствор HNO3 с ω2 = 5%?
Решение:
V(H2O) = 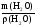
m(H2O) = m2(р-ра) - m1(р-ра)
m1(р-ра) = V1(р-ра)·ρ(р-ра) = 100·1,1 = 110 г
Масса искомого раствора определяется по формуле:
m2(р-ра) = 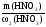
m(HNO3) = m1(р-ра)·ω1(р-ра) = 110·0,2 = 22 г.
Отсюда масса нового раствора:
m2(р-ра) = 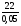 = 440 г
= 440 г
Масса и объем добавленной воды будут равны
m(H2O) = 440 - 110 = 330 г
V(H2O) = 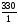 = 330 мл
= 330 мл
Ответ: следует добавить 330 мл воды.
Задача 7. Какой объем 96%ного раствора серной кислоты (r = 1.84 г/мл) потребуется для приготовления 200 г 25%ного раствора серной кислоты?
Решение:
а) 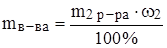
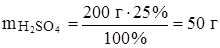
б) 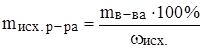
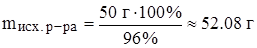
в) 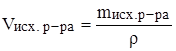
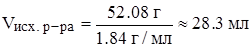
Задача 8. Вычислить молярную и молярную концентрации эквивалента 20%-ного раствора гидроксида натрия, плотность которого при н.у. равна 1,219 г/мл.
Решение:
1) Весовые проценты показывают число граммов растворённого вещества в 100г раствора, следовательно, исходя из условия задачи, в 100г раcтвора содержится 20г NaОН и 80г Н2О.
2) Рассчитаем объём NaOH:
V = 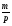 , где p - плотность V =
, где p - плотность V = 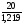 = 16,4(мл)
= 16,4(мл)
3) Рассчитаем объём раствора:
80 + 16,4 = 96,4(мл)
4) Рассчитаем молярную концентрацию раствора:
С = 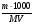 ; М(NaOH) = 40г/моль;
; М(NaOH) = 40г/моль;
С = 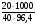 = 5,19 моль/л ( М)
= 5,19 моль/л ( М)
5) Рассчитаем молярную концентрацию эквивалента раствора
С(f экв (NaOH)) =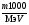 ;
;
Mэ(NaOH) = 40 г/моль; С(f экв (NaOH)) = 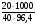 = 5,19 моль/л
= 5,19 моль/л
Ответ: С(f экв (NaOH)) = 5,19 моль/л, С = 5,19моль/л
Задача 9. Вычислите титр раствора, если в 25,00 мл содержится 0,5 г NaOH.
Решение:
Титр раствора находим по формуле:
m 0,5
T = ------ = ------- = 0,02 (г/мл)
V 25,00
Ответ: Т NaOH = 0,02 г/мл
Задача 10 . Какую массу навески фосфорной кислоты H3PO4 необходимо взять для приготовления 2 л 0,06 моль/л раствора H3PO4? Решение:
1. Вычислим молярную массу М (H3PO4) и молярную массу эквивалентаH3PO4 (Мэ H3PO4):
М( H3PO4 )= 1∙3 + 31 + 16∙4 = 98 (г/моль)
Мэ (H3PO4) = М(H3PO4)/3= 98/3 = 32,7 (г/моль)
2.Массу навески также можно рассчитать по формуле:
m = С(f экв (H3PO4)) ∙ Мэ(H3PO4) ∙ V= 0,06 моль/ л ∙32,7 (г/моль) ∙2 л = 3,92 г
Ответ: масса навески H3PO4 равна 3,92 г.
Задача 11. На реакцию 25мл 0,1237 моль/л. НCl израсходовано 23,42 мл раствора КОН. Вычислить молярную концентрацию эквивалента КОН.
Решение: Воспользуемся формулой
С(f экв (HCl)) V(HCl) = С(f экв (КОН)) V(КОН)
, отсюда выразим С(f экв (КОН) = С(f экв (HCl)) V(HCl /VКОН
С(f экв (КОН) =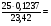 0,1320 моль/л
0,1320 моль/л
Задача 12. Навеска Ba(OH)2 растворена в мерной колбе на 250,00 мл. Объем раствора доведен до метки. На титрование 25,00 мл полученного раствора израсходовано 23,00 мл 0,09908 н. раствора HCl. Вычислите, сколько граммов Ba(OH)2 содержится в навеске.
Решение:
1. Составим уравнение реакции нейтрализации:
Ba(OH)2 + 2HCl = BaCl2 + 2Н2О
2. Вычислим молярную концентрацию эквивалента Ba(OH)2, используя закон эквивалентов:
С(f экв(HCl) ∙ V (HCl) 0,09908 ∙ 23,00
С(f экв(Ba(OH)2))= ----------------------------- = --------------- = 0,091 (моль/л)
V Ba(OH)2 25,00
3. Вычислим молярную массу Ba(OH)2 и молярную массу эквивалента Ba(OH)2
Мr Ba(OH)2 = 137 + (16 + 1) ∙ 2 = 171 (г/моль)
Мэ (Ba(OH)2) = М( Ba(OH)2 )/2 = 171/2 = 85,5 (г/моль)
4. Вычислим навеску Ba(OH)2 по формуле:
С(fэкв(Ba(OH)2)∙Мэкв (Ba(OH)2) ∙ V 0,091∙85,5∙250,00
m (Ba(OH)2) = --------------------------------------------------- = -----------------
1000 1000
= 1,95 (г)
Ответ: m (Ba(OH)2) = 1,95 (г)
Контрольные задачи:
-
Вычислить эквиваленты фосфорной ортокислоты Н3РО4 при образовании фосфата, гидрофосфата и дигидрофосфата натрия.
-
Сколько нужно взять гидроокиси калия, чтобы приготовить 500г 8% -ного раствора?
-
Сколько воды нужно взять для приготовления 2кг 5%-ного раствора?
-
Сколько нужно взять гидроокиси натрия и воды для того, чтобы приготовить 0,5л 20%-ного раствора?
-
Вычислить, какое количество 60%-ного раствора и воды потребуется для приготовления 5кг 10%-ного раствора?
-
Определите массу воды, которую надо добавить к 20 г раствора уксусной кислоты с массовой долей 70% для получения раствора уксуса с массовой долей 3 %.
-
Вычислите массовую долю азотной кислоты в растворе, полученном после добавления 20 г воды к 160 г её 5 % раствора.
-
Определите массу раствора 9% столового уксуса, который получают из 90 г 80% уксусной кислоты.
-
Сколько граммов воды надо добавить к 180 г сиропа, содержащего 25% сахара, чтобы получить сироп, концентрация которого равна 20%?
-
Рассчитать, сколько нужно взять воды и 100%-ной серной кислоты для получения 500г 10%-ного раствора?
-
Как приготовить 50г 10%-ного раствора серной кислоты, исходя из 96%-ной серной кислоты?
-
Сколько граммов кристаллической соды Na2CO3. 10H2O нужно взять, чтобы приготовить 2л 0,2М раствора
-
В 200 г воды растворили 6,37г MgCl2. Определить титр, моляльность, молярную концентрацию раствора и молярную концентрацию эквивалента.
-
Навеска соды массой 0, 5300 г растворена в мерной колбе на 100 мл. Определить титр и молярную концентрацию эквивалента концентрацию полученного раствора.
-
Сколько мл 0,1н. раствора серной кислоты потребуется для нейтрализации 40мл 0,15 моль раствора щёлочи?
-
Вычислить нормальную и молярную концентрации 30%-ного раствора серной кислоты, плотность которой равна 1,217г/мл.
-
Чему равна молярную концентрацию и молярную концентрацию экивалента и титр 40%-ного раствора СаСl2 плотностью 1,396г/мл?
-
Сколько мл 20%-ного раствора соляной кислоты потребуется для приготовления 3л 0,15 моль/л раствора?
-
Найти молярную концентрацию и молярную концентрацию экивалента Н2SO4 и Т Н2SO4 / СаО, если ТН2SO4 = 0,004852г/мл.
-
Сколько щавелевой кислоты Н2С2О4 2Н2О нужно взять для приготовления 100мл 0,15 моль/л раствора.
-
Сколько граммов КОН содержится в 200 мл 0,0900 моль/л раствора его? Ответ:1,032 г.
-
Сколько миллилитров 2,00 моль/л раствора HNO
 взять для приготовления 3л 0,1000 моль/л раствора? Ответ:150 мл.
взять для приготовления 3л 0,1000 моль/л раствора? Ответ:150 мл. -
Чему равна нормальность 40%-го раствора CaCl
 , плотностью 1,396 г/мл. Ответ:10 моль/л
, плотностью 1,396 г/мл. Ответ:10 моль/л -
Вычислить молярную концентрацию 10%-го раствора NH
 , плотностью 0,958 г/см
, плотностью 0,958 г/см . Ответ: 5,6 М
. Ответ: 5,6 М -
Сколько граммов H2SO4 содержится в 5 л раствора, если на титрование 25,00 мл этого раствора израсходовано 22,50 мл 0,0950 моль/л раствора КОН? Ответ: 20,97 г.
-
Сколько граммов Н
 РО
РО содержится в данном растворе, если на титрование его с фенолфталеином затрачено 25,50мл 0,2000 моль/л. раствора NaOH? Ответ: 0,2499 г.
содержится в данном растворе, если на титрование его с фенолфталеином затрачено 25,50мл 0,2000 моль/л. раствора NaOH? Ответ: 0,2499 г. -
До какого объема нужно довести раствор, в котором содержится 1,530 г NaOH, чтобы на титрование 20,00 мл раствора израсходовать 14,70 мл HCl (T
 =0,00380).
=0,00380). -
Сколько процентов HNO
 содержит концентрированная азотная кислота, если после растворения 9,7770 г в мерной колбе емкостью 1л на титрование 25,00мл 0,1040 моль/л раствора NaOH израсходовано 25,45 мл полученного раствора HNO
содержит концентрированная азотная кислота, если после растворения 9,7770 г в мерной колбе емкостью 1л на титрование 25,00мл 0,1040 моль/л раствора NaOH израсходовано 25,45 мл полученного раствора HNO ? Ответ: 68,85%.
? Ответ: 68,85%. -
Вычислить молярную концентрацию эквивалента и титр раствора КОН, если на титрование навески 0,1495г. Н
 C
C H
H O
O , растворенной в произвольном объеме воды израсходовано 25,20мл. его Ответ:0,1005 моль/л; 0,005637 г/мл.
, растворенной в произвольном объеме воды израсходовано 25,20мл. его Ответ:0,1005 моль/л; 0,005637 г/мл. -
Вычислить молярную концентрацию эквивалента и титр раствора H2SO4, если на титрование навески 50,00 мл раствора Na2CO3, полученного растворением навески его 0,5000г в мерной колбе емкостью 200мл, с метиловым оранжевым расходуется 24,00 мл раствора H2SO4. Ответ:0,09826 Н;0,004819 г/мл.
-
Какую навеску Na2CO3 нужно взять для установки по ней титра 0,1 моль/л раствора H2SO4 , если располагают мерной колбой емкостью 200мл и титрование будут вести с метиловым оранжевым? Ответ:0,53 г.
-
Навеску железной руды массой 0,2486 г растворили в кислоте, железо восстановили до Fe(II) и затем оттитровали 20,25 мл. Рассчитайте массовую долю (%) железа в руде. Ответ: 21,66%
-
Навеску 0,6000 г Н2С2О4·2Н2О растворили в мерной колбе емкостью 100 мл на титрование 20,00 мл полученного раствора израсходовано 18,34 мл NaOH. Определить молярную концентрацию эквивалента раствора NaOH и его титр по Н2С2О4. Ответ: 0,1038; 0,004673 г/мл
-
Для осаждения ионов железа (II), содержащихся в 20 мл раствора FeSO4, израсходовано 30 мл раствора гидроксида калия, С(KOH) = 0,3 моль/л. Определить молярную и молярную концентрацию эквивалента раствора сульфата железа (II).
-
Навеску 2,000 г неизвестного растворили в мерной колбе ёмкостью 100,00 мл. На титрование 25,00 мл раствора израсходовано 20,00 мл 0,4455 моль/л HCl. Определить что входило в состав анализируемого вещества: КОН или NaOH. Ответ: КОН.
-
Какую навеску негашеной извести, содержащей 90% СаО и 10% индифферентных примесей, требуется взять для анализа, чтобы на нейтрализацию её шло 20,00 мл раствора HCl с титром 0,007300? Ответ: 0,201 г.
-
Вычислите нормальную концентрацию и титр раствора H2SO4, если на титрование 50,00 мл раствора Na2CO3, полученного растворением 0,50 г Na2CO3 в мерной колбе объемом 200 мл, израсходовано 24,00 мл раствора H2SO4.
-
Сколько процентов железа содержится в руде, если на титрование раствора (полученного при растворении навески руды 0,2500г в HCl) израсходовано 28,00мл 0,09950 моль/л раствора KMnO4? Ответ:62,24%
-
Чему равна карбонатная жесткость воды, если на титрование 100мл её израсходовано 5,00мл 0,0900 моль/л раствора HCl. Ответ: 4,5 мг/экв
-
Навеску 0,3251 г технической гидроксида натрия растворили в мерной колбе ёмкостью 100,00 мл. На титрование 25,00 мл раствора фенолфталеином израсходовано 18,40 мл 0,1000 моль/л HCl, метиловым оранжевым 18,80 мл кислоты. Вычислить процентное содержание NaOH в образце
-
В каком объёме соляной кислоты HCl (T
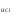 =0,003814 г/мл) нужно растворить навеску 0,1234 г CaCO
=0,003814 г/мл) нужно растворить навеску 0,1234 г CaCO , чтобы на титрование избытка кислоты израсходовать 19,50 мл раствора NaOH (T=0,002910 г/мл)?
, чтобы на титрование избытка кислоты израсходовать 19,50 мл раствора NaOH (T=0,002910 г/мл)? -
К 25 мл раствора Н2S прибавили 50,00 мл 0,01960 моль/л раствора J2 (fэкв=1/2) и избыток иода оттитровали 11,00 мл 0,02040 моль/л Na2S2O3 (fэкв=1). Вычислить концентрацию (г/л) Н2S в растворе.
-
Вычислить молярную концентрацию эквивалента и титр раствора HCl, если на титрование 0,4217 г буры израсходовано 17,50 мл этой кислоты?
-
К 25 мл раствора Н2S прибавили 50,00 мл 0,01960 моль/л раствора J2 (fэкв=1/2) и избыток иода оттитровали 11,00 мл 0,02040 моль/л. Na2S2O3 (fэкв=1). Вычислить концентрацию(г/л) Н2S в растворе.
-
На титрование раствора, содержащего 3,1580 г технического КОН, израсходовано 27,45 мл раствора HCl (T=0,07862 г/мл). Вычислить процентное содержание КОН в образце.
-
Сколько процентов железа содержится в руде, если на титрование раствора (полученного при растворении навески руды 0,2500 г в HCl) израсходовано 28,00 мл 0,09950 моль/л раствора KMnO4?
-
Витамин С (аскорбиновая кислота C6H8O6) определяют йодометрическим методом. Реакция идет по уравнению:
C6H8O6 + I2 = C6H6O6 + 2НI
в присутствии крахмала в качестве индикатора. На титрование 5,00 мл пробы раствора витамина С израсходован 1,00 мл 0,1 моль/л раствора I2 . Определите молярную концентрацию эквивалента аскорбиновой кислоты и титр раствора I2
-
Сколько граммов NaCl содержится в 250,00 мл раствора, если на титрование 10,00 мл этого раствора израсходовано 20,40 мл 0,05 моль/л раствора AgNO3? Составьте уравнение реакции, которое происходит при титровании
-
Рассчитайте содержание NaCl (мг/мл) в рассоле, если на титрование 30,00 мл рассола потребовалось 15,60 мл 0,1000М раствора AgNO3. Ответ: 3,04 мг/мл.
-
Для установления титра рабочего раствора трилона Б (ЭДТА) взяли 0,6252г обезвоженного CaCO3 и растворили в мерной колбе на 250,00 мл. На титрование 25,00 мл этого раствора израсходовали 12,23 мл раствора трилона Б. Определите молярную концентрацию эквивалента раствора трилона Б и его титр
ЛИТЕРАТУРА:
Основная:
-
Аналитическая химия: учебник для средних профессиональных учебных заведений / О.Е. Соенко. - Ростов - на -Дону: Феникс, 2009. - 309 с.
Дополнительная:
-
Барсукова З.А. Аналитическая химия, 1990.-320 с.
-
Васильев В.П. Аналитическая химия. - М. : Дрофа, 2002. - 703 с.
-
Васильев В.П Аналитическая химия. Сборник вопросов, упражнений и задач. - М. : Дрофа, 2003. - 320 с.
-
Воскресенский А.Г., Солодкин И.С., Семиколенов Г.Ф. Сборник задач и упражнений по аналитической химии, 1985.-173 с.
-
Глинка Н.Л. Общая химия, 1988. - 272 с.
-
Жванко Ю.Н., Панкратова Г.В., Мамедова З.И. Аналитическая химия и технохимический контроль в общественном питании. - М.: Высшая школа, 1988.-270 с.
-
Золотов Ю.А. Основы аналитической химии. - М. : Высшая школа, 2004. - 504 с.
-
Золотов Ю.А. Основы аналитической химии. Задачи и вопросы. - М. : Высшая школа, 2004. - 416 с.
-
Клещев Н.Ф. Задачник по аналитической химии. - М. : Химия, 1993. - 223 с
-
Лурье Ю. Ю. Справочник по аналитической химии / Ю. Ю. Лурье. - М.: Химия, 1989. - 448 с. Лурье Ю.Ю.Справочник по аналитической химии. М. : Химия, 1979. - 365 с.
-
Пилипенко А. Т. Аналитическая химия Т. 1-2 / А. Т. Пилипенко, И. В. Пятницкий. - М.: Химия, 1990. - Т. 1. - 479 с., Т. 2. - 845 с.
-
Хомченко И.Г. Общая химия. Сборник задач и упражнений, 2003. -256 с.
-
Шапиро С.А., Шапиро М.А. Аналитическая химия. - М.: Высшая школа, 1979
Приложение
Константы диссоциации слабых электролитов ( при 250 С)
Название электролита
Формула
Константа диссоциации
Азотистая кислота
НNO2
6,9·10-4
Муравьиная кислота
HCOOH
1,8·10-4
Сернистая кислота
H2SO4
6,2·10-4
Синильная кислота
HCN
5,0·10-10
Уксусная кислота
CH3COOH
1,74·10-5
Гидроксид аммония
NH4OH
1,76·10-5
Таблица произведения растворимости
Соединение
Значение ПР
AgBr
5.3·10-13
AgJ
8.3·10-17
AgCl
1.78·10-10
Ag3(PO4)2
1.3·10-20
BaCO3
4.0·10-10
BaSO4
1.1·10-10
CaCO3
3.8·10-9
CaSO4
2.5·10-5
CuCO3
2.5·10-10
CuS
6.3·10-36
Zn(OH)2
1.2·10-7
Fe(OH)2
1.6·10-15
42



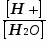 Областное государственное бюджетное профессиональное образовательное учреждение
Областное государственное бюджетное профессиональное образовательное учреждение 