- Преподавателю
- Химия
- Материалы конференции по химии и биологии на тему Вода
Материалы конференции по химии и биологии на тему Вода
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Демидова Н.И. |
| Дата | 01.01.2016 |
| Формат | doc |
| Изображения | Есть |
Демидова Надежда Ивановна
КГБ ПОУ «ПМК», г. Партизанск
КОНФЕРЕНЦИИ ПО ЕСТЕСТВОЗНАНИЮ
НА ТЕМУ: «ВОДА»
Цель: на примере воды показать проявление общих закономерностей природы с точки зрения химии, физики и биологии, т.е. естествознания.
Задачи:
-
рассмотреть это вещество и его строение с точки зрения физики, химии;
-
раскрыть сущность воды, ее значимость физических, химических свойств;
-
показать значение воды в жизни живого;
-
рассмотреть вопрос необходимости охраны воды;
-
продолжить воспитание бережного и экономного отношения к водным ресурсам;
-
продолжить развивать интерес учащихся к науке, активизировать их познавательную деятельность, формировать у них чувство прекрасного;
-
продолжить формировать умение выделять главное, находить ответы на поставленные вопросы.
План конференции
-
Химическая разминка:
- вступительное слово преподавателя
- стихотворение А.Фета «Ода воде»
- фронтальная беседа с аудиторией;
- миниатюра «Синтез воды».
-
Презентация «Ее величество - Вода»
- Вода вокруг нас. Круговорот воды в природе.
- Физические свойства воды.
- Четыре аномалии воды;
- Силы поверхностного натяжения.
- Вода с точки зрения химии.
- Роль воды в живых организмах.
- Водные ресурсы. Загрязнение воды.
- Викторина
-
Жесткость воды и методы ее устранения.
-
Презентация «Пословицы, поговорки и загадки о воде»
-
Презентация и дегустация «Минеральная вода»
-
Подведение итогов.
ХОД КОНФЕРЕНЦИИ
(Презентация «Ее величество -Вода»)
Сегодня мы с вами проводим урок в виде конференции. (Слайд 1) И мне бы хотелось начать со слов Леонардо да Винчи "Воде была дана волшебная власть стать соком жизни на Земле" (слайд 2, 3)
В кружево будто одеты
Деревья, кусты, провода
И кажется сказкою это,
А все это просто вода.
Безбрежная ширь океана
И тихая заводь пруда,
Каскад водопада и брызги фонтана,
А в сущности это вода.
Высокие волны вздымая,
Бушует морская вода,
И топит, и губит, играя
Большие морские суда
Вот белым легли покрывалом
На землю родную снега….
А время придет - все растает,
И будет простая вода!
Фронтальная беседа с аудиторией.
1. Кто и когда впервые осуществил синтез воды?
Ответ: А.Л.Лавуазье в 1783г.
2. Можно ли высушить бельё на морозе?
Ответ: Можно, т.к. лёд тоже испаряется.
3. В каком органе человека содержится наибольшее количество воды, а в каком наименьшее?
Ответ: Стекловидное тело глаза - 99% воды, зубная эмаль - 0,2% воды.
4. Почему стальная иголка не тонет, если её аккуратно положить на поверхность воды?
Ответ: Это объясняется силами поверхностного натяжения.
5. Назовите сезонные явления в жизни животных и растений, связанные с агрегатными состояниями воды.
Ответы:
- анабиоз-период зимнего покоя растений (гелеобразное состояние воды);
- морозобоины растений (вода в твёрдом состоянии), замерзание птиц зимой из-за недостатка корма и понижение температуры их тела (вода в твердом агрегатном состоянии - в виде льда);
- необходимость определённой влажности воздуха для дыхания и транспирации (испарение воды листьями) растений, для поддержания нормального дыхания животных (осушение воздуха в носовой полости) (вода в газообразном состоянии).
6. Аквариум, акватория, акваланг, аквапарк, «Бонаква». Понятно ли вам значение этих слов. Какое отношение они имеют к теме нашей конференции.
Ответ: «аква» - в переводе с лат. означает «вода»
Миниатюра «Синтез воды»
Древнегреческие философы принимали воду за простое вещество. Хотя некоторые представления о воде менялись, она считалась единым и неделимым веществом вплоть до конца XVIII в. Завершить многолетний гигантский марафон по изучению состава воды суждено было выдающемуся французскому химику А. Лавуазье и его коллеге, математику и физику П. Лапласу. В присутствии группы французских ученых 24 июня 1783 г. они синтезировали воду из водорода и кислорода. При этом масса образовавшейся воды была равна массе водорода и кислорода, участвующих в реакции. Вот так в один день стало ясно, что вода не простой элемент, а сложное вещество.
Лавуазье доверено,
Чтоб было все проверено,
С Лапласом выполнял эксперимент.
Все проанализировал,
Он воду синтезировал
И доказал: она не элемент.
Синтезировав воду, А. Лавуазье вскоре провел опыт по ее разложению: пропуская водяной пар над раскаленным железом, он получил водород и оксид металла.
Работы продолжение
Он видит в разложении
Воды в стволе, нагретом докрасна.
И это путь единственный,
Для утвержденья истины:
На газы разлагается она.
Итак, природа воды была раскрыта. Это выдающееся открытие сыграло исключительно важную роль в познании окружающей природы.
Из атомов мир создавала Природа
Два атома лёгких взяла Водорода,
Прибавила атом один кислорода,
И получилась частица Воды,
Море воды, Океаны и Льдины...
1. Вода вокруг нас. Круговорот воды в природе.
(слайд 4)
Ни на одной планете нет такого количества воды, как на Земле. Вода повсюду. Она и вокруг нас: в океанах и морях, реках и озерах, в дожде и снеге, в льдинах и водопроводных трубах, в питье и в пище. Она и в нас самих: мы на 2/3 сделаны из воды. Вода занимает 3/4 поверхности Земли. Около 1/5 суши покрыто твердой водой (льдом и снегом), добрая половина ее всегда закрыта облаками, которые состоят из водяных паров и мельчайших капелек воды, а там, где никаких облаков нет, в воздухе всегда есть водяные пары. Вся земная жизнь рождена водой и не может существовать без нее.
Круговорот воды. Если взглянуть на нашу планету из космоса, то ей больше подойдет название - планета Вода. (слайд 5)
Круговорот воды действует беспрерывно в трех основных географических объектах: океан - атмосфера - суша. С поверхности Мирового океана ежегодно испаряется 453 000 км3 воды. Осадки, выпадающие на Землю, составляют 525 000 км3. Превышение обусловлено испарением воды с других водных поверхностей и испарением влаги растениями.
Испаряющаяся вода, конденсируясь, образует облака и в виде осадков выпадает на поверхность Земли. Эти осадки поглощаются почвой, и в результате подземного и поверхностного стока воды вновь возвращаются в моря и океаны.
Круговорот воды - это хорошо отрегулированный механизм, который беспрерывно «качает» воду из океана на материк и обратно, при этом вода очищается.
Вероятно, мало кто из вас задумывался над удивительными свойствами воды, и это, пожалуй, понятно - ведь вода повсюду окружает нас, она очень обычна на нашей планете. Ну, а обычное никогда не кажется удивительным. Однако сама обыденность необычна. Ведь никакое другое вещество не встречается на Земле в таких количествах, да еще одновременно в трех состояниях: твердом, жидком и газообразном.
2. Физические свойства воды
(Слайд 6, 7)
Удельная теплоемкость воды = 4200 Дж/(кг•°С). Из-за исключительной способности воды поглощать тепло температура ее при нагревании и охлаждении изменяется незначительно, поэтому морским обитателям не угрожает ни сильный перегрев, ни чрезмерное охлаждение. Большая удельная теплоемкость воды определяет климат планеты. Вода нагревается значительно медленнее суши, забирая большое количество солнечного тепла. Полученное тепло она сохраняет дольше, чем воздух и земля, выполняя при этом терморегулирующую функцию. На этом свойстве воды, кстати, основан и принцип обогрева жилых помещений при движении горячей воды по батареям отопительной системы.
Удельная теплота парообразования воды. = .300 000 Дж/кг. Парообразование воды тоже ее терморегулирующее свойство. Например, если бы человек не потел при физической работе, он бы перегрелся. Пот, основой которого является вода, при испарении понижает температуру тела.
Удельная теплота плавления льда при 0 °С и давлении 760 мм рт. ст. составляет 334 000 Дж/кг. Из распространенных на Земле металлов только алюминий, железо и медь имеют удельную теплоту плавления выше 200 000 Дж/кг (при соответствующих температурах плавления). Таким образом, замерзая, вода выделяет тепло и согревает окружающий воздух. Это свойство воды также играет немаловажную роль в формировании климата планеты Земля. Замерзание воды в реках, озерах, морях в то же время не позволяет переохлаждаться воздуху в данной местности. Часто можно наблюдать, как птицы в сильный мороз греются, сидя на льду.
3. Четыре аномалии воды
(слайд 8, 9)
Вода - поразительная жидкость - у нее есть аномалии. Для воды, будто законы не писаны! Но, благодаря ее капризам, не могла бы родиться и развиваться жизнь.
Первая аномалия: воде по ее химической структуре положено плавиться и кипеть при низких температурах, которых на Земле не бывает. Не было бы, значит, на Земле ни твердой, ни жидкой воды. А был бы один пар. А она кипит при 100? С.
Вторая аномалия: высокая теплоемкость. У воды она в 10 раз больше, чем у железа. Из-за исключительной способности воды поглощать тепло температура при ее нагревании и охлаждении изменяется незначительно, поэтому морским обитателям никогда не угрожает ни сильный перегрев, ни чрезмерное охлаждение.
Третья аномалия: у воды очень высокая удельная теплота парообразования. Если бы у воды не было этого свойства, многие озера и реки летом быстро бы пересохли до дна, и вся жизнь в них погибла.
Четвертая аномалия: замерзая, вода расширяется на 9% по отношению к прежнему объему. Поэтому лед всегда легче незамерзшей воды и всплывает вверх. Под такой "шубой" даже зимой в Арктике морским животным не очень холодно.
Все вещества, когда их нагревают, расширяются, а при охлаждении сжимаются. Вода тоже сжимается, пока температура падает, но при +4оС наступает предел. Тут она снова начинает расширяться, хотя температура продолжает понижаться. Поэтому самой плотной и тяжелой вода бывает при +4оС. Зимой, охладившись до +4оС, она опускается на дно. Вот почему на дне пруда, озера, реки под слоем льда сравнительно тепло и обитатели водоемов имеют возможность жить.
4. Сила поверхностного натяжения
Первый взгляд на чай, налитый в чашку, подтверждает известное положение, что жидкость своей формы не имеет, а принимает форму сосуда, в который она налита.
(Слайд 10)
Возьмем пробирку, наполненную водой. Перевернём на книгу или открытку и будем постепенно вытаскивать открытку. Ни одна капля не пролилась, зато поверхность воды вздулась, образовав "горку".
Все системы стремятся уменьшить свою энергию. Точно так же сила поверхностного натяжения стремится сократить до минимума площадь поверхности жидкости. Из всех геометрических форм шар обладает при данном объеме наименьшей поверхностью. Так что собственная форма жидкости - шар. Большое количество жидкости не может сохранить шарообразную форму: она изменяется под действием силы тяжести. Если устранить действие силы тяжести, то под действием молекулярных сил жидкость примет форму шара.
Если взять смесь воды и спирта и поместить в нее каплю жидкого масла, то в какой-то момент сила тяжести уравновесится силой Архимеда и образуется масляный шар, свободно покоящийся в смеси. Этот шар от разлета по молекулам удерживает сила поверхностного натяжения.
Роль поверхностного натяжения в жизни очень разнообразна. Например, существуют целые виды мелких насекомых и паукообразных, передвигающихся за счет поверхностного натяжения. Наиболее известны водомерки, которые опираются на воду кончиками лапок. Сама же лапка покрыта водоотталкивающим налетом. Поверхностный слой воды прогибается под давлением лапки, но за счет силы поверхностного натяжения водомерка остается на поверхности.
(слайд 11)
Мы только что говорили, что в обычных сосудах вода принимает горизонтальную поверхность. Однако и здесь требуется поправка. Приглядитесь внимательнее, и вы заметите, что у краев поверхность жидкости приподнята и образует вогнутую форму. Это - тоже следствие поверхностного натяжения. Молекулы жидкости взаимодействуют между собой и с молекулами сосуда. В зависимости от того, какая из этих сил больше, будет наблюдаться явление смачивания (вогнутая поверхности) или не смачивания (выпуклая форма). Благодаря капиллярным явлениям влага поднимается, и растения имеют возможность питаться
5. Воды с точки зрения химии
(слайд 12 - 18)
Необычные свойства воды объясняются ее строением. Молекула воды - уголковая - угол между связями Н-О-Н равен 104° 27` . (слайд 12) В молекуле воды имеются две полярные ковалентные связи Н - О:

Они образованы за счет перекрывания двух одноэлектронных S-облаков двух атомов водорода.
В молекуле имеются четыре полюса зарядов: два - положительные и два отрицательные. (слайд 13) Положительные заряды сосредоточены у атомов водорода, так как кислород электроотрицательнее водорода. Два отрицательных полюса приходятся на две электронные пары кислорода, таким образом молекула воды является диполем:
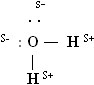
Подобное представление о строении молекулы воды позволяет объяснить многие свойства воды, в частности структуру льда (слайд 14). В кристаллической решетке льда каждая из молекул окружена четырьмя другими. В плоскостном изображении это можно представить так:
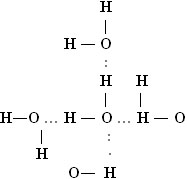
На схеме видно, что связь между молекулами осуществляется посредством атома водорода (слайд 15).
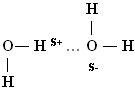
Положительно заряженный атом водорода одной молекулы воды притягивается к отрицательно заряженному атому кислорода другой молекулы воды. Такая связь получила название водородной. По прочности водородная связь примерно в 15-20 раз слабее ковалентной связи. Поэтому водородная связь легко разрывается, что наблюдается, например, при испарении воды. Структура жидкой воды напоминает структуру льда. В жидкой воде молекулы также связаны друг с другом посредством водородных связей. Однако структура воды менее «жесткая», чем льда. Вследствие теплового движения молекул в воде одни водородные связи разрываются, другие образуются. В силу высокой полярности молекул Н2О вода является растворителем других полярных соединений, не имея себе равных.
Свойства и строение воды во многом определяют различные особенности растворов. Прежде всего, выясним, что такое раствор. (слайд 16) Как взаимодействует растворенное вещество и растворитель? Растворяемое вещество в растворе распадается на ионы. Как ведут себя ионы в растворе, долгое время оставалось неясным. В конце ХIХ века (1889-1990 гг.) И.А. Каблуков и, почти одновременно с ним, В.А. Кистяковский пришли к выводу, что ионы движутся не одни, а увлекают с собой некоторое количество воды и чем меньше радиус иона, тем большее количество воды ион может удерживать вокруг себя (слайд 17) . Такое явление стало называться гидратацией. Гидратированый ион окружен молекулами воды. Эта блестящая идея пролила свет на многие вопросы. Оказалось, что вода сама вступает во взаимодействие с растворенным веществом. По растворимости в воде все вещества делятся на гидрофильные, хорошо растворимые в воде, например, кислоты, щелочи, соли и гидрофобные - трудно или вообще не растворимые в воде - это жиры, жироподобные вещества и каучуки (слайд 18). В воде протекают многие реакции, как химические, так и биохимические.
6. Роль воды в живых организмах
(слайд 19- 22)
Вода нужна для нашего организма как растворитель питательных веществ, и как переносчик их, и как среда, в которой протекают различные процессы, связанные с нашей жизнедеятельностью. Выделяясь потовыми железами и испаряясь с поверхности кожи, вода регулирует температуру нашего тела. Кроме того, вода необходима для удаления из организма различных вредных веществ, образующихся в результате обмена. Содержание воды в отдельных органах и тканях тела почти постоянно.
Питательные вещества попадают в кровь через стенки пищеварительного канала. Через эти стенки могут проникать только вещества, растворенные в воде, только жидкости. Если бы кусок сахара не растворился в слюне и в желудочном соке, глюкоза не попала бы в кровь. Белок яйца, крахмал хлеба и картофеля не растворяются в воде, но желудочный и кишечный соки содержат особые вещества - ферменты, которые расщепляют белок и крахмал и переводят их в вещества растворимые. Это расщепление идет только в воде. Кровь, состоящая на четыре пятых из воды, разносит питательные вещества по всему организму.
Ни одно живое существо не может жить в абсолютно сухом пространстве и не может оставаться живым, лишившись воды. Каждый организм может потерять только вполне определенную часть содержащейся в нем воды. У человека потеря 10% воды вызывает целый ряд расстройств, а потеря 20% воды - смерть. Некоторые животные менее чувствительны к потере воды. Какое бы животное или растение мы ни взяли, в него входит вода как одна из главных составных частей. Обитатели водоемов, как правило, содержат в себе больше воды, чем жители суши. В теле рыб, например, до 70-80% воды, а в медузе - больше 95%. В травянистых растениях суши процент воды доходит до 85%. Организмы млекопитающих животных и человека содержат воды меньше. (слайд 21)
Но нельзя забывать, что в истории нашей планеты вода имеет исключительное значение. Пожалуй, никакое другое вещество не может сравниться с водой по своему влиянию на ход тех величайших изменений, которые претерпела Земля за многие сотни миллионов лет своего существования. Там, где есть жизнь, всегда есть вода. Жизнь без воды невозможна (слайд 22)
7. Водные ресурсы. Загрязнение воды.
(слайд 23 - 26)
Соленая и пресная вода составляют водные ресурсы Земли. Причем 97,2% от общего запаса (1345 млн км3) приходится на воды Мировою океана. Понятно, что на долю пресной воды остается 2,8 %, но если исключить полярные ледники, пока еще недоступные для использования, то, увы, приходится констатировать, что практически можно использовать лишь 0,3 % воды.
Теоретически можно считать водные ресурсы неисчерпаемыми, если принять, что при их рациональном использовании они непрерывно возобновляются в процессе круговорота. Вместе с тем потребление воды увеличивается, так как она служит одним из главных видов сырья для промышленности. Ее в огромных количествах используют в качестве теплоносителя и теряют в процессе охлаждения и подогрева.
В металлургии для выплавки I т чугуна и переплавки его в сталь требуется 300 т воды, для получения 1 т меди - 500 т, 1 т никеля - 4000 т воды (слайд 23).
Одним из главных потребителей воды является производство синтетических материалов. Для получения I т синтетического каучука требуется 2100 т воды, лавсана - 4200 т, капрона - 5600 т.. Для изготовления автомобиля нужно 246 т воды, а для запуска межконтинентальной баллистической ракеты - почти 190 000 т!
На производство I т бумаги требуется 250 т воды (слайд 24):
Еще больше воды расходуется в сельском хозяйстве на нужды животноводства и растениеводства. Потребность в воде жителя крупного города (без учета гигиенических нужд) составляет 35 л в сутки (рис. 7.1), но из-за нерационального ее использования, потерь при транспортировке к потребителю, неисправности оборудования в квартирах она увеличивается до 700 л. Запасы пресной воды в зонах интенсивной хозяйственной деятельности и проживания большинства людей становятся недостаточными, поэтому уже сейчас необходимо думать о ее сбережении
Огромное значение воды и важность проблем, связанных с ее загрязнением ни у кого не вызывает сомнений.
Причины нехватки пресной воды заключаются в (слайд 25)
-
Увеличении численности населения.
-
Развитии промышленности.
-
Загрязнении водоемов промышленными и бытовыми стоками.
Потребление воды только в прошлом веке возросло в 7 раз и в настоящее время составляет около 3,5 тыс.км3 в год и с каждым годом все возрастает. Растет загрязнение рек промышленными и бытовыми отходами. Промышленность ежегодно загрязняет 10% речных вод. Ежегодно в море вытекает около миллиона тонн нефти из буровых вышек, портов, промышленных предприятий и т.д. Чтобы обеспечить самоочищение загрязненных вод, необходимо их многократное разбавление чистой водой.
Наиболее простые способы очистки это осаждение, разбавление, отстаивание и фильтрование (слайд 26) .
Способов воспроизводства в больших объемах воды не существует, не существует также и заменителей воды, поэтому необходимо обращаться с самым ценным природным ресурсом с величайшей осторожностью.
Значение проблемы воды для здоровья человека в современном мире подчёркнуто тем, что ООН объявила Международным нынешнее десятилетие обеспечения доброкачественной питьевой водой населения.
Океан седой гремит набатно (слайд 27-28),
Он таит обиду в глубине,
Черные раскачивая пятна.
На крутой разгневанной волне
Стали люди сильными, как боги.
И судьба Земли у них в руках.
Но темнеют страшные ожоги
У земного шара на боках.
Мы давно "освоили" планету.
Широко шагает новый век.
На Земле уж белых пятен нету.
Черные сотрешь ли, человек? (А. Плотников)
(слайд 29) «Вода! Вода, у тебя нет ни вкуса, ни цвета, ни запаха, тебя невозможно описать, тобой наслаждаются, не ведая, что ты такое. Нельзя сказать, что ты необходима для жизни; ты - сама жизнь. Ты наполняешь нас радостью, которую не объяснить нашими чувствами. Ты самое большое богатство на свете..» - эти слова, послужившие эпиграфом к нашему уроку, написал Антуан де Сент Экзюпери, чудом избежавший смерти от жажды в раскаленной пустыне.
Викторина (Слайд 30, 31)
-
Какое греческое название воды?
-
Какое латинское название воды?
-
При какой температуре плотность воды наибольшая?
-
Главное хранилище пресной воды на планете.
-
Сколько процентов от массы человеческого тела составляет вода?
III. Жесткость воды и методы ее устранения
Жесткость воды. Для потребителя важен такой показатель воды, как жесткость. Вода считается жесткой, если она содержат катионы кальция и магния. Понятно, что наличие этих катионов в воде обусловлено присутствием растворимых соединений кальция и магния, например солей (хлоридов, нитратов, сульфатов) или гидроксидов (гидроксид кальция малорастворим в воде - это хорошо известная вам известковая вода). В жесткой воде мыло не мылится, белье после стирки становится грубым, волосы после мытья секутся. Все дело в том, что мыла представляют собой натриевые (твердые) или калиевые (жидкие) соли жирных кислот, общую формулу которых можно условно записать так: RCOONa и RCOOK. Как и все калиевые и натриевые соли, мыла растворимы в воде и диссоциируют:
RCOONa ↔ RCOO- + Na +
чего не скажешь об аналогичных солях кальция и магния. И до тех пор, пока все ионы Са2+ и Мg2+ не будут переведены с помощью мыла в осадок, оно мылить, т.е. стирать и мыть, не будет:
2RСОО- + Са2+ = (RСОО)2Са↓
В жесткой воде мясо и крупы плохо развариваются.
Неприятности, которые приносит человеку жесткая вода, этим не исчерпываются. Загляните внутрь чайника или, если в вашем доме или квартире делают капитальный ремонт, в разрез трубы центрального отопления. Что наблюдаете? Белый, сероватый или рыжеватый рыхлый слой накипи. Оказывается, не только средние растворимые соли кальция и магния являются причиной жесткости воды, но и особая группа солей, которые называют кислыми.
Кислыми, как вы знаете, называют соли, которые можно рассматривать как продукты неполного замещения катионов водорода в кислоте на катионы металлов.
Свойства средних и кислых солей одной кислоты различны. Например, средняя кальциевая соль угольной кислоты (карбонат кальция) СаС03 в воде нерастворима, а кислая соль - гидрокарбонат кальция Са(НС03)2, наоборот, хорошо растворима, что и обусловливает жесткость воды. Именно такие соли при разложении и образуют накинь в чайниках, трубах центрального отопления, паровых котлах и т.д.:
Са(НС03)2 = СаС03↓ + С02↑ + Н20
Жесткость воды, обусловленную содержанием в ней гидрокарбонатов кальция и магния и устраняемую кипячением, называют временной. Жесткость воды, обусловленную содержанием в ней других соединений кальция и магния и кипячением не устраняемую, называют постоянной.
И временная, и постоянная жесткость воды легко устраняются добавлением соды:
СаС12 + Na2С03 = СаСОэ↓ + 2NaС1
Са2+ + С032- = СаС03↓
(Теперь вы поняли, почему соду называют стиральной!)
Самая жесткая природная вода - это вода морская. Общее среднее содержание солей в Мировом океане составляет 35 г на 1 л.
Самая мягкая природная вода - дождевая и талая; содержание солей здесь близко к нулю.
Самая мягкая искусственная вода - дистиллированная. Казалось бы, дистиллированная вода наиболее полезна для организма. Однако ее использование нежелательно и даже вредно, так как она «вымывает» из организма человека необходимые ему минеральные соли. Эти соли поступают в организм с пищей и напитками, в том числе с минеральной водой, природной или искусственной.
IV. Презентация «Пословицы, поговорки и загадки о воде»
Трудно сказать, с каких времен среди народа начали ходить пословицы - устные краткие изречения на самые разные темы. Неизвестно и время возникновения первых поговорок - метких речений, которые способны в разговоре выразительно и точно охарактеризовать что-либо без утомительных и сложных пояснений (Презентация «Пословицы, поговорки и загадки о воде»)
Неоспоримо одно: и пословицы, и поговорки возникли в отдаленной древности и с той поры сопутствуют народу на всем протяжении его истории. Особые свойства сделали пословицы и поговорки столь стойкими и необходимыми в быту и речи. Проанализируем словарь русских поговорок и пословиц Жукова, а в нём более 1200 пословиц и поговорок. О воде больше всего, а именно 43.
Пословица не простое изречение. Она выражает мнение народа. В ней заключена народная оценка жизни, наблюдения народного ума. Не всякое изречение становилось пословицей, а только такое, которое согласовывалось с образом жизни и мыслями множества людей. Подобные изречения могут существовать очень долго, переходя из века в век вместе со своим народом.
За каждой из пословиц стоит авторитет поколений, их создавших. Поэтому пословицы не спорят, не доказывают - они просто утверждают или отрицают что-либо в уверенности, что все сказанное в них - твердая истина.
Прислушайтесь, как категорично и твердо звучат они:
- «Лучше хлеб с водою, чем пирог с бедою»,
- «В худом котле вода не держится»,
- «Чтобы выучиться плавать, надо лезть в воду»
«Под лежачий камень вода не течет» - обозначает, что ленивый человек не добьется успеха. Эту пословицу говорят, когда хотят подтолкнуть себя или другого человека к активности, к делу.
«Кручиной моря не переехать»,- говорит пословица, и в ней слышится отвага бывалого человека.
«Тяп-ляп - вот и корабль» - пословица высмеяла скорую, но необдуманную работу.
- «Носить воду решетом» - означает «делать что-либо впустую, без результата».
ПОСЛОВИЦЫ И ПОГОВОРКИ О ВОДЕ.
-
Не зная броду, не суйся в воду.
-
Водки не пьет, с воды пьян живет.
-
Истина в вине, здоровье - в воде.
-
Простор богатому как щуке в воде.
-
Вола зовут в гости не мед пить - воду возить.
-
От жара и вода кипит.
-
Под лежачий камень вода не течет.
-
Воды жалеть - кашу не сварить.
-
Воду толочь - вода и будет.
-
Что с гуся вода.
-
Наша правда в воде не тонет, в огне не горит.
-
Под водой и на воде враг не спрячется нигде.
-
Возле огня обожжешься, возле воды намочишься.
-
От огня и вода ключом бьет.
-
Где много воды, там больше будет денег.
-
По которой реке плыть, ту и воду пить.
-
Апрель с водой, а май с травой.
-
В тихой воде омуты глубоки.
-
Много воды утекло с тех пор.
-
Чтобы выучиться плавать, надо лезть в воду.
-
Где воды не было, там сухо.
-
Водой мельница стоит, да от воды же и погибает.
-
Вода свое возьмет.
-
Вода путь найдет.
ЗАГАДКИ О ВОДЕ
-
Очень добродушная,
Я мягкая, послушная,
Но когда я захочу,
Даже камень источу.
-
Течет, течет - не вытечет,
Бежит, бежит - не выбежит.
-
Летом бежит, а зимой стоит.
-
Зимой - спит, а летом - шумит.
И в заключение можно сказать, что пословицы и поговорки делают нашу речь краше и интереснее, но мы не поняли бы пословицы и поговорки, если бы не приняли во внимание их особую связь с речью.
V. Минеральная вода. Презентация и дегустация.
(Презентация «Минеральная вода»)
Минеральная вода - вода, содержащая биологически активные минеральные и органические компоненты, обладающая специфическими физико-химическими свойствами, которые оказывают лечебное воздействие на организм человека.
Минеральные воды чаще всего бывают подземными, реже - поверхностными. Подземные воды подразделяются на лечебно-столовые, лечебные и столовые.
Информационная справка
Минералка - это дождевая вода, которая много столетий или даже тысячелетий назад ушла глубоко в землю, просачиваясь сквозь расщелины и поры разных слоев породы. При этом в ней растворялись различные минеральные вещества, находящиеся в породе. От просто природной воды из подпочвенных источников и открытых водоемов минеральные воды отличаются составом. Чем глубже они залегают, тем они теплее и богаче углекислотой и минеральными веществами. Кроме того, чем глубже проникает в породу вода, тем больше она очищается. Различные слои почвы служат своеобразным фильтром.
Изучением минеральных вод и их полезных свойств занимается наука бальнеология.
Классификация минеральных вод с точки зрения бальнеологии:
-
Столовые минеральные воды - минерализация до 1 г/л
-
Лечебно-столовые минеральные воды - минерализация от 1 до 10 г/л
-
Лечебные минеральные воды - минерализация более 10 г/л или высокое содержание биологически активных элементов: железа, брома, йода, сероводорода, фтора и т.д., при этом общая минерализация может быть невысокой.
Классификация минеральных вод по химическому составу:
-
Гидрокарбонатные минеральные воды
-
Хлоридные минеральные воды
-
Сульфатные минеральные воды
-
Натриевые минеральные воды
-
Кальциевые минеральные воды
-
Магниевые минеральные воды
Большинство минеральных вод имеет смешанный состав, что повышает лечебный эффект при их применении.
Классификация минеральных вод в зависимости от газового состава и наличия специфических элементов:
-
Углекислые (кислые) минеральные воды
-
Сульфидные (сероводородные) минеральные воды
-
Бромистые минеральные воды
-
Йодистые минеральные воды
-
Мышьяковистые минеральные воды
-
Радиоактивные (радоновые) минеральные воды
Ориентировочно минеральная вода должна содержать:
-
гидрокарбоната - свыше 600 мг/л,
-
сульфата - свыше 200 мг/л,
-
хлорида - свыше 200 мг/л,
-
кальция - свыше 150 мг/л,
-
натрия - свыше 200 мг/л,
-
магния - свыше 50 мг/л,
-
фторида - свыше 1 мг/л,
-
двухвалентного железа - свыше 1 мг/л.
Натуральные минеральные воды считаются кислыми, если содержат более 250 мг/л углекислоты.
Применение минеральных природных вод позволяет достичь уникальных результатов, ведь в них содержится богатейший состав солей и микроэлементов, которых так не хватает нашему организму. Воздействие минеральных вод очень разнообразно и затрагивает все органы и системы.
Причем, каждая лечебная минеральная вода имеет свою группу показаний и противопоказаний. Многие хронические заболевания, плохо поддающиеся лекарственной терапии, успешно лечатся на бальнеологических курортах.
Минеральные воды оцениваются по следующим показателям:
-
газовому составу и степени газонасыщенности,
-
содержанию биоактивных элементов и органических веществ,
-
радиоактивности,
-
минерализации,
-
ионному составу,
-
температуре,
-
активной реакции воды (рН).
Минеральные воды применяются наружно в виде ванн (газовых и минеральных), а также внутрь для лечения и профилактики.
Основные группы минеральных вод
1. Углекислые
2. Сероводородные
3. Железистые
4. Бромные, йодные и йодобромные
5. Кремнистые термальные
6. Мышьяксодержащие
7. Радоновые (радиоактивные)
8. Борсодержащие
9. Воды, обогащенные органическим веществом
Каждая из групп минеральных вод подразделяется на классы и подклассы по соотношению основных компонентов ионного и солевого состава: анионы: бикарбонаты НСО3- , карбонаты СО32- , сульфаты SO42- , хлориды CI-., катионы: кальций Са2+ , магний Мg 2+ , натрий Na+, калий К+.
Казалось бы, что может быть проще - минералы и газы, растворенные в воде. Тем не менее, подобным сочетанием лечат множество болезней - наружных и внутренних. Эффект после комплексного лечения минеральными ваннами отмечали еще медики древности, которые рекомендовали «взять ванну» чуть ли не от любой болезни. Секрет удивительной эффективности минеральной воды в ее направленном воздействии на организм человека. Минеральные воды содержат в повышенных концентрациях минеральные и органические компоненты, благодаря чему оказывают благоприятное воздействие на организм человека. Каждая составляющая такой природной воды, будь то микроэлемент или растворенный газ, влияет определенным образом на различные биологические механизмы.
Минеральные воды применяются при многих заболеваниях с учетом фазы болезни, кислотности желудочного сока, а также количества, времени приема и температуры воды. В противном случае можно получить действие, обратное лечебному.
И помните - минеральными водами не утоляют жажду, но постоянный прием может привести к нарушению кислотно-щелочного равновесия в организме и отложению камней в почках, печени, желчном пузыре и поджелудочной железе.
Что общего у "Бон аквы" и "Боржоми"? Практически ничего. Это все природная минеральная вода, первая относится к так называемым столовым водам, пить которые можно всем и сколько душе угодно. Вторая - к лечебно-столовым, перебарщивать с которой нельзя. А ведь есть и сугубо лечебные минеральные воды, являющимися разновидностями минералки. И пить их нужно с умом, а то можно запросто заработать какую-нибудь болезнь.
Как правильно лечиться?
Самостоятельно лечиться минеральной водой нельзя? Сначала проконсультируйтесь у специалиста. Если же этого не сделать, то исход будет традиционно русским: хотели как лучше, а получилось... Проще говоря, вместо одного заболевания получите два. Это связано с тем, что в минералке содержится большое количество солей. Поэтому нельзя долгое время пить воду одной и той же марки. Поскольку каждая ее разновидность имеет постоянный состав солей, может произойти перенасыщение организма этими веществами. Несмотря на свои высокие лечебные свойства, минеральную воду некоторым людям и вовсе нельзя пить.
VI. Подводятся итоги работы конференции.
VIII. Литература
-
Габриелян, О.С. Химия: учеб. для студ. учреждений сред. проф.образования/ О.С. Габриелян, И.Г. Остроумов.- М.: Издат.центр «Академия», 2011.- 336 с.
-
Габриелян, О.С. Биология: учеб. для студ. учреждений сред. проф. образования/ О.С. Габриелян, И.Г. Остроумов.- М.: Издат.центр «Академия», 2011.- 336 с.
-
Габриелян, О.С. Химия.11 класс. Базовый уровень: учебн./ О.С. Габриелян.- М.: Дрофа, 2011.- 223 с.
При составлении урока использовался материал с сайта: Фестиваль «Открытый урок 2010/2011», урок-конференция «Вода, вода - кругом вода».


