- Преподавателю
- Химия
- Урок по теме «Кислород — химический элемент и простое вещество. Получение кислорода»
Урок по теме «Кислород — химический элемент и простое вещество. Получение кислорода»
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Мухамеджанова Л.Ф. |
| Дата | 01.03.2014 |
| Формат | doc |
| Изображения | Есть |
Урок по теме "Кислород - химический элемент и простое вещество. Получение кислорода"
Цель:
Систематизация и расширение знаний учащихся о химическом элементе кислороде и простых веществах - кислороде и озоне, их нахождение в природе; усвоение понятий "аллотропия" и "аллотропные модификации"; знакомство с историей открытия простого вещества - кислород и способы его лабораторного получения и собирания; формирование представлений о катализаторах.
Задачи урока:
Обучающие: обеспечить усвоение учащимися теорий, законов, понятий, фактов, признаков, особенностей и т.д.; повторить, систематизировать, обобщить знания; сформировать умения, навыки; устранить пробелы в знаниях.
Воспитательные: формирование у учащихся таких черт характера, как трудолюбие, гуманность, дисциплинированность, ответственность, аккуратность, положительное отношение к учёбе.
Развивающие: развитие у учащихся умения анализировать, сравнивать, обобщать учебный материал; развитие познавательных умений - слушать, выделять главное, составлять план, тезисы, конспекты, делать опыты, наблюдать, ставить проблемы и решать их, выдвигать гипотезы и т.д.
Основные вопросы.
-
Характеристика элемента кислорода.
-
Кислород - простое вещество.
-
История открытия кислорода.
-
Способы получения и собирания кислорода. Понятие о катализаторах.
Основные понятия:
химический элемент кислород, аллотропия, аллотропные модификации, простые вещества - кислород и озон; катализаторы.
УУД:
Личностные УУД:
-
мысленное воспроизведение картины, ситуации;
Регулятивные УУД:
-
Поиск информации в предложенных источниках;
Коммуникативные УУД:
-
Групповая работа;
-
«отгадай, о чем говорим»;
Познавательные УУД:
-
Составление схем-опор;
-
Работа с разного вида таблицами.
Планируемые результаты.
Предметные: Формирование системы знаний о химическом элементе кислороде, его распространенности и роли в природе.
Усвоение понятий "аллотропия", "аллотропные модификации" при сравнении состава, строения, свойств, изучение роли в природе и жизни человека кислорода и озона.
Личностные: Развитие научного мышления учащихся при формировании умений находить причинно-следственные связи, сравнивать химические объекты и давать им сравнительную характеристику.
Развитие научного мировоззрения учащихся при усвоении основных идей курса: единство и познаваемость мира; единство живой и неживой природы; зависимость свойств вещества от особенностей их состава и строения; зависимость способов получения вещества от его свойств.
Метапредметные: Развитие у школьников интереса к изучению химии путем расширения и систематизации их знаний о кислороде и озоне.
Развитие у школьников интереса к изучению химии через лабораторный эксперимент.
Приемы обучения:
-
постановка межпредметных вопросов; выполнение комплексного задания на сравнение состава, строения, свойств и роли кислорода и озона в природе; составление обобщающих таблиц; обращение к историческому материалу.
Средства обучения:
-
Мультимедиапроектор, схемы, таблицы, учебник, дополнительная литература, химический эксперимент, лабораторное оборудование.
Оборудование и реактивы:
-
компьютер, интерактивная доска, мультимедиа проектор, виртуальная лаборатория, пробирки, штатив, лучинки, колбы, Н2О2 - пероксид водорода, MnO2 - оксид марганца (IV).
Ход урока
-
Орг. момент - 2-3 мин.
-
Актуализация знаний - 7 мин.
Учитель: Наш урок посвящен химическому элементу и веществу им образованному, который занимает особое место в жизни всего живого.
П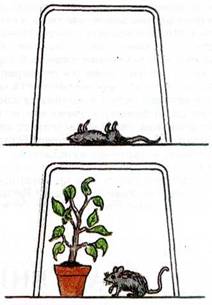 роанализируйте рисунки и скажите: Что случилось с мышкой на рисунке 1? Подумайте чем это можно объяснить?
роанализируйте рисунки и скажите: Что случилось с мышкой на рисунке 1? Подумайте чем это можно объяснить?
Ученики: кислород
Учитель: Что вы знаете о кислороде? Что бы вы хотели узнать?
(фронтальная работа) На доске составляем примерный план урока по ответам детей.
Что я знаю
Что хочу узнать
Что узнал?
План урока.
-
История открытия (кем, когда были открыты).
-
Общая характеристика химического элемента кислорода на основе его положения в Периодической системе Д. И. Менделеева.
-
Нахождение в природе: содержание в земной коре, содержание в атмосфере, в живой и не живой природе.
-
Способы получения (в лаборатории и промышленности). Катализаторы. Каталитические реакции.
Давайте перенесемся в средние века (выступление ученика по теме: «История открытия кислорода» интеллект-карта).
Учитель: Назовите точный адрес проживания кислорода в ПСХЭ и охарактеризуйте его как химический элемент.
План характеристика химического элемента:
-
Символ - О
-
Положение в ПСХЭМ - VI группа (А), II период, Порядковый номер - 8.
-
Химическая природа - неметалл.
-
Относительная атомная масса - Ar (O) = 16
-
Валентность - II.
-
Изучение нового материала - 15 мин.
Учитель: прослушав стихотворение, заполните кластер ( слайд ).
Он без запаха и цвета
С углеродом даст он дым,
Им окутана планета
Без него не быть живым,
Для дыхания он нужен,
В нем сгорают вещества
В океане он и в луже
Там, где зелень и листва.
-
Проанализируйте стихотворение и определите физические свойства.
Как вы думаете, в каком виде кислород содержится в природе? Какие образует вещества? А есть ли еще, какие либо простые вещества, состоящие из кислорода? Что защищает планету от УФ излучения? Ответы учащихся могут быть разными.
Учитель: Перед вами на столе лежит таблица. Для того, чтобы ее заполнить, немного обсудим эти вопросы.
характеристики
кислород
озон
Какова химическая формула простого вещества?
Какова относительная молекулярная масса?
Агрегатное состояние при н.у.
Цвет
Запах
Растворимость в воде
Отличительные свойства
Действие на организм
Ученики читают текст и заполняют таблицу: Кислород - газ, без цвета, вкуса, запаха, малорастворим в воде, тяжелее воздуха, при t = - 1870С превращается в жидкость бледно-синего цвета, а при t = -218, 80 С в синие кристаллы.
Озон - газ, голубого цвета, имеет запах свежести, в воде лучше растворим, чем кислород, тяжелее воздуха, при t = -1120С превращается в жидкость темно-синего цвета.
Учитель: Содержится ли кислород и озон в воздухе? Как эти газы там образуются?
Ученик: Кислород содержится в воздухе (21% по объему) образуется в результате фотосинтеза. Озон также содержится в атмосфере, примерно на расстоянии 10-30 км от поверхности Земли образуется в результате грозовых разрядов.
Учитель: Итак, мы подошли к очень важному понятию "аллотропия" и "аллотропные модификации". Химический элемент кислород образует 2 простых вещества - кислород и озон, которые отличаются друг от друга составом, строением, свойствами. Такое явление называется "аллотропия", а вещества, образованные одним и тем же химическим элементом, - "аллотропными модификациями" или видоизменениями. Запишем это в тетрадь.
Примечание: учащиеся переписывают в тетрадь определения.
Учитель: Явление существования различных простых веществ, образованных атомами одного и того же химического элемента и называется аллотропией, а простые вещества - аллотропными модификациями. Таким образом, О2 и О3, т.е кислород и озон - это аллотропные модификации химического элемента кислорода. Переходим к следующему этапу урока.
-
Групповая работа
Учитель: Как же был получен кислород? (групповая работа)
Учитель: Ребята предлагается работа в 5 группах (дифференцированно).
1-3 группы: задание - изучить по раздаточному материалу «методы получения кислорода» и объяснить этот метод, используя виртуальную лабораторию.
4-5 группы: задание - предложите, опираясь на физические свойства кислорода способы собирания этого газа.
-
Обобщение и систематизация знаний - 10 мин.
Работа в группах. Каждая группа получает карточку с заданием. На данную работу группам отводится 5 мин., затем учащиеся отвечают.
С о д е р ж а н и е к а р т о ч е к д л я г р у п п
Г р у п п а I
1. Составьте рассказ о строении атома и молекулы кислорода, используя опорный конспект по теме «Кислород».
2. Расскажите о нахождении кислорода в природе.
Г р у п п а II
1. Расскажите о получении кислорода в лаборатории и в промышленности.
2. Соберите прибор для получения кислорода и получите его (опыт 2).
Г р у п п а III
1. Расскажите о химических свойствах кислорода.
2. Напишите уравнения реакций взаимодействия кислорода с фосфором(V), железом(II), серой(VI), углеродом(IV).
После названия простого вещества в скобках стоит валентность этого элемента в получившемся соединении.
Г р у п п а IV
1. Расскажите о круговороте кислорода в природе.
2. Решите задачу. Какое количество теплоты выделится при сгорании 1 кг серы в кислороде, если термохимическое уравнение этой реакции:
S + O2 = SO2 + 296 кДж?
Г р у п п а V
Расскажите о применении кислорода и об охране окружающей среды.
Учитель делает вывод о результатах деятельности групп:
Учитель: Кислород можно получить и разложением других кислородсодержащих веществ в присутствии катализаторов.
Катализаторы - это вещества, которые ускоряют ход химической реакции, но сами при этом не расходуются.
Реакции, протекающие с участием катализаторов, называются каталитическими реакциями. Например, разложение бертолетовой соли (хлората калия).
Примечание: Ученики записывают определение понятий в тетради.
Учитель: Итак, подведем итоги урока. Вернемся к нашей табличке и заполним третью колонку.
Что я знаю
Что хочу узнать
Что узнал?
Контроль знаний тест-3мин
Взаимопроверка.-2 мин
Проверка знаний учащихся, подведение итогов занятия.
Проверка знаний учащихся проводится в форме х и м и ч е с к о г о д и к т а н т а: если утверждение соответствует кислороду, ставят знак «+», если не соответствует - знак «-».
1) Хорошо растворяется в воде.
2) Плохо растворяется в воде.
3) Легче воздуха.
4) Тяжелее воздуха.
5) Горючий газ.
6) Газ, поддерживает горение.
7) Восстановитель.
8) Окислитель.
9) При смешении с О2 взрывается при обычных условиях.
10) Горит спокойно.
11) Взаимодействует с оксидом меди(II).
12) Собирают методом вытеснения воздуха.
13) Собирают в опрокинутый вверх дном сосуд.
14) Собирают методом вытеснения воды.
15) Собирают в прямостоящий сосуд.
16) Получают перегонкой жидкого воздуха.
17) Получают электролизом воды.
О т в е т ы д л я с а м о п р о в е р к и
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
-
+
-
+
-
+
-
+
-
-
-
+
-
+
+
+
+
Домашнее задание: используя кейс выполните задания:
Текст:
Кислород самый распространенный элемент на Земле. Он входит в состав всех окружающих нас веществ. Так, например вода, песок, многие горные породы и минералы, составляющие зеленую кору, содержат кислород. Кислород является важной частью многих органических соединений, например белков, жиров и углеводов, имеющих исключительно большое значение в жизни человека.
В 1772 году шведский химик Шееле установил, что воздух состоит из кислорода и азота, В 1774 году английский химик Д. Пристли, разложением оксида ртути получил кислород и изучил его свойства. В 1777 году француз А. Лавуазье объяснил процессы дыхания и горения, как взаимодействие веществ с окислителем кислородом. Название элемента - оксигениум (рождающий кислоты) - дал Лавуазье. [5]
Кислород - бесцветный газ, без вкуса, запаха, малорастворим в воде, тяжелее воздуха.
Кислород энергично реагирует со многими веществами, при этом выделяется теплота и свет. Такие реакции называются горением. Для того, чтобы горение началось необходимы два условия: 1) нагревание горючего вещества до температуры воспламенения; 2) доступ кислорода. Для прекращения горения необходимо исключить хотя бы одно из условий.
Применение кислорода основано на его химических свойствах. В больших количествах кислород используют в разных отраслях химической промышленности, в металлургии, в ракетных двигателях, в медицине и т. д.
Пополняют запас кислорода в атмосфере зеленые растения.
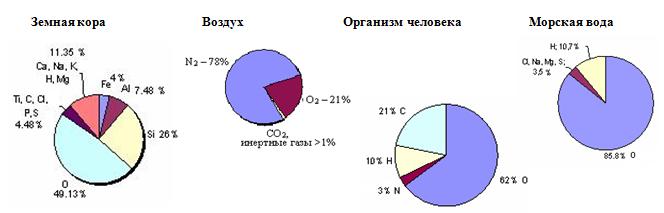
Кислород в природе
Задача №1
Впервые состав воздуха был установлен французским ученым Лавуазье. Он нагрел ртуть в определенном объеме воздуха. Объем воздуха сократился, а ртуть покрылась налетом оранжевого света, оставшийся газ не поддерживал ни горения, ни дыхания. Тогда Лавуазье собрал с поверхности ртути оранжевые чешуйки, поместил их в пробирку, сильно нагрел и собрал выделившийся газ. Смешав собранный газ с остатками газа из первого опыта, он получил смесь газов, ничем не отличающуюся от воздуха. Разъясните опыт Лавуазье. Приведите уравнение тех реакций, которые он воспользовался для определения состава воздуха.
Задача №2
«Доктор Окс… не пользовался марганцовокислым натрием по методу Тессье дю Мотэ, а попросту разлагал слегка подкисленную воду с помощью изобретенной им батареи… Электрический ток проходил сквозь большие чаны, наполненные водой, которая разлагалась на составные элементы, кислород и водород». Запишите уравнение реакций получения кислорода, о которых упоминается в отрывке повести Ж. Верна «Опыт доктора Окса». [2]
Задача №3
Используя диаграмму, определите массу кислорода в своем организме.
Список литературы:
-
Кузнецова Н.Е., Титова И.М., Гара Н.Н., Жегин А.Ю. Химия: Учебник для учащихся 8 класса общеобразовательных учреждений - 2-е издание, перераб. - М.: Вентана - Граф, 2001.
-
Люкимсон П.Е. Исползование художественной литературы на уроках химии //Химия в школе. - 1992 - № 3 - 4.
-
Методика преподавания химии/ Под редакцией Н.Е. Кузнецовой - М.: Просвещение, 1984.
-
Тихомирова С.А., Долгих А.Ф. Использование художественной литературы на уроках при изучении неорганической химии // Химия в школе - 1991 - № 2.
-
Ходаков Ю.В. Неорганическая химия: пособие для учителя - М.: Просвещение, 1972.
-
Шаталов Н.Е., Шаталов М. А. Межпредметные связи в формировании системных знаний // Химия в школе - 1997 - № 5
-
Кузнецова Н.Е., Шаталов М. А. Обучение химии на основе межпредметной интеграции. Учебно - методическое пособие 8 - 9 классы. - М.: Вентана - Граф, 2004.
-
Шаталов М.А. Уроки химии. Методическое пособие 8 класс. - М.: Вентана - Граф, 2006.


