- Преподавателю
- Химия
- Урок химии 8 класс Среда водных растворов электролитов
Урок химии 8 класс Среда водных растворов электролитов
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Конспекты |
| Автор | Боричевская Р.Р. |
| Дата | 20.02.2016 |
| Формат | doc |
| Изображения | Есть |
Урок химии в 8 классе
Тема «Среда водных растворов электролитов»
Цель: формирование исследовательской компетенции обучающихся при изучении среды водных растворов электролитов и методов ее качественного анализа.
Задачи:
-
Сформировать понятия о нейтральной, кислотной, щелочной средах, водородном показателе рН, индикаторах;
-
Ознакомить со способами определения реакции среды и значения рН раствора.
-
Выявить в ходе химического эксперимента наиболее оптимальный индикатор для определения кислой и щелочной среды раствора;
-
Развивать навыки работы с лабораторным оборудованием.
-
Отметить практическое значение водородного показателя для биологических и химических процессов.
-
Продолжить воспитание аккуратности и внимательности.
Ожидаемый результат - каждый учащийся
1) Объясняет, чем характеризуется нейтральная, кислотная и щелочная среды.
2) Знает, чем определяют среду раствора, называет основные индикаторы: лакмус, метилоранж, фенолфталеин, универсальный индикатор.
3) Умеет пользоваться цветной шкалой рН при определении среды раствора, проговаривает последовательность действий.
Планируемые результаты:
Урок должен помочь обучающимся восьмого класса сформировать следующие универсальные учебные действия:
1) Личностные УУД: определиться в выборе индивидуальных образовательных потребностей; научиться общаться со сверстниками, отстаивать свою точку зрения в процессе беседы, показывать свою убежденность в вопросах значения химических знаний в повседневной жизни; оценивать жизненные ситуации и поступки с точки зрения общечеловеческих норм.
2) Регулятивные УУД: организовывать свое рабочее место под руководством учителя; определять цель и составлять план выполнения задания; развивать практические навыки и умения при решении повседневных проблем связанных с химией; использовать в своей деятельности оборудование и реактивы.
3) Познавательные УУД: научиться выполнять творческие задания для самостоятельного получения и применения знаний; устанавливать причинно-следственные связи; выдвигать гипотезы и обосновывать их; формулировать проблемы.
4) Коммуникативные УУД: участвовать в диалоге на уроке и в жизненных ситуациях; сотрудничать с одноклассниками в поиске и сборе информации; принимать решения и реализовывать их; точно выражать свои мысли.
Оборудование (лабораторное):
Чистые пробирки, чистая вода в стакане, растворы соляной кислоты, серной кислоты,
уксусной кислоты, гидроксида натрия.
Растворы лакмуса, фенолфталеина, метилоранжа,
Универсальный индикатор с цветной шкалой.
Ход урока.
I этап - мотивационный
Вступительная беседа:
Добрый день!
Мир, окружающий нас, полон разнообразных по строению и свойствам веществ. Познание их позволит нам познать самих себя.
Самым оптимальным и емким способом познания является исследование. Сегодня я предлагаю нам представить себя не учениками, а сотрудниками химической лаборатории.
*** Демонстрация
Перед вами 3 пробирки с прозрачными растворами.
1) Рассматривая только внешние признаки, вы сможете определить, что это за растворы? (нет)
2) Если я скажу, что это только вода, взятая из разных источников, то без изучения состава растворов можно согласиться?
(Нельзя. В воде могут содержаться частицы, которые мы не видим - внешне незаметные). Мы подошли к проблеме:
Как определить наличие невидимых частиц в растворе?
II этап - Решение проблемы
Цель исследования: изучить некоторые способы качественного анализа водных растворов (т.е. содержания в них разных частиц).
Полемика: Какими способами можно воспользоваться?
(Можно проводить химические реакции - качественные реакции, доказывающие наличие в растворе тех или иных частиц.)
А можно воспользоваться специальными веществами - индикаторами.
Вопрос для размышления:
Вы знакомы с индикаторами из курса биологии, физики и других учебных дисциплин. Как Вы думаете, какое значение в химии имеет термин «индикатор»?
Слайд
Индикатор - это вещество, изменяющее свой цвет в зависимости от среды раствора.
Вопрос для размышления:
Все ли Вам понятно в данном определении?
(Что такое «среда раствора»? Какая она бывает?)
Это тема нашего сегодняшнего урока, запишите ее на рабочем листке
«Среда водных растворов».
Выявить типы сред водных растворов Вам поможет великая наука - логика!... и знание классов неорганических соединений.
*** Предлагаю построить первую логическую цепочку, ответив на соответствующие вопросы
Ответить на вопросы:
-
К какому классу относятся вещества с формулами: HCl, H2SO4, HNO3, H2S? (кислоты)
-
Какие катионы образуются в растворе при диссоциации данного класса соединений? (катионы водорода)
Записать на доске уравнение диссоциации азотной кислоты
HNO3 → H+ + NO3-
Подсказка: Название среды раствора в данном случае происходит от названия соответствующего класса соединений (кислая среда).
Выполнить Р-1 на рабочем листке.
*** Постройте следующую логическую цепочку для соединений, выраженных формулами: NaOH, Ca(OH) 2, KOH, Ba(OH)2. (основания)
Уточните по классификации. (щелочи)
Записать на доске уравнение полной диссоциации гидроксида бария
Ba(OH)2 → Ba2+ + 2OH-
Подсказка: Вспомните классификацию оснований! Все ли основания в водном растворе распадаются на ионы? Название среды происходит от названия растворимых оснований. (щелочная)
Выполните Р-2 на рабочем листке.
*** К какому классу относятся следующие вещества: сульфат калия, хлорид бария, нитрат кальция? (соли).
При растворении в воде данных соединений образуются частицы, характеризующие кислотный или щелочной характер раствора? (не образуются)
Докажите, составив уравнение диссоциации сульфата калия. Мы - в лаборатории. Здесь все утверждения требуют доказательства.
Составить на доске уравнение диссоциации сульфата калия
K2SO4 → 2K+ + SO42-
Подсказка: Название среды происходит от отсутствия катионов водорода и анионов гидроксо-групп. (нейтральная)
Выполните Р-3 на рабочем листке.
_______________ ________________
___________________
Проблемный вопрос:
Итак, мы выяснили, что существуют три типа среды водных растворов (кислая, нейтральная и щелочная).
Измерить уровень кислотности водной среды нам помогут индикаторы, о которых мы уже говорили вначале урока.
Индикаторы - это вещества, изменяющие свой цвет в зависимости от среды раствора.
Индикаторы бывают разные. Сегодня мы с Вами познакомимся с тремя основными: синий лакмус, метиловый оранжевый и фенолфталеин.
Каждый из них по-разному изменяет окраску в зависимости от среды раствора, поэтому наша с Вами задача - подобрать наиболее оптимальный индикатор для каждой среды раствора.
С этой целью выполните Р-4 на рабочем листе.
Опыт № 1. 1 ряд (группа А) исследует раствор кислоты,
а 2 ряд (группа Б)- раствор щелочи.
При проведении эксперимента не забывайте о правилах техники безопасности, они имеются у Вас на столах.
Инструкции:
Группа А:
В три пробирки налейте по 2-3 мл раствора соляной кислоты. В каждую из них добавьте по 1 капле индикаторов (в пробирку № 1 - метиловый оранжевый, в пробирку № 2 - фенолфталеин, в пробирку № 3 - синий лакмус).
Пронаблюдайте за изменением окраски.
Зафиксируйте наблюдаемые изменения в таблице 1.
Задание: Отметьте название индикатора, который наиболее удобно использовать для определения кислой среды водного раствора!
Группа Б:
В три пробирки налейте по 2-3 мл раствора гидроксида натрия. В каждую из них добавьте по 1 капле индикаторов (в пробирку № 1 - метиловый оранжевый, в пробирку № 2 - фенолфталеин, в пробирку № 3 - синий лакмус).
Пронаблюдайте за изменением окраски.
Зафиксируйте наблюдаемые изменения в таблице 2.
Задание: Отметьте название индикатора, который наиболее удобно использовать для определения щелочной среды водного раствора!
Таблица №1
Название индикатора
Изменение окраски в среде
кислая
щелочная
нейтральная
метиловый оранжевый
оранжевый
лакмус
фиолетовый
фенолфталеин
бесцветный
Формулировка выводов, используя записи из таблицы.
В кислой среде окраска метилового оранжевого становится красной, лакмуса - красной, фенолфталеин не изменяет своей окраски. Следовательно, наиболее оптимальный индикатор для определения кислой среды раствора - метиловый оранжевый.
В щелочной среде окраска метилового оранжевого становится желтой, лакмуса - синей, фенолфталеина - малиновой. Следовательно, наиболее оптимальный индикатор для определения щелочной среды - фенолфталеин.
***Дополнительное исследование образцов растворов.
Вы вооружились новыми знаниями. Можете Вы теперь изучить среду раствора ваших образцов?
Попробуйте определить среду каждого образца, используя оптимальные индикаторы, только для этого отлейте из каждой пробирки небольшое количество исследуемого раствора в две чистые пробирки и добавьте в каждую соответствующий индикатор (фенолфталеин, метиловый оранжевый) и универсальным индикатором
Оформите наблюдения в таблице
Название индикатора
Метиловый оранжевый
Фенолфталеин
Универсальный
Название
образца
1й образец
2й образец
Растительные индекаторы.
Проблемный вопрос:
Иногда нам бывает необходимо определить среду раствора в домашних условиях. А под руками нет универсальной индикаторной бумаги. Что делать?
Дополнительная информация:
Оказывается, некоторые овощи и фрукты обладают индикаторной способностью. Они содержат в себе рН-чувствительный пигмент (антоцианин).
Это плоды темно-синего, фиолетового цвета: свекла, ежевика, черника,черная смородина, вишня, темный виноград и, в том числе краснокочанная капуста.
Водородный показатель для питьевой воды должен соответствовать норме 6-9 единиц, для водоемов 6,5 - 8,5.
Исследователи установили, что особенно губительным для водных обитателей является кислая среда, нежели щелочная. У водных растений повышение кислотности воды, в первую очередь, сказывается на нарушении кальциевого обмена и образовании оболочек клеток, их делении, а также на протекании реакции фотосинтеза.
Для водных объектов и питьевой воды содержание нитратов не должно превышать 45 мг/л, фосфатов - 3,5 мг/л. Нитрат- и фосфат - ионы способствуют зарастанию водоемов растительностью, вызывая разрастание планктона. Тот, в свою очередь, отмирает и поглощает большое количество кислорода, лишая воду способности к самоочищению.
Нитраты могут оказать токсическое действие на людей и водных обитателей.
Содержание хлоридов в воде не должно быть выше 300 мг/л. Этот параметр влияет на водообмен водных растений.
По содержанию сульфатов судят о минеральном составе воды: их повышенное содержание свидетельствует о попадании в водоемы промышленных сточных вод. Оно не должно превышать 500 мг/л. Превышение сульфатов вызывает расстройство желудка.
Повышенное содержание железа в воде вызывает отложение железа в печени и по вредности значительно обгоняет алкоголизм. Предельно-допустимая концентрация в воде железа составляет 0,3 мг/л.
III. Рефлексия
1. В растворе каких веществ фенолфталеин приобретает малиновый цвет:
H2S, H2O, NaOH, HNO3.
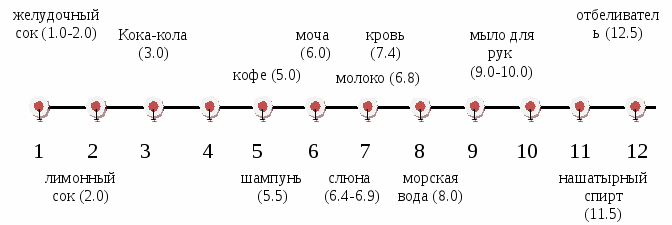
2. Желудочный сок имеет рН 1,7. Назовите тип среды в желудке.
3. Какова среда крови человека, если рН равен 7,4?
4. Определите формулы веществ, изменяющих окраску лакмуса в красный цвет и формулы веществ, изменяющих окраску лакмуса в синий цвет.
Ca(OH)2, H2O, NaCl, H2SO4, KOH, HCl.
5. HCl, LiOH, NaNO3, H2SO4, KOH, BaCl2, HNO3, Ca(OH)2, K2SO4
1) растворы каких веществ изменяют окраску лакмуса на красную?
2) растворы каких веществ изменяют окраску лакмуса на синюю?
Узнал (а) много нового, интересного________________________________________________
На уроке было интересно_____________________________________________________________
На уроке было не интересно__________________________________________________________
Ничего нового не узнала_____________________________________________________________
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Практическое значение знаний о среде растворов.
(На столах справочные таблицы о рН среды)
рН нашей кожи - 5,5, рН у нас в желудке - 1,7 (это сильно кислая среда), рН слюны - 6,9, рН крови - 7,4 , а слез близка к 7.
Разные растения предпочитают разные значения рН почвы: клюква и голубика - 3,5 - 4,5 (сильно кислую среду), ландыш и лилия - 4-5 (кислую), земляника, малина, картофель, свекла, стручковый перец - 5-6,5, томаты, виноград, тюльпаны, розы предпочитают рН от 6 до 7,5 (практически нейтральная среда), а топинамбур, клевер, пшеница и ячмень от 7 до 7,5 (нейтральную и слабощелочную).
Очень сильно влияет значение рН водоемов на рыб. Частое, в наше время, выпадение кислотных осадков приводит к увеличению кислотности среды водоемов. В таких водоемах первыми гибнут моллюски и ракообразные, которые не могут жить при рН<6; при рН<5,7 гибнут лосось, форель и плотва; щука и окунь гибнут при рН<5; достаточно широкие колебания рН среды выдерживают жуки-плавунцы и некоторые виды планктона. Жук плавунец может жить при рН=4 или даже 3,5.
Последнее время, в телевизионной рекламе советуют поддерживать кислотно-щелочной баланс во рту при помощи жевательной резинки, а ухаживать за кожей лица, используя мыло рН которого «нейтральное».
5. Растения индикаторы
Расте́ния - индика́торы , или индикаторные растения - растения, для которых характерна резко выраженная адаптация к определённым условиям окружающей среды. При наличии таких растений можно качественно или количественно оценить условия окружающей среды. Индикаторные растения, растения-индикаторы, растения, тесно связанные с определёнными экологическими условиями, которые могут качественно или количественно оцениваться по присутствию этих растений.
Объектами индикации (индикатами) могут быть почвы, некоторые горные породы, подземные воды, присутствие определённых химических элементов и т. п.
Индикаторные растения пользуются при оценке механического состава и засоления почв, в поисках пресных вод в пустынях, при картировании материнских почвообразующих пород и некоторых видов полезных ископаемых. Индикаторные растения - предмет изучения индикационной геоботаники.
Растения - индикаторы кислотности почв
Группа
Растения-биоиндикаторы
рН почвы
1.Ацидофилы - растения кислых почв
1.1 Крайние ацидофилы
Сфагнум, зеленые мхи: хвощ полевой, молочай, василёк полевой, подмаренник цепкий, белоус.
кошачьи лапки, цетрария, щучка дернистая, , щавелек малый, мокрица, лютик, торица, мята, подорожник, конский щавель.
3,0-4,5
1.2. Умеренные ацидофилы
мышей сизый, калужница болотная, сушеница, лютик ядовитый, толокнянка, седмичник европейский, белозор болотный, сердечник луговой, вейник наземный. фиалка трёхцветная, пикульник, белокудренник, клевер пашенный, молочай, василёк полевой, живокость полевая, подмаренник цепкий, ежовник обыкновенный.
4,5-6,0
1.3. Слабые ацидофилы
горец, живокость полевая, пырей ползучий, мокрица, марь белая, василёк полевой, молочай, клевер белый, вьюнок полевой , ветреница лютиковая, малина, смородина черная, вероника длиннолистная, горец змеиный, орляк, иван-да-марья, кисличка заячья.
5,0-6,7
1.4.Ацидофильно-нейтральные
Зеленые мхи: гилокомиум, плеврозиум, ива козья. аистник цикутный, пастушья сумка, мокрица, вьюнок полевой марь белая, живокость полевая.
4,5-7,0
2.Нейтрофилы - обитатели нейтральных почв;
2.1 Окололинейные
Сныть европейская, клубника зеленая, лисохвост луговой, клевер горный, клевер луговой, мыльнянка лекарственная, аистник цикутны, цикорий, мят(л)ник луговой.
6,0-7,3
2.2 Нейтрально-базифильные
Мать-и-мачеха, пупавка красильная, люцерна серповидная, келерия, осока мохнатая, лядвенец рогатый, гусиная лапка.
6,7-7,8
3. Базифилы - растения щелочных почв.
3.1 Базифильные
Бузина сибирская, вяз шершавый, бересклет бородавчатый.
7,8-9,0
Кислотность - одно из характерных свойств почвы. Повышенная кислотность отрицательно сказывается на росте и развитии ряда вида растений. Это происходит из-за появления в кислых почвах вредных для растений веществ, например растворимого алюминия или избытка марганца. Они нарушают углеводный и белковый обмен в растениях, задерживают образование генеративных органов и приводят к нарушению семенного размножения, а иногда вызывают гибель растений. Повышенная кислотность почв подавляет жизнедеятельность почвенных бактерий, участвующих в разложении органики и высвобождении питательных веществ, необходимых растениям.
Тема урока ___________________________________________________
Рабочий листок (ФИ ученика)___________________________________
Р-1. Друг другу в парах по очереди проговорите, что такое кислоты с точки зрения диссоциации. Допишите незаконченную фразу:
___________________это электролиты, которые при диссоциации в водных растворах в качестве ________________ отщепляют __________________________________________________
Запись диссоциации соляной кислоты (HCl)
_____________________________________________________________________________
_______________________________________________________________________________
Среда (какая?) _______________________________
Р-2 Друг другу в парах по очереди проговорите, что такое основания с точки зрения диссоциации. Допишите незаконченную фразу:
_____________________это электролиты, которые при диссоциации в водных растворах в качестве ______________________ отщепляют _________________________________________
Запись диссоциации гидроксида натрия (NaOH) (щелочи)
___________________________________________________________________________________
Среда (какая?) _________________________
Р-3 Друг другу в парах по очереди проговорите, что такое соли с точки зрения диссоциации. Допишите незаконченную фразу:
_____________________это электролиты, которые при диссоциации в водных растворах в качестве _______________отщепляют ______________, а в качестве_________________
отщепляют__________________________
Запись диссоциации хлорида натрия (NaCl)
___________________________________________________________________________________
Среда (какая?) _________________________
Р-4 В парах по очереди дайте характеристику каждой среде, воспользовавшись этой незаконченной фразой. Допишите.
«В _________________________ среде число____________ ______ числа ________________»
«В _________________________ среде число_____________ ______ числа _______________»
«В _________________________ среде число_____________ ______ числа _______________»
Р-5 Группа А.
Опыт №1.
В три пробирки налейте по 2-3 мл раствора соляной кислоты. В каждую из них добавьте по 1 капле индикаторов (в пробирку № 1 - метиловый оранжевый, в пробирку № 2 - фенолфталеин, в пробирку № 3 - лакмус).
Пронаблюдайте за изменением окраски.
Зафиксируйте наблюдаемые изменения в таблице
Задание:
Отметьте название индикатора, который наиболее удобно использовать для определения кислой среды водного раствора!
Индикаторы
Среда в растворах
Нейтральная
Кислая
Щелочная
Лакмус
Метилораж
Фенолфталиен
Универсальный
С универсальным индикатором работаем по алгоритму
1) Берём 2) Опускаем 3) Сравниваем 4) Определяем
Р-6
Определите среду растворов выданных под № №.
Индикаторы: метилоранж, фенолфталеин, универсальный индикатор.
Пробирки с растворами пронумерованы.
Название индикатора
Метиловый оранжевый
Фенолфталеин
Универсальный
Название
образца
1й образец
2й образец
Р-7 Растительные индикаторы.
Проблемный вопрос: Иногда нам бывает необходимо определить среду раствора в домашних условиях. А под руками нет универсальной индикаторной бумаги. Что делать?
Информация: Оказывается, некоторые овощи и фрукты обладают индикаторной способностью. Они содержат в себе рН-чувствительный пигмент (антоцианин).
Исследуемый раствор
Смородиновый
морс (раствор розового цвета)
Раствор
черничного сока
Раствор кислоты
Раствор щелочи
Р-8 Практическое значение полученных знаний .
Несколькими предложениями запишите, в чем вы видите практическое применение полученных
знаний.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
___________________________________________________________________________________
Рефлексия
Узнал (а) много нового, интересного________________________________________________
На уроке было интересно_____________________________________________________________
На уроке было не интересно__________________________________________________________
Ничего нового не узнала_____________________________________________________________
Тема урока ___________________________________________________
Рабочий листок (ФИ ученика)___________________________________
Р-1. Друг другу в парах по очереди проговорите, что такое кислоты с точки зрения диссоциации. Допишите незаконченную фразу:
___________________это электролиты, которые при диссоциации в водных растворах в качестве ________________ отщепляют __________________________________________________
Запись диссоциации соляной кислоты (HCl)
_____________________________________________________________________________
_______________________________________________________________________________
Среда (какая?) _______________________________
Р-2 Друг другу в парах по очереди проговорите, что такое основания с точки зрения диссоциации. Допишите незаконченную фразу:
_____________________это электролиты, которые при диссоциации в водных растворах в качестве ______________________ отщепляют _________________________________________
Запись диссоциации гидроксида натрия (NaOH) (щелочи)
___________________________________________________________________________________
Среда (какая?) _________________________
Р-3 Друг другу в парах по очереди проговорите, что такое соли с точки зрения диссоциации. Допишите незаконченную фразу:
_____________________это электролиты, которые при диссоциации в водных растворах в качестве _______________отщепляют ______________, а в качестве_________________
отщепляют__________________________
Запись диссоциации хлорида натрия (NaCl)
___________________________________________________________________________________
Среда (какая?) _________________________
Р-4 В парах по очереди дайте характеристику каждой среде, воспользовавшись этой незаконченной фразой. Допишите.
«В _________________________ среде число____________ ______ числа ________________»
«В _________________________ среде число_____________ ______ числа _______________»
«В _________________________ среде число_____________ ______ числа _______________»
Р-5 Группа Б
Опыт №1.
В три пробирки налейте по 2-3 мл раствора гидроксида натрия. В каждую из них добавьте по 1 капле индикаторов (в пробирку № 1 - метиловый оранжевый, в пробирку № 2 - фенолфталеин, в пробирку № 3 - синий лакмус).
Пронаблюдайте за изменением окраски.
Зафиксируйте наблюдаемые изменения в таблице
Задание:
Отметьте название индикатора, который наиболее удобно использовать для определения щелочной среды водного раствора!
Индикаторы
Среда в растворах
Нейтральная
Кислая
Щелочная
Лакмус
Метилораж
Фенолфталиен
Универсальный
С универсальным индикатором работаем по алгоритму
1) Берём 2) Опускаем 3) Сравниваем 4) Определяем
Р-6
Определите среду растворов выданных под № №.
Индикаторы: метилоранж, фенолфталеин, универсальный индикатор.
Пробирки с растворами пронумерованы.
Название индикатора
Метиловый оранжевый
Фенолфталеин
Универсальный
Название
образца
1й образец
2й образец
Р-7 Растительные индикаторы.
Проблемный вопрос: Иногда нам бывает необходимо определить среду раствора в домашних условиях. А под руками нет универсальной индикаторной бумаги. Что делать?
Информация: Оказывается, некоторые овощи и фрукты обладают индикаторной способностью. Они содержат в себе рН-чувствительный пигмент (антоцианин).
Исследуемый раствор
Смородиновый
морс (раствор розового цвета)
Раствор
черничного сока
Раствор кислоты
Раствор щелочи
Р-8 Практическое значение полученных знаний .
Несколькими предложениями запишите, в чем вы видите практическое применение полученных
знаний.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
___________________________________________________________________________________
Рефлексия
Узнал (а) много нового, интересного________________________________________________
На уроке было интересно_____________________________________________________________
На уроке было не интересно__________________________________________________________
Ничего нового не узнала_____________________________________________________________
Правила техники безопасности
В кабинете химии запрещается:
кабинете химии запрещается:
1. 2.
Употреблять пищу Трогать руками химические
вещества
3. 4.
Выливать во флакон Сливать вещества
оставшиеся реактивы без разрешения учителя
Осторожно:
5. 6.
Едкие вещества Ядовитые вещества
Не забудь:
7.
При попадании на кожу химического вещества промыть
данное место водой
В ыучите определение
ыучите определение
Водородный показатель - это величина, характеризующая содержание катионов водорода в растворе.
В ыявите зависимость между значением водородного показателя и средой раствора
ыявите зависимость между значением водородного показателя и средой раствора
При рН > 7 среда раствора ____________________________
При рН = 7 среда раствора ____________________________
При рН < 7 среда раствора ____________________________
Эталонная шкала для рН

 кислая среда щелочная
кислая среда щелочная
1
2
3
4
5
6
7
8
9
10
11
12
Вопрос для размышления: Какова среда раствора выданного Вам образца?
Внесите результаты исследования в четвертый столбик таблицы 1
(страница 4).
Шкала рН некоторых жидкостей
томатный сок (4.0)
Растения-индикаторы
Растения-индикаторы могут помочь садоводу-огороднику определить кислотность почв на участке, глубину залегания грунтовых вод, содержание в почве питательных веществ.
Стоит лишь присмотреться к растениям, которые охотно растут в вашем саду или огороде, и они подскажут вам, что нужно предпринять для окультуривания почвы.
Необходимо соблюдать и другие правила "удачного огорода".
Так например, обильное разрастание малины, гравилата речного (см. фото ниже), лебеды татарской, хмеля, крапивы двудомной и жгучей, кипрея узколистного, паслена сладко-горького, щирицы запрокинутой, бузины черной, смородины черной свидетельствует о повышенном содержании азота в почве.
Наличие клевера темноцветного, дрока красильного и росянки круглолистной (см. фото ниже) говорит о недостатке азота в почве.
Растения, свидетельствующие об избытке кальция (см. фото ниже): венерин башмачок, порезник горный, солнцецвет, степная астра, папоротники пеллея.
На почвах бедных кальцием растут бухарник мягкий, белоус торчащий, майник двулистный, папоротник-орляк, фиалка собачья, верески.
Растения-индикаторы большого содержания питательных веществ в почвах: папоротник-страусник, лунник оживающий, кипрей узколистный, белена черная, паслен сладко-горький, медуница неясная.
На почвах со средним достатком питательных веществ растут: лапчатка белая, подмаренник настоящий, сфагнум береговой, папоротник, щитовник мужской, калужница болотная, купальница европейская, ветреница лютичная, земляника, клевер средний, смолевка поникшая, грушанка круглолистная, бересклет бородавчатый.
О низком уровне содержания питательных веществ в почве свидетельствуют такие растения: лишайники, клевер пашенный, щавель малый, черника, брусника, вереск, клюква, сивец луговой, ястребинка волосистая, .
Если на участке растут щавель, таволга, дуб, верба, камыш лесной, ольха серая и черная, тростник, прутняк, плющ, недотрога желтая, лапчатка гусиная, болиголов, наперстянка, осенний безвременник, мать-и-мачеха, значит грунтовые воды расположены достаточно близко. На таких местах будут плохо расти яблоня и вишня.
Сильнокислые почвы (Рh=5-6,7) предпочитают такие растения, как: калужница болотная, лютики, сердечник луговой, седмичник европейский. Кислые почвы не пригодны для бобовых.
При кислотности почвы Рh=4,5-7 хорошо растут смородина черная, малина, лещина, крапива жгучая.
Щелочные почвы (Рh=6,7-8,5) предпочитают люцерна серповидная, мать-и-мачеха, полыни, лебеда бородавчатая, поташник олиственный, астра солончаковая.
Богатые известью почвы предпочитают живокость, горчица полевая, сушеница болотная, подорожник ланцетолистный. На почвах с недостатком извести растут грыжник голый, василек, дикая редька.
На почвах, богатых карбонатами растут бук, облепиха, бересклет европейский, ясень.
Растения - индикаторы кислотности почвы
Submitted by sveta on Пт, 10/05/2012 - 15:04
На кислых и среднекислых почвах растут: хвощ лесной, Иван-да-марья (марьянник дубравный), горец птичий и щавелелистный, лютик едкий и ползучий, фиалка трехцветная, кислица, подорожник, мята, сушеница, пырей, цикорий корневой.
-
Сфагновый и зеленый мох, голубика, водяника, черника, чина болотная, седмичник, ожига волосистая, щавель кислый - обитатели сильнокислых почв.
-
Растения, предпочитающие слабокислые почвы: щучка, ветреница дубравная, калужница болотная, гравилат речной, осока волосовидная, хвощ болотный, кошачья лапка.
-
Виды, избегающие очень кислых почв, растущие на нейтральных и слабокислых почвах: манжетка, ромашка непахучая и аптечная, мать-имачеха, клевер луговой и ползучий, осот, донник белый, редька полевая, бодяк огородный, пастушья сумка, ландыш майский, лапчатка гусиная, тысячелистник, таволга вязолистная, земляника, герань лесная.
-
На щелочных и нейтральных почвах растут: смолевка белая (дрема), максамосейка, дельфиниум (живокость), горчица полевая, люцерна, вика посевная, тимофеевка луговая, полевица, костер безостый, мятлик луговой.
-
Виды, безразлично относящиеся к реакции почвы: овсяница овечья, фиалка болотная, вороний глаз, полевица собачья.


