- Преподавателю
- Химия
- Конспект урока по теме Строение оболочек
Конспект урока по теме Строение оболочек
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Конспекты |
| Автор | Абибуллаева Г.А. |
| Дата | 20.01.2016 |
| Формат | docx |
| Изображения | Есть |
Тема урока: Строение электронных оболочек атомов элементов: s-, p-, d-, f-электроны.
Цель урока: Сформировать представления учащихся о строении электронной оболочки атома на примере химических элементов 1-3 периодов периодической системы. Закрепить понятия "периодический закон" и "периодическая система".
Задачи урока: Научиться составлять электронные формулы атомов, определять элементы по их электронным формулам, определять состав атома.
Оборудование: Периодическая система химических элементов Д.И. Менделеева, классная доска, мультимедиа-проектор, персональный компьютер, макет и презентация "Составление электронных формул строения атомов".
Тип урока: комбинированный
Методы: словесный, наглядный.
Ход урока
I. Организационный момент.
Приветствие. Отметка отсутствующих. Активизация класса на усвоение новой темы.
Учитель проговаривает и записывает тему урока на доске "Строение электронных оболочек атома".
II. Объяснение нового материала
Учитель: В начале XX века была принята планетарная модель строения атома, предложенная Резерфордом, согласно которой вокруг очень малого по размерам положительно заряженного ядра движутся электроны, как планеты вокруг Солнца. (. Модель Резерфорда).
Следовательно, в атоме есть траектории, по которым движется электрон. Однако дальнейшие исследования показали, что в атоме не существует траекторий движения электронов. Движение без траектории означает, что мы не знаем, как электрон движется в атоме, но можем установить область, где чаще всего встречается электрон. Это уже не орбита, а орбиталь. Двигаясь вокруг атома, электроны образуют в совокупности егоэлектронную оболочку.

Давайте выясним, как движутся электроны вокруг ядра? Беспорядочно или в определенном порядке? Исследования Нильса Бора - основоположника современной атомной физики, а также ряда других ученых позволили сделать вывод: электроны в атомах располагаются определенными слоями - оболочками и в определенном порядке.
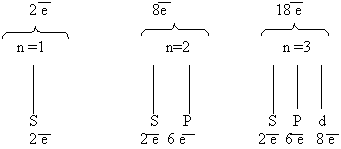
Строение электронных оболочек атомов имеют важную роль для химии, так как именно электроны обуславливают химические свойства веществ. Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром. Электроны в атоме различаются определенной энергией, и, как показывают опыты, одни притягиваются к ядру сильнее, другие слабее. Объясняется это удаленностью электронов от ядра. Чем ближе электроны к ядру, тем больше связь их с ядром, но меньше запас энергии. По мере удаления от ядра атома сила притяжения электрона к ядру уменьшается, а запас энергии увеличивается. Так образуются электронные слои в электронной оболочке атома. Электроны, обладающие близкими значениями энергии образуют единый электронный слой, или энергетический уровень. Энергия электронов в атоме и энергетический уровень определяется главным квантовым числом n и принимает целочисленные значения 1, 2, 3, 4, 5, 6 и 7. Чем больше значение n, тем больше энергия электрона в атоме. Максимальное число электронов, которое может находиться на том или ином энергетическом уровне, определяется по формуле:
N = 2n2
Где N - максимальное число электронов на уровне;
n - номер энергетического уровня.
Установлено, что на первой оболочке располагается не более двух электронов, на второй - не более восьми, на третьей - не более 18, на четвертой - не более 32. Заполнение более далеких оболочек мы рассматривать не будем. Известно, что на внешнем энергетическом уровне может находиться не более восьми электронов, его называют завершенным. Электронные слои, не содержащие максимального числа электронов, называютнезавершенными.
Число электронов на внешнем энергетическом уровне электронной оболочки атома равно номеру группы для химических элементов главных подгрупп.
Как ранее было сказано, электрон движется не по орбите, а по орбитали и не имеет траектории.
Пространство вокруг ядра, где наиболее вероятно нахождение данного электрона, называется орбиталью этого электрона, или электронным облаком.
Орбитали, или подуровни, как их еще называют, могут иметь разную форму, и их количество соответствует номеру уровня, но не превышает четырех. Первый энергетический уровень имеет один подуровень (s), второй - два (s,p), третий - три (s,p,d) и т.д. Электроны разных подуровней одного и того же уровня имеют разную форму электронного облака: сферическую (s), гантелеобразную (p) и более сложную конфигурацию (d) и (f).Сферическую атомную орбиталь ученые договорились называть s-орбиталью. Она самая устойчивая и располагается довольно близко к ядру.
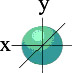
S - орбиталь
Чем больше энергия электрона в атоме, тем быстрее он вращается, тем сильнее вытягивается область его пребывания, и, наконец, превращается в гантелеобразную p-орбиталь:

Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x,y и z. Это легко объяснимо: ведь все электроны заряжены отрицательно, поэтому электронные облака взаимно отталкиваются и стремятся разместиться как можно дальше друг от друга.
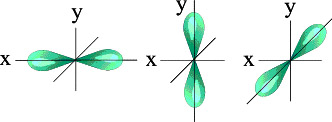
Три p - орбитали
Итак, p-орбиталей может быть три. Энергия их, конечно, одинакова, а расположение в пространстве - разное.
Составить схему последовательного заполнения электронами энергетических уровней
Теперь мы можем составить схему строения электронных оболочек атомов:
-
Определяем общее число электронов на оболочке по порядковому номеру элемента.
-
Определяем число энергетических уровней в электронной оболочке. Их число равно номеру периода в таблице Д. И. Менделеева, в котором находится элемент.
-
Определяем число электронов на каждом энергетическом уровне.
-
Используя для обозначения уровня арабские цифры и обозначая орбитали буквами s и p, а число электронов данной орбитали арабской цифрой вверху справа над буквой, изображаем строение атомов более полными электронными формулами. Ученые условились обозначать каждую атомную орбиталь квантовой ячейкой - квадратиком на энергетической диаграмме:
На s-подуровне может находиться одна атомная орбиталь

а на p-подуровне их может быть уже три -
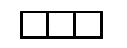
(в соответствии с тремя осями координат):
Орбиталей d- и f-подуровня в атоме может быть уже пять и семь соответственно:
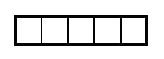

Пример:
Ядро атома водорода имеет заряд +1, поэтому вокруг его ядра движется только один электрон на единственном энергетическом уровне. Запишем электронную конфигурацию атома водорода
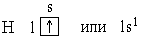
Чтобы установить связь между строением атома химического элемента и его свойствами, рассмотрим еще несколько химических элементов.
Следующий за водородом элемент-гелий. Ядро атома гелия имеет заряд +2, поэтому атом гелия содержит два электрона на первом энергетическом уровне:
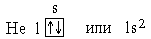
Так как на первом энергетическом уровне может находиться не более двух электронов, то он считаетсязавершенным.
Элемент № 3 - литий. Ядро лития имеет заряд +3, следовательно, в атоме лития три электрона. Два из них находятся на первом энергетическом уровне, а третий электрон начинает заполнять второй энергетический уровень. Сначала заполняется s-орбиталь первого уровня, потом s-орбиталь второго уровня. Электрон, находящийся на втором уровне слабее связан с ядром, чем два других.
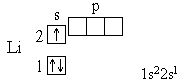
Далее формирование электронных оболочек у элементов 2-го периода происходит следующим образом:
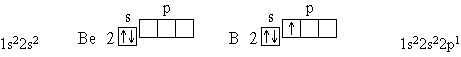
Для атома углерода уже можно предположить три возможных схемы заполнения электронных оболочек в соответствии с электронно-графическими формулами:
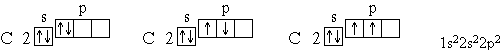
Анализ атомного спектра показывает, что правильна последняя схема. Пользуясь этим правилом, нетрудно составить схему электронного строения для атома азота:
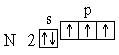
Этой схеме соответствует формула 1s22s22p3. Затем начинается попарное размещение электронов на 2p-орбиталях. Электронные формулы остальных атомов второго периода:
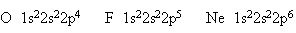
У атома неона заканчивается заполнение второго энергетического уровня, и завершается построение второго периода системы элементов.
Найдите в периодической системе химический знак лития, от лития до неона Ne закономерно возрастает заряд ядер атомов. Постепенно заполняется электронами второй слой. С ростом числа электронов на втором слое металлические свойства элементов постепенно ослабевают и сменяются неметаллическими.
Третий период, подобно второму, начинается с двух элементов (Na, Mg), у которых электроны размещаются на s-подуровне внешнего электронного слоя. Затем следуют шесть элементов (от Al до Ar), у которых происходит формирование p-подуровня внешнего электронного слоя. Структура внешнего электронного слоя соответствующих элементов второго и третьего периодов оказывается аналогичной. Иначе говоря, с увеличением заряда ядра электронная структура внешних слоев атомов периодически повторяется. Если элементы имеют одинаково устроенные внешние энергетические уровни, то и свойства этих элементов подобны. Скажем, аргон и неон содержат на внешнем уровне по восемь электронов, и потому они инертны, то есть почти не вступают в химические реакции. В свободном виде аргон и неон - газы, которые имеют одноатомные молекулы.
Атомы лития, натрия и калия содержат на внешнем уровне по одному электрону и обладают сходными свойствами, поэтому они помещены в одну и ту же группу периодической системы.
Далее, учитель вместе с учениками делают выводы по пройденной теме и повторяют материал.
III. Выводы.
1. Свойства химических элементов, расположенных в порядке возрастания заряда ядра, периодически повторяются, так как периодически повторяется строение внешних энергетических уровней атомов элементов.
2. Плавное изменение свойств химических элементов в пределах одного периода можно объяснить постепенным увеличением числа электронов на внешнем энергетическом уровне.
3. Причина сходства свойств химических элементов, принадлежащих к одному семейству, заключается в одинаковом строении внешних энергетических уровней их атомов.
IV. Закрепление нового материала.
Задание для класса:
1. Изобразите строение атомов следующих элементов:
а) натрия;
б) кремния
2. Сравните строение атомов азота и фосфора.
3. По данным о распределении валентных электронов найдите элемент:
а) 1s2 2s1
б) 1s2 2s22p63s23p6
в) 1s22s22p63s23p4
г) 1s2 2s22p4
д) 1s22s22p63s23p64s1
4. Используя компьютерную презентацию "Составление электронных формул строения атомов" составьте электронные формулы атомов а) азота; б) серы.
5. Используя макет "Составление электронных формул строения атомов" электронные формулы атомов: а) магния; б) кислорода.
V. Домашнее задание: § 8, Стр. 28-33.
Нарисуйте схемы строения электронных оболочек атомов: бора, хлора, лития, алюминия.


