- Преподавателю
- Химия
- Рабочая программа по химии для среднего общего образования (УМК Габриеляна О. С. , профильный уровень)
Рабочая программа по химии для среднего общего образования (УМК Габриеляна О. С. , профильный уровень)
| Раздел | Химия |
| Класс | - |
| Тип | Рабочие программы |
| Автор | Пуляева Е.И. |
| Дата | 25.01.2015 |
| Формат | doc |
| Изображения | Есть |
Муниципальное бюджетное общеобразовательное учреждение
«Прохоровская гимназия»
Прохоровского района Белгородской области
«Согласовано»
Руководитель МО учителей химии и биологии
Давыдова Л.М.
Протокол № ___ от
«____»______2014 г.
«Согласовано»
Заместитель директора
МБОУ «Прохоровская гимназия» __________Севостьянова Т.В.
«___»______2014 г
«Утверждаю»
Директор МОУ «Прохоровская гимназия»
_________ О.А Пономарева.
Приказ №__
от ________________2014 г.
РАБОЧАЯ ПРОГРАММА
по предмету «Химия»
ступень обучения (класс) среднее общее образование, 10-11 классы
уровень профильный
Разработала Пуляева Елена Ивановна учитель химии
первой квалификационной категории
2014-2015 учебный год
Пояснительная записка
Рабочая программа составлена на основе:
- Федерального компонента образовательного стандарта для среднего (полного) общего образования по химии. Профильный уровень.
- Примерной программы среднего (полного) общего образования по химии. Профильный уровень. М. МОН, 2005 г
- Программы курса химии для 8-11 классов общеобразовательных учреждений /О.С. Габриелян. - М.: Дрофа, 2009.
- Учебного плана МБОУ «Прохоровская гимназия».
Учебный предмет «Химия» относится к образовательной области «Естествознание»
Главной целью образования является развитие ребенка как компетентной личности путем включения его в различные виды ценностной человеческой деятельности: учеба, познания, коммуникация, профессионально-трудовой выбор, личностное саморазвитие, ценностные ориентации, поиск смыслов жизнедеятельности. С этих позиций обучение рассматривается как процесс овладения не только определенной суммой знаний и системой соответствующих умений и навыков, но и как процесс овладения компетенциями.
Это определило цель обучения химии:
• освоение знаний о химической составляющей естественнонаучной картины мира, важнейших химических понятиях, законах и теориях органической химии;
• овладение умениями применять полученные знания для объяснения разнообразных химических явлений и свойств органических веществ, оценки роли органической химии в развитии современных технологий и получении новых материалов;
-
развитие познавательных интересов и интеллектуальных способностей в процессе самостоятельного приобретения химических знаний с использованием различных источников информации, в том числе компьютерных;
-
воспитание убежденности в позитивной роли органической химии в жизни современного общества, необходимости химически грамотного отношения к своему здоровью и окружающей среде;
-
применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
На основании требований Государственного образовательного стандарта 2005 г. в содержании рабочей программы предполагается реализовать актуальные в настоящее время компетентностный, личностно-ориентированный, деятельностный подходы, которые определяют задачи обучения:
- формирование знаний основ органической химии - важнейших фактов, понятий, законов и теорий, языка науки, доступных обобщений мировоззренческого характера;
- развитие умений наблюдать и объяснять химические явления, соблюдать правила техники безопасности при работе с веществами в химической лаборатории и в повседневной жизни;
- развитие интереса к органической химии как возможной области будущей практической деятельности;
- развитие интеллектуальных способностей и гуманистических качеств личности;
- формирование экологического мышления, убежденности в необходимости охраны окружающей среды.
Общая характеристика учебного предмета
Программа по химии для 10-11 классов общеобразовательных учреждений является логическим продолжением авторского курса для основной школы. Поэтому она разработана с опорой на курс химии 8-9 классов. Результатом этого явилось то, что некоторые, преимущественно теоретические темы курса химии основной школы рассматриваются снова, но уже на более высоком, расширенном и углубленном уровне.
Курс четко делится на две части соответственно годам обучения: органическую (10 класс) и общую химию (11 класс). Органическая химия рассматривается в 10 классе и строится с учетом знаний, полученных учащимися в основной школе. Поэтому ее изучение начинается с повторения важнейших понятий органической химии, рассмотренных в основной школе.
После повторения важнейших понятий рассматривается строение и классификация органических соединений, теоретическую основу которой составляет современная теория химического строения с некоторыми элементами электронной теории и стереохимии. Логическим продолжением ведущей идеи о взаимосвязи (состав - строение - свойства) веществ является тема «Химические реакции в органической химии», которая знакомит учащихся с классификацией реакций в органической химии и дает представление о некоторых механизмах их протекания.
Полученные в первых темах теоретические знания учащихся затем закрепляются и развиваются на богатом фактическом материале химии классов органических соединений, которые рассматриваются в порядке усложнения от более простых (углеводородов) до наиболее сложных (биополимеров). Такое построение курса позволяет усилить дедуктивный подход к изучению органической химии.
Курс общей химии изучается в 11 классе и ставит своей задачей интеграцию знаний учащихся по неорганической и органической химии с целью формирования у них единой химической картины. Ведущая идея курса - единство неорганической и органической химии на основе общности их понятий, законов и теорий, а также на основе общих подходов к классификации органических и неорганических веществ и закономерностям протекания химических реакций между ними. Такое построение курса общей химии позволяет подвести учащихся к пониманию материальности и познаваемости единого мира веществ, причин его красочного многообразия, всеобщей связи явлений.
В свою очередь, это дает возможность учащимся не только лучше усвоить химическое содержание, но и понять роль и место химии в системе наук о природе. Такое построение курса позволяет в полной мере использовать в обучении операции мышления: анализ и синтез, сравнение и аналогию, систематизацию и обобщение.
В авторскую программу внесены следующие изменения:
В 10 классе:
Увеличено число часов на изучение тем:
- № 2 «Углеводороды» до 25 часов вместо 24;
- № 3 «Спирты. Фенолы» до 10 вместо 6
- №4 «Альдегиды и кетоны до 8 вместо 7
- №5 «Карбоновые кислоты, сложные эфиры, жиры до 11 вместо 10;
- №7 «Азотсодержащие органические соединения» до 11 вместо 9
- №9. Биологически активные органические соединения до 9 вместо 6 за счёт резервного времени и за счёт того, что были распределены практические работы из блока практикум в соответствующие темы.
Объединены в одну следующие темы: Строение и классификация органических соединений и химические реакции в органической химии.
В 11 классе:
1. Практические работы темы 5 «Химический практикум» перенесены в соответствующие темы курса. Нумерация практических и лабораторных работ сквозная и не соответствует нумерации в авторской программе и учебнике.
2. Увеличено число часов на изучение тем:
- тема 2 «Строение вещества» вместо 15 часов - 17 часов, т.к. включена практическая работа «Распознавание пластмасс и волокон» и вводится дополнительный урок по решению расчетных задач (за счет резервного времени);
-тема 3 «Химические реакции» вместо 21 часа - 25 часов, т.к. включены практические работы №2 Скорость химических реакций и №3«Решение экспериментальных задач по теме «Гидролиз». Вводится 2 дополнительных урока по решению задач и выполнению упражнений по термохимии и кинетике, т.к эти задания вызывают у учащихся большие затруднения (за счет резервного времени);
-тема 4»Вещества и их свойства» вместо 33 часов - 38 часов, т.к. включены практические работы №4,№5, №6,№7;№8 ( перенесены из темы 5«Химический практикум» )
-тема 6 «Химия и повседневная жизнь» вместо 9 часов 13 часов, т.к. включена итоговая контрольная работа по курсу общей химии (за счет резервного времени).
3. Из авторской программы исключена часть учебного материала, который отсутствует в обязательном минимуме содержания основных образовательных программ для основной школы, также исключены некоторые демонстрационные опыты и лабораторные работы из-за недостатка времени на их выполнение при 3 часах в неделю, так как авторская программа предусматривает 3-4 часа в неделю.
Данная программа реализована в учебниках:
Габриелян, О. С., Маскаев Ф. Н., Пономарев С. Ю., Теренин В. И. Химия. 10 кл. Про
фильный уровень. М.: Дрофа; Габриелян О. С., Лысова Г. Г. Химия. 11 кл. Профильный уровень. - М.: Дрофа, с использованием рекомендаций: «Примерной программы основного общего образования по химии для VIII-XI классов общеобразовательных учреждений», составленной на основе федерального компонента государственного стандарта основного общего образования, 2006 год.
Описание места учебного предмета в учебном плане.
Химия относится к образовательной области «естествознание» в учебном плане. Изучается с 8 по 11 класс. Объём часов учебной нагрузки, отведённых на освоение рабочей программы, определён учебным планом образовательного учреждения и соответствует базисному плану. Настоящая рабочая программа учитывает направленность класса, в котором будет осуществляться учебный процесс, и органична по отношению к психолого-педагогическим особенностям возраста. Учащиеся химико-биологического профиля обладают достаточными знаниями и навыками, мотивированы к самообразованию, готовы проявлять творческий подход к делу, искать нестандартные способы решения проблем.
Согласно действующему в школе учебному плану и с учетом направленности класса, рабочая программа предусматривает следующие варианты организации процесса обучения: в 10 классе химико-биологического профиля предполагается обучение
в объеме 102 часа. (3 ч. в неделю)
Плановые контрольные работы - 8 час
Практические работы - 10 час
в 11 классе химико-биологического профиля предполагается обучение в объеме 102 часа. (3 ч. в неделю)
Плановые контрольные работы - 6 час
Практические работы - 8 час
Данная рабочая программа может быть реализована при использовании традиционной технологии обучения, а также элементов других современных образовательных технологий, передовых форм и методов обучения, таких как развивающее обучение, компьютерные технологии, тестовый контроль знаний и др. в зависимости от склонностей, потребностей, возможностей и способностей каждого конкретного класса.
Формы организации учебного процесса
Контроль уровня знаний учащихся предусматривает проведение практических, тестовых, самостоятельных и контрольных работ.
Формы промежуточной аттестации: тестирование и самостоятельные работы
ТРЕБОВАНИЯ К УРОВНЮ ПОДГОТОВКИ УЧАЩИХСЯ
В результате изучения химии на профильном уровне ученик должен знать/понимать
-
роль химии в естествознании, ее связь с другими естественными науками, значение в жизни современного общества;
-
важнейшие химические понятия: вещество, химический элемент, атом, молекула, масса атомов и молекул, ион, радикал, аллотропия, нуклиды и изотопы, атомные s-, p-, d-орбитали, химическая связь, электроотрицательность, валентность, степень окисления, гибридизация орбиталей, пространственное строение молекул, моль, молярная масса, молярный объем, вещества молекулярного и немолекулярного строения, комплексные соединения, дисперсные системы, истинные растворы, электролитическая диссоциация, кислотно-основные реакции в водных растворах, гидролиз, окисление и восстановление, электролиз, скорость химической реакции, механизм реакции, катализ, тепловой эффект реакции, энтальпия, теплота образования, энтропия, химическое равновесие, константа равновесия, углеродный скелет, функциональная группа, гомология, структурная и пространственная изомерия, индуктивный и мезомерный эффекты, электрофил, нуклеофил, основные типы реакций в неорганической и органической химии;
-
основные законы химии: закон сохранения массы веществ, периодический закон, закон постоянства состава, закон Авогадро, закон Гесса, закон действующих масс в кинетике и термодинамике;
-
основные теории химии: строения атома, химической связи, электролитической диссоциации, кислот и оснований, строения органических соединений (включая стереохимию), химическую кинетику и химическую термодинамику;
-
классификацию и номенклатуру неорганических и органических соединений;
-
природные источники углеводородов и способы их переработки;
-
вещества и материалы, широко используемые в практике: основные металлы и сплавы, графит, кварц, стекло, цемент, минеральные удобрения, минеральные и органические кислоты, щелочи, аммиак, углеводороды, фенол, анилин, метанол, этанол, этиленгликоль, глицерин, формальдегид, ацетальдегид, ацетон, глюкоза, сахароза, крахмал, клетчатка, аминокислоты, белки, искусственные волокна, каучуки, пластмассы, жиры, мыла и моющие средства;
уметь
-
называть изученные вещества по «тривиальной» и международной номенклатурам;
-
определять: валентность и степень окисления химических элементов, заряд иона, тип химической связи, пространственное строение молекул, тип кристаллической решетки, характер среды в водных растворах, окислитель и восстановитель, направление смещения равновесия под влиянием различных факторов, изомеры и гомологи, принадлежность веществ к различным классам органических соединений, характер взаимного влияния атомов в молекулах, типы реакций в неорганической и органической химии;
-
характеризовать: s- , p- и d-элементы по их положению в периодической системе Д.И.Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических соединений; строение и свойства органических соединений (углеводородов, спиртов, фенолов, альдегидов и кетонов, карбоновых кислот, аминов, аминокислот и углеводов);
-
объяснять: зависимость свойств химического элемента и образованных им веществ от положения в периодической системе Д.И. Менделеева; зависимость свойств неорганических веществ от их состава и строения; природу и способы образования химической связи; зависимость скорости химической реакции от различных факторов, реакционной способности органических соединений от строения их молекул;
-
выполнять химический эксперимент по: распознаванию важнейших неорганических и органических веществ; получению конкретных веществ, относящихся к изученным классам соединений;
-
проводить расчеты по химическим формулам и уравнениям реакций;
-
осуществлять самостоятельный поиск химической информации с использованием различных источников (справочных, научных и научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи информации и ее представления в различных формах;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
-
понимания глобальных проблем, стоящих перед человечеством: экологических, энергетических и сырьевых;
-
объяснения химических явлений, происходящих в природе, быту и на производстве;
-
экологически грамотного поведения в окружающей среде;
-
оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы;
-
безопасной работы с веществами в лаборатории, быту и на производстве;
-
определения возможности протекания химических превращений в различных условиях и оценки их последствий;
-
распознавания и идентификации важнейших веществ и материалов;
-
оценки качества питьевой воды и отдельных пищевых продуктов;
-
критической оценки достоверности химической информации, поступающей из различных источников.
УЧЕБНО - ТЕМАТИЧЕСКИЙ ПЛАН 10 класс
№
п\п
Наименование раздела и темы
По программе О.С.Габриеляна
По рабочей программе
Из них
практ.
работы
контр.
работы
1
Введение
5
5
-
1
2
Тема 1. Строение и классификация органических соединений
10
16
-
1
3
Тема 2. Химические реакции в органической химии
6
4
Тема 3. Углеводороды
24
25
2
1
5
Тема 4. Спирты и фенолы
6
10
1
1
6
Тема 5.Альдегиды и кетоны
7
8
1
1
7
Тема 6. Карбоновые кислоты. Сложные эфиры и жиры
10
11
1
1
8
Тема 7. Углеводы
7
7
1
9
Тема 8. Азотсодержащие органические соединения
9
11
2
1
10
Тема 9. Биологически активные органические соединения
6
9
2
1
11
Практикум
7
10
Итого
97 + 5ч резерв = 102ч
102 ч
10
8
УЧЕБНО - ТЕМАТИЧЕСКИЙ ПЛАН 11 класс
№
темы
Наименование раздела
По программе О.С.Габриеляна
По рабочей программе
Из них
практ.
работы
контр.
работы
1.
Строение атома
9
9
-
1
2.
Строение вещества
15
17
1
1
3.
Химические реакции
21
25
2
1
4.
Вещества и их свойства
33
38
5
2
5.
Химический практикум
10
-
-
6.
Химия в жизни общества
9
13
-
1
Итого
97 + 5ч резерв = 102ч
102
8
6
Календарно- тематическое планирование 10 класс
№п\п
Наименование раздела и темы
Часы учебного времени
Плановые сроки прохождения
Подготовка к ЕГЭ
Примечание
план
факт
Оборудование
Задание
на дом.
Введение (5час)
1.
1.Предмет органической химии
1
Д. Коллекция органических веществ, материалов и изделий из них.
§ 1.
упр 2-4
2
2. Основные положения теории строения органических соединений.
1
3.1
3.2
Д. Модели молекул метана, бутана, изобутана Взаимодействие натрия с этанолом и отсутствие взаимодействия с диэтиловым эфиром. Коллекция полимеров, природных и синтетических каучуков, лекарственных препаратов, красителей
§ 2
(1часть)
упр. 2.
3
3. Строение атома углерода. Ковалентная химическая связь
1
3.1
3.2
Д. Шаростержневые и объёмные модели молекул. Таблица «Строение атомов углерода»
§ 3
Упр. 1-3
4
4. Валентные состояния атома углерода. Вид гибридизации и форма молекул
1
3.1
3.2
Д. Шаростержневые и объемные модели молекул Н2, С12, N2, H2O, СН4. Шаростержневые и объемные модели СН4, С2Н4, С2Н2. Модель, выполненная из воздушных шаров, демонстрирующая отталкивание гибридных орбиталей.
§ 4
Упр. 2-4
5
5. Входной контроль.
1
Карточки-задания
§ 4
Записи в тетради
Тема 1. Строение и классификация органических соединений, химические реакции
в органической химии (16 часов)
6
1. Классификация органических соединений
1
3.3
Д. Образцы представителей различных классов органических соединений и шаростержневые или объемные модели их молекул.
§ 5,
стр. 26-30
7
2. Классификация органических соединений
1
3.3
Д. Таблицы «Название алканов и алкильных заместителей» и «Основные классы органических соединений».
§ 5 (весь) упр. 1-5
8
3. Номенклатура органических соединений
1
3.3
Д. Таблицы «Название алканов и алкильных заместителей» и «Основные классы органических соединений».
§ 6, упр. 1
9
4. Номенклатура органических соединений
1
3.3
Д. Таблицы «Название алканов и алкильных заместителей» и «Основные классы органических соединений».
§ 6, упр. 2
10
5. Изомерия органических соединений
1
3.2
3.3
Д. Шаростержневые модели органических соединений различных классов
§ 7,
упр. 1-3
11
6. Изомерия органических соединений
1
3.2
3.3
Д. Модели молекул изомеров разных видов изомерии.
§ 7,
упр. 4-7
12
7. Решение задач. Вычисление выхода продукта реакции от теоретически возможного.
1
4.3.5
4.3.6
4.3.8
4.3.9
ДМ, задачники
Решить задачи по вариантам
13
8. Решение комбинированных задач.
1
4.3.5
4.3.6
4.3.8
4.3.9
ДМ, задачники
Решить задачи по вариантам
14
9. Типы химических реакций в органической химии
1
1.4.1
Взрыв смеси метана с хлором. Обесцвечивание бромной воды этиленом и ацетиленом. Получение фенолоформальдегидной смолы.
§ 8
Упр. 1 - 4
15
10. Классификация реакций в органической химии
1
1.4.1
Деполимеризация полиэтилена. Получение этилена и этанола. Крекинг керосина.
Творческие задания
16
11. Электронные эффекты в молекулах органических веществ.
1
1.4.1
Взрыв гремучего газа. Горение метана или пропанобутановой смеси (из газовой зажигалки).
§ 9
(1 часть)
17
12. Электронные эффекты в молекулах органических веществ.
1
1.4.1
Взрыв гремучего газа. Горение метана или пропанобутановой смеси (из газовой зажигалки).
§ 9
(1 часть)
18
13. Химические связи в органических веществах. Способы их разрыва.
1
1.4.1
Взрыв смеси метана или пропанобутановой смеси с кислородом (воздухом).
§ 9
Упр. 4
19
14. Повторение и обобщение изученного материала
1
ДМ, задачники
Подготов. к контр. работе
20
15. Контрольная работа
№ 2 по теме:
Строение и классификация органических соединений, химические реакции в органической химии
1
Карточки-задания
21
16. Анализ контрольной работы
1
ДМ, задачники
Задание в тетради
Тема2. Углеводороды (25 часов)
22
1. Алканы.
1
3.3
Модели молекул алканов - шаростержневые и объемные. Лабораторные опыты. 1.Построение моделей молекул алканов. 2. Сравнение плотности и смешиваемости воды и углеводородов.
§11
стр.69-72, упр. 1-2
23
2. Химические свойства алканов
1
3.4
1.4.10
Горение метана, пропанобутановой смеси, парафина в условиях избытка и недостатка кислорода. Взрыв смеси метана с воздухом. Отношение метана, пропанобутановой смеси, бензина, парафина к бромной воде и раствору перманганата калия. Взрыв смеси метана и хлора, инициируемый освещением.
§11
стр.74- 81
упр. 5-7
24
3. Применение и способы получения алканов.
1
4.1.7
Получение метана из ацетата натрия и гидроксида натрия. Восстановление оксида меди (II) парафином.
§11
стр.72- 74, 81-83
упр. 9-11
25
4. Решение задач на нахождение молекулярной формулы вещества по продуктам сгорания.
1
4.3.7
ДМ, задачник
ПР № 1
стр. 297, задачи
26
5. Решение задач на нахождение молекулярной формулы органического соединения по массе(объёму) продуктов сгорания
1
4.3.7
ДМ, задачник
Подг к практ работе
27
6.Практическая работа № 1
«Качественный анализ органических соединений»
1
4.1.1
4.1.2
4.1.4
4.1.5
1.4.10
Парафин, порошок оксида меди, безводный сульфат меди, газоотводная трубка, штатив, известковая вода, спиртовка, медная проволока, хлороформ.
Оформ. отчёт
28
7. Циклоалканы
1
3.3
3.4
1.4.10
Шаростержневые модели молекул циклоалканов и алкенов. Отношение циклогексана к раствору перманганата калия и бромной воде.
§ 15
Упр. 1-3
29
8. Алкены
1
3.3
Шаростержневые и объемные модели молекул структурных и пространственных изомеров алкенов. Объемные модели молекул алкенов. Лабораторные опыты. 3. Построение моделей молекул алкенов.
§ 12
стр. 84-87
30
9. Химические свойства алкенов
1
3.4
1.4.10
Обесцвечивание этеном бромной воды. Обесцвечивание этеном раствора перманганата калия. Горение этена.
§ 12
стр. 89-99
Упр. 4,7,8
31
10. Применение и способы получения алкенов.
1
4.1.7
Получение этена из этанола. Лабораторные опыты. 4. Обнаружение алкенов в бензине.
§ 12
стр. 88-89, 99-101
Упр. 5, 10
32
11.
Практическая работа № 2
«Получение этилена и изучение его свойств»
1
4.1.1
4.1.2
4.1.4
4.1.5
4.1.7
штатив, 2 пробирки, газоотводная трубка, спиртовка, 2-3 мл этилового спирта, 6-9 мл конц. серной кислоты, 4-5 г прокаленного песка, бромная вода, разбавленный раствор перманганата калия, разб. серная кислота.
Оформ. отчёт
33
12. Алкадиены.
1
3.3
3.4
1.4.10
Модели (шаростержневые и объемные) молекул алкадиенов с различным взаимным расположением π-связей. Модели (шаростержневые и объемные) молекул алкадиенов с различным взаимным расположением π-связей.
§ 14
стр. 112-114
упр. 2-3
34
13. Свойства и получение алкадиенов.
1
3.4
1.4.10
4.1.7
Деполимеризация каучука.
Коагуляция млечного сока каучуконосов (молочая, одуванчиков или фикуса).
§ 14
стр. 114-120
упр. 5
35
14. Основные понятия химии высокомолекулярных соединений
1
Коллекция каучуков и резины
Конспект лекции
36
15. Алкины.
1
3.3
3.4
1.4.10
Получение ацетилена из карбида кальция. Физические свойства.
§ 13
стр.102-105
упр. 1-2
37
16. Химические свойства алкинов
1
3.4
1.4.10
Взаимодействие ацетилена с бромной водой. Взаимодействие ацетилена с раствором перманганата калия. Горение ацетилена. Взаимодействие ацетилена с раствором соли меди или серебра.
§ 13
стр.105-110
упр. 3-5
38
17. Применение и способы получения алкинов.
1
4.1.7
Лабораторные опыты. 5. Получение ацетилена и его реакции с бромной водой и раствором перманганата калия.
§ 13
39
18. Ароматические углеводороды.
1
3.3
3.4
1.4.10
Шаростержневые и объемные модели молекул бензола и его гомологов. Разделение с помощью делительной воронки смеси бензол - вода. Растворение в бензоле различных органических и неорганических (например, серы) веществ.
§ 16
стр.125-127
40
19. Изомерия и номенклатура гомологов бензола. Получение.
1
4.1.7
Экстрагирование красителей и других веществ (например, иода) бензолом из водных растворов.
§ 16
стр.127-130
упр. 1-2
41
20. Химические свойства аренов.
1
3.4
1.4.10
Горение бензола. Отношение бензола к бромной воде и раствору перманганата калия. Получение нитробензола. Обесцвечивание толуолом подкисленного раствора перманганата калия и бромной воды
§ 16
стр.130-140
упр. 3-5
42
21. Природные источники УВ. Решение комбинированных задач
1
4.3.7
Коллекция «Природные источники углеводородов». Сравнение процессов горения нефти и природного газа. Образование нефтяной пленки на поверхности воды.
Каталитический крекинг парафина. Растворение парафина в бензине и испарение растворителя из смеси. Плавление парафина и его отношение к воде (растворение, сравнение плотностей, смачивание). Разделение смеси бензин - вода с помощью делительной воронки.ДМ, задачник
§ 10
Упр. 1,2,4-6
43
22. Генетическая связь между классами углеводородов.
1
3.9
ДМ
Схемы взаимосвязи УВ
44
23. Обобщение темы
«Углеводороды»
1
ДМ, задачник
§ 10-16
Подгот к контрол работе
45
24.
Контрольная работа № 3
по теме «Углеводороды».
1
Карточки-задания
Осуществ цепочку превращ.
46
25. Анализ контрольной работы
1
ДМ, задачник
Осуществ цепочку превращ.
Тема 3. Спирты и фенолы (10 часов)
47
1. Спирты: состав, классификация, строение.
Предельные одноатомные спирты.
1
3.3
3.5
3.6
Шаростержневые модели молекул изомеров с молекулярными формулами С3Н8О и С4Н10О.
Физические свойства этанола, пропанола-1 и бутанола-1. Лабораторные опыты. 6. Построение моделей молекул изомерных спиртов.
7. Растворимость спиртов с различным числом атомов углерода в воде.
§ 17
стр.143-146
упр. 1-3
48
2. Химические свойства предельных одноатомных спиртов.
1
3.5
3.6
Количественное вытеснение водорода из спирта натрием. Сравнение реакций горения этилового и пропилового спиртов.
Сравнение скоростей взаимодействия натрия с этанолом, пропанолом-2, глицерином.
Получение простого эфира. Получение сложного эфира.
§ 17
стр.143-147
записи в тетради
упр. 4-6
49
3. Получение предельных одноатомных спиртов.
1
4.1.8
Получение этена из этанола.
§ 17
стр.147-153
упр. 8-12
50
4. Многоатомные спирты. Вычисления по термохимическим уравнениям.
1
3.3
3.4
3.5
Лабораторные опыты. 8. Растворимость многоатомных спиртов в воде. 9. Взаимодействие многоатомных спиртов с гидроксидом меди (II).
§ 17
стр.153-157
51
5. Фенолы. Химические свойства фенолов.
1
3.3
Растворимость фенола в воде при обычной и повышенной температуре.
§ 18
стр.159-163
упр. 1
Конспект лекции
52
6. Получение и применение фенолов.
1
3.4
3.5
4.1.8
Вытеснение фенола из фенолята натрия угольной кислотой. Реакция фенола с хлоридом железа (III). Реакция фенола с формальдегидом. Лабораторные опыты. 10. Взаимодействие водного раствора фенола с бромной водой.
§ 18
стр.163-168
упр. 3, 5
Подгот к ПР № 3
53
7. Практическая работа № 3
«Спирты»
1
4.1.1
4.1.2
4.1.4
4.1.5
4.1.8
Этанол, изоамиловый спирт, вода, глицерин, гидроксид натрия, сульфат меди, дихромат калия, спиртовка, спички.
Оформ. отчёт
54
8. Систематизация и обобщение знаний о спиртах, и фенолах.
1
3.3
3.5
3.6
ДМ, задачники
Задания в тетрадях
55
9. Контрольная работа №4 «Спирты и фенолы»
1
Карточки-задания
Осуществ цепочку превращ.
56
10. Анализ контрольной работы
1
ДМ, задачники
Осуществ цепочку превращ.
Тема 4. Карбонильные соединения: альдегиды и кетоны (8 часов)
.
57
1. Альдегиды и кетоны.
1
3.3
Шаростержневые модели молекул альдегидов и изомерных им кетонов. Лабораторные опыты. 11.Построение моделей молекул изомерных альдегидов и кетонов.
§ 19
стр.169-172
упр. 1-3
58
2. Химические свойства альдегидов и кетонов.
1
3.5
3.6
Окисление бензальдегида на воздухе. Реакция «серебряного зеркала». Окисление альдегидов гидроксидом меди (II).
§ 19
стр.173-177
Упр. 4-6
59
3. Химические свойства альдегидов и кетонов.
1
3.5
3.6
Лабораторные опыты. 12. Реакция «серебряного зеркала». 13. Окисление альдегидов гидроксидом меди (II). 14. Окисление бензальдегида кислородом воздуха.
§ 19
стр.173-177
Упр. 7-9
60
4. Получение карбонильных соединений. Отдельные представители.
1
4.1.8
ДМ
§ 19 стр. 177-178
61
5.Практическая работа № 4
«Альдегиды и кетоны»
1
4.1.1
4.1.2
4.1.4
4.1.5
Раствор формалина, аммиачный раствор оксида серебра, бензальдегид, ацетат кальция, спиртовка, спички, концентрированная соляная кислота, вода
§ 19
Упр. 10-12
62
6. Систематизация и обобщение знаний об альдегидах и кетонах.
1
3.3
3.5
3.6
ДМ, задачники
Подгот. к контр. работе
63
7. Контрольная работа № 5
Тема: Спирты. Фенолы. Карбонильные соединения
1
Карточки-задания
Осущест цепочку превращ.
64
8. Анализ контрольной работы
1
ДМ, задачники
Осущестцепочку превращ.
Тема 5. Карбоновые кислоты, сложные эфиры, жиры (11 часов)
65
1. Карбоновые кислоты.
1
3.3
Знакомство с физическими свойствами некоторых карбоновых кислот: муравьиной, уксусной, пропионовой, масляной, щавелевой, лимонной, олеиновой, стеариновой, бензойной. Возгонка бензойной
кислоты. Отношение различных карбоновых кислот к воде.
§ 20
стр.180-183
66
2. Одноосновные карбоновые кислоты.
1
3.3
3.6
Сравнение кислотности среды водных растворов муравьиной и уксусной кислот одинаковой молярности. Лабораторные опыты. 15. Построение моделей молекул изомерных карбоновых кислот и сложных эфиров.
§ 20 стр. 180 - 183, записи в тетради
67
3. Химические свойства предельных и непредельных одноосновных карбоновых кислот.
1
3.6
Получение приятно пахнущего сложного эфира. Отношение к бромной воде и раствору перманганата калия предельной и непредельной карбоновых кислот.
§ 20 стр. 184-188
упр. 6-10
68
4. Химические свойства предельных и непредельных одноосновных карбоновых кислот.
1
3.6
Лабораторные опыты. 16. Сравнение силы уксусной и соляной кислот в реакциях с цинком. 17. Сравнение растворимости в воде карбоновых кислот и их солей. 18. Взаимодействие карбоновых кислот с основными оксидами, основаниями, амфотерными гидроксидами и солями.
§ 20 конспект урока
упр. 13-16
69
5. Получение карбоновых кислот. Отдельные представители.
1
4.1.8
Эксп.з. Получение уксусной кислоты из ацетата натрия.
Получение карбоновой кислоты из мыла
§ 20 стр. 190-193РТ стр. 79 таблица
70
6. Сложные эфиры. Жиры.
1
3.6
Шаростержневые модели молекул сложных эфиров и изомерных им карбоновых кислот. Отношение сливочного, подсолнечного и машинного масла к водным растворам брома и перманганата калия. Лабораторные опыты. 19. Растворимость жиров в воде и органических растворителях.
§ 21 стр. 196-200
Упр. 10-12
71
7. Соли карбоновых кислот. Мыла.
1
3.6
Эксп.з.
Распознавание растворов ацетата натрия, карбоната натрия, силиката натрия и стеарата натрия.
Распознавание образцов сливочного масла и маргарина
Конспект урока
ПР. № 5
Подготовить уравнения
72
8.Практическая работа № 5
«Карбоновые кислоты»
1
4.1.1
4.1.2
4.1.4
4.1.5
Уксусная, бензойная, серная кислоты. Этанол, цинк, вода, гидроксид натрия, изоамиловый спирт, спиртовка, спички
Оформ. отчёт
73
9. Систематизация и обобщение знаний по теме: «Карбоновые кислоты, сложные эфиры, жиры».
1
3.6
ДМ. Задачники
Подготов. к контрол. работе
74
10. Контрольная работа № 5
«Карбоновые кислоты, сложные эфиры, жиры».
1
Карточки-задания
Осуществ цепочку превращ.
75
11. Анализ контрольной работы
1
ДМ. Задачники
Сообщения:
Значение углеводовКлассиф. углеводов
Тема 6. Углеводы (7 часов)
76
1. Углеводы.
1
3.3
3.8
Образцы углеводов и изделий из них.
§ 22
упр. 5-6
77
2. Моносахариды: глюкоза и фруктоза.
1
3.3
3.6
3.8
Реакция «серебряного зеркала» для глюкозы. Взаимодействие глюкозы с фуксинсернистой кислотой. Лабораторные опыты. 20. Ознакомление с физическими свойствами глюкозы. 21. Взаимодействие глюкозы с гидроксидом меди (II) при обычных условиях и при нагревании.
§ 23
упр. 9-11
78
3. Моносахариды: рибоза и дезоксирибоза.
1
3.3
3.6
3.8
Слайд-презентация, ноутбук, проектор
Конспект урока в тетради
79
4. Дисахариды.
1
3.3
3.6
3.8
Взаимодействие сахарозы с гидроксидом меди (II). Получение сахарата кальция и выделение сахарозы из раствора сахарата кальция. Отношение растворов сахарозы и мальтозы (лактозы) к гидроксиду меди (II) при нагревании. Лабораторные опыты. 22. Взаимодействие глюкозы и сахарозы с аммиачным раствором оксида серебра. 23. Кислотный гидролиз сахарозы.
Конспект урока в тетради
80
5. Полисахариды: крахмал и целлюлоза.
1
3.3
3.6
3.8
Ознакомление с физическими свойствами целлюлозы и крахмала. Набухание целлюлозы и крахмала в воде. Получение нитрата целлюлозы. Лабораторные опыты. 24. Качественная реакция на крахмал. 25. Знакомство с коллекцией волокон
§ 24
упр. 1, 5
ПР. № 6
Подготовить уравнен.
81
6.Практическая работа № 6
«Углеводы»
1
4.1.1
4.1.2
4.1.4
4.1.5
Раствор глюкозы, сахарозы, крахмал,аммиачный раствор оксида серебра, гидроксид натрия, сульфат меди, серная кислота, спиртовой раствор йода, вода, спиртовка, спички
Оформ. отчёт
82
7. Систематизация и обобщение знаний по теме «Углеводы»
1
3.3
3.6
3.8
Эксп.з. Распознавание растворов глюкозы и глицерина.
Определение наличия крахмала в меде, хлебе, маргарине.
ДМ. Задачники
Задания в тетради
Тема 7. Азотсодержащие органические вещества (11 часов)
83
1. Амины.
1
3.7
3.8
Физические свойства метиламина. Лабораторные опыты. 26. Построение моделей молекул изомерных аминов.
§ 25 стр. 218-220, 222
упр. № 1-3
84
2. Химические свойства аминов и способы получения.
1
3.7
3.8
Горение метиламина. Взаимодействие анилина и метиламина с водой и кислотами. Отношение бензола и анилина к бромной воде. Окрашивание тканей анилиновыми красителями Лабораторные опыты. 27. Смешиваемость анилина с водой. 28. Образование солей аминов с кислотами.
§ 25
упр. 4, 8
85
3. Аминокислоты.
1
3.7
3.8
Обнаружение функциональных групп в молекулах аминокислот. Нейтрализация щелочи аминокислотой. Нейтрализация кислоты аминокислотой.
§ 26
стр. 232
№ 5-7
86
4. Белки.
1
3.7
3.8
Растворение и осаждение белков. Денатурация белков. Качественные реакции на белки.
§ 27
стр.233-238
87
5. Белки.
1
3.7
3.8
Лабораторные опыты. 29. Качественные реакции на белки.
§ 27
упр. № 9-10
ПР. № 7
88
6.Практическая работа № 7
«Амины. Аминокислоты. Белки».
1
4.1.1
4.1.2
4.1.4
4.1.5
Анилин, вода, соляная кислота, гидроксид натрия, бромная вода, глицин, порошок оксида меди, раствор белка, сульфат меди, ацетат свинца, конц. азотная кислота, раствор аммиака, спиртовка.
Оформ. отчёт
89
7. Нуклеиновые кислоты.
Понятие о пиримидиновых и пуриновых основаниях.
1
3.7
3.8
Модели молекулы ДНК и различных видов молекул РНК.
§ 28
Упр. № 1-2
90
8. Генная инженерия и биотехнология.
1
3.7
3.8
Образцы продуктов питания из трансгенных форм растений и животных; лекарств и препаратов, изготовленных с помощью генной инженерии.
Конспект урока, подгот к ПР №8
91
9.Практическая работа № 8
« Идентификация органических веществ»
1
4.1.1
4.1.2
4.1.4
4.1.5
Растворы гидроксида натрия, серной кислоты, карбоната натрия, перманганата калия, брома, сульфата меди. Аммиачный раствор оксида серебра. Бензойная кислота, анилин, глюкоза, формалин, этанол, глицерин, уксусная кислота
Оформ. отчёт
92
10. Обобщение и систематизация знаний по теме «Углеводы и азотсодержащие органические соединения»
1
ДМ. Задачники.
Подготов. к контрольн. работе
93
11. Контрольная работа № 6
«Углеводы и азотсодержащие органические соединения»
1
Карточки-задания
Задания в тетрадях
Тема 8. Биологически активные вещества (9 часов)
94
1.Витамины.
1
Образцы витаминных препаратов. Поливитамины. Иллюстрации фотографий животных с различными формами авитаминозов. Лабораторные опыты. 30. Обнаружение витамина А в растительном масле. 31. Обнаружение витамина С в яблочном соке. 32. Обнаружение витамина D в желтке куриного яйца.
Презентации, устные сообщения, схемы.
95
2. Ферменты.
1
Сравнение скорости разложения Н2О2 под действием фермента (каталазы) и неорганических катализаторов (KI, FeCl3, MnO2).Лабораторные опыты. 33. Ферментативный гидролиз крахмала под действием амилазы. 34. Разложение пероксида водорода под действием каталазы. 35. Действие дегидрогеназы на метиленовый синий.
Презентации, устные сообщения, схемы.
96
3.Гормоны.
1
Плакат или кодограмма с изображением структурных формул эстрадиола, тестостерона, адреналина. Взаимодействие адреналина с раствором FeCl3. Белковая природа инсулина (цветные реакции на белки). Лабораторные опыты. 36. Испытание растворимости адреналина в воде и соляной кислоте.
Презентации, устные сообщения, схемы.
97
4. Лекарства.
1
Плакаты или кодограммы с формулами амида сульфаниловой кислоты, дигидрофолиевой и ложной дигидрофолиевой кислот, бензилпенициллина, тетрациклина, цефотаксима, аспирина.
Лабораторные опыты. 37. Обнаружение аспирина в готовой лекарственной форме (реакцией гидролиза или цветной реакцией с сульфатом бериллия).
Презентации, устные сообщения, схемы.
ПР. № 9
98
5.Практическая работа № 9
«Действие ферментов на различные вещества»
1
4.1.1
4.1.2
4.1.4
4.1.5
слюна, крахмал, спиртовой раствор йода, предметное стекло, лёд, спиртовка, аптечный
формалин, некипячёное молоко, метиленовый синий, подсолнечное масло, стеклянная трубка, резиновая груша, перекись водорода, сырое и варёное мясо, сырой и варёный картофель
Оформ. Отчёт
ПР. № 10
99
6. Практическая работа
№ 10
«Анализ лекарственных препаратов»
1
4.1.1
4.1.2
4.1.4
4.1.5
Знакомство с образцами лекарственных препаратов (их анализ). Упаковки образцов лекарственных препаратов (без содержимого), инструкции по их применению. Салициловая кислота, аспирин, салол, этанол, гидроксид натрия, хлорид железа(!!!), парацетомол, фенацетин, вода.
Оформ. отчёт
100100
7. Обобщение и систематизация знаний за курс 10 класса
1
ДМ. Задачники
Задания в тетрадях
101
8. Итоговая контрольная работа №7
1
Карточки- задания
102
9. Анализ контрольной работы
Итоговое занятие
1
Календарно- тематическое планирование 11 класс
№п\п
Наименование раздела и темы
Часы учебного времени
Плановые сроки прохождения
Оборудование
Примечание
план
факт
Подготовка к ЕГЭ
Зада ние
на дом.
Строение атома
(9 часов)
1.
Атом - сложная частица
1
Слайд-лекция «Методы научного познания», ПК, проектор.
ПСХЭ. Таблицы «Строение атома». Модели атомов
§1 упр.1-5 стр.5
2
Состояние электронов в атоме
1
Таблицы.
Слайд-лекция «Строение атома. АМУ», проектор, ноутбук
§2,3, упр. 1,2
стр. 10
3,4 стр.23
3,4
Электронные конфигурации атомов химических элементов
2
Таблицы «Распределение электронов
по уровням».
ПСХЭ
§2,3, упр.
3,4 стр.23
5
Валентные возможности атомов химических элементов
1
ПСХЭ.
ДМ
§4, упр.7 стр.25
6-7
Периодический закон и Периодическая система химических элементов Д.И. Менделеева в свете учения о строении атома
1
ПСХЭ. Портрет Д. И. Менделеева. Видеофильм «Великий закон»
§5, стр.33-35
Упр.6,7 стр.41
8
Обобщение и систематизация знаний по теме.
1
Д. Анализ и синтез химических веществ.
ПСХЭ, ДМ
Повторение гл. 1,
§ 1-5
9
Контрольная работа №1
по теме 1 «Строение атома»
1
КР «Строение атома», с. 132
(О. С. Габриелян.
Методическое
пособие)
Повторить пройденный материал
Тема 2. Строение вещества. Дисперсные системы. (17часов)
10
Химическая связь. Единая природа химической связи. Ионная химическая связь
1
Слайд-лекция «Химическая связь», проектор, ноутбук.
ПСХЭ.
Д. Модели крис-
таллических решеток с различным типом связей
§6, упр.5,7 стр.55
11-12
Ковалентная химическая связь
Свойства ковалентной связи.
2
Слайд-лекция «Химическая связь», проектор, ноутбук.
ПСХЭ.
Д. Модели крис-
таллических решеток различных веществ
Индивидуальные задания
13
Металлическая химическая связь.
1
Слайд-лекция «Химическая связь», проектор, ноутбук.
ПСХЭ.
Д. Модели крис-
таллических решеток различных веществ
§ 6 стр.50
14
Водородная химическая связь
1
Задачники, ДМ, ПСХЭ.
Слайд-лекция «Степень окисления», ноутбук, проектор
§ 6, стр. 50-52
15-16
Гибридизация орбиталей и геометрия молекул
2
Д. Модели молекул различной геометрии. Л. Изготовление моделей молекул воды, аммиака, метана и др.
Карточки-задания
§ 7 , упр.2-4 стр.62.
17-18
Теория строения химических соединений А.М. Бутлерова (ТСБ)
2
Слайд-лекция «Теория Бутлерова», проектор, ноутбук.
Д. Модели изомеров и гомологов. Таблицы «Гомологические ряды», «Генетические связи»
§ 8, упр 1,3,6 стр.77
19
Полимеры. Способы получения, строение полимеров.
1
Д. Слайд-лекция «Полимеры», проектор, ноутбук.
Вопросы к семинару.
§ 9 упр.4-6 стр.90
20
Полимеры органические и неорганические. Каучуки, пластмассы, волокна, биополимеры.
1
Л. Знакомство
с образцами
полимеров.
Образцы различных полимеров, коллекции
§ 9
21
Практическая работа №1
Распознавание пластмасс и волокон.
1
ПР 8, с. 406.
Фенопласт, целлулоид, полиэтилен, капрон, ПВХ, полистирол, полиметилметакрилат, вискоза, шерсть, нитрон, лавсан, хлорин, капрон, шерсть, спиртовка, спички
22
Дисперсные системы
1
Д. Эффект Тиндаля. Образцы различных систем с жидкой средой.
Слайд-лекция «Дисперсные системы», проектор, ноутбук.
Образцы золей, гелей, истинных растворов
§ 10, стр.90-95
23
Растворы
1
Слайд-лекция «Растворы», проектор, ноутбук.
§ 10, стр.95-98
Упр.5,6 стр.98
24
Решение задач, связанные с понятиями «массовая доля», «объёмная доля» компонентов смеси, молярная концентрация растворов.
1
ДМ , задачники
§ 10, в.5,6
Задание по тетради
25
Обобщение и систематизация знаний по теме.
1
Д. Модели ионных, атомных, молекулярных и металлических кристаллических решеток.
ПСХЭ.
ДМ
§6-10
26
Контрольная работа №2
по теме 2 «Строение вещества. Дисперсные системы и растворы»
1
ДМ.
ПСХЭ.
КР «Строение вещества»,
с. 135 (О. С. Га-бриелян. Методическое пособие)
Повторить пройденный материал
Тема 3. Химические реакции (25 часов)
27-28
Классификация химических реакций в неорганической и органической химии
2
Д. Получение аллотропных модификаций серы и фосфора.
Слайд-лекция «Типы химических реакций», проектор, ноутбук
§11, упр.3, стр.118
§11 упр.5.6.7 стр.118
29-30
Вероятность протекания химических реакций
2
Д. Растворение окрашенных веществ в воде.
Видеофрагмент «Тепловой эффект химической реакции»
§12, упр. 4-6
31-32
Скорость химических реакций
Катализ.
2
Слайд-лекция «Скорость химических реакций», проектор, ноутбук.
Д. Взаимодействие растворов сульфата натрия и хлорида бария, натрия с водой и этанолом, тиосульфата натрия и серной кислоты при разных температурах и концентрациях серной кислоты.
Д.Опыты, иллюстрирующие действие катализаторов и ингибиторов.
Д.Взаимодействие цинка (порошок и гранулы) с соляной кислотой и др.ависимость скорости реакции от концентрации и температуры
Д. Разложение пероксида водорода в присутствии катализатора (оксида марганца (IV) и фермента каталазы)
§13, упр. 1,6,8 стр. 144-145
Пр. работа №2 стр.384
33
Практическая работа №2. «Скорость химических реакций»
1
Иодид калия пероксид водорода, крахмальный клейстер, р-р йода, сульфат меди, оксид азота, штатив с пробирками, спиртовка.
С 384-386, отчёт
34-35
Обратимость химических реакций. Химическое равновесие. Принцип Ле Шателье.
2
Портрет Ле Шателье, таблицы
Задачники.
ДМ
§14, упр.3,4,5 стр. 152
36-37
Окислительно-восстановительные реакции в неорганической химии
2
Слайд-лекция «ОВР», проектор, ноутбук.
ДМ.
Таблица
«Направление ОВР в различных средах»
Конспект лекции, инд. задание
38
Окислительно-восстановительные реакции в органической химии
1
Слайд-лекция «ОВР», проектор, ноутбук.
ДМ.
Таблица
«Направление ОВР в различных средах»
Конспект лекции
39-40
Электролитическая диссоциация
2
Слайд-лекция «ТЭД», проектор, ноутбук.
§15, упр. 9 стр. 164
41
Реакции ионного обмена
1
Л. Проведение реакций ионного обмена для характеристики свойств электролитов
§15, упр. 10 стр. 164
42
Водородный показатель
1
Презентация учебного проекта «рН среды и здоровье человека».
Компьютер, проектор
§ 15
(до кон-
ца), упр. 6-7
43-44
Гидролиз неорганических соединений
2
Л. Определение характера среды с помощью универсального индикатора
§16, упр. 3.4 стр. 182
45
Гидролиз органических соединений
1
Л. Определение характера среды с помощью универсального индикатора
§16, упр. 3.4 стр. 182
46
Практическая работа №3 «Решение экспериментальных задач по теме «Гидролиз»
1
ПР №4
Растворы хлорида алюминия, сульфида натрия, хлорида железа 3 , соляной кислоты; порошок цинка, желудочный сок, грушевая эссенция, 2 стеклянные трубки со свёрнутым белком, фенолфталеин, конц. щёлочь, колба, водяная баня.
Оформить отчёт
47-48
Решение задач и упражнений по термохимии и кинетике;
2
ДМ.
Задачники
Задачи в тетради, инд. задание
49-50
Обобщение и систематизация знаний по теме.
1
ДМ.
Задачники
По-вторить гл. 3
51
Контрольная работа №3
по теме 3 «Химические реакции»
1
ДМ. КР «Химические реакции», с. 139
(О. С. Габриелян. Методическое пособие)
Задачник: Хомчен-ко И. Г., № 12.1-
2.21
Тема 4. Вещества и их свойства (38 часов)
52
Классификация неорганических веществ
1
Слайд-лекция «Основные классы неорганических веществ», проектор, ноутбук
§ 17,
упр. 1-3
53-54
Классификация органических веществ).
2
Слайд-лекция «Основные классы органических веществ», проектор, ноутбук
§ 17, упр. 4-7
55
Металлы. Простые вещества- металлы. Общие физические свойства.
1
Слайд-лекция «Металлы», проектор, ноутбук.
Л. Образцы Ме и их соединений Слайд-лекции «Щелочные металлы», «Щелочно-земельные», «Алюминий», проектор, ноутбук
§ 18, упр. 1-10
56-57
Общие химические свойства металлов.
2
Д. Горение железа, магния. Взаимодействие меди с кислородом и серой, Nа с водой, оксида кальция с водой. Устранение жесткости воды. Качественные реакции на ионы кальция, бария, железа Доказательство прочности оксидной пленки алюминия.
Лекции.
Упр. 10-13, с. 262
58-59
Коррозия металлов
2
Д. Опыты по коррозии Ме и защите от нее
§ 18, упр. 14-17
60
Общие способы получения металлов
1
Слайд-лекция «Металлургия», проектор, ноутбук.
§ 18
(до конца),
№ 29, 31, 37
61
Электролиз расплавов веществ
1
ДМ, задачники
§ 18
62-63
Электролиз растворов веществ.
2
ДМ, задачники
§ 18
64-65
Переходные металлы.
2
Слайд-лекции «Железо»,
«d-элементы», проектор, ноутбук
Д.
Получение и свойства оксидов и гидроксидов хрома, железа
§ 18,
с. 240-
260
66
Решение задач и упражнений по теме «Металлы»
1
ДМ.
Задачники
Задачи в тетради, инд. задание
67-68
Неметаллы
2
Д. Горение серы и фосфора. Возгонка йода, растворение йода в спирте. Получение СО2 и кремниевой кислоты.
Слайд-лекция «Общая характеристика неметаллов», проектор, ноутбук
Л. Знакомство
с образцами НеМе (работа с коллекциями). Ознакомление со свойствами карбонатов и гидрокарбонатов
§ 19, упр. 1-7
69
Водородные соединения неметаллов. Несолеобразующие и солеобразующие оксиды.
1
ДМ
§ 19, упр. 8,10
70
Изменение кислотных свойств высших оксидов и гидроксидов неметаллов в периодах и группах.
1
ДМ
§ 19, упр. 9,11,12
71
Решение задач и упражнений по теме «Неметаллы»
1
ДМ, задачники
§ 19, упр. 13-21
72
Практическая работа №4 Получение, собирание и распознавание газов и изучение их свойств.
1
ПР №1
Штатив, пробирки, газоотводная трубка, химический стакан, стекловата, спиртовка (или электронагреватель), цилиндр, стеклянная пластинка, кристаллизатор, перманганат калия, стеклянная воронка, гранулы цинка, разбавленная соляная кислота, оксид меди карбонат кальция (мел), соляная кислота,
кристаллический хлорид аммония, р-р гидроксида натрия.
73
Обобщение и систематизация знаний
1
ДМ.
Задачники
Повторить
§ 18
74
Контрольная работа №4 по теме «Металлы и неметаллы»
1
75-76
Кислоты органические и неорганические
2
Д. Слайд-лекция «Кислоты», проектор, ноутбук.
Д. Взаимодействие концентрированной серной и азотной кислот с Ме.
Л. Распознавание хлоридов и сульфатов
§ 20, упр. 1-9
77-78
Основания органические и неорганические
2
Слайд-лекция «Основания», проектор, ноутбук
§ 21, упр. 1-7
79-80
Амфотерные органические и неорганические соединения
2
Л. Взаимодействие цинка и железа с растворами кислот и щелочей
§ 22, упр. 1-4
81
Практическая работа №5 Сравнение свойств неорганических и органических соединений
1
ПР №3
Штатив, пробирки, изоамиловый спирт, уксусная и серная кислоты конц., водяная баня, пробирка с холодной водой или насыщенный раствор поваренной соли, делительная воронка, фарфоровая чашка, борная кислота ( кристалл.) , этиловый спирт, стеклянная палочка, лучинка, нитрат цинка, гидроксид натрия, соляная кислота, карбонат натрия, глицин, спиртовка, пробиркодержатель, стекло, нитрат и ацетат свинца, иодид калия.
82
Практическая работа №6 Решение экспериментальных задач по неорганической химии.
1
ПР №5
Штатив, пробирки, химический стакан, индикаторы. Кристаллогидрат сульфата меди (II), карбонат магния, карбонат кальция, гидроксид натрия, железо, разб. соляная кислота, хлорид железа (III), сульфат аммония, нитрат меди (II), нитрат серебра, сульфат натрия, хлорид бария, сульфат алюминия, разб. серная и азотная кислоты.
83
Практическая работа №7. Решение экспериментальных задач по органической химии
1
ПР №6
Шесть пробирок с р-ры веществ (для определения): этанол, уксусная кислота, глюкоза, глицерин, этаналь, крахмал. Спиртовка, штатив, держатель, р-ры гидроксида меди (II), гидроксида натрия, серная кислота (разб.), водные р-ры карбоната натрия, перманганата калия, сульфата меди, бромная вода, аммиачный раствор оксида
серебра, индикаторы, раствор иода в спирте.
84-85
Генетическая связь между классами органических и неорганических соединений
2
ДМ.
Таблица «Генетическая связь неорганических веществ»
§ 23, упр. 1-5.
ПР 7,
с. 405
86
Практическая работа №8 Генетическая связь между классами неорганических и органических веществ
1
ПР №7
Штатив, спиртовка, пробирки, держатель, химический стакан, гранулы железа, соляная кислота (разб.), р-р гидроксида натрия, фарфоровая чашка, фильтр, индикатор.
Гранулы алюминия, наждачная бумага, серная кислота(разб.), гидроксид натрия, индикаторы.
Штатив, пробирки, газоотводная трубка, химический стакан, спиртовка, нагреватель, 2-3 мл этилового спирта, 6-9 мл конц. серной кислоты, 4-5 г прокаленного песка, бромная вода, разбавленный раствор перманганата калия, разб. серная кислота. Вариант (на выбор учителя) - осуществление практических превращений по цепочке: этанол → этаналь → уксусная кислота → сложный эфир.
87-88
Обобщение и систематизация знаний по теме
1
ДМ.
Задачники
Повторить
гл. 4
89
Контрольная работа №5 по теме «Вещества и их свойства»
1
ДМ.
КР «Вещества и их свойства», с. 144 (О. С. Га-бриелян. Методическое пособие)
Задачник: Хомченко И. Г.,
№ 30.57,
30.47
Тема 6. Химия в жизни общества (11 часов + 2 часа резервное время)
90-91
Химия и производство
2
Слайд-лекция «Химия в жизни общества», проектор, ноутбук.
Таблицы, модели производства Н2SO4 и NH3.
Л. Ознакомление с различными видами топлива
§24
Таблица 22
92-93
Химия и сельское хозяйство
2
Коллекции удобрений и пестицидов.
Учебный видеофильм.
Л. Ознакомление с различными видами удобрений
§25 упр.1-10 стр.339
94-95
Химия и экология
2
Слайд-презента-ции проектов учащихся «Химия и проблемы окружающей среды», проектор, ноутбук
§26 упр.1-8 стр.351
96-97
Химия и повседневная жизнь человека
2
Слайд-лекции «Химия и пища», «Химические средства гигиены и косметики», проектор, ноутбук. Защита учебных проектов по теме «Химия и повседневная жизнь человека»
§27 упр. 1-14 стр.382
98-99
Обобщение и систематизация знаний по курсу
2
ДМ, задачники
Подготовиться к контрольной работе.
100
Итоговая контрольная работа
1
Задание в тетради
101
Анализ контрольной работы
1
ДМ, задачники
102
Итоговое занятие
1
ДМ, задачники
Содержание программы
10 КЛАСС (ОРГАНИЧЕСКАЯ ХИМИЯ)
(3 ч в неделю; всего 102 ч)
Введение (5 ч)
Предмет органической химии. Особенности строения и свойств органических соединений. Значение и роль органической химии в системе естественных наук и в жизни общества. Краткий очерк истории развития органической химии.
Предпосылки создания теории строения: теория радикалов и теория типов, работы А. Кекуле, Э. Франкланда и А. М. Бутлерова, съезд врачей и естествоиспытателей в г. Шпейере. Основные положения теории строения органических соединений А.М. Бутлерова. Химическое строение и свойства органических веществ. Изомерия на примере н-бутана и изобутана.
Электронное облако и орбиталь, их формы: s и р. Электронные и электронно-графические формулы атома углерода в нормальном и возбужденном состояниях. Ковалентная химическая связь и ее разновидности: s u p. Водородная связь. Сравнение обменного и донорно-акцепторного механизмов образования ковалентной связи.
Первое валентное состояние - sp3-гибридизация - на примере молекулы метана и других алканов. Второе валентное состояние - sр2-гибридизация - на примере молекулы этилена. Третье валентное состояние - sp-гибридизация - на примере молекулы-ацетилена. Геометрия молекул рассмотренных веществ и характеристика видов ковалентной связи в них. Модель Гиллеспи для объяснения взаимного отталкивания гибридных орбиталей и их расположения в пространстве с минимумом энергии.
Демонстрации. Коллекция органических веществ, материалов и изделий из них. Модели молекул СН4 и СН3ОН; С2Н2, С2Н4 и С6Н6; н-бутана и изобутана. Взаимодействие натрия с этанолом и отсутствие взаимодействия с диэтиловым эфиром. Коллекция полимеров, природных и синтетических каучуков, лекарственных препаратов, красителей. Шаростержневые и объемные модели молекул Н2, С12, N2, H2O, СН4. Шаростержневые и объемные модели СН4, С2Н4, С2Н2. Модель, выполненная из воздушных шаров, демонстрирующая отталкивание гибридных орбиталей.
Тема 1 Строение и классификация органических соединений, химические реакции в органической химии (16 ч)
Классификация органических соединений по строению «углеродного скелета»: ациклические (алканы, алкены, алкины, алкадиены), карбоциклические (циклоалканы и арены) и гетероциклические. Классификация органических соединений по функциональным группам: спирты, фенолы, простые эфиры, альдегиды, кетоны, карбоновые кислоты, сложные эфиры.
Номенклатура тривиальная, рациональная и ИЮПАК. Рациональная номенклатура как предшественник номенклатуры ИЮПАК. Принципы образования названий органических соединений по ИЮПАК: замещения, родоначальной структуры, старшинства характеристических групп (алфавитный порядок).
Структурная изомерия и ее виды: изомерия «углеродного скелета», изомерия положения (кратной связи и функциональной группы), межклассовая изомерия. Пространственная изомерия и ее виды: геометрическая и оптическая. Биологическое значение оптической изомерии. Отражение особенностей строения молекул геометрических и оптических изомеров в их названиях.
Понятие о реакциях замещения. Галогенирование алканов и аренов, щелочной гидролиз галогеналканов.
Понятие о реакциях присоединения. Гидрирование, гидрогалогенирование, галогенирование. Реакции полимеризации и поликонденсации.
Понятие о реакциях отщепления (элиминирования). Дегидрирование алканов. Дегидратация спиртов. Дегидрохлорирование на примере галогеналканов. Понятие о крекинге алканов и деполимеризации полимеров.
Реакции изомеризации.
Гомолитический и гетеролитический разрыв ковалентной химической связи; образование ковалентной связи по донорно-акцепторному механизму. Понятие о нуклеофиле и электрофиле. Классификация реакций по типу реагирующих частиц (нуклеофильные и электрофильные) и принципу изменения состава молекулы. Взаимное влияние атомов в молекулах органических веществ. Индуктивный и мезомерный эффекты. Правило Марковникова.
Расчетные задачи. 1. Вычисление выхода продукта реакции от теоретически возможного. 2. Нахождение молекулярной формулы вещества по его относительной плотности и массовой доле элементов в соединениях. 3. Комбинированные задачи.
Демонстрации. Образцы представителей различных классов органических соединений и шаростержневые или объемные модели их молекул. Таблицы «Название алканов и алкильных заместителей» и «Основные классы органических соединений». Шаростержневые модели органических соединений различных классов. Модели молекул изомеров разных видов изомерии.Взрыв смеси метана с хлором. Обесцвечивание бромной воды этиленом и ацетиленом. Получение фенолоформальдегидной смолы. Деполимеризация полиэтилена. Получение этилена и этанола. Крекинг керосина. Взрыв гремучего газа. Горение метана или пропанобутановой смеси (из газовой зажигалки). Взрыв смеси метана или пропанобутановой смеси с кислородом (воздухом).
Тема 2 Углеводороды (25 ч)
Понятие об углеводородах.
Природные источники углеводородов. Нефть и ее промышленная переработка. Фракционная перегонка, термический и каталитический крекинг. Природный газ, его состав и практическое использование. Каменный уголь. Коксование каменного угля. Происхождение природных источников углеводородов. Риформинг, алкилирование и ароматизация нефтепродуктов. Экологические аспекты добычи, переработки и использования полезных ископаемых.
Алканы. Гомологический ряд и общая формула алканов. Строение молекулы метана и других алканов. Изомерия алканов. Физические свойства алканов. Алканы в природе. Промышленные способы получения: крекинг алканов, фракционная перегонка нефти. Лабораторные способы получения алканов: синтез Вюрца, декарбоксилирование солей карбоновых кислот, гидролиз карбида алюминия. Реакции замещения. Горение алканов в различных условиях. Термическое разложение алканов. Изомеризация алканов. Применение алканов. Механизм реакции радикального замещения, его стадии. Практическое использование знаний о механизме (свободно-радикальном) реакций в правилах техники безопасности в быту и на производстве.
Алкены. Гомологический ряд и общая формула алкенов. Строение молекулы этилена и других алкенов. Изомерия алкенов: структурная и пространственная. Номенклатура и физические свойства алкенов. Получение этиленовых углеводородов из алканов, галогеналканов и спиртов. Поляризация π-связи в молекулах алкенов на примере пропена. Понятие об индуктивном (+I) эффекте на примере молекулы пропена. Реакции присоединения (галогенирование, гидрогалогенирование, гидратация, гидрирование). Реакции окисления и полимеризации алкенов. Применение алкенов на основе их свойств. Механизм реакции электрофильного присоединения к алкенам. Окисление алкенов в «мягких» и «жестких» условиях.
Алкины. Гомологический ряд алкинов. Общая формула. Строение молекулы ацетилена и других алкинов. Изомерия алкинов. Номенклатура ацетиленовых углеводородов. Получение алкинов: метановый и карбидный способы. Физические свойства алкинов. Реакции присоединения: галогенирование, гидрогалогенирование, гидратация (реакция Кучерова), гидрирование. Тримеризация ацетилена в бензол. Применение алкинов. Окисление алкинов. Особые свойства терминальных алкинов.
Алкадиены. Общая формула алкадиенов. Строение молекул. Изомерия и номенклатура алкадиенов. Физические свойства. Взаимное расположение π-связей в молекулах алкадиенов: кумулированное, сопряженное, изолированное. Особенности строения сопряженных алкадиенов, их получение. Аналогия в химических свойствах алкенов и алкадиенов. Полимеризация алкадиенов. Натуральный и синтетический каучуки. Вулканизация каучука. Резина. Работы С.В. Лебедева. Особенности реакций присоединения к алкадиенам с сопряженными π-связями.
Циклоалканы. Понятие о циклоалканах и их свойствах. Гомологический ряд и общая формула циклоалканов. Напряжение цикла в С3Н6, С4Н8 и С5Н10, конформации С6Н12. Изомерия циклоалканов (по «углеродному скелету», цис-, транс-, межклассовая). Химические свойства циклоалканов: горение, разложение, радикальное замещение, изомеризация. Особые свойства циклопропана, циклобутана.
Арены. Бензол как представитель аренов. Строение молекулы бензола. Сопряжение π-связей. Изомерия и номенклатура аренов, их получение. Гомологи бензола. Влияние боковой цепи на электронную плотность сопряженного π-облака в молекулах гомологов бензола на примере толуола. Химические свойства бензола. Реакции замещения с участием бензола: галогенирование, нитрование и алкилирование. Применение бензола и его гомологов. Радикальное хлорирование бензола. Механизм и условия проведения реакции радикального хлорирования бензола. Каталитическое гидрирование бензола. Механизм реакций электрофильного замещения: галогенирования и нитрования бензола и его гомологов. Сравнение реакционной способности бензола и толуола в реакциях замещения. Ориентирующее действие группы атомов СН3- в реакциях замещения с участием толуола. Ориентанты I и II рода в реакциях замещения с участием аренов. Реакции боковых цепей алкилбензолов.
Расчетные задачи. 1. Нахождение молекулярной формулы органического соединения по массе (объему) продуктов сгорания. 2. Комбинированные задачи.
Демонстрации. Коллекция «Природные источники углеводородов». Сравнение процессов горения нефти и природного газа. Образование нефтяной пленки на поверхности воды. Каталитический крекинг парафина. Растворение парафина в бензине и испарение растворителя из смеси. Плавление парафина и его отношение к воде (растворение, сравнение плотностей, смачивание). Разделение смеси бензин - вода с помощью делительной воронки.
Получение метана из ацетата натрия и гидроксида натрия. Модели молекул алканов - шаростержневые и объемные. Горение метана, пропанобутановой смеси, парафина в условиях избытка и недостатка кислорода. Взрыв смеси метана с воздухом. Отношение метана, пропанобутановой смеси, бензина, парафина к бромной воде и раствору перманганата калия. Взрыв смеси метана и хлора, инициируемый освещением. Восстановление оксида меди (II) парафином.
Шаростержневые и объемные модели молекул структурных и пространственных изомеров алкенов. Объемные модели молекул алкенов. Получение этена из этанола. Обесцвечивание этеном бромной воды. Обесцвечивание этеном раствора перманганата калия. Горение этена.
Получение ацетилена из карбида кальция. Физические свойства. Взаимодействие ацетилена с бромной водой. Взаимодействие ацетилена с раствором перманганата калия. Горение ацетилена. Взаимодействие ацетилена с раствором соли меди или серебра.
Модели (шаростержневые и объемные) молекул алкадиенов с различным взаимным расположением π-связей. Деполимеризация каучука. Модели (шаростержневые и объемные) молекул алкадиенов с различным взаимным расположением π-связей. Коагуляция млечного сока каучуконосов (молочая, одуванчиков или фикуса).
Шаростержневые модели молекул циклоалканов и алкенов. Отношение циклогексана к раствору перманганата калия и бромной воде.
Шаростержневые и объемные модели молекул бензола и его гомологов. Разделение с помощью делительной воронки смеси бензол - вода. Растворение в бензоле различных органических и неорганических (например, серы) веществ. Экстрагирование красителей и других веществ (например, иода) бензолом из водных растворов. Горение бензола. Отношение бензола к бромной воде и раствору перманганата калия. Получение нитробензола. Обесцвечивание толуолом подкисленного раствора перманганата калия и бромной воды.
Лабораторные опыты. 1. Построение моделей молекул алканов. 2. Сравнение плотности и смешиваемости воды и углеводородов. 3. Построение моделей молекул алкенов. 4. Обнаружение алкенов в бензине. 5. Получение ацетилена и его реакции с бромной водой и раствором перманганата калия.
Практические работы №1. Качественный анализ органических соединений. №2. Получение этилена и изучение его свойств
Тема 3 Спирты и фенолы (10 ч)
Спирты. Состав и классификация спиртов. Изомерия спиртов (положение гидроксильных групп, межклассовая, «углеродного скелета»). Физические свойства спиртов, их получение. Межмолекулярная водородная связь. Особенности электронного строения молекул спиртов. Химические свойства спиртов, обусловленные наличием в молекулах гидроксильных групп: образование алкоголятов, взаимодействие с галогеноводородами, межмолекулярная и внутримолекулярная дегидратация, этерификация, окисление и дегидрирование спиртов. Особенности свойств многоатомных спиртов. Качественная реакция на многоатомные спирты. Важнейшие представители спиртов. Физиологическое действие метанола и этанола. Алкоголизм, его последствия. Профилактика алкоголизма.
Фенолы. Фенол, его физические свойства и получение. Химические свойства фенола как функция его строения. Кислотные свойства. Взаимное влияние атомов и групп в молекулах органических веществ на примере фенола. Поликонденсация фенола с формальдегидом. Качественная реакция на фенол. Применение фенола. Классификация фенолов. Сравнение кислотных свойств веществ, содержащих гидроксильную группу: воды, одно- и многоатомных спиртов, фенола. Электрофильное замещение в бензольном кольце. Применение производных фенола.
Расчетные задачи. Вычисления по термохимическим уравнениям.
Демонстрации. Физические свойства этанола, пропанола-1 и бутанола-1. Шаростержневые модели молекул изомеров с молекулярными формулами С3Н8О и С4Н10О. Количественное вытеснение водорода из спирта натрием. Сравнение реакций горения этилового и пропилового спиртов. Сравнение скоростей взаимодействия натрия с этанолом, пропанолом-2, глицерином. Получение простого эфира. Получение сложного эфира. Получение этена из этанола. Растворимость фенола в воде при обычной и повышенной температуре. Вытеснение фенола из фенолята натрия угольной кислотой. Реакция фенола с хлоридом железа (III). Реакция фенола с формальдегидом.
Лабораторные опыты. 6. Построение моделей молекул изомерных спиртов. 7. Растворимость спиртов с различным числом атомов углерода в воде. 8. Растворимость многоатомных спиртов в воде. 9. Взаимодействие многоатомных спиртов с гидроксидом меди (II). 10. Взаимодействие водного раствора фенола с бромной водой.
Практическая работа № 3. Спирты и фенолы.
Тема 4 Альдегиды. Кетоны (8 ч)
Строение молекул альдегидов и кетонов, их изомерия и номенклатура. Особенности строения карбонильной группы. Физические свойства формальдегида и его гомологов. Отдельные представители альдегидов и кетонов. Химические свойства альдегидов, обусловленные наличием в молекуле карбонильной группы атомов (гидрирование, окисление аммиачными растворами оксида серебра и гидроксида меди (II)). Качественные реакции на альдегиды. Реакция поликонденсации формальдегида с фенолом. Особенности строения и химических свойств кетонов. Нуклеофильное присоединение к карбонильным соединениям. Присоединение циановодорода и гидросульфита натрия. Взаимное влияние атомов в молекулах. Галогенирование альдегидов и кетонов по ионному механизму на свету. Качественная реакция на метилкетоны.
Демонстрации. Шаростержневые модели молекул альдегидов и изомерных им кетонов. Окисление бензальдегида на воздухе. Реакция «серебряного зеркала». Окисление альдегидов гидроксидом меди (II).
Лабораторные опыты. 11. Построение моделей молекул изомерных альдегидов и кетонов. 12. Реакция «серебряного зеркала». 13. Окисление альдегидов гидроксидом меди (II). 14. Окисление бензальдегида кислородом воздуха.
Практическая работа № 4. Альдегиды и кетоны.
Тема 5 Карбоновые кислоты, сложные эфиры и жиры (11 ч)
Карбоновые кислоты. Строение молекул карбоновых кислот и карбоксильной группы. Классификация и номенклатура карбоновых кислот. Физические свойства карбоновых кислот и их зависимость от строения молекул. Карбоновые кислоты в природе. Биологическая роль карбоновых кислот. Общие свойства неорганических и органических кислот (взаимодействие с металлами, оксидами металлов, основаниями, солями). Влияние углеводородного радикала на силу карбоновой кислоты. Реакция этерификации, условия ее проведения. Химические свойства непредельных карбоновых кислот, обусловленные наличием π-связи в молекуле. Реакции электрофильного замещения с участием бензойной кислоты.
Сложные эфиры. Строение сложных эфиров. Изомерия сложных эфиров («углеродного скелета» и межклассовая). Номенклатура сложных эфиров. Обратимость реакции этерификации, гидролиз сложных эфиров. Равновесие реакции этерификации - гидролиза; факторы, влияющие на него. Решение расчетных задач на определение выхода продукта реакции (в %) от теоретически возможного, установление формулы и строения вещества по продуктам его сгорания (или гидролиза).
Жиры. Жиры - сложные эфиры глицерина и карбоновых кислот. Состав и строение жиров. Номенклатура и классификация жиров. Масла. Жиры в природе. Биологические функции жиров. Свойства жиров. Омыление жиров, получение мыла. Объяснение моющих свойств мыла. Гидрирование жидких жиров. Маргарин. Понятие о CMC. Объяснение моющих свойств мыла и CMC (в сравнении).
Демонстрации. Знакомство с физическими свойствами некоторых карбоновых кислот: муравьиной, уксусной, пропионовой, масляной, щавелевой, лимонной, олеиновой, стеариновой, бензойной. Возгонка бензойной кислоты. Отношение различных карбоновых кислот к воде. Сравнение кислотности среды водных растворов муравьиной и уксусной кислот одинаковой молярности. Получение приятно пахнущего сложного эфира. Отношение к бромной воде и раствору перманганата калия предельной и непредельной карбоновых кислот. Шаростержневые модели молекул сложных эфиров и изомерных им карбоновых кислот. Отношение сливочного, подсолнечного и машинного масла к водным растворам брома и перманганата калия.
Лабораторные опыты. 15. Построение моделей молекул изомерных карбоновых кислот и сложных эфиров. 16. Сравнение силы уксусной и соляной кислот в реакциях с цинком. 17. Сравнение растворимости в воде карбоновых кислот и их солей. 18. Взаимодействие карбоновых кислот с основными оксидами, основаниями, амфотерными гидроксидами и солями. 19. Растворимость жиров в воде и органических растворителях.
Экспериментальные задачи. 1. Распознавание растворов ацетата натрия, карбоната натрия, силиката натрия и стеарата натрия. 2. Распознавание образцов сливочного масла и маргарина. 3. Получение карбоновой кислоты из мыла. 4. Получение уксусной кислоты из ацетата натрия. Практическая работа №5. Карбоновые кислоты.
Тема 6 Углеводы (7 ч)
Моно-, ди- и полисахариды. Представители каждой группы. Биологическая роль углеводов. Их значение в жизни человека и общества.
Моносахариды. Глюкоза, ее физические свойства. Строение молекулы. Равновесия в растворе глюкозы. Зависимость химических свойств глюкозы от строения молекулы. Взаимодействие с гидроксидом меди (II) при комнатной температуре и нагревании, этерификация, реакция «серебряного зеркала», гидрирование. Реакции брожения глюкозы: спиртового, молочнокислого. Глюкоза в природе. Биологическая роль глюкозы. Применение глюкозы на основе ее свойств. Фруктоза как изомер глюкозы. Сравнение строения молекул и химических свойств глюкозы и фруктозы. Фруктоза в природе и ее биологическая роль.
Дисахариды. Строение дисахаридов. Восстанавливающие и невосстанавливающие дисахариды. Сахароза, лактоза, мальтоза, их строение и биологическая роль. Гидролиз дисахаридов. Промышленное получение сахарозы из природного сырья.
Полисахариды. Крахмал и целлюлоза (сравнительная характеристика: строение, свойства, биологическая роль). Физические свойства полисахаридов. Химические свойства полисахаридов. Гидролиз полисахаридов. Качественная реакция на крахмал. Полисахариды в природе, их биологическая роль. Применение полисахаридов. Понятие об искусственных волокнах. Взаимодействие целлюлозы с неорганическими и карбоновыми кислотами - образование сложных эфиров.
Демонстрации. Образцы углеводов и изделий из них. Взаимодействие сахарозы с гидроксидом меди (II). Получение сахарата кальция и выделение сахарозы из раствора сахарата кальция. Реакция «серебряного зеркала» для глюкозы. Взаимодействие глюкозы с фуксинсернистой кислотой. Отношение растворов сахарозы и мальтозы (лактозы) к гидроксиду меди (II) при нагревании. Ознакомление с физическими свойствами целлюлозы и крахмала. Набухание целлюлозы и крахмала в воде. Получение нитрата целлюлозы.
Лабораторные опыты. 20. Ознакомление с физическими свойствами глюкозы. 21. Взаимодействие глюкозы с гидроксидом меди (II) при обычных условиях и при нагревании. 22. Взаимодействие глюкозы и сахарозы с аммиачным раствором оксида серебра. 23. Кислотный гидролиз сахарозы. 24. Качественная реакция на крахмал. 25. Знакомство с коллекцией волокон.
Экспериментальные задачи. 1. Распознавание растворов глюкозы и глицерина. 2. Определение наличия крахмала в меде, хлебе, маргарине. Практическая работа №6.Углеводы.
Тема 7 Азотсодержащие органические соединения (11 ч)
Амины. Состав и строение аминов. Классификация, изомерия и номенклатура аминов. Алифатические амины. Анилин. Получение аминов: алкилирование аммиака, восстановление нитросоединений (реакция Зинина). Физические свойства аминов. Химические свойства аминов: взаимодействие с водой и кислотами. Гомологический ряд ароматических аминов. Алкилирование и ацилирование аминов. Взаимное влияние атомов в молекулах на примере аммиака, алифатических и ароматических аминов. Применение аминов.
Аминокислоты и белки. Состав и строение молекул аминокислот. Изомерия аминокислот. Двойственность кислотно-основных свойств аминокислот и ее причины. Взаимодействие аминокислот с основаниями. Взаимодействие аминокислот с кислотами, образование сложных эфиров. Образование внутримолекулярных солей (биполярного иона). Реакция поликонденсации аминокислот. Синтетические волокна (капрон, энант и др.). Биологическая роль аминокислот. Применение аминокислот.
Белки как природные биополимеры. Пептидная группа атомов и пептидная связь. Пептиды. Белки. Первичная, вторичная и третичная структуры белков. Химические свойства белков: горение, денатурация, гидролиз, качественные (цветные) реакции. Биологические функции белков. Значение белков. Четвертичная структура белков как агрегация белковых и небелковых молекул. Глобальная проблема белкового голодания и пути ее решения.
Нуклеиновые кислоты. Общий план строения нуклеотидов. Понятие о пиримидиновых и пуриновых основаниях. Первичная, вторичная и третичная структуры молекулы ДНК. Биологическая роль ДНК и РНК. Генная инженерия и биотехнология. Трансгенные формы животных и растений.
Демонстрации. Физические свойства метиламина. Горение метиламина. Взаимодействие анилина и метиламина с водой и кислотами. Отношение бензола и анилина к бромной воде. Окрашивание тканей анилиновыми красителями. Обнаружение функциональных групп в молекулах аминокислот. Нейтрализация щелочи аминокислотой. Нейтрализация кислоты аминокислотой. Растворение и осаждение белков. Денатурация белков. Качественные реакции на белки. Модели молекулы ДНК и различных видов молекул РНК. Образцы продуктов питания из трансгенных форм растений и животных; лекарств и препаратов, изготовленных с помощью генной инженерии.
Лабораторные опыты. 26. Построение моделей молекул изомерных аминов. 27. Смешиваемость анилина с водой. 28. Образование солей аминов с кислотами. 29. Качественные реакции на белки.
Практические работы №7. Амины, аминокислоты, белки. №8. Идентификация органических соединений.
Тема 8 Биологически активные вещества (9 ч)
Витамины. Понятие о витаминах. Их классификация и обозначение. Нормы потребления витаминов. Водорастворимые (на примере витамина С) и жирорастворимые (на примере витаминов А и D) витамины. Понятие об авитаминозах, гипер- и гиповитаминозах. Профилактика авитаминозов. Отдельные представители водорастворимых витаминов (С, РР, группы В) и жирорастворимых витаминов (A, D, E). Их биологическая роль.
Ферменты. Понятие о ферментах как о биологических катализаторах белковой природы. Значение в биологии и применение в промышленности. Классификация ферментов. Особенности строения и свойств ферментов: селективность и эффективность. Зависимость активности фермента от температуры и рН среды. Особенности строения и свойств в сравнении с неорганическими катализаторами.
Гормоны. Понятие о гормонах как биологически активных веществах, выполняющих эндокринную регуляцию жизнедеятельности организмов. Классификация гормонов: стероиды, производные аминокислот, полипептидные и белковые гормоны. Отдельные представители гормонов: эстрадиол, тестостерон, инсулин, адреналин.
Лекарства. Понятие о лекарствах как химиотерапевтических препаратах. Группы лекарств: сульфамиды (стрептоцид), антибиотики (пенициллин), аспирин. Безопасные способы применения, лекарственные формы. Краткие исторические сведения о возникновении и развитии химиотерапии. Механизм действия некоторых лекарственных препаратов, строение молекул, прогнозирование свойств на основе анализа химического строения. Антибиотики, их классификация по строению, типу и спектру действия. Дисбактериоз. Наркотики, наркомания и ее профилактика.
Демонстрации. Образцы витаминных препаратов. Поливитамины. Иллюстрации фотографий животных с различными формами авитаминозов. Сравнение скорости разложения Н2О2 под действием фермента (каталазы) и неорганических катализаторов (KI, FeCl3, MnO2). Плакат или кодограмма с изображением структурных формул эстрадиола, тестостерона, адреналина. Взаимодействие адреналина с раствором FeCl3. Белковая природа инсулина (цветные реакции на белки). Плакаты или кодограммы с формулами амида сульфаниловой кислоты, дигидрофолиевой и ложной дигидрофолиевой кислот, бензилпенициллина, тетрациклина, цефотаксима, аспирина.
Лабораторные опыты. 30. Обнаружение витамина А в растительном масле. 31. Обнаружение витамина С в яблочном соке. 32. Обнаружение витамина D в желтке куриного яйца. 33. Ферментативный гидролиз крахмала под действием амилазы. 34. Разложение пероксида водорода под действием каталазы. 35. Действие дегидрогеназы на метиленовый синий. 36. Испытание растворимости адреналина в воде и соляной кислоте. 37. Обнаружение аспирина в готовой лекарственной форме (реакцией гидролиза или цветной реакцией с сульфатом бериллия).
Практические работы №9. Действие ферментов на различные вещества. №10. Анализ некоторых лекарственных препаратов (аспирина, парацетамола).
11 КЛАСС (ОБЩАЯ ХИМИЯ)
(3 ч в неделю; всего 102 ч из них 2 часа резервного времени)
Тема 1. Строение атома (9 ч)
Атом - сложная частица. Ядро и электронная оболочка. Электроны, протоны и нейтроны. Микромир и макромир. Дуализм частиц микромира.
Состояние электронов в атоме. Электронное облако и орбиталь. Квантовые числа. Форма орбиталей (s, p, d, f). Энергетические уровни и подуровни. Строение электронных оболочек атомов. Электронные конфигурации атомов элементов. Принцип Паули и правило Гунда. Электронно-графические формулы атомов элементов. Электронная классификация элементов: s-,p-, d- и f-семейства.
Валентные возможности атомов химических элементов. Валентные электроны. Валентные возможности атомов химических элементов, обусловленные числом неспаренных электронов в нормальном и возбужденном состояниях. Другие факторы, определяющие валентные возможности атомов: наличие неподеленных электронных пар и наличие свободных орбиталей. Сравнение понятий «валентность» и «степень окисления».
Периодический закон и периодическая система химических элементов Д. И. Менделеева и строение атома. Предпосылки открытия периодического закона: накопление фактологического материала, работы предшественников (И. Я. Берцелиуса, И. В. Деберейнера, А. Э. Шанкуртуа, Дж. А. Ньюлендса, Л. Ю. Мейера); съезд химиков в Карлсруэ. Личностные качества Д. И. Менделеева.
Открытие Д. И. Менделеевым периодического закона. Первая формулировка периодического закона. Горизонтальная, вертикальная и диагональная периодические зависимости.
Периодический закон и строение атома. Изотопы. Современная трактовка понятия «химический элемент». Закономерность Ван-ден-Брука - Мозли. Вторая формулировка периодического закона. Периодическая система Д. И. Менделеева и строение атома. Физический смысл порядкового номера элементов, номеров группы и периода. Причины изменения металлических и неметаллических свойств элементов в группах и периодах, в том числе больших и сверхбольших. Третья формулировка периодического закона. Значение периодического закона и периодической системы химических элементов Д.И. Менделеева для развития науки и понимания химической картины мира.
Тема 2. Строение вещества. Дисперсные системы (17 ч)
Химическая связь. Единая природа химической связи. Ионная химическая связь и ионные кристаллические решетки. Ковалентная химическая связь и ее классификация: по механизму образования (обменный и донорно-акцепторный), по электроотрицательности (полярная и неполярная), по способу перекрывания электронных орбиталей (σ и π), по кратности (одинарная, двойная, тройная и полуторная). Полярность связи и полярность молекулы. Кристаллические решетки веществ с ковалентной связью: атомная и молекулярная. Металлическая химическая связь и металлические кристаллические решетки. Водородная связь: межмолекулярная и внутримолекулярная. Механизм образования этой связи, ее значение.
Межмолекулярные взаимодействия.
Единая природа химических связей: ионная связь как предельный случай ковалентной полярной связи; переход одного вида связи в другой; разные виды связи в одном веществе и т. д.
Свойства ковалентной химической связи. Насыщаемость, поляризуемость, направленность. Геометрия молекул.
Гибридизация орбиталей и геометрия молекул. sр3-гибридизация у алканов, воды, аммиака, алмаза; sр2-гибридизация у соединений бора, алкенов, аренов, диенов и графита; sp-гибридизация у соединений бериллия, алкинов и карбина. Геометрия молекул названных веществ.
Полимеры органические и неорганические. Полимеры. Основные понятия химии высокомолекулярных соединений: «мономер», «полимер», «макромолекула», «структурное звено», «степень полимеризации», «молекулярная масса». Способы получения полимеров: реакции полимеризации и поликонденсации. Строение полимеров: геометрическая форма макромолекул, кристалличность и аморфность, стереорегулярность. Полимеры органические и неорганические. Каучуки. Пластмассы. Волокна. Биополимеры: белки и нуклеиновые кислоты. Неорганические полимеры атомного строения (аллотропные модификации углерода, кристаллический кремний, селен и теллур цепочечного строения, диоксид кремния и др.) и молекулярного строения (сера пластическая и др.).
Теория строения химических соединений А.М. Бутлерова. Предпосылки создания теории строения химических соединений: работы предшественников (Ж.Б. Дюма, Ф. Велер, Ш.Ф. Жерар, Ф.А. Кекуле), съезд естествоиспытателей в Шпейере. Личностные качества А.М. Бутлерова.
Основные положения теории химического строения органических соединений и современной теории строения. Изомерия в органической и неорганической химии. Взаимное влияние атомов в молекулах органических и неорганических веществ.
Основные направления развития теории строения органических соединений (зависимость свойств веществ не только от химического, но и от их электронного и пространственного строения). Индукционный и мезомерный эффекты. Стереорегулярность.
Диалектические основы общности двух ведущих теорий химии. Диалектические основы общности периодического закона Д.И. Менделеева и теории строения А.М. Бутлерова в становлении (работы предшественников, накопление фактов, участие в съездах, русский менталитет), предсказании (новые элементы - Ga, Se, Ge и новые вещества - изомеры) и развитии (три формулировки).
Дисперсные системы. Понятие о дисперсных системах. Дисперсионная среда и дисперсная фаза. Типы дисперсных систем и их значение в природе и жизни человека. Дисперсные системы с жидкой средой: взвеси, коллоидные системы, их классификация. Золи и гели. Эффект Тиндаля. Коагуляция. Синерезис. Молекулярные и истинные растворы. Способы выражения концентрации растворов.
Расчетные задачи. 1. Расчеты по химическим формулам. 2. Расчеты, связанные с понятиями «массовая доля» и «объемная доля» компонентов смеси. 3. Вычисление молярной концентрации растворов.
Демонстрации. Модели кристаллических решеток веществ с различным типом связей. Модели молекул различной геометрии. Модели кристаллических решеток алмаза и графита. Модели молекул изомеров структурной и пространственной изомерии. Свойства толуола. Коллекция пластмасс и волокон. Образцы неорганических полимеров: серы пластической, фосфора красного, кварца и др. Модели молекул белков и ДНК. Образцы различных систем с жидкой средой. Коагуляция. Синерезис. Эффект Тиндаля.
Лабораторные опыты. 1. Свойства гидроксидов элементов 3-го периода. 2. Ознакомление с образцами органических и неорганических полимеров.
Практическая работа №1 Распознавание пластмасс и волокон
Тема 3. Химические реакции (25 ч)
Классификация химических реакций в органической и неорганической химии. Понятие о химической реакции; ее отличие от ядерной реакции. Реакции, идущие без изменения качественного состава веществ: аллотропизация, изомеризация и полимеризация. Реакции, идущие с изменением состава веществ: по числу и составу реагирующих и образующихся веществ (разложения, соединения, замещения, обмена); по изменению степеней окисления элементов (окислительно-восстановительные реакции и неокислительно-восстановительные реакции); по тепловому эффекту (экзо- и эндотермические); по фазе (гомо- и гетерогенные); по направлению (обратимые и необратимые); по использованию катализатора (каталитические и некаталитические); по механизму (радикальные и ионные); по виду энергии, инициирующей реакцию (фотохимические, радиационные, электрохимические, термохимические). Особенности классификации реакций в органической химии.
Вероятность протекания химических реакций. Закон сохранения энергии. Внутренняя энергия и экзо- и эндотермические реакции. Тепловой эффект химических реакций. Термохимические уравнения. Теплота образования. Понятие об энтальпии. Закон Г.И. Гесса и следствия из него. Энтропия. Энергия Гиббса. Возможность протекания реакций в зависимости от изменения энергии и энтропии.
Скорость химических реакций. Понятие о скорости реакции. Скорость гомо- и гетерогенной реакции. Энергия активации. Элементарные и сложные реакции. Факторы, влияющие на скорость химической реакции: природа реагирующих веществ; температура (закон Вант-Гоффа); концентрация (основной закон химической кинетики); катализаторы. Катализ: гомо- и гетерогенный; механизм действия катализаторов. Ферменты. Их сравнение с неорганическими катализаторами. Ферментативный катализ, его механизм. Ингибиторы и каталитические яды. Зависимость скорости реакций от поверхности соприкосновения реагирующих веществ.
Обратимость химических реакций. Химическое равновесие. Понятие о химическом равновесии. Равновесные концентрации. Динамичность химического равновесия. Константа равновесия. Факторы, влияющие на смещение равновесия: концентрация, давление и температура. Принцип Ле Шателье.
Электролитическая диссоциация. Электролиты и неэлектролиты. Электролитическая диссоциация. Механизм диссоциации веществ с различным типом химической связи. Свойства ионов. Катионы и анионы. Кислоты, соли, основания в свете электролитической диссоциации. Степень электролитической диссоциации, ее зависимость от природы электролита и его концентрации. Константа диссоциации. Ступенчатая диссоциация электролитов. Реакции, протекающие в растворах электролитов. Произведение растворимости.
Водородный показатель. Диссоциация воды. Константа диссоциации воды. Ионное произведение воды. Водородный показатель рН. Среды водных растворов электролитов. Значение водородного показателя для химических и биологических процессов.
Гидролиз. Понятие «гидролиз». Гидролиз органических соединений (галогеналканов, сложных эфиров, углеводов, белков, АТФ) и его значение. Гидролиз неорганических веществ. Гидролиз солей - три случая. Ступенчатый гидролиз. Необратимый гидролиз. Практическое применение гидролиза.
Расчетные задачи. 1. Расчеты по термохимическим уравнениям. 2. Вычисление теплового эффекта реакции по теплотам образования реагирующих веществ и продуктов реакции. 3. Определение рН раствора заданной молярной концентрации. 4. Расчет средней скорости реакции по концентрациям реагирующих веществ. 5. Вычисления с использованием понятия «температурный коэффициент скорости реакции». 6. Нахождение константы равновесия реакции по равновесным концентрациям и определение исходных концентраций веществ.
Демонстрации. Превращение красного фосфора в белый, кислорода - в озон. Модели н-бутана и изобутана. Получение кислорода из пероксида водорода и воды; дегидратация этанола. Цепочка превращений Р → Р2О5 → Н3РО4; свойства соляной и уксусной кислот; реакции, идущие с образованием осадка, газа и воды; свойства металлов; окисление альдегида в кислоту и спирта в альдегид. Реакции горения; реакции эндотермические на примере реакции разложения (этанола, калийной селитры, известняка или мела) и экзотермические на примере реакций соединения (обесцвечивание бромной воды и раствора перманганата калия этиленом, гашение извести и др.). Взаимодействие цинка с растворами соляной и серной кислот при разных температурах, при разных концентрациях соляной кислоты; разложение пероксида водорода с помощью оксида марганца (IV), катал азы сырого мяса и сырого картофеля. Взаимодействие цинка с различной поверхностью (порошка, пыли, гранул) с кислотой. Модель «кипящего слоя». Смещение равновесия в системе Fe3+ + 3CNS- ↔ Fe(CNS)3; омыление жиров, реакции этерификации. Зависимость степени электролитической диссоциации уксусной кислоты от разбавления. Сравнение свойств 0,1 Н растворов серной и сернистой кислот; муравьиной и уксусной кислот; гидроксидов лития, натрия и калия. Индикаторы и изменение их окраски в различных средах. Сернокислый и ферментативный гидролиз углеводов. Гидролиз карбонатов, сульфатов, силикатов щелочных металлов; нитратов цинка или свинца (II). Гидролиз карбида кальция.
Лабораторные опыты. 3. Получение кислорода разложением пероксида водорода и (или) перманганата калия. 4. Реакции, идущие с образованием осадка, газа и воды для органических и неорганических кислот. 5. Использование индикаторной бумаги для определения рН слюны, желудочного сока и других соков организма человека. 6. Разные случаи гидролиза солей.
Практическая работа №2 «Скорость химических реакций»
Практическая работа №3 «Решение экспериментальных задач по теме «Гидролиз»
Тема 4. Вещества и их свойства (38 ч)
Классификация неорганических веществ. Простые и сложные вещества. Оксиды, их классификация. Гидроксиды (основания, кислородсодержащие кислоты, амфотерные гидроксиды). Кислоты, их классификация. Основания, их классификация. Соли средние, кислые, основные и комплексные.
Классификация органических веществ. Углеводороды и классификация веществ в зависимости от строения углеродной цепи (алифатические и циклические) и от кратности связей (предельные и непредельные). Гомологический ряд. Производные углеводородов: галогеналканы, спирты, фенолы, альдегиды и кетоны, карбоновые кислоты, простые и сложные эфиры, нитросоединения, амины, аминокислоты.
Металлы. Положение металлов в периодической системе Д.И. Менделеева и строение их атомов. Простые вещества - металлы: строение кристаллов и металлическая химическая связь. Аллотропия. Общие физические свойства металлов. Ряд стандартных электродных потенциалов. Общие химические свойства металлов (восстановительные свойства): взаимодействие с неметаллами (кислородом, галогенами, серой, азотом, водородом), с водой, кислотами и солями в растворах, органическими соединениями (спиртами, галогеналканами, фенолом, кислотами), со щелочами. Значение металлов в природе и в жизни организмов.
Коррозия металлов. Понятие «коррозия металлов». Химическая коррозия. Электрохимическая коррозия. Способы защиты металлов от коррозии.
Общие способы получения металлов. Металлы в природе. Металлургия и ее виды: пиро-, гидро- и электрометаллургия. Электролиз расплавов и растворов соединений металлов и его практическое значение.
Переходные металлы. Железо. Медь, серебро; цинк, ртуть; хром, марганец (нахождение в природе; получение и применение простых веществ; свойства простых веществ; важнейшие соединения).
Неметаллы. Положение неметаллов в периодической системе Д.И. Менделеева, строение их атомов. Электроотрицательность. Инертные газы. Двойственное положение водорода в периодической системе. Неметаллы - простые вещества. Их атомное и молекулярное строение. Аллотропия и ее причины. Химические свойства неметаллов. Окислительные свойства: взаимодействие с металлами, водородом, менее электроотрицательными неметаллами, некоторыми сложными веществами. Восстановительные свойства неметаллов в реакциях со фтором, кислородом, сложными веществами-окислителями (азотной и серной кислотами и др.).
Водородные соединения неметаллов. Получение их синтезом и косвенно. Строение молекул и кристаллов этих соединений. Физические свойства. Отношение к воде. Изменение кислотно-основных свойств в периодах и группах.
Несолеобразующие и солеобразующие оксиды.
Кислородные кислоты. Изменение кислотных свойств высших оксидов и гидроксидов неметаллов в периодах и группах. Зависимость свойств кислот от степени окисления неметалла.
Кислоты органические и неорганические. Кислоты в свете протолитической теории. Сопряженные кислотно-основные пары. Классификация органических и неорганических кислот. Общие свойства кислот: взаимодействие органических и неорганических кислот с металлами, с основными оксидами, с амфотерными оксидами и гидроксидами, с солями, образование сложных эфиров. Особенности свойств концентрированной серной и азотной кислот. Особенности свойств уксусной и муравьиной кислот.
Основания органические и неорганические. Основания в свете протолитической теории. Классификация органических и неорганических оснований. Химические свойства щелочей и нерастворимых оснований. Свойства бескислородных оснований: аммиака и аминов. Взаимное влияние атомов в молекуле анилина.
Амфотерные органические и неорганические соединения. Амфотерные соединения в свете протолитической теории. Амфотерность оксидов и гидроксидов некоторых металлов: взаимодействие с кислотами и щелочами. Понятие о комплексных соединениях. Комплексообразователь, лиганды, координационное число, внутренняя сфера, внешняя сфера. Амфотерность аминокислот: взаимодействие аминокислот со щелочами, кислотами, спиртами, друг с другом (образование полипептидов), образование внутренней соли (биполярного иона).
Генетическая связь между классами органических и неорганических соединений. Понятие о генетической связи и генетических рядах в неорганической и органической химии. Генетические ряды металла (на примере кальция и железа), неметалла (на примере серы и кремния), переходного элемента (на примере цинка). Генетические ряды и генетическая связь в органической химии (для соединений, содержащих два атома углерода в молекуле). Единство мира веществ.
Расчетные задачи. 1. Вычисление массы или объема продуктов реакции по известной массе или объему исходного вещества, содержащего примеси. 2. Вычисление массы исходного вещества, если известен практический выход и массовая доля его от теоретически возможного. 3. Вычисления по химическим уравнениям реакций, если одно из реагирующих веществ дано в избытке. 4. Определение молекулярной формулы вещества по массовым долям элементов. 5. Определение молекулярной формулы газообразного вещества по известной относительной плотности и массовым долям элементов. 6. Нахождение молекулярной формулы вещества по массе (объему) продуктов сгорания. 7. Комбинированные задачи.
Демонстрации. Коллекция «Классификация неорганических веществ» и образцы представителей классов. Коллекция «Классификация органических веществ» и образцы представителей классов. Модели кристаллических решеток металлов. Коллекция металлов с разными физическими свойствами. Взаимодействие: а) лития, натрия, магния и железа с кислородом; б) щелочных металлов с водой, спиртами, фенолом; в) цинка с растворами соляной и серной кислот; г) натрия с серой; д) алюминия с иодом; е) железа с раствором медного купороса; ж) алюминия с раствором едкого натра. Оксиды и гидроксиды хрома, их получение и свойства. Переход хромата в бихромат и обратно. Коррозия металлов в зависимости от условий. Защита металлов от коррозии: образцы «нержавеек», защитных покрытий. Коллекция руд. Электролиз растворов солей. Модели кристаллических решеток иода, алмаза, графита. Аллотропия фосфора, серы, кислорода. Взаимодействие: а) водорода с кислородом; б) сурьмы с хлором; в) натрия с иодом; г) хлора с раствором бромида калия; д) хлорной и сероводородной воды; е) обесцвечивание бромной воды этиленом или ацетиленом. Получение и свойства хлороводорода, соляной кислоты и аммиака. Свойства соляной, разбавленной серной и уксусной кислот. Взаимодействие концентрированных серной, азотной кислот и разбавленной азотной кислоты с медью. Реакция «серебряного зеркала» для муравьиной кислоты. Взаимодействие раствора гидроксида натрия с кислотными оксидами (оксидом углерода (IV)), амфотерными гидроксидами (гидроксидом цинка). Взаимодействие аммиака с хлороводородом и водой. Аналогично для метиламина. Взаимодействие аминокислот с кислотами и щелочами. Осуществление переходов: Са → СаО → Са(ОН)2; Р → Р2О5 → Н3РО4 → Са3(РО4)2; Си → СиО → CuSO4 → Си(ОН)2 → СиО → Си; С2Н5ОН → С2Н4 → С2Н4Вг2.
Лабораторные опыты. 7. Ознакомление с образцами представителей разных классов неорганических веществ. 8. Ознакомление с образцами представителей разных классов органических веществ. 9. Ознакомление с коллекцией руд. 10. Сравнение свойств кремниевой, фосфорной, серной и хлорной кислот; сернистой и серной кислот; азотистой и азотной кислот. 11. Свойства соляной, серной (разб.) и уксусной кислот. 12. Взаимодействие гидроксида натрия с солями, сульфатом меди (II) и хлоридом аммония. 13. Разложение гидроксида меди (II). Получение гидроксида алюминия и изучение его амфотерных свойств.
Практическая работа №4 Получение, собирание и распознавание газов и изучение их свойств.
Практическая работа №5 Сравнение свойств неорганических и органических соединений.
Практическая работа №6 Решение экспериментальных задач по неорганической химии.
Практическая работа №7 Решение экспериментальных задач по органической химии.
Практическая работа №8 Генетическая связь между классами неорганических и органических веществ.
Тема 6. Химия и общество (11 ч)+2аса - резерв
Химия и производство. Химическая промышленность, химическая технология. Сырье для химической промышленности. Вода в химической промышленности. Энергия для химического производства. Научные принципы химического производства. Защита окружающей среды и охрана труда при химическом производстве. Основные стадии химического производства (аммиака и метанола). Сравнение производства этих веществ.
Химия и сельское хозяйство. Химизация сельского хозяйства и ее направления. Растения и почва, почвенный поглощающий комплекс (ППК). Удобрения и их классификация. Химические средства защиты растений. Отрицательные последствия применения пестицидов и борьба с ними. Химизация животноводства.
Химия и экология. Химическое загрязнение окружающей среды. Охрана гидросферы от химического загрязнения. Охрана почвы от химического загрязнения. Охрана атмосферы от химического загрязнения. Охрана флоры и фауны от химического загрязнения. Биотехнология и генная инженерия.
Химия и повседневная жизнь человека. Домашняя аптечка. Моющие и чистящие средства. Средства борьбы с бытовыми насекомыми. Средства личной гигиены и косметики. Химия и пища. Маркировка упаковок пищевых продуктов и промышленных товаров и умение их читать. Экология жилища. Химия и генетика человека.
Демонстрации. Модели производства серной кислоты и аммиака. Коллекция удобрений и пестицидов. Образцы средств бытовой химии и лекарственных препаратов. Коллекции средств гигиены и косметики, препаратов бытовой химии.
Лабораторные опыты. 14. Ознакомление с коллекцией удобрений и пестицидов. 15. Ознакомление с образцами средств бытовой химии и лекарственных препаратов, изучение инструкций к ним по правильному и безопасному применению.
Формы и средства контроля
Сводная таблица по видам контроля
Виды контроля
10 класс
11 класс
Итого за год
1 полугодие
2 полугодие
1 полугодие
2 полугодие
10 класс
11 класс
Количество плановых контрольных работ
3
5
2
4
8
6
практических работ
2
8
3
5
10
8
Примерная шкала перевода в пятибалльную систему оценки:
Оценка «2» - 0 -35%
Оценка «3» - 36-60%
Оценка «2» - 61- 87%
Оценка «2» - 88 -100%
Материалы для проведения контрольных работ.
(Составлены самостоятельно с учётом требования стандартов и программы по химии).
10 класс
Контрольная работа № 1
Стартовая контрольная работа
ВАРИАНТ -1
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А 1. Схема распределения электронов по слоям в атоме химического элемента, образующего соединения, соответствующие общим формулам Н2Э и ЭО3
1) 2е,6е 3) 2е,8е,6е
2) 2е,8е,5е 4) 2е,8е,7е
А 2. Ряд элементов, расположенных в порядке увеличения атомных радиусов:
1) S, P, Si 3) Se, S, O
2) P, S, О 4) Be, B, Al
А 3. Оксид углерода (IV) является
1) амфотерным 3) несолеобразующим
2) кислотным 4) основным
А 4. Необратимая химическая реакция произойдет при сливании растворов веществ, формулы которых:
1) KOH и NaCl 3) CuCl2 и KOH
2) MgCl2 и HNO3 4) Al2(SO4 )3 и Cu(NO3)2
А 5. Уравнению реакции 2NO + O2 = 2NO2 соответствует схема превращения:
1) N+2 → N+5 3) N-3 → N+2
2) N+4 → N0 4) N+2 → N+4
А 6. Верны ли следующие высказывания?
А. Степень окисления атома хрома в соединении CrO равна +3
Б. Степень окисления атома хрома в соединении Cr2O3 равна +3
1) верно только А 3) верно только Б
2) верны оба суждения 4) оба суждения не верны
Часть 2.
В задании В1 и В2 на установление соответствия запишите последовательность цифр без пробелов и других символов.
В1. Установите соответствие между формулами исходных веществ и продуктов реакций:
ИСХОДНЫЕ ВЕЩЕСТВА: ПРОДУКТЫ РЕАКЦИЙ
А) Ca и S 1) Сa(OH)2
Б) Ca(OH)2 и H2SO4 2) Ca2S
В) CaO и H2O 3) CaS
Г) Ca и O2 4) CaSO4 и 2H2O
5) Сa(OH)2 и H2
6) CaO
В 2. Установите соответствие между формулой вещества и классом соединения:
ФОРМУЛА ВЕЩЕСТВА: КЛАСС СОЕДИНЕНИЯ
А) НСОН 1) Алкан
Б) С4Н10 2) Алкен
В) СН3ОН 3) Альдегид
Г) СН3СООН 4) Спирт
5) Карбоновая кислота
6) Простой эфир
Ответом к заданию В 3 является последовательность цифр в порядке возрастания.
В 3. С разбавленной серной кислотой реагируют:
1) Cu 4) Mg
2) CuO 5) BaCl2
3) NaOH6) SO2
Часть 3
Запишите номер задания и полное решение
C1. Какой объем оксида углерода (IV) образуется при сгорании 11,2л пропана?
Контрольная работа № 1
Стартовая контрольная работа
ВАРИАНТ -2
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А 1. Схема распределения электронов по слоям в атоме химического элемента, образующего соединения, соответствующие общим формулам ЭН2 и ЭО
1) 2е,8е,4е 3) 2е,8е,2е
2) 2е,8е,3е 4) 2е,8е,1е
А 2. Ряд элементов, расположенных в порядке увеличения атомных радиусов:
1) Be, B, Al 3) Li, Be, B
2) Na, Mg, Be 4) Be, Mg, Ca
А 3. Оксид кальция является
1) амфотерным 3) несолеобразующим
2) кислотным 4) основным
А 4. Необратимая химическая реакция произойдет при сливании растворов веществ, формулы которых:
1) NaCl и MgSO4 3) NaOH и KI
2) HCl и Na2SO4 4) KOH и CuCl2
А 5. Уравнению реакции 2SO2 + O2 = 2SO3 соответствует схема превращения:
1) S+4 → S+6 3) S-2 → S+4
2) S+4 → S0 4) S0 → N+6
А 6. Верны ли следующие высказывания?
А. Неметаллы проявляют только восстановительные свойства
Б. Неметаллы проявляют восстановительные и окислительные свойства
1) верно только А 3) верно только Б
2) верны оба суждения 4) оба суждения не верны
Часть 2.
В задании В1 и В2 на установление соответствия запишите последовательность цифр без пробелов и других символов.
В1. Установите соответствие между формулами исходных веществ и продуктов реакций:
ИСХОДНЫЕ ВЕЩЕСТВА: ПРОДУКТЫ РЕАКЦИИ:
А) SO3 и H2O 1) H2SO3
Б) HCl и Na2S 2) Na2SO4 и H2O
В) Na2Oи H2SO4 3) H2S
Г) H2S и O2 4) H2SO4
5) 2NaCl и H2S
6) H2O и SO2
В2. Установите соответствие между формулой вещества и классом соединения:
ФОРМУЛА ВЕЩЕСТВА: КЛАСС СОЕДИНЕНИЯ
А) С2Н5ОН 1) Алкан
Б) С3Н8 2) Алкен
В) СН3 СОН 3) Альдегид
Г) С3Н6 4) Спирт
5) Карбоновая кислота
6) Простой эфир
Ответом к заданию В 3 является последовательность цифр в порядке возрастания.
В 3. С раствором гидроксида натрия реагируют:
1) CuSO4 4) HNO3
2) CuO 5) Zn(OH)2
3) KOH 6) CO2
Часть 3
Запишите номер задания и полное решение
C1. Какой объем кислорода потребуется для сжигания10л этена?
Ответы и система оценивания к.р.№1
Часть А
№ варианта
А1
А2
А3
А4
А5
А6
№1
3
1
2
3
4
3
№2
3
4
4
4
1
3
Часть В.
№ варианта
В1 (2 балла)
В2 (2 балла)
В3 (2 балла)
№1
А3 Б4 В1 Г6
А3 Б1 В4 Г5
2 3 4 5
№2
А4 Б5 В2 Г6
А4 Б1 В3 Г2
1 4 5 6
Часть С
3 балла
Вариант №1
1. Записано уравнение реакции
C3H8 + 5O2 = 3CO2 +4H2O
2. Найден объём углекислого газа : х= 11,2 *22,4 *3/22,4 =33,6л
Вариант №2
1. Записано уравнение реакции
C2H4 +3O2 = 2CO2 +2H2O
2. Найден объём кислорода : х= 10 * 22,4 *3/22,4 =30л
Критерии оценивания работы:
Оценка «5» - 13-15 баллов
Оценка «4» - 10 -12 баллов
Оценка «3» - 6-9 баллов
Оценка «2» - 5 баллов и менее
Контрольная работа №2 по теме: «Строение и классификация органических соединений, химические реакции в органической химии»
1 вариант
-
Дано вещество
CH2=CH-CH2-CH=CH2
а) назовите его;
б) укажите класс, к которому относится данное вещество;
в) определите вид гибридизации каждого атома углерода;
г) посчитайте число сигма - и пи- связей в этом веществе;
д) постройте и назовите гомолог этого вещества;
е) постройте и назовите изомер этого вещества. К какому виду изомерии относится предложенный вами изомер?
2. Определите, к какому классу относятся приведенные ниже соединения?
а) СН=С-СН2-СН3
б) СН3-С- СН2-С Н2-СН3
O
О
в) СН3-СН2-СН2 -С
Н
г) СН3-СН-СН3
NН2
-
Определите типы реакций
1) CH2=CH2 + H2O → C2H5OH
2) C2H6 + F2 → C2H5F + HF
3) nNH2-CH2 -COOH → - NH-CH2-CO - n + nH2O
4) C4H10 → C4H8 + H2
-
Решите задачу.
Массовая доля углерода в углеводороде 92,3%. Относительная плотность этого углеводорода по воздуху равна 0,896. Определите формулу углеводорода.
Контрольная работа №2 по теме: «Строение и классификация органических соединений, химические реакции в органической химии»
2 вариант
-
Дано вещество
СН2=СH-СН-СН3
СН3
а) назовите его;
б) укажите класс, к которому относится данное вещество;
в) определите вид гибридизации каждого атома углерода;
г) посчитайте число сигма - и пи- связей в этом веществе;
д) постройте и назовите гомолог этого вещества;
е) постройте и назовите изомер этого вещества. К какому виду изомерии относится предложенный вами изомер?
2. Определите, к какому классу относятся приведенные ниже соединения?
а) СНз-О-СН2-СНз
б) CH3-СН2-СООН
в) СН3-СН-СН-СН-СН3
ОН ОН ОН
г) СН3-СН2-СН=СН-СН=СН-СН2-СН3
3.Определите типы реакций
1) C3H6 + H2 → C3H8
2) CH3 - CH= CH- CH3 → CH2 =CH - CH2 - CH3
3) CH3Cl + HOH → CH3OH + HCl
4) CH4 + 2O2 → CO2 + 2H2O
-
Решите задачу.
.
Массовая доля углерода в углеводороде 80%. Относительная плотность этого углеводорода по воздуху равна 1,034. Определите формулу углеводорода.
Ответы и система оценивания к.р.№2
1 вариант.
1. (6 баллов) а) пентадиен - 1,4; б)алкадиены; в) г) 12-сигма и 2-пи связи; д) гексадиен - 1,5 или бутадиен -1,3
е)2-метилбутадиен -1,3(углер.скелета) или пентадиен -1,3 (полож. кратной связи)
-
(4балла) а)алкены; б)кетоны; в) альдегиды; г)амины.
-
(4балла) 1) гидратация, присоединение 2) замещения 3) полимеризации 4) дегидрирования, отщепления.
-
(5баллов)Решение:
2 вариант
-
(6 баллов) а) 3-метилбутен - 1; б)алкены; в) г) 14-сигма и 1-пи связь; д) 3-метилпентен -1 или 3-метилгексен -1
е)пентен -1(углер.скелета) или 2-метилбутен-2 (полож. кратной связи)
-
(4балла) а)простые эфиры; б)карбоновые кислоты; в) многоатомные спирты; г)алкадиены.
-
(4балла) 1) гидрирование, присоединение 2) изомеризация 3) замещение 4) горение, окисление
-
(5баллов) Решение:
Критерии оценивания работы: максимальное количество баллов - 19 Оценка «5» - 17-19 баллов Оценка «4» - 13-16 баллов Оценка «3» - 8-12 баллов
Оценка «2» - 7 баллов и менее
Контрольная работа № 3
по теме « Углеводороды»
Вариант 1
А1.Какая общая формула соответствует гомологическому ряду аренов?
-
СnH2n +2
-
CnH2n-2
-
CnHn-6
-
CnH2n-6
А2. Назовите вещество, формула которого:
CH3-C ≡ C-CH2
│
CH3
1) 1 - метилбутин-2
2) 4 - метилбутин-2
3) пентин-2
4) пентин-3
А3. Какой из приведенных углеводородов относится к тому же гомологическому ряду, что и бутин-1:
-
Бутан
-
бутин-2
-
пентин-1
-
правильного ответа нет
А4. Вещества, имеющие формулы: СН3 -СН ═ СН - СН2 - СН3 и
СН3 -С ═ СН - СН3
│
СН3
-
являются гомологами
-
являются структурными изомерами
-
являются изомерами положения кратной связи
-
не являются ни гомологами, ни изомерами
А5. Какие реакции характерны для веществ, соответствующих общей формуле CnH2n-2
-
замещения
-
присоединения
-
дегидрирования
-
дегидратации
А6. В каком случае продуктом приведенных реакций является хлорбензол?
свет
-
С6Н6 + CI2 →
свет
-
С6Н14 + 3 CI2 →
катал.
-
С6Н6 + CI2 →
-
С6Н12 + CI2 →
А7. К какому атому углерода присоединится бром в результате реакции:
1 2 3 4
СН2 ═ СН- СН2 - СН3 + НBr →
-
к первому
-
ко второму
-
к третьему
-
к четвертому
В1. Установите соответствие между типом химической реакции и уравнением реакции:
1) С2Н2 + 2Н2 → А) присоединения
2) С2Н6 + CI2 → Б) замещения
3) С2Н4 +Br2 → В) разложения
4) СН2 ═ СН - СН3 + HF →
В2. Установите соответствие между названием органического соединения и его структурной формулой: СН3
│
1) толуол А) СН3 -С- СН2 - СН3
│
2) пропин-2 СН3
3) 2,2 -диметилбутан Б) С6Н5СН3
4) пропен В) СН3 - С ≡ С-СН2 -СН3
5) пентин- 2 Г) СН2 ═ СН - СН3
6) бензол
С1. Осуществить цепочку превращений:
С2Н2 → С2Н4 → С2Н5ОН
↓
С2Н5CI
С2. Найдите молекулярную формулу углеводорода, содержание углерода в котором составляет 80%, а относительная плотность по водороду равна 15
Контрольная работа № 3
по теме « Углеводороды»
Вариант 2
А1. Состав молекул углеводородов соответствует общей формуле CnH2n +2. К какому классу веществ могут относиться эти углеводороды?
-
алкены
-
алкины
-
алканы
-
арены
А2. Назовите вещество, формула которого:
СН3
\
CH-CH═ CH2
⁄
СН3
1) 2 - метилбутен-3
2) 1,1 - диметилпропен-2
3) 3,3 -диметилпропен-1
4) 3- метилбутен-1
А3. Вещества, имеющие формулы: СН3 -С ≡ С- СН2 - СН3 и
НС≡ С - СН2 - СН2 - СН3
1) являются гомологами
2) являются структурными изомерами
-
являются изомерами положения кратной связи
4) не являются ни гомологами, ни изомерами
А4. Укажите ту пару веществ, которая включает названия гомологов 3- метилпентен-1:
-
2- метилпентен-1; 4- метилпентен-1
-
2- метилбутен-1; 3- метилпентен-2
-
3- метилгексен-1; 3- метилбутен-1
-
3- метилпропен-1; 2- метилпентен-2
А5. К какому атому углерода присоединится хлор в результате реакции:
1 2 3 4
НС ≡ С - СН2- СН3 + НCI →
1) к первому
-
ко второму
-
к третьему
-
к четвертому
А6. Какие реакции характерны для веществ, соответствующих общей формуле CnH2n+2
-
замещения
-
присоединения
-
дегидратации
А7. В каком случае продуктом приведенных реакций является циклогексан?
катал.
-
С6Н6 + 3Н2 →
С акт.
-
3С2Н2 →
катал.
-
С7Н8 + 3Н2 →
катал.
-
С6Н12 + Н2 →
В1. Установите соответствие между названием органического соединения и его структурной формулой:
1) пентадиен-1,3 А) СН2═СН- СН ═ СН- СН3
2)2,3,4-триметилгексан Б) С6Н6
3) бензол В) СН3 -С ≡ С - СН3
4) бутин-2 Г) Н 3С -СН - СН- СН- СН2- СН3
│ │ │
5)пентен-1 СН3 СН3 СН3
6)3,4,5-триметилгексан
В2. Установите соответствие между типом химической реакции и уравнением реакции:
1) С3Н8 + CI2 → А) присоединения
t
2) С2Н6 → Б) замещения
3) С2Н2 +2Br2 → В) разложения
4) СН2 ═ СН - СН ═ СН2 + Br2→
С1. Осуществить цепочку превращений:
СН4 → СН3Br → С2Н6→ C2H4
С2. Найдите молекулярную формулу углеводорода, содержание углерода в котором составляет 82,75%, водорода 17,24%, а относительная плотность по водороду равна 29
Ответы и система оценивания контрольной работы №3:
Часть А
№ варианта
А1
А2
А3
А4
А5
А6
А7
№1
4
3
3
2
2
3
2
№2
3
4
3
3
2
1
1
Часть В
-
№ варианта
В1 (4 балла)
В2(4 балла)
№1
1А 2Б 3А 4А
А1 Б3 В4 Г2
№2
А3 Б1 В5 Г4
1Б 2В 3А 4А
Часть С
Вариант №1
С1 (6 баллов)
С2 (5 баллов)
Вариант №2
С1 (6 баллов)
С2 (5 баллов)
Критерии оценивания работы: максимальное количество баллов - 26 Оценка «5» - 23-26 баллов Оценка «4» - 16- 22 баллов Оценка «3» - 9-15 баллов
Оценка «2» - 8 баллов и менее
Контрольная работа №4. «Спирты. Фенолы»
Вариант l
Часть А
-
Характерной реакцией для многоатомных спиртов является взаимодействие с
1)Ag2O(NH3 p-p) 2) Cu 3) Br2 4) Cu(OH)2
-
И с азотной кислотой, и с гидроксидом меди (ll) будет взаимодействовать
-
фенол 3) этанол
-
глицерин 4) метан
-
Фенол взаимодействует с
-
соляной кислотой 3) этиленом
-
гидроксидом натрия 4) метаном
-
Пропанол можно получить из пропена в результате реакции
-
гидратации 3) галогенирования
-
гидрирования 4) гидрогалогенирования
-
Глицерин, в отличие от пропанола, легкко растворяет
-
оксид железа (II) 3) гидроксид алюминия (III)
-
оксид алюминия (III) 4) гидроксид меди (II)
-
Верны ли следующие суждения?
А. Метиловый спирт - это яд, приводящий к слепоте и смерти.
Б. Этиловый спирт - это бесцветная жидкость с характерным запахом, не растворимая в воде.
1) верно только А 3) верны оба суждения
2) верно только Б 4) оба суждения неверны
7. Метанол, в отличие от этанола, не может быть получен
1) щелочным гидролизом галогеналканов
2) гидролизом сложных эфиров
3) гидратацией алкенов
4) гидролизом алкоголятов
Часть В
Запишите цифры в порядке возрастания.
В1.Фенол реагирует с
-
кислородом 4) хлороводородом
-
бензолом 5) натрием
-
гидроксидом натрия 6) оксидом кремния (IV)
В2. Для метанола справедливы утверждения:
1) газообразен при обычных условиях
2) хорошо растворяется в воде
3) взаимодействует с аммиачным раствором оксида серебра
4) атом углерода находится в sp3 -гибридизации
5) синтезируют из водяного пара
6) в водном растворе проявляет сильные кислотные свойства
Часть С
С1. Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
этен → хлорэтан → этанол → этилат натрия → этанол
С2. Рассчитайте массу фенолята натрия, которая может быть получена при взаимодействии 55 г фенола с 12 г гидроксида натрия.
Вариант ll
Часть А
-
Кислотные свойства наиболее выражены у
1)фенола 3) этанола
2) метанола 4) глицерина
2. Бутанол-2 и хлорид калия образуются при взаимодействии
1)1-хлорбутана и водного раствора КОН
2) 2-хлорбутана и спиртового раствора КОН
3) 1-хлорбутана и спиртового раствора КОН
4) 2-хлорбутана и водного раствора КОН
3. Глицерин в водном растворе можно определить с помощью
1)бромной воды 3) гидроксида меди (ll)
2) нитрата серебра 4) гидроксида натрия
4. При окислении этанола оксидом меди (ll) образуется
1)этан 3) этаналь
2) уксусная кислота 4) хлорэтан
5. Каждый из атомов кислорода в молекуле глицерина образует
1)одну σ-связь 3) две σ-связи
2) одну π-связь 4) одну σ-связь и одну π-связь
6. Верны ли следующие суждения?
А. Предельным одноатомным спиртам, начиная с этанола, изомерны простые эфиры
с тем же числом атомов углерода в иолекуле.
Б. Температура кипения предельных одноатомных спиртов выше, чем температура
кипения соответствующих углеводородов.
1) верно только А 3) верны оба суждения
2) верно только Б 4) оба суждения неверны
7. В отличие от этанола, этиленгликоль при обычных условиях взаимодействует с
1) гидроксидом меди (II) 3) бромоводородом
2) калием 4) аммиачным раствором оксида серебра
Часть В
Запишите цифры в порядке возрастания.
В1. И этанол и глицерин
1) относятся к многоатомным спиртам
2) имеют молекулярную кристаллическую решетку
3) растворяют гидроксид меди (II)
4) окисляются кислородом
5) взаимодействуют с бромоводородом
6) используются в лаборатории для заправки спиртовки
В2. И для фенола, и для бутантриола-1,2,4 справедливы утверждения
1) содержат функциональные группы - ОН
2) относятся к многоатомным спиртам
3) взаимодействуют с углекислым газом
4) проявляют кислотные свойства менее сильные, чем уксусная кислота
5) образуют характерный осадок при взаимодействии с бромной водой
6) в твёрдом состоянии имеют молекулярную кристаллическую решётку
Часть С
С1.Составьте уравнения реакций, с помощью которых можно осуществить следующие
превращения:
этан → этен → дибромэтан → этиленгликоль → дихлорэтан
С2. При взаимодействии 361 г глицерина с избытком азотной кислоты получено 908 г
тринитроглицерина. Вычислите массовую долю выхода продукта реакции.
Ответы и система оценивания контрольной работы №4:
Часть А
№ варианта
А1
А2
А3
А4
А5
А6
А7
№1
4
2
2
1
4
1
3
№2
1
4
3
3
3
3
1
Часть В
-
№ варианта
В1 (2 балла)
В2(2 балла)
№1
1 3 5
2 4 5
№2
2 4 5
1 4 6
Часть С
Вариант №1
С1 (4 балла)
С2 (4 балла)
Вариант №2
С1 (4 балла)
С2 (4 балла)
Критерии оценивания работы: максимальное количество баллов - 19 Оценка «5» -15-19 баллов Оценка «4» - 11-14 баллов Оценка «3» - 8-10 баллов
Оценка «2» - 7 баллов и менее
Контрольная работа №5 по теме «Альдегиды и кетоны».
Вариант 1.
-
Общая формула предельных альдегидов:
а) CnH2nO; б) CnH2n+2O; в) CnH2n+1OH; г) CnH2n-2O.
2. Альдегиды получают окислением спиртов: а) первичных; б) третичных; в) вторичных; г) непредельных.
3. Для получения уксусного альдегида по реакции Кучерова следует взять: а) бутин - 1; б) бутин - 2; в) пропин; г) этин.
4. Формальдегид нельзя получить: а) каталитическим дегидрированием метанола; б) дегидратацией метанола; в) окислением метанола; г) каталитическим окислением метана.
5. Среди нижеперечисленных пар соединений найдите пары, являющимися изомерами: а) 2 - метилпропаналь и пентаналь; б)Метаналь и формальдегид; в)пентанон - 2 и 3 - метилбутанон - 2; г)Бутанон и 2 - метил бутаналь.
6. При восстановлении пропаналя образуется
А) пропан Б) пропанол-1
В) пропановая кислота Г) пропанол-2
7. В цепи превращений Х 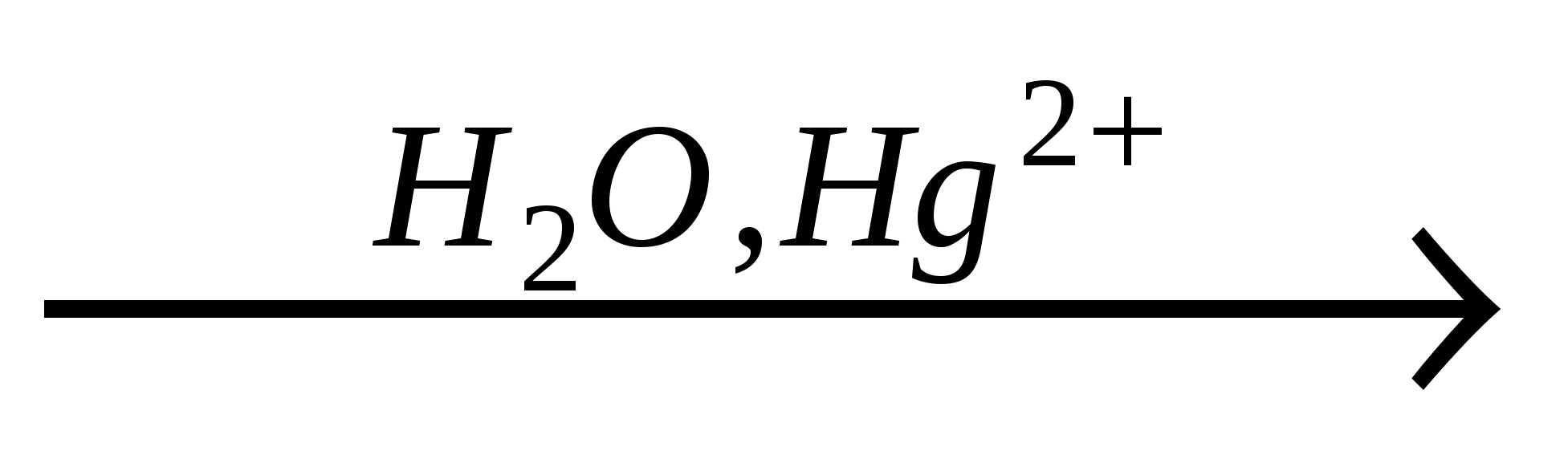 СН3─СН═О
СН3─СН═О 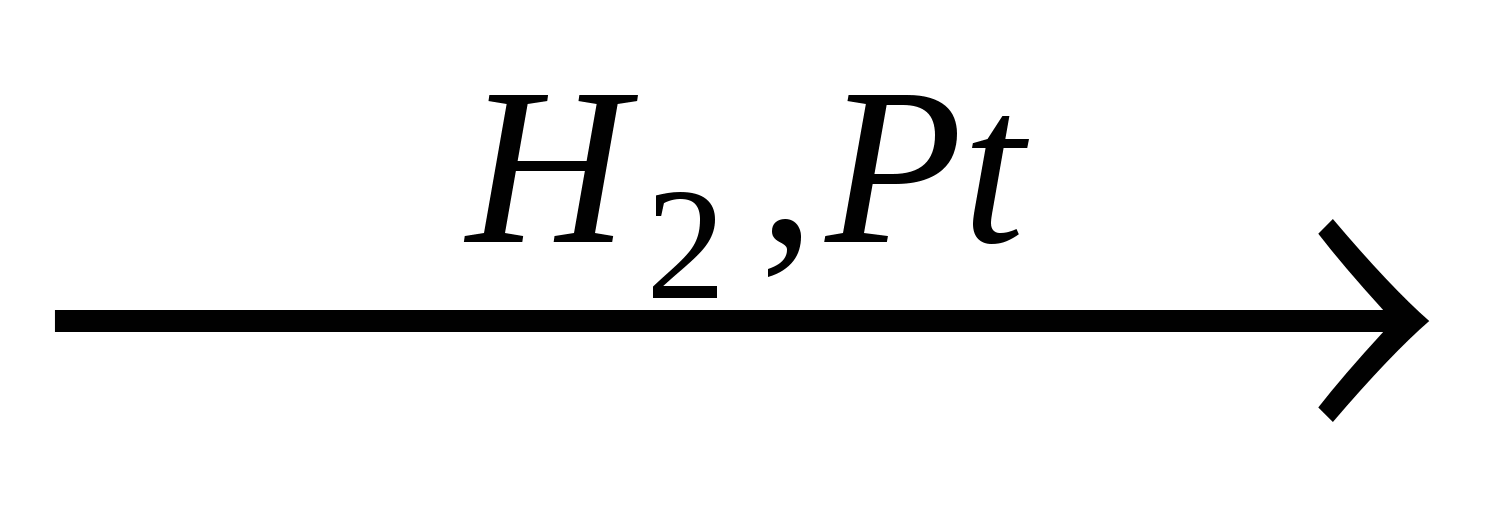 Y
Y
веществами Х и Y соответственно являются
А) этилен и этанол Б) этанол и уксусная кислота
В) ацетилен и этанол Г) ацетилен и уксусная кислота
8. Образование «серебряного зеркала» в реакции с аммиачным раствором оксида серебра доказывает, что в молекуле вещества содержится
А. карбоксильная группа
Б. двойная связь между атомами С и О
В. карбонильная группа на конце молекулы Г. атом углерода в sp2-гибридном состоянии
9. При нагревании ацетальдегида со свежеосаждённым гидроксидом меди(II) наблюдается
А) появление жёлтого, а затем красного осадка
Б) превращение голубого осадка гидроксида меди(II) в чёрный
В) растворение осадка и образование голубого раствора
Г) растворение осадка и образование васильково-синего раствора
ЧАСТЬ В. Задания со свободным ответом
1. (5 баллов). Для 2 - метилпентанона - 3 составьте структурные формулы одного изомера и одного гомолога. Назовите все вещества.
2. (6 баллов). При взаимодействии пропаналя с аммиачным раствором оксида серебра образовалось 8,64г осадка. Определите массу прореагировавшего пропаналя.
Контрольная работа по теме «Альдегиды и кетоны».
Вариант2.
1. Вещество, структура которого СН3─СН ─С Н2 ─СН2─СН═О, называется
│
СН3
А) 2-метил-5-оксопентан-2
Б) 2-метилпентаналь-5
В) 5-метилгексаналь
Г) 4-метилпентаналь
2. Гомологом бутаналя является
А) пропаналь Б) бутанон В) бутанол-1 Г) бутан
3.Бутанон - 2 можно получить: А) окислением бутанола - 1; В) восстановлением бутаналя; Б) дегидратацией бутанола - 2; Г) дегидрированием бутанола - 2.
4. Межклассовыми изомерами являются: А) этаналь и пропанон - 2; В) пропеналь и пропаналь; Б) пропанол - 1 и пропаналь; Г) бутен - 3 - ол - 1 и бутаналь.
5. Для предельных альдегидов характерна изомерия: А) положения функциональной группы; Б) геометрическая; В) углеродного скелета; Г) положения кратной связи.
6. Укажите соединение, в молекуле которого атом С находится в состоянии sp2 - гибридизации: А) этиловый спирт; В) пропанол Б) метиловый эфир; Г) этаналь.
7. В цепи превращений СН3─СН2─ОН →Х → СН3─СООН веществом Х является А) СН≡СН В) СН2═СН2 Б) СН3─СН2Cl Г) СН3─СН═О
8. С помощью аммиачного раствора оксида серебра можно различить растворы
А) метанола и этанола
Б) этанола и этаналя
В) ацетальдегида и формальдегида
Г) глицерина и этиленгликоля
9. Формалин - это: А) иное название формальдегида; В) водный раствор формальдегида; Б) продукт окисления формальдегида; Г) продукт восстановления формальдегида.
ЧАСТЬ В. Задания со свободным ответом
1. (5 баллов). Составьте структурные формулы одного изомера и одного гомолога для 5 - метил - 2 этилгексаналя. Назовите все вещества.
2. (6 баллов). Уксусный альдегид массой 8,8г полностью прореагировал с гидроксидом меди (II) при нагревании. Определите массу образовавшегося осадка красного цвета.
Ответы и система оценивания контрольной работы №5:
Часть А
№ варианта
1
2
3
4
5
6
7
8
9
№1
а
а
г
б
в
б
в
в
а
№2
г
а
г
г
в
г
г
б
в
Часть В
Вариант№1
1.
2.
Вариант№2
1.
2.
Критерии оценивания работы:
Максимальное количество баллов - 20
Оценка «5» -16-20 баллов
Оценка «4» - 11-15 баллов
Оценка «3» - 8-10 баллов
Оценка «2» - 7 баллов и менее
Контрольная работа №6 по теме «Карбоновые кислоты, сложные эфиры, жиры».
Вариант №1
Часть А
Выберите один правильный ответ из четырёх предложенных.
1. (2 балла). К классу предельных одноосновных карбоновых кислот принадлежит вещество состава
A.С3Н6О Б. С3Н6О2 В. С2Н6О2 Г. С2Н6О
2. (2 балла). Молекула акриловой (пропеновой) кислоты содержит
А. один атом кислорода и одну π-связь
Б. два атома кислорода и две π-связи
В. один атом кислорода и две π-связи
Г. два атома кислорода и одну π-связь
3. (2 балла). Изомером пропановой кислоты не является
А. метилацетат В. этилформиат
Б. 1-гидроксипропанон Г. пропандиол-1,2
4. (2 балла). В результате влияния гидроксильной группы на карбонильную предельные карбоновые кислоты
А. хорошо растворимы в воде
Б. вступают в реакцию этерификации
В. не вступают в реакции присоединения
Г. обладают выраженными кислотными свойствами
5. (2 балла). Ацетат натрия не получится при действии на уксусную кислоту
А. натрия Б. гидроксида натрия
В. карбоната натрия Г. хлорида натрия
6. (2 балла). Сложный эфир можно получить реакцией:
А. Галогенирования. Б. Нитрования. В. Гидрирования. Г. Этерификации.
7. (2 балла). Кислотные свойства наиболее ярко выражены у вещества, формула которого:
А. СН3СОН. Б. СН3СН2СН2ОН.
В. СН3СН2СООН. Г. С6Н5ОН.
8 (2 балла). В реакцию нейтрализации могут вступать:
А. Альдегиды. В. Сложные эфиры.
Б. Спирты. Г. Карбоновые кислоты.
9 (2 балла). Формула вещества X в цепочке превращений
СН2=СН-СН3 -> X -> СН3СОСН3:
А. СН2ОН-СН2-СН3. Б. СН3-СНОН-СН3. В. СН3-СНСl-СН3. Г. СН2С1-СН2-СН3.
10 (2 балла). Жиры представляют собой:
А. сложные эфиры глицерина и высших карбоновых кислот;
Б. сложные эфиры этиленгликоля и высших карбоновых кислот;
В. натриевые соли высших карбоновых кислот;
Г. смесь высших карбоновых кислот
ЧАСТЬ Б. Задания со свободным ответом
ЗАДАНИЕ 1 (6 баллов)
Закончите уравнения реакций, укажите условия их осуществления
A. НСООН + Zn →
Б. СН3СООН + СН3ОН →
ЗАДАНИЕ 2 (8баллов)
Напишите уравнения реакций, при помощи которых можно осуществить превращения по схеме:
C3H8 → C3H7Br → C3H7OH → C3H7COH → C3H7COOH
Укажите условия осуществления реакций и названия всех веществ.
ЗАДАНИЕ 3 (6 баллов)
Рассчитайте массу кислоты, полученной при нагревании 55 г 40% -го раствора этаналя с избытком гидроксида меди (II).
Вариант №2
Часть А
Выберите один правильный ответ из четырёх предложенных.
1 (2 балла). Общая формула сложных эфиров:
А. RСОН. Б. RСООН. В. R1CОR2. Г. R1CОOR2.
2. (2 балла). Какое из перечисленных веществ содержит карбоксильную группу?
А. бутанол-2
Б. 3- метилпентановая кислота
В. Пентанон -2
Г. пентаналь
3. (2 балла). Пара гомологов:
А. глицерин и этиленгликоль
Б. метанол и метаналь
В. Уксусная и муравьиная кислоты
Г. фенол и этанол
4. (2 балла). Кислотные свойства среди перечисленных ниже веществ наиболее выражены у
А. хлоруксусной кислоты Б. фенола
В. муравьиной кислоты Г. пропанола
5. (2 балла). Пропановая кислота вступает в реакцию с
А) аммиачным раствором оксида серебра
Б) сульфатом натрия
В) хлороводородом
Г) бромом
6. (2 балла). Продуктом реакции этерификации может быть
А) вода Б) диэтиловый эфир
В) бутанол Г) уксусная кислота
7. (2 балла). Карбоновую кислоту нельзя получить реакцией:
А. Восстановления альдегида. Б. Гидролиза жира.
В. Окисления альдегида. Г. Окисления одноатомного спирта.
8. (2 балла). Кислотные свойства наиболее ярко выражены у вещества, формула которого:
А. НСООН. Б. С3Н7СООН.
В. С2Н5ОН. Г. С4Н9ОН.
9 (2 балла). Формула вещества X в цепочке превращений
С2Н5ОН → X →СН3СООН:
А. СО2. Б. СН3СОН.
В. С2Н5С1. Г. С2Н5ОС2Н5.
10 (2 балла). Жидкие жиры отличаются от твердых тем,что в их составе содержатся:
свободные гидроксильные группы;
Б. остатки ароматических карбоновых кислот;
сложные эфиры высших карбоновых кислот
и этиленгликоля;
Г. остатки непредельных карбоновых кислот
ЧАСТЬ Б. Задания со свободным ответом
ЗАДАНИЕ 1 (6 баллов)
Закончите уравнения реакций, укажите условия их осуществления
A. СН3СООН + СаСО3→
Б. С2Н5ОН + СН3СООН →
ЗАДАНИЕ 2 ( 8 баллов)
Напишите уравнения реакций, при помощи которых можно осуществить превращения по схеме:
СН4→ С2Н2 → СН3СОН→ СН3СООН→ (CH3COO)2Mg.
Укажите условия осуществления реакций и названия всех веществ.
ЗАДАНИЕ 3 (6 баллов)
Рассчитайте массу кислоты, полученной при нагревании 55 г 40% -го раствора этаналя с избытком гидроксида меди (II).
Ответы и система оценивания контрольной работы №6:
Вариант№1
Часть А
1
2
3
4
5
6
7
8
9
10
11
12
13
14
а
г
г
а
б
в
в
в
а
б
в
а
в
г
Часть В
1.
2.
3.
Вариант№2
Часть А
1
2
3
4
5
6
7
8
9
10
11
12
13
14
а
г
г
а
б
в
в
в
а
б
в
а
в
г
Часть В
1.
2.
3.
Критерии оценивания работы:
Максимальное количество баллов- 40
Оценка «5» - 35-40 баллов
Оценка «4» -26-34 балла
Оценка «3» -16 -25 баллов
Оценка «2» - менее 16 баллов
Контрольная работа №7 по теме «Углеводы и азотосодержащие соединения»
Вариант№1
Часть А.
1. Общая формула углеводов условно принята:
а) СnH2nOn б) СnH2nOm в) СnH2mOm г) Сn(H2O)m
2. Среди перечисленных моносахаридов укажите кетогексозу:
а) глюкоза б) фруктоза в) рибоза г) дезоксирибоза.
3. Лактоза относится к группе:
а) моносахаридов б) дисахаридов в) полисахаридов.
4. По химическому строению глюкоза представляет собой:
а) многоатомный спирт б)сложный эфир в)оксикислоту г)альдегидоспирт
5. Качественной реакцией на глюкозу является реакция с:
а) Cu(OH)2 б) FeCl3 в) I2(раствор) г) CuO
6. Молекула целлюлозы построена из остатков:
а) α -глюкозы б) β- глюкозы в) β -фруктозы г)сахарозы.
7.Синее окрашивание с раствором йода даёт:
а) глюкоза б)крахмал в)целлюлоза г)сахароза.
8. Амины можно рассматривать как производные:
а) азота б) метана в) аммиака г) азотной кислоты.
9. Какой из типов веществ не относиться к азотосодержащим соединениям:
а) белки б) аминокислоты в) нуклеиновые кислоты г) полисахариды.
10. При образовании первичной структуры белка важнейшим видом связи является:
а) водородная б) пептидная в) дисульфидная г) ионная.
11. Спиралевидное состояние полипептидной цепи является структурой белка:
а) первичной б) вторичной в) третичной г) четвертичной.
12. Для проведения ксантопротеиновой реакции потребуется реагент:
а) HNO3 б)H2SO4 в) PbS г) CuSO4.
13. Для обнаружения белка можно использовать реакцию:
а) «серебряного зеркала» б) биуретовую в) «медного зеркала» г) реакцию Зинина.
14.Нуклеиновые кислоты принимают участие в биосинтезе:
а) белков б) аминокислот в) жиров г) углеводов.
Часть Б.
1. Назовите амины. Напишите реакцию взаимодействия метиламина с соляной кислотой.
а) N H2-CH3 б) C3H7-NH-C2H5
2. С какими из перечисленных веществ: гидроксид натрия, водород, аммиачный раствор оксида серебра - вступает в реакцию глюкоза? Ответ подтвердите, написав возможные уравнения реакций
3. Рассчитайте объём азота, образующегося при полном сжигании 10г этиламина.
Контрольная работа №7 по теме «Углеводы и азотосодержащие соединения»
Вариант№2
Часть А.
1.Вещество, соответствующее общей формуле Сn(Н2О)m, относится к классу:
а) альдегидов б) углеводов в) спиртов г) карбоновых кислот.
2. Какой из типов веществ не относится к углеводам:
а)фруктоза б) рибоза в) нуклеиновые кислоты г) полисахариды.
3. Фруктозу иначе называют:
а) молочным сахаром б) фруктовым сахаром в) инвертным сахаром г) тростниковым сахаром.
4. Какое из веществ является полимером?
а) глюкоза б)этиленгликоль в)целлюлоза г)сахароза.
5. Изомером глюкозы является:
а) формальдегид б)крахмал в)фруктоза г)сахароза.
6.Какое из веществ не даёт реакцию «серебряного зеркала»?
а) глюкоза б)муравьиная кислота в)метаналь г)сахароза.
7. Окраска смеси глюкозы с гидроксидом меди при нагревании:
а)голубая б) синяя в)красная г)фиолетовая
8. При гидролизе крахмала образуется:
а) α - глюкоза б) β - глюкоза в) α - глюкоза и β - фруктоза г) глюкоза и галактоза.
9. Аминокислоты проявляют свойства:
а) только кислотные б) только основные в) амфотерные.
10. При образовании вторичной структуры белка важнейшим видом связи является:
а) водородная б) пептидная в) дисульфидная г) ионная.
11. Белки являются одним из важнейших компонентов пищи. В основе усвоения белка в желудочно-кишечном тракте лежит реакция:
а) окисления б) этерификации в) гидролиза г) дегидратация.
12. Для проведения биуретовой реакции потребуется реагент:
а) HNO3(конц) б)H2SO4 в) PbS г) CuSO4
13. Для обнаружения белка можно использовать реакцию:
а) «серебряного зеркала» б)ксантопротеиновую в) «медного зеркала» г) реакцию Зинина.
14. . Какие вещества не являются составной частью нуклеотида?
а) Пуриновое или пиримидиновое основание,
б) рибоза или дезоксирибоза,
в) аминокислоты,
г) фосфорная кислота.
Часть Б.
1. Назовите амины. Напишите реакцию взаимодействия анилина с соляной кислотой.
а) CH3-CH2-NH-CH3 б) C6H5-NH2
2. С какими из перечисленных веществ: гидроксид натрия, вода, этанол - вступает в реакцию аминоуксусная кислота?. Ответ подтвердите, написав возможные уравнения реакций
3. Рассчитайте массу этанола, который можно получить из 540г глюкозы при её спиртовом брожении.
Ответы и система оценивания контрольной работы №7: Часть А.
вариант
1
2
3
4
5
6
7
8
9
10
11
12
13
14
№1
Г
Б
Б
Г
А
Б
Б
В
Г
Б
Б
А
Б
А
№2
Б
В
Б
В
В
Г
В
А
В
А
В
Г
Б
В
Часть В.
Вариант №1
1.
2.
3.
Вариант №2
1.
2.
3.
Критерии оценивания работы: Максимальное количество баллов- 24
Оценка «5» - 20-24балла
Оценка «4» - 15- 19баллов
Оценка «3» - 9- 14 баллов
Оценка «2» - менее 9 баллов
Итоговая контрольная работа №8
по органической химии за 10 класс
Вариант №1
1. Вещество, соответствующее общей формуле R-СООН, относится к классу:
А. Альдегидов В. Спиртов
Б. Фенолов Г. Карбоновых кислот
2. Укажите соединение, содержащее карбонильную группу:
А. Спирт В. Простой эфир
Б. Альдегид Г. Фенол
3. Укажите вещество, являющееся изомером пропанола -2:
А. Пропанон В. Пропановая кислота
Б. Пропанол - 1 Г. Пропилацетат
4. Назовите вещество: СН3─ СН─СН2─СН2 ─ С= О
| |
СН3 Н
А. 2- метилпентаналь В. 2 - метилгексанол-5
Б. 4- метилпентанол -2 Г. 4 - метилпентаналь
5. Образование ярко-синего комплексного соединения с гидроксидом меди (ΙΙ) является качественной реакцией на
А. Альдегиды В. Многоатомные спирты
Б. Фенолы Г. Карбоновые кислоты
6. Веществом Х в реакции
С2Н5ОН + СН3СООН → Х + Н2О является:
А. этанол В. пропан
Б. метиловый эфир г. уксусноэтиловый эфир
7. При восстановлении альдегидов образуются:
А. Спирты В. Кетоны
Б. Фенолы Г. Карбоновые кислоты
8. Для предельных одноатомных спиртов не характерно:
А. Горение в кислороде В. Взаимодействие с активными металлами
Б. Реакции гидрирования Г. Реакции дегидратации
9. Процентное содержание углерода в молекуле уксусной кислоты составляет:
А. 40,0% В. 10,2%
Б. 10,1% г. 40,3%
10. Допишите уравнения реакций и установите соответствие:
1) СН3 ─СООН + Nа →
2) СН3─ С= О + Н2 →
|
Н
1
2
А. Гидратации В. Замещения
Б.Гидрирования Г. Этерификации
Часть В. Задания со свободным ответом
1. Составьте формулы веществ по названию. Для вещества диэтиловый эфир напишите 2 изомера, назовите их.
а) метилбензол (толуол) б) 4-аминовалериановая кислота
в) диэтиловый эфир
2. Осуществите цепочку превращений, укажите условия протекания реакций, назовите продукты реакций:
C2H2→ CH3COH → CH3CH2 OH→ CH3-COOCH3
↓
C2H4
Итоговая контрольная работа №8
по органической химии за 10 класс
Вариант №1
1. Вещество, соответствующее общей формуле R-ОН, относится к классу:
А. Альдегидов В. Спиртов
Б. Углеводов Г. Карбоновых кислот
2. Укажите соединение, содержащее карбоксильную группу:
А. Спирт В. Простой эфир
Б. Альдегид Г. Карбоновая кислота
3. Межклассовыми изомерами альдегидов являются
А. Карбоновые кислоты В. Сложные эфиры
Б. Кетоны Г. Спирты
4. Назовите вещество: СН3─ СН─СН2─СН─ СН3
| |
ОН СН3
А. 2- метилпентаналь В. 2- метилпентанол-4
Б. 4- метилпентанол -2 Г. 4 - метилпентаналь-2
5. Реакция «серебряного зеркала» является качественной реакцией на
А. Альдегиды В. Многоатомные спирты
Б. Фенолы Г. Кетоны
6. Веществом Х в реакции
СН3─ С= О + Ag2O → Х + 2Ag является
|
Н
А. метанол В. пропаналь
Б. уксусная кислота Г. пропанол
7. При окислении альдегидов образуются:
А. Спирты В. Кетоны
Б. Фенолы Г. Карбоновые кислоты
8. Предельные одноосновные кислоты не взаимодействуют:
А. С гидроксидом натрия В. С карбонатом калия
Б. С металлами Г. С метаном
9. Процентное содержание углерода в молекуле пропаналя составляет:
А. 82,76% В. 72,4%
Б. 83, 7% Г. 78,2%
10. Допишите уравнения реакций и установите соответствие:
1) СН3 ─СН=СН2 + Н2О →
1
2
2) НСООН + С2Н5ОН →
А. Гидратации В. Этерификации
Б, Дегидратации Г. Гидрирования
Часть В. Задания со свободным ответом
1. Составьте формулы веществ по названию. Для вещества пропиламин напишите 2 изомера, назовите их.
а) 2,3-диметил-3-хлорпентан,
б) этиловый эфир уксусной кислоты
в) пропиламин
2. Осуществите превращения и укажите условия их протекания.
C2H5OH → CH3COH → CH3COOH→ CH2Cl-COOH → NH2-CH2-COOH
Ответы и система оценивания контрольной работы №8:
Часть А.
вариант
1
2
3
4
5
6
7
8
9
№1
Г
Б
Б
Г
В
Г
А
Б
А
№2
В
Г
Б
Б
А
Б
Г
Г
Б
Задание №10.
Вариант №1
Вариант №2
Часть В.
Вариант №1
Задание В1
Задание В2
Вариант №2
Задание В1
Задание В2
Критерии оценивания работы:
Максимальное количество баллов- 22
Оценка «5» - 18-22балла
Оценка «4» - 13- 17баллов
Оценка «3» - 7- 12 баллов
Оценка «2» - менее 7 баллов
Материалы для проведения контрольных работ. 11 класс (Составлены самостоятельно с учётом требования стандартов и программы по химии).
Контрольная работа №1 по теме «Строение атома».
Вариант 1
Часть А:
А 1. Ядро атома заряжено положительно благодаря наличию в нем:
а) протонов, б) нейтронов, в) электронов, г) катионов.
А 2. В какой фразе речь идет об элементе водороде:
а) водород в 14,5 раза легче воздуха, б) массовая доля водорода в воде составляет 11,11%,
в) объемная доля водорода в смеси газов составляет 20%, г) водород в смеси с кислородом или воздухом взрывоопасна.
А 3. Число орбиталей на внешнем энергетическом уровне атома азота равно:
а) одному, б) трем, в) четырем, г) пяти.
А 4. Форму объемной восьмерки имеет орбиталь:
а) s, б) p, в) d, г) f.
А 5. Число энергетических уровней в атоме химического элемента совпадает:
а) с порядковым номером, б) с номером группы, в) с относительной атомной массой, г) с номером периода.
А 6. Электронная конфигурация 1s22s22p63s23p63d104s24p2 соответствует атому:
а) титана, б) кальция, в) германия, г) цинка.
А 7. К семейству s - элементов относится:
а) кислород, б) гелий, в) хром, г) неодим.
А 8. Максимальная валентность атома углерода в возбужденном состоянии равна:
а) одному, б) двум, в) трем, г) четырем.
А 9. Число свободных орбиталей в атоме хлора в основном состоянии равно:
а) одному, б) трем, в) пяти, г) нулю.
А 10. Наиболее ярко выражены металлические свойства у элемента:
а) калия, б) кальция, в) магния, г) натрия.
А 11. Элемент, электронная конфигурация которого……3s23p4, расположен:
а) во втором периоде, б) в третьем периоде, в) в четвертом периоде, г) в шестом периоде.
А 12. Наиболее ярко неметаллические свойства выражены у элемента с электронной конфигурацией:
а) 1s1, б) 1s22s22p1, в) 1s22s22p6, г) 1s22s22p5.
А 13. Число электронов на внешнем энергетическом уровне атомов в ряду N - P - As -Sb - Bi:
а) увеличивается, б) уменьшается, в) не изменяется, г) изменяется периодически.
А 14. Какой из перечисленных элементов образует все три типа оксидов: основный, амфотерный, кислотный:
а) хром, б) сера, в) кальций, г) алюминий.
А 15. Распределение валентных электронов в атоме соответствует конфигурации ….ns2np2. Формулы летучего водородного соединения и высшего оксида этого элемента соответственно:
а) Н2Э и ЭО2, б) ЭН4 и ЭO2, в) ЭН4 и ЭO г) ЭH2 и ЭO.
Часть В:
В 1. Сумма чисел протонов, нейтронов и электронов в атоме равна 134, причем число нейтронов превышает число электронов на 11. Напишите название элемента
В 2. Два атома имеют одинаковое число протонов, но разное число нейтронов в ядре. Как они называются по отношению друг к другу ( в ответе укажите термин во множественном числе)?
В 3. С атомом калия произошло превращение К0 - х → К+. Как называется частица х, которую отдал атом калия, превращаясь в катион?
В 4. Назовите вещество из числа предложенных, в котором атом неметалла имеет неподеленную электронную пару: H2, NH3, CH4, C2H6.
В 5. Элементы Х и У находятся в одном периоде и являются соседями, элементы У и Z расположены в одной группе и также по соседству. Элемент У входит в состав молекул кислот, образуемых элементами Х и Z. К какому классу веществ относятся соединения Х с У и Z с У. (термин напишите во множественном числе).
Часть С:
С 1. Массовая доля водорода в соединении с элементом 4 группы равна 12,5%. Определите этот элемент. Напишите формулу его высшего оксида.
Контрольная работа №1 «СТРОЕНИЕ АТОМА».
Вариант 2
Часть А:
А 1.Определите химический элемент по составу его атомной частицы - 18p, 20n, 18e:
а) F, б) Ca, в) Ar, г) Sr.
А 2. s - элементом является:
а) барий, б) америций, в) галлий, г) ванадий.
А 3. Электронная конфигурация ……..3d64s2 соответствует элементу:
а) аргону, б) криптону, в) железу, г) рутению.
А 4.Элемент Х с электронной формулой 1s22s22p63s23p3 образует высший оксид, соответствующий формуле:
а) Э2О, б) Э2О3, в) ЭО2, г) Э2О5.
А 5. Общее число электронов у иона Br-:
а) 35, б) 36, в) 80, г) 34.
А 6. Максимальное число электронов, занимающих p - подуровень, равно:
а) 1, б) 2, в) 6, г) 8.
А 7. Наибольший радиус атома среди перечисленных элементов имеет:
а) Na, б) Mg, в) Ba, г) Ca.
А 8. Из приведенных элементов 4 - го периода наиболее ярко выраженные металлические свойства имеет:
а) Zn, б) Cr, в) K, г) Cu.
А 9. Число протонов, нейтронов, электронов для изотопа 55Mn:
а) 55p, 25n, 55e, б) 25p, 30n, 25e, в) 25p, 55n, 25e, г) 55p, 25n, 25e.
А 10. Какая частица имеет больше протонов, чем электронов:
а) атом натрия, б) сульфид - ион, в) атом серы, г) ион натрия.
А 11. Порядковый номер элементов в периодической системе определяется:
а) зарядом ядра атома, б) числом электронов в наружном слое,
в) числом электронных слоев в атоме, г) числом нейтронов в атоме.
А 12. Из приведенных ниже электронных формул выберите ту, которая соответствует p - элементу 4 группы:
а) ….4s24p64d35s2, б) ….4s24p2 , в) ….3s23p63d104s2 4p3, г)….2s22p4.
А 13. Электронная формула атома 1s22s2 2p63s23p2. Формула его водородного соединения:
а) РН3 , б) Н2S, в) CH4, г) SiH4.
А 14. Наиболее сходными химическими свойствами обладают простые вещества, образованные элементами:
а) Ca и Si, б) Pb и Ag, в) Сl и Ar, г) P и As.
А 15. Амфотерным является гидроксид, формула которого:
а) Be(OH)2, б) Mg(OH), в) H2SiO3, г) Ba(OH)2.
Часть В:
В 1. Сумма чисел протонов, нейтронов и электронов в атоме равна 273, причем число нейтронов превышает число электронов на 39. Напишите название элемента.
В 2. Формула высшего оксида неметалла имеет формулу Э2О7. Как будет выглядеть формула летучего водородного соединения этого элемента, в какой группе периодической системы он находится?
В 3. С атомом натрия произошло превращение Na0 - х → Na+. Как называется частица х, которую отдал атом натрия превращаясь в катион?
В 4. Назовите вещество из числа предложенных, в котором атом неметалла имеет четыре неспаренных электрона, которые участвуют в образовании связи: H2, NH3, CH4, C2H6
В 5. Расположите элементы: Si, B, O, Mg, P, Al, Cl в порядке возрастания восстановительных свойств
Часть С:
С 1. Высший оксид элемента отвечает формуле ЭО3. Его водородное соединение содержит 2,47% водорода. Определите этот элемент. Напишите формулу его соединения с водородом.
Контрольная работа №1 «СТРОЕНИЕ АТОМА».
Ответы:
ЧастьА
Вариант
А1
А2
А3
А4
А5
А6
А7
А8
А9
А10
А11
А12
А13
А14
А15
№1
а
б
в
б
г
в
б
г
в
а
б
г
в
а
б
№2
в
а
в
г
б
в
в
в
б
г
а
б
г
г
а
Часть В
Вариант №1
В1 ниобий
В2 изотопы
В3 Электрон
В4 аммиак NH3
В5 оксиды
Вариант №2
В1 № 78 , платина
В2 НЭ, в 7 группе
В3 электрон
В4. метан - CH4
В5 O, Cl, P, Si, В, Al, Mg
Часть С
Вариант №1
С1
Вариант №2
С1
Критерии оценивания работы:
Максимальное количество баллов- 30
Оценка «5» - 25-30 баллов
Оценка «4» - 19- 24балла
Оценка «3» - 11- 18 баллов
Оценка «2» - менее 11 баллов
Контрольная работа №2 «СТРОЕНИЕ ВЕЩЕСТВА».
Вариант 1
Часть А:
А 1. Формула вещества с ковалентной полярной связью:
а) Cl2, б) KCl, в) NH3, г) O2.
А 2. Вещество, между молекулами которого существует водородная связь:
а) этанол, б) метан, в) Водород, г) Бензол.
А 3. Число общих электронных пар в молекуле водорода:
а) одна, б) две, в) три, г) четыре.
А 4. Полярность химической связи увеличивается в ряду соединений, формулы которых:
а) NH3, HI, O2 , б) CH4, H2O, HF, в) PH3, H2S, H2, г) HCl, CH4, CL2 .
А 5. Кристаллическая решетка хлорида натрия:
а) атомная, б) ионная, в) металлическая, г) молекулярная.
А 6. Число δ и π - связей в молекуле ацетилена:
а) 5 δ и π - нет, б) 2 δ и 3 π , в) 3 δ и 2 π , г) 4 δ и 1 π .
А 7. Вещества, формулы которых: СН3 - СН2 - ОН и СН3 - О - СН3, - это:
а) гомологи, б) изомеры, в) одно и то же вещество, г) и гомологи и изомеры.
А 8. Гомологом вещества, формула которого СН2 = СН - СН3, - это:
а) бутан, б) бутен - 1, в) бутен - 2, г) бутин - 1.
А 9. Ковалентная неполярная связь образуется между атомами:
а) водорода и кислорода, б) углерода и водорода, в) хлора, г) магния.
А 10. Только δ - связь есть в молекуле:
а) азота, б) этанола, в) этилена, г) оксида углерода (4).
А 11. Атом азота имеет валентность 3 и степень окисления 0 в молекуле вещества, формула которого:
а) NH3, б) N2, в) CH3NO2, г) N2O3.
А 12. Молекулярное строение имеет вещество с формулой:
а) СН4, б) NaOH, в) SiO2, г) Al.
А 13. Наиболее выражен характер ионной связи:
а) CsF, б) NaCl, в) KF, г) LiBr.
А 14. Между атомами есть ковалентная связь, образованная по донорно - акцепторному механизму в веществе, формула которого:
а) СН3NО2, б) NH4NO2, в) C5H8, г) H2O.
А 15. Наименее полярной является связь:
а) С - Н, б) С - Сl, в) С - F, г) С - Br.
Часть В:
В 1. Из числа предложенных, выберите вещество, в молекуле которого имеются 2 π - связи: H2, CH4, Br2, N2, H2S, CH3OH. Напишите название этого вещества.
В 2. Какие реакции лежат в основе получения полимеров? Напишите название реакций в именительном падеже.
В 3. Можно ли назвать дисперсной системой молоко, раствор сахара в воде, зубную пасту, сливочное масло, дым? Ответ дайте одним словом: «да» или « нет»
В 4. Какое из веществ: CH4, H2S, HCl будет иметь наиболее полярную связь? Ответ запишите формулой.
Часть С:
.
С 1 . Составьте структурные формулы веществ: СHI3, C2H2Cl2 , N2.
Составьте графические формулы: Ca3N2, Li2SO4, NaHCO3.
С 2. Определите степень окисления в химических соединениях и ионах:
HNO2, KClO4H3PO4, KHS, KClO3
Контрольная работа №2 «СТРОЕНИЕ ВЕЩЕСТВА».
Вариант 2
Часть А:
А 1. Пара элементов, между которыми образуется ионная химическая связь:
а) углерод и сера, б) водород и азот, в) калий и кислород, г) кремний и водород.
А 2. Формула вещества с ковалентной связью:
а) NaCl, б) HCl, в) BaO, г) Ca3N2.
А 3. Наименее полярной является связь:
а) С - Н, б) С - Сl, в) С - F, г) С - Br.
А 4. Верным является утверждение, что δ - связь в отличие от π - связи:
а) менее прочная, б) образуется при боковом перекрывании атомных орбиталей,
в) не является ковалентной, г) образуется при осевом перекрывании атомных орбиталей.
А 5. Вещество в молекуле которого нет π -связи:
а) этилен, б) бензол, в) аммиак, г) азот.
А 6. Наиболее прочной является молекула:
а) Н2, б) N2, в) F2, г) O2.
А 7. В ионе СО32- атом углерода находится в sp2 - гибридном состоянии, поэтому ион имеет форму:
а) линейную, б) тетраэдра, в) треугольника, г) октаэдра.
А 8. Атом углерода имеет степень окисления -3 и валентность 4 в соединении с формулой:
а) СО2, б) С2Н6, в) СН3Сl, г) CaC2.
А 9. Атомную кристаллическую решетку имеет:
а) сода, б) вода, в) алмаз, г) парафин.
А 10. Вещество между молекулами которого существует водородная связь:
а) этан, б) фторид натрия, в) оксид углерода (4), г) этанол.
А 11. Выберите группу элементов, расположенных в порядке возрастания электроотрицательности:
а) Cl, Si, N, O, б) Si, P, N, F, в) F, Cl, O, Si, г) O, N, F, Cl.
А 12. Между атомами есть ковалентная связь, образованная по донорно - акцепторному механизму в веществе, формула которого:
а) Al(OH)3 , б) [СН3NH3]Cl, в) С2 H5OH, г) C6H12O6 .
А 13. Молекулярное строение имеет вещество с формулой:
а) СН4, б) NaOH, в) SiO2, г) Al.
А 14. Водородная связь образуется между:
а) молекулами воды, б) молекулами водорода,
в) молекулами углеводородов, г) атомами металлов и атомами водорода.
А 15. Формула вещества с ковалентной полярной связью:
а) Cl2, б) KCl, в) NH3, г) O2.
Часть В:
В 1. Из числа предложенных, выберите вещество, в молекуле которого имеются π - связи: H2, CH4, Br2, N2, H2S, CH3OH, NH3. Напишите название этого вещества.
В 2. Процесс взаимодействия электронных орбиталей, приводящих к их выравниванию по форме и энергии, называется……
В 3. Как называется явление укрупнения коллоидных частиц м выпадение их в осадок из коллоидного раствора?
В 4. В каком из указанных веществ, связи наиболее полярны: хлороводород, фтор, вода, аммиак, сероводород. Выбранное вещество запишите формулой.
Часть С:
С 1 . (6 баллов) Составьте структурные формулы веществ: СHF3, C2H2Br2 , O2.
Составьте графические формулы: Mg3N2, Na2SO4, KHCO3.
С 2. (5 баллов) Определите степень окисления в химических соединениях и ионах:
Mg3N2, Cl2, ZnSO4, KHS, FeOHCl2,
Контрольная работа №2 «СТРОЕНИЕ ВЕЩЕСТВА».
Ответы:
ЧастьА
Вариант
А1
А2
А3
А4
А5
А6
А7
А8
А9
А10
А11
А12
А13
А14
А15
№1
в
а
а
б
б
в
б
б
в
б
б
а
а
б
а
№2
в
б
а
г
в
б
в
б
в
г
б
б
а
а
в
Часть В
Вариант №1
В1 азот
В2 полимеризация
В3 да
В4 HCl
Вариант №2
В1 азот
В2 гибридизация
В3 коагуляция
В4 аммиак NH3
Часть С
Вариант №1
С1
С2
HNO2, KClO4 H3PO4, KHS, KClO3
Вариант №2
С1
С2
Mg3N2, Cl2, ZnSO4, KHS, FeOHCl2,
Критерии оценивания работы:
Максимальное количество баллов- 34
Оценка «5» - 29-34 баллов
Оценка «4» - 21- 28балла
Оценка «3» - 13- 20 баллов
Оценка «2» - менее 13 баллов
Контрольная работа №3 «ХИМИЧЕСКИЕ РЕАКЦИИ».
Вариант 1
Часть А:
А 1. Характеристика реакции, уравнение которой 4 Fe + 6H2O +3O2 →4Fe(OH)3 :
а) соединения, ОВР, обратимая, б) замещения, ОВР, необратимая,
в) соединения, ОВР, необратимая, г) обмена, не ОВР, необратимая.
А 2. В окислительно - восстановительной реакции, схема которой:
KClO3 + FeSO4 + H2SO4 → Fe2 (SO4)3 + KСl + H2O сумм а коэффициентов перед окислителем
и восстановителем равна:
а) 4, б) 7, в) 9, г) 10.
А 3. Количество тепловой энергии, которое выделяется или поглощается в ходе химической реакции, называется:
а) тепловым эффектом, б) энергией активации, в) теплотой образования, г) температурным коэффициентом.
А 4. Физический смысл температурного коэффициента Вант - Гоффа заключается в том, что он показывает:
а) скорость химической реакции при увеличении температуры,
б) во сколько раз увеличивается скорость химической реакции при увеличении температуры на 2 - 40 С,
в) во сколько раз увеличивается скорость химической реакции при увеличении температуры на каждые 100С,
г) на сколько градусов необходимо увеличить температуру реакции, чтобы её скорость увеличилась в 2 - 4 раза.
А 5. Сокращенное ионное уравнение реакции NH4+ + OH- → NH3 + H2O соответствует взаимодействию между:
а) NH4 Cl и H2O, б) NH4 Cl (р - р) и KOH( р-р) в) NH3 и H2O, г) NH4NO3 и Mg(OH)2.
А 6. При повышении давления равновесие сместится в сторону продуктов реакции в случае системы:
 а) H2 + Br2 2HBr, б) C + CO2 2CO, в) PCl5(г) PCl3(г) + Cl2 , г) СO + Cl2COCl2(г)
а) H2 + Br2 2HBr, б) C + CO2 2CO, в) PCl5(г) PCl3(г) + Cl2 , г) СO + Cl2COCl2(г)
А 7. Долю молекул, распавшихся на ионы в растворе, показывает величина:
а) константы диссоциации, б) степени диссоциации,
в) температурного коэффициента, г) верного ответа среди перечисленных нет.
А 8. Краткому ионному уравнению СН3СОО- + Н+ → СН3СООН соответствует взаимодействие между:
а) ацетатом магния и водой, б) ацетатом аммония и гидроксидом натрия,
в) ацетатом натрия и кремниевой кислотой, г) ацетатом калия и азотной кислотой.
А 9. Ионы какой группы могут быть легко удалены из раствора в виде труднорастворимых соединений:
а) Cu2+, CO32-, NO3-, б) Fe3+, Na+, Cl-, в) Ca2+, S2-, SiO32-, г) Pb2+, NH4+, Br-.
А 10. В каком случае растворы трех солей в группе можно распознать с помощью универсальной индикаторной бумаги:
а) KCl, HCOONa, Al2(SO4)3 б) NH4NO3, Na2SO4, BaCl2,
в) Pb(NO3)2, K2SO4, NH4Br, г) K2S, NaCN, MgSO4.
А 11. Окислитель в реакции синтеза аммиака, уравнение которой N2 + 3H2 → 2 NH3 + Q:
а) N0, б) H0, в) H+1, г) N-3 .
А 12. При повышении температуры на 300С (температурный коэффициент γ = 3) скорость реакции увеличиться:
а) в 3 раза, б) в 9 раз, в) в 27 раз, г) в 81 раз.
А 13. Щелочную среду имеет водный раствор соли, формула которой:
а) AlCl3, б) KNO3, в) K2CO3, г) FeCl3.
А 14. Гидролизу не подвергается:
а) белок, б) сульфат цинка, в) целлюлоза, г) этилен.
А 15. Реакция ионного обмена возможна между веществами, формулы которых:
а) CH3COOH и HCl, б)Cu(OH)2 и Na2CO3 , в) Ba(OH)2 и Na2SO4, г) H3PO4 и KCl.
Часть В:
В 1. Как называются вещества, водные растворы которых проводят электрический ток.
(напишите термин во множественном числе).
В 2. Как изменит окраску лакмус в растворе силиката натрия?
(Ответ запишите одним словом, указав цвет в именительном падеже).
В 3. На скорость реакции оказывают влияние: природа реагирующих веществ, поверхность соприкосновения, катализатор, концентрация веществ. Какой важный фактор не назван?
(ответ укажите в именительном падеже).
Часть С:
t
С 1. В схеме химической реакции FeO + С → Fe + СО2 расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель. Дайте характеристику данной реакции по всем изученным классификационным признакам. ( 7 баллов)
С 2. Выразите сущность реакции гидролиза солей: карбоната кальция, иодида меди (2). (4 балла)
С 3. Между какими из предложенных веществ возможны химические реакции, идущие в одном направлении: AlCl3, AgNO3, K2CO3, NaNO3. Составьте молекулярные и сокращенные ионные уравнения. (3балла)
Контрольная работа №3 «ХИМИЧЕСКИЕ РЕАКЦИИ».
Вариант 2
Часть А:
А 1. Неверным является утверждение, что при протеканиихимической реакции:
а) сохраняется суммарная масса веществ, б) сохраняются молекулы веществ,
в) сохраняются атомы веществ, г) сохраняется суммарная энергия.
А 2. Реакция уравнение которой СН4 +Cl 2 →CН3 Cl + HCl является:
а) замещения, гомогенной, б) замещения, экзотермической,
в) замещения, гетерогенной, г) обмена, каталитической.
А 3. К окислительно - восстановительным относится реакция, уравнение которой:
а) C2H4 + H2 → C2H6, б) NaCl + AgNO3 → AgCl ↓+ NaNO3,
в) CaO + H2 O → Ca(OH)2, г) CH3 OH + HCl→ CH3 Cl + H2 O
А 4. Сумма коэффициентов в сокращенном ионном уравнении между растворами хлорида бария и сульфата натрия равна:
а) 6, б) 5, в) 4, г) 3.
А 5. Сокращенное ионное уравнение реакции 2H+ + SiO32- → H2SiO3↓ соответствует взаимодействию между:
а) SiO2 и H2O, б) Na2SiO3 и HCl в) H2SO4 и SiO2, г) CaSiO3 и H2SO4.
А 6. Гидролизу подвергается:
а) глюкоза, б) мыло, в) поваренная соль, г) серная кислота.
А 7. Растворение цинка в соляной кислоте будет замедляться в случае:
а) увеличения концентрации кислоты, б) раздробления цинка,
в) понижения температуры, г) использования катализатора.
А 8. С наибольшей скоростью при комнатной температуре протекает реакция:
а) Zn и H2SO4, б) Na и C6H5OH, в) Fe и O2, г) CuSO4(р - р) и KOH(р - р).
А 9. Химическое равновесие в системе СН4 + Н2О →3Н2 + СО - Q смещается в сторону продуктов реакции при:
а) повышении давления, б) понижении температуры,
в) повышении температуры, г) использования катализатора.
А 10. К химической реакции не относится:
а) крекинг углеводородов, б) плавление льда, в) ржавление железа, г) образование накипи.
А 11. Соль, которая гидролизируется по аниону:
а) CrCl3, б) K2SiO3, в) NaClO4, г) NaNO3.
А 12. Химическое равновесие в системе СН4 + Н2О →3Н2 + СО - Q смещается в сторону продуктов реакции при:
а) повышении давления, б) понижении температуры,
в) повышении температуры, г) использования катализатора.
А 13. В водном растворе среда щелочная в случае:
а) ацетата натрия, б) хлорида калия, в) нитрата меди (2), г) сульфата аммония.
А 14. Скорость гомогенной реакции зависит:
а) от природы реагирующих веществ, б) от температуры,
в) от концентрации веществ, г) все приведенные ответы верны.
А 15. Окислитель в реакции синтеза аммиака, уравнение которой N2 + 3H2 → 2 NH3 + Q:
а) N0, б) H0, в) H+1, г) N-3.
Часть В:
В 1. Как называются вещества, которые ускоряют ход химической реакции, сами при этом не расходуются?
(напишите термин в именительном падеже).
В 2. Как называются вещества, водные растворы которых не проводят электрический ток (напишите термин во множественном числе).
В 3. Как изменит окраску лакмус в растворе сульфата аммония?
(Ответ запишите одним словом, указав цвет в именительном падеже).
Часть С:
t
С 1. В схеме химической реакции H2O + С → СО + H2 расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель. Дайте характеристику данной реакции по всем изученным классификационным признакам.
С 2. Выразите сущность реакции гидролиза солей: хлорида хрома (3), сульфида калия.
С 3. Между какими из предложенных веществ возможны химические реакции, идущие в одном направлении: BaCl2, NaNO3, Na2SO4, K2CO3. Составьте молекулярные и сокращенные ионные уравнения.
Контрольная работа №3 «Химические реакции».
Ответы:
ЧастьА
Вариант
А1
А2
А3
А4
А5
А6
А7
А8
А9
А10
А11
А12
А13
А14
А15
№1
в
б
а
в
б
г
б
г
в
а
а
б
в
г
в
№2
б
а
а
б
б
б
в
г
в
б
б
в
а
г
а
Часть В
Вариант №1
В1 электролиты
В2 синий
В3 температура
Вариант №2
В1 катализаторы
В2 неэлектролиты
В3 красный
Часть С
Вариант №1
С1 FeO + С → Fe + СО2
С2
С3
Вариант №2
С1 H2O + С → СО + H2
С2
С3
Критерии оценивания работы:
Максимальное количество баллов- 34
Оценка «5» - 29-34 баллов Оценка «4» - 21- 28балла
Оценка «3» - 13- 20 баллов Оценка «2» - менее 13 баллов
Контрольная работа №; по теме «Металлы» и «Неметаллы»
Вариант №1
Часть А
1. К какому типу элементов относятся щелочные и щелочноземельные металлы?
А) р -элементам Б) s -элементам В) d-элементам Г) f -элементам
2. Атом какого элемента имеет электронную конфигурацию 1s22s22p63s23p64s1 ?
А) К Б) Са В) Ва Г) Na
3.Какой металл р - семейства наиболее активен?
А) алюминий Б) индий В) таллий Г) галлий
4. В какой группе все три металла можно получить алюмотермией из оксидов?
А) Na, Cu, Cr Б) Sn, Cu, Fe
В) Na, Cr, Pb Г) Mg, Zn, Ni
5. В какой группе ПС химических элементов находятся самые активные металлы?
А) VΙΙ группа, побочная подгруппа
Б) Ι группа, главная подгруппа
В ΙΙ группа, главная подгруппа
Г) V группа, побочная подгруппа
6. Верны ли следующие суждения об элементах ΙΙА группы
1) Металлические свойства элементов ΙΙА группы усиливаются сверху вниз
2) Увеличивается число электронов на последнем энергетическом уровне
А) оба - верно Б) оба - неверно В) верно только 1 Г) верно только 2
7.Оцените справедливость суждений о металлах
1) В периодах с увеличением зарядов атомных ядер происходит ослабление основных свойств гидроксидов элементов
2) В главных подгруппах с увеличением заряда атомных ядер происходит усиление притяжения валентных электронов к ядру
А. верно только 1 Б. верно только 2 В. оба - верно Г. оба - неверно
8. Основные свойства наиболее сильно выражены
А) NaOH Б) Mg(OH)2 В) Al(OH)3 Г) Si(OH)4
9. Наиболее энергично взаимодействуют с водой
А) Al Б) Mg В) Са Г) К
10. В ряду Na−Mg−Al элементы расположены в порядке увеличения
А) атомного радиуса
Б) электроотрицательности
В) металлических свойств
Г) числа энергетических уровней
11. Металл Ме образует оксид состава Ме2О3. В невозбужденном состоянии атом Ме имеет конфигурацию валентного слоя:
А) ns2np1 Б) ns2np3 В) ns2np2 Г) ns1
12. Какому химическому элементу соответствует распределение электронов по энергетическим уровням: 2, 8, 18, 8, 2
А) Ca Б) Мg В) Sr Г)Fe.
13.Тип связи в простом веществе натрия:
А) ионная Б) ковалентная неполярная В) металлическая Г) ковалентная полярная
14. Наиболее ярко выраженные металлические свойства проявляет:
А) Mg Б) K В) Al Г) Ca
15. Кислотный характер имеют оксиды, образованные металлами:
А) главных подгрупп Б) со степенью окисления ниже +4
В) со степенью окисления равной или выше +4 Г) с любой степенью окисления
16. Какой химический элемент не образует аллотропных модификаций?
А) кислород Б) углерод В) азот Г) фосфор
17. Наиболее электроотрицательный элемент это:
А)азот Б)кислород В)хлор
Г)фтор
18. Вещество с молекулярной кристаллической решеткой:
А)железо Б)алмаз В)хлорид натрия Г)углекислый газ
Часть В
В1. Осуществите превращение:
+О2 (избыт) +3Н2О+3Са(ОН)2


 Р Х1 Х2 Х3
Р Х1 Х2 Х3
Часть С
С1. В уравнении окислительно-восстановительной реакции
 Сu + HNO3 Cu(NO3)2 + NO + H2O
Сu + HNO3 Cu(NO3)2 + NO + H2O
разб.
Расставьте коэффициенты с помощью электронного баланса. Укажите окислитель и восстановитель
Вариант №2
1. Какому металлу соответствует электронная формула 1s22s22p63s23p64s23d10?
А) Mo Б) Zn В) Ba Г) Fe
2. При взаимодействии железа с разбавленной H2SO4 образуется
А) Fe2(SO4)3 и H2
Б) Fe2(SO4)3 и SO2
В) FeSO4 и H2
Г) FeSO4 и SO2
3.Какой металл не вытеснит водород из разбавленной H2SO4?
А) Fe Б) Cr В) Cu Г) Zn
4.В порядке уменьшения восстановительных свойств металлы расположены в ряду:
А) Al, Zn, Fe Б) Al, Na, K В) Fe, Zn, Mg Г) Fe, Zn, Al
5.Оксиды CrO и CrO3 -
А) основные Б) основные и кислотные В) кислотные Г) кислотные и основные
6.К какому типу элементов относится железо?
А) р - элементам Б) s -элементам В) d -элементам Г) f -элементам
7. На d- подуровне максимально может находиться:
А) 2е Б) 6е В)10е Г) 18е
8. Металлический хром может взаимодействовать с:
А) H2О Б) HCl (разб.) В) HNO3(конц.) Г) NaOH(конц.)
9. Для металлов не характерно следующее физическое свойство:
А) теплопроводность Б) металлический блеск
В) электропроводность Г) хрупкость
10. Верны ли следующие суждения об элементах ΙΙА группы
1) Металлические свойства элементов ΙΙА группы усиливаются сверху вниз
2) Увеличивается число электронов на последнем энергетическом уровне
А). оба - верно Б) оба - неверно В) верно только 1 Г) верно только 2
11. С точки зрения типа кристаллической решетки «лишнее» простое вещество среди данных
А) алмаз Б) хром В) железо Г) кобальт
12.Электронная формула иона Fe+2
А) 1s22s22p63s23p64s23d6
Б) 1s22s22p63s23p64s03d10
В) 1s22s22p63s23p64s03d6
Г) 1s22s22p63s23p64s23d10
13. Свойства оксидов металлов побочных подгрупп с уменьшением степени окисления металла изменяются в следующем порядке
А) основные, амфотерные, кислотные
Б) кислотные, амфотерные, основные
В) основные, кислотные, амфотерные
Г) кислотные, основные, амфотерные

14. В схеме превращения
веществами X и Yсоответственно являются
А) Fe и Cl2 Б) Fe2O3 и HCl В) Fe и HCl Г) Fe3O4 и HCl
15. Какую электронную конфигурацию имеет атом наиболее активного неметалла?
А) 1s22s22p4 Б) 1s22s22p63s2 В) 1s22s2 Г) 1s22s22p63s23p4
16. Наиболее электроотрицательным элементом является:
А) Mg Б) Si В) Cl Г) Ar
17. Утверждение о том, что структурной частицей данного вещества является молекула, справедливо только для: А)Алмаза Б) азота
В) Кремния Г) поваренной соли
18. Графит и алмаз - это:
А)разные химические элементы
Б)одно и тоже вещество
В)аллотропные изменения одного и того же химического элемента
Г) разные агрегатные состояния одного вещества
В1. Осуществите превращения на основе алюминия:
+3HCl +3KOH +3KOH, t


 Al (OH) 3 X1 X2 X3
Al (OH) 3 X1 X2 X3
С 1. В уравнении окислительно - восстановительной реакции Hg + H2SO4HgSO4 + SO2 + H2O
1. В уравнении окислительно - восстановительной реакции Hg + H2SO4HgSO4 + SO2 + H2O
(конц)
Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель
Контрольная работа №3 «Металлы. Неметаллы».
Ответы: ЧастьА
-
Вариант №1
Вариант №2
№ вопроса
Правильный ответ
№ вопроса
Правильный ответ
1
Б
1
Б
2
A
2
В
3
В
3
В
4
Б
4
А
5
Б
5
Б
6
В
6
В
7
А
7
В
8
A
8
Б
9
Г
9
Г
10
Б
10
В
11
A
11
А
12
В
12
В
13
В
13
Б
14
Б
14
В
15
В
15
А
16
В
16
В
17
Г
17
Б
18
Г
18
В
Часть В
Вариант №1
Вариант №2
Часть С
Вариант №1
С1 Сu + HNO3 → Cu(NO3)2 + NO + H2O
разб
Вариант №2
С1
Hg + H2SO4 → HgSO4 + SO2 + H2O
( конц)
Критерии оценивания работы:
Максимальное количество баллов- 25
Оценка «5» - 21-25 баллов
Оценка «4» - 15 - 20баллов
Оценка «3» - 9- 14 баллов
Оценка «2» - менее 9 баллов
Контрольная работа №5 «Вещества и их свойства».
Вариант 1
Часть А:
А 1. По данным элементарного анализа вещество содержит кальций, серу, кислород. Это вещество является:
1. По данным элементарного анализа вещество содержит кальций, серу, кислород. Это вещество является:
а) оксидом, б) основанием,
в) кислотой, г) солью.
А 2. Имеются два утверждения: 1. если на внешнем энергетическом уровне атома содержится один электрон, то это атом металл, 2. если на внешнем энергетическом уровне атома содержится семь электронов, то этот атом неметалл, можно сказать, что:
а) оба утверждения верны, б) оба утверждения неверны,
в) первое утверждение верно, второе - нет, г) второе утверждение верно, первое - нет.
А 3. Какое из веществ не образуется при электролизе водного раствора бромида калия:
а) калий, б) бром, в) водород, г) гидроксид калия.
А 4. При взаимодействии с каким веществом железо окисляется до степени окисления +3:
а) с хлором, б) с хлороводородной кислотой,
в) с сульфатом меди (2), г) все выше приведенные ответы верны.
А 5. Укажите электронную формулу атома неметалла, проявляющего наиболее сильные окислительные свойства:
а) 1s22s22p63s23p4, б) 1s22s22p5 , в) 1s22s22p63s23p5, г) 1s22s22p4.
А 6. При взаимодействии с каким веществом бром проявляет восстановительные свойства:
а) с магнием, б) с сероводородом, в) с пропеном, г) верного ответа среди перечисленных нет.
А 7. Расположите кислородсодержащие кислоты хлора в порядке усиления их кислотных свойств:
1. HClO2, 2. HClO4, 3. HClO, 4. HClO3.
а) 4, 3,2,1, б) 3,1,4,2, в) 2,4,1,3, г) 1,4,2,3.
А 8. Переменную степень окисления в соединениях проявляет:
а) магний, б) марганец, в) натрий, г) стронций
А 9. Разбавленная серная кислота реагирует со всеми веществами группы:
а) Fe, CO2, CaCO3, б) CuO, Mg(OH)2, Ba(NO3)2, в) Ag, Na2O, NH3, г) KOH, CH3COONa, LiCl.
А 10. Восстановительные свойства в ряду химических элементов Ве - Mg - Na - K:
а) изменяются периодически, б) не изменяются, в) ослабевают, г) усиливаются.
А 11. Сокращенное ионное уравнение OH- + NH4+ → NH3 · H2 O соответствует взаимодействию:
а) гидроксида натрия с аммиаком, б) гидроксида железа (2) с хлоридом аммония,
в) гидроксида бария с сульфатом аммония, г) гидроксида калия с нитратом аммония.
А 12. Основным оксидом является:
а) Al2O3, б) BaO , в) BeO, г) SO2.
А 13. Соединения, имеющие функциональную группу NH2 относятся к:
а) кислотам, б) аминам, в) спиртам, г) эфирам.
А 14. Какой из признаков не относится к металлам:
а) пластичность, б) электропроводность, в) хрупкость, г) ковкость.
А 15. Амфотерным соединением не является:
а) Mg(OH)2, б) Zn(OH)2, в) Be(OH)2, г) аминоуксусная кислота.
Часть В:
В 1 Как называется окислительно - восстановительный процесс, протекающий на электродах при пропускании электрического тока через раствор или расплав электролита?
(ответ напишите в именительном падеже).
В 2. Как изменяется кислотный характер оксидов в ряду: SO3 → P2O5 → SiO2 → H2O.
(ответ укажите в форме глагола).
В 3.
Как изменяются основные свойства летучих водородных соединений элементов главной подгруппы 5 группы периодической системы с увеличением порядкового номера?
(ответ укажите в форме глагола).
Часть С:
С 1. При окислении 2,19 г металла образуется 2,67 г амфотерного оксида состава MeO. Определите этот металл?
С 2. Составьте уравнения реакций по следующей схеме:
Cu → CuSO4 → Cu(ОН)2 → CuO →Cu
Укажите условия осуществления реакций.
Контрольная работа №5 «Вещества и их свойства».
Вариант 2
Часть А:
А 1. Основным оксидом является вещество с формулой:
1. Основным оксидом является вещество с формулой:
а) BaO, б) BeO, в) Al2O3, г) SO2.
А 2. Соединение, имеющие функциональную группу - С=О относят к классу:
2. Соединение, имеющие функциональную группу - С=О относят к классу:
Н
а) спиртов, б) карбоновых кислот, в) альдегидов, г) эфиров.
А 3. Амфотерным соединением не является:
а) гидроксид магния, б) гидроксид железа (3), в) аминоуксусная кислота, г) гидроксид цинка.
А 4. Металл, способный вытеснить водород из воды при комнатной температуре:
а) Cu, б) Zn, в) Fe, г) K.
А 5. Для получения лития используют следующий метод:
а) электролиз раствора LiCl, б) электролиз расплава LiCl,
в) восстановление LiCl магнием, г) прокаливание карбоната лития с углем.
А 6. Даны: сажа, графит, фуллерен, алмаз. Количество химических элементов, образующих эти вещества:
а) 1, б) 2, в) 3, г) 4.
А 7. Для нейтрализации серной кислоты можно использовать вещество с формулой:
а) HNO3, б) CH3OH, в) Mg(OH)2, г) NaHSO4.
А 8. Едкие щелочи разрушают растительные и животные ткани. Таким свойством обладает:
а) KOH, б) Cu(OH)2, в) Mg(OH)2, г) C2H5OH.
А 9. Переменную степень окисления в соединениях проявляет:
а) магний, б) марганец, в) натрий, г) стронций.
А 10. Восстановительные свойства в ряду химических элементов Bу - Mg - Na - K:
а) изменяются периодически, б) не изменяются, в) ослабевают, г) усиливаются.
А 11. Простое вещество сера взаимодействует с каждым из веществ ряда:
а) HCl, Na, O2, б) Mg, O2, H2, в) K, Zn, Na2SO4, г) Al, H2O, O2.
А 12. Высший оксид и гидроксид элемента главной подгруппы 5 группы периодической системы соответствует общим формулам:
а) ЭO2 и Н2ЭО3, б) Э2O5 и НЭО3 , в) ЭO3 и Н2ЭО4, г) Э2O7 и НЭО4.
А 13. Переход S-2 →S+4 можно осуществить при взаимодействии веществ, формулы которых:
а) H2S и O2, б) H2S и H2O, в) H2S и NH3, г) Na2S и HCl.
А 14. Элементом Э в генетическом ряду Э → ЭО2 → Na2ЭО3 → Н2ЭО3 является:
а) алюминий, б) азот, в) сера, г) фосфор.
А 15. Амфотерным соединением является:
а) Mg(OH)2, б) Zn(OH)2, в) Fe(OH)2, г) Сu (OH)2.
Часть В:
В 1. Как называют вещества мылкие на ощупь, окрашивающие фенолфталеин в малиновый цвет?
(напишите ответ в именительном падеже).
В 2. Как изменяется кислотный характер оксидов в ряду: N2O5 → P2O5 → As2O5.
(ответ укажите в форме глагола).
В 3 Как изменяются основные свойства высших оксидов соединений элементов главной подгруппы 2 группы периодической системы с увеличением порядкового номера?
(ответ укажите в форме глагола).
Часть С:
С 1. 16, 2 г алюминия вступило в реакцию с неизвестным галогеном, при этом образовалось 160,2 г соли. Определите галоген?
С 2. Составьте уравнения реакций по следующей схеме:
Fe → FeCl2 → Fe(OH)2 → Fe(OH)3 → Fe2O3
Укажите условия осуществления реакций.
Контрольная работа №5 «Вещества и их свойства ».
Ответы:
ЧастьА
Вариант
А1
А2
А3
А4
А5
А6
А7
А8
А9
А10
А11
А12
А13
А14
А15
№1
г
а
а
а
б
г
б
б
б
г
г
б
а
в
а
№2
а
в
а
г
б
а
в
а
б
г
б
б
а
в
б
Часть В
Вариант №1
В1 электролиз
В2 ослабевают
В3 уменьшаются
Вариант №2
В1 щёлочь
В2 ослабевает
В3 усиливается
Часть С
Вариант №1
С1
С2
Вариант №2
С1
С2
Критерии оценивания работы:
Максимальное количество баллов- 31
Оценка «5» - 27-31 балл Оценка «4» - 21- 26балла
Оценка «3» - 12- 20 баллов Оценка «2» - менее 12 баллов
Итоговая контрольная работа
Инструкция по выполнению работы в 11 классе
На выполнение тренировочной работы по химии отводится 45 минут.
Работа состоит из трех частей, включающих 13 заданий.
Часть первая (А) содержит 10 заданий. К каждому заданию этой части дается 4 варианта ответа, из которых только один правильный.
Часть вторая (В) содержит 2 задания:
В1 - на установление соответствия названия органического вещества и класса к которому оно относится.
В2 - на установление соответствия вещества и среды его водного раствора.
Часть третья содержит одно самое сложное задание (С1), требующее полного свободного ответа.
Внимательно прочитайте каждое задание и предлагаемые варианты ответа, если они имеются. Отвечайте только после того, как вы поняли вопрос и проанализировали все варианты ответа. Номер правильного, на ваш взгляд, ответа обведите кружочком.
Выполняйте задания в том порядке, в котором они даны. Если какое-то задание вызывает у вас затруднение, пропустите его и постарайтесь выполнить те, в ответах на которые вы уверены. К пропущенным заданиям сможете вернуться, если у вас останется время.
За выполнение различных по сложности заданий дается от одного до трех баллов.
Постарайтесь выполнить как можно больше заданий и набрать наибольшее число баллов.
Желаем успеха
Вариант 1
А1. Электронная формула внешнего энергетического уровня атома наиболее активного металла
-
4s2
-
3s23p1
-
3s2
-
2s2
А2. Из приведенных элементов четвертого периода наиболее ярко выраженными металлическими свойствами обладает
-
цинк
-
медь
-
хром
-
калий
A3. Веществу с ионным типом связи отвечает формула
-
SО3
-
RbF
-
HCl
-
SiF4
А4. Степень окисления хлора в Са(СlO2)2 равна
-
+3
-
-3
-
0
-
+5
А5. Оксид серы (IV) является
-
осно́вным
-
несолеобразующим
-
амфотерным
-
кислотным
А6. К двухосновным бескислородным кислотам относится
-
Н3РО4
-
H2S
-
H2SО4
-
НВr 2+ -
А7. Сокращенное ионное уравнение реакции Cu + 2OH = Cu(OH)2↓ соответствует взаимодействию
-
CuSO4 и Fe(OH)3
-
CuO и Ba(OH)2
-
CuCl2 и NaOH
-
CuO и H2O
А8. Оксид серы (IV) взаимодействует с каждым из двух веществ
-
NaCl, H2O
-
Ca(OH)2, BaO
-
CaCO3, ZnSO4
-
NaOH, N2
А9. Бутадиен-1,3 относится к углеводородам
-
предельным
-
непредельным
-
ароматическим
-
циклопарафинам
А10. Продуктом реакции пропена с хлором является
-
1,2-дихлорпропен
-
2-хлорпропен
-
2-хлорпропан
-
1,2-дихлорпропан
В1. Установите соответствие между формулой органического вещества и классом (группой) соединений, к которому оно принадлежит
Формула вещества
Класс (группа) органических соединений
1) CH3-CH(CH3)-CHO
А. алкины
2) CH3-CH2-O-(CH2)4-CH3
Б. простые эфиры
3) CH3-CH2-C(CH3)=C(CH3)-CH3
В. алкены
4) CH3-C(CH3)2-CH2-CH2-CH2-OH
Г. альдегиды
Д. спирты
Ответ оформите в виде таблицы
1
2
3
4
В2. Установите соответствие между формулой соли и средой ее водного раствора
Формула соли
Среда раствора
А. MgCl2
1. нейтральная
Б. Al2(SO4)3
2. кислая
В. NaCl
3. щелочная
Г. K2CO3
С1. Используя метод электронного баланса, составьте уравнение реакции
A l + K2Cr2O7 + H2SO4 Al2(SO4)3 + ……….. + K2SO4 + H2O
l + K2Cr2O7 + H2SO4 Al2(SO4)3 + ……….. + K2SO4 + H2O
Определите окислитель и восстановитель
Вариант 2
А1. Электронная формула внешнего энергетического уровня атома наиболее активного неметалла
-
2s22p2
-
3s23p3
-
2s22p3
-
3s23p4
А2. В каком ряду простые вещества расположены в порядке усиления
металлических свойств
-
Mg, Ca, Ba
-
K, Ca, Fe
-
Na, Mg, Al
-
Sc, Ca, Mg
А3. Вещества только с ковалентной полярной связью расположены в ряду
-
HCl, H2O, H2S
-
O2, H2O, LiCl
-
NaCl, N2, NH3
-
KOH, NO, HBr
А4. Среди элементов V A группы наиболее электроотрицательным является
-
фосфор
-
азот
-
мышьяк
-
висмут
А5. Оксид кремния (IV) является
-
осно́вным
-
несолеобразующим
-
амфотерным
-
кислотным
А6. К одноосновным кислородсодержащим сильным кислотам относится
-
HNО2
-
НСl
-
H2SО4
-
НClO4
+ -
А7. Сокращенное ионное уравнение реакции NH4 + OH = NH3↑ + H2O соответствует взаимодействию
-
NH4Cl и Ca(OH)2
-
NH4Cl и H2O
-
NH3 и H2O
-
NH3 и HCl
А8. Сера выступает как окислитель в реакции с
-
хлором
-
кислородом
-
бромом
-
железом
А9. К гомологам относятся
-
этанол и диэтиловый эфир
-
пропан и гексан
-
бутан и бутен-1
-
уксусная кислота и уксусный альдегид
А10. В результате реакции бутен-2 с бромом образуется
-
2,3-дибромбутан
-
1,2-дибромбутан
-
1,4-дибромбутан
-
1,3-дибромбутан
В1. Установите соответствие между названием органического соединения и классом, к которому оно принадлежит
Название соединения
Класс соединений
1) метаналь
А. арены
2) глицерин
Б. альдегиды
3) пропен
В. спирты
4) пропин
Г. алкены
Д. аминокислоты
Е. алкины
Ответ оформите в виде таблицы
1
2
3
4
В2. Установите соответствие между формулой соли и средой ее водного раствора
Формула соли
Среда раствора
А. CaCl2
1. нейтральная
Б. AICI3
2. кислая
В. K2CO3
3. щелочная
Г. CuBr2
Ответ оформите в виде таблицы
А
Б
В
Г
С1. Используя метод электронного баланса, составьте уравнение реакции
P + HClO3 + H2O ………. +HCl
+ HClO3 + H2O ………. +HCl
Определите окислитель и восстановитель.
Итоговая контрольная работа
Ответы:
ЧастьА
Вариант
А1
А2
А3
А4
А5
А6
А7
А8
А9
А10
№1
1
4
2
1
4
2
3
2
2
4
№2
3
1
1
2
4
4
1
4
2
1
Часть В
Вариант №1
В1 ГБВД
В2 2213
Вариант №2
В1 БВГЕ
В2 1232
Часть С
Вариант №1
С1
Вариант №2
С1
Критерии оценивания работы:
Максимальное количество баллов- 34
Оценка «5» - 29-34 баллов Оценка «4» - 21- 28балла
Оценка «3» - 13- 20 баллов Оценка «2» - менее 13 баллов
Описание материально-технического обеспечения образовательного процесса.
Учебно-методический комплект
1. Габриелян О. С., Остроумов И. Г. Химия. 10 кл. Профильный уровень: Методическое пособие. - М.: Дрофа (выйдет в 2006 г.).
2. Габриелян О. С., Лысова Г. Г. Химия. 11 кл. Профильный уровень: Методическое пособие. - М.: Дрофа.
3. Габриелян О. С., Остроумов И. Г. Настольная книга учителя. Химия. 10 кл. - М.: Дрофа, 2004.
4. Габриелян О. С., Лысова Г. Г., Введенская А. Г. Настольная книга учителя. Химия. 11 кл.: В 2 ч. - М.: Дрофа, 2003-2004.
5. Габриелян О. С., Остроумов И. Г. Органическая химия в тестах, задачах, упражнениях. 10 кл. - М.: Дрофа, 2003-2005.
6. Габриелян О. С., Остроумов И. Г. Общая химия в тестах, задачах, упражнениях. 11 кл. - М.: Дрофа, 2003-2005.
7. Химия. 10 кл.: Контрольные и проверочные работы к учебнику О. С. Габриеляна «Химия. 10»/О. С. Габриелян, П. Н. Березкин, А. А. Ушакова и др. - М.: Дрофа, 2003-2006.
8. Химия. 11 к л.: Контрольные и проверочные работы к учебнику О. С. Габриеляна, Г. Г. Лысовой «Химия. 11»/О. С. Габриелян, П. Н. Березкин, А. А. Ушакова и др. - М.: Дрофа, 2004- 2006.
9. Габриелян О. С., Решетов П. В., Остроумов И. Г., Никитюк А. М. Готовимся к единому государственному экзамену. - М.: Дрофа, 2003-2005.
10. Габриелян О. С., Остроумов И. Г. Химия для школьников старших классов и поступающих в вузы: Учеб. пособие. - М.: Дрофа, 2005.
11. Габриелян О. С., Ватлина Л. П. Химический эксперимент в школе. 10 кл. - М.: Дрофа, 2005.
12. Габриелян О. С. Методические рекомендации по использованию учебников О. С. Габриеляна, Ф. Н. Маскаева, С. Ю. Пономарева, В. И. Теренина «Химия. 10» и О. С. Габриеляна, Г. Г. Лысовой «Химия. 11» при изучении химии на базовом и профильном уровне. - М.: Дрофа, 2004- 2005.
Перечень объектов и средств материально-технического обеспечения, необходимых для реализации программы
-
Печатные пособия
1.1. Серия справочных таблиц по химии («Периодическая система химических элементов Д.И. Менделеева», «Растворимость солей, кислот и оснований в воде», «Электрохимический ряд напряжений металлов», «Окраска индикаторов в различных средах»).
1.2. Руководства для лабораторных опытов и практических занятий по химии (8 кл)
1.3. Сборники тестовых заданий для тематического и итогового контроля.
2. Учебно-лабораторное оборудование
2.1. Набор моделей кристаллических решёток: алмаза, графита, поваренной соли, железа.
2.2. Набор для моделирования типов химических реакций (модели-аппликации).
2.3. Коллекции: «Металлы и сплавы», «Минералы и горные породы», «Неметаллы».
3. Учебно-практическое оборудование
3.1. Набор № 1и 2 ОС «Кислоты».
3.2. Набор № 3 ОС «Гидроксиды».
3.3. Набор № 4 ОС «Оксиды металлов».
3.4. Набор № 5 ОС «Металлы».
3.5. Набор № 6 ОС «Щелочные и щелочноземельные металлы».
3.6. Набор № 9 ОС «Галогениды».
3.7. Набор № 10 ОС «Сульфаты. Сульфиты. Сульфиды».
3.8. Набор № 11 ОС «Карбонаты».
3.9. Набор № 12 ОС «Фосфаты. Силикаты».
3.10. Набор № 14 ОС «Соединения марганца».
3.11. Набор № 15 ОС «Соединения хрома».
3.12. Набор № 16 ОС «Нитраты».
3.13. Набор № 17 ОС «Индикаторы».
3.14. Набор посуды и принадлежностей для ученического эксперимента, нагревательные приборы.
4. Информационно-коммуникативные средства
4.1. Мультимедийные программы по всем разделам курса.
4.2. Компьютер и мультимедийный проектор
Оборудование и реактивы для проведения практических работ
10 класс
№
п/п
Тема практической работы, цель работы
Необходимый минимум оборудования и реактивов
Отметка наличия
1
Практическая работа № 1 «Качественный анализ органических соединений»
Цель работы: убедиться в том, что органические вещества - это соединения углерода и водорода
Инструкция: учебник О.С.Габриеляна «Химия 10. Профильный уровень»
стр. 297-299
Оборудование: штатив, спиртовка, 2 пробирки, газоотводная трубка, вата
Реактивы: парафин, порошок оксида меди, безводный сульфат меди, баритовая (известковая) вода, медная проволока, хлороформ.
есть в наличии
2
Практическая работа №2. Получение этилена и изучение его свойств
Цель работы: получить непредельный углеводород - этилен, исследовать его свойства и доказать наличие двойной связи в молекуле
Инструкция: учебник О.С.Габриеляна «Химия 10. Профильный уровень» стр. 299-300
Оборудование: штатив, спиртовка, 3 пробирки, газоотводная трубка,
Реактивы: этиловый спирт, конц. серная кислота, 4-5 г прокаленного песка, бромная вода, разбавленный раствор перманганата калия, разб. Серная кислота
есть в наличии
3
Практическая работа №3. Спирты
Цель работы: исследовать физические и химические свойства одноатомных и многоатомных спиртов.
Инструкция: учебник О.С.Габриеляна «Химия 10. Профильный уровень» стр. 300-301
Оборудование: спиртовка, 5 пробирок, пробиркодержатель, спички
Реактивы: этанол, изоамиловый спирт, вода, глицерин, гидроксид натрия, сульфат меди, дихромат калия
есть в наличии
4
Практическая работа №4. Альдегиды и кетоны.
Цель работы: исследовать свойства альдегидов на примере формалина, получить ацетон и изучить на его примере свойства кетонов.
Инструкция: учебник О.С.Габриеляна «Химия 10. Профильный уровень» стр. 301-302
Оборудование: спиртовка, 5 пробирок, пробиркодержатель, спички, часовое стекло, штатив.
Реактивы: Раствор формалина, аммиачный раствор оксида серебра, бензальдегид, ацетат кальция, концентрированная соляная кислота, вода
есть в наличии
5
Практическая работа №5. Карбоновые кислоты
Цель работы: практически подтвердить свойства органических кислот, закрепить знания о кислотах.
Инструкция: учебник О.С.Габриеляна «Химия 10. Профильный уровень» стр. 302-304
Оборудование: спиртовка, спички, пробиркодержатель, пробирки
Реактивы: уксусная, бензойная, конц. серная кислоты. Этанол, цинк, вода, гидроксид натрия, изоамиловый спирт, индикаторы
есть в наличии
6
Практическая работа №6. Углеводы
Цель работы: исследовать свойства моно- , ди- и полисахаридов, практически подтвердить их свойства.
Инструкция: учебник О.С.Габриеляна «Химия 10. Профильный уровень» стр. 304-305
Оборудование: спиртовка, спички, пробиркодержатель, штатив., пробирки
Реактивы: Раствор глюкозы, сахарозы, крахмал, аммиачный раствор оксида серебра, гидроксид натрия, сульфат меди, серная кислота, спиртовой раствор йода, вода,
есть в наличии
7
Практическая работа №7. Амины. Аминокислоты. Белки
Цель работы: подтвердить практически физические и химические свойства аминов, аминокислот и белков
Инструкция: учебник О.С.Габриеляна «Химия 10. Профильный уровень» стр. 306-307
Оборудование: спиртовка, спички, пробиркодержатель, пробирки.
Реактивы: Анилин, вода, соляная кислота, гидроксид натрия, бромная вода, глицин, порошок оксида меди, раствор белка, сульфат меди, ацетат свинца, конц. азотная кислота, раствор аммиака,.
есть в наличии
8
Практическая работа №8. Идентификация органических веществ.
Цель работы: обобщить и систематизировать знания учащихся о качественных реакциях важнейших классов органических веществ
Инструкция: учебник О.С.Габриеляна «Химия 10. Профильный уровень» стр. 307-308
Оборудование: спиртовка, спички, пробиркодержатель пробирки
Реактивы: Растворы гидроксида натрия, серной кислоты, карбоната натрия, перманганата калия, брома, сульфата меди, аммиачный раствор оксида серебра, вода. Бензойная кислота, анилин, глюкоза, сахароза, формалин, этанол, глицерин, уксусная кислота
есть в наличии
9
Практическая работа №9. Действие ферментов на различные вещества
Цель работы: выяснить механизм действия ферментов на различные вещества
Инструкция: учебник О.С.Габриеляна «Химия 10. Профильный уровень» стр. 308-311
Оборудование: спиртовка, спички, пробиркодержатель пробирки, предметное стекло, стеклянная трубка, резиновая груша, сырое и варёное мясо, сырой и варёный картофель
Реактивы: слюна, крахмал, спиртовой раствор йода, лёд, аптечный формалин, некипячёное молоко, метиленовый синий, подсолнечное масло, перекись водорода,
есть в наличии
10
Практическая работа №10. Анализ лекарственных препаратов
Цель работы: произвести анализ лекарственных препаратов и выяснить, как лекарственное действие связано с особенностями их строения. Инструкция: учебник О.С.Габриеляна «Химия 10. Профильный уровень» стр. 311-313
Оборудование: пробирки, спиртовка, держатель, спички
Реактивы: Упаковки образцов лекарственных препаратов (без содержимого), инструкции по их применению, химический состав. Салициловая кислота, аспирин, салол, этанол, гидроксид натрия, хлорид железа(III), парацетомол, фенацетин, вода, индикатор.
есть в наличии
11 класс
№
п/п
Тема практической работы, цель работы
Необходимый минимум оборудования и реактивов
Отметка наличия
1
Практическая работа №1
Распознавание пластмасс и волокон.
Инструкция: учебник О.С.Габриеляна «Химия 10. Профильный уровень»
стр. 297-299
Цель:
Научиться определять экспериментально заданные пластмассы и ткани, соблюдая правила ОТ и ТБ
ПР 8, с. 406.
Фенопласт, целлулоид, полиэтилен, капрон, ПВХ, полистирол, полиметилметакрилат, вискоза, шерсть, нитрон, лавсан, хлорин, капрон, шерсть, спиртовка, спички
есть в наличии
2
Практическая работа №2
Скорость химических реакций
Цель: экспериментально убедиться во влиянии температуры природы реагирующих веществ, катализатора, поверхности соприкосновения на скорость химических реакций и смещение химического равновесия.
ПР №2
Иодид калия пероксид водорода, крахмальный клейстер, р-р йода, сульфат меди, оксид азота, железо - порошок и стружка, хлорид меди, цинк, хлорид железа, хлорид калия , роданид калия, штатив с пробирками, спиртовка, спички, держатель, лучинка.
есть в наличии
3
Практическая работа №3 «Решение экспериментальных задач по теме «Гидролиз»
Цель: закрепить умение подтверждать теоретические знания химическим экспериментом.
ПР №4
Растворы хлорида алюминия, сульфида натрия, хлорида железа 3 , соляной кислоты; порошок цинка, желудочный сок, грушевая эссенция, 2 стеклянные трубки со свёрнутым белком, фенолфталеин, конц. щёлочь, колба, водяная баня.
есть в наличии
4
Практическая работа №4 Получение, собирание и распознавание газов и изучение их свойств.
Цель работы: выяснить способы получения водорода, кислорода, углекислого газа в лаборатории, изучить способы собирания и распознавания этих газов
ПР №1
Штатив, пробирки, газоотводная трубка, химический стакан, стекловата, спиртовка (или электронагреватель), цилиндр, стеклянная пластинка, кристаллизатор, перманганат калия, стеклянная воронка, гранулы цинка, разбавленная соляная кислота, оксид меди карбонат кальция (мел), соляная кислота,
кристаллический хлорид аммония, р-р гидроксида натрия.
есть в наличии
5
Практическая работа №5 Сравнение свойств неорганических и органических соединений
Цель: закрепить умение подтверждать теоретические знания химическим экспериментом.
ПР №3
Штатив, пробирки, изоамиловый спирт, уксусная и серная кислоты конц., водяная баня, пробирка с холодной водой или насыщенный раствор поваренной соли, делительная воронка, фарфоровая чашка, борная кислота ( кристалл.) , этиловый спирт, стеклянная палочка, лучинка, нитрат цинка, гидроксид натрия, соляная кислота, карбонат натрия, глицин, спиртовка, пробиркодержатель, стекло, нитрат и ацетат свинца, иодид калия.
есть в наличии
6
Практическая работа №6 Решение экспериментальных задач по неорганической химии.
Цель работы: научиться опытным путём доказывать химический состав вещества, распознавать предложенные вещества при помощи качественных реакций
ПР №5
Штатив, пробирки, химический стакан, индикаторы. Кристаллогидрат сульфата меди (II), карбонат магния, карбонат кальция, гидроксид натрия, железо, разб. соляная кислота, хлорид железа (III), сульфат аммония, нитрат меди (II), нитрат серебра, сульфат натрия, хлорид бария, сульфат алюминия, разб. серная и азотная кислоты.
есть в наличии
7
Практическая работа №7. Решение экспериментальных задач по органической химии
Цель работы: научиться опытным путём доказывать химический состав вещества, распознавать предложенные вещества при помощи качественных реакций
ПР №6
Шесть пробирок с р-ры веществ (для определения): этанол, уксусная кислота, глюкоза, глицерин, этаналь, крахмал. Спиртовка, штатив, держатель, р-ры гидроксида меди (II), гидроксида натрия, серная кислота (разб.), водные р-ры карбоната натрия, перманганата калия, сульфата меди, бромная вода, аммиачный раствор оксида
серебра, индикаторы, раствор иода в спирте.
есть в наличии
8
Практическая работа №8 Генетическая связь между классами неорганических и органических веществ
Цель работы: научиться экспериментально осуществлять превращения веществ согласно схеме, проводить наблюдения, делать выводы.
ПР №7
Штатив, спиртовка, пробирки, держатель, химический стакан, гранулы железа, соляная кислота (разб.), р-р гидроксида натрия, фарфоровая чашка, фильтр, индикатор.
Гранулы алюминия, наждачная бумага, серная кислота(разб.), гидроксид натрия, индикаторы.
Штатив, пробирки, газоотводная трубка, химический стакан, спиртовка, нагреватель, 2-3 мл этилового спирта, 6-9 мл конц. серной кислоты, 4-5 г прокаленного песка, бромная вода, разбавленный раствор перманганата калия, разб. серная кислота. Вариант (на выбор учителя) - осуществление практических превращений по цепочке: этанол → этаналь → уксусная кислота → сложный эфир.
есть в наличии
Необходимое обеспечение для проведения практических работ есть в наличии.


