- Преподавателю
- Химия
- Конспект урока по химии на тему Кислород, его общая характеристика и нахождение в природе. Получение кислорода и его физические свойства
Конспект урока по химии на тему Кислород, его общая характеристика и нахождение в природе. Получение кислорода и его физические свойства
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Конспекты |
| Автор | Фурсова А.И. |
| Дата | 14.09.2015 |
| Формат | docx |
| Изображения | Есть |
8 класс
Урок по химии
По здоровьесберегающей технологии
тема «Кислород, его общая характеристика и нахождение в природе. Получение кислорода и его физические свойства».
Аксиологический аспект: акцентирование внимания на необходимости кислорода для жизнедеятельности всех организмов на планете Земле.
Гносеологический аспект: осознать информацию о важности кислорода для активной работы мозга.
Здоровьесберегающий аспект: описан в ситуационных заданиях.
Эмоционально-волевой аспект: учащийся находятся в напряженном интересе, т.к. урок основан на вопросах учителя и ответах ученика.
Физкультурно-оздоровительный аспект: положительные стороны от зарядки
План конспекта.
-
Актуализация опорных знаний. Мотивация учебной деятельности.
-
Объяснение нового материала
-
Лабораторный опыт (техника безопасности)
-
Закрепление материала
-
Рефлексия.
Цель: Познакомить учащихся с кислородом простым вещество и химическим элементом, его распространением, открытием кислорода, физическими свойствами, способами получения, научить применять на практике знания по технике безопасности при получении газов.
Задачи:
Предметные: приобретать навыки получения кислорода лабораторным способом; совершенствовать написание уравнений химических реакций и расстановки коэффициентов; использовать таблицу им. Д. И. Менделеева для характеристики элемента по положению в периодической системе;
Метапредметные: стимулировать развитие у обучающихся способности анализировать; повышать их информационную компетентность; развивать познавательные способности, мышление, внимание, а также умения использовать изученный материал для познания нового; познакомить обучающихся с теорией Флогистона; узнать историю открытия кислорода; определить значимость кислорода в физиологических процессах.
Личностные: воспитывать у обучающихся как самостоятельность, так и способность сотрудничать, работать в команде; акцентировать внимание на нравственных качествах - взаимовыручке, адекватной самооценке; актуализировать необходимость охраны природы, показав взаимосвязь человека с окружающей средой.
Оборудование: лабораторное оборудование: спиртовка, спички, пробирка с газоотводной трубкой, лучинка, колба, лабораторный штатив, химический стакан, вата, периодическая таблица.
реактивы: перманганат калия.
Тип урока: урок изучения нового материала.
ХОД УРОКА:
План занятия: (записан на доске, перед уроком.)
1.Открытие кислорода.
2.Нахождение кислорода в природе.
3.Общая характеристика элемента кислорода.
4.Получение кислорода.
5.Физические свойства кислорода.
1 этап
ОТКРЫТИЕ КИСЛОРОДА. В результате
Изначально считалось, что во все вещества входит флогистон. Учитель поджигает спичку, а потом бумагу. И именно флогистон загорается при внесении огня. Это и объясняет теория флогистона. Но благодаря двум ученым, Джозефу Пристли и Антуану Лавуазье эта теория была опровергнута. Дж. Пристли, в 1775 году путем разложения вещества на два составляющих, одно из которых красного цвета, содержится в градусниках в виде красных гранул, а другое - мы сегодня будем исследовать. О каком веществе идет речь? (кислород). Получил кислород, сам того не зная. А А. Лавуазье назвал новое простое вещество, полученное другом, оксигеном. Но Карл Шееле еще в 1771 году, прокаливая селитру с серной кислотой и затем, разлагал получившийся оксид азота, получил кислород, назвав его огненным газом. К сожалению, эти данные были опубликованы в 1777 году, и все лавры достались не ему, а именно Пристли и Лавуазье.
Тема урока, записана на доске. Учащиеся записывают в тетради.
Учитель раздает листы А4, на которых учащийся будут писать опорный конспект. В конце урока будет проведена проверка конспекта. Высший бал получат те, кто использовал как можно меньше слов и как можно больше условных обозначений.
2 этап
НАХОЖДЕНИЕ КИСЛОРОДА В ПРИРОДЕ.
Учитель акцентирует внимание учеников на распространении кислорода в природе. Заставляет задуматься о важности кислорода для всего живого, задавая наводящие вопросы (почему нам так необходим кислород? Где мы можем его встретить?).
Кислород самый распространённый химический элемент на нашей планете, его массовая доля составляет 49%. Он содержится в воде, углекислом газе, кремнезёме, в органических веществах: белках, жирах, углеводах, нуклеиновых кислотах и многих других. Простое вещество кислород содержится в воздухе и составляет 21% от объёма воздуха. Он необходим для дыхания всем живым организмам.
Учитель выделает 1 минуту для самостоятельной записи полученной информации в опорные конспекты.
После записи учащиеся вместе с учителем делают зарядку на месте.
3 этап
ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТА КИСЛОРОДА..
Преподаватель предлагает открыть учебник с таблицей Д.И. Менделеева на форзаце и дать характеристику кислорода по данным из таблицы. На вопрос учителя «Какую информацию можно получить с таблицы Менделеева?» обучающиеся составляют план-характеристику (Порядковый номер, номер периода, номер группы, относительная атомная масса, валентность, степень окисления, водородное соединение). Похвалить за проделанную работу. Дать 1 минуту для записи новой информации в опорный конспект.
4 этап
ПОЛУЧЕНИЕ КИСЛОРОДА.
Учитель напоминает о технике безопасности, после чего наглядно показывает эксперимент, который является одним из способов лабораторного получения кислорода, с перманганатом калия, вследствие которого выделяется кислород Уравнения реакции записаны на доске. Ученики расставляют коэффициенты. (Есть еще один способ получения кислорода в лаборатории - с помощью перманганата калия. Этот способ мы проведем сейчас с Вами. Для этого нам необходимо нагреть перманганат калия (KMnO4), к пробирке с необходимым веществом подвести газоотводную трубку, которая заканчивается в колбе. При нагревание происходит распад перманганата калия, с выделением кислорода. В колбу с кислородом подносим тлеющую лучинку, которая вспыхивает ). Учитель спрашивает, как можно еще получить кислород
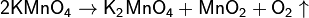
Далее учитель раздает каждому ученику карточки с химическими реакциями получения кислорода, где ученикам необходимо дописать уравнения и расставить коэффициенты, и определить тип реакции? (реакции разложения)
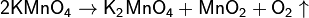
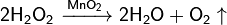
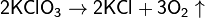
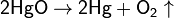

В промышленности кислород получают из воздуха, который представляет собой смесь газов (азота и кислорода).
После проверки расстановки коэффициентов и правильности написания учитель дает 2 минуты для самостоятельной записи способов получения кислорода. Хвалит учеников за проделанный труд. После записи полученной информации учитель предлагает ученикам сделать гимнастику для глаз.
5 этап
ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА.
Учитель задает наводящие вопросы о физических свойствах кислорода, а именно: Какой и кислорода вкус? Запах? Какое агрегатное состояние имеет кислород в нормальных условиях? Какого цвета кислород? Почему шарики надувают гелием, а не кислородом? Кислород тяжелее воздуха? Кислород может перейти в твердое состояние? Как тогда он выглядит? (синие кристаллы, температура плавления -217,35С). Как же выглядит жидкий кислород? Его часто используют в фильмах (бледно-голубая жидкость, температура кипения -182С). Необходимую информацию ученики записывают в опорный конспект.
Наблюдения записывают в тетрадь.
-бесцветный газ, без вкуса и запаха.
-масса кислорода составляет 32а.е.м., а воздух - 29 а.е.м.
-малорастворимый в воде (в 100 объёмах воды при температуре 20 С растворяется 3,5 объёма кислорода, с понижением температуры растворимость кислорода в воде возрастает)
-t кипения = -183 С, t плавления = -218,8 С.
Урок заканчивается рефлексией, в ходе которой обучающим представляются ситуационными задачами:
Ситуация №1.
Класс не проветривался в течении 6 уроков. Спустя вышесказанное время у учеников упала работоспособность в сравнении с 1 и 2 уроками. Некоторые жаловались на головную боль и недомогание. С чем это связано. найдите возможные причины сложившиеся ситуации.
Ситуация №2.
Вова дома решил провести опыт. Он взял гранулы цинка и соляную кислоту. Получившиеся газ собрал в пустую жестяную банку ,к которой поднес лучинку. Раздался … Допишите уравнение реакции, которые произошли у Вовы. Какие правила были нарушены?
Ситуация №3.
Катя играла во дворе в футбол. В ходе последних минут игры она упала, поранив ногу. По приходу домой девочка взяла перекись водорода и обработала ранку. Зачем она это сделала, что произошло в ходе этой процедуры? Напишите уравнение химической реакции.
Ситуация №4.
В подводных лодках, в специальных контейнерах находится вещество, (пероксид натрия) которое решает две проблемы. Но в связи с халатностью работников пероксид натрия заменили на оксид. Подводники чувствовали недомогание. С чем это связано? Напишите уравнение реакции.
Учитель предлагает показать опорные конспекты, выборочно опрашивает учеников по ним. Учитель показывает свой опорный конспект. Выставляет оценки; задает домашнее задание; желает успешного рабочего дня.
Ситуация №1.
Класс не проветривался в течении 6 уроков. Спустя вышесказанное время у учеников упала работоспособность в сравнении с 1 и 2 уроками. Некоторые жаловались на головную боль и недомогание. С чем это связано. найдите возможные причины сложившиеся ситуации.
ОТВЕТ: исходя из того, что класс не проветривался в течении 6 уроков, не было притока кислорода, углекислый газ, выдыхаемый учениками накапливался в течении всего учебного процесса. В связи с этим у учеников понизилась работоспособность. Недостаток кислорода и избыток углекислого газа стали причиной головной боли учащихся.
Ситуация №2.
Вова дома решил провести опыт. Он взял гранулы цинка и соляную кислоту. Получившиеся газ собрал в пустую жестяную банку, к которой поднес лучинку. Раздался …. Допишите уравнение реакции, которые произошли у вовы. Какие правила были нарушены?
ОТВЕТ: раздался взрыв. Это связано с выделением водорода, который был собран Вовой в емкость, и поднесения к нему огня. Первое: Вова нарушил правила техники безопасности. Второе: эксперименты необходимо проводить исключительно в лаборатории и с обязательным присутствием специалиста.
Ситуация №3.
Катя играла во дворе в футбол. В ходе последних минут игры она упала, поранив ногу. По приходу домой девочка взяла перекись водорода и обработала ранку. Зачем она это сделала, что произошло в ходе этой процедуры? Напишите уравнение химической реакции.
ОТВЕТ: Данная процедура необходима для обеззараживания нарушения атомической целостности покровных тканей. В ходе данной процедуры перекись водорода, под действием фермента (каталазы) разложилась до воды и кислорода.
Ситуация №4.
В подводных лодках, в специальных контейнерах находится вещество, (пероксид натрия) которое решает две проблемы. Но в связи с халатностью работников пероксид натрия заменили на оксид. Подводники чувствовали недомогание. С чем это связано? Напишите уравнение реакции.
ОТВЕТ: Пероксид натрия - универсальное вещество. Оно решает сразу две проблемы, а именно: связывание углекислого газа и выделение кислорода. Но так как пероксид натрия был заменен другим веществом, углекислый газ связывался, но кислород не выделялся. Поэтому подводники чествовали себя неудовлетворительно.


