- Преподавателю
- Химия
- Модуль по теме Карбоновые кислоты, профильный уровень
Модуль по теме Карбоновые кислоты, профильный уровень
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Пуляева Е.И. |
| Дата | 19.04.2015 |
| Формат | doc |
| Изображения | Есть |
Учитель высшей категории МБОУ «Прохоровская гимназия» Пуляева Елена Ивановна
Модуль "Карбоновые кислоты" /7 часов/
Отдельные элементы модуля "Карбоновые кислоты" могут быть использованы в базовом курсе изучения темы.
В содержание модуля входят следующие элементы:
-
М-1 - Классификация. Строение молекул. Зависимость физических свойств от электронного строения.
-
М-2 -Номенклатура карбоновых кислот. Гомология и изомерия предельных одноосновных карбоновых кислот.
-
М-3 - Химические свойства карбоновых кислот.
-
М-4 - Получение и применение карбоновых кислот.
-
М-5 - Практическое занятие "Получение карбоновых кислот и изучение их свойств".
-
М-6 - Урок-резюме, подготовка к контрольной работе.
-
М-7 - Контрольная работа.
Цель модуля: продолжить формирование системы знаний о классах органических соединений - карбоновых кислот: усвоить определение, общую формулу, гомологический ряд, номенклатуру, изомерию, электронное строение карбоксильной группы, получение.
- продолжить формирование следующих умений: давать определение, применять общую формулу, составлять структурные формулы и называть гомологи и изомеры, составлять генетическую цепочку получения карбоновых кислот;
- научить на основании знаний о строении молекул карбоновых кислот прогнозировать и сравнивать их химические свойства;
- научить записывать уравнения химических реакций (указывать условия), называть продукты по М.Н., составлять и осуществлять генетическую цепочку.
М-1. Классификация. Строение молекул. Зависимость физических свойств от электронного строения.
Номер УЭ
Учебный материал
Руководство по усвоению учебного материала
УЭ-0
Интегрирующая цель:
-
сформулировать определение,
-
вывести общую формулу,
-
изучить классификацию,
-
определить закономерности, вытекающие из электронного строения.
УЭ-1
ЦеЦель: дайте название темы урока, выведите общую формулу класса соединений, с которым мы сегодня знакомимся, и сформулируйте его определение.
Выполните задания:
Задание №1 Используя подсказки, расположенные у вас на столах, дайте название темы урока.
Подсказки:
-
Вещества данного класса, кислые на вкус, - последнее звено в цепи:



Спирт → Альдегид → ?
-
Вещества данного класса относятся к группе кислородосодержащих соединений и придают многим продуктам питания кислых вкус.
-
Вещества данного класса - продукты реакции окисления соответствующих альдегидов - известны человечеству с незапамятных времен и обуславливают кислый вкус многих плодов и ягод.
Работайте в группах.
Задание оценивается в 1 балл
Задание №2 Рассмотрите формулы отдельных представителей данного класса:
HCOOH COOH
H
 OOC - COOH
OOC - COOH
H2C = CH - COOH
Группа
Задание
I
-
Выделите функциональную группу, содержащуюся во всех указанных выше соединениях
-
Укажите частицу, с которой соединена эта группа
-
Определите название класса органических соединений
II
-
Определите общие черты строения молекул вышеуказанных соединений
-
Укажите отличительные особенности состава указанных выше соединений
-
Назовите частицу, определяющую название класса
-
Определите класс изучаемых веществ
III
-
Исследуйте состав вышеуказанных соединений
-
Определите название класса рассматриваемых соединений
-
Выведите общую формулу данного класса органических соединений
-
Сформулируйте определение данного класса органических соединений
Работайте в группах.
Сделайте необходимые записи в тетради
Задание оценивается в 2 балла
Задание №3 Выберите вещества, относящихся к данному классу орг. соединений, из следующего перечня:
CH3-CH2-OH, CH3-CH=CH- COOH, HCOOH, CH3 -COH, HOOC - COOH, CH3-CH=CH - CH2-OH.
Задание оценивается в 2 балла
Оцените результаты своей работы
Максимальная оценка - 5 баллов
УЭ-2
Цель: освоить навыки классификации карбоновых кислот по разным признакам.
Задание №1
Группа
Задание
I
-
Вспомните классификацию углеводородов
-
Разделите вещества на 3 группы, схожие по составу
-
Определите признак, который вы положили в основу классификации
CH3 - CH2 - COOH, CH3 - (CH2)7 - CH = CH - (CH2)7 - COOH,
CH2 = CH - COOH, H3C - CH - COOH, COOH
 ׀ ׀
׀ ׀
CH3
II
-
Разделите вещества на 3 группы, схожие по составу
-
Определите признак, который вы положили в основу классификации
-
Вспомните понятие «основности» из классификации неорганических кислот
HCOOH, H3C - COOH, HOOC - COOH, HOOC - CH2 - COOH,
HOOC - CH2 - CH - CH2 - COOH, CH3 - CH - COOH
׀ ׀
COOH CH3
III
-
Предложите классификацию карбоновых кислот по двум основным признакам.
-
Дайте названия каждой получившейся группе кислот.
-
Объясните понятие «высшие» и «низшие» карбоновые кислоты
CH2 = CH - COOH HOOC - CH2 - CH2 - COOH
HCOOH CH3 - (CH2)14 - COOH
COOH CH3COOH
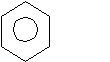 ׀
׀
 CH3 CH3 - CH2 - COOH CH3 - CH - COOH
CH3 CH3 - CH2 - COOH CH3 - CH - COOH
׀ ׀
CH3
HOOC - CH - CH2 - COOH
׀
OH
Работайте в группах устно.
Задание оценивается в 3 балла
Обсудите результаты работы, работайте вместе с классом
Задание №2. Составьте схему: «Классификация карбоновых кислот»
Запишите схему в тетрадь
Задание оценивается в 4 балла
Задание №3. Дайте полную классификацию, соответствующую янтарной кислоте:
HOOC - CH2 - CH2 - COOH
Работайте индивидуально.
Задание оценивается в 3 балла
Оцените результаты своей работы
Максимальная оценка - 10 баллов
УЭ-3
Цель: изучить физические свойства карбоновых кислот. Обосновать взаимозависимость между составом, строением кислоты и ее физическими свойствами.
Лабора Задание №1 Лабораторная работа: «Изучение физических свойств карбоновых кислот»
Группа
Задание
I
-
Сравните агрегатное состояние при н. у. кислот:
Уксусная, валерьяновая, стеариновая
-
Определите наличие запаха у каждого вещества
Вспомните, как правильно определять запах!
-
Сделайте вывод о взаимосвязи строения и изученных физических свойствах карбоновых кислот, дополнив фразы:
Агрегатное состояние низших карбоновых кислот __________________;
Агрегатное состояние высших карбоновых кислот __________________
Чем больше относительная молекулярная масса кислоты, тем _____________________ запах
II
-
Сравните растворимость в воде кислот:
Уксусная, валерьяновая, стеариновая
Вспомните, как правильно обращаться с растворами кислот!
-
Сделайте вывод о взаимосвязи относительной молекулярной массы и растворимости карбоновых кислот
С увеличением относительной молекулярной массы кислоты растворимость _____________
III
-
Определите экспериментальным путем температуры кипения следующих кислот: муравьиная, уксусная, пропионовая
Вспомните, как правильно проводить нагревание жидкости!
-
Сформулируйте вывод о взаимосвязи относительной молекулярной массы кислот и их температуры кипения
-
Проанализируйте данные таблицы
-
Сформулируйте вывод о взаимосвязи структуры молекулы и температуры кипения карбоновых кислот
Чем больше относительная масса кислоты, тем _______температура кипения
Температура кипения кислот с нормальным строением углеродного радикала, _______чем температура кипения кислот изомерного строения.
Та Таблица
Температуры кипения некоторых предельных одноосновных карбоновых кислот
Кислота
Формула
t кип, 0С
Масляная (бутановая)
C3H7COOH
163,5
Изомасляная
(2 - метилпропановая)
CH3 - CH - COOH
CH3
154,5
Валерьяновая (пентановая)
C4H9COOH
187
Изовалерьяновая
(3 - метилбутановая)
CH3 - CH - CH2 - COOH
CH3
176,7
Триметилуксусная
(2,2 - диметилпропановая)
CH3
CH3 - C - COOH
CH3
163,8
Задание 2. Прочитайте по учебнику текст о строении функциональной группы карбоновых кислот. Назовите ее составные части.
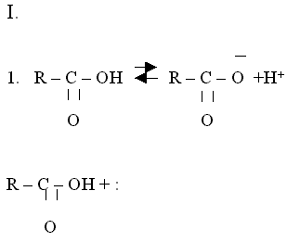
Рассмотрите электронное строение карбоксильной группы
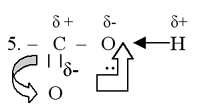
Полярная группа карбоксил содержит:
1) группу С=О, в которой атом С оттягивает на себя e связи С - О;
2) группу - О - Н , в которой неподеленная пара 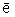 атома О взаимодействует с
атома О взаимодействует с 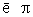 - связями группы С = О.
- связями группы С = О.
Вывод:
а) увеличивается полярность связи группы О - Н, это приводит ______________;
б) уменьшается + заряд на атоме С группы С = О, не характерны реакции _____________.
Работайте в группах.
Обсудите результаты работы вместе с классом.
Задание оценивается в 4 балла
Работайте самостоятельно с учебником - стр. 183- 184
Задание оценивается в 2 балла
Проб Ученые, путем незамысловатых действий, пришли к выводу, что лимонный сок обладает большей кислотностью, чем томатный, а кислотность томатного выше, чем пота и мочи. Как определить кислотность, и от чего она зависит?
Задание №3 Изучите текст и расположите формулы предложенных кислот в порядке усиления их кислотных свойств.
1. При введении в молекулу более ЭО элемента, электронная плотность переходит к нему, оттягивая за собой электронную плотность от атома О атом водорода становится более подвижным сила кислоты увеличивается.
-
Чем больше карбоксильных групп, тем сильнее кислота.
-
Чем больше R, тем меньше сила кислоты, т. к., электронная плотность теряется по молекуле.
НООС - СН - СН2 - СООН яблочная
ОН
СООН
ОСОСН3 - ацетилсалициловая
Н3С - СООН - уксусная
НСООН - муравьиная
Внимательно прочитайте предложенный текст.
Работайте индивидуально.
Задание оценивается в 4 балла
Оцените результаты своей работы
Максимальная оценка - 10 баллов
УЭ-4
Цель: подведите итоги урока
Ещё раз прочитайте цель урока
индивидуально
Достигли ли вы цели урока? В какой степени?
Вместе с классом
Оцените работу на уроке. Если по итогам урока вы набрали:
23-25 баллов, то получаете оценку «5», если 22-18 баллов- «4», если 17-12 баллов - «3», менее 12- «2»
Ваша оценка за урок ____
Домашнее задание: если за работу на уроке вы получили «5», то вы освобождаетесь от д/з.
Если испытали затруднения, допустили несколько ошибок, поработайте с учебником с 180-185 и выполните упр. 8 стр 194
Если вы допустили много ошибок, проработайте модуль ещё раз, а также поработайте с учебником с 180-185 и выполните упр. 8 стр 194
М-2 -Номенклатура карбоновых кислот. Гомология и изомерия предельных одноосновных карбоновых кислот.
Номер УЭ
Учебный материал
Руководство по усвоению учебного материала
УЭ-0
Интегрирующая цель: познакомиться с особенностями номенклатуры и основными видами изомерии одноосновных карбоновых кислот
УЭ-1
ЦеЦель: проверить уровень усвоения материала предыдущего урока
Выберите правильный вариант ответа:
1. Одноосновные карбоновые кислоты имеет общую формулу а) R-COH б) R-COOH в) R-OH г) R-CO-R
2. Укажите в списке формулы карбоновых кислот:
а ) H3C - CH2 - OH, б) H3C - CH = CH - COOH, в) H2N
) H3C - CH2 - OH, б) H3C - CH = CH - COOH, в) H2N
г) HCOOH, д) H3C - CH - CH3, е) H3C - COH
׀
COOH
3. Этановая кислота является: а) предельной двухосновной б) непредельной двухосновной в) предельной одноосновной г) непредельной одноосновной.
4.Водородная связь образуется между молекулами: а) альдегидов б) сложных эфиров в) карбоновых кислот г) простых эфиров.
5. Какая из четырёх кислот, формулы которых приведены ниже, наиболее сильная? а) CCl3-COOH б) CH3-COOH в) CH2Cl-COOH г) CH3- CH2 - COOH
Работайте индивидуально.
Оцените результаты работы по ключу к тесту
Максимальная оценка-5 баллов
УЭ-2
Цель: Познакомиться с принципами международной номенклатуры ИЮПАК и тривиальными названиями карбоновых кислот и научиться давать названия кислотам и составлять формулы по названиям.
Для органических кислот более часто употребляются тривиальные названия. Поскольку многие из этих соединений известны очень давно, то эти термины указывают скорее на источник выделения, чем на химическую структуру кислот. Например, жжение при укусе муравья вызывается муравьиной кислотой (от латинского formica - муравей); уксусная кислота впервые выделена из уксуса, образующегося при скисании вина; масляная кислота сообщает прогорклому маслу его типичный запах; капроновая кислота входит в состав козьего жира (от латинского caper- коза).
Но нельзя забывать про международную номенклатуру ИЮПАК. В основе названия кислот лежат те же принципы, что и при номенклатуре изученных ранее органических соединений.
Группа
Задание №1
I
-
Опишите алгоритм международной номенклатуры карбоновых кислот, дополнив схему последовательности действий:
-
Нумеруем _______________, начиная с атома углерода ___________________ группы
5 4 3 2 1 О
4 3 2 1 О
С - С - С - С - С
ОН
-
Если есть в молекуле функциональная группа, то указываем ее ____________________ и ____________________
 5 4 3 2 1 О
5 4 3 2 1 О
С - С - С - С - С 3 - ФГ….
׀ ОН
ФГ
-
Даем название _______________ по числу атомов __________ в ____________, добавляем суффикс _______ и слово ___________

3 - ФГ алкановая кислота
-
Дайте название по международной номенклатуре молочной кислоте:
СH3 - CH - COOH
׀
OH
-
Молочная кислота находится в квашеной капусте, созревшем сыре, маринованных огурцах, поте человека. Впервые была выведена Шееле в 1780 г из кислого молока, что и дало ей такое название!
-
Группа - ОН в номенклатуре обозначается «окси»
II
-
Опишите алгоритм международной номенклатуры карбоновых кислот, исходя из схемы последовательности действий:
 5 4 3 2 1 О
5 4 3 2 1 О
С - С - С - С - С
ОН
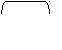

Алкан → алкановая кислота
 5 4 3 2 1 О
5 4 3 2 1 О
С - С - С - С - С
׀ ОН
ФГ
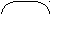
3 - ФГалкановая кислота
 5 4 3 2 1 О
5 4 3 2 1 О
С = С - С - С - С
ОН
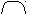
Алкен - 4 - овая кислота
-
Дайте название по международной номенклатуре акриловой кислоте: H2C = CH - COOH
-
Акриловая кислота необходима для получения важнейших полимеров: Художественной пластмассы, оргстекла, синтетического волокна!
III
По одной из древнегреческих легенд, Аполлон, Бог Солнца, разрешил своему сыну Фаэтону править солнечной колесницей. Фаэтон слишком близко подлетел к Земле и на ней запылали пожары, почернели люди Эфиопии, образовались пустыни. Тогда, по просьбе Богини Земли - Геи - Зевс своей молнией сбросил Фаэтона в одну из оставшихся рек, и пожары прекратились. Мать и сестры, оплакивая погибшего, превратились в тополя, с ветвей которых продолжали капать слезы. Слезы твердели и становились янтарем. Янтарная кислота содержится в недозрелых фруктах и буром угле.
-
Изучите состав молекулы янтарной кислоты:
HOOC - CH2 - CH2 - COOH
-
Сопоставьте международное название кислоты с ее составом и строением:
1, 4 - бутандиовая кислота
-
Яблочная кислота находится в яблоках, недозревшей рябине, ягодах барбариса и виноградном соке. Впервые была выведена Шееле в 1785 г из сока яблок!
-
Изучите состав молекулы яблочной кислоты:
НООС - CH - CH2 - COOH
׀
OH
-
Сопоставьте международное название кислоты с ее составом и строением:
2 - окси - 1,3 - пропандиовая кислота
-
Составьте алгоритм номенклатуры ИЮПАК для карбоновых кислот
-
Дайте название по международной номенклатуре лимонной кислоте:
OH
׀
HOOC - CH2 - C - CH2 - COOH
׀
COOH
Лимонная кислота содержится в лимонах, землянике, смородине, ананасах, а так же молоке и крови. Осенью китайский лимонник - пятнадцатиметровая лиана - покрывается кистями целебных мелких плодов с лимонным привкусом. Они повышают общий тонус организма. Впервые лимонная кислота была получена из сока незрелых лимонов шведским аптекарем Шееле в 1784г
Изучив текст учебника на стр.181-183, выполните задание №1.
Работайте в группах
Задание оценивается в
5 баллов
Задание 3 . Дайте систематические название следующим кислотам:
А) H3C - CH - CH3, В) HOOC - CH2 - COOH Д) H2C = CH - COOH
׀
COOH
Б) CH3 - CH - CH2 - COOH Г) CH3 - CH2 - CH - CH2 - COOH,
CH3׀
OH
Работайте индивидуально.
Задание оценивается в
5 баллов
Задание 4. Напишите формулы следующих кислот:
а) дихлорэтановой, б) 3-нитробензойной, в) 2,2-диметилпропановой, г) бутандиовой, д) 2-аминопропановой
Работайте индивидуально.
Задание оценивается в
5 баллов
Обсудите результаты своей работы
Работайте вместе с классом
Оцените результаты своей работы
Максимальная оценка - 15 баллов
УЭ-3
Цель: познакомиться с гомологическим рядом и видами изомерии карбоновых кислот; научиться составлять формулы изомеров и давать им названия.
Вспомните, какие вещества называют гомологами.
Задание №1. Заполните пропуски в таблице, дайте название по международной номенклатуре пяти гомологам муравьиной кислоты
Формула
Тривиальное название
Международное название
Название радикала
НСООН
Муравьиная
Метановая
Формиат
СН3СООН
Уксусная
?
Ацетат
СН3СН2СООН
Пропионовая
?
Пропионат
СН3(СН2)2СООН
Масляная
?
Бутират
СН3(СН2)3СООН
Валериановая
?
Валерат
СН3(СН2)4СООН
Капроновая
?
Капрат
Виды изомерии карбоновых кислот
-
углеродного скелета;
-
межклассовая изомерия (со сложными эфирами RCOOR1)
Задание оценивается в 5 баллов
Запишите схему в тетрадь
Задание 2. Для вещества состава C5H10O2 постройте 2 гомолога и 5 изомеров. Назовите вещества.
Предположите, какие ещё классы органических веществ могут быть изомерны карбоновым кислотам?
Работайте в парах.
Задание оценивается в
15 баллов
Задание 3. Среди нижеприведенных пар кислот выберите пары кислот, являющихся изомерами:
А) бутановая и 2- метилпропановая, б) пропановая и пропеновая в) пентановая и 2-метилбутановая, г) олеиновая и проненовая, д) бутановая и 2,2- диметилпропановая
Работайте индивидуально.
Задание оценивается в
5 баллов
Обсудите результаты своей работы
Работайте вместе с классом
Оцените результаты своей работы
Максимальная оценка - 20 баллов
УЭ-4
Цель: подведите итоги урока
Ещё раз прочитайте цель урока
индивидуально
Достигли ли вы цели урока? В какой степени?
Вместе с классом
Оцените работу на уроке. Если по итогам урока вы набрали:
36-40 баллов, то получаете оценку «5», если -35-28 - баллов- «4», если 27-20баллов - «3», менее 20- «2»
Ваша оценка за урок ____
Домашнее задание: Выучить тривиальные названия шести первых карбоновых кислот.
Повторить химические свойства неорганических кислот (8 кл).
Если за работу на уроке вы получили «5», то вы выполняете любое упражнение из трёх по выбору
Если испытали затруднения, допустили несколько ошибок, поработайте с учебником с 180-184 и выполните два упражнения по выбору
Если вы допустили много ошибок, проработайте модуль ещё раз, а также поработайте с учебником с 180-185 и выполните три упражнения № 1,16,17
М-3 Химические свойства карбоновых кислот.
Номер УЭ
Учебный материал
Руководство по усвоению учебного материала
УЭ-0
Интегрирующая цель: Сформировать понятие о свойствах карбоновых кислот, об особых свойствах отдельных карбоновых кислот.
УЭ-1
ЦеЦель: проверить уровень усвоения материала предыдущего урока
Выполните задание:
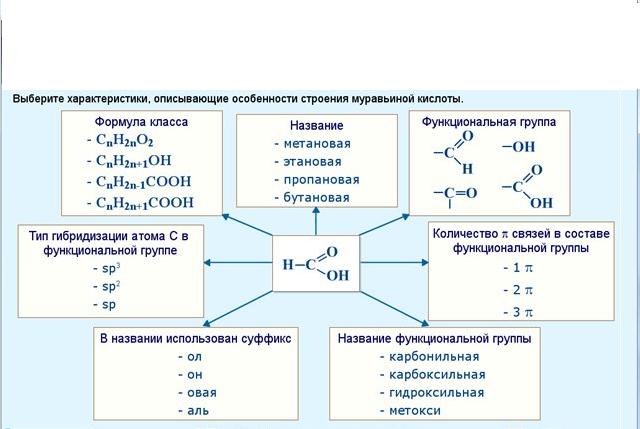
Обведите правильные ответы
Работайте индивидуально.
Задание оценивается в 7 баллов
-
Составьте формулы следующих кислот: а) 3,4 - диметилгексановой кислоты б) 2,2,3 - триметилбутановой кислоты в) этандиовой кислоты
Работайте индивидуально
Задание оценивается в 3 балла
Оцените результаты работы
Максимальная оценка-10 баллов
УЭ-2
Цель: Изучить химические свойства карбоновых кислот.
Проблема: некоторые лекарственные препараты нельзя запивать целым рядом напитков, в том числе кислые фрукты и соки, маринады, блюда с уксусом нельзя употреблять в пищу наряду с антибиотиками пенициллинового ряда и эритромицином. Как вы думаете, чем вызван данный запрет?
Задание №1. Вспомните, чем обусловлены кислотные свойства веществ.
-
Наличие какого иона в растворе обуславливает кислую реакцию среды?
-
Как меняют цвет индикаторы в растворах кислот?
Вспомните электронное строение карбоксильной группы. Ответьте на вопросы:
-
Какие особенности строения карбоновых кислот определяют их химические свойства?
-
Являются ли карбоновые кислоты сильными или слабыми электролитами?
-
В каждой из нижеследующих кислот укажите кислоту, являющуюся наиболее сильным электролитом:
А)метановая, этановая, пропановая;
Б) уксусная, хлоруксусная, дихлоруксусная;
В) бромуксусная, хлоруксусная, фторуксусная
Работайте вместе с классом
Изучите стр. 184-185
Задание оценивается в 7 баллов
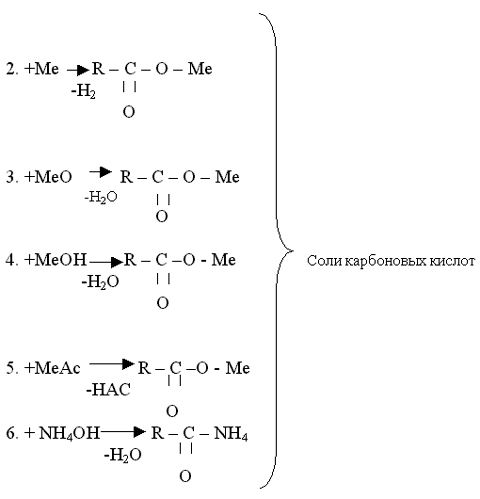
Задание №2. Изучите химические свойства, которые являются общими для органических и неорганических кислот
Опорный конспект по теме: «Химические свойства карбоновых кислот»
I. Реакции с разрывом О-Н - связи.
Выполните упражнения:
-
С какими из нижеперечисленных металлов реагирует уксусная кислота: а) медь, б) железо, в) цинк, г) серебро? Напишите уравнения реакций.
-
С какими из нижеперечисленных оксидов реагирует уксусная кислота: а) CO2 б) MgO в) NO г) CuO. Напишите уравнения реакций.
-
Напишите уравнение реакции нейтрализации раствора гидроксида натрия раствором следующей кислоты: а) муравьиной, б) пропионовой.
-
Укажите условие взаимодействия карбоновых кислот с солями. Напишите уравнения реакций, если они возможны: а) CH3-CH2-COOH + NaHCO3 → б) CH3-COOH + NaCl → в) CH3-COOH + Na2SiO3 →
Используйте опорный конспект и стр. 185 учебника О.С. Габриеляна
Запишите химические свойства в тетрадь и назовите продукты реакции
Задание оценивается в 8баллов
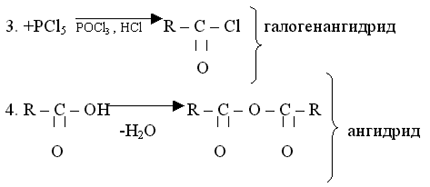
Задание №3 Используя опорный конспект, изучите другие свойства карбоновых кислот и выполните предложенные упражнения.
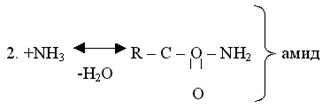
II. Реакции с разрывом С - О - связи (замещение ОН-группы).
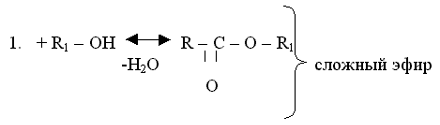
III. Реакции в углеводородном радикале
Выполните упражнения:
-
Какую реакцию называют реакцией этерификации? При каких условиях эта реакция протекает более полно? Как называют реакцию, обратную реакции этерификации? (3б)
-
Напишите уравнения следующих реакций, назовите исходные вещества и получаемые продукты: а) CH3COOH + С2H5 OH ↔ б) CH3COOH + СH3 OH ↔ в) C2H5COOСH3 + H2O ↔ (6б)
-
В каком положении углеводородной цепи оказывается атом хлора при взаимодействии хлора с карбоновыми кислотами в присутствии красного фосфора? Напишите уравнения реакций, назовите получаемые продукты:
а) C2H5COOH + Cl2 → б) CH3 CH2 CH2COOH + Cl2 → (5б)
4. С помощью какого реактива можно отличить акриловую кислоту от пропановой. Напишите уравнение соответствующей реакции Укажите наблюдаемый признак этой реакции. (3б)
5. С помощью какого реактива можно отличить муравьиную кислоту от уксусной кислоты? В чём состоит особенность строения муравьиной кислоты? Напишите уравнение реакции «серебряного зеркала» для муравьиной кислоты. (3б)
Внимательно изучите текст учебника стр. 186-189. и опорный конспект.
Выполните упражнения в тетрадях . Работайте в парах.
Задание оценивается в 20 баллов
Обсудите результаты своей работы
Работайте вместе с классом. Сверьте свои ответы с эталоном
Оцените результаты своей работы
Максимальная оценка за УЭ -2 - 35 баллов
УЭ-3
Цель: отработать умение осуществлять цепочки химических превращений
Напишите уравнения реакций следующих превращений:
А) уксусная кислота → Х →дихлоруксусная кислота (3 балла)
Б)этаналь → Х → ацетат натрия (3 балла)
В) метан → хлорметан → метанол → Х →муравьиная кислота → этилформиат (6баллов)
Работайте самостоятельно.
Задание оценивается в 10 баллов
УЭ-4
Цель: подведите итоги урока
Ещё раз прочитайте цель урока
индивидуально
Достигли ли вы цели урока? В какой степени?
Вместе с классом
Оцените работу на уроке.
Если по итогам урока вы набрали:
48-55 баллов, то получаете оценку «5», если -38-47 - баллов- «4», если 37-27баллов - «3», менее 27- «2»
Ваша оценка за урок ____
Домашнее задание: стр184-190, упр. 6,7,10,18
Выполнить творческие задания по группам: подготовить презентации об отдельных представителях карбоновых кислот, их значении и применении:
1 группа - муравьиная и олеиновая 3 группа - пальмитиновая и стеариновая кислоты
2 группа - уксусная и щавелевая
М-4 - Получение и применение карбоновых кислот.
Номер УЭ
Учебный материал
Руководство по усвоению учебного материала
УЭ-0
Интегрирующая цель: Сформировать понятие об основных способах получения карбоновых кислот, о значении и применении отдельных представителей карбоновых кислот.
Прочтите цель урока
УЭ-1
Ц
Ц Цель: проверить уровень усвоения материала предыдущего урока
Тест.
1. Уксусная кислота взаимодействует с : а)оксидом кремния б) медью в) гидроксидом магния г) этаном
2. При взаимодействии этановой кислоты с метанолом образуется: а)метилформиат б) метилацетат в) этилацетат г) этилформиат
3. Пропионовая кислота взаимодействует с каждым из двух веществ: а)CH3OH и CO2 б) Cl2 и NaHCO3 в) CaO и KCl г) C6H6 и Ag
4. Олеиновая кислота взаимодействует с каждым из двух веществ: а)глицерином и серебром б) пропаном и хлором в) метанолом и бромоводородом г) этаном и азотом
5. Муравьиную кислоту можно отличить от уксусной с помощью: а)гидроксида натрия б) сульфата меди в) аммиачного раствора оксида серебра г) этанола
Ответьте на вопросы теста
Работайте самостоятельно
Оцените результаты работы по ключу к тесту
Максимальная оценка-5 баллов
УЭ-2
Цель: усвоить общие способы получения карбоновых кислот и частные способы получения отдельных кислот
Опорный конспект «Общие способы получения карбоновых кислот»
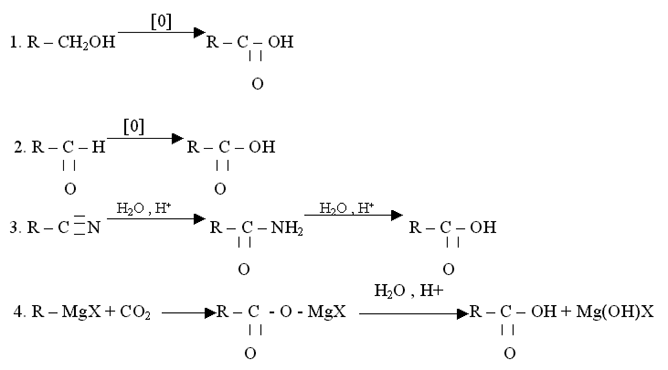
Изучите стр. 190 и опорный конспект, выполните задания в тетради.
Работайте в парах.
Задание №1 Выполните упражнения
1.Напишите уравнения реакций окисления: а) метанола б) этанола, в) пропанола до соответствующих кислот. (3 б)
2.Напишите уравнения реакций окисления: а) муравьиного, б) уксусного, в) пропионового альдегидов до соответствующих кислот. (3 б)
3. Какие продукты образуются при гидролизе сложных эфиров? В каких условиях следует проводить эту реакцию? Напишите уравнение реакции гидролиза этилового эфира уксусной кислоты в кислой и щелочной среде. (4 б)
Работайте самостоятельно
Задание оценивается в 10 баллов
Опорный конспект «Частные способы получения отдельных кислот»
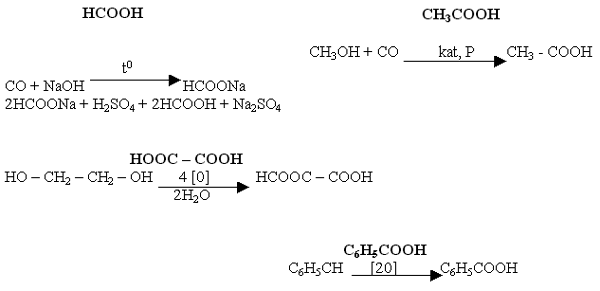
Изучите стр. 190 и опорный конспект, запишите уравнения реакции в тетрадь.
Задание №2 Осуществите цепочки превращений
Карбид кальция →Х1 →этаналь → уксусная кислота → Х2 +NaOH →метан
Оцените свою работу в максимум 5 баллов
УЭ-3
Цель: выяснить области применения карбоновых кислот и их производных и их значение.
Защита творческих проектов
Работайте в группах
Внимательно слушайте выступления, задавайте вопросы своим оппонентам.
Оцените работу ваших оппонентов по пятибалльной шкале
Суммируйте полученные вашей группой оценки.
Оцените свою работу в максимум 10 баллов
УЭ-4
Цель: подведите итоги урока
Ещё раз прочитайте цель урока
индивидуально
Достигли ли вы цели урока? В какой степени?
Вместе с классом
Оцените работу на уроке.
Если по итогам урока вы набрали: 26-30 баллов, то получаете оценку «5», если 25-20 баллов- «4», если 15-19 баллов - «3», менее 15- «2»
Домашнее задание: подготовиться к практической работе
Если вы получили неудовлетворительную оценку, проработайте модуль ещё раз, а также поработайте с учебником с 180-185
Ваша оценка за урок ____
М-5. Практическое занятие "Получение карбоновых кислот и изучение их свойств".
Цели: получение уксусной кислоты, изучение ее свойств.
Реактивы: ацетат натрия, раствор серной кислоты (1:1), магний (порошок), оксид магния, 20% раствор гидроксида натрия, раствор лакмуса, 10% раствор карбоната натрия, вода (в стакане).
Инструктивная карта.
Требуется проявлять осторожность при нагревании ацетата натрия и серной кислоты, проведении реакции между уксусной кислотой и магнием.
Что делаю?
Что наблюдаю?
Выводы и уравнения реакций
1
 . Получение уксусной кислоты. Cоберите прибор для получения CH3COOH.
. Получение уксусной кислоты. Cоберите прибор для получения CH3COOH.
В пробирку влейте 3 г. крист. ацетата натрия и прилейте 3 мл. серной кислоты (1:1).
Закройте пробирку пробкой с газоотводной трубкой, конец которой опустите в пустую пробирку до дна.
Нагревайте смесь до получения 2-3 мл. кислоты в пробирке-приемнике.
Разбавьте полученную уксусную кислоту на половину водой.
2. Исследования химической активности уксусной кислоты.
В четыре пробирки следует добавить поочередно порошок магния, оксида магния, раствор карбоната натрия, лакмус и раствор гидроксида натрия.
Рис. 43.3. с. 175
В пробирке- приемнике собралась жидкость без цвета с резким запахом, ………. растворимая в воде.
t0
CH2COONa + H2SO4
Вывод:
[Все реакции следует записывать в молекулярном, полном и сокращенном виде]
CH3COOH + Mg
CH3COOH + MgO
CH3COOH + NaOH + лакмуc
CH3COOH + Na2CO3
Выводы: (аргументировано изложите теоретические и практические данные о свойствах уксусной кислоты как представителя предельных одноосновных карбоновых кислот.)
М-6 Подготовка к контрольной работе.
Урок-консультация "Двадцать вопросов по данной теме".
Для этого класс делится на группы по 4 человека. За 8-10 минут они должны будут составить и записать 20 вопросов по изученной теме. В каждой группе выбирается выступающий ученик. Первая группа задает вопрос. Другие группы вычеркивают этот вопрос, если он есть у них в списке. Выступающий второй группы дает на него ответ, при необходимости, он может воспользоваться помощью своей группы. Далее следуют уточнения, дополнение и углубление учителя. Листки с вопросами собираются для анализа. Отметки за ответы на этом уроке не предусмотрены. Такая методика позволяет провести консультацию интересно, в хорошем темпе. Вопросы и ответы учащихся показывают готовность класса к итоговому уроку.
М-7 Контрольная работа №5 по теме «Карбоновые кислоты, сложные эфиры, жиры».
Вариант №1
Часть А
Выберите один правильный ответ из четырёх предложенных.
1. (2 балла). К классу предельных одноосновных карбоновых кислот принадлежит вещество состава
A.С3Н6О Б. С3Н6О2 В. С2Н6О2 Г. С2Н6О
2. (2 балла). Молекула акриловой (пропеновой) кислоты содержит
А. один атом кислорода и одну π-связь
Б. два атома кислорода и две π-связи
В. один атом кислорода и две π-связи
Г. два атома кислорода и одну π-связь
3. (2 балла). Изомером пропановой кислоты не является
А. метилацетат В. этилформиат
Б. 1-гидроксипропанон Г. пропандиол-1,2
4. (2 балла). В результате влияния гидроксильной группы на карбонильную предельные карбоновые кислоты
А. хорошо растворимы в воде
Б. вступают в реакцию этерификации
В. не вступают в реакции присоединения
Г. обладают выраженными кислотными свойствами
5. (2 балла). Ацетат натрия не получится при действии на уксусную кислоту
А. натрия Б. гидроксида натрия
В. карбоната натрия Г. хлорида натрия
6. (2 балла). Сложный эфир можно получить реакцией:
А. Галогенирования. Б. Нитрования. В. Гидрирования. Г. Этерификации.
7. (2 балла). Кислотные свойства наиболее ярко выражены у вещества, формула которого:
А. СН3СОН. Б. СН3СН2СН2ОН.
В. СН3СН2СООН. Г. С6Н5ОН.
8 (2 балла). В реакцию нейтрализации могут вступать:
А. Альдегиды. В. Сложные эфиры.
Б. Спирты. Г. Карбоновые кислоты.
9 (2 балла). Формула вещества X в цепочке превращений
СН2=СН-СН3 -> X -> СН3СОСН3:
А. СН2ОН-СН2-СН3. Б. СН3-СНОН-СН3. В. СН3-СНСl-СН3. Г. СН2С1-СН2-СН3.
10 (2 балла). Жиры представляют собой:
А. сложные эфиры глицерина и высших карбоновых кислот;
Б. сложные эфиры этиленгликоля и высших карбоновых кислот;
В. натриевые соли высших карбоновых кислот;
Г. смесь высших карбоновых кислот
ЧАСТЬ Б. Задания со свободным ответом
ЗАДАНИЕ 1 (6 баллов)
Закончите уравнения реакций, укажите условия их осуществления
A. НСООН + Zn →
Б. СН3СООН + СН3ОН →
ЗАДАНИЕ 2 (8баллов)
Напишите уравнения реакций, при помощи которых можно осуществить превращения по схеме:
C3H8 → C3H7Br → C3H7OH → C3H7COH → C3H7COOH
Укажите условия осуществления реакций и названия всех веществ.
ЗАДАНИЕ 3 (6 баллов)
Рассчитайте массу кислоты, полученной при нагревании 55 г 40% -го раствора этаналя с избытком гидроксида меди (II).
Вариант №2
Часть А
Выберите один правильный ответ из четырёх предложенных.
1 (2 балла). Общая формула сложных эфиров:
А. RСОН. Б. RСООН. В. R1CОR2. Г. R1CОOR2.
2. (2 балла). Какое из перечисленных веществ содержит карбоксильную группу?
А. бутанол-2
Б. 3- метилпентановая кислота
В. Пентанон -2
Г. пентаналь
3. (2 балла). Пара гомологов:
А. глицерин и этиленгликоль
Б. метанол и метаналь
В. Уксусная и муравьиная кислоты
Г. фенол и этанол
4. (2 балла). Кислотные свойства среди перечисленных ниже веществ наиболее выражены у
А. хлоруксусной кислоты Б. фенола
В. муравьиной кислоты Г. пропанола
5. (2 балла). Пропановая кислота вступает в реакцию с
А) аммиачным раствором оксида серебра
Б) сульфатом натрия
В) хлороводородом
Г) бромом
6. (2 балла). Продуктом реакции этерификации может быть
А) вода Б) диэтиловый эфир
В) бутанол Г) уксусная кислота
7. (2 балла). Карбоновую кислоту нельзя получить реакцией:
А. Восстановления альдегида. Б. Гидролиза жира.
В. Окисления альдегида. Г. Окисления одноатомного спирта.
8. (2 балла). Кислотные свойства наиболее ярко выражены у вещества, формула которого:
А. НСООН. Б. С3Н7СООН.
В. С2Н5ОН. Г. С4Н9ОН.
9 (2 балла). Формула вещества X в цепочке превращений
С2Н5ОН → X →СН3СООН:
А. СО2. Б. СН3СОН.
В. С2Н5С1. Г. С2Н5ОС2Н5.
10 (2 балла). Жидкие жиры отличаются от твердых тем,что в их составе содержатся:
свободные гидроксильные группы;
Б. остатки ароматических карбоновых кислот;
сложные эфиры высших карбоновых кислот
и этиленгликоля;
Г. остатки непредельных карбоновых кислот
ЧАСТЬ Б. Задания со свободным ответом
ЗАДАНИЕ 1 (6 баллов)
Закончите уравнения реакций, укажите условия их осуществления
A. СН3СООН + СаСО3→
Б. С2Н5ОН + СН3СООН →
ЗАДАНИЕ 2 ( 8 баллов)
Напишите уравнения реакций, при помощи которых можно осуществить превращения по схеме:
СН4→ С2Н2 → СН3СОН→ СН3СООН→ (CH3COO)2Mg.
Укажите условия осуществления реакций и названия всех веществ.
ЗАДАНИЕ 3 (6 баллов)
Рассчитайте массу кислоты, полученной при нагревании 55 г 40% -го раствора этаналя с избытком гидроксида меди (II).