- Преподавателю
- Химия
- Сера и ее распространение в природе
Сера и ее распространение в природе
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Тасимова А.У. |
| Дата | 03.03.2014 |
| Формат | doc |
| Изображения | Есть |
Министрество образования и науки Республики Казахстан
Западно - Казахстанская область
Зеленовский район
Рубежинская СОШ - детсад
Сера и ее распространение в природе
9 класс
Учитель химии: Чунчалиева У.С.
Тема: Сера и ее распространение в природе
Цель: узнать особенности строения атома серы, свойства, биохимическую роль и области применения серы и ее соединений, продолжить развитие умений устанавливать причинно-следственные связи между строением и свойствами вещества, составлять уравнения реакций, отражающие свойства серы и рассматривать их с точки зрения окисления, восстановления.
Задачи урока: образовательные - сформировать знания и умения по теме «Сера и ее распространение в природе», продолжить формирование умений работать с учебником, тетрадью;
воспитательные: воспитание целостных ориентаций; привитие интереса к химии; воспитание чувства само - и взаимоуважения в условиях малых групп; продолжение формирования мировоззрения учащихся, развитие осознанного отношения к процессам, влияющим на экономию и понимание собственной значимости;
развивающие: развивать наблюдательность, память; развивать умение сравнивать (например, сравнение свойств элементов в зависимости от их положения в периодической таблице); научить учащихся обобщать и делать выводы; развивать у учащихся навыки самостоятельной работы, умение выделять главное, анализировать и делать логические выводы.
Оборудование и реактивы: таблица Д.И. Менделеева, персональный компьютер, кристаллическая сера, стаканчики с водой, спиртовка, пробирки, стеклянные палочки, порошок железа, коллекция «Минералы и горные породы».
Межпредметные связи: география (минералы, содержащие серу), биология (биологическое значение серы)
Опорные знания: строение периодической системы элементов Д.И. Менделеева, строение атома, аллотропия, аллотропические видоизменения, окислитель, восстановитель, элемент, простое вещество.
Ход урока
I. Актуализация урока.
Оргмомент. (2 мин)
Опрос домашнего задания (15 мин)
Вопросы для фронтального опроса (слайды 1-6)
1. Каково положение неметаллов в периодической системе?
2. Каковы особенности строения атомов неметаллов?
3. Как изменяется электроотрицательность неметаллов одного периода? Одной группы?
4. Какой из неметаллов самый сильный окислитель? Самый сильный восстановитель?
5. Как изменяются неметаллические свойства элементов одной группы? Одного периода?
6. Определите по уравнению реакции, какой из атомов является окислителем, а какой восстановителем?
C u0- 2 e Cu+2
u0- 2 e Cu+2
S 0 + 2 e S -2
0 + 2 e S -2
Вопросы для обсуждения: (слайды 7-8)
1. Объясните, почему фтор является самым сильным окислителем?
2. Как и почему изменяются неметаллические свойства галогенов с увеличением атомных масс?
Письменная работа (приложение 1)
II. Формирование новых понятий и способов действия. (20 мин)
Сегодня речь пойдет о веществе, известном человеку с древних времен. Считалось, что голубое пламя и запах этого горящего вещества отгоняют демонов. При раскопках Помпеи нашли картину, на которой изображен процесс отбеливания тканей при помощи газов, образующихся при горении этого вещества. Применяли вещество и для военных целей. В 670 г защитники Константинополя сожгли арабский флот с помощью «греческого огня», в состав которого входили селитра, уголь и наша «незнакомка». Атомы химического элемента, их которых состоит это вещество, находятся в 3 периоде VI группе, главной подгруппе. Что это? (Сера)
С
 оставим схему строения атома серы. (вызываю сильного ученика к доске)
оставим схему строения атома серы. (вызываю сильного ученика к доске)
+16S 1s2 2s2 2p6 3s2 3p4 4d0
2 8 6
За счет свободных d- орбиталей возможно распаривание электронов третьего энергетического уровня, поэтому сера проявляет валентности II, IV, VI. Степени окисления -2, +2,+4, +6 (слайд 9)
Лабораторная работа.
Перед вами на столах образцы серы, стаканчики с водой. Рассмотрим ее физические свойства и заполним таблицу. (слайд 10)
Агрегатное состояние
Цвет
Запах
Растворимость в воде
Из желтого порошка кристаллической серы легко получить пластическую.
Демонстрационный опыт. Наполняю пробирку на 1/3 желтым порошком серы, медленно нагреваю. Расплавившуюся серу выливаю в стаканчик с водой. Стеклянной палочкой извлекаю из стаканчика и демонстрирую пластическую серу.
Задание учащимся. (слайд 11)
Внимательно изучите по таблице свойства кристаллической и пластической серы и ответьте на вопрос: кристаллическая и пластическая сера - одно вещество или два разных вещества. Почему?
(это два вещества, так как у них разное строение молекул и разные свойства)
Название
Формула
Строение молекулы
Температура плавления
Кристаллическая (ромбическая)
S8
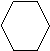
112,80
Пластическая
Sn
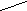
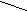
1870
Вспомните, как называется это явление и такие вещества? (аллотропия, аллотропные видоизменения)
Подумайте, переход кристаллической серы в пластическую - химическое или физическое явление? (химическое, так как образуется вещество с новыми свойствами)
S 8 t Sn
8 t Sn
Рассмотрим химические свойства серы. (Реакции составляют вызванные к доске учащиеся. Обращаю внимание на валентность серы в соединениях с металлами - II, условия протекания реакции).
 O2
O2

H2 ,t
 (Схема на доске, заготовлена заранее)
(Схема на доске, заготовлена заранее)
S Zn, t (слайд 12)
Zn, t (слайд 12)

Al, t

 Hg
Hg
Характеризуем реакции как окислительно-восстановительные, выясняя какую роль (окислителя или восстановителя) играет сера.


 4 e
4 e
S 0 + O02 S+4O2-2 S - восстановитель
0 + O02 S+4O2-2 S - восстановитель
2e


H 02 + S0 H2+1 S-2 S - окислитель
02 + S0 H2+1 S-2 S - окислитель
2 e


Z n0+S0 Zn+2 S-2 S - окислитель
n0+S0 Zn+2 S-2 S - окислитель


 6 e
6 e
2 Al0 + S0 Al2+3 S3-2 S - - окислитель
Al0 + S0 Al2+3 S3-2 S - - окислитель
2 e


H g0 + S0 Hg+2 S-2 S - - окислитель
g0 + S0 Hg+2 S-2 S - - окислитель
Вывод: с металлами сера проявляет окислительные свойства, а с неметаллами сера может выступать и как окислитель, и как восстановитель.
В природе сера встречается как в свободном виде, так и в виде соединений. Свободную серу добывают на Алтае, в горах Жонгарского Алатау, она входит в состав нефтей месторождений Западного Казахстана.
Природные соли, содержащие серу:
глауберовая соль (мирабилит) Na2S4 ● 10 H2O (о. Тенгиз, Нура)
пирит Fe2S
медный калчедан Cu FeS2
гипс CaSO4 ● 2 H2O
барит BaSO4
Сера входит в состав белков.
(демонстрация образцов минералов)
Прочитав абзац на стр. 41 заполните схему:
Применение серы (слайд 13)














III. Обобщение закрепление нового материала. (5 мин)
Сегодня мы познакомились с еще одним представителем неметаллов периодической системы химических элементов Д.И. Менделеева - серой.
1.В каком виде встречается сера в природе?
2. Какие простые вещества образует сера?
3. Какую валентность имеет сера?
4. С какими веществами сера взаимодействует при нормальной температуре?
5. С какими веществами сера взаимодействует при нагревании?
IV. Домашнее задание (2 мин):
I уровень. Прочитать §12, уметь составлять химические реакции, характеризующие свойства серы.
II уровень. Дополнительно выполнить упражнение 2 стр. 43
III уровень. Дополнительно. Творческое задание: подготовить сообщение «Запасы серы в Казахстане и их применение».
Литература:
1. Химия 9 класс. И. Нугуманова, Р. Жумадилова, Ж. Кембебаева. Мектеп, 2005
2. Химия 9 класс (методическое руководство) И. Нугуманова, Р. Жумадилова, Р. Каржасбаева. Мектеп, 2005
3. Сборник задач и упражнений. Под редакцией И. Нугуманова. Мектеп, 2005
4. Обучение химии в 9 классе. Пособие для учителя. Под редакцией М.Зуевой. Просвещение 1990
5. Неорганическая химия энциклопедия школьника. Под редакцией М.А. Прокофьева. «Советская энциклопедия» 1975.
Приложение 1
Вариант 1
1. Пользуясь таблицей Д.И. Менделеева, назовите 3 неметалла. Сколько электронов у них на последнем энергетическом уровне?
2. Какой из элементов более сильный окислитель? Стрелкой покажите переход электронов
S O, O F, N H
3. Определите, в каком случае элемент является окислителем, в каком - восстановителем.
C u0 - 2e Cu+2
u0 - 2e Cu+2
S 0 + 2 e S-2
0 + 2 e S-2
Вариант II
1. Назовите все неметаллы 7 группы, сколько электронов у них на последнем энергетическом уровне?
2. Какой из элементов более сильный окислитель? Стрелкой покажите переход электронов
SiF, P Cl, H S
3. Определите, в каком случае элемент является окислителем, в каком - восстановителем.
C u0 - 2e C+2
u0 - 2e C+2
O 0 + 2 eO-2
0 + 2 eO-2
Методическое описание урока
У рок «Сера и ее распространение в природе» - это урок из раздела «Неметаллы. Их природные соединения. Значение неметаллов». На этом уроке имеются возможности закрепить, развить понятия «химический элемент», «простые вещества», «аллотропия», наглядно показать связь между строением и свойствами веществ, подтвердить логическую цепочку: строение свойство вещество. Изучаемый материал дает возможность закрепить навыки составления окислительно-восстановительных реакций, определения окислителя - восстановителя.
рок «Сера и ее распространение в природе» - это урок из раздела «Неметаллы. Их природные соединения. Значение неметаллов». На этом уроке имеются возможности закрепить, развить понятия «химический элемент», «простые вещества», «аллотропия», наглядно показать связь между строением и свойствами веществ, подтвердить логическую цепочку: строение свойство вещество. Изучаемый материал дает возможность закрепить навыки составления окислительно-восстановительных реакций, определения окислителя - восстановителя.
Урок начинаю с проверки домашнего задания. Опрос состоит из трех этапов. Первый этап «мозговая атака» - требует односложных коротких ответов. Таким образом, проверяю знание основных понятий.
На втором этапе - вопросы, требующие рассуждения, объяснения. Третий этап - письменная работа по карточкам, в которые включены разноуровневые задания. Учащиеся имеют возможность полнее показать свои знания.
Объяснение нового материала начинаю с интригующего исторического рассказа, таким образом, осуществляю «побуждение» - готовность учащихся воспринимать новый материал.
Использую эвристический метод - учащиеся, самостоятельно пользуясь таблицей Менделеева, определяют, о чем пойдет речь на уроке.
При изучении физических свойств серы выполняем лабораторную работу, в ходе которой у учащихся формируются навыки работы с сыпучими веществами, развивается аккуратность, наблюдательность. На этом уроке изучаются только некоторые свойства серы. Более полное изучение химических свойств серы программой по химии предусмотрено в курсе 10 класса. Поэтому нет необходимости загружать учащихся дополнительной информацией. Более целесообразно использовать урок для совершенствования навыков составления окислительно-восстановительных реакцией., определять окислитель - восстановитель, показывать переход электронов, степени окисления. Схему химических свойств серы готовлю заранее на доске. А составление уравнений реакций осуществляют учащиеся из числа сильных. Я корректирую выполнение работы и указываю на условия течения реакций. Таким образом, совмещаю изучение новой темы с формированием и закреплением навыков.
На следующем этапе урока изучаем распространение серы в природе. Использую коллекцию «Минералы и горные породы», опираюсь на географические знания учащихся о полезных ископаемых. Использую методы: рассказ с элементами беседы и демонстрацию образцов минералов.
Изучение вопроса о применении серы организую в форме работы с учебником с последующим составлением «кластера». Такая организация работы позволяет сократить время на закрепление.
В комплектацию кабинета химии входит один персональный компьютер. На этом уроке я использую его для проверки домашнего задания и объяснения нового материала. В файлах представлена «презентация». Вопросы для проверки домашнего задания, таблицы и другие материалы необходимые для объяснения. Использование компьютера вносит новизну в структуру урока, делает урок более привлекательным для учащихся, во время опроса позволяет полнее раскрыться учащимся, так как включается не только слуховое, но и зрительное восприятие.
В заключение подводим итого урока: что узнали нового на уроке. Данный урок построен таким образом, что учащимся предоставляется возможность, опираясь на имеющиеся знания самостоятельно добывать новые. Нет необходимости много времени отводить на закрепление, так как ученики участвуют в процессе приобретения новых знаний.


