- Преподавателю
- Химия
- Методическая разработка по теме Амины
Методическая разработка по теме Амины
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Дъячук Л.В. |
| Дата | 27.12.2015 |
| Формат | docx |
| Изображения | Есть |
ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
СРЕДНЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
НОВОСИБИРСКОЙ ОБЛАСТИ
«БАРАБИНСКИЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ»
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
ТЕОРЕТИЧЕСКОГО ЗАНЯТИЯ ДЛЯ ПРЕПОДАВАТЕЛЯ
Специальность 34.02.01 Сестринское дело базовой подготовки
Дисциплина «Химия»
Раздел 4. Органическая химия
Тема 4.21. Амины
2015
Одобрена на заседании цикловой
методической комиссии
Протокол № ______ от _________
Председатель_______________________
Автор: Дъячук Л.В. - преподаватель 1 квалификационной категории
ОГЛАВЛЕНИЕ
1. Методический лист ……………………………………………………..4
2. Примерная хронокарта занятия ……………………………………….. 7
3. Исходный материал ……………………………………………………. 8
4. Приложение 1. Контроль знаний по теме
«Углеводы. Полисахариды»….…………………………………………14
5. Приложение 2. Задания для закрепления знаний по теме «Амины»…16
6. Приложение 3. Задание для предварительного контроля знаний… 17
7. Приложение 4. Задание для самостоятельной внеаудиторной работы
студентов …... …………………………………………………………. 19
8. Список использованных источников …………………………………. 19
МЕТОДИЧЕСКИЙ ЛИСТ
Вид занятия - комбинированный урок
Продолжительность - 90 мин.
ЦЕЛИ ЗАНЯТИЯ
1. Учебные цели:
- сформировать знания об аминах, их классификации, строении, физических и химических свойствах, рассмотреть способы получения анилина и других аминов.
2. Развивающие цели:
- формирование умений составлять формулы аминов и давать им названия, составлять структурные формулы изомеров, характеризовать строение и свойства аминов в сравнении с аммиаком, развитие логического мышления, внимания, памяти.
3. Воспитательные цели:
- создавать содержательные и организационные условия для развития самостоятельности в добывании студентами знаний, скорости восприятия и переработки информации, культуры речи, воспитании настойчивости в достижении цели, формирование способности организовывать собственную деятельность при выполнении упражнений.
МОТИВАЦИЯ
За десять лет до появления теории химического строения А.М. Бутлерова в органической химии шли интенсивные поиски закономерностей, которые могли бы преодолеть хаос в вопросах классификации и строения веществ «живой природы». Наиболее прогрессивной в то время была теория типов О. Лорана и Ш. Жерара. Многие органические вещества они относили к типу воды, рассматривая их как продукты замещения одного или обоих атомов водорода в этом веществе на радикалы. Например, «производные воды», в которых атом водорода замещён на углеводородный радикал, можно отнести к спиртам, а если заменить два атома водорода на углеводородные радикалы, то получатся простые эфиры.
Любая теория хороша, если с ней согласуется как можно больше экспериментальных данных. На радость Жерару, в 1849 году его тёзка Шарль Вюрц в продуктах гидролиза азотсодержащих природных веществ обнаружил «летучие органические основания». Это были алифатические амины. После того как учёным удалось установить их молекулярный состав, Жерар развил свою теорию новым типом веществ - типом аммиака. Такая картинка замечательно ложится на то определение аминов, которое будет дано на сегодняшнем занятии.
Методы обучения - объяснительно-иллюстративный, репродуктивный, проблемный.
Место проведения занятия - кабинет математики, физики и химии.
Выписка из рабочей программы
дисциплины «Химия»
для специальности 34.02.01 Сестринское дело базовой подготовки
Тема 4.21.
Амины
Содержание учебного материала
2
Амины, их классификация и значение. Строение молекул аминов. Физические свойства аминов. Химические свойства аминов. Анилин. Применение аминов. Формирование умения характеризовать строение и свойства аминов. Организация собственной деятельности при выполнении упражнений.
1,2
Лабораторные работы
-
Практические занятия
-
Контрольные работы
-
Самостоятельная работа обучающихся: чтение текста, выполнение заданий по образцу [2, с. 347--353]
1
ПРИМЕРНАЯ ХРОНОКАРТА ТЕОРЕТИЧЕСКОГО ЗАНЯТИЯ
п/№
Наименование этапа
Время
Цель этапа
Деятельность
Оснащение
преподавателя
студентов
-1-
-2-
-3-
-4-
-5-
-6-
-7-
Организационный этап
5 мин.
Организация начала занятия, подготовка рабочего места студентов
Отмечает отсутствующих студентов в журнале
Староста называет отсутствующих студентов. Студенты приводят в соответствие внешний вид, готовят рабочие места.
Журнал, тетради
Контроль знаний по предыдущей теме
15 мин.
Оценка уровня сформированности знаний по теме «Углеводы. Полисахариды»
Инструктирует и проводит контроль
Выполняют упражнения.
Приложение 1
Упражнения по вариантам
Мотивационный этап
3 мин.
Развитие интереса к новой теме
Объясняет студентам важность изучения данной темы
Слушают, задают вопросы
Методическая разработка теоретического занятия
Цели занятия
2 мин
Установка приоритетов при изучении темы
Озвучивает цели занятия
Слушают, записывают в тетрадь новую тему
Методическая разработка теоретического занятия, таблицы
Изложение исходной информации
35 мин.
Формирование знаний об аминах, их классификации, строении, свойствах, получении и применении
Излагает новый материал
Слушают, записывают
Выполнение заданий для закрепления знаний
15 мин.
Закрепление знаний, формирование умений составлять формулы аминов и давать им названия, составлять структурные формулы изомеров, характеризовать строение и свойства аминов в сравнении с аммиаком
Инструктирует и контролирует выполнение заданий, обсуждает правильность ответов
Выполняют задания, слушают правильные ответы после выполнения, вносят коррективы
Приложение 2
Упражнения
Предварительный контроль новых знаний
13 мин.
Оценка эффективности занятия и выявление недостатков в новых знаниях, формирование способности организовывать собственную деятельность при выполнении упражнений.
Инструктирует и проводит контроль
Выполняют задания
Приложение 3
Задания для предварительного контроля знаний по новой теме (химический диктант)
Задание для самостоятельной внеаудиторной работы студентов
2 мин.
Формирование и закрепление знаний,
развитие самостоятельности в добывании студентами знаний.
Дает задание для самостоятельной внеаудиторной работы студентов, инструктирует о правильности выполнения
Записывают задание
Приложение 4
Исходный материал
Аминами называются соединения, которые могут быть произведены от аммиака замещением в нем атомов водорода на углеводородные радикалы.
Номенклатура аминов основывается на названии углеводородных остатков или углеводорода и слова «амин». Если к атому азота присоединены различные углеводородные остатки, то за основу названия принимают название самой длинной углеродной цепи, непосредственно связанной с атомом азота.
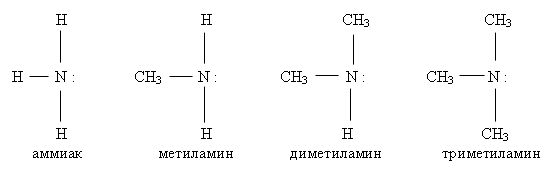
Классификация аминов
1) По числу углеводородных радикалов, связанных с атомом азота амины делят на:
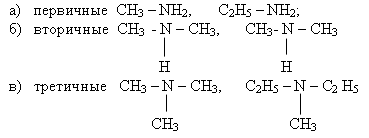
2) По характеру углеводородного радикала:
 С2Н5NH2 C6H5NH2
С2Н5NH2 C6H5NH2
Изомерия аминов
1) Изомерия углеродного скелета:
CH3CH2CH2СН2-NH2 CH3-CH-CH2-NH2
׀
CH3
Бутиламин - 1 2-метилпропиламин -1
2) Изомерия положения аминогруппы:
CH3CH2CH2СН2-NH2 CH3-CH2-CH-СН3
׀
NH2
Бутиламин - 1 Бутиламин - 2
Строение аминов
Атом азота в молекуле аминов находится в состоянии SP³ гибридизации и имеет тетраэдрическую ориентацию орбиталей. Три из четырёх гибридных орбиталей участвуют в образовании связей N-C, N-H. На четвёртой гибридной орбитали находится пара электронов, способных к образованию химических связей только по донорно-акцепторному механизму. Наличие неподелённой пары электронов, способной к присоединению катионов водорода, подобно молекуле аммиака, обусловливает свойства аминов как огранических оснований.
Получение аминов
Из-за запаха низшие амины долгое время принимали за аммиак, пока в 1849 году французский химик Шарль Вюрц не выяснил, что в отличие от аммиака, они горят на воздухе с образованием углекислого газа. Он же синтезировал метиламин и этиламин.
1842 г Н. Н. Зинин получил анилин восстановлением нитробензола - в промышленности
1) Восстановление нитросоединений:
R-NO2 + 6[H] t,kat-Ni → R-NH2 + 2H2O
или
R-NO2+3(NH4)2S t, Fe в кислой среде →R-NH2 +3S↓ +6NH3↑ + 2H2O (р. Зинина)
Другие способы:
2) Алкилирование аммиака осуществляют нагреванием галогеноалканов с аммиаком под давлением. ( Промышленный способ).
CH3Cl + 2NH3 t, ↑p → CH3-NH2 + NH4Cl
3) Лабораторный - действие щелочей на соли алкиламмония
(получение первичных, вторичных, третичных аминов):
[R-NH3]Г + NaOH t → R-NH2 + NaГ + H2O
4).Пропусканием паров спирта и аммиака при 300оС над катализатором.
С2Н5ОН + NН3 → С2Н5-NН2 +Н2О
Физические свойства аминов
Метиламин, диметиламин и триметиламин - газобразные вещества, с запахом аммиака, хорошо растворяются в воде, так как их молекулы образуют водородные связи с молекулами воды. Средние члены алифатического ряда - жидкости со слабым запахом тухлой рыбы, с постепенно повышающейся температурой кипения. Высшие амины (начиная с С16Н35N)-твердые нерастворимые вещества, не имеющие запаха. Ароматические амины - бесцветные высококипящие жидкости или твердые вещества, практически нерастворимые в воде. Связь N-H является полярной, поэтому первичные и вторичные амины образуют межмолекулярные водородные связи (несколько более слабые, чем Н-связи с участием группы О-Н). Это объясняет относительно высокую температуру кипения аминов по сравнению с неполярными соединениями со сходной молекулярной массой. Например:
Третичные амины не образуют ассоциирующих водородных связей (отсутствует группа N-H). Поэтому их температуры кипения ниже, чем у изомерных первичных и вторичных аминов (триэтиламин кипит при 89 °С, а н-гексиламин - при 133 °С).
По сравнению со спиртами алифатические амины имеют более низкие температуры кипения (т. кип. метиламина -6 °С, т. кип. метанола +64,5 °С). Это свидетельствует о том, что амины ассоциированы в меньшей степени, чем спирты, поскольку прочность водородных связей с атомом азота меньше, чем с участием более электроотрицательного кислорода.
Анилин (фениламин) С6H5NH2 - важнейший из ароматических аминов:
Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом (т. кип. 184 °С, т. пл. - 6 °С). На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит.
Химические свойства аминов.
Основные свойства
Атом азота в молекулах аминов, как и в молекуле аммиака, находится в состоянии sp3-гибридизации. На трех sp3-гибридных орбиталях находятся по одному электрону, эти орбитали участвуют в образовании связей N-C и N-H. На четвертой орбитали находится неподеленная электронная пара, которая определяет основные свойства, как аммиака, так и аминов. Свободная электронная пара атома азота способна взаимодействовать с вакантной орбиталью атома водорода (протона) по донорно-акцепторному механизму, поэтому амины, проявляя основные свойства, образуют гидроксиды, соли.
Алифатические амины - более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают электронную плотность на атоме азота за счет +I-эффекта. По этой причине электронная пара атома азота удерживается менее прочно и легче взаимодействует с протоном.
Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его π-электронами.
Ряд увеличения основных свойств аминов:
C6H5-NH2 < NH3 < R3N < R-NH2 < R2NH
-------------------------------------------------→
возрастание основных свойств
Водные растворы аминов имеют щелочную реакцию (амины реагируют с водой по донорно-акцепторному механизму):
R-NH2 + H2O → [R-NH3]+ + OH-
ион алкиламмония
Анилин с водой не реагирует и не изменяет окраску индикатора!!!
2) Взаимодействие с кислотами (донорно-акцепторный механизм):
CH3-NH2 + H2SO4 → [CH3-NH3]HSO4
(соль - гидросульфат метиламмония)
2CH3-NH2 + H2SO4 → [CH3-NH3]2SO4
(соль - сульфат метиламмония)
Способность к образованию растворимых солей с последующим их разложением под действием оснований часто используют для выделения и очистки аминов, не растворимых в воде. Например, анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси, а затем, добавив раствор щелочи (нейтрализация водного раствора), выделить анилин в свободном состоянии.
3) Реакция горения (полного окисления) аминов на примере метиламина:
4СH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2
Ароматические амины легко окисляются даже кислородом воздуха. Являясь в чистом виде бесцветными веществами, на воздухе они темнеют. Неполное окисление ароматических аминов используется в производстве красителей. Эти реакции обычно очень сложны.
4) Особые свойства анилина.
Для анилина характерны реакции, как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
а) Для анилина характерны свойства бензольного кольца - действие аминогруппы на бензольное кольцо приводит к увеличению подвижности водорода в кольце в орто- и пара- положениях.
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок). Эта реакция может использоваться для качественного и количественного определения анилина:
C6H5NH2 + 2Br2 →C6H2Br3NH2 + 3HBr
б) Свойства аминогруппы:
С6Н5NН2 + HCl → [С6Н5NН3 ]+Сl-
хлорид фениламмония
Применение
Амины используют при получении лекарственных веществ, красителей и исходных продуктов для органического синтеза. Гексаметилендиамин при поликонденсации с адипиновой кислотой дает полиамидные волокна.
Анилин находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты).
Приложение 1.
Контроль знаний по теме «Углеводы. Полисахариды»
Вариант 1.
1. Подвергается ли гидролизу а) глюкоза; б) крахмал. Ответ подтвердите уравнениями реакций.
2. В чём отличие крахмала и целлюлозы по физическим свойствам?
3. Какая масса молочной кислоты образуется при брожении глюкозы массой 300г, содержащей 5% примесей?
Вариант 2.
1. Осуществите превращения:
крахмал ----- глюкоза------- этиловый спирт------- этиловый эфир уксусной кислоты.
2. Чем по строению крахмал отличается от целлюлозы?
3. Какой объём углекислого газа образуется при спиртовом брожении глюкозы массой 250г, содержащей 4 % примесей?
Эталоны ответов
Вариант1.
1. Глюкоза гидролизу не подвергается, так как она является моносахаридом
Крахмал гидролизуется с образованием молекул α- глюкозы:
(C6H10O5)n + n H2O → t n С6Н12О6
2. Крахмал - это порошок белого цвета, не растворяется в воде. В горячей воде набухает; целлюлоза - волокнистое вещество, нерастворимое в воде.
3. С6Н12О6 → 2С3Н6О3
1) масса примесей: 300 • 0,05= 15г
2) масса чистой глюкозы: 300-15=285г
3) М (С6Н12О6)= 180г/моль
4) М (С3Н6О3) = 90г/моль
5) m (С3Н6О3)= 180г
6) масса молочной кислоты: 285•180:180= 285г
Вариант 2.
1.( C6H10O5)n + n H2O → t n С6Н12О6
С6Н12О6 → 2С2Н5ОН +2 СО2
С2Н5ОН + СН3СООН → СН3СОО С2Н5 + Н2О
2. Крахмал имеет линейную и разветвлённую структуры, а целлюлоза только линейную; крахмал состоит из звеньев α- глюкозы, а целлюлоза - из β- глюкозы.
3. С6Н12О6 → 2С2Н5ОН +2 СО2
1) масса примесей: 250 • 0,04= 10г
2) масса чистой глюкозы: 250-10= 240г
3) М (С6Н12О6)= 180г/моль
4) V( 2 СО2) = 44,8л
5) Объём углекислого газа: 240 • 44,8 : 180=59,7л
Критерии оценок:
Оценка «5» ставится, если правильно выполнены все задания
Оценка «4» ставится, если имеются небольшие ошибки (не поставлен коэффициент или имеется математическая ошибка в последнем действии задачи) или не выполнено задание 2
Оценка «3» ставится, если имеется 2 существенная ошибки (неправильно составлено уравнение реакции, ошибки в расчёте молярной массы, задача решена на 1/3)
Оценка «2» ставится, если правильно выполнено менее половины заданий.
Приложение 2.
Задания для закрепления знаний по теме «Амины»
Задание 1.
Назовите амины, формулы которых:
1- уровень
а) CH3-CH2-NH2
б) CH3-CH-CH3
׀
NH2
в) CH3-NH-CH2-CH2-CH3
2- уровень
а) CH3-CH2-CH2-NH2
б) CH3-CH2-NH-CH3
в) CH3-CH2-N-CH2-CH3
׀
C2H5
Задание 2.
Расположите в ряд по возрастанию основные свойства веществ: а) диметиламин, б) дифениламин, в) фениламин, г) аммиак, д) метиламин. Ответ поясните.
Эталоны ответов
Задание1.
1 уровень:
а) этиламин
б) пропиламин -2
в) метилпропиламин
2 уровень:
а) пропиламин - 1
б) метилэтиламин
в) триэтиламин
Задание 2.
Дифениламин - фениламин - аммиак - метиламин - диметиламин
Алкильные радикалы обладают положительным индуктивным эффектом. Они увеличивают электронную плотность на азоте, основность амина возрастает. Метиламин более сильное основание, чем аммиак, а диметиламин - чем метиламин. В анилине неподелённая электронная пара азота вовлечена в ароматическое сопряжение бензольного кольца. Поэтому основность у анилина меньше, чем у аммиака.
Критерии оценок
Оценка «5»: обучающийся правильно выполняет 2 задания (1 задание второго уровня)
Оценка «4»: обучающийся правильно выполняет 2 задания (1 задание первого уровня)
Оценка «3»: обучающийся правильно выполняет одно из заданий (ставится по желанию)
Приложение 3.
Задание для предварительного контроля знаний
Химический диктант по теме «Амины»
Инструкция: Прочитайте внимательно тексты. Вставьте пропущенные слова, словосочетания, формулы.
Вариант 1.
1. Амины по числу углеводородных радикалов можно разделить на три группы: …., …, ….
2. Вещество с формулой С2Н5 - NН - С2Н5 называется …
3. Метиламин - …. с резким аммиачным запахом, хорошо растворим в воде 4. Горение метиламина выражается уравнением: 4СН3NH2 + 9О2 → 4… + 10…+ 2N2
5. Характерное химическое свойство аминов заключается в образовании солей при взаимодействии с кислотами, поэтому амины - органические …. 6. Качественной реакцией на анилин является реакция с ….
7. Впервые анилин получил русский химик …
Вариант 2.
1. Амины - производные …, в молекулах которых один или несколько атомов водорода замещены на углеводородный радикал.
2. Вещество с формулой С2Н5 - NН2 называется …
3. Анилин - ….. в воде жидкость с неприятным запахом, быстро темнеющая на воздухе, очень ядовитая.
4. Горение анилина выражается уравнением: 4С6Н5NH2 + 31О2→24 … + 14 …+ N2
5. Анилин более слабое …., чем амины и аммиак.
6. При взаимодействии анилина с бромной водой образуется …. осадок.
7. В основе получения анилина лежит реакция восстановления …
Эталоны ответов
Вариант 1.
1. Первичные, вторичные, третичные.
2. Диэтиламин.
3. Бесцветный газ.
4. СО2, Н2О.
5. Основания.
6. Бромной водой.
7. Зинин
Вариант 2.
1. Аммиака.
2. Этиламин.
3. Бесцветная, нерастворимая.
4. СО2, Н2О.
5. Основание.
6. Белый.
7. Нитробензола.
Критерии оценок за работу по новой теме
Оценка «5»: обучающийся набирает 7 баллов (1балл за каждый правильный ответ)
Оценка «4»: обучающийся набирает 5 баллов
Оценка «3»: обучающийся набирает 4 балла (ставится по желанию)
Приложение 4.
Задание для самостоятельной внеаудиторной работы студентов
Прочитайте текст учебника [2], с.347-353 и выполните задания 1, 6 (с.352-353).
Список использованных источников
1. Бабков, А.В. Химия [Текст]: учебник для студентов сред. мед. учеб. заведений / А.В. Бабков, Т.И. Баранова, В.А. Попков; под ред. А.Н. Творогова. - М.: Издательский центр «Академия», 2003. - 272 с.
2. Ерохин, Ю.М. Химия [Текст]: учеб. для сред. проф. учеб. заведений / Ю.М. Ерохин; под ред. В.Н.Николаева. - 8-е изд., стер. - М.: Издательский центр «Академия», 2007. - 384 с.
3. Габриелян, О. С. Химия. 10 класс: Настольная книга для учителя [Текст]: пособие для учителя / О. С. Габриелян, И. Г. Остроумов; под ред. Н. В. Губина. - М.: Дрофа, 2010. - 480 с.
4. Радецкий, А.М., Горшкова, В.П., Кругликова, Л.Н. Дидактический материал по химии для 10-11 классов [Текст]: пособие для учителя / под ред. Е.К. Липкина. - М.: Просвещение, 2008. - 79 с.
20


