- Преподавателю
- Химия
- Методические рекомендации для студентов по проведению и выполнению лабораторных работ по дисциплине Химия образовательного цикла для специальностей технического профиля
Методические рекомендации для студентов по проведению и выполнению лабораторных работ по дисциплине Химия образовательного цикла для специальностей технического профиля
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Дубинина П.В. |
| Дата | 31.05.2015 |
| Формат | doc |
| Изображения | Есть |
Государственное автономное образовательное учреждение
среднего профессионального образования
Тольяттинский колледж сервисных технологий и предпринимательства
(ГАОУ СПО ТКСТП)
Методические рекомендации для студентов
по выполнению лабораторных работ
По химии
(Наименование дисциплины по примерному учебному плану)
Пояснительная записка.
Настоящие методические рекомендации составлены в соответствии с рабочей программой по дисциплине «Химия», составленной на основании примерной программы дисциплины «Химия» (на базе основного общего образования) ИПР СПО 2010, автор Ерохин Ю. М., одобренной Министерством образования Российской Федерации и предназначена для студентов специальностей СПО, обучающихся на базе основного общего образования.
Лабораторные работы являются одним из видов ученического эксперимента, применяемого при усовершенствовании и закреплении знаний. В процессе проведения лабораторных работ студенты глубже и полнее вникают в химические явления и законы, овладевают техникой химического эксперимента
Для познания сущности химических явлений студентов необходимо учить наблюдать, разъясняя цель и необходимость наблюдений, добиваться самостоятельного объяснения наблюдаемых процессов и умения делать выводы из проводимых опытов. От студентов требуется осмысленное выполнение заданий, основанное на теоретических знаниях. Однако это не исключает при определённых условиях умения автоматически выполнять ряд операций. Но «автоматизации» умения (навыка) обязательно предшествует представление (на более высоком уровне - понятие) о свойствах исходных и конечных продуктов, технологии (механизме, химизме) процессов, практическом применении. К «автоматизированным» можно отнести такие приёмы, как зажигание и гашение спиртовой горелки, нагревание, наливание жидкостей из одного сосуда в другой (например, переливание растворов из бутылки в пробирку с обязательным снятием последней капли), насыпание (взятие) твердых веществ из банок в пробирку и т.д., сборка простейших приборов. В общедидактическом плане следует, очевидно, полагать, что все, или почти все, что относится к экспериментальным умениям, нужно считать общетрудовыми умениями, так как формирование любого экспериментального умения связано с определённым видом физической или умственной деятельности (умственная деятельность - тоже трудовая).
Одним из путей формирования трудовых умений является изучение техники безопасности. Поэтому не только в узкопрактических целях, но и с учётом большого перспективного значения следует разъяснять студентам правила техники безопасности в процессе осуществления всех видов экспериментальной деятельности и требовать их строжайшего исполнения.
Лабораторные работы способствуют воспитанию у студентов любви и уважения к труду, формирование целеустремлённости, настойчивости в достижении цели. В этом плане правомерно требование переделать опыт, переписать отчёт. Систематические самостоятельные экспериментальные наблюдения, строгие требования к оформлению результатов работ развивают внимание, наблюдательность, научное мышление студентов, их стремление к самостоятельному поиску новых знаний.
Настоящие методические рекомендации представляет собой методическое пособие по дисциплине «Химия», которое предназначается для выполнения лабораторных работ.
В настоящих методических рекомендациях показана последовательность самостоятельного выполнения студентами лабораторных работ.
В качестве оформления и разъяснения лабораторных работ предусмотрены методические указания.
Методическое пособие содержит в себе 16 основных лабораторных работ, которые позволяют студенту закрепить свои знания, умения и навыки по химии.
Студент должен знать:
-
закон сохранения массы веществ при химических реакциях;
-
периодический закон химических элементов Д. И. Менделеева;
-
структуру периодической системы химических элементов Д. И. Менделеева;
-
зависимость свойств химических элементов от строения атома;
-
понятия об изомерии и гомологии, простых и кратных связях, функциональных группах;
-
строение, свойства, нахождение в природе и практическое значение изученных углеводородов, кислород- и азотсодержащих органических веществ.
Студент должен уметь:
-
классифицировать неорганические и органические вещества;
-
определять степень окисления элемента;
-
записывать уравнения реакций характеризующие химические свойства и методы получения изученных веществ;
-
записывать ионные уравнения реакций;
-
расставлять коэффициенты в уравнениях окислительно-восстановительных реакций;
-
называть органические вещества изученных классов по систематической номенклатуре;
-
вычислять по химической формуле относительную молекулярную массу вещества и определять его молярную массу
-
выполнять химические опыты, подтверждающие химические свойства изученных веществ.
К работам предъявляются общие требования:
Выполнение работы в тетрадях для лабораторных работ.
Лабораторная работа № 1
«Моделирование построения Периодической таблицы химических элементов»
Цель: Закрепить знания: о строении атома и электронных оболочек, периодического закона и системы химических элементов Д.И.Менделеева. Закрепить умения: записывать электронные и графические паспорта, определять количество протонов, нейтронов, электронов и заряд ядра; распределение электронов по слоям, пользоваться таблицей химических элементов Д.И. Менделеева.
Оборудование: карточка-задание, периодическая таблица химических элементов Д.И. Менделеева, набор для моделирования, 20 карточек размером 6х10 см.
Теоретическая часть
Атом состоит из положительно заряженного ядра и отрицательно заряженной электронной оболочки. Ядро состоит из протонов и нейтронов. Заряд ядра - это порядковый номер элемента в периодической таблице химических элементов Д.И.Менделеева со знаком +. Протон обозначается буквой р и имеет заряд +1 и массу 1. Соответственно количество протонов равно заряду ядра атома. Нейтрон обозначается буквой n и имеет заряд 0 и массу 1. Соответственно количество нейтронов равно атомная масса минус заряд ядра атома. Электрон обозначается буквой е и имеет заряд -1 и массу стремящуюся к нулю. Количество электронов в атоме равно количеству протонов в ядре данного элемента.
Электронный паспорт (формула) это распределение электронов по уровням и подуровням. Для написания электронного паспорта нужно соблюдать следующие правила:
-
не существует 2 атомов разных элементов с одинаковыми 4 квантовыми числами.
-
все электроны стремятся занять положение с минимумом энергии
ШКАЛА ЭНЕРГИИ.
1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s,4f,5d,6p,7s,5f,6d,7p.
-
на каждом подуровне может находиться количество электронов укладывающихся в диапазон:
S от 0 до 2
p от 0 до 6
d от 0 до 10
f от 0 до 14
Графический паспорт (формула) ПОКАЗЫВАЕТ РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОНОВ ПО ЯЧЕЙКАМ. Для написания графического паспорта нужно соблюдать следующие правила:
-
в ячейке не может быть больше 2 электронов с разно направленными спинами.
-
электроны занимают свободные ячейки, располагаясь сначала по одному и имея при этом одинаковые спины, а лишь затем спариваются.
-
для каждого подуровня характерно определённое число ячеек:
S - 1, p - 3, d - 5, f - 7
ПРИМЕР: запишите строение атома для элемента железо.
Fe №п/п=26, Аr(Fe)=56
Z=+26
p=26
n=56-26=30
e=26
1s22s22p63s23p64s23d6
=
-
=
_
_
_
_
2e,8e,14e,2e.
Периодический закон химических элементов Д.И.Менделеева сформулирован в 1869 году. Современная формулировка: «Свойства химических элементов и их соединений находятся в периодической зависимости от заряда их атомных ядер»
Периодическая таблица состоит из периодов (горизонтальных рядов) и групп(вертикальных рядов). По периодам сверху вниз увеличиваются радиус атома и металлические свойства, а уменьшаются электроотрицательность и неметаллические свойства. По группам главным подгруппам справа налево увеличиваются радиус атома и металлические свойства, а уменьшаются электроотрицательность и неметаллические свойства.
План характеристики химического элемента.
I. Положение элемента в периодической системе:
1. порядковый номер
2. период, ряд
3. группа, подгруппа
4. относительная атомная масса
II. Строение атома элемента:
1. заряд ядра атома
2. формула состава атома (количество p; n ; e )
3. количество энергетических уровней и размещение на них электронов (e)
4. формула электронной конфигурации (1S 2S...)
5. квантовые ячейки
III. Формулы соединений:
1. оксида
2. гидроксида (кислоты или основания)
3. летучего водородного соединения (для неметаллов)
IV. Химический характер самого элемента и его соединений:
-
металл, неметалл, переходный
-
кислотный, основной, амфотерный
V. Сравнение химического характера с соседями:
-
по периоду
-
по подгруппе.
Контрольные вопросы:
-
Расскажите о составе атома.
-
Перечислите элементарные частицы.
-
Какое максимальное количество электронов может разместиться на s-орбитали?
Практическая часть
Подготовьте 20 карточек размером 6х10 см для элементов с порядковыми номерами с 1 по 20. На карточке укажите следующие сведения об элементе: химический символ, название, относительную атомную массу, формулу высшего оксида (в скобках укажите характер оксида - основный, кислотный или амфотерный), формулу высшего гидроксида (в скобках укажите характер оксида - основный или амфотерный), формулу летучего водородного соединения для неметаллов.
Перемешайте карточки, а затем расположите их в ряд по возрастанию относительных атомных масс элементов.
Расположите сходные элементы с 3 по 18 друг под другом. Водород и калий над литием и под натрием соответственно, калий под магнием, гелий над неоном. Сформулируйте выявленную вами закономерность в виде закона. Обратите внимание на несоответствие относительных атомных масс аргона и калия, их расположению по общности свойств элементов. Объясните причину этого явления.
Лабораторные работы № 2
«Приготовление суспензии карбоната кальция в воде»
Цель: ознакомиться с приготовлениями суспензий
Оборудование и реактивы: раствор гидроксида кальция, пробирки, трубочка.
Теоретическая часть
Карбонат кальция (углекислый кальций) - неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула - CaCO3. В природе встречается в виде минералов - кальцита, арагонита, является главной составной частью известняка, мела и мрамора. Нерастворим в воде и этаноле.
Очищенный от посторонних примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве. Производители бумаги используют карбонат кальция одновременно в качестве отбеливателя, наполнителя (заменяя им дорогостоящие волокна и красители), а также раскислителя. Производители стеклянной посуды, бутылок, стекловолокна используют карбонат кальция в огромных количествах в качестве источника кальция - одного из основных элементов, необходимых для производства стекла. Широко используется при производстве продукции личной гигиены (например, зубной пасты), и даже в медицинской промышленности. В пищевой промышленности часто используется в качестве антислеживающего агента и разделителя в сухих молочных продуктах. При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей.
Производители пластмассы - одни из основных потребителей карбоната кальция (более 50% всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида, полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно - это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т. п. Карбонат кальция составляет порядка 20 % красящего пигмента, используемого при производстве красок.
Строительство - еще один из основных потребителей карбоната кальция. Шпатлевки, различные герметики - все они содержат карбонат кальция в значительных количествах. Также, карбонат кальция является важнейшим составным элементом при производстве продукции бытовой химии - средств для чистки сантехники, кремов для обуви.
Карбонат кальция также широко используется в очистительных системах, как средство борьбы с загрязнением окружающей среды, при помощи карбоната кальция восстанавливают кислотно-щелочной баланс почвы.
Подавляющее большинство карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из чистого источника (как правило, мрамор).
Карбонат кальция может быть приготовлен кальцинацией оксида кальция. Вода добавляется к этому оксиду, давая гидроксид кальция, и затем проводится углекислый газ, который проходит через этот раствор для осаждения желаемого карбоната кальция:
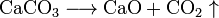
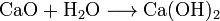
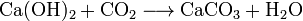
Химические свойства
При нагревании до 900−1000 C расщепляется на кислотный оксид - углекислый газ CO2 и оксид - негашёную известь CaO по уравнению:
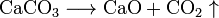 .
.
В воде с углекислым газом растворяется, образуя кислую соль - гидрокарбонат кальция Ca(HCO3)2:
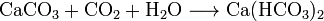 .
.
Существование именно этой реакции дает возможность образовываться сталактитам, сталагмитам и прочим красивейшим формам.
При 1500°C вместе с углеродом образует карбид кальция и оксид углерода (II)
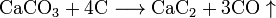 .
.
Контрольные вопросы:
-
в каких производствах применяют карбонат кальция?
-
расскажите о применении карбоната кальция в производстве пластмасс.
-
какой способ приготовления карбоната кальция?
-
с помощью какой реакции образуются сталактиты и сталагмиты?
Практическая часть
Опыт. В пробирку налейте 4-5 мл свежеприготовленного раствора гидроксида кальция (известковой воды) и осторожно через трубочку продувайте через него выдыхаемый воздух.
Оформление работы
Заполните таблицу.
№ п/п
Реактивы
Наблюдения
Уравнения
Выводы
название
формулы
Лабораторные работы № 3
«Получение эмульсии моторного масла. Ознакомление со свойствами дисперсных систем»
Цель: ознакомиться с получением эмульсий и свойствами дисперсных систем.
Оборудование и реактивы: пробирки, эмульсии, суспензии, пасты, гели
Теоретическая часть
Некоторые жидкости трудно или совсем невозможно смешать. К ним относятся вода и жиры, вода и эфирные масла и др. Смеси таких веществ называются эмульсиями и потребность в них бывает очень велика.
Рассмотрим кратко области применения эмульсий.
1. В производствах, связанных с механической обработкой металлов эмульсии используются в качестве охлаждающих и смазывающих жидкостей. Эмульсии используются для получения высококачественных красок, лаков, шпаклёвочных материалов и т.п.
2. В медицине эмульсии имеют ряд преимуществ перед другими лекарственными формами одного и того же вещества: они быстро всасываются в организм при любом способе введения, смягчают раздражающее действие лекарственных веществ на слизистые оболочки, в форме эмульсий ускоряется процесс гидролиза жиров ферментами желудочно-кишечного тракта.
3. В пищевой промышленности и домашнем хозяйстве введение жира в виде эмульсий в фарш позволяет увеличить их водосвязывающую способность, улучшает качество фарша и производимых из него продуктов (например, колбас). Многие вещества в домашнем хозяйстве используются в виде эмульсий, например, различные майонезы, маргарины, кетчупы и т.п.
4. Дробление жировых частиц молока до микроскопических размеров, т.е. получение мелкодисперсной жировой эмульсии, почти на треть повышает питательную ценность молока.
5. Введение в тесто жировых эмульсий вместо жира улучшает качество хлебобулочных изделий. Жировые эмульсии могут использоваться для смазки форм и листов в хлебопечении, сохраняя до 90% используемого в настоящее время жира.
6. В парфюмерном производстве очень эффективным является использование ароматических эмульсий эфирных масел.
Диспе́рсная систе́ма - это образования из двух или более числа фаз (тел), которые совершенно или практически не смешиваются и не реагируют друг с другом химически. Первое из веществ (дисперсная фаза) мелко распределено во втором (дисперсионная среда). Если фаз несколько, их можно отделить друг от друга физическим способом (центрифугировать, сепарировать и т. д.).
Классификация дисперсных систем
Обозначение
Дисперсная фаза
Дисперсионная среда
Название и пример
Г/Г
Газообразная
Газообразная
Дисперсная система не образуется
Ж/Г
Жидкая
Газообразная
Аэрозоли: туманы, облака
Т/Г
Твёрдая
Газообразная
Аэрозоли (пыли, дымы), порошки
Г/Ж
Газообразная
Жидкая
Газовые эмульсии и пены
Ж/Ж
Жидкая
Жидкая
Эмульсии: нефть, крем, молоко
Т/Ж
Твёрдая
Жидкая
Суспензии и золи: пульпа, ил, взвесь, паста
Г/Т
Газообразная
Твёрдая
Пористые тела
Ж/Т
Жидкая
Твёрдая
Капиллярные системы: жидкость в пористых телах, грунт, почва
Т/Т
Твёрдая
Твёрдая
Твёрдые гетерогенные системы: сплавы, бетон, ситаллы, композиционные материалы
Практическая часть
Приготовьте небольшую коллекцию образцов дисперсных систем из имеющихся дома суспензий, эмульсий, паст и гелей. Каждый образец снабдите фабричной этикеткой. Поменяйтесь с соседом коллекциями и затем распределите образцы коллекции в соответствии с классификацией дисперсных систем.
Ознакомьтесь со сроками годности пищевых, медицинских и косметических гелей. Каким свойством гелей определяется срок годности?
Лабораторные работы № 4
«Химические свойства кислот»
Цель: закрепить знания и умения по следующим вопросам: кислоты, химические свойства кислот.
Оборудование и реактивы: растворы соляной, серной, азотной кислот, раствор лакмуса, цинк, медь, оксид меди (II), спиртовка, раствор щелочи, фенолфталеин, сульфат меди (II), карбонат натрия, нитрат серебра, метиловый оранжевый.
Теоретическая часть
Кисло́ты - сложные вещества, в состав которых обычно входят атомы водорода, способные замещаться на атомы металлов, и кислотный остаток. Водные растворы кислот имеют кислый вкус, обладают раздражающим действием, способны менять окраску индикаторов, отличаются рядом общих химических свойств.
Определения кислот и оснований претерпели значительную эволюцию по мере расширения теоретических представлений о природе химической связи и механизмах химических реакций.
В 1778 французский химик Антуан Лавуазье предположил, что кислотные свойства обусловлены наличием в молекуле атомов кислорода. Эта гипотеза быстро доказала свою несостоятельность, так как многие кислоты не имеют в своём составе кислорода, в то время как многие кислородсодержащие соединения не проявляют кислотных свойств. Тем не менее, именно эта гипотеза дала название кислороду как химическому элементу.
В 1839 немецкий химик Юстус Либих дал такое определение кислотам: кислота - это водородосодержащее соединение, водород которого может быть замещён на металл с образованием соли.
Химические свойства
Взаимодействие с основными оксидами с образованием соли и воды:
CaO + 2 HCl = CaCl2 + H2O
Взаимодействие со щелочами с образованием соли и воды (реакция нейтрализации):
NaOH + HCl = NaCl + H2O
Взаимодействие с нерастворимыми основаниями с образованием соли и воды, если полученная соль растворима:
Cu (OH)2 + H2SO4 = CuSO4 + 2 H2O
Взаимодействие с солями, если выпадает осадок или выделяется газ:
BaCl2 +H2SO4 = BaSO4 + 2HCl
Металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (кроме азотной кислоты HNO3 любой концентрации и концентрированной серной кислоты H2SO4), если образующаяся соль растворима:
Mg + 2 HCl = MgCl2 + H2
Контрольные вопросы:
-
Что называют кислотами?
-
Какую гипотезу предложил Лавуазье?
-
Какое определение дал Либих кислотам?
-
расскажите о химических свойствах оснований.
Практическая часть
Опыт 1. Испытание растворов кислот индикаторами
В три пробирки налейте растворы соляной, серной и азотной кислот соответственно. Добавьте к ним по 2 - 3 капли раствора лакмуса. Повторите опыт с использованием раствора метилового оранжевого.
Опыт 2. Изучение взаимодействия металлов с растворами кислот
В две пробирки опустите соответственно гранулу цинка и кусочек меди и прилейте в каждую по 2 - 3 мл раствора соляной кислоты. Напишите уравнения реакций в молекулярной и ионной формах.
Опыт 3. Изучение взаимодействия оксида меди(II) с раствором кислоты
На донышко пробирки поместите небольшое количество черного порошка оксида меди(II). Затем прилейте в нее 2 мл раствора серной или соляной кислоты. Закрепите пробирку в держателе или в лапке штатива и нагрейте на пламени спиртовки. Напишите уравнение реакции в молекулярной и ионной формах.
Опыт 4. Изучение взаимодействия кислот с основаниями
В пробирку налейте 2-3 мл раствора щелочи и несколько капель фенолфталеина. Затем прилейте в пробирку раствор кислоты до полного обесцвечивания содержимого.
Получите нерастворимый гидроксид меди(II) реакцией обмена. С этой целью в пробирку с 2 - 3 мл раствора сульфата меди(II) прилейте 1 - 2 мл раствора щелочи. К полученному осадку прилейте раствор соляной или серной кислоты до полного его растворения. Объясните результаты наблюдений. Напишите уравнения реакций в молекулярной и ионной формах.
Опыт 5. Изучение взаимодействия кислот с солями
В пробирку с раствором карбоната натрия (1-2 мл) прилейте такой же объем раствора соляной кислоты.
В пробирку с раствором соляной кислоты добавьте несколько капель раствора нитрата серебра(I). Напишите уравнения реакций в молекулярной и ионной формах.
Оформление работы.
Заполните таблицу.
№ п/п
Реактивы
Наблюдения
Уравнения
Выводы
название
формулы
1
2
3
4
5
Лабораторная работа № 5
«Химические свойства оснований»
Цель: закрепить знания и умения по следующим вопросам: основания, химические свойства щелочей.
Оборудование и реактивы: хлорид аммония, раствор лакмуса, спиртовка, раствор щелочи, фенолфталеин, сульфат меди (II), метиловый оранжевый.
Теоретическая часть
Щёлочи - гидроксиды щелочных, щёлочноземельных металлов и аммония. К щёлочам относят хорошо растворимые в воде основания. При диссоциации щёлочи образуют анионы OH− и катион металла.
К щёлочам относятся гидроксиды металлов главных подгрупп I и II (начиная с кальция) периодической системы, например NaOH (едкий натр), KOH (едкое кали), Ba(OH)2 (едкий барит). Едкие щёлочи - тривиальное название гидроксидов лития LiOH, натрия NaOH, калия КОН, рубидия RbOH, и цезия CsOH.
Гидроксиды щелочных металлов (едкие щёлочи) представляют собой твердые, белые, очень гигроскопичные вещества. Щёлочи - сильные основания, очень хорошо растворимые в воде, причём реакция сопровождается значительным тепловыделением. Сила основания и растворимость в воде возрастает с увеличением радиуса катиона в каждой группе периодической системы. Самые сильные щёлочи - гидроксид цезия в группе I и гидроксид радия в группе II.
Химические свойства
1. изменение окраски индикатора
Фенолфталеин бесцветный становится малиновым, лакмус (фиолетовый) становится синим, что свидетельствует о наличии в растворе щелочей гидроксид-ионов OH-.
2. взаимодействие с кислотными и амфотерными оксидами
Ca(OH)2 + CO2 = CaCO3 + H2O 2 NaOH + ZnO = Na2ZnO2 + H2O
3. взаимодействие с солями
CuSO4 + NaOH = Cu(OH)2 + Na2SO4
4. взаимодействие с кислотами - реакция нейтрализации характерна для всех оснований
NaOH + HCl = NaCl + H2O
Едкий натр применяется во множестве отраслей промышленности и для бытовых нужд:
Каустик применяется в целлюлозно-бумажной промышленности, в производстве бумаги, картона, искусственных волокон, древесно-волоконных плит.
Для омыления жиров при производстве мыла, шампуня и других моющих средств. Продукты на основе гидроксида натрия (с добавлением гидроксида калия, нагретые до 50-60 градусов Цельсия, применяются в сфере промышленной мойки для очистки изделий из нержавеющей стали от жира и других маслянных веществ, а также остатков механической обработки.
В химических отраслях промышленности - для нейтрализации кислот и кислотных окислов, как реагент или катализатор в химических реакциях, в химическом анализе для титрования, для травления алюминия и в производстве чистых металлов, в нефтепереработке - для производства масел.
Для изготовления дизельного топлива.
Контрольные вопросы:
-
что такое щелочи?
-
расскажите о химических свойствах щелочей
-
где применяются щелочи?
Практическая часть
Опыт 1. Изучение изменения окраски индикаторов в щелочной среде
В три пробирки прилейте 2 - 3 мл раствора щелочи, затем добавьте в первую - несколько капель фенолфталеина, во вторую - небольшое количество раствора лакмуса, в третью - небольшой объем раствора метилового оранжевого.
Опыт 2. Изучение взаимодействия щелочей с солями
В пробирку прилейте 2 - 3 мл раствора хлорида аммония, а затем добавьте 1 - 2 мл раствора щелочи. Содержимое пробирки нагрейте, осторожно понюхайте выделяющийся газообразный продукт или поднесите к отверстию пробирки влажную лакмусовую бумажку. Напишите уравнения реакций в молекулярной и ионной формах.
Опыт 3. Изучение разложения гидроксида меди(II)
Пробирку с полученным предварительно осадком гидроксида меди(II) закрепите в держателе или лапке штатива и нагрейте. Напишите уравнение реакции.
Оформление работы.
Заполните таблицу.
№ п/п
Реактивы
Наблюдения
Уравнения
Выводы
название
формулы
1
2
3
Лабораторная работа № 6
«Химические свойства солей. Гидролиз солей различного типа»
Цель: закрепить знания и умения по следующим вопросам: соли, химические свойства солей.
Оборудование и реактивы: хлорид аммония, раствор лакмуса, цинк, медь, оксид меди (II), спиртовка, раствор щелочи, фенолфталеин, сульфат меди (II), карбонат натрия, нитрат серебра, метиловый оранжевый.
Теоретическая часть
Со́ли - класс химических соединений, к которому относятся вещества, состоящие из катионов металла и анионов кислотного остатка.
Химические свойства определяются свойствами катионов и анионов, входящих в их состав.
Соли взаимодействуют с кислотами и основаниями, если в результате реакции получается продукт, который выходит из сферы реакции (осадок, газ, мало диссоциирующие вещества, например, вода):
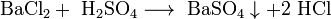
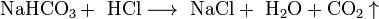
Соли взаимодействуют с металлами, если свободный металл находится левее металла в составе соли в электрохимическом ряде активности металлов:
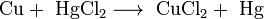
Соли взаимодействуют между собой, если продукт реакции выходит из сферы реакции (образуется газ, осадок или вода); в том числе эти реакции могут проходить с изменением степеней окисления атомов реагентов:
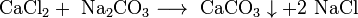
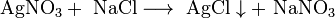
Некоторые соли разлагаются при нагревании:
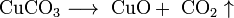
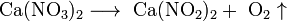
Применение солей
Соли повсеместно используются как в производстве, так и в повседневной жизни.
Соли соляной кислоты. Из хлоридов больше всего используют хлорид натрия и хлорид калия.
Хлорид натрия (поваренную соль) выделяют из озерной и морской воды, а также добывают в соляных шахтах. Поваренную соль используют в пищу. В промышленности хлорид натрия служит сырьём для получения хлора, гидроксида натрия и соды.
Хлорид калия используют в сельском хозяйстве как калийное удобрение.
Соли серной кислоты. В строительстве и в медицине широко используют полуводный гипс, получаемый при обжиге горной породы (дигидрат сульфата кальция). Будучи смешан с водой, он быстро застывает, образуя дигидрат сульфата кальция, то есть гипс.
Соли азотной кислоты. Нитраты больше всего используют в качестве удобрений в сельском хозяйстве. Важнейшим из них является нитрат натрия, нитрат калия, нитрат кальция и нитрат аммония. Обычно эти соли называют селитрами.
Из ортофосфатов важнейшим является ортофосфат кальция. Эта соль служит основной составной частью минералов - фосфоритов и апатитов. Фосфориты и апатиты используются в качестве сырья в производстве фосфорных удобрений, например, суперфосфата и преципитата.
Соли угольной кислоты. Карбонат кальция используют в качестве сырья для получения извести.
Карбонат натрия (соду) применяют в производстве стекла и при варке мыла.
Карбонат кальция в природе встречается и в виде известняка, мела и мрамора.
Контрольные вопросы:
-
что такое соли?
-
расскажите о химических свойствах солей.
-
как добывают хлорид натрия?
Практическая часть
Опыт 1. изучение реакции замещения меди железом
Налейте в пробирку 2-3 мл раствора сульфата меди (II) и опустите в него стальную кнопку или скрепку. Напишите уравнение реакции в молекулярной и ионной формах. Рассмотрите окислительно-восстановительные процессы.
Опыт 2. взаимодействие солей с солями
В три пробирки с растворами хлорида, фосфата и иодида натрия соответственно прилейте по несколько капель раствора нитрата серебра (I). Напишите уравнения реакций в молекулярной и ионной формах.
Оформление работы.
Заполните таблицу.
№ п/п
Реактивы
Наблюдения
Уравнения
Выводы
название
формулы
1
2
Лабораторные работы № 7:
«Реакции, идущие с образованием осадка, газа или воды»
Цель: экспериментально исследовать вопрос о возможности протекания реакций ионного обмена.
Оборудование и реактивы: штативы с пробирками, сульфат меди, сульфат алюминия, хлорид бария, карбонат натрия, карбонат кальция, гидроксид натрия, соляная кислота, универсальный индикатор.
Теоретическая часть.
Необходимым условием протекания обменных реакций в растворах электролитов является удаление из раствора тех или иных ионов вследствие образования малодиссоциированных соединений (слабые электролиты), газов или малорастворимых веществ (осадки).
Примеры реакций, протекающих практически необратимо:
1. образование малодиссоциираванпых соединений:
НСl + NaOН =НаС1 + Н2О
Н+ + Сl- + Nа+ + ОН- = Сl- + Nа+ + Н2О
Н+ + ОН- = Н2О
таким образом, сильные кислоты (основания) вытесняют слабые кислоты (основания) из растворов их солей;
2. образование нерастворимых и малорастворимых веществ:
FеС12 + 2NaОН = Fе(ОН)2↓ + 2NaС1
Fе2+ +2Сl- + 2Na+ + 2ОH- = Fе(ОН)2↓+ 2Сl- + 2Nа+
Fе2++ 2ОH- = Fе(ОН)2↓
3. образование газообразных веществ:
Na2S + 2НС1 = 2NaС1 + Н2S↑
2Na+ + S2- + 2Н+ + 2Сl- = 2Сl- +2Na+ +H2S↑
S2- + 2H+ = H2S↑
При выполнении работы следует помнить, что реакции ионного обмена - это процесс обмена ионами в ходе химической реакции обязательно приводящий к связыванию ионов в недиссоциирующее соединение.
При практическом выполнении задачи следует помнить следующее:
1. Нельзя проводить реакции в пробирках, в которых даны исследуемые вещества.
2. Для распознавания берется проба раствора исследуемого вещества.
Практическая часть.
Опыт 1. В одну пробирку налейте 3-4мл раствора сульфата меди (II), во вторую - столько же раствора сульфата алюминия. В первую пробирку добавьте немного раствора гидроксида натрия, во вторую - раствор хлорида бария.
Опыт 2. В одну пробирку налейте 3-4 мл раствора карбоната натрия, во вторую - положите кусочек мела. В каждую из них добавьте столько же серной кислоты.
Опыт 3. В одну пробирку налейте 3-4 мл раствора гидроксида натрия и проверьте реакцию среды. Затем прилейте такой же объём раствора соляной кислоты. В другую пробирку налейте примерно 10 мл сульфата меди (II) и добавьте немного гидроксида натрия. Образуется голубой осадок. Прилейте в пробирку серную кислоту до растворения осадка.
Оформление работы.
Заполните таблицу.
№ п/п
Реактивы
Наблюдения
Уравнения
Выводы
название
формулы
1
2
3
Лабораторная работа № 8
«Зависимость скорости взаимодействия цинка с соляной кислотой от ее концентрации. Зависимость скорости взаимодействия оксида меди(II) с серной кислотой от температуры»
Цель: уметь выявлять зависимость скорости взаимодействия реакции от концентрации и температуры
Оборудование и реактивы: раствор соляной кислоты, вода, цинк, оксид меди (II), раствор серной кислоты, спиртовка.
Теоретическая часть
Под скоростью химической реакции понимается изменение концентрации одного из реагирующих веществ или продуктов реакции в единицу времени.
Скорость одной и той же химической реакции в данных условиях - величина переменная, изменяющаяся по ходу реакции. Например, скорость реакции между цинком и соляной кислотой постоянно падает, т.к. со временем уменьшается концентрация кислоты. Скорость взаимодействия меди с азотной кислотой постоянно возрастает, т.к. продукты реакции (оксиды азота) ускоряют её.
В гомогенных системах реагирующие вещества равномерно перемешаны между собой, реакция идет по всему объему реакционной смеси. Поэтому концентрация каждого из веществ будет находиться как частное от деления количества вещества на объем смеси
С = n / V
Если в первый момент времени t1 концентрация вещества
C1 = n1 / V, а во второй t 2 концентрация C2 = n2 / V, то скорость реакции будет вычисляться по формуле
v = (n2 - n1) / V (t 2 - t1)
v = Δ С / Δ t , где Δ - разница второго и первого значения.
Для гомогенных реакций скорость химической реакции определяется изменением концентрации одного из веществ в единицу времени.
Скорость измеряется в моль / л сек или моль/ л мин и т.д.
Гетерогенные реакции идут только на границе раздела фаз: газ - твердое вещество, газ - жидкость, жидкость - твердое вещество. Скорость будет измеряться не в отношении к единице объема, а к единице площади соприкосновения реагирующих веществ
v = Δ n / S Δ t
Скорость каждой реакции при определенных условиях находят экспериментально.
На скорость гетерогенных реакций может влиять природа продуктов реакции. Скорость реакции также зависит от концентрации реагирующих веществ. Чем выше их концентрация, тем больше вероятность столкновения активных частиц, т. е. скорость реакции прямо пропорциональна концентрации реагирующих веществ.
Существует закон действующих масс:
Скорость гомогенной реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных коэффициентам перед формулами.
Если представить уравнение реакции в общем виде аА + вВ = сАВ,
то закон действующих масс можно записать так: v = k( A)a( B)b
Скорость реакций, имеющих газовую фазу, будет увеличиваться при повышении давления, т. к. это повышает концентрацию газообразного вещества.
Скорость реакции зависит от температуры. Чем она выше, тем больше в веществе активных частиц, выше скорости их движения и сильнее соударения, тем большее число соударений приводит к реакции, т. е. возрастает скорость реакции. Существует правило Вант-Гоффа:
При нагревании на каждые 10 0 С скорость химической реакции увеличивается в 2-4 раза.
Из всего выше сказанного следует:
на скорость химических реакций влияют такие факторы как природа реагирующих веществ, концентрация реагирующих веществ, температура, а также давление (для газообразных веществ) и измельчение твердых веществ (для гетерогенных реакций).
Контрольные вопросы:
-
что такое скорость химической реакции?
-
от чего зависит скорость химической реакции?
-
формулировка закона действующих масс
-
что представляет собой правило Вант-Гоффа?
Практическая часть
Опыт 1. изучение зависимости скорости химической реакции от концентрации
В три пробирки налейте соответственно 1, 2, 3 мл раствора соляной кислоты. В первую пробирку добавьте 2 мл воды, во вторую - 1 мл, затем в каждую из пробирок опустите по одной грануле цинка.
Опыт 2. изучение зависимости скорости химической реакции от температуры
В три пробирки поместите небольшое количество черного порошка оксида меди (II). В каждую пробирку прилейте по 2 мл раствора серной кислоты. Первую пробирку оставьте в штативе, вторую поместите в стакан с кипятком, третью закрепите в держателе и нагрейте на пламени спиртовки.
Оформление работы.
Заполните таблицу.
№ п/п
Реактивы
Наблюдения
Уравнения
Выводы
название
формулы
1
2
Лабораторные работы № 9
«Закалка и отпуск стали. Ознакомление со структурами серого и белого чугуна. Распознавание руд железа»
Цель: ознакомление с составом, свойствами и применением чугуна, легированных сталей и некоторых сплавов цветных металлов
Оборудование и реактивы: проволока из железа, меди, алюминия, свинца, олова, цинка, штатив, парафин, спиртовка, магнит.
Теоретическая часть
К сплавам относятся системы, состоящие из двух или нескольких металлов, а также из металлов и неметаллов, обладающие свойствами, присущими металлическому состоянию.
Сплавы можно классифицировать по следующим признакам:
1) по числу компонентов - на двойные, тройные и т. д.;
2) по структуре - на гомогенные (однофазные) и гетерогенные (смеси), состоящие из нескольких фаз;
3) по характеру металла, являющегося основой сплава,- на черные (сталь, чугун), цветные (сплавы алюминия, меди, никеля и т. д.);
4) по характерным свойствам - на тугоплавкие, легкоплавкие, жаропрочные, высокопрочные, твердые, коррозионно-устойчивые;
5) по технологическим признакам - на литейные (для изготовления деталей путем литья) и деформируемые (подвергаемые ковке, штамповке, прокату, прессованию и другим видам обработки)
Виды и свойства чугунов
Вид чугуна
Состав
Свойства
Применение
Серый чугун (с высоким содержанием кремния)
Белый чугун (с небольшим содержанием кремния)
Содержит 1,7-4,3%С, 1,25-4,0% Si и до 1,5% Мn. Большое содержание кремния снижает растворимость углерода. Поэтому углерод выделяется в виде графита
Содержит 1,7-4,3% С, более 4% Мп, но очень мало кремния. Углерод в основном содержится в виде цементита - карбида железа Fe3 С
Сравнительно мягкий и поддающийся механической обработке. Свободный углерод придает чугуну мягкость
Твердый и хрупкий. Эти свойства придает цементит, который обладает большой твердостью
Различные литые детали (шестерни, колеса, трубы и т. д.)
Переработка в сталь
Свойства некоторых легированных сталей и их применение
Легирующий элемент
Свойства, которые легирующий элемент придает стали
Применение
Хром
Твердость и устойчивость против коррозии
Инструменты, резцы, зубила
Никель
Вязкость, механическая прочность и устойчивость против коррозии
Турбины электростанций и реактивных двигателей, измерительные приборы, детали, используемые при высоких температурах
Марганец
Твердость, механическая прочность, устойчивость против ударов и трений
Детали дробильных установок, железнодорожные рельсы, зубья ковшей экскаваторов
Титан
Жаростойкость, механическая прочность при высоких температурах, устойчивость против коррозии
В самолето-, ракето- и судостроении. Химическая аппаратура
Вольфрам
Твердость и жаропрочность, износоустойчивость
Быстрорежущие инструменты, пилы, фрезы, штампы, нити электрических ламп
Молибден
Эластичность, жаростойкость, устойчивость против коррозии
В производстве лопастей турбин реактивных самолетов и автомобилей, броневые плиты, лабораторная посуда, детали электронных ламп
Кремний
Устойчивость к воздействию кислот
Трансформаторы, кислотоупорные аппараты и приборы
Ванадий
Высокая прочность, упругость и устойчивость к ударам
В производстве инструментальных сталей. Детали автомобильные, тракторные и других машин, подвергающиеся ударам
Сплавы некоторых цветных металлов
Название
Состав, %
Температура плавления, °C
Применение
Бериллиевая бронза
Сu (97,4-98),
Be (2-2,6)
1000
Пружины и инструменты, не образующие при ударе искр, струны музыкальных инструментов
Латунь
Сu (57-60),
Zn (40-43)
900
Детали механизмов и предметов быта
Нейзильбер
Сu (~65),
Zn (20),
Ni (15)
1040
Монеты
Константан
Сu (~60),
Ni (39-41),
Мn (0,4-0,6)
1270
Электроизмерительные приборы
Мельхиор
Сu (~80),
Ni (18,5-20,5),
Fe (0,1 - 1)
1170
Монеты и детали различных машин и инструментов
Никелин
Сu (65-67),
Ni (33-35),
Мn (0,4-0,6)
1250
Электрические нагреватели
Легкоплавкий сплав
Bi (36),
Pb (28),
Cd (6),
Hg (30)
48
Автоматические огнетушители и средства сигнализации, которая включается при достижении определенной температуры
Сплав Вуда
Bi (50),
Pb (25),
Sn (12,5),
Cd (12,5)
60,5
Электрон
Mg (86,5-96,6),
Al (3-10),
Zn (0,2-3),
Mn (0,15-0,5)
625
В ракетной технике, авиа- и автостроении
Контрольные вопросы:
-
что такое сплавы?
-
назовите признаки, по которым классифицируют сплавы.
-
назовите процентный состав латуни.
-
где применяется сплав Вуда?
Практическая часть
Опыт 1. Изучение пластичности, прочности на изгиб металлов
Закрепите проволоку одинаковой толщины и длины из железа, меди, алюминия, свинца, олова, цинка в лапке штатива и, одинаково изгибая ее на определенный угол, подсчитайте число сгибаний-разгибаний до разлома каждой проволоки. Расположите исследованные металлы в ряд по прочности на изгиб.
Опыт 2. Изучение теплопроводности металлов
Возьмите проволоку из алюминия, меди, железа одинаковой толщины и длины. Эти образцы проволоки скрепите с одного конца и раздвиньте их в виде веера. На другой конец образцов проволоки укрепите с помощью парафина или воска небольшие бумажные флажки. Нагревайте связанные концы образцов проволоки в пламени спиртовки и наблюдайте плавление воска и падение бумажных флажков. В каком порядке упали флажки с металлов? В том же порядке уменьшается их теплопроводность.
Опыт 3. Изучение магнитных свойств металлов
Одно из свойств металлов - способность притягиваться магнитом. Из наиболее распространенных металлов таким свойством обладают железо, кобальт, никель. Убедитесь в этом при помощи магнита и пластинок из указанных металлов.
Для каждого металла существует определенная температура, выше которой магнитные свойства теряются. Например, для никеля она равна всего 362 °С. Нагрейте пластинку из никеля в пламени спиртовки и убедитесь в том, что пластинка не притягивается к магниту. Магнитные свойства возвращаются к металлу после остывания.
Оформление работы.
Заполните таблицу.
№ п/п
Реактивы
Наблюдения
Уравнения
Выводы
название
формулы
1
2
3
Лабораторные работы № 10
«Изготовление моделей молекул органических веществ»
Цель: ознакомление с составом и химическим строением органических веществ
Оборудование и реактивы: карточка-задание, набор для моделирования.
Теоретическая часть
Свойства органических веществ определяются их составом и химическим строением. Поэтому неудивительно, что в основе классификации органических соединений лежит именно теория строения - теория А. М. Бутлерова. Классифицируют органические вещества по наличию и порядку соединения атомов в их молекулах. Наиболее прочной и малоизменяемой частью молекулы органического вещества является ее скелет - цепь атомов углерода. В зависимости от порядка соединения атомов углерода в этой цепи вещества делятся на ациклические, не содержащие замкнутых цепей атомов углерода в молекулах, и карбоциклические, содержащие такие цепи (циклы) в молекулах.
Помимо атомов углерода и водорода, молекулы органических веществ могут содержать атомы и других химических элементов. Вещества, в молекулах которых эти так называемые гетероатомы включены в замкнутую цепь, относят к гетероциклическим соединениям.
Гетероатомы (кислород, азот и др.) могут входить в состав молекул и ациклических соединений, образуя в них функциональные группы, например гидроксильную -ОН
Основные классы органических соединений
Название класса соединений
Функциональная группа или
наличие кратной связи
Пример соединения
Название соединения
Алканы,
CnH2n+2
Все связи С-С одинарные
СН3СН3
Этан
Алкены,
CnH2n
Одна двойная связь С=С
CH2 = CH2
Этен (этилен)
Алкины,
CnH2n-2
Одна тройная связь С≡С
СН≡СН
Этин
(ацетилен)
Алкадиены,
CnH2n-2
Две двойные связи
СН2=СН-СН=СН2
Бутадиен-1,3
Спирты
-ОН
гидроксильная
СН3СН2-OH
Этанол
Простые эфиры
-O- оксигруппа
СН3СН2-O-СН3СН2
Диметиловый эфир
Альдегиды

карбонильная
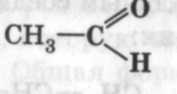
Уксусный альдегид, этаналь
Кетоны
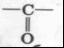
карбонильная
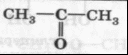
Ацетон, пропанон
Карбоновые кислоты
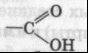
карбоксильная
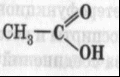
Уксусная кислота, этановая кислота
Сложные эфиры

сложно-эфирная
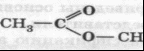
Метиловый эфир уксусной кислоты, метилацетат
Контрольные вопросы:
-
какая теория лежит в основе классификации органических веществ?
-
на какие соединения делятся органические вещества в зависимости от порядка соединения атомов в цепи?
-
перечислите функциональные группы.
Практическая часть
Построить модели молекул:
- метана
- этана
- пропена
- этилена
- бутадиена-1,3
- ацетилена
- пентина
Лабораторные работы № 11
«Ознакомление с коллекцией образцов нефти и продуктов ее переработки»
Цель: ознакомиться с коллекцией образцов нефти и продуктов ее переработки.
Оборудование и реактивы: коллекция образцов нефти и продуктов ее переработки.
Теоретическая часть
Нефть - природная маслянистая горючая жидкость, состоящая из сложной смеси углеводородов и некоторых других органических соединений. По цвету нефть бывает красно-коричневого, иногда почти чёрного цвета, хотя иногда встречается и слабо окрашенная в жёлто-зелёный цвет и даже бесцветная нефть; имеет специфический запах, распространена в осадочных породах Земли.
Цель переработки нефти (нефтепереработки) - производство нефтепродуктов, прежде всего, различных топлив (автомобильных, авиационных, котельных и т. д.) и сырья для последующей химической переработки.
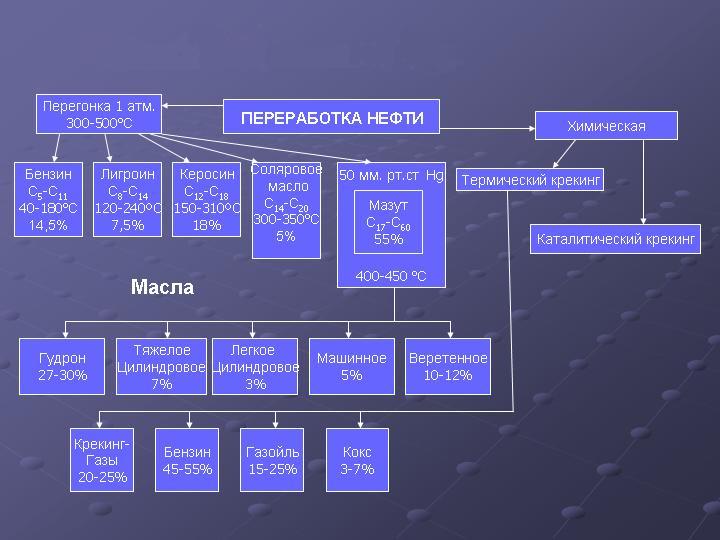
Первичная переработка нефти заключается в ее перегонке. Перегонку производят на нефтеперерабатывающих заводах после отделения попутных газов. При перегонке нефти получают светлые нефтепродукты: бензин, лигроин, керосин, газойль - соляровое масло, а в остатке - вязкую черную жидкость - мазут. Мазут подвергают дальнейшей переработке и выделяют смазочные масла: веретенное, машинное, цилиндровое и др. Из мазута некоторых сортов нефти выделяют вазелин и парафин. Остаток мазута после отгонки называют нефтяным пеком или гудроном.
Продукты перегонки нефти имеют различное применение.
Бензин используется как авиационное и автомобильное топливо.
Лигроин служит топливом для дизельных двигателей, а также растворителем в лакокрасочной промышленности.
Керосин применяется как горючее для реактивных и тракторных двигателей, а также для бытовых нужд.
Соляровое масло используется как моторное топливо, а смазочные масла - для смазки механизмов.
Вазелин используется в медицине.
Парафин применяется для пропитки древесины в производстве спичек и карандашей, для изготовления свечей, гуталина и т. д. Он состоит из смеси твердых углеводородов.
Гудрон - нелетучая темная масса, после частичного окисления применяется для получения асфальта.
Мазут помимо переработки на смазочные масла и бензин используется в качестве котельного жидкого топлива.
При вторичных методах переработки нефти происходит изменение структуры углеводородов, входящих в ее состав. Среди этих методов большое значение имеет крекинг (расщепление) углеводородов нефти, проводимый с целью повышения выхода бензина.
Термический крекинг проводится при нагревании исходного сырья (мазута и др.) при температуре 450-550°С и давлении 2-7 МПа. Таким способом получают главным образом автомобильный бензин. Термический крекинг открыт русским инженером В. Г. Шуховым в 1891 г.
Каталитический крекинг производится в присутствии катализаторов (обычно алюмосиликатов) при 450°С и атмосферном давлении. Этим способом получается авиационный бензин. Такому виду крекинга подвергается преимущественно керосиновая и газойлевая фракции нефти.
Важным каталитическим процессом является ароматизация углеводородов, т. е. превращение парафинов и циклопарафинов в ароматические углеводороды.
В последние годы (наряду с увеличением выработки топлива и масел) углеводороды нефти широко используются как источник химического сырья. Различными способами из них получают вещества, необходимые для производства пластмасс, синтетического текстильного волокна, синтетического каучука, спиртов, кислот, синтетических моющих средств, взрывчатых веществ, ядохимикатов, синтетических жиров и т. д.
Контрольные работы:
-
что такое нефть?
-
какие существуют способы переработки нефти?
-
что представляет собой первичная переработка нефти?
-
перечислите продукты перегонки нефти
-
расскажите о вторичном методе переработки нефти
Практическая часть
По выданным индивидуальным наборам, определить и описать продукты нефтепереработки.
Оформление работы.
Заполните таблицу.
№ п/п
Внешний вид
Выводы
цвет
консистенция
1
2
3
Лабораторная работа № 12
«Ознакомление с коллекцией каучуков и образцами изделий из резины»
Цель: ознакомиться с коллекцией каучуков и образцами изделий из резины.
Оборудование и реактивы: штатив для пробирок, пробирки, пробки корковые или пластиковые под пробирки, пипетка; образцы каучука и резины, бензин (керосин).
Теоретическая часть
Участники экспедиции Колумба в 1496 году, вернувшись из второго плавания в Америку, рассказывали, как индейцы острова Гаити играют темно-коричневыми шариками - мячами. Индейские мячи, ударившись о землю, подпрыгивают и скачут словно живые. Они совершенно не похожи на неуклюжие тряпичные или кожаные мячи европейцев. Гаитяне изготовляют это удивительные, прыгающие мячики из сока дерева, которое они называли "геве".
Эти деревья достигают 40 метров в высоту и до 2х метров в обхвате. Если сделать надрез будет сочится густой и белый, как молоко, сок. Индейцы называли сок гевеи - каа-о-чу, что значит "плач дерева", или "слёзы дерева". Они собирали каа-о-чу в чашки, сделанные из скорлупы орехов и давали ему постоять - сок густел. Затем перуанцы окунали в млечный сок гевеи форму, сделанную из глины. Сок облеплял её со всех сторон. Повторяя эту операцию несколько раз подряд, перуанцы получали плёнку нужной толщины, а затем коптили её в дыму костра и снимали изделие с формы, как чулок. Таким образом они изготовляли из сока гевеи калоши, бутылки, мячи.
К 1751 году каучук стал более известен. В Европе изделия из каучука (галоши, водонепроницаемая одежда) стали распространяться с начала XIX века. Но эти изделия были хороши и удобны лишь при умеренных температурах, в жаркое время они размягчались и становились липкими, а на морозе делались жёсткими и хрупкими. Устранить этот недостаток удалось, когда был открыт способ вулканизации каучука - превращение его в резину путём нагревания с серой.
Необходимость создания синтетических каучуков высокой эластичности встала перед учёными в связи с ограниченностью ресурсов натурального каучука. Гевея - основной источник натурального каучука - у нас не произрастает, и страна вынуждена была ввозить каучук из - за границы. В коллекции представлены образцы натурального и синтетических каучуков.
Бутадиеновый каучук имеет нерегулярное строение. Обладает водо- и газонепроницаемостью. По эластичности отстаёт от природного каучука. Используется для производства обуви, перчаток, детских игрушек, медицинских грелок, наружных оболочек кабелей и других предметов быта.
Бутадиенстирольный каучук обладает газонепроницаемостью, но недостаточно жароустойчив. Используется в производстве лент для транспортёров, автокамер.
Хлорпреновый каучук обладает хорошей эластичностью, высокой прочностью на истирание, разрыв и удар. Стоек и разрушающему действию многократных деформаций. Высокоустойчив к действию растворителей, тепла, света, озона.
Используется в производстве ремней, транспортных лент, изоляционных резин в кабельной промышленности, а также в производстве трубопроводов для перекачки бензина, нефти.
Изопреновый каучук имеет регулярное строение. По составу, структуре и эластическим свойствам близок к натуральному каучуку.
Используется в производстве автомобильных и авиационных шин.
Недостатком синтетического изопренового каучука является недостаточная стойкость по отношению к органическим растворителям (керосину, бензину) и недостаточное сохранение эластичности при низких температурах.
Резина представляет собой вулканизированный каучук (добавляют серу и наполнители; особенно важным наполнителем является сажа). Резина обладает лучшей эластичностью, большей прочностью по сравнению с каучуком, более устойчива к изменениям температуры.
Практическая часть
Опыт 1. Исследование эластичности
растяните выданные образцы каучука и резины, а затем отпустите.
Какой образец быстрее возвращается в исходное состояние и является более эластичным?
Попытайтесь растягивать образцы до их разрыва. Что прочнее: каучук или резина?
Опыт 2. Отношение к органическим растворителям
разместите в штативе для пробирок пробирки - 2шт.
налейте в пробирки выданные органические растворители бензин или керосин по 2-3 мл (40 - 60 капель).
Внесите в пробирки с растворителем: в одну - кусочек каучука, а во вторую - кусочек резины.
Закройте пробирки пробками и оставьте до следующего занятия.
Какие изменения произошли с образцами? Сделайте выводы.
Оформление работы.
Заполните таблицу.
№ п/п
Реактивы
Наблюдения
Уравнения
Выводы
название
формулы
1
2
Лабораторная работа №13
«Химические свойства спиртов. Растворение глицерина в воде и взаимодействие с гидроксидом меди(II)»
Цель: исследовать свойства предельных одноатомных спиртов и глицерина.
Оборудование и реактивы: штативы с пробирками, пипетки, пробки, этиловый спирт, кристаллический хлорид натрия концентрированная серная кислота, медная проволока, спиртовка, раствор хлорида (сульфата) меди (II); раствор гидроксида натрия; концентрированная серная кислота.
Теоретическая часть.
Спирты (алкоголи) - это производные углеводородов, содержащие в молекуле одну или несколько гидроксильных групп (-ОН) у насыщенного атома углерода
Общая формула: R - (OH)n , n = 1, где R - углеводородный радикал, n - число функциональных гидроксильных групп, которое определяет атомность спирта.
Классификация:
1. По характеру радикала
• Предельные (метанол СН3ОН)
• Непредельные (пропен-2-ол-1СН2=СН-СН2ОН)
• Ароматические (2-фенилэтанол С6Н5-СН2-СН2ОН)
2. По числу гидроксильных групп
• Одноатомные /олы (С2Н5ОН этанол / этиловый спирт)
• Многоатомные а) двухатомные /диолы (СН2(ОН)- СН2(ОН) этандиол-1,2 / этиленгликоль); б) трёхатомные / триолы (СН2(ОН) - СН(ОН) - (СН2(ОН) пропантирол-1,2,3 /глицерин)
3. По типу атома углерода, связанного с гидроксильной группой
• Первичные (пропанол-1/ пропиловый спирт СН3СН2СН2ОН)
• Вторичные (пропанол-2/ изопропиловый спирт СН3СН (ОН) СН3)
• Третичные (2-метилпропанол-2/ трет-бутиловый спирт CH3CH СН3СОН)
Изомерия: Структурная:
1. изомерия цепи;
2. положение гидроксильной группы;
3. межклассовая (с простыми эфирами)
ПРЕДЕЛЬНЫЕ ОДНОАТОМНЫЕ СПИРТЫ.
Физические свойства: Низшие спирты - жидкости, высшие с числом углеродных атомов больше 12 - твердые вещества. Низшие имеют характерный алкогольный запах и жгучий вкус. Все спирты легче воды. Растворимость их в воде уменьшается с ростом молекулярной массы. Метиловый и этиловый спирты смешиваются с водой в любых отношениях.
Методы получения:
1. Гидратация алкенов
2. Гидролиз галогеноалканов.
CН3- СН2 - С1 + NаОН = СН3 - СН2 -ОН + NаС1
Химические свойства:
1. Взаимодействие с галогеноводородами
С2Н5ОН + НВг = С2 Н5Вг + Н2О
2. Взаимодействие многоатомных спиртов с гидроксидом меди (II)
Сu SО4 + 2NаОН = Сu(ОН)2 + Nа2 S04
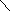
Контрольные вопросы:
-
что такое спирты?
-
расскажите о классификации спиртов
-
расскажите о методах получения
Практическая часть
Опыт 1. Получение хлорэтана из этилового спирта.
К хлориду натрия (кристал.) прилейте 3 капли этилового спирта и 3 капли концентрированной серной кислоты. Смешайте содержимое. Укрепите пробирку в штативе и начинайте осторожно нагревать. Лучинкой подожгите у отверстия пробирки образующийся хлорэтан. Обратите внимание на зелёное пламя кольцеобразной формы. После этого прекратите нагревание.
Опыт 2. К 0,5 мл воды в пробирке добавьте 2 капли глицерина, содержимое взболтайте. Прибавьте ещё каплю глицерина и снова взболтайте. Что можно сказать о растворимости глицерина?
Опыт 3. а) Налейте в пробирку 2 капли раствора сульфата меди(II) и добавьте ещё 4 капли раствора гидроксида натрия
б) К полученному осадку добавьте раствор глицерина (1) и тщательно перемешайте содержимое.
Опыт 4. Соберите прибор. Свободное колено дугообразной трубки закройте ватным тампоном. Налейте в дугообразную трубку насыщенного раствора поваренной соли по объёму столько, чтобы покрыть изгиб трубки. В пробирку налейте 3-4 мл смеси спирта, уксусной и серной кислот и для равномерного кипения добавьте немного речного песка. Реакционную смесь в пробирке нагрейте на слабом пламени. В левом колене дугообразной трубки образуется тонкий слой эфира на поверхности раствора. Закончив нагревание, выньте ватный тампон.
Оформление работы.
Заполните таблицу.
№ п/п
Реактивы
Наблюдения
Уравнения
Выводы
название
формулы
1
2
3
4
Дополнительные задания.
Составьте уравнение реакции бутена-2 с водой
Составьте уравнение реакции взаимодействия глицерина с азотной кислотой
Запишите формулы следующих веществ этандиол-1,2; бутен-1ол-2; 3-метилгексанол-1.
Лабораторная работа № 14
«Химические свойства карбоновых кислот»
Цель работы: ознакомиться со свойствами карбоновых кислот; изучить экспериментальным путём реакцию этерификации.
Оборудование и реактивы: пробирки, раствор уксусной кислоты, раствор гидроксида натрия, карбонат натрия, лакмус, пипетки, концентрированная серная кислота, этиловый спирт, уксусная кислота, насыщенный раствор поваренной соли.
Теоретическая часть
Карбоновые кислоты - производные алифатических и ароматических углеводородов, содержащих в молекуле карбоксильную группу ( - СООН)
Общая формула СnН2n+1 - СООН, где n ≥ 0
Номенклатура. В основе названий - название соответствующего углеводорода. Наличие карбоксильной группы отражается суффиксом -овая кислота. Нумерацию цепи всегда начинают с атома углерода карбоксильной группы.
Например: 4метил 2 этил пентановая кислота
СН3 - СН - СН2 - СН - СООН
СН3 С2Н5
Методы получения.
1 . Окисление первичных спиртов и альдегидов под действием окислителей:
R - СН2ОН + [О] → R - СНО+ [О] → R -СООН +Н2О
Химические свойства. Реакции с разрывом связи О - Н.
1 . Диссоциация: R - СООН -> Н+ + R -СОО-
2. Взаимодействие с металлами:
2СН3СООН + Мg → (СН3СОО)2 Мg + Н2
3.Взаимодействие с основными оксидами:
2СН3СООН + СаО → (СН3СОО)2 Са + Н2О
4. Взаимодействие с основаниями:
СН3СООН+ KOH → СН3СООK + Н2О
5. Взаимодействие с солями более слабых кислот:
СН3СООН + K2СО3 → 2СН3СООK + Н2О+ СО2
Реакции с разрывом связи С - О.
1. Взаимодействие со спиртами с образованием сложных эфиров (реакция этерификации): СН3СООН + С2Н5ОН -> 2СН3СОО С2Н5 + Н2О
Контрольные вопросы:
-
что такое карбоновые кислоты?
-
опишите методы получения карбоновых кислот.
-
расскажите о реакции с разрывом связи.
Практическая часть
Опыт 1. В пробирку поместите немного порошка магния и прилейте 10 капель разбавленной уксусной кислоты.
Опыт 2. Налейте в пробирку 10 капель раствора гидроксида натрия, добавьте каплю лакмуса.
Опыт 3. В пробирку налейте 10 капель уксусной кислоты и прибавьте 5-10 капель раствора карбоната натрия.
Опыт 4. Соберите прибор. Свободное колено дугообразной трубки закройте ватным тампоном. Налейте в дугообразную трубку насыщенного раствора поваренной соли по объёму столько, чтобы покрыть изгиб трубки. В пробирку налейте 3-4 мл смеси спирта, уксусной и серной кислот и для равномерного кипения добавьте немного речного песка. Реакционную смесь в пробирке нагрейте на слабом пламени. В левом колене дугообразной трубки образуется тонкий слой эфира на поверхности раствора. Закончив нагревание, выньте ватный тампон.
Оформление работы.
Заполните таблицу.
№ п/п
Реактивы
Наблюдения
Уравнения
Выводы
название
формулы
1
2
3
4
Лабораторная работа № 15
«Углеводы. Взаимодействие глюкозы и сахарозы с гидроксидом меди (II). Качественная реакция на крахмал»
Цель: экспериментально изучить качественные реакции на углеводы.
Оборудование и реактивы: раствор глюкозы, аммиачный раствор оксида серебра, гидроксид натрия, медный купорос, спиртовка, пробирки, раствор сахарозы, серная кислота, крахмал, спиртовой раствор иода.
Теоретическая часть
Углеводы - органические вещества, молекулы которых состоят из атомов углерода, водорода и кислорода, причем водород и кислород находятся в них, как правило, в таком же соотношении, как и в молекуле воды (2:1).
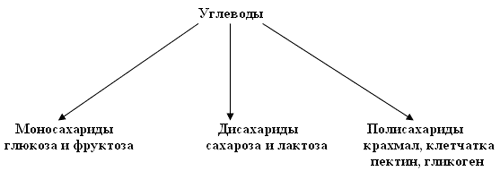
Моносахариды (простые углеводы) - углеводы, которые не гидролизуются. В зависимости от числа атомов углерода подразделяются на триозы, тетрозы, пентозы, гексозы. Для человека наиболее важны глюкоза, фруктоза, галактоза, рибоза, дезоксирибоза.
Дисахариды - углеводы, которые гидролизуются с образованием двух молекул моносахаридов. Наиболее важны для человека сахароза, мальтоза и лактоза.
Полисахариды - высокомолекулярные соединения - углеводы, которые гидролизуются с образованием множества молекул моносахаридов. Они делятся на перевариваемые и неперевариваемые в желудочно-кишечном тракте. К перевариваемым относят крахмал и гликоген, из вторых для человека важны клетчатка, гемицеллюлоза и пектиновые вещества.
Углеводы часто называют сахаристыми веществами или сахарами. Они могут быть безвкусными, сладкими и горькими. Если сладость раствора сахарозы принимать за 100 %, то сладость фруктозы - 173 %, глюкозы - 81 %, мальтозы и галактозы - 32 %, лактозы - 16 %.
ГЛЮКОЗА -
• бесцветное кристаллическое вещество,
• хорошо растворимо в воде,
• сладкое на вкус,
• температура плавления 146 С.
Химические свойства глюкозы.
Химические свойства глюкозы, как и любого другого органического вещества, определяются ее строением. Глюкоза обладает двойственной функцией, являясь и альдегидом, и многоатомным спиртом, поэтому для нее характерны свойства и многоатомных спиртов, и альдегидов.
Реакции глюкозы как многоатомного спирта
Глюкоза дает качественную реакцию многоатомных спиртов - со свежеполученным гидроксидом меди(II), образуя ярко-синий раствор соединения меди(II).
Глюкоза, подобно спиртам, может образовывать сложные эфиры.
Реакции глюкозы как альдегида
-
Окисление альдегидной группы. Глюкоза как альдегид способна окисляться в соответствующую (глюконовую) кислоту и давать качественные реакции альдегидов:
Реакция «серебряного зеркала»:
СН2ОН - (СНОН)4 - СОН + Ag2O = СН2ОН - (СНОН)4 - СООН + 2Ag![]()
Реакция со свежеполученным Cu(OH)2 при нагревании:
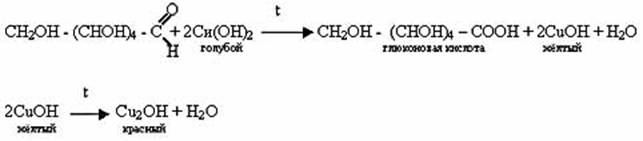
-
Восстановление альдегидной группы. Глюкоза может восстанавливаться в соответствующий спирт (сорбит):
CH2OH - (CHOH)4 COH + H2 → CH2OH - (CHOH)4 - CH2OH
Специфические свойства.
Большое значение имеют процессы брожения глюкозы, происходящие под действием органических катализаторов-ферментов (они вырабатываются микроорганизмами).
а) спиртовое брожение (под действием дрожжей)
С6Н12О6 -> 2С2Н5 ОН + 2СО2
б) молочнокислое брожение (под действием молочнокислых бактерий)
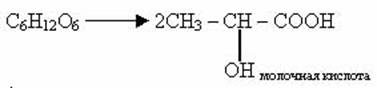
в) маслянокислое брожение

Применение глюкозы.
Глюкоза является основным источником энергии в живой клетке, поэтому она широко применяется в медицине при лечении самых различных заболеваний, особенно при общем истощении организма. Полученный восстановлением глюкозы сорбит используется при диабете в качестве заменителя сахара.
В микробиологической промышленности растворы глюкозы применяют как питательную среду для размножения кормовых дрожжей. Спиртовым брожением глюкозы получают пищевой этиловый спирт.
В кондитерской промышленности глюкоза в составе патоки используется при изготовлении мармелада, карамели, пряников и т.п.
Реакция «серебряного зеркала» глюкозы применяется при изготовлении зеркал и елочных украшений.
В текстильной промышленности глюкоза используется для отделки тканей.
Для всех этих целей глюкозу получают из крахмала, подвергая его гидролизу в присутствии минеральных кислот.
Контрольные вопросы:
1.что представляют собой углеводы?
2.на какие группы делятся углеводы?
3.какая реакция используется для обнаружения гидроксильных групп в углеводе?
4.какие реакции свойственны глюкозе как альдегиду?
5.что представляют собой специфические свойства глюкозы?
6.на чем основано применение глюкозы в медицине и промышленности?
Дополнительные задания
-
При молочном брожении 144 кг глюкозы получили 120 кг молочной кислоты. Какова массовая доля выхода молочной кислоты от теоретически возможного?
-
В процессе фотосинтеза зеленые растения нашей планеты ежегодно поглощают 100 млрд т углекислого газа. Какой объем кислорода выделяется в атмосферу при этом?
Практическая часть
Опыт 1. Действие аммиачного раствора оксида серебра на глюкозу.
В пробирку, содержащую 1-2 мл раствора глюкозы в воде, прилейте 1-2 мл аммиачного раствора оксида серебра и нагрейте пробирку на кипящей водяной бане.
Опыт 2. Действие гидроксида меди(II).
А) в пробирку прилейте 0,5 мл раствора глюкозы и 2 мл раствора гидроксида натрия. К полученной смеси добавьте 1 мл раствора медного купороса.
Б) к полученному раствору аккуратно добавьте 1 мл воды и нагрейте на пламени горелки пробирку, укрепив ее наклонно так, чтобы нагревалась только верхняя часть раствора. Прекратите нагревание, как только начнется изменение цвета.
Опыт 3. Действие аммиачного раствора оксида серебра на сахарозу.
А) в пробирку, содержащую 1-2 мл раствора сахарозы в воде, прилейте 1-2 мл аммиачного раствора оксида серебра и нагрейте пробирку на кипящей водяной бане.
Б) в пробирку, содержащую 1-2 мл раствора сахарозы в воде, добавьте несколько капель разбавленной серной кислоты и нагрейте на кипящей водяной бане в течение 5-10 мин. Затем охлажденный раствор доведите до слабощелочной реакции (проба на лакмус), добавив в пробирку раствор щелочи. К полученному раствору добавьте 1-2 мл аммиачного раствора оксида серебра и нагрейте пробирку на кипящей водяной бане.
Опыт 4. Действие иода на крахмал.
Приготовьте крахмальный клейстер по следующей методике: в стакан с 20 мл воды, нагретой до кипения, добавьте 2 г крахмала, хорошо размешайте образовавшуюся суспензию до образования прозрачного коллоидного раствора - крахмального клейстера. Налейте в пробирку 2-3 мл охлажденного клейстера и добавьте несколько капель спиртового раствора иода.
Оформление работы.
Заполните таблицу.
№ п/п
Реактивы
Наблюдения
Уравнения
Выводы
название
формулы
1
2
3
4
Лабораторная работа № 16
«Изучение свойств белков»
Цель: научиться определять наличие белковых соединений качественными реакциями.
Оборудование и реактивы: спиртовка, пробирки, азотная кислота(1:3), раствор гидроксида натрия, раствор сульфата меди, водный раствор яичного белка(1мл белка на 5мл насыщенного раствора поваренной соли).
Теоретическая часть
Белки - это природные высокомолекулярные соединения, структурной единицей которых являются аминокислоты.
Строение. Различают четыре уровня структурной организации белков.
Первичная структура белка - это число и последовательность аминокислотных остатков в полипептидной цепи.
Вторичная структура белка - это конформация полипептидной цепи, т.е. способ укладки (скручивания) цепи за счёт водородных связей, образующихся между группами N - Н, С=О.
Третичная структура белка - это пространственная конфигурация спирали. Это структура поддерживается за счет гидрофобных взаимодействий, ионных, водородных, дисульфидных связей.
Четвертичная структура белка - способ совместной укладки нескольких полипептидных цепей.
Химические свойства.
Специфические свойства.
1. Гидролиз (кислый, щелочной, ферментативный)
Белки + Н2О - Полипептиды + Н2О - Олигопептиды + Н2О - дипептиды + Н2О -аминокислоты.
2. Осаждение:
а) обратимое (высаливание);
б) необратимое (денатурация).
Денатурация - это разрушение их природной структуры с сохранением первичной структуры. Первичная структура разрушается при гидролизе.
3. Цветные реакции:
А) ксантопротеиновая реакция (на радикалы аминокислот, содержащих бензольное кольцо):
Белок + НNО3 (конц)---желтое окрашивание;
Б) биуретовая реакция (на пептидные связи):
Белок + СuSО4 + NаОН - ярко-фиолетовое окрашивание.
Контрольные вопросы:
1.что такое белки?
2.что представляют собой уровни организации белков?
3.дайте понятие денатурации.
4.расскажите о качественных реакциях белков.
ПРАКТИЧЕСКАЯ ЧАСТЬ.
Опыт 1. Денатурация белка.
Приготовьте раствор белка. Для этого белок куриного яйца растворите в 150 мл воды. В пробирку налейте 4-5 мл раствора белка и нагрейте на горелке до кипения. Отметьте помутнение раствора. Охладите содержимое пробирки. Разбавьте водой в 2 раза.
Опыт 2. Осаждение белка солями тяжелых металлов.
В две пробирки налейте по 1-2 мл раствора белка и медленно, при встряхивании, по каплям добавьте в одну пробирку насыщенный раствор медного купороса, а в другую - раствор ацетата свинца. Отметьте образование труднорастворимых солеобразных соединений белка. Данный опыт иллюстрирует применение белка как противоядия при отравлении солями тяжелых металлов.
Опыт 3. Цветные реакции белков.
-
Ксантопротеиновая реакция
В пробирку налейте 2-3 мл раствора белка и прибавьте несколько капель концентрированной азотной кислоты. Получившийся белый осадок нагрейте: окраска становится жёлтой.
-
Биуретовая реакция.
В пробирку налейте 2-3 мл раствора белка, 2-3 мл раствора сульфата меди и добавьте раствор щелочи до появления фиолетового цвета раствора.
ЭКСПЕРИМЕНТАЛЬНЫЕ ЗАДАЧИ.
ЗАДАЧА 1. В молоке содержатся белки (казеин, альбумин и др.). Докажите их наличие с помощью цветной реакции.
ЗАДАЧА 2. Вам выданы нити хлопчатобумажной и шерстяной ткани. Определите, где какие нити.
ЗАДАЧА 3. Выдано три пробирки с коллоидными растворами белка, крахмала, мыла. Определите на основании известных вам свойств этих веществ, в какой пробирке какое вещество.
ВАРИАНТ 1. ЗАДАЧА 1,3
ВАРИАНТ 2 ЗАДАЧА 2,3
Оформление работы.
Заполните таблицу.
№ п/п
Реактивы
Наблюдения
Уравнения
Выводы
название
формулы
1
2
3
4
5
Рекомендуемая литература
1. Ерохин Ю.М. Химия.- М., 2007.
2. Габриелян О.С. Химия: учеб. для студ. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. - М., 2007.
3. Габриелян О.С., Остроумов И.Г. Химия: Пособие для поступающих в вузы. - М., 2007.
4. Габриелян О.С., Остроумов И.Г., Введенская А.Г. Общая химия в тестах, задачах и упражнениях. - М., 2007.
Техника безопасности
-
Соблюдение требований настоящей инструкции обязательно для студентов, работающих в кабинете химии.
-
Допуск посторонних в кабинет в момент проведения эксперимента разрешается только с разрешения преподавателя химии.
-
Во время работы в кабинете студенты обязаны поддерживать порядок на рабочем месте.
-
Прежде чем приступить к выполнению работы, необходимо изучить по пособию порядок ее проведения. Следует соблюдать все указания преподавателя по безопасному обращению с реактивами, по методам нагревания, по наполнению сосудов и т.д.
-
Подготовленный к работе прибор необходимо показать преподавателю или лаборанту.
-
Запрещается проводить самостоятельно любой эксперимент, не предусмотренный данной работой.
-
Запрещается есть или пить в кабинете, загромождать проходы пакетами и сумками.
-
При получении травмы (порезы, ожоги), а также при плохом самочувствии студенты должны немедленно сообщить преподавателю или лаборанту.
-
Запрещается выносить из кабинета и вносить в него любые вещества без разрешения преподавателя.
-
О всех случаях, когда разлиты жидкости или рассыпаны твердые реактивы, нужно сообщить преподавателю или лаборанту.
Самостоятельно убирать любые вещества запрещается.
-
Обо всех неполадках оборудования, электросети, водопровода и т.д. необходимо ставить в известность преподавателя. Самостоятельно исправлять неисправность запрещается.
-
Запрещается оставлять нагревательные приборы без наблюдения.
-
По окончанию работы студенты обязаны вымыть руки с мылом.
-
При возникновении в кабинете аварийных ситуаций не допускать паники и подчиняться указаниям преподавателя.


