- Преподавателю
- Химия
- «Горение и медленное окисление. Оксиды. Тепловой эффект реакции. Термохимические уравнения» ( 8 класс)
«Горение и медленное окисление. Оксиды. Тепловой эффект реакции. Термохимические уравнения» ( 8 класс)
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Конспекты |
| Автор | Алистратенко Е.В. |
| Дата | 23.01.2016 |
| Формат | docx |
| Изображения | Есть |
КГУ «Общеобразовательная средняя школа им. М.Кайырбаева»
Открытый урок по химии на тему:
«Горение и медленное окисление. Оксиды. Тепловой эффект реакции. Термохимические уравнения»
Учитель химии: Алистратенко Е.В.
2015-2016 УЧ.ГОД
Тема урока: Горение и медленное окисление. Оксиды. Тепловой эффект реакции. Термохимические уравнения.
Цель урока
Образовательные: сформировать знания о реакциях горения, условиях их протекания и прекращения, знания о тепловом эффекте химической реакции, экзо - и эндотермических реакциях, термохимических уравнениях, закрепить навыки составления химических уравнений реакций горения;
Развивающие: развивать внимание, память, логическое мышление, продолжить формирование умений сравнивать, делать выводы;
Воспитательные: воспитывать интерес к предмету химии, коллективизм, стремление самому добывать знания. Содействовать развитию внимательности, инициативности, трудолюбия, творческих способностей.
Тип урока: Изучение нового материала.
Оборудование: таблица ПСХЭ ДИ Менделеева, интерактивная доска,
Реактивы: лабораторные стаканы, раствор лимонной кислоты, сода, натрий, вода
Ожидаемый результат:
Знать: понятия «реакция горения», «тепловой эффект химической реакции», « экзо и эндотермической реакции
Уметь: составлять термохимические уравнения, определять тип реакции по тепловому эффекту.
Владеть терминологией, изученной во время урока.
Ход урока:
Этапы
Время
Деятельность учителя
Деятельность учащихся
1.Орг.момент
3 мин
.Создание колоборативной среды Разминка «Найди пару». ( карточки «Оксиды»: на одной формула, на другой название)
Психологический настрой на работу.
2. Актуализация опорных знаний
8 мин
Какую тему мы изучали на прошлом уроке? (Кислород).
Назовите химическую формулу кислорода. (О2).
Химический диктант по теме « Кислород»
Самооценка:
16-14 баллов- оценка « 5»
13-12баллов - оценка « 4»
11-9 баллов- оценка « 3»
8 и менее баллов оценка «2»
С какими веществами взаимодействует
кислород? (С простыми и сложными) Какие продукты получаются в результате реакций с кислородом? (Оксиды)
Что такое оксиды? (Это сложные вещества, состоящие из двух элементов, один из которых кислоро
Выполнение упражнений по теме : «Оксиды»
Выберите правильный ответ.
1. Формулы только оксидов приведены в ряду:
1) H2SO4, СаО, CuCl2 ;
2) Na2CO3, Na2O, N2O5 ;
3) Р2О5, BaO, SO3;
4) NaOH, Na2O, Cu(OH)2.
2. Формулы только основных оксидов приведены в ряду:
1) СО2, СаО, СuО ;
2) СО2, Na2O, N2O5;
3) Р2О5, BaO, SO3 ;
4) СаО, Na2O, CuO .
3. Формулы только кислотных оксидов приведены в ряду:
1) СО2, SO2, SO3;
2) СО2, Na2O, N2O5;
3) Р2О5, BaO, SO3 ;
4) CaO, Na2O, CuO .
4. Из приведенных формул веществ выпишите только те, которыми обозначены оксиды: NaCl, Na2O, НСl, Сl2О7, Са3(РО4)2, CaO, Р2О5, Н2О, Н3РО4
5. Запишите уравнения реакций получения оксидов: железа (II), алюминия, калия.
Определите тип реакции. Какие типы реакций вы еще знаете?
Как называются реакции взаимодействия веществ с кислородом?
( Горение, окисление ).
Какую химическую реакцию человек начал использовать с давних времён?
( Горение)
Для чего человеку нужен был огонь?
( Греться, готовить пищу ).
Беседа.
Работа в по карточкам, самооценка и оценка по ключу.
Беседа.
Фронтальная проверка
Самооценка:
7 баллов- оценка « 5»
6 баллов - оценка « 4»
5 баллов- оценка « 3»
4 и менее баллов оценка «2»
Работа на доске.
Итог повторения, выставление оценок.
Обсуждение.
3.Изучение нового материала.
10 мин
А сейчас мы узнаем, что теплота есть в любой химической реакции.
. 
Любая химическая реакция протекает или с выделением, или с поглощением теплоты, т.е. сопровождается тепловым эффектом. Тепловой эффект реакции обозначается Q . Уравнения реакций с указанием теплового эффекта называются термохимическими.
Реакции, протекающие с выделением теплоты, называются экзотермическими.
«Экзо» - наружу например:
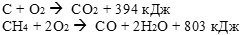
Демонстрационный опыт: вода + концентрированная серная кислота
Реакции, протекающие с поглощением теплоты, называются эндотермическими.
«Эндо» - внутрь например:
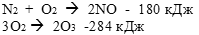
Демонстрационный опыт: вода + соль ( нитрат аммония )
Запись в тетради.
Обсуждение , выход на цель урока.
Запись в тетради, демонстрация опытов, презентация
4. Первичная проверка знаний.
5 мин
Проверочная работа :
« Термохимические уравнения».
1. Заполни пропуски
Реакции, протекающие с выделением теплоты и света, называют реакциями
…. Это реакции ….
Выберите пропущенные слова (укажи буквы, соответствующие по смыслу пропускам):
а) разложения;
б) горения;
в) эндотермические;
г) экзотермические.
2. Какие схемы можно назвать термохимическими уравнениями реакций?
а) 2 H2(г) + O2(г) = 2 H2О(ж) + 572 кДж
б) 2 H2 + O2 = 2 H2О + 572 кДж
в) 2 H2(г) + O2(г) = 2 H2О(ж)
г) H2 + O2 -> H2О + 572 кДж
3. Какая запись, соответствует эндотермической реакции?
а) С(тв) + O2(г) = СO2(г) + 394 кДж
б) СаСO3 = СO2 + СаО - 310 кДж
г) Н2 + I2 = 2HI - 52 кДж
д) 3Fe + O2 = Fe3O4 + 118 кДж
4. Установите соответствие между схемой реакции и её типом:
А) СH4(г) + 2 O2(г) = СO2(г) + 2 H2О(ж) + 890 кДж
Б) 2 H2О = 2 H2 + О2 - 572 кДж
1. Эндотермическая реакция
2. Экзотермическая реакция
Вывод:
- Как классифицируются реакции по тепловому эффекту?
- Что такое тепловой эффект реакции?
- Чем отличаются термохимические уравнения
Парная работа.
Самооценка .
7 баллов- оценка « 5»
6 баллов - оценка « 4»
5 баллов- оценка « 3»
4 и менее баллов оценка «2»
Обсуждение.
5. Физминутка
2 мин
Игра « Молекулы-атомы».
Деление на группы
3.Изучение нового материала.
6
мин
Горение и медленное окисление.
( работа с допол.материалом)
( Прием « Инсерт)
٧ - уже знал
+ - новое
- - думал иначе
? - не понял, есть вопросы
Обсуждение.
6.Вывод по теме урока:
3 мин

Учащиеся самостоятельно формулирует вывод урока.
8. Инф. О дом задании
2 мин
Параграф 27, стр 70 упр.6
Творческое задание: Озон и значение озонового слоя Земли.( сообщение или презентация)
Запись в тетрадь или в дневник.
9.Рефлексия
4 мин
Заполнить оценочный лист по критериям, разработанным учителем.
Ученики заполняют оценочный лист.
2 мин

Выставляют оценки на стикеры и вывешивают на звездочку.
Приложение 1.
Горение и медленное окисление.
Горение - это первая химическая реакция, с которой познакомился человек. Огонь… Можно ли представить наше существование без огня? Он вошел в нашу жизнь, стал неотделим от нее. Без огня человек не сварит пищу, сталь, без него невозможно движение транспорта. Огонь стал нашим другом и союзником, символом славных дел, добрых свершений, памятью о минувшем.
Раз в четыре года в мире происходит событие, сопровождающееся переносом «живого» огня. В знак уважения к основателям олимпиад огонь доставляют из Греции. По традиции один из выдающихся спортсменов доставляет этот факел на главную арену олимпиады.
Об огне сложены сказки, легенды. В старину люди думали, что в огне живут маленькие ящерицы - духи огня. А были и такие, которые считали огонь божеством и строили в его честь храмы. Сотни лет горели в этих храмах, не угасая, светильники, посвященные богу огня. Поклонение огню было следствием незнания людьми процесса горения.
М.В.Ломоносов говорил: «Изучение природы огня и без химии предпринимать отнюдь невозможно».
Горение - реакция окисления, протекающая с достаточно большой скоростью, сопровождающаяся выделением тепла и света.
Схематически этот процесс окисления можно выразить следующим образом:
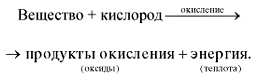
Реакции, протекающие с выделением теплоты, называются экзотермическими (от греч. «экзо» - наружу).
При горении идет интенсивное окисление, в процессе горения появляется огонь, следовательно, такое окисление протекает очень быстро. Если скорость реакции окажется достаточно большой? Может произойти взрыв. Так взрываются смеси горючих веществ с воздухом или кислородом. К сожалению, известны случаи взрывов смесей воздуха с метаном, водородом, парами бензина, эфира, мучной и сахарной пылью и т.п., приводящие к разрушениям и даже человеческим жертвам.
Для возникновения горения необходимы:
-
горючее вещество
-
окислитель (кислород)
-
нагревание горючего вещества до температуры воспламенения
Температура воспламенения у каждого вещества различна.
В то время как эфир может воспламениться от горячей проволоки, для того чтобы поджечь дрова, нужно нагреть их до нескольких сот градусов. Температура воспламенения веществ различна. Сера и дерево воспламеняются при температуре около 270 °С, уголь - около 350 °С, а белый фосфор - около 40 °С.
Однако не всякое окисление непременно должно сопровождаться появлением света.
Существует значительное число случаев окисления, которые мы не можем назвать процессами горения, ибо они протекают столь медленно, что остаются незаметными для наших органов чувств. Лишь по прошествии определенного, часто весьма продолжительного времени мы можем уловить продукты окисления. Так, например, обстоит дело при весьма медленном окислении (ржавлении) металлов или при процессах гниения.
Разумеется, при медленном окислении выделяется теплота, но это выделение вследствие продолжительности процесса протекает медленно. Однако сгорит ли кусок дерева быстро или подвергнется медленному окислению на воздухе в течение многих лет, все равно - в обоих случаях при этом выделится одинаковое количество теплоты.
Медленное окисление - это процесс медленного взаимодействия веществ с кислородом с медленным выделением теплоты (энергии).
Примеры взаимодействия веществ с кислородом без выделения света: гниение навоза, листьев, прогоркание масла, окисление металлов (железные форсунки при длительном употреблении становятся тоньше и меньше), дыхание аэробных существ, т. е. дышащих кислородом, сопровождается выделением теплоты, образованием углекислого газа и воды.
Познакомимся с характеристикой процессов горения и медленного окисления приведённой в таблице.
Характеристика процессов горения и медленного окисления
Признаки реакции
Процесс
Горение
Медленное окисление
Образование новых веществ
Да
(оксиды)
Да
(оксиды)
Выделение теплоты
Да
Да
Скорость выделения теплоты
Большая
Небольшая
(идет медленно)
Появление света
Да
Нет
Вывод: реакции горения и медленного окисления - это экзотермические реакции, отличающиеся скоростью протекания этих процессов.
Приложение 2.
Лист самооценки
Оценочный лист ученика 8 а класса_____________________________________________________
по теме : «Горение и медленное окисление. Оксиды. Тепловой эффект реакции. Термохимические уравнения.»
№
Этапы урока
Кол-во баллов
оценка
1
Химический диктант « Кислород»
2
Упражнения « Оксиды»
3
Проверочная работа « Термохимические уравнения».
Итоговая оценка за урок
Приложение 3.
CO
оксид углерода ( II )
NO
оксид азота ( II )
N2O5
оксид азота (V )
Fe2O3
оксид железа (III )
CrO3
оксид хрома (VI )
Mn2O7
оксид марганца (VII )
SiO2
оксид кремния
Al2O
оксид алюминия
ZnO
оксид цинка
№2. Головоломка «Не повторяющиеся буквы».
Для решения этой головоломки внимательно просмотри каждую строчку. Выбери из них ни разу не повторяющиеся буквы. Если ты сделаешь это правильно, то сможешь из этих букв составить пословицу о правилах обращения с огнем.

13


