- Преподавателю
- Химия
- Материал у урокам Кейсы по химии
Материал у урокам Кейсы по химии
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Афанасьева М.Н. |
| Дата | 14.09.2015 |
| Формат | docx |
| Изображения | Есть |



Министерство образования и науки Российской Федерации
Комитет образования и науки Курской области
Комитет образования города Курска
Муниципальное бюджетное общеобразовательное учреждение
«Средняя общеобразовательная школа
с углубленным изучением отдельных предметов
№ 53» города Курска
«Современные образовательные технологии: 17 + 3 кейсов по химии»
Афанасьева Маргарита Николаевна
заместитель директора
по учебно - воспитательной работе,
учитель химии и биологии
МБОУ «Средняя общеобразовательная школа
с углубленным изучением отдельных предметов
№ 53» города Курска
E - mail: [email protected]
Сайт: nsportal.ru/afanasieva53/
СОДЕРЖАНИЕ
Современные образовательные технологии…………………….………………3
8 класс
-
Разделение смесей веществ………………………………………………..6
-
Физические и химические явления……………………………..………..12
-
Атомы. Знаки химических элементов……………………...……………15
-
Типы химических реакций…………………………………….…………19
-
Получение кислорода…………………………………………….……….30
-
Вода…………………………………………………………………...……33
9 класс
-
Скорость химических реакций………………………………….………..39
-
Кальций……………………………………………………………...……45
-
Алюминий……………………………………………………...………….50
10 класс
-
Коррозия металлов………………………………………………..………55
-
Изомеры. Гомологи………………………………………………….……60
-
Структурная теория органических соединений. Основные классы органических соединений……………………………………………………….65
11 класс
-
Сложные эфиры……………………………………………….………….72
-
Жиры……………………………………………………………………….76
-
Углеводы. Глюкоза……………………………………………..…………82
-
Амины. Анилин………………………………………………..………….86
-
Химия в строительстве………………………………………...…………92
+++
+1. Соединения кальция и их использование в строительстве (9 класс)..…95
+2. Зеленая химия (11 класс)…………………………………………..……….99
+3. Счастье на свалке (11 класс)…………………………………………..…..104
"Как зритель, не видевший первого акта,
в догадках теряются дети.
И все же они ухитряются как-то
понять, что творится на свете"
С.Маршак
Современные образовательные технологии
Образование - это индустрия, направленная в будущее (С.П.Капица).
В настоящее время в условиях современной школы методика обучения переживает сложный период, связанный с изменением целей образования, разработкой ФГОС нового поколения, построенного на компетентностном подходе. Трудности возникают и в связи с тем, что в базисном учебном плане сокращается количество часов на изучение отдельных предметов, в том числе и дисциплин естественнонаучного цикла. Все эти обстоятельства требуют новых педагогических исследований в области методики преподавания предметов, поиска инновационных средств, форм и методов обучения и воспитания, связанных с разработкой и внедрением в образовательный процесс современных образовательных и информационных технологий.
Для реализации познавательной и творческой активности школьника в учебном процессе используются современные образовательные технологии, дающие возможность повышать качество образования, более эффективно использовать учебное время и снижать долю репродуктивной деятельности обучающихся за счет снижения времени, отведенного на выполнение домашнего задания.
Исследовательские методы дают возможность обучающимся самостоятельно пополнять свои знания, глубоко вникать в изучаемую проблему и предполагать пути ее решения, что важно при формировании мировоззрения. Это важно для определения индивидуальной траектории развития каждого школьника.
Кейс-метод (case) как педагогическая технология
Кейс (с англ. - случай, ситуация) - это разбор ситуации или конкретного случая, деловая игра. Он может быть назван технологией анализа конкретных ситуаций, «частного случая». Суть технологии состоит в том, что в основе его используются описания конкретных ситуаций или случая (от английского «case» - случай). Представленный для анализа случай должен желательно отражать реальную жизненную ситуацию. Во-вторых, в описании должна присутствовать проблема или ряд прямых или косвенных затруднений, противоречий, скрытых задач для решения исследователем. В - третьих, требуется овладение предварительным комплексом теоретических знаний для преломления их в практическую плоскость решения конкретной проблемы или ряда проблем. В процессе работы над кейсом требуется часто дополнительная информационная подпитка самих участников работы над анализом ситуации. В конечном итоге обучающиеся находят собственные выводы, решения из проблемной ситуации, и часто, в виде неоднозначных множественных решений.
Данная педагогическая технология в корне интерактивна, так как изначально вводит обучаемых в процесс субъект - субъектных отношений, дает возможность обучающимся проявить активность, инициативу, самостоятельность в согласовании с мнениями со - товарищей, так и право каждого на собственное мнение. Однако, самое важное то, что данный подход направлен за пределы учебного пространства, выходит в сферу профессиональных решений проблем в данной области знаний, формирует интерес и профильную мотивацию. Здесь, как и в истинных инновационных технологиях, учебные знания и учебный процесс в целом не самоцель, а инструмент для включения ученика в компетентностное обучение.
Технология кейс - метода в образовании была разработана в 1920-х г. в обучении менеджменту в Гарвардской бизнес - школе. В мировой образо-вательной практике кейс широко распространился в 1970-1980-х годах.
Основными понятиями, используемыми в кейс - технологии, являются понятия «ситуация» и «анализ», а также производное от них - «анализ ситуации». Термин «ситуация» может пониматься как состояние, событие, действие, поворотный момент для принятия решения, набор определенных взаимосвязанных фактов, которое содержит в себе противоречие(я), необходимость оценки(ок) или способов выхода на новый уровень. При проведении учебного занятия на основе кейса, можно применять дополнительные варианты работы обучающихся.
Виды и содержание кейсов
1. Практические кейсы. Данные кейсы как можно реальнее должны отражать вводимую ситуацию или случай. Это исторический источник, реальный документ, статистика в динамике данных, даже вещественный артефакт или комплекс приведенных источников-компонентов кейса. Это кейс моделирования реального события в истории, экологического состояния локальной территории, или кейс моделирования технико-технологической проблемы, которую надо решить. Целью данного кейса является отработка навыков преломления учебных, предметных знаний и умений в постобразовательное, профессионально - деятельностное пространство реальной жизни.
2. Обучающие кейсы. Основной задачей их выступает обучение. Однако, степень реальности более сводится к типичным учебным ситуациям, в которых отрабатывается автоматизм навыков и способов поиска решений. В данных процессах важна отработка навыков синтеза, объединения частных случаев в типичные, закономерные с выделением общих признаковых элементов, причин и факторов, возможных последствий.
3. Научно-исследовательские кейсы ориентированы на включение ученика в исследовательскую деятельность. Например, на основе изучения всей доступной информации и работ ряда авторов, реконструкция события, ситуации в комплексе, разработка тематического проекта локального, регионального типа и пр.
В процессе подбора имеющихся или разработки кейса самим учителем, важно полностью переработать имеющийся текст. Во - первых, выбрать оптимальный объем кейс - текста. Для обучающихся 5-7 классов - не более 1 - 2 страниц. Для обучающихся старших классов вполне доступна работа с кейсами до 3-7 страниц текста, содержащими от 2 до 5 смысловых проблемных фрагментов. В состав кейса может быть включен небольшой вводный или дополняющий комментарий учителя.
Непременным требованием для работы с кейсом становятся вопросы или задания по тексту кейса. В качестве задания можно приложить самостоятельный сбор дополнительной информации самим учеником, задание по разработке компьютерной презентации или проекта.
Таким образом, кейс - технологии развивают умение:
-
анализировать и устанавливать проблему;
-
четко формулировать, высказывать и аргументировать свою позицию;
-
общаться, дискутировать, воспринимать и оценивать вербальную и невербальную информацию;
-
принимать решения с учетом конкретных условий и наличия фактической информации.
Кейс - технологии помогают:
-
понять, что чаще всего не бывает одного единственно верного решения;
-
выработать уверенность в себе и в своих силах, отстаивать свою позицию и оценивать позицию оппонента;
-
cформировать устойчивые навыки рационального поведения и проектирования деятельности в жизненных ситуациях.
8 класс
-
«Разделение смесей веществ» 8 класс
Кейс
В процессе жизнедеятельности современного человека образуется огромное количество бытовых отходов. Городской мусор содержит много ценных веществ: алюминий (фольга от чая, конфет), олово (консервные банки) и даже золото (негодные радиодетали, черепки тарелок с золотой каемкой). Однако переработкой мусора с целью выделения полезных материалов и веществ в городском хозяйстве почти не занимаются. Это связано с тем, что мусор - совершенно уникальная по количеству компонентов смесь. Выделение из нее веществ в чистом виде - дело очень трудоемкое и дорогое.
Пока не найдены эффективные и простые способы переработки мусора. Это дело будущего, однако вы уже сейчас можете предложить методы разделения некоторых компонентов отходов.
Задания
-
Вам выдана смесь поваренной соли, песка, железного порошка, деревянных опилок, моделирующая мусор, а также компоненты этой смеси в чистом виде. Попытайтесь найти простые и эффективные методы разделения этой смеси. Определите массовую долю каждого компонента в смеси.
-
Как вы думаете, будут ли другими методы разделения веществ, если вместо деревянных опилок в смеси присутствует медная стружка.
Информационный материал
§ 5, стр. 14 - 17
Пова́ренная соль (хлорид натрия, NaCl; употребляются также названия «хлористый натрий», «столовая соль», «каменная соль», «пищевая соль» или просто «соль») -пищевой продукт. В молотом виде представляет собой мелкие кристаллы белого цвета. Поваренная соль природного происхождения практически всегда имеет примеси других минеральных солей, которые могут придавать ей оттенки разных цветов (как правило, серого). Производится в разных видах: очищенная и неочищенная (каменная соль), крупного и мелкого помола, чистая и йодированная, морская, и так далее. 

Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в г на 100 г воды) равен 35,9 при 21 °C и 38,1 при 80 °C.
Песо́к - осадочная горная порода, а также искусственный материал, состоящий из зёрен горных пород. Очень часто состоит из почти чистого минерала кварца (вещество - диоксид кремния). Слово «песок» часто употребляется во множественном числе («пески»). Песок - это оксид кремния (IV) (диоксид кремния, кремнезём SiO2 -бесцветные кристаллы, tпл1713-1728 °C, обладают высокой твёрдостью и прочностью. Диоксид кремния SiO2 - кислотный оксид, не реагирующий с водой.
Железные порошки используются в различных отраслях металлургического производства в качестве высокочистого шихтового материала и легирующих добавок. Чистый железный порошок (магнетит) может использоваться в качестве магнитной добавки. 
Опи́лки - древесные частицы, образующиеся как отходы пиления, разновидность измельчённой древесины. Опилки являются отходами деревообрабатывающей промышленности, однако они нашли широкое применение в качестве топлива, для изготовления прессованных промышленных изделий, подстилки для животных, в качестве мульчирующего материала или как субстрат для мицелиев.
Опилки содержат около 70 % углеводов (целлюлоза и гемицеллюлоза) и 27 % лигнина. Баланс химических веществ: 50 % углерод, 6 % водород, 44 % кислород и около 0,1 % азот.
Медь - это пластичный переходный металл золотисто - розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко применяется человеком.
Медь - диамагнетик, слабо отталкивается от магнита. Очень слабо, в быту не чувствуется, фиксируется только приборами. Железо - парамагнетик, при комнатной температуре находится в ферромагнитной фазе. Все парамагнетики притягиваются к магниту, особенно сильно они притягиваются к магниту, когда находятся в ферромагнитной фазе. В этой фазе они могут оставаться намагниченными даже если выключить внешнее магнитное поле, то есть они могут быть постоянными магнитами.
Методы разделения смеси веществ
В природе нет чистых веществ, они встречаются в виде смесей. Смеси можно разделить на две большие группы: однородные и неоднородные.
СМЕСИ
Однородные (гомогенные)
Неоднородные (гетерогенные)
Однородными называют такие смеси, частицы в которых нельзя обна-ружить ни визуально, ни с помощью оптических приборов, поскольку вещества находятся в раздробленном состоянии на микроуровне
Неоднородными называют смеси, в которых частицы можно обнаружить либо визуально, либо с помощью оптических приборов. Причём эти вещества находятся в разных агрегатных состояниях (фазах)
Примеры смесей
Истинные растворы (поваренная соль + вода, раствор спирта в воде)
Суспензии (твёрдое+жидкость), например вода+песок
Твёрдые растворы, сплавы, например, латунь, бронза.
Эмульсии (жидкость+жидкость), например вода +жир
Газовые растворы (смеси любых количеств и любого числа газов)
Аэрозоли (газ+жидкость), например туман
Дистилляция (вода - поваренная соль)
Фильтрование (вода-песок)
Кристаллизация (вода-сахар)
Отстаивание (вода-мел)
Перегонка (нефть)
Магнитная сепарация (железо-медь)
Отстаивание - это способ, основанный на различной плотности веществ. Например, смесь растительного масла и воды можно разделить на масло и воду, дав смеси просто отстояться.


Фильтрование - это способ, основанный на различной способности фильтра пропускать вещества, из которых состоит смесь.
Например, с помощь фильтра можно отделить твердые примеси от жидкости.
Дистилляция (лат. distillatio - стекание каплями) - перегонка, испарение жидкости с последующим охлаждением и конденсацией паров. Различают дистилляцию с конденсацией пара в жидкость (при которой получаемый конденсат имеет усреднённый состав вследствие перемешивания) и дистилляцию с конденсацией пара в твёрдую фазу (при которой в конденсате возникает распределение концентрации компонентов). Продуктом дистилляции является конденсат или остаток (или и то, и другое) - в зависимости от дистиллируемого вещества и целей процесса. 
Выпаривание - это выделение нелетучих твердых веществ из раствора в летучем растворителе - в частности в воде.
Например, чтобы выделить соль, растворенную в воде, надо просто выпарить воду. Вода испарится, а соль останется.
Таким образом, не только неоднородные смеси (вода с частицами почвы), но и однородные смеси (растворы) могут быть разделены с помощью перегонки. Отстаиванием и фильтрованием однородные смеси (растворы) разделить невозможно.
Хроматогра́фия (от др.-греч. χρῶμα - цвет) - динамический сорбционный метод разделения и анализа смесей веществ, а также изучения физико-химических свойств веществ. Основан на распределении веществ между двумя фазами - неподвижной (твердая фаза или жидкость, связанная на инертном носителе) и подвижной (газовая или жидкая фаза). Название метода связано с первыми экспериментами по хроматографии, в ходе которых разработчик метода Михаил Цвет разделял ярко окрашенные растительные пигменты. 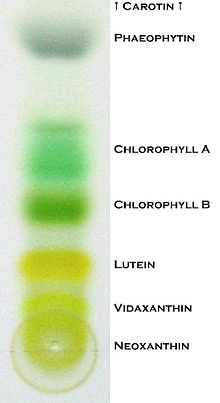
Обзор известных физических методов разделения смесей веществ, используемых в химии и химической технологии
Агрегатное сос-тояние составных частей смеси
Физическое свойс-тво, используемое для разделения
Метод разделения
Твердое - твердое
Плотность
Отстаивание, седиментация
Смачиваемость
Флотация, пенная флотация
Размер частиц
Просеивание
Растворимость
Экстракция, выщелачивание
Магнетизм
Магнитная сепарация
Твердое - жидкое
Плотность
Седиментация, декантация (сливание жидкости с осадка), центрифугирование
Температура кипения жидкости
Выпаривание, дистилляция, осушка
Размер частиц
Фильтрование
Растворимость твердого вещества
Кристаллизация
Твердое - газообразное
Плотность
Седиментация, центробежная сепарация
Размер частиц
Фильтрование
Электрический заряд
Электрофильтрование
Жидкое - жидкое
Плотность
Отстаивание (в делительной воронке, в маслоотделителе), центрифугирование
Температура кипения
Дистилляция
Растворимость
Экстракция
Плотность
Седиментация, центробежная сепарация
Жидкое - газообразное
Растворимость газа
Отгонка газа (путем повышения температуры), промывание с помощью другой жидкости
Газообразное - газообразное
Температура конденсации
Конденсация
Абсорбируемость
Абсорбция (поглощение объемом сорбента)
Адсорбируемость
Адсорбция (поглощение поверхностью сорбента)
Размер частиц
Диффузия
Масса
Центрифугирование
Массовой долей компонента в смеси называется число, показывающее, какую часть составляет масса компонента от общей массы смеси, принятой за единицу или 100%.
mк.с.
ω к.с. = ----------- ∙100%
mсмеси
Задача:
Для определения содержания драгоценных металлов в их сплавах широко применяется еще один вид концентрации - проба. Она показывает, сколько миллиграммов металла содержится в тысяче миллиграммов (т. е. одном грамме) сплава. Например, «золото 585-й пробы» - это далеко не чистое золото, а сплав золота, серебра и меди, в котором на 1000 мг сплава приходится всего 585 мг золота. Определите пробу и массовую долю золота в сплаве, для изготовления которого взяли 73 г золота, 12 г серебра, 10 г палладия, 6 г никеля и 13 г меди.
Решение:
m(сплава) = 73г + 12г + 10г + 6г + 13г = 114г
73г
ω (золота) = ----------- ∙100% = 64%
114г
Проба - 640
-
«Физические и химические явления» 8 класс
Кейс
В одном из пособий для трудовой школы по химии (1927 год) было дано задание: "Проследите со всею внимательностью все явления, которые происходят в то время, когда "ставится" самовар. Запишите, какие из этих явлений вы отнесете к физическим и какие - к химическим, начиная от наливания в самовар воды и закладки углей, не забыв зажигания спички и явлений, происходящих при этом, и кончая заваркой чая, наливанием его в стакан и растворением сахара. Обратите внимание, во что превратится уголь, не получилось ли радужных полос на медной крышке самовара около кувшина (внутренней трубы самовара)". 
Задания:
-
Разберите данную ситуацию, проведите ее анализ.
-
Какие явления называются физическими?
-
Какие явлениями называются химическими?
-
Составьте список последовательных действий при чаепитии.
-
Какие из перечисленных вами действий при чаепитии относятся к физическим, а какие - к химическим явлениям?
Информационный материал
§6 стр. 18-22
Всё, что нас окружает: и живая, и неживая природа, находится в постоянном движении и непрерывно изменяется: движутся планеты и звёзды, идут дожди, растут деревья. И человек, как известно из биологии, постоянно проходит какие-либо стадии развития. Перемалывание зёрен в муку, падение камня, кипение воды, молния, свечение лампочки, растворение сахара в чае, движение транспортных средств, молнии, радуги - это примеры физических явлений.
И с веществами (железо, вода, воздух, соль и др.) происходят разнообразные изменения, или явления. Вещество может быть кристаллизировано, расплавлено, измельчено, растворено и вновь выделено из раствора. При этом его состав останется тем же.
Так, сахарный песок можно измельчить в порошок настолько мелкий, что от малейшего дуновения он будет подниматься в воздух, как пыль. Сахарные пылинки можно разглядеть лишь под микроскопом. Сахар можно разделить ещё на более мелкие части, растворив его в воде. Если же выпарить из раствора сахара воду, молекулы сахара снова соединяться друг с другом в кристаллы. Но и при растворении в воде, и при измельчении сахар остаётся сахаром.
В природе вода образует реки и моря, облака и ледники. При испарении вода переходит в пар. Водяной пар - это вода в газообразном состоянии. При воздействии низких температур (ниже 0˚С) вода переходит в твёрдое состояние - превращается в лёд. Мельчайшая частичка воды - это молекула воды. Молекула воды является и мельчайшей частичкой пара или льда. Вода, лёд и пар не разные вещества, а одно и то же вещество (вода) в разных агрегатных состояниях.
Подобно воде, и другие вещества можно переводить из одного агрегатного состояния в другое.
Характеризуя то или другое вещество как газ, жидкость или твёрдое вещество, имеют в виду состояние вещества в обычных условиях. Любой металл можно не только расплавить (перевести в жидкое состояние), но и превратить в газ. Но для этого необходимы очень высокие температуры. Во внешней оболочке Солнца металлы находятся в газообразном состоянии, потому что температура там составляет 6000˚С. А, например, углекислый газ путём охлаждения можно превратить в «сухой лёд».
Явления, при которых не происходит превращений одних веществ в другие, относят к физическим явлениям.
Физические явления могут привести к изменению, например, агрегатного состояния или температуры, но состав веществ останется тем же.
Со всеми предметами, которые нас окружают, происходят различные изменения.
Если нагреть медную пластину на воздухе, она потеряет свой блеск и покроется налётом черного цвета, который можно легко соскоблить. Повторяя этот процесс много раз, можно всю медь превратить в чёрный порошок, этот порошок называется оксид меди. Оксид меди - это новое вещество, которое обладает новыми свойствами. И при охлаждении чёрный порошок снова не станет медью.
Лента металла магния, если её поджечь, горит с ярким, ослепительным светом. Получается новое вещество - оксид магния.
Возьмём стеклянную трубку и будем продувать воздух через раствор извести - известковую воду. Жидкость станет мутной, потому что в ней образуется белый порошок, похожий на мел. Постепенно этот порошок осядет на дно сосуда. Этот осадок является новым веществом, которое образовалось из растворённой в воде извести и углекислого газа.
Если нагреть сахар в пробирке, мы увидим, как он плавится и постепенно приобретает коричнево-бурый цвет с выделением едкого запаха. На стенках пробирке появятся капельки воды, несмотря на то, что сахар был совершенно сухим. В конце опыта сахар превратится в вещество чёрного цвёта, безвкусное и нерастворимое в воде - это уголь.
При горении древесины происходит выделение воды и углекислого газа. Мы не можем этого видеть, но если провести ряд экспериментов это станет очевидным. Если поднести горящую спичку к перевёрнутому стакану, на стенках стакана изнутри осядут капельки воды.
Что же общего в описанных явлениях? Во всех случаях из одних веществ получаются другие вещества. Все рассмотренные нами явления - это примеры химических явлений.
Химическими явлениями называются такие явления, при которых из одних веществ образуются другие вещества. Химические явления называют химическими реакциями.
-
«Атомы. Знаки химических элементов» 8 класс
Кейс
То кружились, то мелькали,
то водили хоровод,
то взрывались, то пылали,
то шипели, то сверкали,
то в покое пребывали
Алюминий, Натрий, Калий,
Фтор, Бериллий, Водород…
Перепутались все свойства,
недалеко от беды.
Вдруг команда: - Стройся, войско! -
Стали строиться в ряды.
Во втором ряду волненье:
все боятся окисленья. -
Поглядите! - злится Литий. -
Фтор ужасный окислитель!
Я не встану в этот ряд!
Пусть другие здесь горят! -
И Бериллий мрачно мыслит: -
Кислород нас всех окислит!
И, простите за повтор,
как несносен этот Фтор! -
Бор кивает головой,
но не рвется сразу в бой!
И Азот не лезет в спор.
Но зато взорвался Фтор: -
Ах! Так мы для вас не пара!
Кислород! Поддай им жару!
Окисляй! За мной! Вперед! -
Стойте! - крикнул Углерод. -
Я и уголь, и алмаз.
И за них я и за вас!
Я сражаться не горю,
я вас лучше помирю!
Встану я посередине!..
Третий ряд! Трубите сбор! -
Натрий, Магний, Алюминий,
Кремний, Фосфор, Сера, Хлор!
По порядку, по закону
элементы встали в ряд.
И выходит, что в колонне
все похожие стоят!
Кремний встал под Углеродом.
Сера схожа с Кислородом.
Алюминий встал под Бор -
замечательный подбор!
Ряд пристраивают к ряду.
А рядов - то десять кряду.
Металлы под металлами,
едкие под едкими,
ковкие под ковкими
идут своими клетками.
По порядку все стоит.
Вот Природы Алфавит!
Задания:
-
Дайте определение понятия «атом», «химический элемент».
-
Кем и когда были предложены термины «атом», «химический элемент»?
-
Сколько химических элементов встречается в природе, сколько синтезировано искусственно?
-
О скольких химических элементах рассказывается в стихотворении? Выпишите все химические элементы, о которых идет речь, используя таблицу химических элементов Д.И. Менделеева.
Информационный материал
§7 стр. 22 - 26 8 класс
А́том (от др.-греч. ἄτομος - неделимый) - частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств.
История становления понятий
Понятие об атоме как о наименьшей неделимой части материи было впервые сформулировано древнеиндийскими и древнегреческими философами. В XVII и XVIII веках химикам удалось экспериментально подтвердить эту идею, показав, что некоторые вещества не могут быть подвергнуты дальнейшему расщеплению на составляющие элементы с помощью химических методов. Однако в конце XIX - начале XX века физиками были открыты субатомные частицы и составная структура атома, и стало ясно, что атом в действительности не является неделимым.
На международном съезде химиков в Карлсруэ (Германия) в 1860 году были приняты определения понятий молекулы и атома. Атом - наименьшая частица химического элемента, входящая в состав простых и сложных веществ.
Латинское слово элемент (elementum) использовалось еще античными авторами (Цицерон, Овидий, Гораций), причем во многом в том же смысле, что и современное его значение - как часть чего-то (элемент речи, элемент образования и т.п.). Интересно происхождение названия этого слова. В древности было распространено изречение «Как слова состоят из букв, так и тела - из элементов». Отсюда - вероятное происхождение этого слова: по названию ряда согласных букв в латинском алфавите: l, m, n, t («el» - «em» - «en» - «tum»).
Близким по смыслу было у римлян слово principium в значении «составная часть», «начало». Древнеримский философ Тит Лукреций Кар в своей поэме «О природе вещей» часто употреблял термин principium (в переводе - «первоначало»). В этом смысле он очень близок современному «химическому» понятию элемента:
Что же до первоначал, то они еще больше имеют
Средств для того, чтоб из них возникали различные вещи,
Нет ни одной из вещей, доступных для нашего взора,
Чтоб она из начал состояла вполне однородных...
Первоначала вещей уносятся собственным весом
Или толчками других...
(О природе вещей. Тит Лукреций Кар)
Учение о том, что все вещества состоят из мельчайших частиц, получило название атомистической теории. Догадки древних, основанные лишь на размышлении, не так уж далеки, в принципе, от современных представлений: существует ограниченное число различных типов атомов (т.е. элементов), которые могут по-разному соединяться друг с другом, давая огромное разнообразие веществ с разными свойствами. А процесс перестройки взаимного расположения атомов составляет сущность химической реакции. Понятие об атомах, элементах - величайшее достижение человеческого разума. Очень образно об этом сказал лауреат Нобелевской премии по физике Ричард Фейнман: «Если бы в результате какой-то мировой катастрофы все накопленные научные знания оказались бы уничтоженными и к грядущим поколениям живых существ перешла бы только одна фраза, то какое утверждение, составленное из наименьшего количества слов, принесло бы наибольшую информацию? Я считаю, что это - атомная гипотеза (можно называть ее не гипотезой, а фактом, но это ничего не меняет): все тела состоят из атомов - маленьких телец, которые находятся в беспрерывном движении, притягиваются на небольшом расстоянии, но отталкиваются, если одно из них плотнее прижать к другому. В одной этой фразе... содержится невероятное количество информации о мире, стоит лишь приложить к ней немного воображения и чуть соображения».
Атомы одного сорта составляют химический элемент. Еще в 17 в. Роберт Бойль, а в следующем веке - М.В.Ломоносов и А.Л.Лавуазье ясно сформулировали понятие «элемент» как простое вещество, которое невозможно разложить на составные части химическими методами. Современное определение химического элемента очень лаконичное: элемент - это совокупность атомов с определенным зарядом ядра Z. Заряд ядра равен числу протонов в нем; именно оно определяет сущность химического элемента, его индивидуальность и отличие от всех других элементов. Поэтому следует признать, что и бесцветный легкий газ, состоящий из молекул Н2 и положительно заряженные катионы H+ в водных растворах кислот, и анионы H- в расплавах гидрида лития LiH, и протоны в физических ускорителях или в глубинах Солнца, и «холодные» нейтральные атомы Н в межзвездных пространствах - все это элемент водород (Z = 1). Более того, тяжелые разновидности водорода - дейтерий (D) и тритий (T), содержащие, помимо одного протона один или два нейтрона, а также искусственно полученные сверхтяжелые атомы 4H и 5H также относятся к элементу водороду.
Всего в природе найдено 90 различных элементов, и еще более 20 получено искусственно. В природе химические элементы входят в состав простых и сложных веществ. Простые вещества образованы атомами одного и того же химического элемента, тогда как сложные вещества содержат атомы двух и более элементов.
-
Типы химических реакций» 8 класс
Урок по химии по теме
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
8 класс
Тип урока:
урок изучения нового материала и закрепления полученных знаний.
Цель урока:
на основе имеющихся у обучающихся знаний об условиях, признаках протекания химических реакций обеспечить усвоение обучающимися понятия классификации химических реакций, деления их на типы.
Задачи:
-
Закрепить понятие «признаки химических реакций»;
-
Развить навыки проведения химических реакций, используя правила техники безопасности; развить логическое мышление при определении типа химической реакции;
-
Развить познавательную активность и творческие способности обучающихся при выполнении заданий.
-
Воспитывать чувство коллективизма и взаимопонимания при работе в творческих группах; воспитывать отношение к химии, как прикладной науке, при изучении применения ряда химических реакций.
ХОД УРОКА
Химия - наука древнейшая настолько, что невозможно установить, когда она возникла. К тому же это еще и божественная наука. 
Теологи прошлого утверждали, что химией интересовался уже Адам, которого привлекала проблема искусственного получения золота. 
В дальнейшем химическими экспериментами успешно занимался Иисус Христос, превращавший воду в вино.
А Моисей сумел перевести золотого тельца в жидкое состояние, растворив его в царской водке. Он также открыл ионообменники в процесс обессоливания воды. Первый ионообменный полимер Моисей с успехом применил, когда вел израильтян через пустыню. Он превратил горькую воду в пригодную для питья, погрузив в нее стволы старых гнилых деревьев. Действительно, в настоящее время наука подтвердила, что разлагающаяся целлюлоза является хорошим ионообменником для катионов магния. О химических превращениях свидетельствуют и другие библейские истории.
Если ко всему этому добавить, что первая химическая реакция, сознательно использовавшаяся человеком, - реакция горения - на самом деле пришла к нему с неба (в виде молнии), то вряд ли кто станет сомневаться, что химия имеет божественное происхождение и что именно она является наиболее древней наукой.
Самое интересное в окружающем нас мире - это то, что он очень сложно устроен, и к тому же постоянно меняется. Каждую секунду в нем происходит неисчислимое множество химических реакций, в результате которых одни вещества превращаются в другие. Человек сделал вдох - и в организме начались реакции окисления органических веществ. Он сделал выдох - и в воздух попал углекислый газ, который затем поглотится растениями и в них превратится в углеводы. Некоторые реакции мы можем наблюдать непосредственно, например ржавление железных предметов, свертывание крови, сгорание автомобильного топлива. Однако подавляющее большинство химических процессов остаются невидимыми, но именно они определяют свойства окружающего мира. Чтобы управлять превращениями веществ, необходимо как следует разобраться в природе подобных реакций. Для этого и нужна химия.
За то недолгое время, пока мы с вами изучаем химию, мы узнали о том, что существуют молекулы и атомы, химические реакции и физические явления, научились их различать, вычислять относительную атомную и молекулярную массы. И прежде чем, перейти к теме нашего урока, мы немного повторим то, что прошли.
Задание:
в верхней части листа записаны уравнения химических реакций, в нижней - беспорядочно расставлены точки с цифрами; каждой цифре соответствует сумма коэффициентов в вышенаписанных уравнениях реакций. Ваша задача: расшифровать замаскированный химический элемент. Для этого необходимо по порядку уравнивать химические реакции, подсчитывать сумму коэффициентов в уравнении, находить соответствующие точки и последовательно, с помощью маркеров, соединять их друг с другом. Если вы правильно выполните задание, то узнаете, какой химический элемент спрятался за цифрами.
-
C + O2 → CO2
-
CH4 → C2H2 + H2
-
Ca + HCl → CaCl2 + H2
-
K + S → K2S
-
HNO3 + CaO → Ca(NO3)2 + H2O
-
Fe + O2 → Fe2O3
-
BaO + H2SO4 → BaSO4 + H2O
-
Fe + Cl2 → FeCl3
Проверка:
-
Ba + O2 → BaO
-
Fe(OH)3 + HCl → FeCl3 + H2O
-
Na + S → Na2S
-
Fe + O2 → Fe3O4
5
8
4
6
-
C + O2 → CO2
-
CH4 → C2H2 + H2
-
Ca + HCl → CaCl2 + H2
-
K + S → K2S
3
6
5
4

-
HNO3 + CaO → Ca(NO3)2 + H2O
-
Fe + O2 → Fe2O3
-
BaO + H2SO4 → BaSO4 + H2O
-
Fe + Cl2 → FeCl3
5
9
4
7

Ответ: N - азот, P - фосфор, О - кислород.


В 60-х годах XVII века гамбургский алхимик Г. Бранд искал «философский камень». В 1669 году он надеялся перегонкой мочи получить жидкость, с помощью которой серебро можно превратить в золото. При прокаливании образовалось вещество, светящееся в темноте. Это был фосфор.
Безжизненный, не поддерживающий дыхания и горения - в этом качестве видели химики основное свойство азота.
В истории открытия кислорода переплелось множество судеб, но об этом - на следующем уроке.
А вот один из способов получения кислорода мы сейчас увидим.
Демонстрационный опыт Получение кислорода
2 KMnO4 = K2MnO4 + MnO2 + O2↑
Итак, тема сегодняшнего урока:
«Типы химических реакций»
Работать мы с вами будем по группам.
Кейс
Юра заболел и его положили в больницу. Когда Юра выздоровел, оказалось, что он пропустил несколько тем уроков по химии и не может выполнить домашние задания. Используя дополнительный материал, помогите Юре выполнить домашнее упражнение: заполните таблицу
Типы химических реакций
соединения
разложения
замещения
обмена
определение
исходные вещества
продукты реакции
схема реакции
примеры уравнений реакций
Материал кейса
Типы химических реакций
В реакциях соединения из нескольких исходных веществ образуется одно сложное вещество. 2Mg + O2 = 2MgO
2Cu + O2 + H2O + CO2 = Cu2CO5H2
Реакции разложения приводят к распаду одного исходного сложного вещества на несколько продуктов. CaCO3 = CaO + CO2
Cu2CO5H2 = 2CuO + H2O + CO2
Реакции замещения - это реакции между простым и сложным веществами, протекающие с образованием двух новых веществ - простого и сложного. CuSO4 + Fe = FeSO4 + Cu
Реакциями обмена называют взаимодействие между двумя сложными веществами, при котором они обмениваются атомами или группами атомов.
FeS + 2HCl = FeCl2 + H2S
Многие химические реакции нельзя отнести ни к одному из перечисленных четырех типов. Примером может служить реакция горения метана: CH4 + 2O2 = CO2 + 2H2O
Исходные вещества
Одно сложное вещество
Два сложных вещества
Два вещества: простое и сложное
Два или более простых или сложных вещества
Продукты реакции
Одно сложное вещество
Два сложных вещества
Два новых вещества: простое и сложное
Два или более простых или сложных вещества
Схемы реакций
А + В = С
С = А + В
А + ВС = АС + В
АВ + СД = АД + СВ
- Однажды Петя принес из школы модель молекулы углекислого газа. Как только Петя отвернулся, кот Филимон столкнул модель со стола, и она развалилась. На что развалилась модель молекулы углекислого газа?
СО2 = С + О2↑
- Один дурной мальчик взял без спросу кусок негашеной извести (СаО) и спрятал его за пазуху. Спасаясь от преследователей, он попал в воду. Известь нагрелась и причинила ему сильные ожоги. Мораль: не следует брать ничего без спросу!
СаО + Н2О = Са(ОН)2
- Если положить в пробирку кусочек мела размером с горошину и накапать в пробирку несколько капель уксусной кислоты, то произойдет реакция:
СаСО3 + 2СН3СООН =(СН3СОО)2Са + Н2О + СО2↑
- Способ получения водорода, открытый в давние времена, используется в лабораториях до сих пор. Для этого в аппарат Киппа загружают палочки, отлитые из цинка, и заливают 20 - процентную серную кислоту:
Zn + H2SO4 =ZnSO4 + H2↑
- Чистую азотную кислоту впервые получил немецкий химик Иоганн Рудольф Глаубер действуя на селитру купоросным маслом (концентрированной серной кислотой).
KNO3 + H2SO4 (конц.) = KHSO4 + HNO3↑
- Джозеф Пристли выделял кислород (который он именовал «дефлогистированным воздухом»), нагревая оксид ртути:
2HgO = 2Hg + O2↑
Для этого в кристаллизатор, наполненный ртутью, он помещал перевернутый вверх дном стеклянный цилиндр с оксидом ртути. Фокусируя с помощью большой линзы солнечные лучи на верхнюю часть цилиндра, ученый наблюдал, как образующаяся ртуть стекала в кристаллизатор, а цилиндр наполнялся бесцветным газом. Позднее Пристли обнаружил, что вместо оксида ртути можно использовать и сурик:
2Pb3O4 = 6PbO + O2↑
- Находясь долгое время на воздухе, медь покрывается пленкой малахита, образующегося по реакции 
2Cu + O2 + H2O + CO2 = (CuOH)2CO3.
Именно этому веществу обязаны своим цветом бронзовые памятники и старые крыши городов Западной Европы.
- Жилец из квартиры №26 решил помочь освободиться жильцу из квартиры №29 из его хлорида (соединение элемента № 29 с двумя атомами хлора), но сам попал в западню. Почему?
Напишите уравнения реакции, определите тип реакции и поставьте коэффициенты.
- В Цюрихе перед лекцией профессора Вельта один из студентов взял из выставленной банки кусок калия и, тщательно завернув в носовой платок, положил в карман. Во время лекций калий начал реагировать с влажным воздухом. Студент беспокойно завертелся на скамье, затем вдруг вскочил на нее и стремительно вырвал загоревшийся карман вместе с его содержимым.
- В чем дело? - воскликнул испуганный профессор.
- У меня в кармане был кусочек калия, завернутый в тряпочку, ответил дрожащий от страха похититель.
Громовой хохот! Студент пострадал не только от насмешек, но и от ожогов. Остатки кармана как предостережение вошли в химическую коллекцию кафедры и хранились в банке с надписью: «Действие украденного калия на карман студенческих брюк».
Проверка кейса:
Типы химических реакций
соединения
определение
В реакциях соединения из нескольких исходных веществ образуется одно сложное вещество
исходные вещества
Два или более простых или сложных вещества
продукты реакции
Одно сложное вещество
схема реакции
А + В = С
пример реакции
СаО + Н2О = Са(ОН)2
Типы химических реакций
разложения
определение
Реакции разложения приводят к распаду одного исходного сложного вещества на несколько продуктов.
исходные вещества
Одно сложное вещество
продукты реакции
Два или более простых или сложных вещества
схема реакции
С = А + В
пример реакции
2Pb3O4 = 6PbO + O2↑
Типы химических реакций
замещения
определение
Реакции замещения - это реакции между простым и сложным веществами, протекающие с образованием двух новых веществ - простого и сложного.
исходные вещества
Два вещества: простое и сложное
продукты реакции
Два новых вещества: простое и сложное
схема реакции
А + ВС = АС + В
пример реакции
Zn + H2SO4 =ZnSO4 + H2↑
Типы химических реакций
обмена
определение
Реакциями обмена называют взаимодействие между двумя сложными веществами, при котором они обмениваются атомами или группами атомов.
исходные вещества
Два сложных вещества
продукты реакции
Два новых сложных вещества
схема реакции
АВ + СД = АД + СВ
пример реакции
KNO3 + H2SO4 (конц.) = KHSO4 + HNO3↑
Типы химических реакций
соединения
разложения
замещения
обмена
опреде-ление
В реакциях соединения из нескольких исходных ве-ществ образу-ется одно сложное вещество
Реакции разложения приводят к распаду одного исходного сложного ве-щества на нес-колько продук-тов.
Реакции замещения - это реакции между прос-тым и слож-ным вещест-вами, протека-ющие с образо-ванием двух новых веществ - простого и сложного.
Реакциями обмена называют взаимодейст-вие между двумя слож-ными вещест-вами, при котором они обменивают-ся атомами или группами атомов.
исходные вещества
Два или более простых или сложных вещества
Одно сложное вещество
Два вещества: простое и сложное
Два сложных вещества
продукты реакции
Одно сложное вещество
Два или более простых или сложных вещества
Два новых вещества: простое и сложное
Два новых сложных вещества
схема реакции
А + В = С
С = А + В
А + ВС =
АС + В
АВ + СД = АД + СВ
пример реакции
СаО + Н2О = Са(ОН)2
2Pb3O4 =
6PbO + O2↑
Zn + H2SO4 =ZnSO4 + H2↑
KNO3+H2SO4 = KHSO4+HNO3
Подведение итогов:
Химию создавали люди необычной судьбы - вначале алхимики, затем врачи, аптекари и, наконец, собственно химики. Они верили в свое предназначение и не щадили здоровья, а порой и жизни в стремлении открыть двери в неизведанное, получить новые вещества и материалы.
Об одной такой реакции более подробно:
В 1843 году Рудольф Беттгер получил дихромат аммония - оранжево - красное кристаллическое вещество. Он решил испытать это вещество на способность взрываться от удара и воспламеняться от горящей лучины. Удар молотком на чугунной плите всего лишь превратил кристаллы дихромата аммония в порошок. Затем, насыпав на тарелку горку кристаллов, Беттгер поднес к ней горящую лучинку. Кристаллы не вспыхнули, но вокруг конца горящей лучинки что - то закипело, начали стремительно вылетать раскаленные частицы. Позднее было установлено, что дихромат аммония самопроизвольно разлагается не только от зажженной лучинки или спички, но и от нагретой стеклянной палочки.



Вулкан Беттгера
(NH4)2Cr2O7 = Сr2O3 + N2↑ + 4H2O
Криминалистика - юридическая наука, которая начиналась с простейших химических методов расследования, кислотные дожди действуют губительно на памятники (здания и скульптуры), выполненные из известняка и мрамора; теория химической эволюции - современная теория происхождения жизни - в основе ее лежит не внезапное возникновение живых существ на Земле, а образование химических соединений и систем, которые составляют живую материю.
Мир химических реакций огромен, разнообразен и интересен. Одни из них проходят быстро, эффектно, как вспышка звезды. Другие медленно, почти незаметно. Вы только вступаете в этот огромный удивительный мир, только начинаете его познавать. И эти знания помогут объяснить вам многие химические реакции, протекающие в природе. Умейте только видеть и удивляться.
Домашнее задание:
Закон сохранения массы веществ
После сжигания свечи, уравновешенной на весах, чаша весов со свечой поднимается вверх:
А) можно ли утверждать, что закон сохранения массы нарушен?
Б) как усовершенствовать этот опыт, чтобы доказать правильность закона?
-
«Получение кислорода» 8 класс
Кейс
Та история простая…
Джозеф Пристли, как- то раз
окись ртути нагревая,
обнаружил странный газ.
Газ без цвета, без названья.
Ярче в нем горит свеча.
А не вреден для дыханья?
(Не узнаешь у врача!)
Новый газ из колбы вышел -
никому он не знаком.
Этим газом дышат мыши
под стеклянным колпаком.
Человек им тоже дышит.
Джозеф Пристли быстро пишет:
«Воздух делится на части».
(Эта мысль весьма нова).
Здесь у химика от счастья
и от воздуха отчасти
(от его важнейшей части)
закружилась голова…
Кошка греется на крыше.
Солнца луч в окошко бьет.
Джозеф Пристли с ним две мыши
Открывают КИСЛОРОД.
Задания:
Проанализируйте стихотворение и ответьте на вопросы.
1. Какой газ обнаружил Д. Пристли, нагревая оксид ртути?
2. Опишите его физические свойства.
3. Почему способ получения кислорода методом Д. Пристли в данное время потерял актуальность?
4. Назовите способы получения кислорода в настоящее время.
5.Назовите составные части воздуха.
6. Заполните таблицу.
Таблица «Характеристика кислорода».
1.
Открытие кислорода
2.
Характеристика кислорода как химического элемента
3.
Характеристика кислорода как простого вещества
4.
Получение кислорода
5.
Содержание кислорода в воздухе
Информационный материал
§15, стр. 52 - 56
Открытие кислорода.
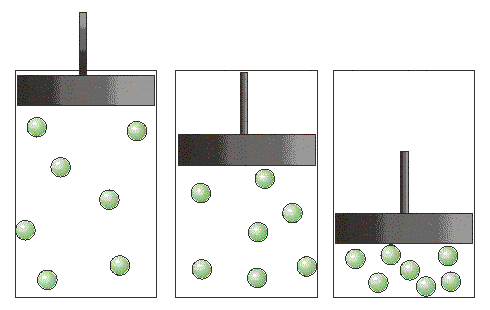
В конце XVIII в. английский ученый Д. Пристли занимался нагреванием разных веществ, собирая солнечные луч при помощи увеличительного стекла. Когда он накаливал таким образом оксид ртути (II) HgO - в приборе, изображенном на рисунке, выделилось много газа. Сначала Д. Пристли подумал, что это воздух. Но когда он опустил в сосуд с собранным газом горящую свечу, то увидел нечто необычное. "Меня поразило,- писал Д. Пристли, - больше, чем я мог выразить, что свеча в этом газе горела замечательно блестящим пламенем".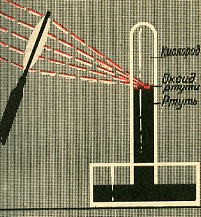
Д. Пристли поместил одну мышь в сосуд с обыкновенным воздухом, а другую в такой же сосуд с полученнным им газом. Первая мышь быстро задохнулась, а вторая в это время еще чувствовала себя хорошо и оживленно двигалась. Д. Пристли и сам пробовал дышать полученным газом и нашел, что им дышится легко и приятно.
Характеристика элемента.
Химический знак элемента - О, относительная атомная масса равна 16.
Кислород - самый распространенный химический элемент на поверхности земного шара. В свободном состоянии (в виде простого вещества) содержится в воздухе, в связанном - в воде Н2О, а также входит в состав горных пород и минералов. На кислород приходится почти половина массы земной коры, гидросферы и атмосферы.
Характеристика простого вещества кислород.
Кислород О2 - бесцветный газ, не имеет запаха и вкуса, малорастворим в воде. Немного тяжелее воздуха: (относительная плотность по воздуху вычисляется отношение молекулярной массы газа к молекулярной массе воздуха, которая равна 29. Для кислорода получаем: 32:29 = 1,1...Значит, он тяжелее воздуха в 1,1... раз.). При давлении 101,3 кПа и температуре -1830 С кислород переходит в жидкое состояние. Жидкий кислород - подвижная жидкость голубого цвета.
Получение кислорода в лаборатории.
Дж. Пристли получал этот газ из соединения, название которого - меркурий (II) оксид. Ученый использовал стеклянную линзу, с помощью которой фокусировал на веществе солнечный свет. При нагревании меркурий (II) оксид (порошок желтого цвета) превращается в ртуть и кислород. Ртуть выделяется в газообразном состоянии и конденсируется на стенках пробирки в виде серебристых капель. Кислород собирается над водой во второй пробирке.
Соответствующее химическое уравнение:
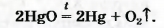
Сейчас метод Пристли не используют, поскольку пары ртути токсичны. Кислород получают с помощью других реакций, подобных рассмотренной. Они, как правило, происходят при нагревании.
Для получения кислорода в лаборатории используют:
• калий перманганат KMnO4 (бытовое название марганцовка; вещество является распространенным дезинфицирующим средством)
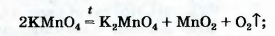
• калий хлорат KClO3 (тривиальное название - бертолетова соль, в честь французского химика конца XVIII - начала XIX в. К.-Л. Бертолле)
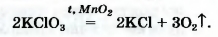
Небольшое количество катализатора - оксида MnO2 - добавляют к к хлорату калия для того, чтобы разложение соединения происходило с выделением кислорода.
Кислород может находиться в атмосфере (21% по объему), в земной коре (47% по массе), в живых организмах (65% по массе), в гидросфере (89% по массе). В целом 99,99% кислорода «связано» в виде соединений, 0,01% - свободное простое вещество-газ кислород. Кажется, это очень небольшое количество, но на самом деле на 0,01% приходится 1,5.1015 тонн! Весь свободный кислород образуется на планете благодаря зеленым растениям. «Связывание» кислорода происходит в результате дыхания (живая природа) и горения (неживая природа).
-
«Вода» 8 класс
Кейс
Монооксид дигидрогена - это одно из научных названий воды. Он имеет формулу Н2О, в которой O - «монооксид» (кислород), а H2 «дигидроген» - двойной водород (англ. hydrogen - водород).
Популярный вариант шутки про монооксид дигидрогена придумали студенты Калифорнийского университета в Санта-Крузе Эрик Лехнер, Ларс Норпчен и Мэтью Кауфман в 1990 году, распространив в кампусе листовки, предупреждавшие о загрязнении воды опасным веществом - монооксидом дигидрогена. Мысль возникла у Мэтью по аналогии с предупреждением о «гидроксиде водорода», опубликованном в мичиганской газете «Дюранд Экспресс», после чего трое приятелей решили придумать термин, который «звучал бы ещё опаснее». Эрик напечатал предупреждение на компьютере, после чего листовка была размножена на копировальном аппарате.
В 1994 году Крейг Джексон создал веб - страницу «Объединения за запрещение DHMO».
В 1997 году Натан Зонер, 14-летний ученик школы Игл - Рок в городе Айдахо - Фолс, штат Айдахо, собрал 43 голоса за запрещение химиката, опросив 50 одноклассников. За своё исследование, озаглавленное «Насколько мы легковерны?», Зонер получил первую премию на научной ярмарке Айдахо - Фолс. В знак признания его эксперимента журналист Джеймс К. Глассман придумал термин «зонеризм», что означает «использование факта, которое приводит к ложным выводам публику, не сведущую в науке и математике».
1 апреля 1998 года член австралийского парламента объявил о начале кампании по запрещению дигидрогена монооксида на международном уровне. Первое упоминание на веб - страницах было приписано «Pittsburgh Post-Gazette» «Объединению по запрещению дигидрогена монооксида- вымышленной организации, придуманной Крэйгом Джексоном. Предупреждение (в котором все утверждения соответствуют действительности) выглядело так:
Недавно исследователи открыли факт загрязнения наших водопроводных систем опасным химикатом. Этот химикат бесцветный, безвкусный и не имеет запаха. Он убивает бесчисленное множество людей каждый год. Правительство не предприняло никаких попыток регулирования этого опасного заражения. Данный химикат называется «дигидрогена монооксид» (Dihydrogen monoxide).
Химикат используется для следующих целей:
-
В производстве как растворитель и охладитель
-
В ядерных реакторах
-
В производстве пенопласта
-
В огнетушителях
-
В химических и биологических лабораториях
-
В производстве пестицидов
-
В искусственных пищевых добавках
-
Химикат является основной составляющей кислотных дождей
-
Способствует эрозии почвы
-
Ускоряет коррозию и вредит большинству электроприборов
-
Длительный контакт с химикатом в его твёрдой форме приводит к серьёзным повреждениям кожи человека
-
Контакт с газообразной формой химиката приводит к сильным ожогам
-
Вдыхание даже небольшого количества химиката грозит смертельным исходом
-
Химикат обнаружен в злокачественных опухолях, нарывах, язвах и прочих болезненных изменениях тела
-
Химикат развивает наркозависимость; жертвам при воздержании от потребления химиката грозит смерть в течение 168 часов
-
Ни один известный очиститель не способен полностью очистить воду от этого химиката
Несмотря на эти опасности, химикат активно и безнаказанно используется в индустрии. Многие корпорации ежедневно получают тонны химиката через специально проложенные подземные трубопроводы. Люди, работающие с химикатом, как правило, не получают спецодежды и инструктажа. Отработанный химикат тоннами выливается в реки и моря.
Мы призываем население проявить сознательность и протестовать против дальнейшего использования этого опасного химиката.
Задания:
-
Что является источником пресной воды?
-
Каков качественный и количественный состав молекул воды?
-
Почему в природе нет чистой воды?
-
В каких агрегатных состояниях встречается вода в природе?
-
Какими физическими свойствами обладает вода?
-
Каковы основные источники загрязнения воды?
-
Каковы методы очистки воды?
-
Каковы способы получения чистой воды в лаборатории, в промышленности?
-
При каких условиях протекают химические реакции получения воды в лаборатории, в промышленности?
-
Почему вода является универсальным растворителем?
-
С какими веществами может взаимодействовать вода? Какие вещества при этом образуются? Напишите уравнения возможных реакций и назовите полученные вещества.
Информационный материал
§28-29 стр. 104 - 117
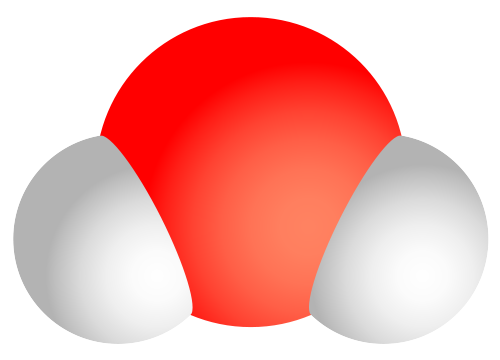
Молекула вещества, состоящая из одного атома кислорода (оксигена) и двух атомов водорода (гидрогена)
Вода́ (оксид водорода) - бинарное неорганическое соединение, химическая формула Н2O. Молекула воды состоит из двух атомов водорода и одного -кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеет цвета, запаха и вкуса. В твёрдом состоянии называется льдом, снегом или инеем, а в газообразном - водяным паром.
Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, льды) - 361,13 млн. км2. На Земле примерно 96,5 % воды приходится на океаны, 1,7 % мировых запасов составляют грунтовые воды, ещё 1,7 % на ледники и ледяные шапки Антарктиды и Гренландии, небольшая часть в реках, озёрах и болотах, и 0,001 % в облаках. Бо́льшая часть земной воды - солёная, и она непригодна для сельского хозяйства и питья. Доля пресной составляет около 2,5 %, причём 98,8 % этой воды находится в ледниках и грунтовых водах. Менее 0,3 % всей пресной воды содержится в реках, озёрах и атмосфере, и ещё меньшее количество (0,003 %) находится в живых организмах.
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Виды воды
Вода на Земле может существовать в трёх основных состояниях - жидком, газообразном и твёрдом. Вода способна растворять в себе множество органических и неорганических веществ.
Химические названия
С формальной точки зрения вода имеет несколько различных корректных химических названий:
-
Оксид водорода: бинарное соединение водорода с атомом кислорода в степени окисления −2
-
Монооксид дигидрогена
-
Гидроксид водорода: соединение гидроксильной группы OH- и катиона (H+)
-
Оксидан
-
Дигидромонооксид
Физические свойства
Вода в нормальных условиях сохраняет жидкое агрегатное состояние. Атомы водорода присоединены к атому кислорода, образуя угол 104,45°.
При температуре перехода в твёрдое состояние молекулы воды упорядочиваются, в процессе этого объёмы пустот между молекулами увеличиваются и общая плотность воды падает, что и объясняет причину меньшей плотности (большего объёма) воды в фазе льда.
Вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные - атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде.
Чистая вода - хороший изолятор. Поскольку вода - хороший растворитель, в ней практически всегда растворены те или иные соли, то есть в воде присутствуют положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Химические свойства
Вода является наиболее распространённым растворителем на планете Земля. Вода - химически активное вещество.
Воду можно получить в ходе реакций:
2H2O2 →2H2O + O2↑
NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
-
В ходе реакций нейтрализации:
H2SO4 + 2KOH→ K2SO4 + 2H2O
HNO3 + NH4OH → NH4NO3 + H2O
-
Восстановлением оксида меди водородом:
CuO + H2 → Cu + H2O
Вода реагирует при комнатной температуре:
-
с активными металлами (натрий, калий, кальций, барий и др.)
2H2O + 2Na → 2NaOH + H2↑
-
со фтором и межгалоидными соединениями
2H2O + 2F2 → 4HF + O2↑
H2O + F2 → HF + HOF (при низких температурах)
3H2O + 2IF5 → 5HF + HIO3
-
с солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз: Al2S3 + 6H2O → 2Al(OH)3↓ + 3H2S↑
-
со многими солями, образуя гидраты
Вода реагирует при нагревании:
-
с железом, магнием: 4H2O + 3Fe → Fe3O4 + 4H2↑
-
с углем, метаном: H2O + C → CO↑ + H2↑
Вода реагирует в присутствии катализатора:
-
с амидами, эфирами карбоновых кислот, ацетиленом и другими алкинами, алкенами, нитрилами
Вода в природе
В атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса). В совокупности жидкая водная оболочка Земли называется гидросферой, а твёрдая - криосферой. Вода является важнейшим веществом всех живых организмов на Земле.
Роль воды в клетке
Вода выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время - достаточную сложность образующихся комплексных соединений.
Поскольку у льда плотность меньше, чем у жидкой воды, вода в водоемах замерзает сверху, а не снизу. Образовавшийся слой льда препятствует дальнейшему промерзанию водоема, это позволяет его обитателям выжить.
Применение
-
Выращивание сельскохозяйственных культур;
-
Питьё и приготовление пищи;
-
Растворитель - для многих веществ. Используется для очистки как самого человека, так и различных объектов человеческой деятельности, как растворитель в промышленности;
-
Обладает наибольшей теплоёмкостью. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в качестве льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя;
-
Во многих ядерных реакторах вода используется не только в качестве теплоносителя, но и замедлителя нейтронов для эффективного протекания цепной ядерной реакции;
-
В пожаротушении вода зачастую используется не только как охлаждающая жидкость, но и для изоляции огня от воздуха в составе пены;
-
Многими видами спорта занимаются на водных поверхностях, на льду, на снегу и даже под водой.
Факты
-
В среднем в организме растений и животных содержится более 50 % воды;
-
При средней глубине в 3,6 км Мировой океан покрывает около 71 % поверхности планеты и содержит 97,6 % известных мировых запасов свободной воды;
-
Морская вода при обычной её солёности 35 % замерзает при температуре −1,91 °C;
-
Иногда вода замерзает при положительной температуре;
-
Вода отражает 5 % солнечных лучей, в то время как снег - около 85 %. Под лёд океана проникает только 2 % солнечного света;
-
Синий цвет чистой океанской воды объясняется избирательным поглощением и рассеянием света в воде;
-
Существует следующая поговорка с использованием формулы воды - H2O: «Сапоги мои того - пропускают аш-два-о». Вместо сапог в поговорке может участвовать и другая дырявая обувь;
-
класс
-
«Скорость химических реакций» 9 класс
Кейс
При проведении некоторых операций на сердце и нейрохирургических операций пациентов подвергают охлаждению, чтобы снизить скорость протекания в организме метаболических процессов. В других случаях наоборот, необходимо повышение температуры.
Задания:
-
Для чего необходимо учитывать скорость химических реакций?
-
Назовите факторы, от которых зависит скорость химических реакций.
-
Приведите конкретные примеры зависимости скорости химической реакции от различных факторов.
Информационный материал
§19 стр. 96-99 9 класс
Химические реакции протекают с различными скоростями. Некоторые из них полностью заканчиваются за малые доли секунды, другие осуществляются за минуты, часы, дни; известны реакции, требующие для своего протекания несколько лет, десятилетий и еще более длительных отрезков времени. Кроме того, одна и та же реакция может в одних условиях, например, при повышенных температурах, протекать быстро, а в других, - например, при охлаждении, - медленно; при этом различие в скорости одной и той же реакции может быть очень большим.
Знание скоростей химических реакций имеет очень большое научное и практическое значение. Например, в химической промышленности при производстве того или иного вещества от скорости реакции зависят размеры и производительность аппаратуры, количество вырабатываемого продукта.
При рассмотрении вопроса о скорости реакции необходимо различать реакции, протекающие в гомогенной системе (гомогенные реакции), и реакции, протекающие в гетерогенной системе (гетерогенные реакции).
Гомогенной называется система, состоящая из одной фазы, гетерогенной- система, состоящая из нескольких фаз.
Примером гомогенной системы может служить любая газовая смесь (все газы при не очень высоких давлениях неограниченно растворяются друг в друге). Другим примером гомогенной системы может служить раствор нескольких веществ в одном растворителе. В каждом из этих двух случаев система состоит только из одной фазы: из газовой фазы в первом примере и из водного раствора во втором.
В качестве примеров гетерогенных систем можно привести следующие системы: вода со льдом, насыщенный раствор с осадком, уголь и сера в атмосфере воздуха. В последнем случае система состоит из трех фаз: двух твердых и одной газовой.
Если реакция протекает в гомогенной системе, то она идет во всем объеме этой системы. Если реакция протекает между веществами, образующими гетерогенную систему, то она может идти только на поверхности раздела фаз, образующих систему. Например, растворение металла в кислоте может протекать только на поверхности металла, потому что только здесь соприкасаются друг с другом оба реагирующие вещества. В связи с этим скорость гомогенной реакции и скорость гетерогенной реакции определяются различно.
Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы.
Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы.
Например для реакции:
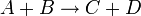
выражение для скорости будет выглядеть так:
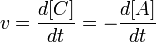 .
.
В 1865 году Н. Н. Бекетовым и в 1867 году Гульдбергом и Вааге был сформулирован закон действующих масс: Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в степени, равные их стехиометрическим коэффициентам.
Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы:
-
природа реагирующих веществ;
-
наличие катализатора;
-
температура (правило Вант-Гоффа);
-
давление;
-
площадь поверхности реагирующих веществ.
Влияние концентраций веществ на скорость химической реакции
Чтобы вещества прореагировали, необходимо, чтобы их молекулы столкнулись. Вероятность столкновения двух людей на оживленной улице гораздо выше, чем на пустынной. Так и с молекулами. Очевидно, что вероятность столкновения молекул на рисунке слева выше, чем справа. Она прямо пропорциональна количеству молекул реагентов в единице объема, т.е. молярным концентрациям реагентов. Это можно продемонстрировать с помощью модели.
Влияние давления на скорость химической реакции
Давление сильно влияет на скорость реакций с участием газов, потому что оно непосредственно определяет их концентрации.
В уравнении Менделеева-Клапейрона:
pV = nRT
перенесем V в правую часть, а RT - в левую и учтем, что n/V = c:
p/RT = c
Давление и молярная концентрация газа связаны прямо пропорционально. Поэтому в закон действующих масс мы можем подставлять вместо концентрации p/RT.
Влияние поверхности соприкосновения реагентов на скорость химической реакции
Пока что для простоты рассматривались гомогенные реакции, т.е. реакции, которые протекают в однородной среде, например, в смеси газов или в растворе. Но существует множество гетерогенных процессов, идущих на поверхности соприкосновения:
-
твердого вещества и газа: S + O2 = SO2,
-
твердого вещества и жидкости: Fe + 2HCl = FeCl2 + H2,
-
двух несмешивающихся жидкостей: C3H7Br + KCN (водн.) = C3H7CN + KBr(водн.)
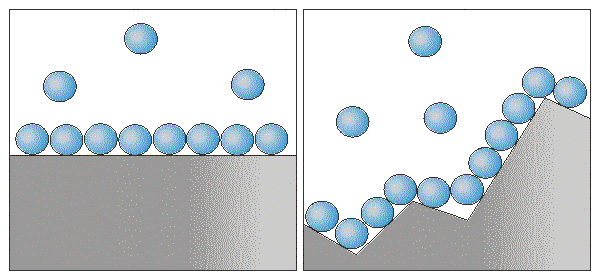
Скорость гетерогенной реакции прямо пропорциональна площади поверхности соприкосновения реагентов.
*Твердые вещества, участвующие в гетерогенной реакции, для увеличения скорости взаимодействия измельчают, чтобы увеличить площадь поверхности частиц. Например, уголь для приготовления пороха растирают в порошок. Жидкость для реакции с газом распыляют в мельчайшие капельки: так, дизельное топливо (смесь углеводородов) впрыскивают в камеру, где оно встречается с воздухом, через специальное устройство, обеспечивающее распыление.
Влияние природы реагентов на скорость химической реакции
Константа скорости реакции зависит в первую очередь от природы реагирующих веществ. Калий быстрее взаимодействует с водой, чем натрий, а литий - еще медленнее натрия. Водород реагирует с кислородом очень быстро (часто со взрывом), а азот с кислородом - крайне медленно и лишь в жестких условиях (электрический разряд, высокие температуры).
Влияние температуры на скорость химической реакции
Влияние температуры на скорость реакций определяется правилом Вант-Гоффа (сформулировано Я. Х. Вант-Гоффом на основании экспериментального изучения множества реакций):
В интервале температур от 0оС до 100оС при повышении температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза:
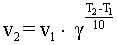
где g - t температурный коэффициент, принимающий значения от 2 до 4.
Катализ и ингибирование
Есть вещества, которые влияют на скорость химической реакции, не являясь при этом реагентами. Они принимают в реакции самое непосредственное участие, но в результате реакции остаются неизменными. Такие вещества называются катализаторами, если они ускоряют реакцию, и ингибиторами, если замедляют ее.
75% химической промышленности использует каталитические процессы. Среди них - как крупнотоннажные производства: синтез аммиака и его окисление, производство серной кислоты, так и тонкие многостадийные синтезы, например, лекарственных средств.
Все биохимические реакции, протекающие в живых организмах, требуют участия природных катализаторов - ферментов. Ферменты представляют собой крупные белковые молекулы с так называемым активным центром - как правило, это химически связанная с белком молекула небелковой природы или ион металла. Ферменты обладают непревзойденной активностью (т.е. скоростью каталитического процесса), ускоряя реакции в миллиарды и триллионы раз при комнатной температуре. При высоких температурах они теряют активность, так как белок денатурируется. Кроме того, ферменты характеризуются чрезвычайной избирательностью (селективностью), превращая лишь строго определенные вещества в строго определенные продукты. Они способны на это благодаря своей уникальной форме, к которой реагенты должны подойти, как ключ к замку.
Многие катализаторы не просто ускоряют реакции, а ведут их по другому пути. Так, реакция окисления аммиака без катализатора:
4NH3 + 3O2 = 2N2 + 6H2O
не представляет никакого интереса для промышленности, а в результате каталитического окисления на платине:
4NH3 + 5O2 = 4NO + 6H2O
получается ценный продукт - оксид азота(II).
В пищевой промышленности широко используются ингибиторы, предотвращающие гидролиз жиров, реакции окисления и брожения.
Особый случай катализа - аутокатализ, или ускорение реакции одним из ее продуктов. При этом скорость реакции не уменьшается по мере расходования реагентов, а растет. Так, реакция
2KMnO4 + 5K2SO3 + 3H2SO4 = 2MnSO4 + 6K2SO4 + 3H2O
ускоряется по мере накопления ионов Mn2+, образующихся при восстановлении перманганата.
Пероксид водорода
Условия
Примеры
Природа реагирующих веществ
Многие вещества хранятся годами, а перекись водорода разлагается: 2Н2О2 = 2Н2О + О2↑
Их концентрация
Чистая перекись водорода разлагается со взрывом, а в растворе - за несколько месяцев
Температура
В прохладном месте раствор Н2О2 сохраняется довольно долго
Присутствие катализаторов и ингибиторов
Раствор Н2О2, поступающий в продажу, содержит ингибиторы, чтобы лучше хранился. Но если к нему добавить щепотку MnO2 в качестве катализатора - происходит бурное выделение кислорода
-
«Кальций» 9 класс
Кейс
С самых древних времен и до наших дней художники, создавая монументальную живопись, чаще всего используют технику фрески. Слово это происходит от итальянского «fresco», что значит «свежий», «сырой».
Фрески пишут по сырой штукатурке красками, которые разводятся водой. Высыхая, известь штукатурки плотно соединяется с красочным слоем.
Для приготовления красок, используемых в создании фресок, применяют обычные пигменты. Но при их отборе учитывают одно общее ограничение, обусловленное химическими свойствами основных компонентов грунта.
Задания
-
Разберите данную ситуацию, проведите ее анализ.
-
Из имеющихся у вас пигментов (красная охра, берлинская лазурь, цинковые белила, фиолетовый кобальт, краплак, зеленый крон, желтый крон), предложите художнику те, которые возможны в использовании во фресковой живописи. Докажите это практически.
-
Пригодятся ли знания, полученные из данного кейса, в вашей будущей профессиональной деятельности?
Информационный материал
§ 42 стр. 194 - 197 9 класс
Приложение 1. «Кипелка» и «пушонка»
Еще в I веке нашей эры Диоскорид - врач при римской армии - в сочинении «О лекарственных средствах» ввел для оксида кальция название «негашеная известь», которое сохранилось и в наше время. Строители ее называют «кипелкой» - за то, что при гашении выделяется много тепла, и вода закипает. Образующийся при этом пар разрыхляет известь, она распадается с образованием пушистого порошка. Отсюда строительное название гашеной извести - «пушонка». Гашеная известь Са(ОН)2 - тонкий рыхлый порошок, обычно белого цвета. Поглощая углекислый газ из воздуха, гидроксид кальция превращается в карбонат кальция, проявляющий вяжущие свойства. В зависимости от количества воды, добавляемой к извести, гашение идет до получения пушонки, известкового теста, известкового молока или известковой воды. Все они нужны для приготовления вяжущих растворов.
Приложение 2 Кальций углекислый
Карбонат кальция СаСО3 - одно из самых распространенных на Земле соединений. Минералы на основе СаСО3 покрывают около 40 млн. км2 земной поверхности. Мел, мрамор, известняки, ракушечники - все это СаСО3 с небольшими примесями.
Самый важный из этих минералов - известняк. Известняки есть практически везде. В европейской части России известняки встречаются в отложениях почти всех геологических возрастов. В чистом виде известняки - белого или светло - желтого цвета, но примеси придают им более темную окраску. Известняк незаменим в производстве цемента, карбида кальция, соды, всех видов извести (гашеной, негашеной, хлорной), белильных растворов и многих других полезных веществ. Без известняка не обходится ни одно строительство.
Во - первых, из него самого строят, во - вторых, из известняка делают многие строительные материалы.
Другая разновидность углекислого кальция - мел. Мел - это не только зубной порошок и школьные мелки. Его используют в бумажной и резиновой промышленности - в качестве наполнителя, в строительстве и при ремонте зданий - для побелки. При соприкосновении с кислотами мел «вскипает».
Приложение 3
Качеству грунта - штукатурке - во фресковой живописи придается очень большое значение, поскольку от него зависит долговечность создаваемых картин. На Руси известь, применяемая для фресок, проходила многолетнюю обработку: в течение трех - восьми лет ее выдерживали в особых ямах, постоянно перелопачивая. Для получения штукатурки известь смешивали с гипсом, мелом, мелкотолченым кирпичом, рубленым льном. Грунт обычно делали двухслойным. На хорошо просохший первый, достаточно толстый слой штукатурки непосредственно перед началом работы художника наносили тонкий второй слой. По нему и выполняли роспись.
Приложение 4.
Химический процесс, лежащий в основе высыхания фресковой живописи - процесс карбонизации, соответствующий уравнению реакции:
Са(ОН)2 + СО2 = СаСО3↓ + Н2О
Гипсовая известь нерастворимый
в составе грунта карбонат кальция
В результате такого взаимодействия на поверхности росписи возникает тончайшая пленка из нерастворимого в воде карбоната кальция.
Приложение 5. Оксиды - пигменты художественных красок.
Pb3O4 - сурик, получаемый пережиганием свинцовых белил. Пигмент ярко - красного цвета.
ZnO - при горении парообразного цинка на воздухе появляется сине - зеленое пламя и образуются белые хлопья оксида цинка ZnO. Оксид цинка в виде рыхлого белого порошка используется для изготовления цинковых белил (в отличие от свинцовых белил на воздухе не темнеет и безвреден).
Fe2O3 - «охра», природный кристаллический пигмент. По цвету охры делят на светло - желтые (12 - 25% Fe2O3) и золотисто - желтые (40-75% Fe2O3). Красную охру (Fe,Fe2)O4 (современное название этого двойного оксида - тетраоксид дижелеза (III) - железа (II)) называли еще «мумия» или «железный сурик». Мумия содержит 35 - 70% Fe2O3 и получается при обжиге железосодержащих руд. Кроме Fe2O3 мумия включает еще глинистые вещества и диоксид кремния SiO2.
TiO2 - рутил. Применяется для изготовления титановых белил.
Cr2O3 - темно - зеленый порошок, тугоплавок, химически инертен. Широко применяется под названием «зеленого крона» для приготовления клеевой и масляных красок.
Известной популярностью пользуется у художников и зелень Гинье, хромофором которой является гидрат оксида хрома Cr2O3.(2-3)Н2О, где часть воды химически связана, а часть адсорбирована. Этот пигмент придает окраске изумрудный оттенок.
«Тенарова синь» - двойной оксид алюминия и кобальта состава (CoAl2)O4 - тетраоксид диалюминия - кобальта. Вещество это получило свое название по имени французского химика Тенара, предложившего реакцию образования этого оксида для обнаружения алюминия в минералах.
Краска
Оксид - пигмент красок
Цвет
Примечания
Массикот
PbO
Оранжево - желтый
Применяют с древнос-ти. Используются как сиккативы при варке олифы.
Свинцовый сурик «голубиная кровь»
Pb3O4
Неяркий, красный
Применяются с древ-ности
Красная охра
Fe2O3 в смеси SiO2 и Al2O3
Красный
Применяются с древ-ности. Очень прочные и светостойкие
Натуральная охра
Fe2O3.nH2O с при-месями каолина и силикатов
Желтый
В переводе с греческого «охра» - бледная, желтоватая
Сиена жженая
Умбра жженая
Fe2O3 с примеся-ми MnO2 и глины
Fe2O3, MnO2
Коричневый
Коричневый
Названия произошли от г. Сиены и провин-ции Умбрия (Италия), где добывали эти зем-ляные краски
Коричневая Ван Дейка (кассельс-кая, кельнская земля)
Смесь органи-ческих веществ с Fe2O3, Al2O3,SiO2
Коричневый
Применяется с XV века. Добывалась в окрестностях Касселя и Кельна (Германия)
Синий кобальт
Церелиум
CoO.Al2O3
CoO.SnO2
Зеленовато - синий
Синий
Очень прочные, светостойкие
Зеленая хромовая
Cr2O3
Оливково - зеленый
Прочная, светостойкая, термостойкая
Цинковые белила
ZnO
Белый
Промышленный вы-пуск налажен в 1850 году
Титановые белила
TiO2
Белый
Применяется с начала ХХ века. Промыш-ленный выпуск нала-жен с 1920 года
Приложение 6 Соли - пигменты художественных красок
Техническое наз-вание соли или название краски
соль
цвет
примечания
Мел
Гипс
CaCO3
CaSO4.2H2O
Белый
Белый
Входит в состав ху-дожественных грунтов и клеевых красок
Свинцовые белила
2PbCO3.Pb(OH)2
Белый
Один из древнейших пигментов, темнеет под действием H2S
Бланфикс (бари-товые постоян-ные белила)
BaSO4
Белый
Промышленный вы-пуск налажен в 1830 году
Цинковая желтая
ZnCrO4
Желтый
Получена Л. Вокленом в 1809 году
Баритовая желтая
BaCrO4
Желтый
Получена Л. Вокленом в 1809 году
Азурит (горная синяя)
2CuCO3.Cu(OH)2
Синий
В природе часто встре-чается с малахитом
Берлинская ла-зурь (прусская синяя, милора)
Вивианит (охра синяя)
Fe4[Fe(CN)6]3
Fe3(PO4)2.8H2O
Синий
Синий
Под действием щело-чей разрушаются с об-разованием оксида же-леза. Неприменимы во фресковой живописи.
Швейнфуртская зелень
Cu(CH3COO)2. 3Cu(AsO2)2
Зеленый
Во 2 половине 19 века применялась в качестве инсектицида.
Малахит (горная зелень)
Ярь - медянка
CuCO3.Cu(OH)2
Cu(CH3COO)2.
3Cu(OH)2
Зеленый
Зеленый
В живописи широко применялись в стари-ну, сейчас практически не используются
Темный кобальт
Co3(PO4)2
Фиолетовый
Получена М. Сальве-татом в 1859 году
-
«Алюминий» 9 класс
Кейс
В 1825 - 1827 гг. был получен металл, который ценился дороже золота. Погремушка сыны Наполеона III была сделана из этого металла, а самый богатый королевский двор Европы имел столовые приборы, изготовленные из него.
В 1886 году американец Ч. Холл в сарае, в котором была устроена лаборатория, на оборудовании, состоявшем из сковороды, подержанной бензиновой печи и самодельных тиглей, получил "серебро из глины". Этот метод получения металла используется в промышленности и сейчас.
По распространённости в природе он занимает четвёртое место среди всех элементов и первое среди металлов (8,8% от массы земной коры). Он стал вторым по значению металлом XX века после железа. По объёму производства он занимает второе место в мире после выплавки чугуна и стали. Входит в состав различных пиротехнических смесей.
Задания:
-
О каком металле идёт речь?
-
Каково положение этого металла в Периодической системе химических элементов Д.И.Менделеева.
-
Каково строение атома этого металла?
-
Какими физическими свойствами он обладает?
-
В какие химические реакции вступает это вещество и какие вещества при этом образуются? Напишите уравнения возможных реакций и назовите продукты реакций.
-
Почему при обычных условиях изделия из этого металла устойчивы к воздействию факторов окружающей среды?
-
По какой до конца XIX века этот металл был на вес золота?
-
На каких свойствах этого металла основано его применение в народном хозяйстве?
-
Почему посуду из этого металла называли «посудой бедняков»?
Информационный материал
§43 стр. 197 -204 9 класс
Алюми́ний - элемент 13-й группы периодической таблицы химических элементов (по устаревшей классификации - элемент главной подгруппы III группы), третьего периода, с атомным номером 13. Обозначается символом Al (лат. Aluminium). Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния). Название элемента образовано отлат. aluminis - квасцы.
Лёгкий, парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.
Получение
Алюминий образует прочную химическую связь с кислородом. По сравнению с другими металлами восстановление алюминия из руды более сложно в связи с его высокой реакционной способностью и с высокой температурой плавления большинства его руд (таких, как бокситы). Прямое восстановление углеродом применяться не может, потому что восстановительная способность алюминия выше, чем у углерода. Возможно непрямое восстановление с получением промежуточного продукта Al4C3, который подвергается разложению при 1900-2000 °С с образованием алюминия. Этот способ находится в разработке, но представляется более выгодным, чем процесс Холла-Эру, так как требует меньших энергозатрат и приводит к образованию меньшего количества CO2.
Современный метод получения, процесс Холла-Эру был разработан независимо американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием расходуемых коксовых или графитовых электродов. Такой метод получения требует больших затрат электроэнергии, и поэтому оказался востребован только в XX веке.
Лабораторный способ получения алюминия предложил Фридрих Вёлер в 1827 году, он основывается на восстановлении металлическим калием (реакция протекает при нагревании без доступа воздуха):
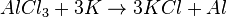
Физические свойства

-
Металл серебристо-белого цвета, лёгкий
-
плотность - 2,7 г/см³
-
температура плавления у технического алюминия - 658 °C, у алюминия высокой чистоты - 660 °C
-
температура кипения - 2500 °C
-
Алюминий образует сплавы почти со всеми металлами. Наиболее известны сплавы с медью и магнием (дюралюминий) и кремнием (силумин).
Нахождение в природе
Природные соединения алюминия
В природе алюминий, в связи с высокой химической активностью, встречается почти исключительно в виде соединений: Бокситы - Al2O3 · H2O (с примесями SiO2, Fe2O3, CaCO3); Глинозёмы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3); Корунд (сапфир, рубин, наждак) - Al2O3. Тем не менее, в некоторых специфических восстановительных условиях (жерла вулканов) найдены ничтожные количества самородного металлического алюминия.
Химические свойства
При нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями: с H2O (t°);O2, HNO3 (без нагревания). Благодаря этому алюминий практически не подвержен коррозии и потому широко востребован современной промышленностью. Однако при разрушении оксидной плёнки (например, при контакте с растворами солей аммония NH4+, горячими щелочами или в результате амальгамирования), алюминий выступает как активный металл-восстановитель.
Легко реагирует с простыми веществами:
-
с кислородом, образуя оксид алюминия:
4Al + 3O2 = 2Al2O3
-
с галогенами (кроме фтора), образуя хлорид, бромид или иодид алюминия: 2Al + 3Hal2 = 2AlHal3 (Hal = Cl, Br, I)
-
с другими неметаллами реагирует при нагревании:
-
со фтором, образуя фторид алюминия: 2Al + 3F2 = 2AlF3
-
с серой, образуя сульфид алюминия: 2Al + 3S = Al2S3
-
с азотом, образуя нитрид алюминия: 2Al + N2 = 2AlN
-
с углеродом, образуя карбид алюминия: 4Al + 3С = Al4С3
-
Со сложными веществами:
-
с водой (после удаления защитной оксидной пленки, например, амальгамированием или растворами горячей щёлочи):
2Al + 6H2O = 2Al(OH)3 + 3H2
-
со щелочами (с образованием тетрагидроксоалюминатов и других алюминатов):
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
6NaOH + 2Al = 2Na3AlO3 + 3H2
-
Легко растворяется в соляной и разбавленной серной кислотах:
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4(разб.) = Al2(SO4)3 + 3H2
-
При нагревании растворяется в кислотах - окислителях, образующих растворимые соли алюминия:
8Al + 15H2SO4(конц.) = 4Al2(SO4)3 + 3H2S + 12H2O
Al + 6HNO3(конц.) = Al(NO3)3 + 3NO2 + 3H2O
-
восстанавливает металлы из их оксидов (алюминотермия):
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
2Al + Cr2O3 = Al2O3 + 2Cr
Производство
Легенда из «Historia naturalis» гласит, что однажды к римскому императору Тиберию (42 год до н. э. - 37 год н. э.) пришёл ювелир с металлической, небьющейся обеденной тарелкой, изготовленной якобы из глинозёма - Al2O3. Тарелка была очень светлой и блестела, как серебро. По всем признакам она должна быть алюминиевой. При этом ювелир утверждал, что только он и боги знают, как получить этот металл из глины. Тиберий, опасаясь, что металл из легкодоступной глины может обесценить золото и серебро, приказал на всякий случай отрубить ювелиру голову.
Лишь почти через 2000 лет после Тиберия, в 1825 году, датский физик Ганс Христиан Эрстед получил несколько миллиграммов металлического алюминия, а в 1827 году Фридрих Вёлер смог выделить крупинки алюминия, которые, однако, на воздухе немедленно покрывались тончайшей пленкой оксида алюминия.
До конца XIX века алюминий в промышленных масштабах не производился. Только в 1854 году Анри Сент-Клер Девиль (его исследования финансировал Наполеон III, рассчитывая, что алюминий пригодится его армии) изобрёл первый способ промышленного производства алюминия, основанный на вытеснении алюминия металлическим натрием из двойного хлорида натрия и алюминия NaCl·AlCl3. В 1855 году был получен первый слиток металла массой 6-8 кг. За 36 лет применения, с 1855 по 1890 год, способом Сент-Клер Девиля было получено 200 тонн металлического алюминия. В 1856 году он же получил алюминий электролизом расплава хлорида натрия-алюминия.
В 1885 году был построен завод по производству алюминия в немецком городе Гмелингеме, работающий по технологии, предложенной Николаем Бекетовым. Технология Бекетова мало чем отличалась от способа Девиля, но была проще и заключалась во взаимодействии между криолитом (Na3AlF6) и магнием. За пять лет на этом заводе было получено около 58 т алюминия - более четверти всего мирового производства металла химическим путем в период с 1854 по 1890 год.
Метод, изобретённый почти одновременно Чарльзом Холлом в США и Полем Эру во Франции (1886 год) и основанный на получении алюминия электролизом глинозема, растворённого в расплавленном криолите, положил начало современному способу производства алюминия. С тех пор, в связи с улучшением электротехники, производство алюминия совершенствовалось. Заметный вклад в развитие производства глинозема внесли русские учёные К. И. Байер, Д. А. Пеняков, А. Н. Кузнецов, Е. И. Жуковский, А. А. Яковкин и др.
Мировые запасы бокситов практически безграничны, то есть несоизмеримы с динамикой спроса. Существующие мощности могут производить до 44,3 млн. т первичного алюминия в год. Следует также учитывать, что в будущем некоторые из применений алюминия могут быть переориентированы на использование, например, композитных материалов.
Применение
Широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве - лёгкость, податливость штамповке, коррозионная стойкость (на воздухе алюминий мгновенно покрывается прочной плёнкой Al2O3, которая препятствует его дальнейшему окислению), высокая теплопроводность, неядовитость его соединений. В частности, эти свойства сделали алюминий чрезвычайно популярным при производстве кухонной посуды, алюминиевой фольги в пищевой промышленности и для упаковки. Первые же три свойства сделали алюминий основным сырьем в авиационной и авиакосмической промышленности (в последнее время медленно вытесняется композитными материалами, в первую очередь, углеволокном). Широко применяется в электротехнике для изготовления проводов, их экранирования и даже в микроэлектронике при изготовлении проводников в чипах.
10 класс
-
«Коррозия металлов» 10 класс
Кейс
В начале XX века из Нью-Йоркского порта вышли в открытый океан красавица-яхта. Её владелец, американский миллионер, не пожалел денег, чтобы удивить свет. Корпус был сделан из очень дорогого в то время алюминия, листы которого скреплялись медными заклепками. Это было красиво-сверкающий серебристым блеском корабль, усеянный золотистыми головками заклепок! Однако через несколько дней обшивка корпуса начала расходиться, и яхта пошла быстро ко дну.
Задания.
1. Что же случилось с яхтой? Предложите свой способ спасения яхты.
2.Исследуйте свою квартиру, дом и установите, где использованы антикоррозионные покрытия. Постройте классификацию антикоррозионных покрытий на основании областей их применения.
3. Найдите дополнительную информацию о коррозии и способах борьбы с ней.
4. Отчет о проделанной работе предоставить в произвольной форме.
Информационный материал
§13 стр. 90 - 98 10 класс
Коррозией металлов называется их разрушение вследствие химического или электрохимического взаимодействия с внешней средой.
Химической коррозией называется процесс разрушения металлов без электрического тока, происходящий в среде сухих газов или в жидкостях, не проводящих электрический ток. Химической коррозии подвергаются поверхности корпусных конструкций при соприкосновении с перевозимыми нефтепродуктами, солью, углем и другими минералами.
Наибольшие коррозионные разрушения наблюдаются на танках, вмещающих светлые сорта нефтепродуктов - бензины, керосины и т. п.,- от воздействия на металл корпуса сернистых соединений и различных кислотных остатков, входящих в их состав.
Электрохимической коррозией является процесс разрушения металла при соприкосновении его с жидкостями, проводящими электрический ток (электролитами). Это разрушение происходит на границе между металлом и жидкостью и вызвано электрохимической реакцией, возникающей между ними, аналогично явлению, протекающему в гальваническом элементе. Таким электролитом по своему химическому составу является морская вода. Металлический же корпус судна, представляющий собой неоднородный по структуре материал, образует большое количество микрогальванических пар, являющихся анодами, с участков которых металл, корродируя, переходит в раствор.
В судостроении наибольшие потери металлов от корродирования происходят вследствие электрохимической коррозии, влияние на которую оказывает состав морской воды (наличие в ней солей и содержание кислорода).
Известно, что введение, например, в сталь легирующих элементов повышает ее антикоррозионную стойкость.
Рассматривая коррозионные разрушения корпуса, можно обнаружить следующую закономерность: наибольшему разрушению подвергается наружная обшивка корпуса в районах грузовой ватерлинии и действия гребных винтов, верхняя палуба у бортов, концевые поперечные переборки, палубы трюмов в районе льял, сварные швы и головки заклепок.
Методами борьбы с коррозией корпуса судна являются: выбор металла, обладающего наибольшей коррозионной стойкостью в определенных условиях эксплуатации судна; применение легированных сталей; нанесение на поверхность металла различных покрытий - гальванизация, металлизация и плакирование металлом (цинком, никелем, хромом и др.), лакокрасочные покрытия и установка электрохимической (катодной и протекторной) защиты, а также исключение контактов стальных конструкций с деталями из других сплавов, в первую очередь с цветными металлами.
Наиболее эффективным способом борьбы с коррозией судового корпуса является электрохимический способ, заключающийся в установке в районе предполагаемого коррозионного разрушения проекторов - металлических накладок из магниево-алюминиевого сплава или цинка, электрический потенциал которого ниже потенциала защищаемого металла. Этот способ основан на разнице электрических потенциалов металла (катода), подвергающегося коррозии, и протектора (анода).
Кроме коррозионного разрушения, на наружной обшивке в районе гребных винтов наблюдаются внешне схожие разрушения металла в виде скопления на поверхности углублений и язвочек. Такое разрушение называется эрозией металла.
Эрозия металла происходит от механического воздействия на поверхность металла быстродвижущихся частиц жидкостей, песчинок твердых тел, взвесей, газовых пузырьков и т. п. Интенсивность эрозионного разрушения зависит от однородности структуры и твердости металла. Для увеличения эрозионной стойкости в металл корпуса вводят легирующие компоненты, повышающие его прочность и антикоррозионную стойкость, производят поверхностное упрочение, закалку и проводят другие мероприятия.
Коррозия приводит к большим объемам корпусных ремонтных работ. Обрастание корпуса и коррозия требуют периодических работ для уменьшения шероховатости наружной обшивки. Химическая коррозия (окисление) характерна для незащищенных надводных стальных конструкций.
Более опасна электрохимическая коррозия, сущность которой состоит в следующем: при размещении в электролите двух элементов с разными электрическими потенциалами между ними начинает протекать электрический ток от элемента с более низким потенциалом (анода) к элементу с более высоким потенциалом (катоду). Процесс сопровождается разрушением анода. Морская вода является электролитом, стальная наружная обшивка корпуса - анодом, а ее окалина, разнородные шлаковые и газовые включения, бронзовые гребные винты, втулки дейдвудных подшипников и др. катодом.
Наиболее интенсивно распространяется электрохимическая коррозия по наружной обшивке в районе переменной ватерлинии, у кормового подзора, в местах установки донной арматуры, в районе сварных швов. Усиленно коррозируют якорные цепные ящики, льяла, двойное дно, ватервейс, настилы под деревянными покрытиями и у комингсов люков, прачечные, душевые и т. п. Для защиты наружной обшивки от коррозии и обрастания применяют противообрастающие покрытия, которые можно разделить на четыре группы: обычные, долгосрочные, самовосстанавливающиеся и само полирующиеся.
Обычные покрытия типа ХВ-53 работоспособны в течение 12-14 мес, долгосрочные - 16-24 мес, самовосстанавливающиеся - 2,5-5 лет, само полирующиеся покрытия (СПК), основанные на медленно растворяющихся в воде органических акриловых сополимерах (выделяющих при этом токсичные вещества) и образующие пленку повышенной гладкости, до 30 мес. К само полирующимся относится покрытие "Хидрон", которое набухает, поглощая до 70-80 % воды от своей массы, и сглаживает поверхность.
В последние годы разработано много устройств ультразвуковой защиты от обрастания, заставляющих обшивку корпуса слабо вибрировать, что не позволяет морским организмам и водорослям прикрепляться к ее поверхности. Для уменьшения коррозии цистерн в балластную воду и некоторые нефтепродукты добавляют специальные ингибиторы (замедлители), отдельные конструкции и узлы, трубопроводы выполняют из нержавеющей стали, поверхности определенных деталей оксидируют для образования прочной и плотной пленки окислов (обычно применяют фосфатирование).
При протекторной защите к наружной обшивке корпуса на приварных шпильках крепят изготовленные из сплавов на алюминиевой основе протекторы, являющиеся по отношению к обшивке анодом. Радиус действия протекторов ограничен. Более эффективна катодная защита, при которой в определенных районах наружной обшивки на изолированном стеклопластиком участке крепят железокремниевые или платинотитановые экраны.
Положительный полюс судового источника постоянного тока подводят к экрану (анод), отрицательный - к корпусу судна (катод). Защиту многих деталей, трубопроводов от коррозии обеспечивают цинкованием, хромированием и т. п. В последнее время получила распространение профилактическая и преддоковая очистка корпусов судов под водой. В первом случае удаляется только обрастание, а во втором - вместе с обрастанием снимается и старая краска.
Сущность очистки с помощью механического очистного органа заключается в воздействии на очищаемую поверхность пучков стальных проволок, шарошек, пластинок, скребков, ударников, которые подвергают наслоения удару, срезанию, царапанию, рыхлению и частичному заглаживанию. Наиболее распространенными средствами механизации очистки на отечественных заводах являются агрегаты с механическим рабочим органом в виде щеточных и шарошечных барабанов.
Создание эффективных и надежных дробеструйных и дробеметных агрегатов с замкнутым циклом регенерации дроби требует серьезной конструкторско-технологической проработки. Получил распространение гидродинамический способ, использующий подаваемую под давлением воду в качестве средства очистки и повышающий качество очистки.
Эффективность очистки повышается за счет совместного использования динамического и кавитационного воздействия высоконапорной затопленной струи воды на обрабатываемую поверхность. При истечении высоконапорной затопленной (при подводной очистке) струи из насадки со скоростью 32 м/с и более при давлении 0,6 МПа и более образуется кавитационная зона, заполненная выделившимися из жидкости в процессе ее расширения газами и парами.
Практическое использование ряда напряжений
Ряд напряжений используется на практике для сравнительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе:
-
Металлы, стоящие левее, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Например, взаимодействие Zn + Cu2+ → Zn2+ + Cu возможно только в прямом направлении.
-
Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот - неокислителей; наиболее активные металлы (до алюминия включительно) - и при взаимодействии с водой.
-
Металлы, стоящие в ряду правее водорода, с водными растворами кислот - неокислителей при обычных условиях не взаимодействуют.
-
При электролизе металлы, стоящие правее водорода, выделяются на катоде; восстановление металлов умеренной активности сопровождается выделением водорода; наиболее активные металлы (до алюминия) невозможно при обычных условиях выделить из водных растворов солей.
Электрохимический ряд активности металлов
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au
Элементы расположены в порядке возрастания стандартного электродного потенциала.
-
«Изомеры. Гомологи» 10 класс
Кейс
На уроке химии троечник Вася сказал, что гомологами называют вещества, различающиеся по своему составу на группу CH2. Однако отличница Катя сказала, что такое возможно не всегда и Вася дал неправильное определение. В качестве доказательства Вася привел формул двух соединений: С4Н8 и С5Н10. Однако Катя сказала, что данные вещества не могут быть гомологами и в качестве доказательства привела их структурные формулы:
Н2С СН2
и СН2=СН- СН2-СН2-СН3
Н2С СН2
Задания:
-
Уточните данное Васей определение.
-
Дайте определение, что такое изомер, приведите примеры веществ - изомеров и их названия.
-
Виды изомерии.
-
Приведите структурные формулы трех изомерных соединений A, B и C, отличающихся от соединения X на группу CH2, но не являющихся его гомологами.
Информационный материал:
§16,17 стр. 113-126 10 класс
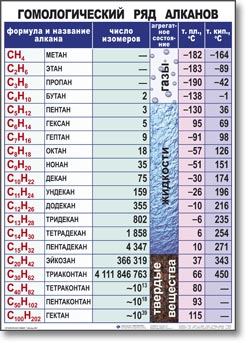
Гомологи - вещества, принадлежащие к одному классу, сходные по составу, строению и свойствам, но различающиеся на одну или несколько групп СН2 (группу СН2 называют гомологической разностью).
Гомологическим рядом называется ряд веществ, расположенных в порядке возрастания их молекулярных масс, сходных по строению и химическим свойствам, где каждый член отличается от предыдущего на группу СН2.
Изомеры - это вещества, имеющие одинаковый состав и молекулярную массу, но разные физические и химические свойства. Различия в свойствах изомеров обусловлены различиями в их химическом или пространственном строении.
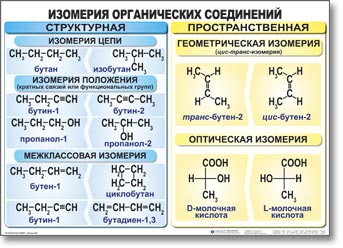
Под химическим строением понимают природу и последовательность связей между атомами в молекуле. Изомеры, молекулы которых отличаются по химическому строению, называют структурными изомерами.
Структурные изомеры могут отличаться:
-
по строению углеродного скелета
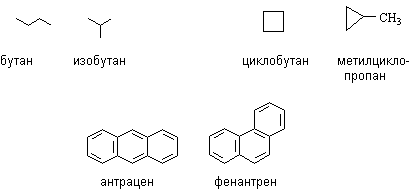


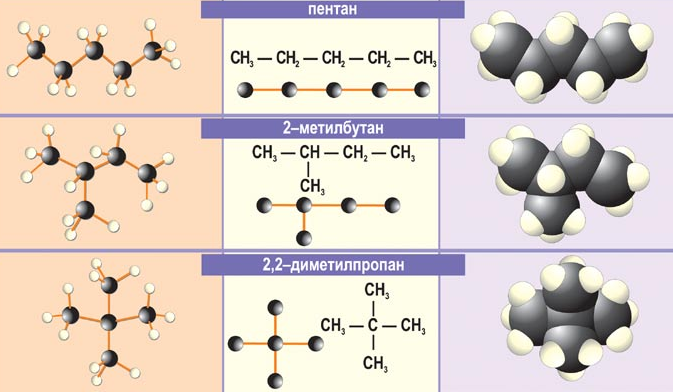
-
по положению кратных связей и функциональных групп
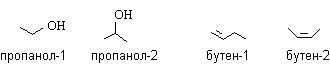
-
по типу функциональных групп
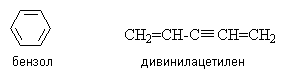
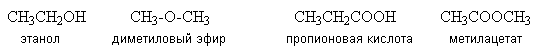
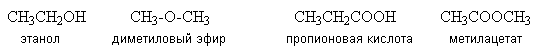
Межклассовая изомерия (когда одной и той же формуле C2H5O2N соответствуют вещества, принадлежащие к различным классам), например:
CH3CH2NO2 H2N-CH2-COOH
нитроэтан и глицин
Другими примерами могут служить:
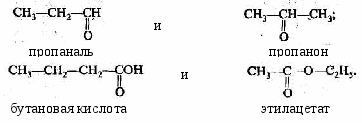
Изомерия положения, заключающаяся в различном расположении:
-
кратной связи
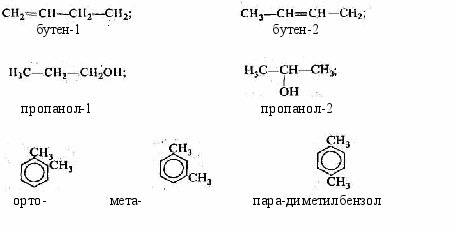
-
функциональной группы:

-
радикалов-заместителей в цикле:

Пространственная или стереоизомерия
Геометрическая изомерия, характерная для соединений, содержащих двойную связь или замкнутый цикл из атомов углерода. В таких молекулах можно провести условную плоскость по σ-связям таким образом, что заместители, расположенные у разных атомов углерода, могут оказаться как по одну (цис-изомер), так и по разные стороны от этой плоскости (транс-изомер):
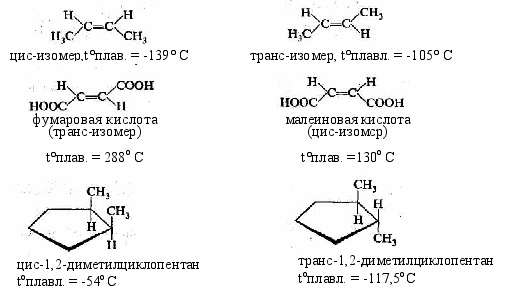
Оптическая изомерия, в которой изомеры имеют совершенно одинаковые физические и химические свойства, поворачивают плоскость поляризации света на равный угол, но (!) в противоположных направлениях. Так, например, 2-оксипропановая (молочная) кислота имеет два изомера:
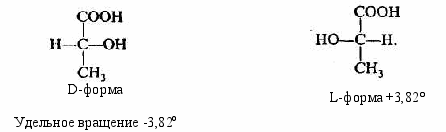
Такие изомеры являются зеркальным отражением друг друга и при вращении молекулы не могут быть совмещены. Необходимо обратить внимание на то, что центральный атом углерода в этих молекулах окружен четырьмя разными заместителями. Такой атом углерода называется асимметрическим, и наличие его в молекуле является непременным признаком того, что для этой молекулы существует оптический изомер
И, наконец, еще один вид изомерии, который можно назвать динамической изомерией,- таутомерия. В этом случае вещества при установившемся равновесии представляют собой смеси двух (или более) взаимопревращающихся изомеров - таутомеров. Наиболее известным примером является кето-енольная таутомерия в реакции Кучерова (гидратация ацетилена):
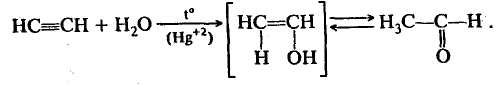
виниловый спирт этаналь
(енольная форма) (кетоформа)
-
«Структурная теория органических соединений. Основные классы органических соединений» 10 класс
Кейс
Эти два профессора возглавляли кафедры неорганической и органической химии в Петербургском университете. Друзьями они не были. Первое их столкновение произошло из-за увлечения спиритизмом. Один активно пропагандировал спиритизм, чем и вызвал возмущение другого.
В 1870-1880 гг. заведующий кафедрой неорганической химии выступил против теории химического строения, разработанной его коллегой. Особенно резко он сформулировал свое отношение к этой теории в третьем издании учебника "Основы химии": «Понятия структуристов не могут быть сочтены за истинные". В результате студенты Петербургского университета слушали курс неорганической химии, где отрицалась теория химического строения, а затем слушали курс органической химии, где утверждалась полезность этой теории.
Задания:
-
Кто были эти ученые - заведующие кафедрами Петербургского университета?
-
Назовите основные положения структурной теории органических соединений.
-
Приведите примеры, доказывающие правильность теории строения органических веществ.
-
Назовите основные классы органических соединений, их функциональные группы, представителей.
-
Заполните таблицу:
Класс соединений
Признак класса, функциональная группа
Общая формула класса
Пример соединений
Алканы
Циклоалканы
Алкены
Алкины
Алкадиены
Арены
Спирты
Простые эфиры
Кетоны
Альдегиды
Карбоновые кислоты
Сложные эфиры
Информационный материал
§ 16 - 17 стр. 113 - 126 10 класс
ru.wikipedia.org/
Дми́трий Ива́нович Менделе́ев (1834, Тобольск -1907, Санкт-Петербург) - русский ученый, профессор Санкт- Петербургс-кого университета; член-корреспондент по разряду «физический» Императорской Санкт-Петербургской Академии наук. Среди наиболее известных открытий - периодический закон химических элементов.
Биография:
-
1841 - поступил в тобольскую гимназию; 1855 - окончил физико-математический факультет Главного педагогического института в Санкт-Петербурге; 1855 - старший учитель Симферопольской мужской гимназии; 1855-1856 - старший учитель гимназии в Одессе; 1856 - блестяще защитил диссертацию, присвоена учёная степень магистра химии; 1857 - 9 января утверждён в звании приват-доцента Императорского Санкт-Петербургского университета по кафедре химии; 1857-1890 - преподавал в Императорском Санкт-Петербургском университете (с 1865 года - профессор химической технологии, с 1867 - профессор общей химии) - во 2-м кадетском корпусе читает лекции по химии; одновременно в 1863-1872 годах - профессор Санкт-Петербургского технологического института, в 1863-1872 годах руководил химической лабораторией института; 1859-1861 - находился в научной командировке в Гейдельберге.
Алекса́ндр Миха́йлович Бу́тлеров (1828,Чистополь - 1886, деревня Бутлеровка) - русский химик, создатель теории химического строения органических веществ, родоначальник «бутлеровской школы» русских химиков, ректор Императорского Казанского университета в 1860-1863 годах. 
Биография:
-
1844-1849 гг. студент Казанского университета «разряда естественных наук»; 1849 - преподаватель, с 1854 экстраординарный, а с 1857 ординарный профессор химии в том же университете. В 1860-1863 был дважды его ректором; 1868-1885 ординарный профессор химии Петербургского университета. В 1885 году вышел в отставку, но продолжал читать в университете специальные курсы лекций. В 1870 был избран адъюнктом, в 1871 - экстраординарным, а в 1874 - ординарным академиком Петербургской АН; 1878-1882 преемник Н. Н. Зинина на посту председателя Отделения химии Русского химического общества.
Теория химического строения органических веществ была сформулирована А. М. Бутлеровым в 1861 году.
У этой теории четыре положения:
-
Атомы в молекуле соединены в определённой последовательности в соответствии с их валентностью. Эта последовательность называется химическим строением. Углерод в органических соединениях всегда четырехвалентен, а его атомы способны соединяться друг с другом, образуя различные цепи. Порядок соединения атомов в молекулах может быть отображен при помощи структурных формул.
-
Свойства веществ определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекуле, т.е. химическим строением вещества. Различное строение при одном и том же составе и относительной молекулярной массе вещества обуславливает явление изомерии. Вещества, имеющие один и тот же состав, но разное строение, называются изомерами.
-
Свойства органических соединений зависят от взаимного влияния атомов и групп атомов в молекуле друг на друга. Наибольшее влияние оказывают атомы, непосредственно связанные друг с другом. Влияние атомов или групп атомов, не связанных непосредственно, ослабевает по мере их удаления друг от друга.
-
Зная строение вещества, можно предположить его свойства. И наоборот, зная свойства вещества, можно предположить его строение.
СН3 - СН2 - ОН этиловый спирт
С2Н6О
СН3 - О - СН3 диметиловый эфир
Основные положения современной теории строения
-
Свойства веществ зависят не только от их химического строения, но также и от их электронного и пространственного строения;
-
Вещества, которые имеют один и тот же качественный и количественный составы, но отличаются по своему строению и свойствам, называются изомерами, а явление существования таких веществ носит название изомерии;
СН3 - СН2 - СН2 - СН3 СН3 - СН - СН3
│
СН3
БУТАН (С4Н10) ИЗОБУТАН (С4Н10)
(t кип. = -11,7 С) (t кип. = - 0,5 С)
Объективными предпосылками ее появления явились: а) Введение в химию понятий о валентности и особенно, о четырехвалентности атома углерода, б) Введение понятия об углерод-углеродной связи. в) Выработка правильного представления об атомах и молекулах.
А.М. Бутлеров утверждал, что каждому веществу соответствует одна химическая формула: она характеризует все химические свойства вещества, реально отражает порядок химической связи атомов в молекулах. В последующие годы А.М. Бутлеров и его ученики осуществили ряд экспериментальных работ с целью проверки правильности предсказаний, сделанных на основе теории химического строения. Так, были синтезированы изобутан, изобутилен, изомеры пентана, ряд спиртов и др. По значимости для науки эти работы можно сравнить с открытием предсказанных Д.И. Менделеевым элементов (экабор, экасилиций, экаалюминий).
Бутлеров говорил:
«Способность атомов соединяться друг с другом различна. Особенно интересен в этом отношении углерод, который, по мнению Августа Кекуле, является четырехвалентным. Если представить валентность в виде щупальцев, с помощью которых атомы связываются между собой, нельзя не заметить, что способ связи отражается на свойствах соответствующих соединений. Может быть, настало время, когда наши исследования должны стать основой новой теории химического строения веществ. Эта теория будет отличаться точностью математических законов и позволит предвидеть свойства органических соединений».
Основные классы органических соединений
Органические соединения классифицируют по двум основным признакам: строению углеродного скелета и функциональным группам.
По строению углеродного скелета различают ациклические, карбоциклические и гетероциклические соединения.
Ациклические соединения - содержат открытую цепь атомов углерода.
Карбоциклические соединения - содержат замкнутую цепь углеродных атомов и подразделяются на алициклические и ароматические. К алициклическим относятся все карбоциклические соединения, кроме ароматических. Ароматические соединения содержат циклогексатриеновый фрагмент (бензольное ядро).
Гетероциклические соединения - содержат циклы, включающие наряду с атомами углерода один или несколько гетероатомов.
По природе функциональных групп органические соединения делят на классы.
Таблица 1. Основные классы органических соединений.
Функциональная группа
Класс соединений
Общая формула
Отсутствует
Углеводороды
R-H
Галоген
-F, -Cl, -Br, -I (-Hal)
Галогенпроизводные
R-Hal
Гидроксильная
-ОН
Спирты и фенолы
R-OH
Ar-OH
Алкоксильная
-OR
Простые эфиры
R-O-R
Амино
-NH2, >NH, >N-
Амины
RNH2, R2NH, R3N
Нитро
-NO2
Нитросоединения
RNO2
Карбонильная
Альдегиды и кетоны
Карбоксильная
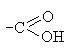
Карбоновые кислоты
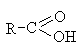
Алкоксикарбонильная
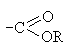
Сложные эфиры
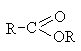
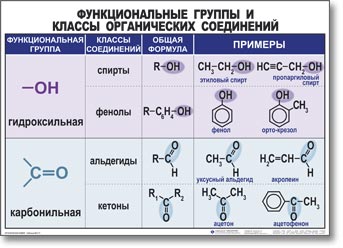
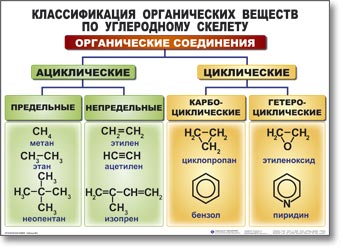
Основные классы углеводородов
Алканы - предельные углеводороды, атомы которых связаны только одинарными связями. Общее строение, которых можно выразить формулой CnH2n+2. (пропан СН3-СН2-СН3)
Циклоалканы - предельные углеводороды, атомы которых, как и у алканов связаны одинарными связями. Общая формула циклоалканов СnH2n. ( СН2 СН2
Циклобутан)
СН2 СН2
Алкены - непредельные углеводороды, содержащие кроме одинарных, одну двойную связь. Общая формула алкенов СnH2n. (бутен-1 СН2=СН-СН2-СН3)
Алкадиены - это непредельные углеводороды, имеющие в своей молекуле две двойные углерод - углеродные связи. Алкадиены имеют общую формулу СnH2n-2. (бутадиен-1,3 СН2=СН-СН=СН2)
Алкины - непредельные углеводороды, молекулы которых содержат одну тройную углерод-углеродную связь. Алкины имеют общую формулу СnH2n-2. ( пропин СН≡С-СН3)
Общие формулы гомологических рядов
Гомологический ряд
Общая формула
Молярная масса
Алканы
CnH2n+2
14n+2
Алкены
CnH2n
14n
Алкины
CnH2n-2
14n-2
Алкадиены
CnH2n-2
14n-2
Циклоалканы
CnH2n
14n
Арены
CnH2n-6
14n-6
Моногалогеналканы
CnH2n+1X
14n+1+M(X)
Дигалогеналканы
CnH2n+X2
14n+2+M(X)
Предельные одноатомные спирты
CnH2n+1OH или CnH2n+2O
14n+18
Альдегиды
CnH2n+1COH или CnH2nO
14n+30
Предельные одноосновные карбоновые кислоты
CnH2n+1СООH или CnH2nО2
14n+46
Простые эфиры
CnH2n+2О
14n+18
Первичные амины
CnH2n+1NH2 или CnH2n+3N
14n+17
Аминокислоты
(NH2)CnH2nCOOH
14n+61
Трехатомный спирт
CnH2n-1(OH)3
14n+50
Сложные эфиры
CnH2nO2
14n+32
11 класс
-
«Сложные эфиры» 11 класс
Кейс
Исследование газопылевого облака Стрелец B2 в центре Млечного пути привело к неожиданным результатам! Выяснилось, что оно состоит из интереснейших компонентов! Кроме любимого народом этилового спирта и любимого хозяйками уксусной кислоты, в облаке нашёлся ещё и этилформиат, который отвечает за характерный вкус малины и за запах рома. Справедливости ради надо сказать, что вкус малины формируется не только этилформиатом, но и другими веществами, но этиловый спирт с растворённым в нём этилформиатом ну очень смахивает на ром! Месторождения рома, увы, не получится исследовать - Стрелец B2 удалён от нас на 26 тысяч световых лет…
Задания:
-
Напишите формулу этилформиата.
-
К какому классу соединений относится данное вещество?
-
Перечислите основные химические свойства данного класса соединений, способы получения.
-
Применение веществ данного класса.
-
Какие еще запахи и вкусы «присутствуют» у веществ данного класса соединений?
Информационный материал:
§8 стр. 35 - 38 11 класс
Сло́жные эфи́ры - производные оксокислот, формально являющиеся продуктами замещения атомов водорода гидроксилов -OH кислотной функции на углеводородный остаток (алифатический, алкенильный, ароматический или гетероароматический). Отличаются от простых эфиров, в которых два углеводородных радикала соединены атомом кислорода (R1-O-R2).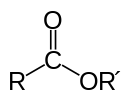
Синтез
Основные методы получения сложных эфиров:
-
Этерификация - взаимодействие кислот и спиртов в условиях кислотного катализа, например получение этилацетата из уксусной кислоты и этилового спирта:
СН3COOH + C2H5OH = СН3COOC2H5 + H2O
-
взаимодействие ангидридов или галогенангидридов карбоновых кислот со спиртами, например получение этилацетата из уксусного ангидрида и этилового спирта:
(CH3CO)2O + 2 C2H5OH = 2 СН3COOC2H5 + H2O
Свойства и реакционная способность
Сложные эфиры низших карбоновых кислот и простейших одноатомных спиртов - летучие бесцветные жидкости с характерным, зачастую фруктовым запахом. Сложные эфиры высших карбоновых кислот - бесцветные твердые вещества, температура плавления зависит как от длин углеродных цепей ацильного и спиртового остатков, так и от их структуры.
1. Гидролиз сложных эфиров - важнейшая реакция этой группы веществ. Гидролиз под действием воды - обратимая реакция. Для смещения равновесия вправо используются щелочи:
R-СО-OR' + Н20 <---H+---> R-СО-ОН + R'OH,
R-СО-OR' + NaOH -> R-СО-ONa + R'OH
2. Восстановление сложных эфиров водородом приводит к образованию двух спиртов:
R-СО-OR' + [Н] -> R-СН2-ОН + R'OH
-
Под действием аммиака сложные эфиры превращаются в амиды кислот: R-СО-OR' + Н-NH2 -> R-СО-NH2 + R'OH.
Применение
Сложные эфиры широко используются в качестве растворителей, пластификаторов, ароматизаторов.
Эфиры муравьиной кислоты
-
HCOOCH3 - метилформиат, tкип = 32 °C; растворитель жиров, минеральных и растительных масел, целлюлозы, жирных кислот; ацилирующий агент; используют в производстве некоторых уретанов, формамида.
-
HCOOC2H5 - этилформиат, tкип = 53 °C; растворитель нитрата и ацетата целлюлозы; ацилирующий агент; отдушка для мыла, его добавляют к некоторым сортам рома, чтобы придать ему характерный аромат; применяют в производстве витаминов B1, A, E.
-
HCOOCH2CH(CH3)2 - изобутилформиат несколько напоминает запах ягод малины.

-
HCOOCH2CH2CH(CH3)2 - изоамилформиат (изопентилформиат) растворитель смол и нитроцеллюлозы.
-
HCOOCH2C6H5 - бензилформиат, tкип = 202 °C; имеет запах жасмина; используется как растворитель лаков и красителей.

-
HCOOCH2CH2C6H5 - 2-фенилэтилформиат имеет запах хризантем.

Эфиры уксусной кислоты
-
CH3COOCH3 - метилацетат, tкип = 58 °C; по растворяющей способности аналогичен ацетону и применяется в ряде случаев как его заменитель, однако он обладает большей токсичностью, чем ацетон.
-
CH3COOC2H5 - этилацетат, tкип = 78 °C; подобно ацетону растворяет большинство полимеров. По сравнению с ацетоном его преимущество в более высокой температуре кипения (меньшей летучести).
-
CH3COOC3H7 - н-пропилацетат, tкип = 102 °C; по растворяющей способности подобен этилацетату.
-
CH3COOCH(CH3)2 - изопропилацетат, tкип = 88 °C; по растворяющим свойствам занимает промежуточное положение между этил- и пропилацетатом.
-
CH3COOC5H11 - н-амилацетат (н-пентилацетат), tкип = 148 °C; напоминает по запаху грушу, применяется как растворитель для лаков, поскольку он испаряется медленнее, чем этилацетат.

-
CH3COOCH2CH2CH(CH3)2 - изоамилацетат (изопентилацетат), используется как компонент грушевой и банановой эссенций.
-
CH3COOC8H17 - н-октилацетат имеет запах апельсинов.

Эфиры масляной кислоты
-
C3H7COOCH3 - метилбутират, tкип = 102,5 °C; по запаху напоминает ранет.
-
C3H7COOC2H5 - этилбутират, tкип = 121,5 °C; имеет характерный запах ананасов.

-
C3H7COOC4H9 - бутилбутират, tкип = 166,4 °C;
-
C3H7COOC5H11 - н-амилбутират (н-пентилбутират) и C3H7COOCH2CH2CH(CH3)2 - изоамилбутират (изопентилбутират) имеют запах груш, а также служат растворителями в лаках для ногтей.
Эфиры изовалериановой кислоты
-
(CH3)2CHCH2COOCH2CH2CH(CH3)2 изоамилизовалерат (изопентилизовалерат) имеет запах яблока.

Применение в медицине
В конце XIX - начале XX века, когда органический синтез делал свои первые шаги, было синтезировано и испытано фармакологами множество сложных эфиров. Они стали основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами.
НЕКОТОРЫЕ СЛОЖНЫЕ ЭФИРЫ, обладающие фруктовым или цветочным ароматом (фрагменты исходных спиртов в формуле соединения и в названии выделены жирным шрифтом)
Формула сложного эфира
Название
Аромат
СН3СООС4Н9
Бутилацетат
грушевый
С3Н7СООСН3
Метиловый эфир масляной кислоты
яблочный
С3Н7СООС2Н5
Этиловый эфир масляной кислоты
ананасовый
С4Н9СООС2Н5
Этиловый эфир изовалериановой кислоты
малиновый
С4Н9СООС5Н11
Изоамиловый эфир изовалериановой кислоты
банановый
СН3СООСН2С6Н5
Бензилацетат
жасминовый
С6Н5СООСН2С6Н5
Бензилбензоат
цветочный
-
«Жиры» 11 класс
Кейс
Жиры - смесь сложных эфиров, образованных глицерином и жирными кислотами. М.Э. Шеврель посвятил изучению жиров 14 лет. В 1808 году к нему обратился владелец текстильной фабрики с просьбой изучить состав мягкого мыла, получаемого на фабрике. Шеврель установил, что мыло - натриевая соль высшей жирной кислоты. Шеврель изготовлял мыла из жиров различных животных, выделял из них жирные кислоты. Так были впервые получены стеариновая, олеиновая, капроновая кислоты. Шеврель показал, что жиры состоят из глицерина и жирных кислот, причем это не только их смесь, а соединение, которое, присоединяя воду, распадается на глицерин и жирные кислоты.
Задания:
-
Каковы формулы жира и мыла?
-
Напишите по одной структурной формуле жидкого и твердого жиров.
-
Предложите способ получения мыла из жира в домашних условиях.
Найдите из других источников дополнительную информацию о жирах, мылах, СМС.
-
В современном мире предлагается много косметической, гигиенической продукции. А как правильно выбрать мыло, на что надо обратить внимание?
Информационный материал
§9 стр. 38 - 43 11 класс
Жиры - сложные эфиры глицерина и высших одноосновных карбоновых кислот.
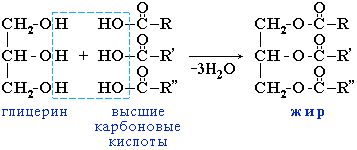
Общее название таких соединений - триглицериды или триацилглицерины, где ацил - остаток карбоновой кислоты -C(O)R.
В состав природных триглицеридов входят остатки насыщенных (предельных) кислот (пальмитиновой C15H31COOH, стеариновой C17H35COOH и др.) и ненасыщенных (непредельных) кислот (олеиновой C17H33COOH, линолевой C17H31COOH, линоленовой C15H29COOH и др.). Природные кислоты, образующие молекулы жира, имеют неразветвленное строение и содержат четное число углеродных атомов (от 4 до 24). В ненасыщенных кислотах присутствуют связи С=С в цис-форме. Эти особенности строения жиров обусловлены процессами биосинтеза. Жиры содержатся во всех растениях и животных. Они представляют собой смеси полных сложных эфиров глицерина и не имеют чётко выраженной температуры плавления.
Физические свойства жиров.
-
Животные жиры (бараний, свиной, говяжий и т.п.), как правило, являются твердыми веществами с невысокой температурой плавления (исключение - рыбий жир). В твёрдых жирах преобладают остатки насыщенных кислот.
-
Растительные жиры - масла (подсолнечное, соевое, хлопковое и др.) - жидкости (исключение - кокосовое масло, масло какао-бобов). Масла содержат в основном остатки ненасыщенных (непредельных) кислот.
Жидкие жиры превращают в твердые путем реакции гидрогенизации (каталитического гидрирования). При этом водород присоединяется по двойной связи, содержащейся в углеводородном радикале молекул масел.
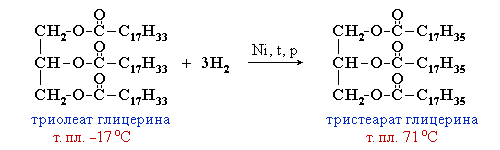
Продукт гидрогенизации масел - твердый жир (искусственное сало, саломас). Маргарин - пищевой жир, состоит из смеси гидрогенизированных масел (подсолнечного, кукурузного, хлопкового и др.), животных жиров, молока и вкусовых добавок (соли, сахара, витаминов и др.).
В условиях процесса гидрогенизации масел (высокая температура, металлический катализатор) происходит изомеризация части кислотных остатков, содержащих цис-связи С=С, в более устойчивые транс-изомеры.
Жирам как сложным эфирам свойственна обратимая реакция гидролиза, катализируемая минеральными кислотами. При участии щелочей (или карбонатов щелочных металлов) гидролиз жиров происходит необратимо. Продуктами в этом случае являются мыла - соли высших карбоновых кислот и щелочных металлов.
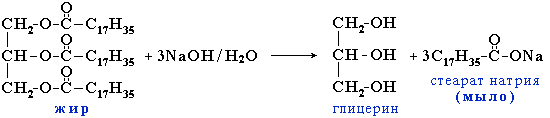
Натриевые соли - твердые мыла, калиевые - жидкие. Реакция щелочного гидролиза жиров, и вообще всех сложных эфиров, называется также омылением.
Высшие карбоновые кислоты можно выделить из мыла действием более сильных кислот. При длительном хранениии жиры портятся (прогоркают). Под действием воздуха, света и микроорганизмов происходит частичный гидролиз жиров с образованием свободных жирных кислот и продуктов их превращения, обычно имеющих неприятный запах и вкус. Срок годности жиров увеличивается при низкой температуре и в присутствии консервантов (чаще всего поваренной соли). Жиры, содержащие остатки ненасыщенных кислот, способны к окислению по связям С=С. Важное значение имеют так называемые высыхающие масла (льняное, тунговое и др.), которые входят в состав красок и лаков (в частности, олифы). Эти масла отличаются высоким содержанием остатков кислот с двумя или тремя двойными связями и способны к образованию на окрашиваемой поверхности прочной пленки за счет полимеризации по кратным связям под действием кислорода воздуха.
Свойства мыла.
Многие свойства мыла, например, твёрдость, растворимость в воде, пенообразование, моющая способность, зависят от его жирового состава.
Так, входящая в состав свиного и говяжьего сала пальмитиновая кислота даёт мылу твёрдость и хорошие пенообразующие качества, а олеиновая кислота - растворимость в холодной воде и моющую способность. Стеариновая кислота усиливает моющее действие мыла в горячей воде. Благодаря лауриновой кислоте, содержащейся в кокосовом масле, мыло лучше растворяется в холодной воде, увеличивается его моющая способность и уменьшается набухание; но эта кислота может вызвать раздражение кожи. А вот из-за линолевой кислоты (компонент свиного сала) мыло приобретает неприятный запах и становится непригодным к длительному хранению. Поэтому содержание свиного сала в жировых смесях, используемых для варки мыла, как правило, невелико. Помимо жировой основы в состав мыла вводят также различные добавки. Это наполнители (оксид титана или цинка), парфюмерные отдушки, красители, увлажняющие компоненты (глицерин, касторовое масло, воски животного происхождения - ланолин и спермацет). Бактерицидные и дезодорирующие мыла содержат антисептические вещества, например, триклозан.
Понятие о синтетических моющих средств (СМС) и мыло
Синтетические моющие средства - это натриевые соли кислых сложных эфиров высших спиртов и серной кислоты:
R-CH2-OH + H-O-SO2-OH R-CH2-O-SO2-OH + H2O
R-CH2-O-SO2-OH + NaOH R-CH2-O-SO2-ONa + H2O
В последние годы производство синтетических моющих средств (СМС) в мире стало исчисляться уже десятками миллионов тонн в год. Около 70% потребляемых населением СМС расходуется на так называемые общие стирки, которые осуществляются раз в 3-7 дней. Это стирка, при которой стирают постельное, столовое и нательное белье, проводят чаще всего в стиральных машинах. Около 20% СМС расходуется на "легкую" стирку слабозагрязненной изделий из тонких тканей вручную в теплой воде. СМС для легкой стирки не должны делать раздражающего действия на кожу рук, должны создавать обильную пену и хорошо стирать при температуре воды 25-45 С.Несмотря на то, что наступила эпоха СМС, мыло еще полностью не сдало свои позиции: его рекомендуется использовать для ручной стирки изделий из хлопчатобумажных и льняных тканей. Если окунуться в далекое прошлое, то можно узнать про мыло много интересного. Так, в далекой древности волосы для красоты намазывали маслами и благовониями. В дни траура голову посыпали пеплом. А потом - странное дело - жир легко смывался, волосы становились чистыми, блестящими. Ведь пепел в сочетании с маслами - прообраз мыла. Это свойство и использовали четыре тысячелетия назад, создав мылоподобное полужидкое вещество "сапо". Применяли его не столько с гигиеническими, сколько с косметическими целями. Липкая, легко засыхаемая, быстро смываемая масса служила для укладки волос. Вспомните мудрые сооружения на головах и закрученные в мелкие жгуты бороды на изображениях древних вавилонян. Для стирки же использовали моющие глины и соки таких растений, как мыльный корень, мыльнянки. После изобретения в XVI веке стиральной доски получил распространение и другой способ стирки: белье укладывали в чан, над ним расстилалась полотно, на которое насыпали золу. В чан через полотно заливали горячую воду - от смешения с золой получался щелок, и белье отстирывалось быстрее. На Руси и в некоторых других странах щелок брали с собой в баню вместо мыла. Мыло же долгое время стояло в одном ряду с медицинскими средствами и лекарствами. И только в 1424 году в Италии, в Севони, промышленным путем стали выпускать твердое мыло. Жиры соединяли не с золой, а с природной кальцинированной содой, что добывали из озер. Для варки мыла использовали говяжье, баранье, свиное, лошадиное сало, костяной, китовый и рыбий жир, отходы жиров различных производств. Добавляли и растительные масла - льняное, хлопковое, оливковое, миндальное, кунжутовое, кокосовое и пальмовое.
Как правильно выбирать мыло и на что обращать внимание?
Прежде всего, нужно тщательно прочитать состав мыла на упаковке. Если Вы найдете там вещества, список которых приведено ниже, то это, скорее всего, мыло массового промышленного производства.
Полипропилен гликоль
(propillene glycol)
Продукт, который получают из нефти, используется в косметической продукции, а также для приготовления антифриза и тормозной жидкости. Он более дешевый, чем глицерин, но вызывает больше аллергических реакций и воспаление кожи.
Лаурет сульфат натрия (Sodium Laureth Sulfate)
Дешевое моющее средство, образует много пены, при этом возникает иллюзия, что он имеет очень сильные моющие свойства. Есть предположение, что это канцероген.
ПАВ
поверхностно активные вещества
Все они являются нефтепродуктами - DEA (Diethnolamine) MEA (Monoethanolamine) TEA (Triethanolamine), Cacamide DEA, DEA-cetyl phosphate, DEA Oleth-3 phosphate, Myristamide DEA, Stearamide MEA, Cocamide MEA, Lauramide DEA, Linoleamide MEA, Oleamide DEA, TEA Lauryl Sulfate - все эти компоненты используются как эмульгаторы и пенообразующие вещества, раздражают кожу и глаза, существует предположение, что это канцерогены.
Формалин
Используется как консервант, но производители понимают, что неявность такого составляющего не делает продукт привлекательным для покупателя и вводят не свободный формалин, а вещества, которые его выделяют.
Бензол и толуол
Очень токсичные субстанции, обычно используются в виде бензоатов.
Диоксид титана
Используется как краситель (мыло белого цвета всегда имеет в составе диоксид титана), есть предположение, что это канцероген.
Красители
FD&C и D&C - угольная смола, есть предположение, что это канцероген
Содиум лаурил сульфат (Sodium Lauryl Sulfate)
Дешевое моющее средство, которое считают наиболее опасным в препаратах для ухода за кожей и волосами. В промышленности используют для мытья пола, машин и двигателей. Оставляет на коже пленку, которая вызывает аллергические реакции и раздражение.
Парабены (Methylparaben, Propylparaben идр.)
Аналоги сульфаниламидных препаратов, которые имеют противомикробные свойства и используются в качестве консервантов. Благодаря широчайшему распространению в косметических средствах парабены способствуют образованию новых штаммов нечувствительных к лекарствам микроорганизмов, нарушают природный иммунитет, являются наиболее частой причиной аллергических реакций на косметические средства. При всасывании проявляют токсическое действие на печень.
Если в аннотации указано, что в мыле присутствуют только соли жирных кислот, вода и натуральные добавки, такое мыло заслуживает Вашего внимания. Мыло ручной работы отличается и по внешнему виду. Как правило, оно проще по форме, имеет включение и следы от ручной нарезки. Натуральное мыло ручной работы не может иметь сильный запах (такой запах имеют только синтетические отдушки) и яркий неестественный цвет. В натуральном мыле ручной работы не может быть никаких химических и синтетических добавок.
-
«Углеводы. Глюкоза» 11 класс
Кейс
«В молодости я поставил задачу синтезировать свой собственный завтрак и могу утверждать, что в значительной мере ее выполнил», утверждал один из знаменитых немецких химиков на своей лекции. Химиком был Эмиль Фишер, немецкий химик-органик, лауреат Нобелевской премии 1902 года.
Задания:
-
Какие основные исследования были проведены Эмилем Фишером?
-
За что Фишер получил Нобелевскую премию по химии?
-
Состав и структура, номенклатура углеводов.
-
Физические и химические свойства углеводов.
-
Применение углеводов, значение для человека.
-
Моносахариды.
-
Реакции брожения глюкозы.
Информационный материал
§ 10 стр. 43 - 48 11 класс
Эмиль Герман Фишер (нем. Hermann Emil Fischer; 9 октября 1852, Ойскирхен -15 июля 1919, Берлин) - немецкий химик, лауреат Нобелевской премии по химии 1902 года. 
-
1875 - синтез фенилгидразина, который был им применён как качественный реактив на альдегиды и кетоны, а впоследствии для идентификации моносахаридов;
-
1882 - исследование строения пуриновых соединений, которые привели в дальнейшем к синтезу многих важных веществ (кофеина, теобромина и др.);
-
с 1884 - масштабные исследования углеводов, определение состава и структуры, разработка номенклатуры;
-
1890 - синтез виноградного и фруктового сахара;
-
1894 - применение ферментов для синтеза химических соединений;
-
с 1899 - исследования по химии белков;
-
1901 - разработка эфирного метода анализа аминокислот, открытие аминокислот валина, пролина и оксипролина;
-
1902 - Э. Фишер предложил пептидную теорию строения белка;
-
1903 - синтез диэтилбарбитуровой кислоты (веронал, барбитал);
-
1907 - синтез полипептидов;
-
1916 - доказал сходство естественных пептонов с полипептидами осуществив синтез полипептида из 19 аминокислот (совместно с Абдергальденом).
Лауреат Нобелевской премии по химии за 1902 за работы по исследованию сахаров и пуринов, синтез глюкозы.
Моносахариды (от греческого monos: единственный, sacchar: сахар), - органические соединения, одна из основных групп углеводов; самая простая форма сахара; являются обычно бесцветными, растворимыми в воде, прозрачными твердыми веществами. Некоторые моносахариды обладают сладким вкусом. Моносахариды - стандартные блоки, из которых синтезируются дисахариды (такие, как сахароза, мальтоза, лактоза), олигосахариды и полисахариды (такие, как целлюлоза и крахмал), содержат гидроксильные группы и альдегидную (альдозы) или кетогруппу (кетозы). Каждый углеродный атом, с которым соединена гидроксильная группа (за исключением первого и последнего), является хиральным, что дает начало многим изомерным формам. Например, галактоза и глюкоза - альдогексозы, но имеют различные химические и физические свойства. Моносахариды представляют собой производные многоатомных спиртов, содержащие карбонильную группу - альдегидную или кетонную.
Виды моносахаридов
Моносахариды подразделяют на триозы, тетрозы, пентозы, гексозы и т. д. (3, 4, 5, 6 и т. д. атомов углерода в цепи); природные моносахариды с углеродной цепью, содержащей более 9 атомов углерода, не обнаружены. Моносахариды, содержащие 5-членный цикл, называются фуранозами, 6-членный - пиранозами.
Химические свойства
Моносахариды вступают в химические реакции, свойственные карбонильной и гидроксильной группам. Характерная особенность моносахаридов - способность существовать в открытой (ациклической) и циклической формах и давать производные каждой из форм. Глюкоза, например, легко образует полуацетали, соединяя свои своим С1 и О5, чтобы сформировать 6-членное кольцо, названное пиранозид. Та же самая реакция может иметь место между С1 и О4, чтобы сформировать 5-членный фуранозид.
Моносахариды в природе
Моносахариды входят в состав сложных углеводов (гликозиды, олигосахариды, полисахариды) и смешанных углеводсодержащих биополимеров (гликопротеиды, гликолипиды и др.). Биосинтез моносахаридов из углекислого газа и воды происходит в растениях (фотосинтез). Распад моносахаридов в организме (например, спиртовое брожение, гликолиз) сопровождается выделением энергии.
Углево́ды (сахара́, сахариды) - органические вещества, содержащие карбонильную группу и несколько гидроксильных групп. Название класса соединений происходит от слов «гидраты углерода», оно было впервые предложено К. Шмидтом в 1844 году. Появление такого названия связано с тем, что первые из известных науке углеводов описывались брутто-формулой Cx(H2O)y, формально являясь соединениями углерода и воды.
Источником углеводов для всех живых организмов является процесс фотосинтеза, осуществляемый растениями.
Углеводы - весьма обширный класс органических соединений, среди них встречаются вещества с сильно различающимися свойствами. Это позволяет углеводам выполнять разнообразные функции в живых организмах. Соединения этого класса составляют около 80 % сухой массы растений и 2-3 % массы животных.
Простые и сложные
Все углеводы состоят из отдельных «единиц», которыми являются сахариды. По способности к гидролизу на мономеры углеводы делятся на две группы: простые и сложные. Углеводы, содержащие одну единицу, называются моносахариды, две единицы - дисахариды, от двух до десяти единиц - олигосахариды, а более десяти - полисахариды. Моносахариды быстро повышают содержание сахара в крови, и обладают высоким гликемическим индексом, поэтому их ещё называют быстрыми углеводами. Они легко растворяются в воде и синтезируются в зелёных растениях. Углеводы, состоящие из 3 или более единиц, называются сложными. Продукты, богатые медленными углеводами, постепенно повышают содержание глюкозы и имеют низкий гликемический индекс, поэтому их ещё называют медленными углеводами.
Моносахариды
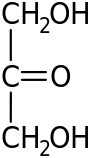
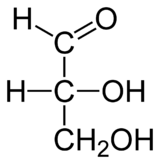
D-глицеральдегид диоксиацетон
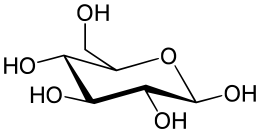
Распространённый в природе моносахарид - бета-D-глюкоза.
Моносахари́ды (от греческого monos - единственный, sacchar - сахар) - простейшие углеводы, не гидролизующиеся с образованием более простых углеводов - обычно представляют собой бесцветные, легко растворимые в воде, плохо - в спирте и совсем нерастворимые в эфире, твёрдые прозрачные органические соединения, одна из основных групп углеводов, самая простая форма сахара. Водные растворы имеют нейтральную pH. Некоторые моносахариды обладают сладким вкусом. Моносахариды содержат карбонильную (альдегидную или кетонную) группу, поэтому их можно рассматривать как производные многоатомных спиртов. Моносахарид, у которого карбонильная группа расположена в конце цепи, представляет собой альдегид и называется альдоза. При любом другом положении карбонильной группы моносахарид является кетоном и называется кетоза. В зависимости от длины углеродной цепи (от трёх до десяти атомов) различают триозы, тетрозы,пентозы, гексозы, гептозы и так далее. Среди них наибольшее распространение в природе получили пентозы и гексозы. Моносахариды - стандартные блоки, из которых синтезируются дисахариды, олигосахариды иполисахариды.
В природе в свободном виде наиболее распространена D-глюкоза (виноградный сахар или декстроза, C6H12O6) - шестиатомный сахар (гексоза), структурная единица (мономер) многих полисахаридов (полимеров) - дисахаридов: (мальтозы, сахарозы и лактозы) и полисахаридов (целлюлоза, крахмал). Другие моносахариды, в основном, известны как компоненты ди-, олиго- или полисахаридов и в свободном состоянии встречаются редко. Природные полисахариды служат основными источниками моносахаридов.
Важнейшие источники
Главными источниками углеводов из пищи являются: хлеб, картофель, макароны, крупы, сладости. Чистым углеводом является сахар. Мёд, в зависимости от своего происхождения, содержит 70-80 % глюкозы и фруктозы.
К углеводной группе, кроме того, примыкают и плохо перевариваемые человеческим организмом клетчатка и пектины.
-
«Амины. Анилин» 11 класс
Кейс
В 1862 году в Лондоне состоялась международная выставка, на которой кроме технических новинок демонстрировались химические процессы и продукты. Среди последних демонстрировалось странное неприятное вещество, вдобавок обладающее неприятным запахом. Кристаллин, кианол, бензидам - названия, которые были предложены учеными для него. Но мы его знаем совершенно под другим названием.
Задания:
-
О каком веществе идет речь?
-
Почему оно удостоилось международной выставки?
-
Имена каких ученых связаны с этим веществом?
-
К какому классу веществ принадлежит данное вещество, химические свойства представителей класса?
Информационный материал
§13 стр. 55-58 11 класс
Ами́ны - органические соединения, являющиеся производными аммиака, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы.
По числу замещённых атомов водорода различают соответственно первичные (замещен один атом водорода), вторичные (замещены два атома водорода из трех) и третичные (замещены три атома водорода из трех) амины.
По числу NH2-групп в молекуле амины делят на моноамины, диамины, триамины и так далее.
Первичный амин
Вторичный амин
Третичный амин
Номенклатура
К названию органических остатков, связанных с азотом, добавляют слово «амин» (группы упоминают в алфавитном порядке): CH3NHC3H7 - метилпропиламин, CH3N(C6H5)2 - метилдифениламин. Для высших аминов название составляется, взяв за основу углеводород, прибавлением приставки «амино», «диамино», «триамино», указывая числовой индекс атома углерода:
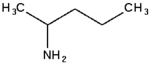 2-аминопентан
2-аминопентан
Для некоторых аминов используются тривиальные названия: C6H5NH2 - анилин (систематическое название - фениламин).
Химические свойства
Амины, являясь производными аммиака, имеют сходное с ним строение и проявляют подобные ему свойства. Для них также характерно образование донорно-акцепторной связи. Азот предоставляет неподеленную электронную пару, исполняя роль донора. В качестве акцептора электоронов может выступать, например, протон Н+, образуя ион R3NH+. Возникшая ковалентная связь N-H полностью эквивалентна остальным связям N-H в амине.
-
Взаимодействие с водой. Водные растворы аминов проявляют щелочную реакцию:
-
Взаимодействуя с кислотами, амины образуют алкиламмониевые соли, в большинстве случаев растворимые в воде:
-
Ацилирование. При нагревании с карбоновыми кислотами, их ангидридами, хлорангидридами или сложными эфирами первичные и вторичные амины ацилируются с образованием N-замещенных амидов, соединений с фрагментом -С(О)N<:
Реакция с ангидридами протекает в мягких условиях. Ещё легче реагируют хлорангидриды, реакция проводится в присутствии основания, чтобы связать образующийся HCl.
Таким образом получают жаропонижающее средство - ацетанилид:
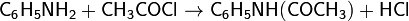
-
Ароматические амины реагируют с галогенами по механизму электрофильного замещения в бензольном ядре. При галогенировании анилина бромной водой при комнатной температуре образуется триброманилин (в виде осадка белого цвета):
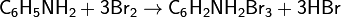
-
Первичные и вторичные амины взаимодействуют с азотистой кислотой различным образом. При помощи азотистой кислоты первичные, вторичные и третичные амины отличают друг от друга. Из первичных аминов образуются первичные спирты:
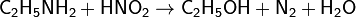
При этом выделяется газ (азот). Это признак того, что в колбе первичный амин. Вторичные амины образуют с азотистой кислотой желтые, трудно растворимые нитрозамины - соединения, содержащие фрагмент >N-N=O:
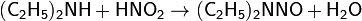
Третичные амины при обычной температуре в азотистой кислоте просто растворяются.
-
При горении амин выделяет кроме воды и углекислого газа ещё и азот:
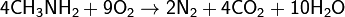
Получение
Восстановление нитросоединений - Реакция Зинина. Эту реакцию впервые осуществил Н. Н. Зинин в 1842 году. Действуя на нитробензол сульфидом аммония, он получил анилин:
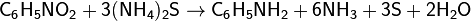
Восстановление железом:
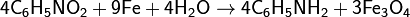
Восстановление водородом в присутствии катализатора и при высокой температуре:
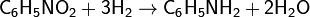
Анили́н (фениламин) - органическое соединение с формулой C6H5NH2, простейший ароматический амин. Представляет собой бесцветную маслянистую жидкость с характерным запахом, немного тяжелее воды и плохо в ней растворим, хорошо растворяется в органических растворителях. На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит. Название «анилин» происходит от названия одного из растений, содержащих индиго - Indigofera anil (современное международное название растения - Indigofera suffruticosa). 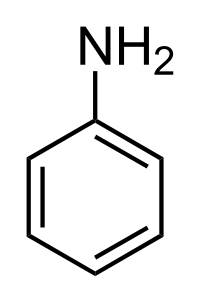
Впервые анилин был получен в 1826 году при перегонке индиго с известью немецким химиком Отто Унфердорбеном (нем. Otto Unverdorben), который дал ему название «кристаллин».
В 1834 г. Ф. Pyнгe обнаружил анилин в каменно-угольной смоле и назвал «кианолом».
В 1841 г. Ю. Ф. Фрицше получил анилин нагреванием индиго с раствором KOH и назвал его «анилином». 
В 1842 г. анилин был получен Н. Н. Зининым восстановлением нитробензола действием (NH4)2S и назван им «бензидамом».
В 1843 г. А. В. Гофман установил идентичность всех перечисленных соединений.
Промышленное производство фиолетового красителя мовеина на основе анилина началось в 1856 году.
Получение
В промышленности анилин получают в две стадии. На первой стадии бензол нитруется смесью концентрированной азотной и серной кислот при температуре 50-60 °C, в результате образуется нитробензол. На втором этапе нитробензол гидрируют при температуре 200-300 °C в присутствии катализаторов:
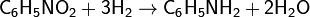
Впервые восстановление нитробензола было произведено с помощью железа:
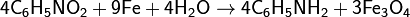
Другим способом получение анилина является восстановление нитросоединений -реакция Зинина:
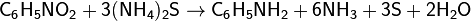
Химические свойства
Для анилина характерны реакции как по аминогруппе, так и по ароматическому кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов. С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению с алифатическими аминами и даже с аммиаком. С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол. Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок).
Анилин (аминобензол) применятся в производстве красителей, искусственных смол, текстильной и фармацевтической промышленности. Отравление анилином возможно при поступлении анилина в организм через рот, дыхательные пути и кожу. Накапливается в подкожной основе и паренхиматозных органах. Является метгемоглобинобразующим ядом, токсически влияет на центральную нервную систему, паренхиматозные органы.
Фридлиб Фердинанд Рунге - (1794 - 1867) - немецкий химик - органик.
Важнейшие научные работы посвящены изучению органических соединений, в том числе алкалоидов и красителей. В 1819 году описал токсические свойства атропина и его способность расширять зрачок, выделил из коры хинного дерева хинин (за год до П. Ж. Пельтье и Ж. Б. Каванту). Исследовал цветочные пигменты и дубильные вещества. В 1831 году во время эпидемии холеры предложил использовать хлор в качестве дезинфицирующего средства (вместо уксуса и сернистого газа). В 1834 году выделил из каменноугольной смолы карболовую кислоту, пиррол, хинолин и анилин («кианол»); обнаружил, что окисление анилина приводит к образованию окрашенных продуктов. Получил из анилина действием хлорной извести синий краситель, а действием бихромата калия и серной кислоты - чёрный.
Автор трёхтомной монографии «Химия красителей» (1834-1850), учебника «Основы химии» (1846-1847).
Никола́й Никола́евич Зи́нин (1812- 1880) - выдающийся русский химик-органик, академик Петербургской академии наук, первый президент Русского химического общества (РХО) (1868-1877).
Зинин впервые получил бензоин конденсацией бензальдегида в присутствии цианистого калия и бензил окислением бензоина азотной кислотой. В 1842 году Зинин открыл реакцию восстановления ароматических нитропроизводных в ароматические амины действием сернистого аммония (Реакция Зинина). Синтезы Зинина послужили научной основой для создания промышленности синтетических красителей, взрывчатых веществ, фармацевтических препаратов, душистых веществ и др.
Фрицше Юлий Фёдорович - (1808г. - 1871г.) - российский химик и ботаник. 
Первые работы связаны с извлечением лекарственных веществ из растений. Последующие исследования относятся главным образом к области органической химии. Изучал (конец 1830-х) производные мочевой кислоты, пурпуровую кислоту и её соли; установил природу мурексида - аммониевой соли пурпуровой кислоты (1839). При разложении индиго выделил (1840) антраниловую кислоту и описал её распад с образованием углекислого газа и азотистого основания, которое назвал анилином. Установил, что окисление анилина приводит к образованию окрашенных соединений. Открыл (1858) реакцию пикриновой кислоты с ароматическими углеводородами, приводящую к образованию хорошо кристаллизующихся молекулярных соединений. Открыл (1858) карбазол в каменноугольном дёгте, выделил углеводороды антрацен (1857), ретен (1858) и фенантрен (1869). Открыл (1868) реактив, чувствительный на углеводороды, - β-динитроантрахинон (реактив Фрицше).
-
«Химия в строительстве» 11 класс
Кейс
Известняк, по-видимому, был первым строительным материалом, какой использовал человек. Из его плит сооружены египетские пирамиды и Великая китайская стена. Наша столица Москва прозвана белокаменной именно потому, что многие ее здания возведены из известняка. Прочность кладки древних сооружений обеспечивалась идеальной подгонкой камней. (Вяжущие материалы тогда не применяли вовсе. Их научились приготавливать много позже.)
Бетон был изобретён ещё в Древнем Риме. Они изобрели бетон, который, застывая, приобретал прочность и долговечность камня.
Приходилось ли вам наблюдать, как разбирают старинные здания? Это очень нелегкое дело. Рабочие с превеликим трудом отламывают от стен кирпичи. Может быть, наши пращуры знали какой-нибудь секрет кладки? Нет. Оказывается, податливый, мягкий, как тесто, известковый раствор, которым скрепляли кирпичи, впитывает в себя углекислый газ из воздуха. Постепенно он становится тем же крепышом, каким был первоначально, - известняком. В современном строительстве известь почти не применяется. Во-первых, масса слишком долго твердеет; во-вторых, сохнет она недостаточно быстро; и в-третьих, прочность шва невелика.
Задания:
Составьте бизнес-проект по технической химии (презентацию). В Вашем распоряжении имеется сырье - известняк. Ваша задача - создать новое производство на имеющемся сырье, показать возможности создания других производств. Отразить применение, общие принципы и методы производства, схему производства (реакционный аппарат), указать химические реакции.
Слайды должны раскрыть содержание следующим образом:
-
1-ый слайд - Источник сырья, месторождение, доставка (карта, путь);
-
2-ой слайд - сырье, его подготовка, характеристика;
-
3-ий слайд - схема технологического процесса (упрощенная); принципы производства;
-
4-ый слайд - химические реакции (механизмы, если возможно);
-
5-ый слайд - аппараты, оборудование;
-
6-ой слайд - готовая продукция, характеристика;
-
7-ой слайд - применение готовой продукции;
-
8-ой слайд - проблемы охраны среды; техника безопасности;
-
9-ый слайд - исторические факты, персоналии, портреты (при возможности);
-
10-ый слайд - литературные источники, в том числе, ссылки на сайты.
Информационный материал
§19 стр. 94 - 100 11 класс
cement-zavod.ru/cement_producing.html
stroymehanika.ru/article_27.php
transbeton.ru/technology/
m350.ru/articles/more/v/id/9/
ural-plit.ru/statii/78-tehnologiya-proizvodstva-betona
Технология фрески по сырой штукатурке
Технология фрески основана на естественных свойствах извести при высыхании постепенно превращаться из жидкого в коллоидно-кристаллическое вещество. От качества извести очень сильно зависит как ход работы, так и сохранность законченного изображения, поэтому для создания штукатурки под фресковую роспись необходимо взять свежую хорошо обожженную известь самого лучшего сорта и "загасить" ее - в емкость с большим количеством воды очень постепенно всыпается известь, при этом необходимо быть очень осторожным, поскольку известь при гашении очень сильно нагревается. После того, как известь загашена, ей нужно дать выстояться в воде или в мокром состоянии в течении как можно более длительного периода времени. Желательно как минимум год, хотя если обстоятельства не позволяют заготовить известь заблаговременно, допускается и применение извести с меньшим сроком гашения.
В качестве наполнителей для штукатурки под фресковую роспись традиционно используется несколько видов материалов, самым лучшим из них традиционно считается кирпичная крошка - мелко молотый "кирпичный бой". Ее преимущества состоят в том, что в сыром штукатурном растворе вода с растворенной в ней известью, входящая в поры кирпича при его намокании, высыхает и выходит на поверхность очень медленно, тем самым продлевая общее время просыхания штукатурки и время работы над изображением. Кроме этого постепенность высыхания обеспечивает наиболее глубокое "прорастание" образующихся кристаллов извести в толщу основания.
Кроме кирпичной крошки (а при отсутствии и вместо неё) применяется песок, причем рекомендуется использовать именно речной, поскольку у него самые разноразмерные "зерна", плотно прилегающие друг к другу. Из-за этого речной песок обладает самой высокой плотностью. Этот фактор важен, поскольку известь в штукатурном растворе технически выполняет роль минерального "клея", скрепляющего между собой частицы наполнителя. При этом, чем ближе прилегание частиц друг к другу, тем выше КПД извести, и тем прочнее оказывается штукатурное покрытие в целом.
Не менее важным, чем кирпич или песок является такой наполнитель, как рубленая пенька или льняное волокно, - они делают штукатурный слой менее хрупким, придавая ему дополнительную пластичность и устойчивость к небольшим деформациям.
Перед нанесением штукатурки необходимо сначала подготовить стену или панель, на которую она наносится. Самым лучшим основанием для фрески является кирпичная стена. В случае работы по бетону рекомендуется попытаться сделать его поверхность неровной, - сделать неглубокие отверстия или выбоины.
Если же стена для фрески была предварительно оштукатурена, старую штукатурки надо постараться сбить, в тех местах, где не сбивается, - очистить от старой краски, пыли и грязи.
Нанесение штукатурного раствора рекомендуется проводить в два или даже три слоя на хорошо смоченное основание. При трёхслойном грунте первому слою дают совершенно просохнуть, затем смачивают его водой до полного насыщения и наносят два последних. Для двухслойного грунта первому слою дают основательно подвять, - окрепнуть, но не до конца высохнуть, и только после этого наносится последний слой штукатурки, заглаживаемый под живопись - "интонако". Для нанесения каждого последующего слоя поверхность штукатурки очищается шпателем от образующейся при высыхании извести известковой корки.
В начале работы, когда штукатурка еще достаточно сырая, делается рисунок. Процесс создания рисунка подразумевает творческий поиск и нахождение наилучшей выразительной "конструкции" для изображения. Технически это означает, что на этапе рисунка в первоначальный план изображения могут вноситься необходимые исправления, но к концу этого этапа должны быть четко определены границы пространства для каждого из локальных цветов.
+ 1 План-конспект урока химии по теме:
«Соединения кальция и их использование в строительстве».
Тип урока: урок-обобщение.
Вид урока: урок с использованием кейс-технологии.
Цели урока:
1. образовательная: обобщить знания о природных соединениях кальция и значении соединений кальция в строительной индустрии.
2. развивающая: развивать инициативу, любознательность, умственную активность.
3. воспитательная: формировать коммуникативные навыки, умения вырабатывать и аргументировать самостоятельные решения, аргументировать самостоятельные решения, навыки сотрудничества в группах.
Учебные задачи:
1.систематизировать знания о свойствах соединений кальция, обуславливающих их широкое применение в строительной индустрии;
2.формировать умения раскрывать взаимосвязь науки и практики;
3.формировать умения использовать полученные знания в своей профессиональной деятельности.
Оборудование и реактивы: образцы веществ без названий (алебастр, известь и мел), соляная кислота, лакмус, фенолфталеин, вода, пробирки в штативе, стеклянные палочки, стеклянные пластинки.
Раздаточный материал: кейс «Эврика», правила работы с кейсом
План урока.
Кейс «Эврика»
1. Подготовительный этап.
Конкретизация преподавателем цели урока.
2. Ознакомительный этап.
Вовлечение обучающихся в живое обсуждение конкретной ситуации (случай из профессиональной практики обучающихся).
2.1. Введение в ситуацию.
Действие разворачивается на одной из строительных площадок вблизи г. Курск. Действующие лица: мастер производственного обучения Ответнова Ольга Ивановна; обучающиеся группы №6 по профессии «Мастер отделочных работ»; Игорь, бригадир бригады №1; Виктор, бригадир бригады №2; кладовщик.
2.2. Описание ситуации. Ответнова Ольга Ивановна уже в семь часов тридцать минут утра прибыла на строительный объект, где проходили производственную практику ее ученики. До приезда детей ей необходимо было определить фронт работ на сегодняшний день и распределить ребят по рабочим местам. Детям нравилось работать на стройке, тем более, что их работу оплачивали, и оплачивали неплохо, что их еще больше подстегивало. А за досрочное завершение работы даже обещали премию. В положенное время все ребята как один стояли перед мастером и ждали распоряжений. Ольга Ивановна уже выяснила, что на сегодня ребятам нужно отделать два небольших помещения, но в разных местах стройки. Решили разделиться на две бригады, чтобы не толкаться и не мешать друг другу при работе, так как комнаты были очень небольшими. Тут же выбрали бригадиров, Игоря и Виктора, самых авторитетных ребят, которым и Ольга Ивановна часто доверяла ответственные задания, да и группа их уважала. Бригадиры получили бланки формы «М29» и с помощниками отправились к кладовщику за инструментом и необходимыми материалами. На складе хранилось много разнообразных материалов, и даже таких, которые, по мнению ребят, не имели к строительству никакого отношения: кислоты, индикаторы, ингибиторы и еще что-то с непонятными названиями. Со склада строительных материалов ребята-бригадиры увидели выехавшую машину, до верха нагруженную мешками. Кладовщик что-то быстро говорил водителю, размахивая руками. «Пошли быстрее, а то без материалов останемся» - сказал Игорь ребятам. Кладовщик Иван Петрович Уладов встретил ребят не так приветливо как обычно. Что-то бормоча себе под нос, начал выдавать положенные по списку в накладной инструменты и материалы. «А алебастр и мел я не могу вам дать» - заявил Иван Петрович. - На склад завезли мешки с известью, мелом и алебастром, но все мешки без названий. Я, их что, на язык должен определить. Одну партию я уже отправил обратно, чтобы поменяли, а эти мешки после обеда отвезут. Так что ждите, когда машина обратно приедет». Делать нечего, Игорь и Витя с помощниками отправились на свои объекты без полного набора материалов. Виктор решил, что нужно установить дежурство у склада, чтобы не прозевать прибытие машины. «Жди теперь, когда машина возвратится с нужными материалами. За пол дня вряд ли успеем справиться с работой» - Игорь был настроен на работу, ему хотелось, чтобы его бригада быстрее справилась, но теперь все планы рушились. И тут его осенило. Он оставил ребят и быстрым шагом, почти бегом поспешил на склад. Через полчаса у его бригады было все необходимое.
Задание.
-
Разберите данную ситуацию, проведите анализ.
-
Какой способ решения проблемы нашел Игорь? Осуществите практически.
-
По какому пути пошли бы вы?
-
Пригодятся ли знания, полученные из данной ситуации, в вашей профессиональной деятельности?
2.3. Информационный материал.
Важнейшие природные соединения кальция
Название минерала
Химическая формула (основной составной части)
Важнейшие месторождения
Известняк, мрамор, мел, ракушечник
Гипс
Фосфорит и апатит
Доломит
CaCO3
CaSO4 • 2H2O
Ca3(PO4)2
CaCO3 • MgCO3
Широко распространен
Широко распространен
Широко распространен
Широко распространен
Кальций - углекислый
Карбонат кальция CaCO3 - одно из самых распространенных на Земле соединений. Минералы на основе CaCO3 покрывают около 40 млн. км2 земной поверхности. Мел, мрамор, известняки, ракушечники - все это CaCO3 с небольшими примесями, а кальцит чистый CaCO3.
Самый важный из этих минералов - известняк. Известняки есть практически везде. Ракушечники - известняки органического происхождения. Знаменитые Одесские катакомбы - это бывшие каменоломни, в которых добывали ракушечник. Из известняков главным образом сложены и западные склоны Урала.
В чистом виде известняки - белого или светло-желтого цвета, но примеси придают им более темную окраску. Известняк незаменим в производстве цемента, карбида кальция, соды, всех видов извести (гашеной, негашеной, хлорной), белильных растворов и многих других полезных веществ. Без известняка не обходится ни одно строительство. Во-первых, из него самого строят, во-вторых, из известняка делают многие строительные материалы.
Другая разновидность углекислого кальция - мел. Мел - это не только зубной порошок и школьные мелки. Его используют в бумажной и резиновой промышленности - в качестве наполнителя, в строительстве и при ремонте зданий - для побелки. При соприкосновении с кислотами мел «вскипает».
Третья разновидность карбоната кальция - мрамор - встречается реже. В строительстве мрамор (всех цветов и оттенков) используют не столько как конструкционный, сколько как облицовочный материал.
Доломит - важный огнеупорный материал и сырье для производства цемента.
Кальций - сернокислый
Сульфат кальция CaSO4 тоже широко распространен в природе. Известный минерал гипс - это кристаллогидрат CaSO4 • 2H2O. Как вяжущее, гипс используют уже много веков, чуть ли не со времен египетских пирамид. Но природному гипсу (гипсовому камню) несвойственна способность твердеть на воздухе и при этом скреплять камни. Это свойство гипс приобретает при обжиге. Если природный гипс прокалить при температуре не выше 180˚С, он теряет три четверти связанной с ним воды. Получается кристаллогидрат состава CaSO4 • 0,5H2O. Это алебастр, или жженный гипс, который используется в строительстве. Помимо вяжущих свойств у жженого гипса есть еще одно полезное свойство. Затвердевая, он немного увеличивается в объеме. Это позволяет получать хорошие слепки из гипса. В процессе твердения жженого гипса, смешанного с водой (гипсового теста), полторы молекулы воды, потерянные при обжиге, присоединяются, и снова получается гипсовый камень CaSO4 • 2H2O. Если обжиг гипсового камня вести при температуре выше 500˚С, получается безводный сернокислый кальций - «мертвый гипс». Он не может быть использован в качестве вяжущего. «Оживить» мертвый гипс можно. Для этого нужно прокалить его при еще более высоких температурах - 900…1200˚С. Образуется так называемый гидравлический гипс, который, будучи замешанным с водой, вновь дает затвердевающую массу, очень прочную и стойкую к внешним воздействиям.
«Кипелка» и «пушонка»
Еще в I в.н.э. Диоскорид - врач при римской армии - в сочинении «О лекарственных средствах» ввел для оксида кальция название «негашеная известь», которое сохранилось и в наше время. Строители ее называют «кипелкой» - за то, что при гашении выделяется много тепла, и вода закипает. Образующийся при этом пар разрыхляет известь, она распадается с образованием пушистого порошка. Отсюда строительное название гашеной извести - «пушонка». Гашеная известь Ca(OH)2 - тонкий рыхлый порошок, обычно белого цвета. Поглощая углекислый газ из воздуха, гидроксид кальция превращается в карбонат кальция, проявляющий вяжущие свойства. В зависимости от количества воды, добавляемой к извести, гашение идет до получения пушонки, известкового теста, известкового молока или известковой воды. Все они нужны для приготовления вяжущих растворов.
+2 «Зеленая» химия» 11 класс
Кейс
Совершенно очевидно, что без достижений химии, т.е. без эффективных лекарств, строительных материалов, новых видов топлива, минеральных удобрений и средств защиты растений, современное общество обойтись не может. Однако, несмотря на очевидные заслуги химии в улучшении качества жизни человека, в обществе прогрессирует хемофобия - отрицательное отношение к химии и ее проявлениям. Такое отношение отчасти оправдано - оно вызвано коптящими заводскими трубами, ядовитыми выхлопными газами, низкокачественными пищевыми добавками, отравлением водоемов, техногенными катастрофами.
Что же необходимо сделать, чтобы максимально снизить нагрузку на окружающую среду и минимизировать плату за прогресс в химической промышленности?
Задания
1. Охарактеризуйте основные принципы «зеленой» химии. Какова их нравственная основа?
2. Прокомментируйте высказывание одного из основоположников «зеленой» химии Пола Анастаса о том, что лучшие химики занимаются «зеленой» химией, потому что «зеленая» химия - это просто часть занятий хорошей химией.
3. Приведите примеры используемых в промышленности каталитических процессов, позволяющих максимально снизить энергетические затраты. Составьте уравнения соответствующих реакций. Классифицируйте эти процессы с точки зрения возобновления ресурсов. Для процессов, использующих исчерпаемые ресурсы, предложите альтернативные способы получения продуктов, ориентированные на возобновляемое сырье.
4. Проанализируйте таблицу, в которой содержатся данные о количестве потерь на килограмм продукта - Е-фактор - в различных отраслях химической промышленности , и определите, какая из них является наиболее эффективной с точки зрения значения Е-фактора:
Промышленность
Количество тонн продуктов
Соотношение, кг (Е) побочный продукт/нужный продукт
Нефтехимическая
106-108
-0,1
Крупнотоннажная основная химия
104-106
<1 - 5
Тонкая химия
102-104
5 - 50
Фармацевтическая
101-103
25 - 100+
Как вы можете объяснить эти данные?
На основании уравнения реакции обжига пирита рассчитайте степень утилизации в этой стадии получения серной кислоты. Предложите и обоснуйте иные способы получения оксида серы (IV), имеющие оптимальные значения Е-фактора.
5. Используя различные информационные источники, в том числе Интернет, опишите, как достижения нанотехнологий позволят решить задачи, стоящие перед «зеленой» химией.
6. Спрогнозируйте и оцените возможности «зеленой» химии для устойчивого развития общества, а также экономические, социальные и иные проблемы, которые могут возникнуть в процессе реализации идей «зеленой» химии.
Информационный материал
Зелёная химия (Green Chemistry) - научное направление в химии, к которому можно отнести любое усовершенствование химических процессов, которое положительно влияет на окружающую среду. Как научное направление, возникло в 90-е годы XX века.
Новые схемы химических реакций и процессов, которые разрабатываются во многих лабораториях мира, призваны кардинально сократить влияние на окружающую среду крупнотоннажных химических производств. Химические риски, неизбежно возникающие при использовании агрессивных сред, производственники традиционно пытаются уменьшить, ограничивая контакты работников с этими веществами.
В то же время, Зелёная химия предполагает другую стратегию - вдумчивый отбор исходных материалов и схем процессов, который вообще исключает использование вредных веществ. Таким образом, Зеленая химия - это своего рода искусство, позволяющее не просто получить нужное вещество, но получить его таким путем, который, в идеале, не вредит окружающей среде на всех стадиях своего получения.
Последовательное использование принципов Зеленой химии приводит к снижению затрат на производство, хотя бы потому, что не требуется вводить стадии уничтожения и переработки вредных побочных продуктов, использованных растворителей и других отходов, - поскольку их просто не образуется. Сокращение числа стадий ведет к экономии энергии, и это тоже положительно сказывается на экологической и экономической оценке производства.
В то время как Химия окружающей среды изучает источники, распространение, устойчивость и воздействие химических загрязнителей, химия для окружающей среды обеспечивает химические решения для того, чтобы избавиться от загрязнений. При этом существуют следующие возможные пути химических решений: 1. Уничтожать загрязнители, поступившие в окружающую среду; 2. Ограничивать их распространение, если они локальные; 3. Прекратить их производство - путем замены существующих способов получения химических продуктов на новые.
Первые два направления входят в область исследований Экологической химии; последнее направление представляет собой ту область, которой занимается Зеленая химия.
В 1998 году П. Т. Анастас и Дж. С. Уорнер в своей книге «Зеленая химия: теория и практика» сформулировали двенадцать принципов «Зеленой химии», которыми следует руководствоваться исследователям, работающим в данной области:
1. Лучше предотвратить потери, чем перерабатывать и чистить остатки.
2. Методы синтеза надо выбирать таким образом, чтобы все материалы, использованные в процессе, были максимально переведены в конечный продукт.
3. Методы синтеза по возможности следует выбирать так, чтобы используемые и синтезируемые вещества были как можно менее вредными для человека и окружающей среды.
4. Создавая новые химические продукты, надо стараться сохранить эффективность работы, достигнутую ранее, при этом токсичность должна уменьшаться.
5. Вспомогательные вещества при производстве, такие, как растворители или разделяющие агенты, лучше не использовать совсем, а если это невозможно, их использование должно быть безвредным.
6. Обязательно следует учитывать энергетические затраты и их влияние на окружающую среду и стоимость продукта. Синтез по возможности надо проводить при температуре, близкой к температуре окружающей среды, и при атмосферном давлении.
7. Исходные и расходуемые материалы должны быть возобновляемыми во всех случаях, когда это технически и экономически выгодно.
8. Где возможно, надо избегать получения промежуточных продуктов (блокирующих групп, присоединение и снятие защиты и т. д.).
9. Всегда следует отдавать предпочтение каталитическим процессам (по возможности наиболее селективным).
10. Химический продукт должен быть таким, чтобы после его использования он не оставался в окружающей среде, а разлагался на безопасные продукты.
11. Нужно развивать аналитические методики, чтобы можно было следить в реальном времени за образованием опасных продуктов.
12. Вещества и формы веществ, используемые в химических процессах, нужно выбирать таким образом, чтобы риск химической опасности, включая утечки, взрыв и пожар, были минимальными.
Е. С. Локтева и В. В. Лунин добавили к этому списку дополнительный, 13-й принцип: Если вы делаете все так, как привыкли, то и получите то, что обычно получаете.
Пути, по которым развивается зелёная химия, можно сгруппировать в следующие направления: Новые пути синтеза (часто это реакции с применением катализатора); Возобновляемые источники сырья и энергии (то есть полученные не из нефти); Замена традиционных органических растворителей.
В 2005 году Р. Найори выделил три ключевых направления развития Зелёной химии: использование сверхкритического CO2 в качестве растворителя, водного раствора перекиси водорода в качестве окислителя, и использование водорода в асимметрическом синтезе.
Новые пути синтеза
Наиболее распространенный - использование катализатора, который снижает энергетический барьер реакции. Некоторые из новейших каталитических процессов обладают очень высокой атомной эффективностью. Так, например, процесс синтеза уксусной кислоты из метанола и CO на родиевом катализаторе, разработанный фирмой Монсанто, протекает со 100 % выходом:
CH3OH + CO => CH3COOH
Другое направление - использование локальных источников энергии для активации молекул (фотохимия, микроволновое излучение), позволяющих снизить затраты энергии.
Замена традиционных органических растворителей
Большая надежда возлагается на использование сверхкритических жидкостей (в основном, углекислый газ и вода, в меньшей степени - аммиак, этан, пропан и др.)
Сверхкритический CO2 уже широко применяется в качестве безвредного, экологически чистого растворителя - например, для экстракции кофеина из кофейных зёрен, эфирных масел из растений и в качестве растворителя для некоторых химических реакций.
Другими примерами являются реакции окисления, протекающие в сверхкритической воде, реакции, протекающие в водной эмульсии, а также реакции без растворителей (включая твердофазные реакции).
Еще одно перспективное направление это использование ионных жидкостей. Они представляют собой жидкие соли при низких температурах. Это новый класс растворителей, которые не имеют давления насыщенного пара и поэтому не испаряются и не являются горючими. Имеют очень хорошую способность растворять широкие гаммы веществ, в том числе и биополимеры. Их возможное количество виртуально не ограничено, и они могут быть получены с любыми заданными наперед свойствами. Кроме того, они могут быть получены из возобновляемых источников, быть не токсичными и не опасными для окружающей среды и человека.
Возобновляемые исходные реагенты
Биоразложимые одноразовые стаканы, сделанные из полилактида.
Ещё один путь, ведущий к целям «зеленой химии», - широкое использование биомассы вместо нефти, из которой химические предприятия творят сейчас все многообразие веществ - конструкционные материалы, химикаты, лекарства, парфюмерию и многое, многое другое.
С 70-х годов XX века в Бразилии, ЕС, Китае, США и других странах построено множество заводов, которые сегодня дают порядка 75 млрд. л или около 60 млн. т топливного спирта (данные 2009 г.), полученного биотехнологическим путём из сахарного тростника, кукурузы, свеклы, патоки и других источников. Также быстро растет производство эфиров жирных кислот ("биодизеля") и, в последнее время, целлюлозного этанола.
Работает несколько мощных заводов по получению молочной кислоты из глюкозы, полученной из мелассы и отходов целлюлозы. Производительность такого предприятия близка к теоретической: из килограмма глюкозы производится килограмм молочной кислоты. Полученная дешёвая молочная кислота и ее ангидрид (лактид) далее используются в производстве биоразлагаемого полимера - полилактида.
К целям зелёной химии относится также разработка путей эффективного использования такого сырья, как лигнин, который пока не нашёл широкого применения.
Биотехнология
Биоинженерия также рассматривается в качестве перспективной техники для достижения целей Зелёной химии. Ряд промышленно важных химических соединений может быть синтезирован с высокими выходами с помощью биологических агентов (микроорганизмов, вирусов, трансгенных растений и животных).
+3 Кейс «Счастье на свалке» 11 класс
Лаборатории одного химического комбината, производящего красители, постоянно не хватало денег. Каждые сутки эта лаборатория обязательно проводила пробы на качество химических реагентов. Одна из таких проб предусматривала прокаливание порошка в большой пустотелой спирали из кварцевого стекла. После проведения анализа спираль приходилось выбрасывать, т. к. внутри нее намертво прилипал нерастворимый спеченный порошок наподобие пемзы.
Кварцевая спираль имеет продольное отверстие диаметром 5 мм по всей длине. Диаметр витков спирали - около 200 мм, количество витков - 20. Каждая спираль стоит примерно тысячу долларов и закупается в Европе. Только за год выбрасывали «на свалку» 365 тысяч долларов!
У новаторов на комбинате появилась идея: «А если чистить спирали упругой стальной проволокой?» Попробовали.
Оказалось: тонкая стальная проволока, имеющая острый расплющенный конец, разрыхляет осадок внутри спирали и он легко высыпается. А спираль можно использовать повторно, как новую!
Но выяснилось, что проволокой можно чистить только 1-2 витка: проволока пружинит, застревает в витках и «рыхление осадка» прекращается. Пробовали применять разные (по упругости и толщине) проволоки, тросики, однако прочищали лишь несколько витков.
Комбинат по-прежнему закупал дорогие спирали и нес «оправданные» убытки на лабораторные исследования.
Эту задачу сам руководитель этой химической лаборатории.
Вместо проволоки внутрь отверстия насыпали немного мелких железных опилок и с помощью магнита, расположенного снаружи, стали перемещать и вращать опилки в каналах спирали. Острые опилки очистили прикипевший порошок, и спирали стали использовать многократно.
Хорошо, что на комбинате не успели ликвидировать свалку с использованными спиралями! А их там скопилось пару тысяч.
Литература:
-
В. В. Еремин, Н. Е. Кузьменко, В. В. Лунин. А. А. Дроздов, В. И. Теренин «Химия 8-11 классы», Учебники для общеобразовательных учреждений, Москва, Дрофа, 2013.
-
Соловьев Ю. Н. История химии. Развитие химии с древнейших времен до конца XIX века: Пособие для учителя. Москва, Просвещение, 1983 г.
-
Титова И. М. Вещества и материалы в руках художника: Пособие для учителя. Москва, МИРОС, 1994 г.
-
Шульпин Г. Б. Химия для всех. Москва, Знание, 1987 г.
-
Энциклопедия для детей. Том 17: Химия. Москва, Аванта +, 2000 г.
-
Энциклопедия для детей. Том 19: Экология. Москва, Аванта +, 2001 г.
-
DVD -диск «Вода» (документальный фильм)
-
Википедия: свободная энциклопедия.
110