- Преподавателю
- Химия
- Тема урока «Вычисление изменения энтропии и расчёт энергии Гиббса»»
Тема урока «Вычисление изменения энтропии и расчёт энергии Гиббса»»
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Матюгина И.И. |
| Дата | 27.02.2014 |
| Формат | docx |
| Изображения | Есть |
Практическая работа №7
Тема: «Вычисление изменения энтропии и расчёт энергии Гиббса».
Цель работы: 1)Практически рассчитать изменение энтропии химической реакции. 2)Практически научиться определять возможность протекания химических реакций, при заданных условиях исходя из значения изобарно - изотермического потенциала.
Теоритическая часть:
Энтропия (S) - это функция состояния системы, которая отражает движение частиц вещества и является мерой неупорядоченности системы. Энтропия возрастает с увеличением движения частиц, т.е. при нагревании, испарении, плавлении, расширении газа. Энтропия уменьшается при процессах, связанных с упорядочением системы, т.е. конденсация, кристаллизация, сжатия.
Изменение энтропии (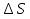 ) зависит только от начального и конечного состояния процесса, и не зависит от пути процесса.
) зависит только от начального и конечного состояния процесса, и не зависит от пути процесса.
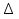 Sх.р.=
Sх.р.= 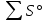 прод.-
прод.-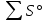 исх.
исх.
Величина изобарно - изотермического потенциала (G) или её называют энергией Гиббса, зависит от природы вещества, его количества и температуры. Изменение энергии Гиббса (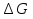 ) .
) .
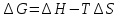
Если 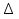 G
G 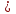 0, то реакция при заданных условиях может протекать. Если ∆G
0, то реакция при заданных условиях может протекать. Если ∆G 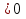 , то самопроизвольно протекающие процессы идут в сторону уменьшения ∆G.
, то самопроизвольно протекающие процессы идут в сторону уменьшения ∆G.
Практическая часть:
Задача №1:
Найти энтропию химической реакции, используя табличные данные стандартной энтропии C2H2 + O2→ CO2+H2O
Дано: Решение:
S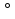 298 (C2H2) = 200,82 2C2H2 + 5O2→ 4CO2+ 2H2O
298 (C2H2) = 200,82 2C2H2 + 5O2→ 4CO2+ 2H2O
S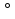 298(O2) = 205,03
298(O2) = 205,03 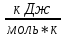
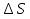 х.р.=
х.р.= 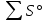 298(прод.) -
298(прод.) - 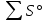 298 (исход.)
298 (исход.)
S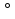 298 (CO2) = 213,65
298 (CO2) = 213,65 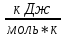
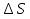 х.р.= 4 S
х.р.= 4 S 298(CO2) + 2S
298(CO2) + 2S 298(H2O) - 2S
298(H2O) - 2S 298(C2H2) +
298(C2H2) +
S 298 (H2O) = 69,94
298 (H2O) = 69,94 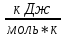 5S
5S 298(O2) = 4 * 213,65+2 * 69,94 - 2 * 200,82 - 5 *
298(O2) = 4 * 213,65+2 * 69,94 - 2 * 200,82 - 5 *
∆Sх.р.=? 205, 03 = (854, 6+139, 88) - (401, 64 - 1025, 13) =
994, 48 - (623, 49) = 994, 48 + 623, 49 = 1617, 97 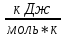 . Ответ: ∆Sх.р.= 1617, 97
. Ответ: ∆Sх.р.= 1617, 97 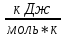
Задача № 2:
Найти энергию Гиббса для химической реакции C2H6+O2→CO2+H2O при температуре 1 .
.
Дано: Решение:
Т= 1 = 274 К 2C2H6+7O2→ 4CO2+6H2O
= 274 К 2C2H6+7O2→ 4CO2+6H2O
S 298(C2H6) = 219, 45
298(C2H6) = 219, 45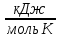 ∆Gх. р. = ∆Hх.р. - Т∆Sх.р.
∆Gх. р. = ∆Hх.р. - Т∆Sх.р.
S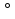 298(CO2) = 213, 65
298(CO2) = 213, 65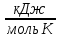 ∆Hх.р. =
∆Hх.р. = 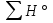 прод. -
прод. - 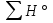 исход.
исход.
S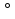 298(H2O) = 186, 72
298(H2O) = 186, 72 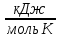 ∆Hх. р. = 4* (- 343, 51) + 6*(- 285, 84) - 2*(- 84, 67)
∆Hх. р. = 4* (- 343, 51) + 6*(- 285, 84) - 2*(- 84, 67)
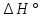 298(C2H6) = -84, 67
298(C2H6) = -84, 67 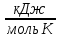 = - 1374, 04 - 1715, 04 + 169, 34 = - 2919, 74
= - 1374, 04 - 1715, 04 + 169, 34 = - 2919, 74
∆H°298(CO2) = -343, 51 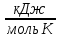 ∆Sх.р. = ∑ S
∆Sх.р. = ∑ S прод.- ∑S
прод.- ∑S исход. = 4 * 213, 65 + 6* 186, 72-
исход. = 4 * 213, 65 + 6* 186, 72-
∆H°298(H2O) = - 285, 84 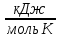 - 2 * 219, 45 = 854, 6 + 1120, 32 - 438, 9 = 1536, 02
- 2 * 219, 45 = 854, 6 + 1120, 32 - 438, 9 = 1536, 02
∆Gх.р. = ? ∆Gх.р. = - 2919, 74 - 274 * 1536, 02 = -2919, 74 -
- 420. 869, 48 = - 423. 789, 22 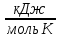
Ответ: ∆G х. р. = - 423. 789, 22 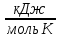
Вывод: 1) Я практически научилась рассчитывать изменение энтропии химической реакции. 2) Я практически научилась определять возможность протекания химических реакций, при заданных условиях исходя из значения изобарно - изотермического потенциала.


