- Преподавателю
- Химия
- Разработка интегрированного урока по химии и биологии С солями по жизни
Разработка интегрированного урока по химии и биологии С солями по жизни
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Конспекты |
| Автор | Сотырко Н.Д. |
| Дата | 07.02.2016 |
| Формат | docx |
| Изображения | Есть |
Для того, чтобы бижутерия сверкала, вам понадобятся:
1 столовая ложка соли
1 столовая ложка соды
1 столовая ложку средства для мытья посуды
1 стакан воды
1 кусок алюминиевой фольги
Этапы очистки бижутерии:
1.Подогрейте воду.
2. Отрежьте кусок алюминиевой фольги и положите на дно небольшой миски или стакана.
3. Налейте горячую воду в миску. Добавьте соль, соду, и жидкость для мытья посуды. Положите ювелирные изделия на фольгу и оставьте на 5-10 минут. Промойте ювелирные изделия в прохладной воде и протрите сухой мягкой тканью.
Это средство для чистки ковров, сделанное в домашних условиях, в разы дешевле покупных средств.
Для приготовления средства для чистки ковров понадобится:
- пустая тара среднего размера с распылителем;
- 1 столовая ложка соды;
- 1/3 стакана уксуса;
- горячую воду (не доходя около 5 см до края тары);
- 1 столовую ложку стирального порошка.
Наполняем емкость водой и добавляем остальные компоненты. Встряхиваем тару до полного растворения ингредиентов.
Возьмите стакан и добавьте туда соду в количестве пяти столовых ложек, потом налейте воды, чтобы получилась консистенция каши. Нанесите кашу из соды на тряпку, а потом протрите покрытие утюга очень сильно. Потом возьмите тряпку и протрите утюг, сначала слегка влажной тряпкой, а потом полностью сухой.
Как почистить сковороду?
Картофелину разрежьте пополам и макните в соду. Теперь этой картофелиной потрите сковороду или кастрюлю. Результат заметен сразу.
Устранить желтоватые пятна пота на светлых футболках можно, замочив их перед стиркой в соляном растворе.
Чтобы «смягчить» новые джинсы, добавьте 1/3 стакана соли при стирке вместе со стиральным порошком.
Избавиться от темного налета внутри кофейника можно с помощью соли. Добавьте в кофейник 4 ч. ложки соли, 1 стакан ледяной крошки и стакан воды. Энергично встряхните, затем вымойте кофейник губкой.
Запах масляной краски в квартире быстрее исчезнет, если в нескольких местах поставить тарелки с солью.
Свежие пятна от вина легко удаляются, если посыпать их солью, а затем замочить в холодной подсоленной воде на 30 минут перед стиркой.
Жирные брызги на моющихся обоях в кухне можно отчистить пастой из пищевой соды. Смешайте четверть стакана соды с небольшим количеством воды (по консистенции масса должна походить на зубную пасту). Мягкой тканью круговыми движениями сотрите загрязнения и протрите обои влажной губкой или салфеткой.
Столовому серебру можно вернуть первоначальный блеск, если почистить его содой. Заткните раковину пробкой, застелите дно фольгой, а затем выложите на нее столовые приборы, залейте кипятком и добавьте 1 неполный стакан соды. Тусклость сойдет, а оставшиеся на серебре пятна можно потереть содовой пастой, и оно засияет как новое!
Чтобы избавить от неприятных запахов старую мягкую мебель, посыпьте ее содой, оставьте на 1-2 часа, в особенно загрязненные места хорошенько вотрите, а затем тщательно пропылесосьте.
Белый налет, который обычно образуется в вазах для цветов, можно удалить, протерев их изнутри губкой с содой.
Ванна с содой и солью называется содовой, хотя соли берётся больше: на 200 г соды - 300 г соли. Принимают такую ванну всего 10 минут, а потом ложатся в постель под тёплое одеяло, на 30-40 минут. За 2 часа до приёма ванны и 2 часа после неё не надо ничего есть и пить, иначе эффект будет очень слабым, а самочувствие может ухудшиться.
Урок сегодня проводим в интегративном формате, а значит главная цель, которую мы преследуем - это показать, что все предметные знания важны, нужны и взаимосвязаны. Чтобы решить проблему профессионально и грамотно необходимо взглянуть на неё с разных точек зрения. Те проблемы, которые нам предстоит сегодня обсудить, очень серьёзны и актуальны.
Предметом изучения нашего урока будут соли, с которыми мы непосредственно сталкиваемся в нашей повседневной жизни. Герои нашего урока: соль натрий хлорид - каменная соль, натрий гидрокарбонат - пищевая сода и нерастворимые соли кальция и магния, которыми так богат наш родной город и вода, которая течет из крана в наших квартирах.
Представьте себе, что мы все сотрудники одной химической лаборатории. Для работы нам необходимо вести лабораторный журнал, в котором необходимо вести записи наших наблюдений. На столах у вас лежат листы с графами, лабораторный журнал. Напишите дату и тему урока «Соли, которые нас окружают. Значение и применение солей».
III. Актуализация знаний и умений учащихся (10 мин.).На предыдущих уроках мы уже изучили химические формулы и свойства некоторых солей. Давайте вспомним: (фронтальный опрос):
-
Дайте определение классу солей.
-
Солей достаточно много, а можно ли их классифицировать? По какому признаку?
а) соли средние (нормальные): Na2CO3, CuSO4;
б) соли кислые: NaHСO3, NaHSO4;
в) соли основные: CaOHCI.
Рассмотрите, пожалуйста, коллекцию «Соли» и ответьте на вопрос, какими физическими свойствами обладают соли? (Все соли твердые кристаллические вещества. Соли имеют различную окраску, и разную растворимость в воде).
Ну а теперь, давайте вспомним химические свойства солей. «Химический цветок»
В нашей лаборатории расцвёл цветок необычайной красоты - на его лепестках - формулы веществ. Вспомним о лете. Летом вы, наверное, гадали на ромашке «любит - не любит», так и сегодня мы погадаем «взаимодействует - не взаимодействует» данное вещество с сульфатом меди?
На лепестках формулы: Ag, Zn, CuО, NaOH, BaCl2, Na2CO3, HCI, Mg(OH)2.
Игра «Крестики-нолики» по парам (выигрышный ряд - или только растворимые или только нерастворимые соли (с использованием таблицы растворимости), только оксиды, только кислоты или только основания.
NaCl, CaCO3 , AgNO3 ,CuSO4 ,MgSO4 , AgCl, CaSO4, Na2CO3, BaCl2 ,BaSO4, CaCl2,Ca3(PO4)2 , NaI.
а) Прочитать формулы солей.
б) Назвать соли.
Составить формулы солей и дать им название
(Два ученика работают у доски, остальные учащиеся - на своих местах.)
а) ZnxCly, Cax(CO3 )y;
б) KxSy, Nax(SO4)y.
Задание для класса: игра "Ручеёк".
Первый ученик проговаривает формулу любой задуманной кислоты, следующий ее называет и в свою очередь задает свою формулу соседу. Учитель выбирает и корректирует разные направления, течения и делает заключение.
Задание для класса "Третий лишний".
K2O
CaO
P2O5
CO2
MgO
SO3
HNO3
BaCO3
H2SO4
Определить:
-кислотный оксид среди основных;-основной оксид среди кислотных;-соль среди кислот.
Выписать из предложенных веществ формулу солей. Назвать их и определить соответствующие им кислоты, основания.
Презентация отчетов исследовательской работы 3-х групп учеников:
-
«Соль - белое золото Донбасса».
Учитель:
Вы, вероятно, считаете, что единственные химикаты у вас на кухне находятся у вас под раковиной? Нет. Откроем кухонный шкаф. Каждая составляющая нашей еды является химическим веществом. Как только человек начал готовить себе пищу, так он, пусть и неосознанно, стал химиком. На сковородах и в жаровнях, в бочках и глиняных сосудах шли сложнейшие химические и биохимические процессы. Самое распространенное из химических веществ, то, что можно найти везде, самая древняя пищевая добавка - соль. "Среди всех солей самая главная и основная та, которую мы называем просто солью". (А.Е.Ферсман)
Но как мало мы знаем даже о ней. В ходе урока, используя межпредметную информацию, мы создадим цельный образ - "портрет" одного из самых удивительных веществ.
-
Выступление-презентация исследовательской работы "Соль - белое золото" (сообщения учеников сопровождаются слайдами компьютерной презентации).
1 ученик:
Было так: чтобы не стать врагами,
И под кровом вечно мир хранить,
Непременно должен был с гостями
Хлеб да соль хозяин разделить.
Хлеб - бесценный дар земли родимой.
Соль - величье мудрости земной.
Дорогим гостям преподносимы
В добрый час и сердцем и душой.
Историки.
Как относились к поваренной соли наши предки?
По русскому обычаю, когда подносят гостям хлеб - соль, то тем самым желают им здоровья. В ряде стран сохранился обычай ставить перед гостями соль как символ дружбы и гостеприимства.
Подчеркивает важное значение соли большое количество пословиц и поговорок о соли:
Соль - всему голова, без соли и жито - трава.
И старая лошадь до соли лакома.
Без денег торговать, как без соли хлебать.
Без соли, без хлеба - худа беседа
Без хлеба не сытно, без соли не сладко
Собираясь пить чай, клади в него щепотку соли. От нее быстрее усвоится пища, исчезнут болезни желудка. (Из народной медицины).
И наоборот - просыпать соль означало навлечь на себя гнев богов. В этой связи интересно вспомнить, что на знаменитой картине Леонардо да Винчи "Тайная вечеря" около правой руки Иуды изображена опрокинутая солонка с рассыпанной солью - верный признак будущих неприятностей. У всех народов разных времен рассыпать соль значило накликать беду, потерять здоровье.
Древние приписывали соли священные свойства, связывали ее с добрыми духами. В католической церкви при крещении в ротик младенца кладут кристаллик соли.
Нет ничего полезнее солнца и соли», - говорили в античности. Ее называли божественной благодатью, а сравнение с солью означало сравнение с Богом.
Поэтому когда Господь в Нагорной проповеди называет учеников солью земли, тем самым Он подчеркивает их предназначение и ценность - осолять землю, и если они перестанут быть солью земли, то народ потеряет силу.
Соль известна людям давно. В Китае за 2 тысячи лет до нашей эры впервые начали добывать соль из морской воды. А в средние века в Китае были крестьянские волнения, вызванные непомерными солевыми поборами, которые продолжались 9 лет. Некоторые народы Центральной Азии в своё время платили за соль цену примерно равную цене золота.
Что же важнее: соль или золото? (демонстрация видеофрагмента сказки «Соляной принц»).
Древнем Риме воины Цезаря часть зарплаты получали солью (отсюда - английское salary - жалованье). Соль заменяла деньги во многих странах. И даже в 1927 г. в Эфиопии, по свидетельству академика Н.И. Вавилова, соль еще заменяла крупные деньги, а красный перец - мелкие. В Китае XIII века, как свидетельствует Марко Поло, из каменной соли изготовлялись и сами монеты, на которые ставилось клеймо богдыхана. Солью вместо денег платили жалованье римским воинам и крестоносцам (отсюда - английское salary - жалованье). Воинам платили жалованье солью, а чиновники получали солевой паек. Торговля солью являлась государственной монополией. На столах царей, императоров, королей и шахов стояли солонки из золота и заведовал ими особо доверенный человек - солоничий.
1 группа учеников: «Мифы о соли». Работа с магнитной доской (схема «Миф или реальность?»)
В среднем человеческое тело содержит около 250 гр. соли. Неужели, соль такое уж важное вещество?
В ходе работы над проектом мы задались целью: подтвердить или опровергнуть некоторые кухонные и физиологические мифы о соли.
-
Соленая вода закипает быстрее? Миф о том, что соленая вода закипает быстрее, так и остался мифом после нашого эксперимента. При подсаливании воды, крошечные крупинки окутываются пузырьками воздуха, которые тут же всплывают на поверхность и выходят вместе с парами воды - создается впечатление, что вода закипает. Такой же эффект наблюдаем при добавлении песка.
-
Соль снижает горечь? Да. При добавлении соли в тоник, он становится слаще. Это свойство можно использовать при приготовлении соусов, супов, кофе, если вас раздражает горький вкус (предлагается сравнить подсоленные и не соленые кофе или тоник).
-
Соль препятствует росту бактерий? Да. Соль используют при консервировании продуктов. Рассол препятствует росту бактерий. Если мы окутаем бактерию солью - ее клетка начнет избавляться от воды, чтобы повысить концентрацию соли внутри себя, при потери большого количества воды клетка гибнет. Во время Отечественной войны, когда не хватало лекарств, хирург Щеглов пользовался салфетками, которые смачивали в густом соляном растворе и прикладывали к ранам. Через три-четыре дня раны становились розовыми и чистыми.
-
Соль сохраняет цвет яблок? Да. Тонко порежем зеленое яблоко и опустим в раствор соли и сахара. Соль замедляет повреждение ферментов, которые являются главной причиной потемнения яблок.
-
Соль понижает температуру замерзания? Да. Если класть соль на лед, соль растапливает лед, извлекая тепло из окружающей воды.
-
Соль улучшает структуру теста? Да. Соль делает тесто более волокнистым и эластичным, тесто можно более тонко раскатать. При выпечке соль влияет на ферментацию.
-
Для сохранения зеленого цвета овощи должны отвариваться в соленой воде? Нет. Соль действительно не нужна для сохранения зеленого цвета овощей, но, как выяснилось, самым важным для этого является качество самой воды, в частности, содержание в ней кальция. Кальций - враг зеленых овощей; они утрачивают зеленый цвет при высоком уровне содержания кальция в воде. От времени закладки поваренной соли в блюда зависит вкус блюда?
-
От времени закладки поваренной соли в блюда зависит вкус блюда?Да. Мясной бульон солят за 30 минут до окончания варки мяса, а рыбный бульон - в начале варки. При варке очищенного картофеля соль добавляется в начале тепловой обработки во избежание выщелачивания минеральных солей. Бобовые солят после их размягчения, иначе они плохо развариваются. Мясные и рыбные натуральные полуфабрикаты солят перед обжариванием их, а панированные полуфабрикаты - перед планированием. Все овощи солят перед обжариванием, за исключением картофеля, который следует солить в конце тепловой обработки.
-
NaCl - жизненно необходимое вещество для живых организмов?
Да. Когда живые организмы вышли на сушу, они сменили богатую хлоридом натрия среду, в которой жили, на бедную этой солью среду - на сушу. Поэтому живому организму необходимо искать NaCl в крови другого животного, как это делают хищники, или добывать в чистом виде, как это делают травоядные и всеядные, а также человек.
С точки зрения биологии, хлорид натрия активно участвует в минеральном обмене организма животного и человека. Он содержится в крови, пищеварительном соке. Поваренная соль служит источником образования в желудке соляной кислоты, которая является составной частью желудочного сока. В организме человека соли составляют 5,5% массы тела, в том числе хлорида натрия около 300 г. Среднесуточная норма потребления хлорида натрия взрослого человека - 10-15 г. В условиях жаркого климата потребность в соли возрастает до 25-30 г. Это связано с тем, что хлорид натрия выводится из тела человека с потом и для восстановления его потерь в организм нужно вводить больше соли. При работе в горячих цехах и в условиях сухого и жаркого климата врачи рекомендуют пить подсоленную воду (0,3 - 0,5 % - ный раствор поваренной соли), так как соль способствует удержанию воды в тканях.
-
Правда ли, чтобы узнать человека, надо съесть с ним пуд соли? Пуд соли - это 16 кг. За год человек съедает 5-7 кг соли. То есть, за 2-2,5 года вполне возможно узнать человека.
-
Раствор соли может заменить кровь? Да. Поваренная соль входит в тканевые жидкости и в состав крови. В крови ее концентрация равна 0,5 - 0,6 %. Водный 0,09% раствор соли - так называемый физиологический раствор, в медицине используют в качестве кровезаменяющих жидкостей после кровотечений и при явлениях шока.
-
Правда ли, что на пастбищах разбрасывают куски каменной соли?
Да. Лошади, коровы, козы, овцы с удовольствием едят соленый корм. Дикие животные пьют воду соленых источников и едят солончаковые травы. На пастбища кладут каменную соль, которую животные с удовольствием лижут, восполняя таким путем недостаток в организме хлорида натрия. При стойловом содержании животных поваренную соль вводят как кормовую добавку.
-
Соль применяют в строительстве?
Да. При изучении свойств почв учёные установили, что, будучи пропитанными хлоридом натрия, она не пропускает воду. Это открытие было использовано при строительстве оросительных каналов и водоёмов. Если дно водоёма покрыть слоем земли, пропитанной солью, то утечки воды не происходит. Для этой цели, конечно, применяют техническую соль. Строители используют хлорид натрия для устранения смерзания почвы зимой. Для этого участки грунта, которые планируется вынимать, осенью густо посыпают солью. В этом случае в сильные морозы данные участки земли остаются мягкими.
-
Морская или йодированная соль намного лучше, чем обыкновенная?
Да. В морской соли содержится почти вся таблица Менделеева. Морскую или йодированную соль лучше добавлять уже в готовые блюда, т.к. полезные свойства такой соли теряются при термообработке. У морской соли один недостаток - она стоит намного дороже, чем обыкновенная поваренная соль.
-
Действительно ли поваренная соль может спровоцировать ссору?
Иногда какая-нибудь хозяйка, просыпав соль огорчается: "Не иначе, как к ссоре, быть беде". В прошлом соль была товаром очень дорогим. И конечно, если в те времена кто-нибудь в семье просыпал или портил соль, то его ругали, возникала ссора. Эта естественная связь между солью и ссорой, существовавшая в те времена, постепенно превратилась в сознании людей в фантастическую суеверную примету.
-
Соль - это «белая смерть»? Да. При употребление 10-кратного избытка соли она превращается в смертельный яд.
Много соли: нагрузка на сердце; ишемическая болезнь; нагрузка на сосуды; отеки; гипертония; проблемы с почками; набор веса, ожирение; нарушение обмена веществ.
Мало соли: сонливость; слабость; головокружение; тошнота; цинга; потеря вкуса; поражение нервной системы; спазмы гладкой мускулатуры. В тех странах, где соли было мало, люди прибегали к различным способам утолить свою потребность в NaCl. Меланезийцы каждое утро натощак пили морскую воду. В Новой Зеландии пищу запивали морской водой. На островах Самоа, Таити и Тонга население употребляло сырую рыбу, обмакивая ее в морскую воду. В Центральной Африке во многих местах население ело золу солончаковых и береговых растений, а в Северной Америке прибрежные индейские племена высушивали и прессовали специальный вид морской водоросли и этим своеобразным пирогом закусывали каждый кусок пищи.
Результаты исследования потребления поваренной соли в нашем классе Результаты опроса отражены в таблице. Не связано ли употребление соли с заболеваниями моих одноклассников? Как видно из таблицы, многие, из тех, кто любит «солененькое», часто болеют, а некоторые страдают различными хроническими заболеваниями.
Соль способствует задерживанию воды в организме, что, в свою очередь, приводит к повышению артериального давления. Поэтому врачи рекомендуют снижать суточное потребление поваренной соли, особенно при гипертонической болезни, ожирении, проблемах с почками и нервной системой.
Вывод: большинство наших сверстников любят соленую пищу и не задумываются, что это может привести к различным заболеваниям организма.
Обнаружение частиц натрия и хлора в растворе поваренной соли, в соках фруктов и овощей
Обнаружение частиц натрия и хлора в растворе поваренной соли.
В 50 г воды растворил 5 г соли. К порции полученного раствора по каплям приливаю раствор нитрата серебра. Выпадение белого творожистого осадка говорит о наличии в соли частиц хлора.
Каплю исследуемого раствора внес в пламя спиртовки. Пламя окрасилось в желтый цвет, что говорит о наличии частиц натрия в составе соли.
Вывод: в поваренной соли есть частицы натрия и хлора.
Обнаружение частиц хлора и натрия в соках фруктов и овощей
Для опыта я взял зеленые яблоки, мандарины, морковь, картофель, капусту. Фрукты и овощи тщательно измельчил, выжал сок и профильтровал его.
Взял равное количество (по 1 мл) полученного сока и к каждой порции по каплям добавил раствор нитрата серебра. Во всех образцах произошло выпадение белого творожистого осадка, но в разном количестве.
В яблоках большое содержание частиц хлора, мандаринах его значительно меньше.
В моркови, картофеле, обнаружил малое содержание частиц хлора, а в капусте их значительно больше.
Каплю исследуемых растворов поочередно внес в пламя спиртовки. Пламя окрасилось в желтый цвет, что говорит о наличии частиц натрия в составе соли.
Вывод: фрукты и овощи содержат некоторое количество соли.
Таким образом, любой живой организм требует употребления соли. Убедился, что овощи и фрукты содержат достаточное количество соли для жизнедеятельности организма. Поэтому увлекаться потреблением соли из пачки нет особой необходимости.
Географ.
На уроках географии мы рассматриваем NaCl как минерал - природное соединение химических элементов, образовавшиеся естественным путем без вмешательства человека. NaCl - минерал галит (от гречес. "галос" - соль, море). Полупрозрачен, со стеклянным блеском, бесцветен, но примеси часто окрашивают его в серый, красный, коричневый цвета. ( Показ минерала, солевой лампы.)
Есть города, реки и озера названые в честь поваренной соли: Соликамск, река Усолка, река Соленая на Украине, Солигорск в Белоруссии, река Зальцах и родина Моцарта Зальцбург в Австрии. Но поскольку мы с вами изучаем географию нашей Родины - Донетчины, то хотелось бы поговорить о залежах и методах добычи соли у нас. Донбасс славен не только угольными месторождениями, но и соляными залежами. В Донецкой области эксплуатируются Артемовское, Славянское. Запасы соли в них составляют (млн. тонн): Артемовское - 15648, Славянском - 5468.
Артемовское месторождение занимает площадь 179 км2. Оно разрабатывается пятью шахтами с суммарной проектной мощностью 2250 тыс. тонн соли в год. Содержимое NaСl в солях здесь составляет 98-98,3%, а подсчёт запасов выполнен до глубины 600 м. Фактически добыча соли в настоящее время осуществляется на глубинах 150-280 м.
Ученые-физики:
Мы задались вопросом, почему крупные кристаллы сухой поваренной соли трещат на горячей сковороде?
Кристаллы NaCl имеют внутри полости, заполненные раствором, из которого соль выкристаллизовалась. Чем крупнее кристаллы, тем больше в них жидкости (ее масса может превышать 3% от массы кристаллов). На горячей сковороде вскипающая вода "взрывает" кристаллы. По этой же причине трещат и сырые или смолистые дрова в печке.
Практические советы в виде памяток раздаются другим ученикам для детального ознакомления.
Чтоб знания о солях вы могли использовать в повседневной жизни, мы хотим дать вам несколько полезных советов.
1. Застарелую ржавчину и чернильные пятна на белье можно вывести солью, растворённой в лимонном соке, затем их следует подвергнуть воздействию солнечного света. После первого раза пятна сильно побледнеют, а после неоднократного повторения окончательно исчезнут;
7. Чтобы нарезанные яблоки не потемнели, их можно залить слегка подсоленной водой.
14. Перед тем, как зажечь свечи, обмакните их в соленую воду. Свечи не будут оплывать и будут гореть ровнее и дольше, особенно если положить около фитиля несколько кристалликов соли.
Демонстрация: - соляное дерево; - выращенный кристалл соли;
Какая вкусная ты, соль,
Что сеешь смерть, я не поверю,
Ты можешь лишь усилить боль
На свежей ране мне и зверю.
Ты наслаждение нам в еде,
С тобой к искусству блюда ближе.
На сопках и в солончаке
Тебя дремучий зверь полижет.
Но был один натуропат,
Пол Брэгг ученого так звали,
Он думал, что поставит мат,
Назвав соль ядом, чтобы знали.
Писал - не нужен нам продукт,
Назвал отравой соль и ядом,
Не овощ это и не фрукт,
И не лежать ей с пищей рядом.
Но правда в том, что это клад,
Приправа, вкусная добавка,
Ее не каждый сыпать рад,
На уточненье вкуса ставка.
Но соль нужна не только для питанья,
Ее используют для полученья натрия
И хлора, натра едкого и соды,
И медицины ей открыты своды,
Она и в технике находит примененье -
Столь велико ее предназначенье!
Так будь же славен, натрия хлорид!
Вполне заслуженно ты в мире знаменит!
Учитель:
Итак, поваренная соль является важнейшим сырьём химической промышленности. Можно с уверенностью сказать: "Соль - белое золото".
Из неё получают хлор, соляную кислоту, гидроксид натрия, металлический натрий, соду.
-
Выступление группы учеников «Сода - незаменимая помощница» сопровождается презентацией, демонстрацией опытов и образцами различных видов соды.
Химик.
Пищевая сода, такая вещь, которую можно найти в каждом доме. Сода - это щелочь, на языке химиков - гидрокарбонат натрия. В общем случае «сода» представляет собой техническое название натриевых солей угольной кислоты H2CO3. В зависимости от химического состава соединения различается:
- питьевая сода (пищевая сода, бикарбонат натрия, двууглекислый натрий, гидрокарбонат натрия) - NaHCO3;
- кальцинированная сода (карбонат натрия, безводный углекислый натрий) - Na2CO3;
- кристаллическая сода - Na2CO3•10H2O, Na2CO3•7H2O, Na2CO3•H2O.
Искусственная пищевая сода (NaHCO3) - белый кристаллический порошок. Наверняка каждый из вас наблюдал, как мама смешивает соду с уксусом (демонстрация взаимодействия соды с раствором уксусной кислоты). Запись уравнения химической реакции:
NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
Сода получила довольно широкое применение в химической, пищевой, фармацевтической, легкой промышленностях. А именно в:
- химической промышленности - в целях производства пенопластов, красителей, товаров бытовой химии, фтористых реактивов;
- легкой промышленности - изготовлении искусственной кожи, подошвенной резины, текстиля;
- медицине - в качестве средства для снижения кислотности желудочного сока, а также нейтрализации ожогов кожи кислотами.
Кроме того, гидрокарбонат натрия входит в состав порошка, применяемого в пожаротушении - его действие основано на оттеснении кислорода от места возгорания с помощью углекислого газа.
Сода поможет вам избавиться даже от самых въедливых и неприятных запахов, в том числе и от запаха мочи. Этот способ изначально был придуман химиками, когда они искали средство от самого резкого и сильного животного зловония - запаха скунса. Избавиться от запаха кошачьих «меток» вам также поможет сода. Сделайте пасту из соды и воды и нанесите ее на «помеченные» животным места. Оставьте на 3 часа и, когда паста высохнет, пропылесосьте пол.
Историк.
Сода была известна человеку примерно за полторы-две тысячи лет до нашей эры. Ее добывали из содовых озер и извлекали из немногочисленных месторождений в виде минералов. Первые сведения о получении соды путем упаривания воды содовых озер относятся к 64 году нашей эры. Алхимикам всех стран вплоть до 18 века представлялась неким веществом, которое шипело с выделением какого-то газа при действии известных к тому времени кислот - уксусной и серной.
Искусственно сода была получена лишь в конце XVIII века во Франции химиком Лебланом (1791 год). Секрет получения, как тогда водилось, долго держался в тайне, вследствие чего сода стала впервые активно применяться именно во французской кулинарии, в то время как кондитерское производство в других странах - например, в Австрии, в России - развивалось в ином направлении, с использованием других, преимущественно дрожжевых тестоподъемных средств. Вот почему во Франции, кроме бисквитов, доминировали сухие и слоеные печенья, в то время как Вена вплоть до XX века оставалась центром пышных кондитерских изделий и знаменита превосходным дрожжевым «венским тестом» - верхом искусного применения дрожжей в кондитерском деле.
В России еще во времена Петра Первого соду называли «зодой» или «зудой» и вплоть до 1860 года ее ввозили из-за границы. В 1864 году в России появился первый содовый завод по технологии француза Леблана. Именно благодаря появлению своих заводов сода стала более доступной и начала свой победный путь в качестве химического, кулинарного и даже лекарственного средства.
Химик-технолог.
Сода впервые была получена в 1791 г. Лебланом, однако пищевая, очищенная сода была изготовлена в 1861 г. бельгийцем Сольвэ. Таким образом, сода, в зависимости от способа приготовления, бывает леблановская
и аммиачная.
Сущность леблановского способа заключается в следующем: из поваренной соли действием на нее серной кислотой вначале получали сульфат натрия, затем сульфат натрия сплавляли при высокой температуре с углекислым кальцием и углем. Из полученного сплава соду выщелачивали водой. Раствор затем выпаривали.
Изобретенный бельгийским ученым Э. Сольвэ в середине XIX столетия аммиачный способ получения соды применяется в настоящее время во всех странах. Аммиачный способ (способ Сольве) заключается в следующем: в насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть, как бы вводят гидрокарбонат аммония NH4HCO3:
NH3 + CO2 + H2O + NaCl → NaHCO3 + NH4Cl.
Необходимую для процесса углекислоту получают обжигом известняка или мела. В зависимости от температуры, содержания NaCl в рассоле, степени насыщения его аммиаком и углекислотой и других факторов выход бикарбоната составляет 65-75%. Практически невозможно полное превращение поваренной соли в осадок бикарбоната натрия. В этом заключается один из существенных недостатков производства соды аммиачным методом.
Медик.
У каждой хозяйки на кухне стоит пачка соды, ну куда ж без нее. Но сода имеет полное право находиться и в домашней аптечке. Вот почему: соль, сода и йод, это первое можно сказать, народное средство при боли в горле. Однако, перед тем как использовать соду, вы должны знать какую пользу и вред может принести сода. Несколько слов об условиях хранения данного продукта. Срок годности закрытой пачки соды составляет 18 месяцев, открытой пачки - полгода. Храните соду в сухом месте, чтоб она не отсырела. А содой с истекшим сроком годности всегда можно помыть кафель, ванну, стекла или даже посуду.
Пищевая сода обладает бактерицидным и противовоспалительным свойствами. Сода полезна при кашле, простуде, так как она смягчает кашель, разжижает мокроту. Пищевая сода прекрасно снимает зуд после укусов насекомых. Сода пищевая очень мягко отбеливает и очищает зубы. Соду используют для снятия ороговевшей кожи на локтях, применяют при грибковых заболеваниях ног. Соду применяют в косметологии, добавляя в различные маски для лица - исчезают черные точки на лице, прыщи. Еще сода спасет от неприятного запаха пота. После того, как вы приняли душ, помажьте подмышки небольшим количеством соды, запах пота не появится около 12 часов. А еще полоскание содовым раствором поможет справиться с неприятным запахом изо рта. Еще раствором шампуня и соды (4:1) прекрасно мыть волосы после гелей и лаков.
Хотя, на мой взгляд, сода приносит больше пользы, чем вреда, все же есть некоторые факты. При длительном контакте с кожей, сода может нанести вред коже, вызвать раздражение. Если сухая сода попадает в глаза, то может вызвать ожег. Используют часто соду при изжоге, но в последнее время врачи не советуют этого делать, так как это может вызвать вздутие желудка, а также в большом количестве выделяется углекислый газ. Пищевая сода в принципе довольно безопасна, но при длительном приеме соды может быть тошнота, тогда следует сразу же прекратить лечение содой. А еще хозяйки добавляют частенько щепотку соды при варке овощей, чтоб цвет овощей сохранить, но этого делать не нужно, так как сода разрушает витамины в овощах. Таким образом, польза и вред соды, теперь очевиден для вас. Я считаю, если соду использовать для лечения правильно, то никакого вреда не будет. Применяйте соду и не болейте!
Технолог приготовления пищи.
NaHCO3 - зарегистрирован в качестве пищевой добавки E500.
Основное применение питьевой соды в кулинарии, преимущественно, в качестве основного или дополнительного разрыхлителя при выпечке (так как при нагревании выделяет углекислый газ), производстве газированных напитков и искусственных минеральных вод. Соду применяют как разрыхляющее средство в мясные фарши, если они состоят только из мяса и лука, без добавления мучных компонентов (муки, белого хлеба, панировочных сухарей). Такой сырой мясной фарш (говяжий, свиной) оставляют с содовой добавкой на выстойку в холодильнике на несколько часов, а затем легко формуют из этого фарша «сосиски», которые быстро (за 10-15 минут) гриллируют в духовом шкафу любой домашней плиты (газовой, дровяной или электрической).
Без соды практически невозможна идеальная чистка столовой и кухонной эмалированной, фарфоровой, стеклянной и фаянсовой посуды, а также кухонного инструментария и оборудования от посторонних запахов и различных налетов. Особенно незаменима и необходима сода при чистке чайной посуды - заварочных чайников и чашек от образующегося на их стенках чайного налета, пленки.
Современные экологические обстоятельства вызвали еще одно новое применение соды на кухне как средства, повышающего качество овощного сырья. Можно, например, рекомендовать обмывать все обработанные, но еще не нарезанные овощи - перед их закладкой в кастрюлю или на сковородку - в растворе соды в воде. Если выдержать в содовом растворе очищенный картофель, предназначенный для отваривания или приготовления пюре, то это не только очистит картофель от химикатов, которые использовались при его выращивании, но и сделает сам продукт светлее, чище, красивее, снимет все побочные запахи, приобретенные при транспортировке или неправильном хранении, а также порче. Сам картофель станет после готовности рассыпчатым, вкусным. Таким образом, применение соды до приготовления, при холодной обработке (затем продукт тщательно промывается холодной водой), способно повысить качество овощного пищевого сырья, в частности у крахмалосодержащих овощей, у корнеплодов и листовых культур (капусты, салатов, шпината, петрушки и т. д.).
Множество различных фирменных пакетиков и их доступность не отменяют развлечения для юных химиков - самостоятельно изготовить порошок для выпечки - так называемый порошок Либиха. Немецкий химик Юстус Либих изобрел не только бульонные кубики, но и порошок для получения пышного теста - это смесь NaHCO3 и лимонной кислоты, которая при нагревании превращается в цитрат натрия, выделяя СО2 и воду:
3 NaHCO3 + С3Н4 (ОН) (СООН)3 = С3Н4 (ОН) (СООNa)3 + 3СО2 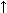 + 3Н2О.
+ 3Н2О.
Чем заменить разрыхлитель для теста или домашний разрыхлитель
Итак, домашний разрыхлитель:
-
сода пищевая - 5 г,
-
лимонная кислота - 3 г
-
мука пшеничная - 12 г
Смешать, и получится 20 г пекарского порошка или разрыхлителя. Разрыхлитель добавляют в муку, а затем уже вымешивают тесто. Такое количество домашнего разрыхлителя рассчитано примерно на 500 г муки.
Словом, сода - непременный компонент кухонного производства, и на хорошей кухне без нее нельзя обойтись.
Жесткость воды. Учитель.
Когда-то территория нашего города была дном мирового океана. Известковые панцири морских моллюсков, раковин, рачков представляют собой карбонат кальция. Отмирая, морские обитатели опускались на дно, их скелетные ткани образовывали огромные пласты минерала - известняка. Он широко используется в промышленности и строительстве.
Кальций принадлежит к числу самых распространённых в природе элементов. В земной коре его содержится приблизительно 3% (масс.). Из-за своей химической активности в чистом виде кальций в природе не встречается, встречается только в виде соединений (солей).
Лабораторная работа "Ознакомление с природными соединениями кальция".
Учитель: Соли кальция образуют в природе большие скопления в виде карбонатов (мел, известняк, доломит, мрамор), сульфатов (гипс), фосфатов (фосфоритов). Рассмотрите выданные вам образцы природных соединений кальция и обратите внимание на их внешний вид.
Учитель: Как отличить карбонатные породы от некарбонатных? (Провести качественную реакцию на карбонат-ион. Подействовать на выданный образец природного соединения кальция кислотой, наблюдается характерное "вскипание" - выделение СО2).
Качественная реакция на карбонат-ион
Характерное «вспенивание» при взаимодействии кислот с солями угольной кислоты (карбонатами) принято считать качественной реакцией на карбонат-ион.
Вы увидели и доказали, что мел и известковый налет по своему составу не отличаются, оба вещества являются солями угольной кислоты. Составьте уравнение химической реакции в молекулярном и ионном виде взаимодействия карбоната кальция с раствором соляной кислоты (один ученик работает у доски, остальные в тетрадях).
Проблематизация.
Включаем видеоролик рекламы продукции бытовой химии и средств по устранению известкового налета.
Итак, наверное, все догадались, о чем пойдет речь на следующем этапе урока - о жесткости воды. Вода - хороший растворитель. Просачиваясь сквозь горные породы, она растворяет некоторые из них. Так в воде накапливаются растворённые вещества (соли) и она минерализуется.
В воде могут быть растворены не только минеральные вещества, но и газы (углекислый газ, сероводород) и органические вещества.
Подземные воды, содержащие большое количество солей и газов, называют минеральными
Ода Докучаевску
-
Выступление творческой группы с результатами работы над проектом «Что может натворить жесткая вода?».
Глагол «натворить» употреблен умышленно: НАТВОРИТЬ (нанести вред) и НАТВОРИТЬ (сотворить). У нас две новости: одна хорошая и вторая - решаемая.
Все мы слышали о проблеме жесткости воды. Но, может быть, жесткая вода способна не только приносить вред и убытки? Ведь если природа придумала жесткую воду, значит это для чего-то нужно? Известкование в природе и в быту (например, в чайнике) протекает одинаково.
Уравнение реакции образования карбоната кальция из гидрокарбоната:
Са(НСО3)2 t° -> СаСО3 + Н2О + СО2
Демонстрируются фотографии сталактитовых пещер, морских раковин кораллов и т.п., видеоролик об образовании сталактитов.
Проблема жесткой воды актуальна для нашего города.
ИНСТРУКТИВНАЯ КАРТОЧКА
Обнаружение солей в минеральной воде
-
Доказать разную степень минерализации. Для этого на предметное стекло накапать несколько капель минеральной воды сначала одного вида, затем столько же другого. Выпарить воду.
-
Оставшийся сухой остаток на стекле свидетельствует о наличии минеральных солей.
При стирке белья жесткая вода не только ухудшает качество стираемых тканей, но и приводит к повышенным затратам мыла. В жесткой воде с трудом развариваются пищевые продукты, а сваренные в ней овощи теряют вкус. Также плохо заваривается чай.
Жесткая вода не пригодна для использования в паровых котлах: растворенные в ней соли при кипячении образуют на стенках котлах слой накипи, который плохо проводит тепло.
Это приводит к перерасходу топлива, к преждевременному износу котлов, а иногда, в результате перегрева котла, и к аварии. Также образуется и накипь в чайниках, нагревателях стиральных машин, что выводит их из строя. Жесткая вода вредна для металлических конструкций, трубопроводов. Употребление жесткой воды в пищу приводит к образованию камней в почках.
В ходе работы над проектом было проведено исследование жесткости воды и способов ее устранения.
Результаты исследования:
Жесткость воды обусловлена содержанием в воде ионов Са2+ и Мg2+ в составе растворимых гидрокарбонатов, хлоридов, сульфатов. Жесткость делится на следующие виды:
Вид жесткости
Чем обусловлен
1.Карбонатная или временная
2. Некарбонатная или постоянная
3. Общая
Са (НСО3)2, Мg(НСО3)2
СаСl2, МgCl2, CaSO4, MgSO4
Постоянная и временная вместе
Для определения жесткости воды использовался концентрированный мыльный раствор. В основе эксперимента лежит способность мыльного раствора образовывать устойчивую пену в воде разной жесткости с разной скоростью. Мыльный раствор добавляется к исследуемому образцу по каплям и встряхивается. В качестве эталона берется дистиллированная вода.
Берем 1/3 пробирки исследуемой воды и по каплям добавляем мыльный раствор, после каждого добавления встряхиваем.
Результаты определения жесткости воды
Образец воды
Число капель мыльного раствора
Изменения
1.Вода дистиллированная
2.Вода водопроводная
3.Вода колодезная
4. Вода дождевая
Образовалась устойчивая пена
Образовалась устойчивая пена, появился хлопьевидный осадок
Образовалась пена, выпал хлопьевидный осадок
Образовалась устойчивая пена
Вывод: Дистиллированная вода не содержит солей. Вода дождевая почти не содержит солей Са2+ и Мg2+.
Вода из колодца и водопроводная - жесткая.
Уменьшение жесткостиДля этого берем 1/3 исследуемой воды (водопроводная и колодезная) и нагреваем до кипения.
Образец воды
Действие
Число капель мыльного раствора
Вид жесткости
1.Водопроводная вода
2.Колодезная
Кипячение
Кипячение
Временная и постоянная
Временная и постоянная
Вывод: Так как после кипячения уменьшился расход мыльного раствора, то исследуемая вода обладала карбонатной жесткостью, которая устраняется кипячением. Са(НСО)2= СаСО3 + СО2+ Н 2О
Демонстрация эксперимента с последующими расчетами КПД кипятильника покрытого известковым налетом и очищенным (Закон Джоуля-Ленца)
Ученики (2 человека) начинают физический эксперимент и расчеты.
Описание эксперимента: В 2 банки, емкостью 1л, наливают воду из крана, измеряют температуру воды (должна быть одинаковой) с помощью термометров, помещают в каждую банку по кипятильнику с одинаковой мощностью, но один кипятильник должен быть очищен от известкового налета, а другой покрыт известковым налетом (кипятильники закрепить на отдельных штативах), одновременно включить в сеть и включить секундомеры. Каждый ученик наблюдает за своим нагревательным прибором и измеряет время до начала кипения воды. Затем по закону Джоуля-Ленца производятся расчеты КПД кипятильников и перерасход энергии в %. Опыт очень прост, но наглядно демонстрирует какой экономический ущерб наносит народному хозяйству процесс известкования (образование накипи при использовании жесткой воды).
Опыт занимает время, поэтому пока ученики проводят эксперимент и готовят на доске расчеты, ученикам в классе предлагается рассмотреть образцы нагревательных приборов, кусочков труб отопления (спил, где хорошо видна толщина слоя известкового налета) и т.п. и эксперимент о моющей способности мыла в жесткой и мягкой воде.
После знакомства с образцами перед учащимися демонстрируется опыт «Растворение мыла в мягкой и жесткой воде»
Описание эксперимента: Выданы две пробирки с мягкой и жесткой водой и раствор мыла. Ученик, приглашенный к доске, приливает раствор мыла и встряхивает одновременно обе пробирки одинаковое количество раз, после чего с помощью линейки измеряет высоту столбика пены. Делает выводы (о недостатках мыла и предлагает путь решения данной проблемы, использовать альтернативные СМС).
Экспериментаторы предъявляют свои расчеты, делают выводы.
Ррасчет КПД по закону Джоуля - Ленца
η = Q полезн./ Qзатрач. Q затр.= P*Δ t(сек) Q полезн. = Q нагрев.
Q нагрев.= m*С*ΔТ= V*ρ *С*ΔТ P-мощность кипятильников (1200 Вт)
Δ t (сек) - время измеренное секундомерами (время до начала закипания воды) V-объем воды (1л = 10-3м3) ρ -плотность воды (1кг/ м3)
С - удельная теплоемкость воды (4200 Дж/кг * С)
ΔТ- разность температур (до нагревания и после нагревания)
Пример расчета:
Температура воды вначале опыта 220С,после закипания 1000С
t1 (сек) = 4мин 50сек =290 сек потребовалось чтобы вскипятить воду чистым кипятильником
t2 (сек) = 5мин 33сек =333 сек потребовалось чтобы вскипятить воду кипятильником на котором есть известковый налет.
Q полезн.=Q нагрев.= 10-3м3 * 1кг/ м3 * 4200 Дж/кг * С * (1000С - 220С)=327,6 Дж; Q1затр.= 1,2 кВт * 290 сек =348 Дж;Q2 затр.= 1,2 кВт * 333 сек =399,6 Дж
η 1 = 327,6 / 348 = 0,94 (94%) КПД чистого кипятильника
η 2 =327,6 / 399,6 = 0,82 (82%) КПД кипятильника с накипью
Δη = 94-82=12% составляют потери
Способы устранения жесткости воды.
УЧИТЕЛЬ: Проблемы обозначены, каковы возможные пути их решения? Как устранить или снизить жесткость воды? Как бороться с уже образовавшимся известковым налетом?
Средства для умягчения воды и устранения известкового налета
Ученик: Для эффективного решения проблем связанных с образованием известкового налета химическая промышленность предлагает множество средств бытовой химии. Чтобы применить какое-либо средство правильно необходимо ознакомиться с инструкцией на упаковке и изучить состав.
Средства для умягчения воды в быту (или для предотвращения образования накипи), обратите внимание, какие вещества входят в их состав. Сода (карбонат натрия) и фосфат натрия, это те вещества, которые можно использовать для устранения временной и постоянной жесткости.
Ученик записывает уравнения между солями жесткости и водоумягчающими компонентами), например
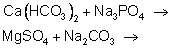
Образованные осадки не оседают на нагревательных приборах, а вымываются вместе с моющими растворами.
Средства для устранения образовавшегося известкового налета содержат в своем составе органические и минеральные кислоты. Давайте выясним почему. Проведем для этого простой опыт.
Приглашенный ученик проводит опыт по растворению известкового налета на любом нагревательном приборе (можно на уже использованном ранее кипятильнике) с помощью минеральной кислоты, а так же растворение мела и записывает на доске уравнение реакции в молекулярном и ионном виде.
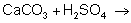
Жесткость воды и способы ее устранения
Состав жесткой воды
Вид жидкости
Способы устранения
катионы
анионы
по составу
по способу её устранения
Са 2 +
Mg 2+
НСО-3
карбонатная
временная
1) нагревание
2) добавление известкового молока или соды.
Сl -
SO42-
некарбонатная
постоянная
1) добавление соды
НСО-3
Сl -
SO42-
общая
1) добавление соды
2) добавление извести
Выводы.
1. В ходе нашей работы мы выяснили, что воды из различных источников значительно различаются по содержанию солей кальция и магния, так жёсткость на юге почти в 2 раза выше, чем на севере.
2. В современных стиральных порошках содержатся компоненты (полифосфаты), снижающие жёсткость воды.
3. Бытовые фильтры достаточно хорошо умягчают воду, снижая содержание кальция и магния почти в 2 раза.
Биолог «Жесткость»
Так можно ли пить жесткую воду?
Организм человека требует живую воду, с ее природной структурой, физиологически полноценной по своему составу. Основные макроэлементы жесткости воды необходимы человеку, поэтому пить жесткую воду можно, но в меру.
Влияние жесткой воды на здоровье человека:
1) жесткая вода, взаимодействуя с мылом, образует «мыльные шлаки», которые не смываются водой и оставляют малосимпатичные разводы на посуде и поверхности сантехники; «мыльные шлаки» также не смываются с поверхности человеческой кожи, забивая поры и покрывая каждый волос на теле, что может стать причиной появления сыпи, раздражения, зуда;
2) при питье жесткой воды есть вероятность развития мочекаменной болезни.
СаСО3 + СО2 + Н2О 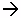 Са(НСО3)2
Са(НСО3)2
MgСО3 + СО2 + Н2О 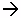 Mg(НСО3)2
Mg(НСО3)2
Учитель. Итак, давайте обобщим, что нового мы узнали о воде и ее жесткости.
1. К каким водам - мягким или жестким относится колодезная и ключевая вода? (Средней жесткости)
2. Почему колодезная вода, как правило, вкусная, а дождевая нет? (Вкус колодезной воды придают содержащие в ней различные вещества)
3. Почему до изобретения антифриза в системы охлаждения двигателей заливали дистиллированную воду, а не воду из-под крана? (В воде из-под крана содержатся гидрокарбонаты кальция и магния, то при повышении температуры будут превращаться в нерастворимые карбонаты и оседать на стенках системы, тем самым, ухудшая теплоотдачу двигателя)
4.Как доказать что накипь содержит карбонат? (Подействовать кислотой)
5. Как химическим путем можно очистить в домашних условиях посуду от накипи? (Можно удалить раствором уксуса)
6. Иногда для приготовления продуктов используют горячую воду из крана. Возможно ли это (Нет, ее смягчают содой для уменьшения отложения на стенках труб нерастворимых карбонатов)
Домашнее задание.
-
Проверка глубины осмысления знаний, степени обобщения
Итак, давайте вернёмся к эпиграфу урока.
СИНКВЕЙН
• Первая строка - тема урока, выраженная одним словом, обычно существительным.
• Вторая строка - описание темы в двух словах, как правило, прилагательными.
• Третья строка - описание действия в рамках данной темы тремя словами, обычно глаголами.
• Четвертая строка - фраза из четырех слов, выражающая отношение автора к данной теме.
• Пятая строка - одно слово, синоним к первому, эмоциональное, образное, философской обобщение, повторяющее суть темы.
1.Соли.
2. Кислые, средние, основные.
3.Растворяются, обмениваются, разлагаются.
4.Без них нельзя обойтись
5. Химические вещества.
Рефлексия.
Вывод по теме урока делают учащиеся:
-
Сегодня я узнал…
-
Было интересно…
-
Было трудно…
-
Я выполнял задания…
-
Я понял, что…
-
Теперь я могу…
-
Я почувствовал, что…
-
Я приобрел…
-
Я научился…
-
У меня получилось …
-
Я смог…
-
Я попробую…
-
Меня удивило…
-
Урок дал мне для жизни…
-
Мне захотелось…
Оценивание учащихся, самооценка.
РЕФЛЕКСИЯРеализую рефлексивный тест:
1) Я узнал(а) много нового. Меня очень заинтересовала очень простая на вид поваренная соль, но оказалась, что о ней можно узнать много интересного и познавательного.
В мире запасы соли практически неисчерпаемы. Человек использует для себя те источники, которые позволяют ему, получать более доступную, дешевую, чистую соль.
Работая над данной темой, я понял, что эти бесцветные твердые кристаллы, хорошо растворимые в воде, которых-то и в пищу употребляют в малых количествах, играют огромную роль в жизнедеятельности живых организмов (как животных, так и человека).
Очевидно, что нельзя недооценивать важность и необходимость соли в нашей жизни. Но, при этом, нельзя забывать и о вреде, который она может причинять при неграмотном использовании. Я думаю, что практически любой полезный и нужный продукт может стать опасным для человека и природы при неразумном его использовании.
2) Мне это пригодится в жизни.
3) На уроке было над, чем подумать.
4) На все возникшие у меня вопросы я получил(а) ответы.
5) На уроке я поработал(а) добросовестно.
В случае согласия с утверждением поставьте напротив него знак «+».


