- Преподавателю
- Химия
- Конспект занятия по химии на тему Классы неорганических соединений (с использованием ИКТ)
Конспект занятия по химии на тему Классы неорганических соединений (с использованием ИКТ)
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Кондакова Л.Н. |
| Дата | 25.08.2015 |
| Формат | docx |
| Изображения | Есть |
План-конспект учебного занятия №9.
Тема: «Классификация неорганических соединений и их свойства».
Дата проведения: « » ________________ 20___ г.
Цели: Обобщить и закрепить знания о классификации неорганических веществ; научить на основании состава молекулы вещества правильно называть вещества; рассмотреть взаимосвязь и взаимообусловленность состава, строения и свойства вещества; дать представление о значении неорганических веществ в повседневной жизни; дать понятие комплексного соединения.
Тип урока: Обобщение и закрепление пройденного ранее материала.
Методическое обеспечение урока:
Учебные пособия: презентация «Классы неорганических соединений», ссылки на электронные учебники:
Ссылка №1. (учебник И.И. Новошинский, Н.С. Новошинская 8 класс.)
narod.ru/disk/60533216001.17bc3e455cb4199f2e7b9bd8b5a5195b/Himiya.pdf.html
(смотри с.79 §24)
Ссылка №2. alhimikov.net/elektronbuch/menu.html
Ссылка №3 для скачивания. rusfolder.com/download/62/?37560019&9m7lbl03QuKpnFdgkwoZLQ%3D%3D
(смотри с.151 Глава 6)
himichim.ucoz.net/load/osnovnye_klassy_neorganicheskikh_soedinenij/1-1-0-16
(презентация классы неорганических соединений).
ТСО: компьютеры, проектор, учебная доска, мел.
Основные понятия урока:
Простые вещества - металлы и неметаллы; сложные вещества - оксиды, кислоты, соли, основания; амфотерность, структурные формулы соединений, двойные, средние, кислые и комплексные соли.
Ход урока:
-
Оргмомент. (проверка присутствующих на занятии)
-
Обобщение и закрепление пройденного ранее материала.
- Ребята, мы уже знаем, что химия изучает вещества и их превращения. А вещества в свою очередь бывают простые и сложные. Какие вещества называются простыми, а какие сложными?
- Вспомните, какие вы знаете сложные вещества? Назовите их. К каким классам неорганических соединений они относятся?
- Сегодняшнее занятие у нас будет в необычной форме. Мы с вами должны сравнить металлы и неметаллы, а также охарактеризовать классы неорганических соединений и заполнить их сравнительную таблицу.
- Давайте вспомним, чем же металлы отличаются от неметаллов и каковы их химические свойства?
Для сравнения металлов и неметаллов давайте составим следующую таблицу:
Вещество
Строение атома
Вид химической связи
Строение простых веществ, тип кристаллической решетки
Свойства вещества
Все металлы
Малое кол-во электронов на внешнем энергетическом уровне (меньше 3)
Металлическая связь
Металлическая кристаллическая решетка
Восстановительные свойства
Все неметаллы
Большое количество электронов на внешнем энергетическом уровне (больше 4)
Ковалентная полярная связь
Молекулярная или атомная кристаллическая решетки
Окислительно-восстановительные свойства
Благородные газы
Внешний энергетический уровень завершен (октет электронов или 2 у Не)
Нет связей между атомами
Молекулярная кристаллическая решетка
Инертны
- А сейчас давайте вспомним основные классы неорганических соединений и рассмотрим их свойства.
Для характеристики классов пользуйтесь следующим планом:
1. № п/п
2. Название класса. Определение. Общая формула.
3. Классификация
4. Способы получения.
5. Химические свойства.
6. Основная область применения класса.
№ п/п
Название, определение, общая формула.
Классификация
Способы получения
Химические свойства
1.
Оксиды - это соединения, состоящие из атомов 2 элементов, одним из которых является кислород в с.о. равной -2.
Общая формула: ЭхОу
Оксиды:
-
Несолеобразующие (безразличные) - NO, СО, N2O.
-
Солеобразующие -
А) Основные оксиды - образованы металлами, им соотв-т основания. ВаО, Na2О, К2О
Б) Кислотные оксиды - образованы неметаллами и металлами в высшей с.о. Им соотв-т кислоты. SO2, SO3, СО2.
В)Амфотерные оксиды -образованы переходными элементами- Fe, Mn, Mo, Cu, Zn, Pt, Au.
1) Горение простых веществ
С + О2 = СО2
2) Горение сложных веществ
СН4 + 2О2 = СО2 + 2Н2О
3) Разложение солей
СаСО3 = СаО + СО2
4) Разложение кислот
Н2СО3= СО2 + Н2О
5)Разложение нерастворимых оснований
2Fe(ОН)3 = Fe2О3 + 3Н2О
Свойства основных оксидов:
1)Вз-е с водой
СаО + Н2О = Са(ОН)2
2) Вз-е с кислотами
Al2О3 + 6НСl = 2AlCl3 + 3Н2О
3) вз-е с кислотными оксидами
СаО + СО2 = СаСО3
4)Вз-е с амфотерными оксидами
Li2O + Al2O3 = 2LiAlO2
Свойства амфотерных оксидов:
-
Вз-т с кислотами и основаниями
ZnO + 2HCl = ZnCl2 + Н2О
ZnO + 2NaOH + Н2О = Na2[Zn(OH)4]
-
Реагируют с основными и кислотными оксидами
ZnO + СаО = СаZnО2
ZnО + SiО2 = ZnSiО3
Свойства кислотных оксидов:
-
Вз-е с водой
SO3 + Н2О = Н2SО4
-
Вз-е со щелочами
NaOH + SiO2 = Na2SiO3 + H2O
-
Вз-е с основными оксидами
SiO2 + CaO = CaSiO3
-
Вз-е с амфотерными оксидами
Al2O3 + 3SO3 = Al2(SO4)3
Оксиды входят в состав многих минералов и горных пород: кварц (SiO2), корунд (Al2O3), асбест (СаО*3MgO*4SiO2), тальк (3MgO*4SiO2*H2O), глина, руды железа: красный железняк - Fe2O3, магнитный железняк - Fe3O4. В состав воздуха входят: оксид углерода IV - СО2, вода - Н2О; СО - угарный газ (образуется при неполном сгорании топлива).
2.
Основания - это сложные вещества, состоящие из ионов металла и 1 или нескольких гидроксид-ионов.
Общая формула оснований:
Ме+n(ОН)-n
- По числу гидроксид-ионов бывают:
1.Однокислотные - КОН, NаОН
2. Многокислотные - Са(ОН)2, Fe(ОН)2
- По растворимости в воде бывают:
-
Растворимые - (щелочи) - металлы I и II групп.
-
Нерастворимые - их образуют все остальные металлы.
-
Металл + вода
2Na + Н2О = 2NaОН + Н2
-
Оксид + вода
Li2О + Н2О = 2LiОН
-
Электролиз растворов щелочных металлов
2NaCl + 2 Н2О = 2NaОН + Сl2 + Н2
-
Соль + щелочь
CuSО4 + 2 NaОН = Cu(OH)2 + Na2SO4
-
Вз-е с кислотами:
КОН + НСl = KCl + Н2О
-
Вз-е с кислотными оксидами
2КОН + СО2 = К2СО3 + Н2О
-
Действие индикаторов
Лакмус - синяя;
ф/ф - малиновый;
м/о - желтый.
-
Вз-е с амфотерными оксидами
2КОН + ZnО = К2ZnО2 + Н2О
-
Вз-е с солями
NaОН + CuCl2 = Cu(ОН)2 + 2NaCl
-
При нагревании разлагаются (кроме LiОН)
Сu(ОН)2 = СuO + Н2О
-
Амфотерные гидроксиды (Al(OH)3; Zn(OH)2; Ве(ОН)2; Fe(ОН)3) вз-т с кислотами и щелочами
Zn(ОН)2 + 2НСl = ZnCl2 + 2Н2О
Al(ОН)3 + NaОН = Na[Al(ОН)4]
NaОН - «едкий натр» - очистка нефтепродуктов, отбеливание бумаги, производство мыла, осушка газов в орг. синтезе; Cа(ОН)2 - известковый раствор, побелка, производство сахарозы; NН4ОН - нашатырный спирт - в медицине, аммиачная вода - жидкое минеральное удобрение; Al(ОН)3 - в медицине - алмагель - обладает обволакивающими адсорбирующими свойствами; Fe(ОН)3 - компонент желтого пигмента для красок и эмалей, катализатор в орг.синтезе.
3.
Кислоты - это сложные вещества, молекулы которых состоят из ионов водорода и кислотных остатков.
Общая формула кислот:
Н+хАх-
- По числу атомов водорода (т.е. по основности):
1.Одноосновные - НСl, НNО3
2. Двухосновные - H2S, H2SO4
3. Трехосновные - Н3РО4
- По наличию кислорода в кислотном остатке
-
Бескислородные - НСl, H2S
-
Кислородсодержащие - НNО3, Н3РО4, H2SO4
- По растворимости:
-
Растворимые - НСl, НNО3
-
Нерастворимые - Н2SiО3
-
Кислотный оксид + вода
SO3 + Н2О = Н2SО4
-
Неметалл + сильный окислитель
Р + 5НNО3 + 2Н2О = 3Н3РО4 + 5 NO
-
Вз-е металлов и неметаллов
Н2 + Сl2 = 2 НСl
-
Соль + менее летучая кислота
NaNО3 + Н2SО4 = НNО3 + NaHSО4
NaCl + Н2SО4 = 2НСl + NaHSО4
-
Изменяют окраску индикаторов
Лакмус - красный,
м/о - красный,
ф/ф - бесцветный
-
Вз-е с металлами, стоящими до водорода
Н2SО4 + Са = СаSО4 + Н2↑
-
Вз-е с основными оксидами
Н2SО4 + СаО = СаSО4 + Н2О
-
Вз-е с основаниями
Н2SО4 + Са(ОН )2 = СаSО4 + 2Н2О
-
Вз-е с амфотерными оксидами
Н2SО4 + ZnО = ZnSО4 + Н2О
-
Вз-е с солями с образованием малорастворимого, малодиссоциирующего или летучего вещества
Н2SО4 + ВаСl2 = ВаSО4 + 2 НСl
-
При нагревании слабые кислоты легко разлагаются
Н2SiО3 = Н2О + SiО2
Н2SО4 - для произ-ва минер.удобрений, очистке нефтепродуктов, поверхностей металлов, произ-ва волокон, краски, лаков, лекарственных препаратов, взрывотехника, заливка аккумуляторов.
НNО3 - для произ-ва азотных удобрений, лекарственных препаратов, ракетного топлива; Н3РО4 - для произ-ва фосфорных удобрений; НСl - для травления металлов, произ-ва солей, в медицине.
4.
Соли - сложные вещества, состоящие из катионов металла и анионов кислотного остатка.
Соли бывают:
-
Кислые - обр-ся при неполном замещении атомов водорода в молекулах кислот на атомы металла.
Н3РО4 --- NaН2РО4
Н3РО4 --- Na2НРО4
-
Средние - обр-ся при полном замещении атомов водорода в молекуле кислоты на атомы металла или полном замещении гидроксогрупп в молекулах оснований на кислотные остатки:
Н3РО4 ---Na3РО4,
Ва(ОН)2 --- ВаСl2
-
Основные - обр-ся при неполном замещении гидроскогрупп в основаниях на кислотные остатки:
Fe(ОН)3 --- (FeOH)Cl2
Cu(OH)2 --- (CuOH)NO3
-
Двойные-диссоциируют в водных растворах в одну ступень на катионы металлов и анионы кислотных остатков.
КAl(SO4)2=К++Al3++2SO42-
-
Комплексные - при диссоциации образуют сложные комплексные ионы, которые устойчивы в водных растворах.
[Cu(NH3)4]SО4 = [Cu(NH3)4]2+ + SО42-
-
металл+неметалл
Mg+Cl2=MgCl2
-
металл+кислота
Zn+2HCl=ZnCI2+H2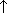
-
металл + соль
Fe+CuSO4=FeSO4+Cu
-
основной оксид+кислота
CaO+2HCl=CaCl2+H2O
-
кислотный оксид+основание
CaO+CO2=CaCO3
-
основной+амфотерный оксиды
Al2O3+CaO=Ca(AlO2)2
-
кислота+основание (р-я нейтрализации)
H2SO4+2NaOH=Na2SO4+2H2O
-
соль+соль
AgNO3+NaCl=AgCl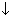 +NaNO3
+NaNO3
-
соль+щелочь
CuSO4+2NaOH=Cu(OH)2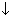 +Na2SO4
+Na2SO4
10)соль+кислота
Na2CO3+2HCl=2NaCl+H2O+CO2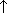
Кислые соли получают такими же способами, что и средние, но при других мольных соотношениях (при избытке кислоты)
NaOH+H2SO4=NaHSO4+H2O
Основные соли образуются при взаимодействии некоторых солей со щелочами (при избытке щелочи)
ZnCl2+NaOH=ZnOHCl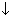 +NaCl
+NaCl
-
Разложение при прокаливании
CaCO3=CaO+CO2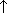
-
Соль + металл
Fe+CuSO4=FeSO4+Cu
-
Соль + соль
AgNO3+NaCl=AgCl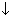 +NaNO3
+NaNO3
-
Соль + щелочь
CuSO4+2NaOH=Cu(OH)2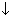 +Na2SO4
+Na2SO4
-
Соль + кислота
Na2CO3+2HCl=2NaCl+H2O+CO2
Na2СО3 - кальцинированная сода - исп-т в стекольной, мыловаренной, текстильной, целлюлозно-бумажной и нефтяной промышл-ти, NaНСО3 - питьевая сода - в хлебопечении и пищевой промышл-ти, Са3(РО4)2 - в произв-ве фосфорных удобрений, Na2SiО3 - в произв-ве клея, MgSО4 ∙ 7Н2О - горькая соль - сод-ся в морской воде и придает ей горький вкус, применяют в кач-ве слабительного, NaCl - в составе желудочного сока, крови, для получения соды, хлора, щелочи и т.д.
4. Закрепление.
- Мы рассмотрели сегодня строение и свойства неорганических соединений, их значение в жизни, а сейчас давайте закрепим полученные сегодня знания.
- Давайте решим задания в конце параграфов ссылки №1 ( И.И. Новошинский, Н.С. Новошинская 8 кл.).
1. Оксиды - с.82 №1, №2, №5
2. Основания - с.84-85 №1, №2, №5
3. Кислоты - с.90 №1, №2, №4
4. Соли - с. 94-95 №1, №2, №5
5. Домашнее задание.
Запишите домашнее задание ссылки №1 на дом:
ссылка №1 ( И.И. Новошинский, Н.С. Новошинская 8 кл.).
1. Оксиды - с.82 №3, №4
2. Основания - с.85 №3, №4
3. Кислоты - с.90 №3
4. Соли - с. 95 №3, №4
6. Рефлексия (итог урока):
Выставляются оценки за работу на уроке. Подводятся итоги урока.


