- Преподавателю
- Химия
- Конспект урока по химии на тему Реакции разложения
Конспект урока по химии на тему Реакции разложения
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Конспекты |
| Автор | Бажанов А.Г. |
| Дата | 16.10.2015 |
| Формат | doc |
| Изображения | Есть |
Конспект урока по химии в 8 классе.
Тема: Реакции разложения.
Цель:
-
Сформировать представление о химических уравнениях;
-
Дать понятие о реакциях разложения;
-
Начать формировать умения составлять уравнения химических реакций.
Задачи:
- образовательные: обеспечить повторение и закрепление представлений учащихся о химических уравнениях. Рассмотреть химические уравнения на примере реакций разложения, и, практически изучить распространённые примеры реакций разложения.
- воспитательные: способствовать формированию основных мировоззренческих идей: материальность мира, причинно-следственные связи явлений, познаваемость мира. Содействовать трудовому и эстетическому воспитанию учащихся. Воспитать дисциплинированность, самостоятельность, внимательность и аккуратность в работе.
- развивающие: развивать у учащихся интерес к предмету, умение работать на уроке, работать с наглядным материалом, учебником; развивать умение логически мыслить, делать собственные выводы; развивать у учащихся внимание, воображение, память, восприятие. Развивать умение выделять главное и существенное, сравнивать и анализировать.
Форма организации занятия: урок
Форма организации работы в классе: фронтальная, групповая, индивидуальная.
Тип урока: урок изучения нового материала.
Методы:
- словесные (объяснение, рассказ, описание, беседа);
- словесно - наглядные (демонстрационный опыт);
- словесно - наглядно - практические (самостоятельная работа учащихся, работа с книгой, записи в тетради).
Оборудование и реактивы: штатив, демонстрационные пробирки с газоотводными трубками, спиртовка, лучинка, спички, мел (порошок), сульфат меди, гидроксид натрия, пероксид водорода (3 %), оксид марганца (IV).
План урока:
I Вводная часть.
1. Организационный момент.
2. Сообщение темы и цели урока, мотивация деятельности учащихся
II. Основная часть
1. Повторение пройденного материала.
2. Организация восприятия и осознание нового материала.
3. Закрепление пройденного материала.
III. Заключительная часть.
1. Подведение итогов
2. Сообщение и комментирование домашнего задания.
Литература:
1. Габриелян О.С. «Химия 8 класс» Москва- 2012
2. Габриелян О.С., И.Г.Остроумов «Настольная книга учителя. Химия 8 класс» Москва-2009
3. Поурочные планы по химии к учебникам О.С. Габриеляна, Л.С. Гузея и др. Химия. 8 класс. - М.: ВАКО, 2009.
Ход урока
I. Вводная часть.
1) Организационный момент.
Учитель: Здравствуйте, садитесь! Дежурный, назовите отсутствующих!
Ученик: … (называет отсутствующих, если они имеются).
2) Сообщение темы и цели урока, мотивация деятельности учащихся.
Учитель: Ребята, сегодня мы должны изучить новую тему: Химические уравнения. Реакции разложения.
Перед нами поставлены следующие цели:
-
Сформировать представление о химических уравнениях;
-
Дать понятие о реакциях разложения;
-
Продолжить формирование умения составлять уравнения химических реакций.
Тема урока сложная, поэтому не отвлекайтесь, слушайте внимательно.
II. Основная часть.
-
Повторение пройденного материала.
Учитель: Для перехода к изучению нового материала необходимо проверить, как вы усвоили материал прошлых занятий.
Вам даны карточки с уравнениями реакций, в которых необходимо расставить коэффициенты. На выполнение задания дается 5 минут.
Карточка «Составление уравнений реакций»
1) 4P + 5O2 → 2P2O5.
2) 2CuOH → Cu2O + H2O.
3) H3PO4 + 3NaOH → Na3PO4 + 3H2O.
4) Na2O + H2O → 2NaOH.
5) 3FeO + 2Al → Al2O3 + 3Fe.
Сейчас обменяйтесь карточками с соседом и проверьте правильность выполнения задания. Правильные ответы выведены на экран.
А сейчас проведем фронтальный опрос.
Учитель: На прошлых уроках вы познакомились с понятиями физических и химических явлений, научились составлять химические уравнения.
Учитель: Что представляют собой химические явления? Приведите примеры химических явлений.
Ученик: Это такие явления, при которых изменяется состав вещества. Например, горение древесины, спирта.
Учитель: Какими внешними признаками сопровождаются химические реакции?
Ученик: Образование осадка (AgNO3 + NaCl → AgCl … + NaNO3); образование газа (CaCO3 → CaO + CO2); изменение цвета (FeCl3 + KCNS → Fe(CNS)3 + 3KCl), FeCl3 имеет жёлтый цвет, а образовавшийся Fe(CNS)3 - красную окраску; выделение (C + O2 → CO2) или поглощение (2H2O → 2H2 + O2) теплоты.
Учитель: Какие реакции называют реакциями горения? Приведите примеры.
Ученик: Реакции горения - это реакции, протекающие с выделением теплоты и света. Например, (C2H5OH + 3O2 → 2CO2 + 3H2O).
Учитель: Какие реакции называют экзотермическими? Приведите примеры.
Ученик: Экзотермическими называют реакции, протекающие с выделением теплоты. Например, (CH4 + 2O2 → CO2 + 2H2O).
Учитель: Какие реакции называют эндотермическими? Приведите примеры.
Ученик: Эндотермическими называют реакции, протекающие с поглощением теплоты. Например, электролиз воды (2H2O → 2H2 + O2).
Учитель: Кто и когда открыл закон сохранения массы веществ?
Ученик: Закон сохранения массы веществ открыл Ломоносов М.В. в 1756 году.
Учитель: Сформулируйте закон сохранения массы веществ?
Ученик: Масса веществ, вступивших в химическую реакцию, равна массе веществ, получившихся в результате её.
2) Изучение нового материала.
Учитель: Откройте свои тетради, запишите на полях сегодняшнее число 18.02.14, в центре листа тему урока: Реакции разложения.
Учитель: Давайте вспомним, какие же типы химических реакций выделяют «по числу и составу исходных веществ и продуктов реакции».
Ученик: По числу и составу исходных веществ и продуктов реакции выделяют 4 типа химических реакций: разложения, соединения, обмена и замещения.
Учитель: Сегодня мы с вами рассмотрим первый тип химических реакций по числу и составу исходных веществ и продуктов реакции - это реакции разложения.
Записи в тетради: Реакции разложения - это реакции, в результате которых из одного сложного вещества образуется два или более простых или сложных новых веществ.
В 1774 году английский химик Дж. Пристли, используя стеклянную двояковыпуклую линзу, направил сконцентрированный ею пучок солнечных лучей на оксид ртути (II) и получил кислород (рис. 100). Чтобы подчеркнуть, что кислород - это газ, в уравнении реакции рядом с его формулой записывают стрелку, направленную вверх:
2HgO → 2Hg + O2↑.
В этом уравнении химической реакции видно, что из одного сложного вещества образуется два простых вещества.
Записи в тетради:
2HgO → 2Hg + O2↑.
Рассмотрим другую, аналогичную, реакцию: разложение воды электрическим током с помощью специальной установки - электролизёра (рис. 101):
2H2O → 2H2↑ + O2↑.
Этот процесс является одним из способов получения чистого кислорода.
В лаборатории кислород часто получают разложением другого вещества - пероксида водорода (H2O2):
2H2O2 → 2H2O + O2↑.
Записи в тетради:
2H2O → 2H2↑ + O2↑;
2H2O2 → 2H2O + O2↑.
Если подогревать некоторый объем пероксида водорода в пробирке, не доводя его до кипения, то кислород выделяется медленно и его будет недостаточно, чтобы увидеть, как вспыхнет, внесённая в верхнюю часть пробирки, тлеющая лучинка. В этом случае реакция идёт с небольшой скоростью.
Скорость химической реакции можно увеличить.
Демонстрационный опыт. Нальём в химический стакан на ¼ его объёма пероксида водорода и с помощью ложечки всыплем в него немного порошка оксида марганца (IV) (рис.102, а). Жидкость в стакане мгновенно «вскипает» от бурно выделяющегося кислорода (рис. 102, б). Внесённая в верхнюю часть стакана, тлеющая лучинка ярко вспыхивает, доказывая наличие кислорода (рис. 102, в). В этом случае реакция протекает с большей скоростью. Следовательно, скорость химической реакции - это быстрота её протекания, т.е. быстрота превращения одних веществ - в другие. В этой реакции MnO2 является катализатором.
Записи в тетради: Катализаторы - это вещества, ускоряющие скорость химической реакции, но сами в реакцию не вступающие.
По окончании химической реакции разложения пероксида водорода ускоривший её протекание оксид марганца (IV) не изменился. Если вылить из химического стакана оставшийся в нём продукт реакции - воду, а затем вновь прилить в него свежую порцию пероксида водорода, то реакция будет протекать снова.
Аналогичный процесс происходит при обрабатывании ранки перекисью водорода. Бурное выделение кислорода катализируется содержащимся в крови биологическим катализатором - ферментом каталазой.
Записи в тетради: Ферменты - это катализаторы белковой природы.
Большинство химических процессов в живых организмах протекает с участием ферментов.
Ферменты входят в состав качественных стиральных порошков, и помогает отстирывать пятна крови, белков, чая и других загрязнителей. С помощью ферментов изготавливают сыры и лекарства.
Обратим внимание на признак реакции разложения пероксида водорода: в реакцию вступило одно сложное вещество, а образовалось два новых - простое и сложное.
Демонстрационный опыт. Рассмотрим ещё один опыт - разложение свежеполученного голубого студенистого осадка гидроксида меди (II) в пробирке при нагревании.
Записи в тетради:
Cu(OH)2 → CuO + H2O.
В этой реакции из одного сложного вещества образовалось два новых сложных вещества.
Демонстрационный опыт. В промышленности реакцией разложения минерала известняка получают негашёную известь (оксид кальция).
Записи в тетради:
CaCO3 → CaO + CO2↑.
Этот производственный процесс называют обжигом известняка. Его также применяют для производства углекислого газа, который имеет большое промышленное значение.
В результате разложения может образовываться и более двух веществ. Рассмотрим такую реакцию. Разложение перманганата калия при нагревании:
2KMnO4 → K2MnO4 + MnO2 + O2↑.
В данном случае в реакцию вступило одно сложное вещество, а образовалось одно простое и два новых сложных вещества.
Разложение дихромата калия при нагревании:
4K2Cr2O7 = 4K2CrO4 + 2Cr2O3 + 3O2↑.
В данном случае в реакцию вступило одно сложное вещество, а образовалось одно простое и два новых сложных вещества.
3) Закрепление пройденного материала.
Учитель: При разложении аммиака под действием температуры образуются свободные азот и кислород, напишите эту схему и расставьте коэффициенты.
Ученик: 2NH3 → N2 + 3H2.
Из одного сложного вещества образуется два простых.
Учитель: При разложении нитрата калия под действием температуры образуются нитрит калия и кислород, напишите эту схему и составьте химическое уравнение, т.е. расставьте коэффициенты.
Ученик: 2KNO3 → 2KNO2 + O2↑.
Из одного сложного вещества образуется одно сложное и одно простое вещества.
Учитель: При разложении гидроксида железа (III) под действием температуры образуются оксид железа (III) и вода, напишите эту схему и расставьте коэффициенты.
Ученик: 2Fe(OH)3 → Fe2O3 + 3H2O.
Из одного сложного вещества образуется два новых сложных вещества.
Учитель: При разложении азотной кислоты под действием света образуются оксид азота (IV), кислород и вода, напишите эту схему и расставьте коэффициенты.
Ученик: 4HNO3 → 2H2O + 4NO2 + O2↑.
Из одного сложного вещества образуется два новых сложных вещества и одно простое.
Учитель: При разложении нитрата серебра под действием температуры образуются оксид азота (IV), серебро и кислород, напишите эту схему и расставьте коэффициенты.
Ученик: 2AgNO3 → 2Ag + 2NO2↑ + O2↑.
Из одного сложного вещества образуется два простых и одно новое сложное вещества.
Резюме.
Итак, ребята, сегодня на уроке мы изучили трудную, сложную тему. Познакомились с химическими уравнениями и научились их составлять. Также разобрали ещё одну классификацию химических реакций. Изучили первый тип реакций - это реакции разложения, а так же познакомились с ними на практике, т.е. провели опыты. Начали формировать понятия о катализаторах и ферментах. Рассмотрели действие катализатора - оксида марганца (IV) на пероксид водорода.
III. Заключительный часть.
1) Подведение итогов
Учитель выставляет оценки за работу при повторении пройденного материала и за работу на уроке в целом.
2) Сообщение и комментирование домашнего задания.
Прочитайте § 30, упр. 1, 5, 6.
На этом урок окончен! Все свободны!
Записи в тетради.
Химическим уравнением называют условную запись химической реакции с помощью химических формул и индексов.
Правила составления химических уравнений:
-
В левой части уравнения пишутся формулы исходных веществ, а в правой - формулы продуктов реакции.
-
Число атомов каждого химического элемента в правой части уравнения должно равняться числу атомов этого же элемента в левой части.
-
Перед формулой простого вещества можно записывать дробный коэффициент, но затем все коэффициенты удваивают.
-
Если в схеме реакции есть формула соли, то вначале уравнивают число ионов, образующих соль.
-
Если участвующие в реакции вещества содержат водород и кислород, то атомы водорода уравниваются в предпоследнюю очередь, а атомы кислорода - в последнюю.
-
Если в схеме реакции имеется несколько формул солей, то необходимо начинать уравнивание с ионов, входящих в состав соли, содержащей большее их число.
С + О2 → СО2
2SO2 + O2 → 2SO3
Классификация реакций, в основу которой положен признак числа и состава исходных веществ и продуктов реакции.
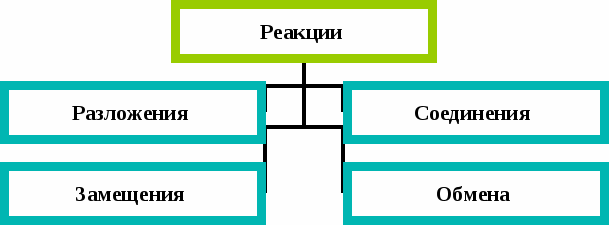
Реакции разложения - это реакции, в результате которых из одного сложного вещества получается несколько простых или новых сложных веществ.
2HgO → 2Hg + O2
2H2O → 2H2 + O2
2H2O2 → 2H2O + O2
Катализаторы - это вещества, ускоряющие скорость химической реакции, но сами в реакцию не вступающие.
Ферменты - это катализаторы белковой природы.
Большинство химических процессов в живых организмах протекает с участием ферментов.
Cu(OH)2 → CuO + H2O
CaCO3 → CaO + CO2
2KMnO4 → K2MnO4 + MnO2 + O2
2KMnO4 → K2MnO4 + MnO2 + O2↑.
2NH3 → N2 + 3H2
2KNO3 → 2KNO2 + O2
4HNO3 → 2H2O + 4NO2 + O2
2AgNO3 → 2Ag + 2NO2 + O2


