- Преподавателю
- Химия
- ОБОБЩЕНИЕ ПЕДАГОГИЧЕСКОГО ОПЫТА. Тема: Окислительно-восстановительные реакции 8 класс
ОБОБЩЕНИЕ ПЕДАГОГИЧЕСКОГО ОПЫТА. Тема: Окислительно-восстановительные реакции 8 класс
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Конспекты |
| Автор | Дзугкоева А.Г. |
| Дата | 12.12.2015 |
| Формат | docx |
| Изображения | Есть |
План- конспект открытого урока по химии в 8 классе по теме:
«Окислительно-восстановительные реакции»
Цели урока:
-
познакомить учащихся с новой классификацией химических реакций по признаку изменения степеней окислений элементов - окислительно-восстановительными реакциями;
-
охарактеризовать единство и непрерывность процессов окисления и восстановления;
-
систематизировать знания о типах химических реакций, о степени окисления химических элементов.
Задачи урока:
Образовательная - рассмотрение сущности окислительно-восстановительных процессов, научить применять «степени окисления» для определения процессов окисления и восстановления. Научить учащихся уравнивать записи окислительно-восстановительных реакций методом электронного баланса.
Развивающая - формирование учебно-познавательной компетенции (постановка цели урока, составление плана урока, подведение итогов урока); б) умения анализировать (использование теории ОВР для объяснения результатов выполняемых заданий); в) умения сравнивать, систематизировать, обобщать (сравнение состава веществ, степеней окисления, входящих в них элементов и некоторых свойств, систематизация веществ, реакций по определенным признакам, объяснение), г) прогнозировать (прогноз окислительно-восстановительных свойств веществ на основании степеней окисления элементов). Формирование информационной компетенции - поиск и отбор необходимой информации, ее сохранение и передача (работа с текстом заданий, с таблицами, устной информацией, сохранения информации в виде записей в тетрадях, использование информационных технологий). Развитие речи (обогащение и усложнение словарного запаса при использовании химических номенклатуры и понятий).
Воспитательная - развитие компетентности в общении, опыта и готовности взаимодействия с другими людьми, сотрудничество в группе. Воспитание культуры знаковой записи химических процессов (ведение записей на доске и в тетрадях).
. Тип урока: комбинированный (урок + презентация).
Методы обучения:
-
частично-поисковый - самостоятельная работа в группах, беседа с целью ответа на поставленные проблемные вопросы, фронтальный опрос. Урок включает в себя элементы ИКТ - презентация.
Контроль: оценочно-стимулирующий - тестирование.
Ход урока:
I. Организационный момент, актуализация знаний.
II. Проверка домашнего задания.
Даны вещества:
NaOH, MgCl2, K2CO3, AlCl3, H3PO4, K2SO4, HNO3, CuSO4, Zn(NO3)2.
В формулах этих веществ определите:
а) заряды ионов;
б) степени окисления всех химических элементов, входящих в состав.
Вещество
Заряд ионов
Степень окисления элементов
NaOH
Na + , OH -
+1 -2 +1
Na O H
MgCl2
Mg 2+, 2Cl-
+2 -1
Mg Cl2
K2CO3
2K +, CO32-
+1 +4 -2
K2 C O3
AlCl3
Al 3+, 3Cl-
3+ -1
Al Cl3
H3PO4
3H +, PO43-
+1 +5 -2
H3 P O4
K2SO4
2K +, SO42-
+1 +6 -2
K2 S O4
HNO3
H +, NO3-
+1 +5 -2
H N O3
CuSO4
Cu 2+, SO42-
+2 +6 -2
Cu S O4
Zn(NO3)2
Zn 2+ , 2NO3-
+2 +5 -2
Zn (N O3)2
III. Изучение нового материала. Целеполагание.
Рассмотрим ниже приведенные уравнения реакций.
AgNO3 + HCl = AgCl + HNO3
2HCl +Zn = ZnCl2 + H2↑
Проставить степени окисления над элементами, входящими в состав реагирующих и образующихся веществ.
Поставить перед обучающимися проблемный вопрос: « Чем отличаются эти реакции?»
1. Слайд 2. Понятие ОВР.
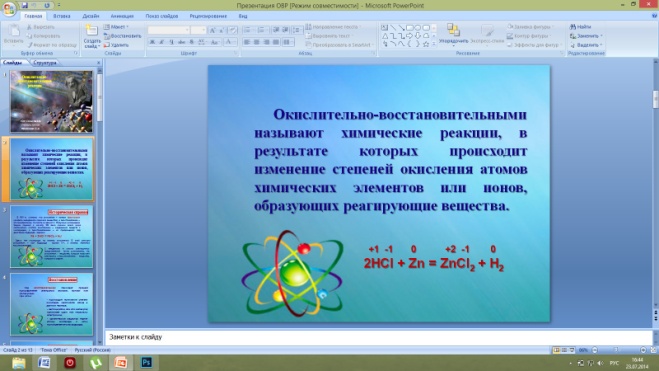
Многообразие классификаций химических реакций по различным признакам (направлению, числу и составу реагирующих и образующих веществ, использованию катализатора, тепловому эффекту) можно дополнить еще одним признаком. Этот признак - изменение степени окисления атомов химических элементов, образующих реагирующие вещества.
+1 +5 -2 +1 -1 +1 -1 +1 +5 -2
AgNO3 + HCl = AgCl + HNO3
В этой реакции степени окисления атомов химических элементов после реакции не изменились.
+1-1 0 +2 -1 0
2HCl +Zn = ZnCl2 + H2↑
А в этой реакции - взаимодействие соляной кислоты с цинком - атомы двух элементов, водорода и цинка, изменили свои степени окисления: водород с +1 на 0, а цинк - с 0 на +2. Следовательно, в этой реакции каждый атом водорода получил по одному электрону
+1 0
2H + 2ē → H2
А каждый атом цинка - отдал два электрона
0 +2
Zn - 2ē → Zn
Химические реакции, в результате которых происходит изменение степеней атомов химических элементов или ионов, образующих реагирующие вещества, называют окислительно-восстановительными реакциями.
2. Слайды 3-4. Историческая справка.

Издавна ученые полагали, что окисление - это потеря флогистона (особого невидимого горючего вещества), а восстановление - его приобретение. Но, после создания А.Лавуазье в 1777г. кислородной теории горения, к началу XIX века химики стали считать окислением взаимодействие веществ с кислородом, а восстановлением - их превращения под действием водорода. Тем не менее, в качестве окислителя могут выступать и другие элементы, например
Fe + 2HCl = FeCl2 + H2↑
- простейшая реакция железа с соляной кислотой, в ней нет кислорода, тем не менее железо окисляется. В этой реакции окислитель - ион водорода - протон H+, а железо выступает в роли восстановителя. В соответствии с электронно-ионной теорией окисления-восстановления, разработанной Л.В. Писаржевским в 1914 г., окисление - процесс отщепления электронов от атомов или ионов элемента, который окисляется; восстановлением называется процесс присоединения электронов к атомам или ионам элемента, каковой восстанавливается. Например, в реакции
0 0 +2 -1
Zn + Cl2 → ZnCl2
атом цинка теряет два электрона, то есть окисляется, а молекула хлора присоединяет их, то есть восстанавливается.
3. Слайды 5-7. Восстановление.
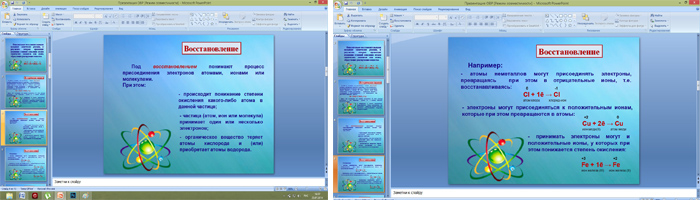
Под восстановлением понимают процесс присоединения электронов атомами, ионами или молекулами. Степень окисления при этом понижается.
Например, атомы неметаллов могут присоединять электроны, превращаясь при этом в отрицательные ионы, т.е. восстанавливаясь:
0 -1
Cl + 1ē → Cl
атом хлора хлорид-ион
Электроны могут присоединяться и к положительным ионам, которые при этом превращаются в атомы:
+2 0
Cu + 2ē → Cu
ион меди (II) атом меди
Принимать электроны могут и положительные ионы, у которых при этом степень окисления понижается:
+3 +2
Fe + 1ē → Fе
ион железа (IV) ион железа (II)
Атомы, ионы или молекулы, принимающие электроны, называют окислителями.
4. Слайды 8-11. Окисление. Единство двух процессов.
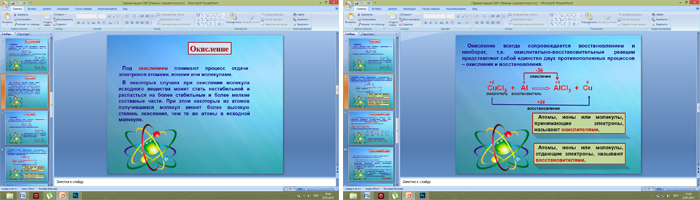
Под окислением понимают процесс отдачи электронов атомами, ионами и молекулами. Например, атомы металлов, теряя электроны, превращаются в положительные ионы, т.е. окисляются:
0 +1
Na - 1ē → Na
атом натрия ион натрия
Отдавать электроны могут отрицательные ионы:
-1 0
Cl - 1ē → Cl
хлорид ион атом хлора
Терять электроны могут и некоторые положительные ионы с низшими степенями окисления:
+1 +2
Cu - 1ē → Cu
ион меди (I) ион меди (II)
Можно отметить, что при этом степень окисления повышается.
Атомы, ионы или молекулы, отдающие электроны, называются восстановителями.
Окисление всегда сопровождается восстановлением и наоборот, т.е. окислительно-восстановительные реакции представляют собой единство двух противоположных процессов - окисления и восстановления.
5. Слайды 12-17. Электронный баланс.
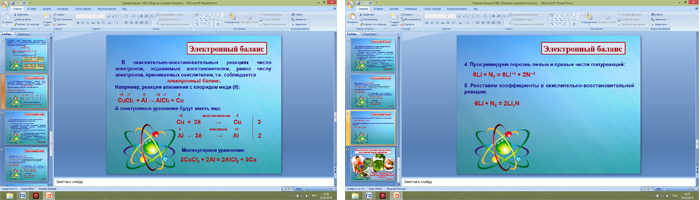
Суть метода электронного баланса заключается в следующем:
- подсчет изменения степени окисления для каждого из элементов, входящих в уравнение химической реакции;
- элементы, степень окисления которых в результате происшедшей реакции не изменяется - не принимаются во внимание;
- из остальных элементов, степень окисления которых изменилась - составляется баланс, заключающийся в подсчете количества приобретенных или потерянных электронов;
- для всех элементов, потерявших или получивших электроны (количество которых отличается для каждого элемента) находится наименьшее общее кратное;
- найденное значение и есть базовые коэффициенты для составления уравнения.
Визуально алгоритм решения задачи с помощью метода электронного баланса выглядит следующим образом:
подсчитать степень окисления каждого элемента → записать уравнение с указанием вычисленных степеней окисления → выделить элементы, степень окисления которых изменилась → составить электронный баланс → найти наименьшее общее кратное → вставить в уравнение найденные коэффициенты.
6. Слайд 19. Биологическое значение окислительно-восстановительных процессов.

Окислительно-восстановительные реакции являются самыми распространенными и играют большую роль в природе и технике. Они являются основой жизни на Земле. С ними связаны дыхание и обмен веществ в живых организмах, гниение и брожение, фотосинтез в зеленых частях растений и нервная деятельность человека и животных. Они лежат в основе металлургических процессов и круговорота элементов в природе. С их помощью получают аммиак, щелочи, азотную, соляную и серную кислоты и многие другие ценные продукты. Благодаря окислительно-восстановительным реакциям происходит превращение химической энергии в электрическую в гальванических и топливных элементах и аккумуляторах. Они широко используются в мероприятиях по охране природы.
IV. Закрепление материала.
Тест ( парная работа) со взаимопроверкой.
№
I вариант
II вариант
1
К окислительно-восстановительным реакциям не относится реакция, представленная схемой:
А) N2 + 3Н2 = 2NН3
Б) Mg + 2HCl = MgCl2 + H2↑
В) MgCO3 = MgO + CO2 ↑
Г) 2CuO = 2Cu + O2↑
К окислительно-восстановительным реакциям относится реакция, представленная схемой:
А) H2O + CaO = Ca(OH)2
Б) H2O + N2O5 = 2HNO3
В) Na2CO3 + 2HCl = 2NaCl + H2O + CO2
Г) CuO + H2 = Cu + H2O
2
В каком соединении степени окисления элементов равны -3 и +1
А) NF3 Б) Cl2O3
В) NH3 Г) AlCl3
В каком соединении степени окисления элементов равны +3 и -2
А) NF3 Б) Cl2O3
В) NH3 Г) AlCl3
3
Схема Na0 →Na+1 отражает процесс:
А) окисления
Б) восстановления
В) нейтрализации
Г) диссоциации
Схема Сl0 → Сl-1 отражает процесс:
А) окисления
Б) восстановления
В) нейтрализации
Г) диссоциации
4
Восстановительные свойства простых веществ, образованных элементами второго периода, с увеличением заряда ядра:
А) уменьшаются
Б) усиливаются
В) изменяются периодически
Г) не изменяются
Окислительные свойства простых веществ, образованных элементами седьмой группы, главной подгруппы с увеличением заряда ядра:
А) уменьшаются
Б) усиливаются
В) изменяются периодически
Г) не изменяются
V. Подведение итогов и рефлексия.
- на уроке я узнал…
- я научился …
- я понял …
VI. Домашнее задание: § 43 учебника, 1 уровень упр. 1,3,7; 2 уровень упр. 3,4,7,8.
VII. Выставление оценок. Взаимооценивание.
Литература:
О.С.Габриелян. Химия. 8 класс. М.Дрофа.2013.
О.С.Габриелян, И.П.Воскобойникова, А.В.Яшукова. Настольная книга учителя. Химия. 8 класс. М. Дрофа. 2012.
7


