- Преподавателю
- Химия
- Конспект урока по теме
Конспект урока по теме
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Мурзабаева Г.А. |
| Дата | 29.10.2014 |
| Формат | docx |
| Изображения | Есть |
| Урок № 19/1 | Дата:12.11.14 | Класс:8А,8Б,8В | Тип урока: формирование первичных знаний | |||||||||
| Мурзабаева Г.А. | Урок №1 Состав и строение атома. Классификация химических элементов. Изотопы. | |||||||||||
| Тема урока: | ||||||||||||
| Цель: | Подготовиться к изучению периодического закона и ПСХЭ в свете теории строения атома. | |||||||||||
| Ожидаемый результат: | Знать: строение атома, его состав; понятия -атом, ядро, протон, нейтрон,электрон,электронное облако;электронное строение,энергетическийуровень, «изотопы», «химический элемент». | |||||||||||
|
| Понимать: физический смысл периода, группы и порядкового номера. | |||||||||||
|
| Уметь:изучить, осмыслить и изложить группе рабочую информацию | |||||||||||
| Ключевые идеи: | Уметь извлекать релевантную информацию из текста, обсуждать, интерпретировать, уметь изложить, принять ответственность за свою работу. | |||||||||||
| Основные понятия: | Протон, нейтрон, ядро, атом;«изотопы», «химический элемент»;электрон, электронное строение; энергетический уровень, электронное облако;
| |||||||||||
| Исследование в действии | Способность учащихся 8-х классов усвоить большой объем информации, используя метод «Зигзаг», «инсерт», само и взаимооценивание.
| |||||||||||
| Рефлексия ИД | Учащийся А Обратить внимание на активность и умение организовать работу в группе | Учащийся В: Обратить внимание на активность учащихся на этапе создания проекта.
| УчащийсяС: Обратить внимание на выполнение работы на этапе взаимообучения. | |||||||||
| Этап урока | Модуль | Стратегии | Ресурсы | Время | Деятельность учителя | Деятельность учащихся | ||||||
| Стадия вызов и осмысления | Критическое мышление для чтения и письма | Метод «Зигзаг», «Инсерт» | Текст для 6 групп, | _____минут-чтение, (_____минут пересказ) (по _____ минуты на ученика) | Предлагает учащимся в домашних группах рассчитаться по порядку на (6). Затем учащиеся пересаживаются за стол соответствующий порядковому номеру. Организуется 6 рабочих групп с экспертами. Учитель раздает экспертам текст с номером участника: Текст №1 - участнику с номером №1 Предлагает ознакомиться с текстом по методу «Инсерт»
Пересказ прочитанного. Каждый при пересказе дополняет пропущенную информацию в рассказе предыдущего эксперта. Совместное составление плана изложения материала в домашних группах.
| Класс в домашних группах рассчитывается и все рассаживаются за столы: Первый стол учащиеся с порядковым номером-1 и т.д. Участники индивидуально знакомятся с текстом используя прием «Инсерт». ! -я это знал
| + Для меня это новое
| - Это противоречит тому, что я знал
| ? Я хочу знать об этом больше
| ||||||
По очереди каждый эксперт группы рассказывает, то, что он для себя понял. Все слушают внимательно не перебивая.
Совместно составляют план, по которому будут рассказывать свой материал в родной группе.
повторение и опрос изученного материала
КМ для чтения и письма
«Зигзаг», взаимообучение
План эксперта
(___ минут) по ___ минуты на участника
Эксперты с номерами:1,2,3,4,5,6 возвращаются в свои домашние группы и пересказывают изученный материал своей группе.
Каждый эксперт по своему плану, излагает изученную информацию, другие участники делают записи в тетради. И задают вопросы, только после окончания рассказа.
Стадия размышления
КМ для чтения и письма
«Зигзаг», создание
(кластера)
Готовый постер
или кластер группы
____ минут,
Предлагается создать общую картину изученного, в виде любого творческого продукта, на усмотрение детей.
Команды должны создать и защитить свой проект.
Оценивание
КМ
самооценивание,взаимооценивание,
выходные листы
______минут
В Защите проекта учитывается качество информации, эстетичность, оригинальность, умение защитить свой проект, участие всех участников.
При защите учащиеся оценивают проекты соседних команд по критериям:
Интересно:
Познавательно:
Оригинально:
Аккуратно:
Рефлексия
КМ
Выходные билеты
Карточки с вопросами
В конце урока
На ИАД (на слайде)
1.Что нового вы узнали сегодня на уроке:____________________________
2. Что оказалось наиболее сложным для понимания?_______________________
3. Какие трудности возникли у вас на уроке?____________________________
4.Ваш вклад на уроке в повышение качества знания вашего класса
________________________________
Записывают полные ответы на рефлексивные стикеры. С указанием класса, имени и фамилии.
Домашнее задание
§§53,54,55
Стр. 139-144
№ ____________________________
Инструкция к выполнению домашнего задания (на слайде)
Записывают в дневники, слушают инструкцию к выполнению домашнего задания.
Текст №1
Наиболее точную и полную модель строения атома предложил Эрнест Резерфорд, хотя понятие «атом» было известно еще в античном мире. Свою модель строения атома ученый назвал планетарной, потому что атом как крошечная Солнечная система, в центре которого ядро, а вокруг ядра вращаются электроны (слайд №1-2).
Оказывается, что само крошечное ядро состоит из элементарных частиц - протонов и нейтронов. Рассмотрим таблицу, в которой указан символ этой частицы, ее масса и заряд.
Из таблицы видно, что протон имеет заряд +1, масса протона равна 1, как и у водорода, поэтому он имеет символ р (пэ). Нейтроны тоже имеют массу равную 1, не имеют заряда, он равен 0 и обозначаются буквой n (эн). Электроны обозначаются буквой е, заряд их равен -1, т.к. масса их ничтожна мала, то ей можно пренебречь.
Сумма чисел протонов и нейтронов называется массовым числом и обозначается буквой (А), которая численно равна относительной атомной массе, округленной до целого значения. Для того чтобы определить число протонов и электронов, достаточно знать порядковый номер элемента. Давайте вспомним как. Например, у атома фосфора порядковый номер 15, значит у него 15 протонов в ядре, 15 электронов в атоме. А для нахождения числа нейтронов можно использовать формулу N = A - Z, т.к A = Z + N, где N - число нейтронов, а Z - число протонов. 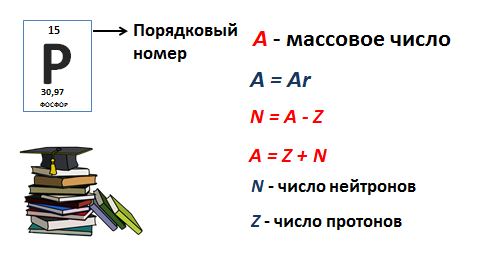
Текст №2
Несмотря на то, что атом очень малы, швейцарские ученые Биннинг и Рорер с помощью сканирующего микроскопа смогли увидеть реальные молекулы и атомы, в последствие им дали Нобелевскую премию за это достижение. Представьте, сканирующие микроскопы могут увеличивать объект в 100 млн. раз, т.е. позволяет увидеть частицы размером всего 10-9 м. Такие частицы называются наночастицами ( слайд -6).
Итак, мы с вами помним, что положение химического элемента зависит от заряда ядра атома, или от числа протонов. И, если изменить число протонов в ядре, то будет образовываться совсем другой химический элемент. Эти процессы называются ядерными.
Ядерные процессы протекают с выделением большого количества энергии, как, например, на Солнце, когда ядра атомов водорода соединяются и образуют ядра атомов гелия. Но если не изменять число протонов, т.е. заряд ядра, а только число нейтронов, то другого химического элемента не образуется, образуется тот же элемент, но с другой массой. Эти разновидности элементов с разной массой называют изотопами.
Текст №3Запомните, что изотопы - разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд ядра, но разное массовое число. Слово изотоп состоит из двух греческих слов: изос - «одинаковый» и топос - «место».
Химические элементы, встречающиеся в природе, являются смесью изотопов. Например, у водорода есть три изотопа, каждый из которых отличается не только массовым числом, но и имеет свое название. Давайте их рассмотрим (слайд-11). Первый изотоп - это протий, с массовым числом равным единице, второй изотоп - это дейтерий, у которое массовое число равно двум, третий называется тритием и массовое число его равно трем. Но число протонов, как вы могли заметить одинаково, т.е. в ядре каждого из них содержится один протон.
Теперь, давайте выясним, на основании полученных знаний, почему же относительная атомная масса имеет дробное значение? Мы с вами уже знаем, что в природе один и тот же химический элемент представляет собой смесь изотопов, тогда относительная атомная масса является средним значением атомных масс природной смеси изотопов данного химического элемента с учетом содержания их в природе. Разберем это на примере. Атомы хлора состоят из смеси двух изотопов с массовым числом 35, их в природе 75% и с массовым числом 37, которых в природе встречается 25%. Следовательно, относительная атомная масса хлора вычисляется таким образом: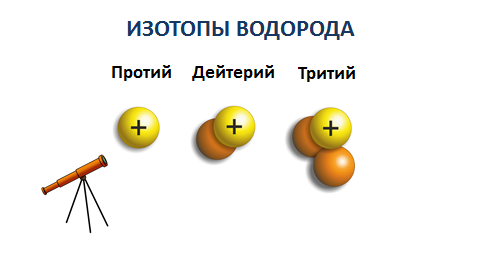
Ar(Cl) = 35 ∙ 0,75 + 37 ∙ 0,25 = 35,5
На основании знаний о строении атома, существования изотопов, мы можем дать более точное определение химического элемента - это совокупность атомов с одинаковым зарядом ядра.
Текст №4
Прежде, чем мы узнаем, что такое электронная оболочка атома, давайте вспомним, из чего состоит атом. Помните планетарную модель строения атома, согласно которой, в центре атома расположено положительно заряженное ядро, вокруг которого вращаются отрицательно заряженные электроны, подобно тому, как вращаются планеты вокруг Солнца.
Электроны, двигаясь вокруг ядра, в совокупности образуют электронную оболочку атома. Сколько электронов в атоме, столько их и образует электронную оболочку. Вы помните, что число электронов в атоме равно числу протонов в ядре и соответствует порядковому номеру элемента. 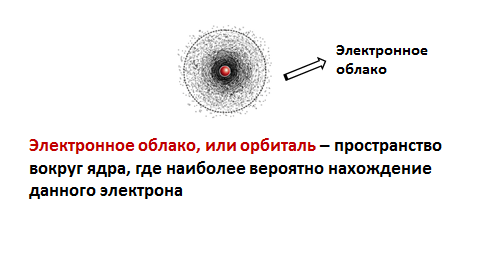
Запомните, что электроны двигаются в определенном порядке и различаются своей энергией. Электроны с маленьким запасом энергии расположены ближе к ядру, они связаны крепко с ядром и их тяжелее вырвать из электронной оболочки. А вот электроны с большим запасом энергии, напротив, находятся дальше от ядра, слабо с ним связаны, поэтому их легче оторвать.
Не смотря на это, в …
Текст №5
Не смотря на это, в …
атоме находятся электроны, которые имеют близкие значения энергии. Эти электроны образуют электронные слои или еще их называют энергетические уровни. 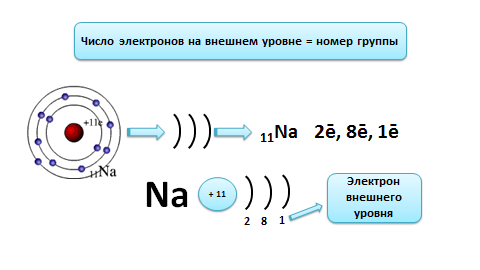
Чтобы определить число энергетических уровней, достаточно знать номер периода, в котором находится данный элемент. Например, у азота семь электронов в атоме, и два энергетических уровня. Теперь распределим эти семь электронов по уровням. Получается на первом их 2, а на втором - оставшиеся 5.
Максимальное число электронов на энергетическом уровне определяется по формуле: 2n2, где n - номер периода. Если подставить значения первых трех периодов, то у нас получится, что максимально на первом энергетическом уровне возможно только 2 электрона, на втором - 8, на третьем - 18.
Нужно запомнить, что число электронов на внешнем энергетическом уровне для элементов главных подгрупп равно номеру группы.
Попробуем разобраться со всем этим на примере атома натрия.
Ядро атома натрия имеет заряд +11, т.е. и электронов в атоме тоже 11. Натрий находится в третьем периоде, значит, у него три энергетических уровня, которые мы будем изображать в виде скобки ). Это записывают с помощью электронной формулы следующим образом: 11Na 2ē, 8ē, 1ē. И так, мы видим, на первом уровне 2 электрона (это максимально), на втором - 8 (больше быть не может), а на третий остается один электрон. Вот этот электрон и будет электроном внешнего энергетического уровня. Натрий - элемент главной подгруппы I группы, поэтому число электронов на внешнем уровне равно номеру группы, т.е. единице.
Текст №6
Двигаясь, электроны образуют своеобразный рисунок, так называемое электронное облако, которое можно еще назвать орбиталью. Запомните, что электронное облако, или орбиталь - пространство вокруг ядра, где наиболее вероятно нахождение данного электрона. 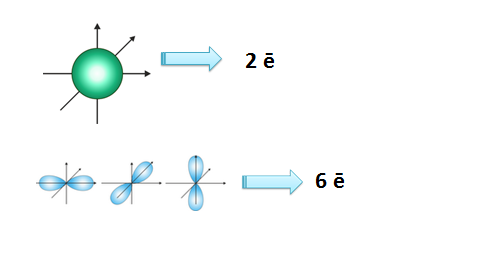
На всех энергетических уровнях есть s-орбитали, они сферической формы и она только одна, на втором уровне уже появляются p-орбитали, которые имеют форму гантели, их всего три. На каждой орбитали максимально может находится не более двух электронов, следовательно на s-орбитали - их два, на р-орбитали - шесть (см. рис. 39). 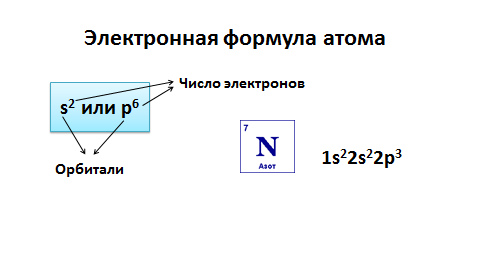
Для того чтобы записать электронную формулу атома, для обозначения уровня используют арабские цифры, орбитали соответственно буквами s и р, а число электронов данной орбитали - арабской цифрой сверху справа над буквой орбитали.


