- Преподавателю
- Химия
- «Простые вещества – металлы»
«Простые вещества – металлы»
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Конспекты |
| Автор | Микерина (.Т. |
| Дата | 07.01.2016 |
| Формат | doc |
| Изображения | Есть |
Конспект урока
по химии
в 8 классе
на тему
«Простые вещества - металлы»
Тема: Простые вещества - металлы
Цели:
Образовательные:
1. Расширение и углубление знаний учащихся об особенностях строения атомов металлов, расположения металлов в Периодической системе химических элементов Д.И. Менделеева, строения кристаллической металлической решетки и металлической химической связи.
2. Познакомить с общими физическими свойствами металлов.
3. Научить характеризовать и объяснять свойства веществ на основании вида химической связи и типа кристаллической решетки.
Развивающие:
1. Развитие общеучебных умений и навыков (умение сравнивать, обобщать и делать выводы).
2. Развитие познавательной активности, познавательных и интеллектуальных способностей учащихся, умений самостоятельно приобретать знания.
3. Формирование научной картины мира.
Воспитательные:
1. Способствовать развитию интереса к предмету.
2. Воспитание трудолюбия, внимательности.
Оборудование: компьютер, проектор.
Методы работы: рассказ, беседа, структуры сингапурских методов обучения.
Ход урока:
I. Организационный момент.
Приветствие, подготовка учащихся к уроку. Парты расставлены по парам, ученики сидят по 4 человека за столом. Столы пронумерованы.
II. Актуализация знаний.
-
Сообщение темы и целей урока
Слайд № 1
В Древнем Египте считали все, что металлов - всего 7!
Семь металлов создал свет по числу семи планет
Медь, железо, серебро… дал нам космос на добро.
Злато, олово, свинец… всем им Ртуть - родной отец.
Слайд №2
-
Ребята, вы прослушали стихотворение, в котором говорится о теме сегодняшнего урока. Сформулируйте тему урока.
Ответ: Металлы
Слайд №3
-
Правильно, на сегодняшнем уроке мы с вами будем говорить о металлах. Запишите в тетрадях тему урока «Простые вещества - металлы».
2. Актуализация ранее изученных знаний
-
Обратите внимание на тему урока. Понятия «простые вещества» и «металлы» нам уже знакомы. Давайте вспомним, какие вещества называются простыми?
Ответ: Вещества, состоящие из атомов одного вида, называются простыми веществами.
-
А что вы уже знаете о металлах?
Ответ: Строение металлов, расположение в Периодической системе элементов металлов, металлическую химическую связь.
- Заполните колонку «ДО» в таблице, которая перед вами (Сингапурская структура «Эй-ар-гайд»). (Отводится 2 минуты) (Приложение 1)
-
Теперь, положите листочки на край стола, вернемся к этому заданию в конце урока.
-
Вспомним расположение металлов в ПСХЭ.
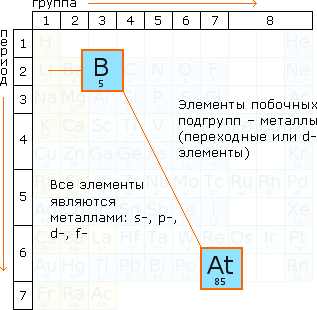
Если провести диагональ от элемента бора В (порядковый номер 5) до элемента астата At (порядковый номер 85), то слева внизу под этой диагональю в Периодической системе все элементы являются металлами, кроме этого металлами являются все элементы побочных подгрупп. Справа вверху над диагональю находятся элементы неметаллы (исключая металлы побочных подгрупп).
-
Каких элементов в Периодической таблице Д.И. Менделеева больше?
Ответ: В Периодической таблице Д.И.Менделеева больше металлов.
-
Зарисуйте в тетради схему с доски. (Приложение 2)
-
Из 110 элементов Таблицы Д.И.Менделеева 88 металлы и лишь 22 неметаллы.
Слева направо по периоду металлические свойства и Rатома уменьшаются.
Сверху вниз по группе металлические свойства химических элементов и Rатома увеличиваются.
- Сколько всего электронов у металлов на внешнем энергетическом уровне?
Ответ: От 1 до 3 электронов на внешнем энергетическом уровне.
- Зная, что металлы имеют сравнительно большие радиусы атомов и небольшое количество электронов на внешнем энергетическом уровне, ответьте, к чему стремятся атомы металлов?
Ответ: Атомы металлов стремятся к отдать электроны с внешнего энергетического уровня.
- Во что превратятся атомы металлов, отдавшие электроны?
Ответ: Атомы металлов превращаются в положительно заряженные ионы.
Слайд №4
- Простые вещества, которые образуют элементы - металлы, при обычных условиях, являются твердыми кристаллическими веществами, кроме ртути, свинца.
Вспомним строение кристаллической решетки металлов.
Ответ: В узлах металлической кристаллической решетки находятся положительные ионы и атомы металлов (атом-ионы), а между ними - свободные электроны. Эти электроны свободно перемещаться. Свободные электроны имеют отрицательный заряд и притягивают положительно заряженные ионы металлов. Поэтому кристаллическая решетка металлов является устойчивой.
- Правильно, в металле постоянно существуют атомы, ионы и свободные электроны. Составьте на доске схемы металлической химической связи для Na, Mg , Al.
Вызываются по очереди ученики к доске, а все остальные выполняют в тетрадях.
Ответы:
L
 i0 -1 ē Li1+
i0 -1 ē Li1+

 Ca 0 -2 ē Ca 2+
Ca 0 -2 ē Ca 2+

 Al 0 -3 ē Al 3+
Al 0 -3 ē Al 3+
-
Проверьте свои записи.
-
Вспомните, как называется связь между положительными ионами металлов и свободными электронами в кристаллической решетке металлов?
Ответ: Металлическая связь.
-
Свободные электроны внутри металлической кристаллической решетки могут переносить теплоту и электричество, отражать световые волны, поэтому они являются причиной главных физических свойств металлов - высокой электро- и теплопроводности.
Слайд №5
III. Изучение нового материала.
Начинаем изучать «Физические свойства металлов».
- Сейчас мы будем изучать физические свойства металлов, которые вы должны перечислить в тетради. При этом запишем сведения с экрана.
1. Твердость - все металлы при обычных условиях твердые вещества, кроме ртути. (Просмотр видео «Ртуть»)
По твердости металлы делятся на мягкие и твердые. Самый твердый из металлов - хром, который может царапать стекло. Самые мягкие - щелочные металлы и свинец (Демонстрация видео «Щелочные металлы - Литий, натрий, калий»). Щелочные металлы хранят в особых условиях: литий в вазелине из-за своей низкой плотности, натрий в керосине, керосин в стеленной баночке, баночка в асбестовой крошке, асбест в жестяной баночке, жестяная баночка в сейфе.
Слайд №6
2. Пластичность, ковкость - это свойство металлов изменять свою форму при ударе. Прокатываться в тонкие листы и вытягиваться в проволоку. Механическое воздействие на кристалл с металлической решеткой вызывает только смещение слоев атомов и не сопровождается разрывом связи и поэтому металл характеризуется высокой пластичностью.
Самым пластичным из драгоценных металлов является золото. Один его грамм можно вытянуть в проволоку длиной 2км. Демонстрация учащимся алюминиевую фольгу.
Слайд №7
3. Металлический блеск - все металлы обладают металлическим блеском. Электроны, заполняющие межатомное пространство отражают световые лучи, а не пропускают как стекло. Самые блестящие металлы - это ртуть и серебро. Из ртути изготавливали в средние века знаменитые «венецианские зеркала», современные зеркала изготавливают из серебра.
Слайд №8
4. Металлы звенят - это свойство используется для изготовления колоколов, музыкальных инструментов и т.д. самые звонкие металлы - это золото, серебро и медь.
Демонстрация звона золотого обручального кольца, подвешенного на женском волосе. При ударе по нему деревянной палочкой (карандашом) слышен очень долгий высокий и чистый звук.
Слайд №9
5. Тепло- и электропроводность - металлы, характеризующиеся высокой электрической проводимостью, обладают и высокой теплопроводностью. Лучшие проводники серебро, медь, золото, железо, алюминий.
-
Если самый лучший проводник - серебро, то почему электрические провода из него не делают?
Ответ: Высокая стоимость этого металла.
Худшей тепло-, электропроводностью обладают ртуть, свинец вольфрам.
Слайд №10
6. Температура плавления металлов изменяется в широких пределах. Самый легкоплавкий металл - ртуть (t0пл. = -38.90С), самый тугоплавкий - Вольфрам (t0пл. = 33800С).
Слайд №11
7. Плотность металлов тоже изменяется в широких пределах. Металл с наименьшей плотностью - литий 0,53*103 кг/м3. Металл с наибольшей плотностью осмий 22,48*103 кг/м3.
Слайд №12
8. Аллотропия - способность атомов одного ХЭ образовывать несколько простых веществ - модификации.
Рассказ учителя про аллотропные модификации олова.
IV. Физминутка
Слайд№ 13-24
-
А теперь немножко отдохнем. Внимательно смотрите на экран, на нем будут появляться названия химических элементов. Если на экране - металл, вы должны встать, если нет - продолжаем сидеть (Сингапурская структура «Тейк оф тач даун»). Внимание на экран!
А теперь вернемся снова к таблицам, которые мы заполняли в начале урока. Только теперь заполните колонку «После». (Дается время - 2мин)
-
Изменилось ли ваше мнение?
Ответ:
-
Зачитайте мне ваши результаты, стол №…. участник №… (так учитель спрашивает у нескольких учеников)
-
В конце проверим, что вы усвоили на сегодняшнем уроке. Для этого возьмите лист А4, которые у вас на столах. Сложите в 4, потом сложите уголок и раскройте лист. (Сингапурская структура «Модель Фрейера») (Приложение 3)
(Дается 10 минут)
Теперь за каждым столом по очереди зачитайте ваши ответы («Сингл раунд робин»). (На каждого ученика по 30 секунд)
-
Стол №… , участник №…, зачитайте ваши ответы (спрашивается у нескольких учеников)
VIII. Домашнее задание:
Слайд №25
- Параграф 13 прочитать, стр. 69-72., упр.1-3 стр.72 (устно).
Приложение 1
Эй-ар-гайд
ДО
Утверждения
ПОСЛЕ
Все металлы по агрегатному состоянию твердые
Все металлы тугоплавкие
Металлы хорошо проводят электрический ток
Все металлы имеют высокую плотность
Металлы имеют блеск
В ПСХЭ металлов больше, чем неметаллов
Приложение 2
Приложение 3
М
 одель Фрейера
одель Фрейера
Обязательные характеристики
Необязательные характеристики
Металлы


Примеры
Противоположные примеры


