- Преподавателю
- Химия
- Урок по химии Состав и строение кислот. Классификация и химические свойства
Урок по химии Состав и строение кислот. Классификация и химические свойства
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Кульниязова Г.З. |
| Дата | 22.11.2015 |
| Формат | docx |
| Изображения | Есть |
Депобразования и молодежи Югры
бюджетное учреждение среднего профессионального образования
Ханты-Мансийского автономного округа - Югры
«Мегионский политехнический колледж»
открытый урок по химии
Состав и строение кислот.
Классификация и химические свойства.
разработала преподаватель химии - Г. З Кульниязова
Мегион - 2015
тема урока: Состав и строение кислот. Классификация и химические свойства.
тип урока: урок изучения нового материала.
метод урока: частично- поисковый
цели урока: 1 Довести до осознания и осмысления понятие «кислота», «кислородсодержащие и бескислородные кислоты», химические свойства кислот,
2 развить умение экспериментально определять кислоты среди других веществ, научиться называть кислоты, продолжить формирование умений работать с веществами, соблюдая правила безопасности.
3 Воспитание интереса к предмету.
Оборудование и реактивы: пробирки с растворами соляной и лимонной кислот, таблетки аскорбиновой кислоты, индикаторы (лакмусовая бумажка, раствор фенолфталеина, метилоранжа), стеклянная палочка
Ход урока
Орг. момент.
Мотивация- Почему у некоторых фруктов кислый вкус?
- Действительно, овощи и фрукты содержат органические кислоты: лимонную, яблочную, аскорбиновую, ацетилсолециловую. Они играют определённую роль в пищеварении, а, следовательно, в нашей жизни.
- Мы сегодня поговорим о неорганических кислотах, которые очень важны для человека, т.к. он использует их в своей практической деятельности.
- А, что такое кислота, и какие бывают кислоты мы узнаем, изучив тему сегодняшнего урока.
I. Актуализация и повторение знаний
1. Вспомните как классифицируют неорганические соединения?
2. Назовите какие из них мы с вами уже изучили.
3. Перечислите известные вам кислоты.
4. Перечислите правила техники безопасности при работе с кислотами.
5. Даны кислотные остатки: F¯ ; ClO4¯ ; SiO3²¯.
Составьте формулы возможных кислот, назовите их и дайте им характеристику, используя признаки классификации.
II. Первичное усвоение
Кислоты - сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков. Общая формула кислот HxR. Кислотный остаток может быть как простой (Cl, S, Br )так и сложный (SO4, CO3, PO4 )
Работа в парах с взаимопроверкой.
- Даны формулы кислот: H2SO4, H2CO3, H3PO4, HCl, ответьте на вопросы
- Какие признаки можно взять за основу деления кислот?
- Чем отличаются данные кислоты по составу друг от друга.
Делаем вывод о классификации кислот (кислородосодержащие и безкислородные)
Изучим действие кислот на индикаторы:
Лабораторный опыт.
Форма работы: парная..
ИНСТРУКТИВНАЯ КАРТА:
Задание:
Исследовать окраску индикаторов в кислотных средах.
Оборудование и реактивы:
2 пробирки с соляной и 2 пробирки с лимонной кислотами, лакмусовая бумажка, жидкие фенолфталеин и метилоранж, стеклянные палочки.
Проведение опыта и оформление результатов:
1). Перепишите в тетрадь таблицу, представленную в конце опыта.
2). Смочите соляной кислотой (HCl) из 1-ой пробирки лакмусовую бумажку. Результаты наблюдений (изменение окраски бумажки) запишите в таблицу.
Затем в эту же пробирку с кислотой добавьте каплю фенолфталеина. Перемешайте стеклянной палочкой.
Результаты наблюдений запишите в таблицу.
Во 2-ую пробирку с соляной кислотой добавьте каплю метилоранжа. Перемешайте стеклянной палочкой.
Результаты наблюдений запишите в таблицу.
3). Повторите опыты, описанные выше в пункте 2), используя две другие пробирки с лимонной кислотой.
Не забывайте результаты наблюдений фиксировать в таблице!
ДЕЙСТВИЕ КИСЛОТ НА ИНДИКАТОРЫ
Индикатор
Окраска индикатора в воде
Окраска индикатора в растворе соляной кислоты (HCl)
Окраска индикатора в лимонной кислоте
Лакмусовая бумажка
Желтая
Фенолфталеин
Бесцветная
Метилоранж
Оранжевая
Химические свойства На доске прикрепляю карточки (зачитываю химические свойства)
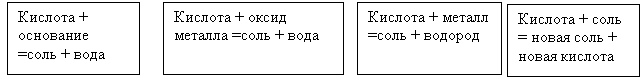
Задание: провести лабораторные опыты (по группам)
Первая группа выполняет лабораторный опыт "Взаимодействие кислот с щелочами (основаниями)"
Лабораторный опыт "Взаимодействие кислот с щелочами (основаниями)"
Порядок выполнения работы:
-
В пробирку налейте 2 мл раствора гидроксида натрия и прибавьте 1-2 капли фенолфталеина. Что вы наблюдаете?
-
К раствору щелочи с фенолфталеином приливайте по каплям соляную кислоту, периодически взбалтывая содержимое пробирки. Что вы наблюдаете?
-
Составьте молекулярное и ионные уравнения проделанной реакции.
Вторая группа - лабораторный опыт " Взаимодействие кислот с солями".
Лабораторный опыт "Взаимодействие кислот с солями"
Порядок выполнения работы:
-
В пробирку налейте 2 мл серной кислоты и прибавьте несколько капель хлорида бария. Что вы наблюдаете?
-
Напишите молекулярное и ионные уравнения проделанной реакции
Третья группа - лабораторный опыт "Взаимодействие кислот с металлами".
Лабораторный опыт "Взаимодействие кислот с металлами"
Порядок выполнения работы:
-
В пробирку положите 2 гранулы цинка и прилейте соляную кислоту, закройте пробирку пробкой. Подождите некоторое время, чтобы она заполнилась водородом, затем откройте пробку и поднесите зажженную спичку к отверстию.
-
Что вы наблюдаете?
-
Напишите молекулярное уравнение проделанной реакции.
Четвертая группа - лабораторный опыт "Взаимодействие кислот с основными оксидами".
Лабораторный опыт "Взаимодействие кислот с основными оксидами"
Порядок выполнения работы:
1. В пробирку насыпьте немного оксида меди (СиО) и прилейте раствор серной кислоты. Подогрейте смесь. Что вы наблюдаете?
2. Напишите молекулярное уравнение проделанной реакции.
После выполнения работы 4 учащихся от каждой группы выходят к доске и пишут уравнения реакции под соответствующими карточками. В это время 4 других учащихся представляют отчет о проделанной работе.
Затем зачитываю применение кислот в быту. Уксусная и лимонная кислота применяется для удаления пятен от ржавчины на хлопчатобумажных, льняных и шерстяных белых тканях. 1 чайная ложка на 1 стакан воды, подогреть до кипения и ткань с пятном несколько раз окунуть в раствор или пятно протереть раствором, а затем кислоту тщательно смыть водой, лучше с добавлением несколько капель нашатырного спирта - для нейтрализации кислоты.
III. Осознание и осмысление
1. Составьте уравнения химических реакций, проделанных вами опытов. (по группам)
2. Задание: составьте возможные уравнения реакций взаимодействия перечисленных веществ с раствором серной кислоты. Из букв, соответствующих правильным ответам, вы составите название одного из элементов четвертого периода таблицы Д.И. Менделеева.
1) SiО2
А
3) Ва NО3
А
5) К2О
Л
7) Н NО3
О
2) LiОН
К
4) НСI
С
6) К2 SiО3
И
8) Fе(ОН)3
Й
Итог урока.
Домашнее задание: П 13 , выполнить задания 1, 2, 3, с 82-83


