- Преподавателю
- Химия
- Открытый урок Угольная кислота и свойства карбонатов
Открытый урок Угольная кислота и свойства карбонатов
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Рахимова М.Д. |
| Дата | 25.01.2015 |
| Формат | doc |
| Изображения | Есть |
Тема: Угольная кислота и свойства карбонатов.
Цель и
задачи урока: Обучающая:
1.Ознакомить учащихся со свойствами угольной кислоты, важнейших карбонатов и их значение для народного хозяйства.
Воспитательная:
2.Профессиональное обучение и воспитание на основе применения карбонатов и гидрокарбонатов.
Развивающая:
3.Развивать мыслительную деятельность, умения и навыки при выполнении лабораторной работы.
Тип урока: Нестандартный.
Технология
преподавания: Беседа, использование информационной технологии для преподавания химии при помощи проектора с дисков «Базовый курс химии», «Общая и неорганическая химия», лабораторная работа, работа с учебником.
Форма обучения: групповая работа, индивидуальная работа.
Оборудование: компьютер, проектор, экран, учебник, пробирки, карбонат Ca, карбонат Na, известковая вода, соляная кислота, сода, питьевая сода.
Ход урока:
I.Подготовительный, организационный момент. (3 мин)
Учащиеся делятся на группы. Объявляется тема, цель, этапы урока и ожидаемый результат.
II. Опрос. (5 мин)
(выявить степень подготовленности и проверить знания учащихся)
Проводится «гимнастика ума» по пройденным темам «Неметаллы».
-
Сколько химических элементов считается неметаллами? (22)
-
Где в периодической системе расположены типичные неметаллы? (в правом верхнем углу таблицы)
-
От чего зависят химические свойства простых неметаллических веществ? (от строения молекул)
-
В какой группе расположены «галогены»? (VII, главной подгруппы)
-
Самый распространенный элемент во Вселенной? (водород)
-
Какой газ желто-зеленого цвета? (хлор)
-
Для определения какого вещества в качестве реактива используется крахмал?( йод)
-
Газ, составляющий 78 % (по объёму) воздуха… (азот)
-
Простое вещество, применяется в производстве спичек … (фосфор)
-
Элемент, который считают «царем» живой природы? (углерод)
III. Закрепление и обобщение знаний по неметаллам.
Просмотр видеоматериала по «Неметаллам» с диска «Базовый курс химии», с использованием компьютера, проектора и экрана по разделам:
-
Неметаллы. Общая характеристика.
-
Галогены, строение атомов.
-
Подгруппа кислорода, строение атомов.
-
Подгруппа азота, строение атомов
-
Подгруппа углерода, строение атомов
В ходе просмотра учитель разъясняет степени окисления элементов и их свойства.
IV. «Осмысление».
(учащиеся сравнивают собственные знания по усвоенному материалы с теми понятиями, которые будут ими услышаны)
Беседа:
-
В каком состоянии углерод встречается в природе? Что такое аллотропия?
-
Какие свойства алмаза, графита, фуллерена и карбина вы знаете?
-
Важнейшие соединения углерода.
Просмотр видеоматериала по «Неметаллам» с диска «Базовый курс химии», с использованием компьютера, проектора и экрана по разделу:
-
Свойства оксидов.
Учащиеся делают выводы и собирают информацию.
На доске заполняется таблица Т-схема «Сравнительная характеристика свойств оксидов углерода.
СО
СО2
Угарный газ - без цвета, без запаха, ядовит, мало растворим в воде, легче воздуха, индифферентный оксид хороший восстановитель.
Углекислый газ - без цвета, без запаха, тяжелее воздуха, 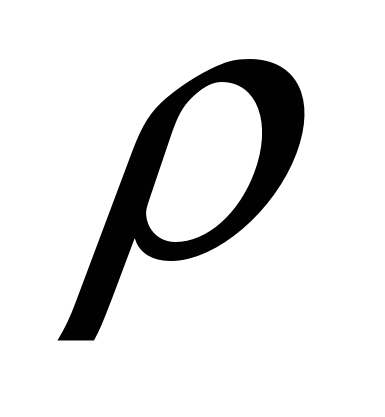 = 1,52 кг/см3, «сухой лёд», хорошо растворим в воде, кислотный оксид, не поддерживает горение.
= 1,52 кг/см3, «сухой лёд», хорошо растворим в воде, кислотный оксид, не поддерживает горение.
Переходим к изучению новой темы.
V. «Осмысление» новой темы.
Просмотр видеоматериала с диска «Общая и неорганическая химия», с использованием компьютера, проектора и экрана по теме «Угольная кислота и её соли».
Учитель в ходе просмотра темы «Угольная кислота и её соли» указывает на её особенности и свойства:
а) СО2+Н2О → Н2СО3 → Н+ + НСО32- + СО32-


карбонаты Na2CO3, K2CO3, CaCO3
 б) Н2СО3
б) Н2СО3
 гидрокарбонаты NaНCO3, Mg(HCO3)2, Ca(HCO3)2
гидрокарбонаты NaНCO3, Mg(HCO3)2, Ca(HCO3)2
в) Области применения:
-
Na2CO3▪ 10 Н2О - сода (стиральная)
-
NaНCO3 - питьевая сода
-
CaCO3 - известняк, мел, мрамор
-
K2CO3 - поташ (древесная зола)
VI. «Размышление» (рефлексия)
Перестройка ранее сложившихся понятий с включением новой информации.
Выполнение лабораторной работы.
-
Знакомство со свойствами карбонатов и гидрокарбонатов.
Просмотр видеоматериала с диска «Общая и неорганическая химия», с использованием компьютера, проектора и экрана по теме: «Свойства карбонатов и гидрокарбонатов».
Ученики записывают в тетради:
-
Взаимодействие известковой воды с углекислым газом
Са(ОН)2+ СО2→ CaCO3↓+Н2О
Помутнение раствора с образованием осадка CaCO3↓
-
При дальнейшем пропускание углекислого газа осадок растворяется
CaCO3+ СО2+Н2О→ Ca(HCO3)2
-
При нагревании (≈70ºС) раствора снова выпадает осадок
tº
Ca(HCO3)2→ CaCO3+ СО2+Н2О
-
Качественная реакция на карбонат ион.
Проведение опыта.
-
В одну пробирку положили кусочек мела и прильем соляную кислоту, выделяется газ
-
В другую пробирку раствор карбонат натрия и прильем соляную кислоту, также выделяется газ СО2. Горящая лучинка потухает, а известковая вода мутнеет.
Вывод: на основании этих опытов доказываем наличие карбонат ионов.
VII. Подведение итогов урока.
Результаты и вопросы:
-
Что нового для себя вы узнали?
-
Что было для вас интересного.
Выставление оценок за урок.
VIII. Домашнее задание.
-
Прочесть § 12, ответить на вопросы на стр. 38
-
Подготовиться к практической работе.


