- Преподавателю
- Химия
- Методические рекомендации по выполнению практических работ по неорганической химии
Методические рекомендации по выполнению практических работ по неорганической химии
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Бойко Ж.Б. |
| Дата | 02.01.2015 |
| Формат | docx |
| Изображения | Есть |
ДЕПАРТАМЕНТ ОБРАЗОВАНИЯ И НАУКИ КЕМЕРОВСКОЙ ОБЛАСТИ
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
СРЕДНЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«БЕЛОВСКИЙ ТЕХНИКУМ ЖЕЛЕЗНОДОРОЖНОГО ТРАНСПОРТА»
Методические указания
по выполнению практических работ
Учебная дисциплина
Химия
Составлены в соответствии с требованиями Государственного стандарта и уровня подготовки обучающихся по профессии:
23.01.09 Машинист локомотива
23.01.10 Слесарь по обслуживанию и ремонту подвижного состава
11.01.05 Электромонтер оборудования электросвязи и проводного вещания
13.01.10 Электромонтер по ремонту и обслуживанию электрооборудования (по отраслям)
15.01.05 Сварщик (электросварочные и газосварочные работы)
23.01.14 Электромонтер устройств сигнализации, централизации, блокировки (СЦБ)
Белово
2014
СОГЛАСОВАНО: УТВЕРЖДЕНО:
Методическая комиссия ООД Зам.директора по УР
Протокол №___ от «__»_______2014 г «___»_______2014 г
Председатель _________________ _______________________
Составил:
Преподаватель химии ГБОУ СПО «БТЖТ» Бойко Жанна Борисовна
Содержание
ВВЕДЕНИЕ
ОБЩИЕ МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ И УКАЗАНИЯ ПО ВЫПОЛНЕНИЮ ПРАКТИЧЕСКИХ И ЛАБОРАТОРНЫХ РАБОТ
ПЕРЕЧЕНЬ ЛАБОРАТОРНЫХ И ПРАКТИЧЕСКИХ РАБОТ
ОПИСАНИЕ ЛАБОРАТОРНЫХ И ПРАКТИЧЕСКИХ РАБОТ
ВВЕДЕНИЕ
Дисциплина ОДБ. 6 «Химия» является общеобразовательной дисциплиной , в процессе изучения которой обучающиеся должны приобрести знания в о свойствах веществ, их превращениях, способах получения и областях применения.
Наряду с изучением теоретического материала по дисциплине «Химия» большое внимание должно быть уделено практическим занятиям. Последние представляют собой весьма важную часть в общем объеме дисциплины. Выполнение обучающимися лабораторных и практических работ направлено на:
- обобщение, систематизацию, углубление, закрепление полученных теоретических знаний
- формирование умений применять полученные знания на практике, реализацию единства интеллектуальной и практической деятельности;
- выработку при решении поставленных задач таких значимых качеств, как самостоятельность, ответственность, точность, творческая инициатива.
ОБЩИЕ МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ И УКАЗАНИЯ ПО ВЫПОЛНЕНИЮ ПРАКТИЧЕСКИХ И ЛАБОРАТОРНЫХ РАБОТ
1.1 Подготовка к практической и лабораторной работы
Для выполнения практических и лабораторных работнеобходимо руководствоваться следующими положениями:
1. Каждый обучающийся должен знать правила по технике безопасности при работе в химической лаборатории.
2.Внимательно ознакомиться с описанием соответствующей практической и лабораторной работой и установить, в чем состоит основная цель и задача этой работы.
3. По лекционному курсу или краткому изложению учебного материала в методических рекомендациях изучить теоретическую часть, относящуюся к данной работе.
1.2 Выполнение практических и лабораторных работ
Успешное выполнение практических и лабораторных работ может быть достигнуто в том случае, если обучаемый представляет себе цель выполнения практической и лабораторной работы.Поэтому важным условием является тщательная подготовка к работе.
Прежде чем приступить к выполнению химических опытов, обучающиеся обязаны изучить описание лабораторной работы и внимательно выслушать объяснения преподавателя.
Если возникнут какие-либо затруднения, которые невозможно разрешить самостоятельно, обучающиеся должны обратиться за помощью к преподавателю.
Работая в химической лаборатории, необходимо соблюдать большую осторожность, приступать к выполнению задания после указания преподавателя, соблюдать «Правила по технике безопасности при проведении лабораторных и практических работ».
Проведя запланированный эксперимент, обучающиеся кратко записывают всё, что делали и что при этом наблюдали, то есть описывают условия протекания и признаки химических реакций.Составляют уравнение реакций, которые провели. Если в ходе опыта протекало несколько химических реакций, уравнение записывается для каждой реакции.
При необходимости зарисовывается прибор, которым пользовались обучающиеся.Рисунок должен быть четким, с пояснительными надписями.
Вывод обучающиеся формулируют после каждого опыта (или работы). Повторное описание своих действий или наблюдений не может считаться выводом.
В завершение обучающиеся письменно отвечают на вопросы.
1.3 Оформление практических и лабораторных работ
Оформление практических и лабораторных работ является важнейшим этапом выполнения. Каждую работу выполняютруководствуясь следующими положениями:
1. С новой строки указать название и порядковый номер практической или лабораторной работы, а также кратко сформулировать цель работы;
2. После проведения практических и лабораторных занятий составляется отчет о проделанной работе. Практическая или лабораторная работа должна быть написана разборчивым подчерком и выполнена в тетради с полями для проверки работы преподавателем.
Итогом выполнения является письменная защита работы, по вопросам которые прописаны в конце каждой работы.
Перечень лабораторных и практических работ по разделам:
1 курс
Строение вещества
Л.р.№1 Приготовление суспензии карбоната кальция в воде.
Л.р.№2 Получение эмульсии моторного масла.
Л.р.№3 Систематизация природных и бытовых дисперсных систем на основе анализа состава их компонентов
Вода. Растворы. Электролитическая диссоциация
Практическая работа №1 «Приготовление раствора заданной концентрацией»
Химические реакции
Л.р.№4 Реакция замещения меди железом в растворе медного купороса
Л.р.№5 Реакции, идущие с образованием осадка, газа или воды
Л.р.№6 Окисление меди в пламени
Л.р.№7 Зависимость скорости химической реакции от катализатора.
Классификация неорганических соединений и их свойства
Л.р.№8 Испытание растворов кислот и щелочей индикаторами
Л.р.№9 Свойства кислот
Л.р.№10 Свойства оснований
Л.р.№11 Свойства солей
Л.р.№12 Взаимодействие оксидов металлов с кислотами
Металлы и неметаллы
Л.р.№13 Взаимодействие металлов с солями
Л.р.№14 Исследование свойств неметаллов
Практическая работа №2 «Получение, собирание ираспознавание газов»
Практическая работа №3 «Решение экспериментальных задач по теме «Металлы и неметаллы».
Лабораторная работа №1
Тема: Приготовление суспензии карбоната кальция в воде.
Цель: изучить способы приготовления суспензий; отработать навыки экспериментальной работы, соблюдая правила техники безопасности при работе в кабинете химии.
Оборудование: пробирка с порошком мела, пробирка с водой.
Краткие теоретические сведения
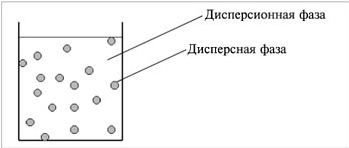
Дисперсные системы - это системы, в которых мелкие частицы вещества, или дисперсная фаза, распределены в однородной среде (жидкость, газ, кристалл), или дисперсионной фазе
Суспензия относится к дисперсной системе ВЗВЕСИ, и состоит из жидкости и распределенного в ней твердого вещества с размером частиц более 100 нм. Если порошок поместить в жидкость и перемешать, то получится суспензия, а при высушивании суспензия снова превращается в порошок.
Концентрированные суспензии (пасты) могут быть получены как в результате оседания более разбавленных суспензий, так и непосредственно растиранием порошков или массивных твердых тел с жидкостями.
Последовательность выполнения работы:
1. К порошку мела в пробирке добавьте 1-2 мл воды и энергично взболтайте.
2. Опишите наблюдаемое явление. Записи внесите в таблицу по форме:
Что делали
Что наблюдали
Уравнения реакций
Вывод
3. Сформулируйте вывод
Контрольные вопросы:
1. Укажите, что в полученной вами дисперсной системе «суспензия» является дисперсионной средой, а что дисперсной фазой?
2. Разделяются ли со временем дисперсионная среда и дисперсная фаза в данной суспензии?
Список литературы
Габриэлян О.С., Остроумов И.Г. Химия для профессий и специальностей технического профиля. М. Издательский центр «Академия». 2011
Лабораторная работа №2
Тема: Получение эмульсии моторного масла.
Цель:изучить способы приготовления эмульсий, ознакомиться с областями их применения.
Оборудование: пробирка с маслом, пробирка с водой.
Краткие теоретические сведения
Эмульсия относится к дисперсной системе ВЗВЕСИ. Эму́льсия (новолат. emulsio, от лат. emulgeo - дою, выдаиваю) - дисперсная система с жидкой дисперсионной средой и жидкой дисперсной фазой. Эмульсии состоят из несмешиваемых жидкостей. Например, молоко - одна из первых изученных эмульсий, в нём капельки жира распределены в водной среде. Они постепенно поднимаются на поверхность, поскольку их плотность меньше, чем плотность воды. В молоке за несколько часов образуется слой сливок. Молоко является не устойчивой эмульсией. Получение устойчивых концентрированных эмульсий возможно только в присутствии специальных эмульгаторов.
К эмульгаторам, способным образовывать прочные защитные пленки, относятся высокомолекулярные соединения, например, сапонин, белки (желатин, казеин), каучук, смолы, соли жирных кислот (мыла) и др. Наибольший интерес представляют собой желатированные или твердые эмульсии.Желатированные эмульсии характеризуются большой устойчивостью, прочностью и другими механическими свойствами. Примерами таких эмульсий являются консистентные смазки, маргарин, сливочное масло, густые кремы. Обычными эмульсиями являются жидкости, применяемые при обработке металлов.
Эмульсии играют большую роль при мыловарении, в технологии пищевых продуктов (сливочное масло, маргарин), при переработке натурального каучука, в живописи. В виде эмульсий получают смазочно-охлаждающие жидкости, битумные материалы, пропиточные композиции, пестицидные препараты, лекарственные и косметические средства.
Последовательность выполнения работы:
1. К маслу в пробирке добавьте 1-2 мл воды и энергично взболтайте.
2. Опишите наблюдаемое явление. Записи внесите в таблицу по форме:
Что делали
Что наблюдали
Уравнения реакций
Вывод
3. Сформулируйте вывод
Контрольные вопросы:
1. Укажите, что в полученной вами дисперсной системе «эмульсия» является дисперсионной средой, а что дисперсной фазой?
2. Разделяются ли со временем дисперсионная среда и дисперсная фаза в данной эмульсии?
3. Каково значение эмульсий в повседневной жизни?
Список литературы
Габриэлян О.С., Остроумов И.Г. Химия для профессий и специальностей технического профиля. М. Издательский центр «Академия». 2011
Лабораторная работа №3
Тема: Систематизация природных и бытовых дисперсных систем на основе анализа состава их компонентов
Цель:изучить компонентный состав различных естественных и искусственных дисперсных систем
Оборудование:примеры дисперсных систем
Краткие теоретические сведения
Дисперсной называется гетерогенная (неоднородная) система, в которой одно вещество в виде очень мелких частиц относительно равномерно распределено в объеме другого.
Дисперсная фаза - это вещество, которое присутствует в меньшем количестве и распределяется в объеме другого.
Дисперсионная среда - это вещество, которое присутствует в большем количестве и в объеме которого распределяется другое вещество.
Организмы животных и растений, гидросфера, земная кора и недра, космическое пространство часто представляют собой вещества в раздробленном, или, как говорят, дисперсном, состоянии. Большинство веществ окружающего нас мира существует в виде дисперсных систем: почвы, ткани живых организмов, пищевые продукты и др. Химия дисперсного состояния довольно новая наука
Диспе́рснаясисте́ма - это образования из двух или более фаз (тел), которые совершенно или практически не смешиваются и не реагируют друг с другом химически. Первое из веществ (дисперсная фаза) мелко распределено во втором (дисперсионная среда). Если фаз несколько, их можно отделить друг от друга физическим способом (центрифугировать, сепарировать и т. д.).
Наиболее общая классификация дисперсных систем основана на различии в агрегатном состоянии дисперсионной среды и дисперсной фазы. Сочетания трех видов агрегатного состояния позволяют выделить девять видов дисперсных систем. Для краткости записи их принято обозначать дробью, числитель которой указывает на дисперсную фазу, а знаменатель на дисперсионную среду, например для системы «газ в жидкости» принято обозначение Г/Ж.
Дисперсная фаза Дисперсионная среда Название и пример
Г/Г Газообразная Газообразная Дисперсная система не образуется
Ж/Г Жидкая Газообразная Аэрозоли: туманы, облака
Т/Г Твёрдая Газообразная Аэрозоли (пыли, дымы), порошки
Г/Ж Газообразная Жидкая Газовые эмульсии и пены
Ж/Ж Жидкая Жидкая Эмульсии: нефть, крем, молоко
Т/Ж Твёрдая Жидкая Пульпа, ил, взвесь, паста
Г/Т Газообразная Твёрдая Пористые тела
Ж/Т Жидкая Твёрдая Жидкость в пористых телах, грунт, почва
Т/Т Твёрдая Твёрдая Сплавы, бетон,
Дисперсные системы с газообразной дисперсионной средой называют аэрозолями. Туманы представляют собой аэрозоли с жидкой дисперсной фазой (Г1 - Ж2), а пыль и дым - аэрозоли с твердой дисперсной фазой (Г1 - Т2); пыль образуется при диспергировании веществ, а дым - при конденсации летучих веществ.
Пены - это дисперсия газа в жидкости (Ж1 - Г2), причем в пенах жидкость вырождается до тонких пленок, разделяющих отдельные пузырьки газа. Эмульсиями называют дисперсные системы, в которых одна жидкость раздроблена в другой, нерастворяющей ее жидкости (Ж1 - Ж2). Низкодисперсные системы твердых частиц в жидкостях (Ж1 - Т2) называют суспензиями, или взвесями, а предельно-высокодисперсные - коллоидными растворами, или золями, часто лиозолями, чтобы подчеркнуть, что дисперсионной средой является жидкость (от греч. «лиос» - жидкость). Если дисперсионной средой является вода, то такие золи называют гидрозолями, а если органическая жидкость - органозолями.
В твердой дисперсионной среде могут быть диспергированы газы, жидкости или твердые тела. К системам T1-Г2 (твердые пены) относятся пенопласты, пенобетон, пемза, шлак, металлы с включением газов. Как своеобразные твердые пены можно рассматривать и хлебобулочные изделия. В твердых пенах газ находится в виде отдельных замкнутых ячеек, разделенных дисперсионной средой. Примером системы T1-Ж2 является натуральный жемчуг, представляющий собой карбонат кальция, в котором коллоидно-диспергирована вода.
Большое практическое значение имеют дисперсные системы типа T1-Т2. К ним относятся важнейшие строительные материалы (например, бетон), а также металлокерамические композиции (керметы) и ситаллы.
К дисперсным системам типа T1-T2 относятся также некоторые сплавы, цветные стекла, эмали, ряд минералов, в частности некоторые драгоценные и полудрагоценные камни, многие изверженные горные породы, в которых при застывании магмы выделились кристаллы.
Цветные стекла образуются в результате диспергирования в силикатном стекле примесей металлов или их оксидов, придающих стеклу окраску. Например, рубиновое стекло содержит 0,01-0,1% золота с размером частиц 4-30 мкм. Условия получения ярко-красных рубиновых и других окрашенных стекол изучались еще М. В. Ломоносовым. Эмали - это силикатные стекла с включениями пигментов (SnO2, TiO2, ZrO2), придающих эмалям непрозрачность и окраску. Драгоценные и полудрагоценные камни часто представляют собой оксиды металлов, диспергированные в глиноземе или кварце (например, рубин - это Сr2О3, диспергированный в Аl2О3).
Последовательность выполнения работы:
1. Перепишите в тетрадь из приведенноготекста определения понятий Дисперсная система, Дисперсная фаза , Дисперсная среда.
2. Перечертите таблицу в тетрадь и заполните графу «Примеры природных и бытовых дисперсных систем» используя прилагаемый список.
Дисперсионная среда
Дисперсная фаза
Примеры природных и бытовых дисперсных систем
ГАЗ
Газ
Жидкость
Твердое вещество
ЖИДКОСТЬ
Газ
Жидкость
Твердое вещество
ТВЕРДОЕ ВЕЩЕСТВО
Газ
Жидкость
Твердое вещество
СПИСОК ДИСПЕРСНЫХ СИСТЕМ: Воздух, природный газ, туман, корбюраторная смесь в двигателях автомобиля, аэрозоль в баллончике, пыль в воздухе, дым, смог, песчаная буря, пыльная буря, шипучие напитки, пена, плазма крови, пищеварительные соки, цитоплазма клеток, кисель,студень (холодец), клей, строительный раствор, известь, кирпич и керамика, пористый шоколад, поролон, крем, мазь, помада, цветные стекла, сплавы.
Контрольные вопросы:
1. Приведите примеры использования дисперсных систем в быту.
2. Приведите примеры использования дисперсных систем на производстве вашего профиля.
Список литературы:
Габриэлян О.С., Остроумов И.Г. Химия для профессий и специальностей технического профиля. М. Издательский центр «Академия». 2011
Практическая работа №1 «Приготовление раствора заданной концентрацией»
Цель: освоить расчеты и методику приготовления растворов определенной концентрации
Оборудование:кристаллический хлорид натрия, вода, колба, весы, мерный стакан
Краткие теоретические сведения
Растворы играют важную роль в живой и неживой природе, а также в науке и технике.
Большинство физиологических процессов в организмах человека, животных и в растениях, различных промышленных процессов, биохимических процессов в почвах и т.п. протекают в растворах.
Раствор - это гомогенная многокомпонентная система, в которой одно вещество распределено в среде другого или других веществ.
Растворы могут быть в газообразном (воздух), жидком и твердом (сплавы, цветные стекла) агрегатных состояниях. Содержание данного вещества в единице массы или объема раствора называется концентрацией раствора. На практике наиболее часто пользуется такой способ выражения концентрации как массовая доля - отношение массы данного компонента в растворе к общей массе этого раствора. Массовая доля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных долях (млнˉ1). Массовая доля данного компонента, выраженная в процентах, показывает, сколько граммов данного компонента cодержится в 100 г раствора.
Для приготовления определённого раствора нужной концентрации обычно составляют пропорцию, где за x принимают массу вещества, которую необходимо растворить, для получения раствора необходимой концентрации. При этом необходимо вычитать массу растворённого вещества из массы раствора, чтобы найти массу растворителя.
Например: приготовить 200 г раствора соли, массовая доля которого 20% или 0,2.
РЕШЕНИЕ
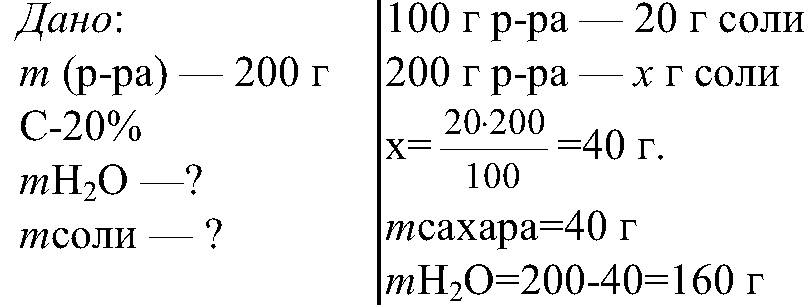
Ответ: Для приготовления 20-ти процентного раствора сахара, необходимо взять 160 г воды и 40 г соли.
Последовательность выполнения работы:
1. Задание. Необходимо приготовить 50г 2% раствора соли:
- выполните расчеты
- взвесьте необходимую массу соли и поместите ее в колбу.
- отмерьте нужное количество воды и добавьте ее в колбу с солью, перемешайте раствор.
2. Сформулируйте вывод.
3. Выберите 3 задания по своему желанию из общего списка и выполните расчеты:
№ 1. Для полоскания горла используется 2 % раствор соды. Вычислите массу соды и объём воды, которые необходимо взять для приготовления 150 г такого раствора. Приготовьте раствор.
№ 2. Для засолки огурцов применяется 10 % раствор поваренной соли. Вычислите массу соли и объём воды, которые необходимо взять для приготовления 200 г такого раствора. Приготовьте раствор.
№ 3. Перед посадкой семена томатов дезинфицируют (протравливают) 1% раствором перманганат калия. Вычислите массу перманганата калия и объём воды, которые необходимо взять для приготовления 100 г такого раствора. Приготовьте раствор.
№ 4. Для удаления с побелки ржавых пятен используют 2 % раствор сульфата меди. Вычислите массу сульфата меди и объём воды, которые необходимо взять для приготовления 300 г такого раствора. Приготовьте раствор.
№ 5. Для приготовления компотов из яблок, груш и т.д. используется 40 % раствор сахара. Вычислите массу сахара и объём воды, которые необходимо взять для приготовления 50 г такого раствора. Приготовьте раствор.
№ 6. Для подкормки растений используется 2 % раствор кальциевой селитры. Вычислите массу соды и объём воды, которые необходимо взять для приготовления 150 г такого раствора. Приготовьте раствор.
Контрольные вопросы:
1. Какие растворы используются в быту и на предприятиях вашего профиля?
Список литературы
Габриэлян О.С., Остроумов И.Г. Химия для профессий и специальностей технического профиля. М. Издательский центр «Академия». 2011
Лабораторная работа №4
Тема: Реакция замещения меди железом в растворе медного купороса
Цель:изучить протекание реакций замещения на примере взаимодействия железа с сульфатом меди
Оборудование:пробирка с раствором сульфата меди(медного купороса CuSO4), железный гвоздь.
Краткие теоретические сведения
Реакции замещения - реакция между простыми и сложными веществами, при котором атомы простого вещества замещают атомы одного из элементов в сложном веществе. К такому типу реакций относится взаимодействие между металлами и кислотами, металлами и солями. При этих реакциях необходимо учитывать положение металла в ряду напряжений (ряд Бекетова), а также силу кислот и растворимость солей.
Железо легко вытесняет медь в химической реакции замещения. Если в раствор медного купороса опустить металлическое изделиемы будем наблюдать на поверхности железа образование микроскопических кристаллов химически чистой меди красно-бурого цвета. При этом голубой раствор медного купороса постепенно бледнеет и приобретает зеленоватый окрас, происходит образование железного купороса FeSO4x5H2O.
Но это способ не эффективен для прочного медного покрытия, поэтомудля более качественного нанесения медного покрытия используют электричество. Таким способом (реакцией замещения) можно покрыть металлом, стоящим правее металл стоящий левее в ряду напряжений.
Последовательность выполнения работы:
1. Опустите железный гвоздь в пробирку с медным купоросом, наблюдайте за происходящими изменениями цвета поверхности гвоздя и раствора соли в течение 10 минут.
2. Опишите наблюдаемое явление. Записи внесите в таблицу по форме:
Что делали
Что наблюдали
Уравнения реакций
Вывод
3. Сформулируйте вывод.
Контрольные вопросы:
1. Какие реакции относятся к реакциям замещения?
2. В каком случае возможна реакция замещения: между серебром и хлоридом железа или между железом и нитратом серебра? Ответ обоснуйте.
Список литературы
Габриэлян О.С., Остроумов И.Г. Химия для профессий и специальностей технического профиля. М. Издательский центр «Академия». 2011
Лабораторная работа №5
Тема: Реакции, идущие с образованием осадка, газа или воды
Цель:осуществить практически реакции ионного обмена, выяснить условия протекания химических реакций между растворами электролитов до конца.
Оборудование:растворы следующих солей: сульфат натрия, хлорид бария, карбонат натрия, соляная кислота, гидроксид калия, фенолфталеин.
Краткие теоретические сведения
При растворении некоторых веществ в воде (или других полярных растворителях) под воздействием молекул растворителя происходит распад молекул данного вещества на ионы. В результате этогопроцесса раствор содержит не только молекулы растворителя и растворенного вещества, но и образовавшиеся ионы. Растворы веществ, которые при растворении в воде или других полярных растворителяхраспадаются на ионы, называются электролитами.
Процесс распада молекул растворенного вещества (электролита) на ионы под действием полярных молекул растворителя называется электролитической диссоциацией.
К сильным электролитам, если растворителем является вода, относятся:
- кислоты: НNO3, H2SO4, НCNS, НCl, НClO3, HClO4, HBr, HВrО3, HВrО4,
НI, НIO3 HMnO4, H2SeO4, HReO4, HTcO4; а также кислоты Н2СrO4,
H4P2O7, H2S2O6 которые являются сильными по первой ступени диссоциации, т. е. при отрыве первого иона Н+;
- основания: гидроксиды щелочных (Li, Na, K, Rb, Cs, Fr) и щелочноземельных металлов (Ca, Sr, Ba, Ra): LiOH, NаОН, KОH, RbОН, CsОН, FrОН, Ca(OH)2, Ba(OH)2, Sr(OH)2; Ra(OH)2;
- большинство солей. Исключение: Fe(SCN)3, Mg(CN)2, HgCl2, Hg(CN)2.
К слабым электролитам относятся:
- кислоты: H2CO3, НClO, H2S, H3BO3, HCN, H2SO3, H2SiO3, CH3COOH,
HCOOH, H2C2O4;
- основания: Be(OH)2, Mg(OH)2, Fe(OH)2, Zn(OH)2; гидроксидаммония NH4OH, атакжеорганическиеоснования - амины(CH3NH2) иамфолиты (H3N+CH2COOˉ).
Вода является очень слабым электролитом.
Химические свойства растворов электролитов зависят от свойств ионов и молекул, находящихся в растворе. Направление протекания реакций между ионами и молекулами в растворах электролитов определяется возможностью образования малорастворимых веществ или слабых электролитов. Если в результате реакции не происходит образования малорастворимого вещества или слабого электролита, то такая реакция протекать не может. Например, при сливании растворов нитрата натрия и хлорида калия реакция не протекает, так как по обменной реакции из ионов находящихся в растворе не может образоваться какое либо малорастворимое вещество или слабый электролит. Эти соли относятся к сильным электролитам и хорошо растворяются в воде, поэтому в растворе будет находиться смесь ионов: Na+ + NO3ˉ + K+ + Clˉ, из которых состояли исходные вещества.
Реакцию, протекающую в растворе, можно представить в виде:
- молекулярного уравнения реакции;
- ионно-молекулярного уравнения (полного или сокращенного).
Уравнение реакции, содержащее только формулы недиссоциированных веществ, называется молекулярным уравнением. Молекулярная форма уравнения показывает, какие вещества и в каком количестве участвуют в реакции. Оно позволяет производить необходимые расчеты, связанные с данной реакцией. Уравнение, содержащее формулы недиссоциированных слабых электролитов и ионы сильных электролитов, называется полным ионным или ионно-молекулярным уравнением реакции. Сократив одинаковые продукты в левой и правой части ионно-молекулярного уравнения реакции, получаем сокращенное или краткое ионное уравнение реакции. Ионное уравнение, не содержащее одинаковых веществ (ионов или молекул) в левой и правой части реакции, называется сокращенным или кратким ионным уравнением реакции. Это уравнение и отражает сущность происходящей реакции.
При записи ионных уравнений реакций необходимо помнить:
1) сильные электролиты следует записывать в виде отдельных составляющих их ионов;
2) слабые электролиты и малорастворимые вещества следует записывать в виде молекул.
Рассмотрим примеры записи некоторых ионно-молекулярных уравнений.
Пример 1. Образование трудно- и малорастворимых соединений (осадка).
а) Образование сульфата бария
Молекулярное уравнение реакции:
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl.
Полное ионное (ионно-молекулярное) уравнение реакции:
Ba2+ + 2Clˉ + 2Na+ + SO42-= BaSO4↓ + 2Na+ + 2Clˉ.
Сокращенное ионное уравнение реакции (краткая форма уравнения):
Ba2+ + SO42ˉ= BaSO4↓.
б) Образование карбоната бария
Ва(ОН)2 + СО2 = ВaCO3↓ + Н2О (молекулярное уравнение)
Ba2+ + 2ОНˉ + СO2= BaСO3↓ + Н2О (сокращенное ионное уравнение).
Пример 2. Образование газообразного вещества.
а) Na2S + 2HCl = H2S↑ + 2NaCl (молекулярное уравнение)
2Na+ + S2- + 2H+ + 2Cl- = H2S↑ + 2Na+ +2Cl- (полное ионное уравнение)
2H+ + S2- = H2S↑ (сокращенное ионное уравнение)
б) К2СО3 + 2 НС1 = 2 КС1 + СО2↑ + H2O (молекулярное уравнение)
CO32- + 2 H+ = CO2↑ + H2O (сокращенное ионное уравнение).
Пример 3. Образование слабого электролита.
а) воды:
2NaOH + H2SO4 = 2H2O + Na2SO4 (молекулярное уравнение)
2Na+ + 2OH- +2H+ + SO42- = 2H2O + 2Na+ + SO42- (полное ионное уравнение)
2OH- + 2H+ = 2H2O (сокращенное ионное уравнение).
Реакция нейтрализации сильной кислоты сильным основанием сводится
к взаимодействию ионов водорода с гидроксид-ионами;
б) слабой кислоты:
2NaNO2 + H2SO4 = 2HNO2 + Na2SO4 (молекулярное уравнение)
2Na+ +2NO2ˉ+ 2H+ + SO42- = 2HNO2 +2Na+ + SO42-(полное ионное уравнение)
2H+ + 2NO2ˉ= 2HNO2 (сокращенное ионное уравнение).
Сильные кислоты вытесняют слабые кислоты из их солей;
в) слабого основания:
NH4Cl + NaOH = NH4OH + NaCl (молекулярное уравнение)
NH4+ + Cl- + Na+ + OH- = NH4OH + Na+ + Cl- (полное ионное уравнение)
NH4+ + OH- = NH4OH (сокращенное ионное уравнение).
Сильные основания вытесняют слабые основания из их солей.
Последовательность выполнения работы:
1. К раствору сульфата натрия прилейте хлорид бария.
2. К раствору карбоната натрия добавьте соляную кислоту.
3. В пробирку с гидроксидом калия добавьте фенолфталеин до появления малиновой окраски индикатора, затем понемногу добавляйте кислоту до исчезновения окраски.
4. Опишите наблюдаемые явления. Записи внесите в таблицу по форме:
Что делали
Что наблюдали
Уравнения реакций
Вывод
Уравнения запишите в молекулярной и ионной форме.
5.Сформулируйте вывод
Контрольные вопросы:
1. В виде каких частиц преимущественно присутствуют в растворе сильные электролиты, слабые электролиты?
2. Как записываются сильные электролиты в ионных уравнениях реакций?
3. Как записываются слабые электролиты, осадки и газообразные вещества в ионных уравнениях реакций?
4. Перечислите три условия протекания реакций ионного обмена до конца?
5. Что отображают сокращенные ионные уравнения реакции?
Список литературы
Габриэлян О.С., Остроумов И.Г. Химия для профессий и специальностей технического профиля. М. Издательский центр «Академия». 2011
Лабораторная работа №6
Тема: Окисление меди в пламени
Цель:изучение реакции окисления на примере взаимодействия меди с кислородом
Оборудование:спиртовка, медная проволока, зажим
Краткие теоретические сведения
Металл медь(Cu) - металл красного цвета, имеет высокую пластичность, то есть способность деформироваться, при этом не ломаясь. Медь - отличный проводник тока. По проводимости она занимает третье место после золота и серебра. Медь отлично проводит тепло. При контакте с горячей поверхностью очень быстро нагревается, поэтому не рекомендуется её использовать для переноса горячих предметов. Чистая медь хорошо окисляется. При длительном пребывании в воде на её поверхности образуется зеленоватый налёт, - это гидроксид меди и карбонат меди (Cu(OH)2 и CuCO3). Медь на воздухе быстро покрывается тонкой плёнкой тёмного оксида меди CuO, которая предохраняет её от дальнейшего разрушения. Медь непосредственно реагирует с кислородом. При нагревании на воздухе медные изделия чернеют, покрываясь слоем оксида меди (II) CuО.
При температуре свыше 1000°С образуется другой оксид меди- Cu2О.
Находясь долгое время на воздухе, чистая медь покрывается плёнкой малахита, образующегося по химической реакции2Cu+О2+Н2О+СО2=(CuОН)2СО3. Именно этому веществу обязаны своим цветом бронзовые памятники и старые крыши городов Западной Европы.
Последовательность выполнения работы:
1. Нагрейте медную проволоку в пламене спиртовки.
2. Опишите наблюдаемое явление. Записи внесите в таблицу по форме:
Что делали
Что наблюдали
Уравнения реакций
Вывод
3. Сформулируйте вывод.
Контрольные вопросы:
1. Какие реакции относятся вреакциям окисления?
2. Что является продуктом реакций окисления?
Список литературы
Габриэлян О.С., Остроумов И.Г. Химия для профессий и специальностей технического профиля. М. Издательский центр «Академия». 2011
Лабораторная работа №7
Тема: Зависимость скорости химической реакции от катализатора
Цель:пронаблюдать роль катализатора в химической реакции
Оборудование:пробирка с пероксидом водорода, пробирка с оксидом марганца.
Краткие теоретические сведения
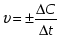 Скорость химической реакции - изменением концентрации реагирующих или образующихся веществ в единицу времени.
Скорость химической реакции - изменением концентрации реагирующих или образующихся веществ в единицу времени.
, где С - молярная концентрация, t - время

Катализа́тор - химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции. Количество катализатора, в отличие от реагентов, после реакции не изменяется. Важно понимать, что катализатор участвует в реакции особенным образом. Обеспечивая более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно повторяется.
Для каждого типа реакций эффективны только определённые катализаторы.
В современной науке и технике часто применяют системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции.
Последовательность выполнения работы:
1. В пробирку с пероксидом водорода Н2О2 добавьте порошок оксида марганца MnO2.
2. Опишите наблюдаемое явление. Записи внесите в таблицу по форме:
Что делали
Что наблюдали
Уравнения реакций
Вывод
3. Сформулируйте вывод.
Контрольные вопросы:
1. Чем в данной реакции является оксид марганца.
2. Какие факторы влияют на скорость химической реакции?
3. Как называется реакция, протекающая в присутствии катализатора?
Список литературы
Габриэлян О.С., Остроумов И.Г. Химия для профессий и специальностей технического профиля. М. Издательский центр «Академия». 2011
Лабораторная работа №8
Тема: Испытание растворов кислот индикаторами
Цель:изучить реакцию универсального индикатора на присутствие кислоты в растворе
Оборудование:пробирка с раствором серной кислоты,пробирка с раствором гидроксида натрия, универсальный индикатор.
Краткие теоретические сведения
Кисло́ты - сложные вещества, в состав которых обычно входят атомы водорода, способные замещаться на атомы металлов, и кислотный остаток. Водные растворы кислот имеют кислый вкус, обладают раздражающим действием, способны менять окраску индикаторов, отличаются рядом общих химических свойств.
Различают кислоты бескислородные (HCl, HI, H2S, HCN) и кислородсодержащие (HNO3, H2SO4, H2SO3, H3PO4).
Кислоты получают растворением кислотных оксидов в воде: P2O5 + 3H2O = 2H3PO4
или по реакции обмена соли с кислотой: Ca3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4
Практически все кислоты (кроме кремниевой) хорошо растворимы в воде. Растворы кислот в воде изменяют окраску специальных веществ - индикаторов. Индикаторы представляют собой вещества сложного строения. В растворах оснований и в нейтральных растворах они имеют иную окраску, чем в растворах кислот.
По окраске индикаторов определяют присутствие кислоты. Индикаторы лакмус и метиловый оранжевый окрашиваются растворами кислот в красный цвет.
Основаниями называются вещества, в которых атомы металла связаны с гидрокси-группами.
Существует также основание, в котором гидрокси-группа присоединена не к металлу, а к иону NH4+ (катиону аммония). Это основание называется гидроксидом аммония и имеет формулу NH4OH. Гидроксид аммония образуется в реакции присоединения воды к аммиаку, когда аммиак растворяют в воде:
NH3 + H2O = NH4OH (гидроксид аммония).
NaOH - гидроксид натрия, KOH - гидроксид калия, Ca(OH)2 - гидроксид кальция,
Fe(OH)3 - гидроксид железа (III), Ba(OH)2 - гидроксид бария.
Гидрокси-группы одновалентны, поэтому формулу основания легко составить по валентности металла. К химическому символу металла надо приписать столько гидрокси-групп, какова валентность металла. Большинство оснований - ионные соединения.
Основания бывают растворимыми и нерастворимыми. Растворимые основания называются щелочами. Щелочи получают растворением оксидов в воде: Na2O + H2O = 2NaOH
Лишь небольшую часть всех оснований называют щелочами. Это, например, KOH - гидроксид калия (едкое кали), NaOH - гидроксид натрия (едкий натр), LiOH - гидроксид лития, Ca(OH)2 - гидроксид кальция (его раствор называется известковой водой), Ba(OH)2 - гидроксид бария. Большинство других оснований в воде нерастворимы и щелочами их не называют.
Растворы щелочей скользкие на ощупь ("мыльные") и довольно едкие. Они разъедают кожу, ткани, бумагу, очень опасны (как и кислоты) при попадании в глаза. Поэтому при работе со щелочами и кислотами необходимо пользоваться защитными очками. Если раствор щелочи все-таки попал в лицо, необходимо промыть глаза большим количеством воды, а затем разбавленным раствором слабой кислоты (например, уксусной). Этот способ медицинской помощи основан на уже известной нам реакции нейтрализации.
Кислотность основания определяется числом ионов OH⎯. Многокислотные основания диссоциируют ступенчато: Ca(OH)2D(CaOH)+ + OH⎯,(CaOH)+DCa2+ + OH⎯
Индикаторы в щелочных растворах меняют окраску: так лакмус приобретает синий цвет, бесцветный фенолфталеин становится малиновым, метиловый оранжевый - желтым.
Последовательность выполнения работы:
1. Впробирку с раствором серной кислоты и в пробирку с гидроксидом натрия опустите универсальную индикаторную бумагу.
2. Опишите наблюдаемое явление. Записи внесите в таблицу по форме:
Что делали
Что наблюдали
Уравнения реакций
Вывод
3.Сформулируйте вывод
Контрольные вопросы:
1. Что собой представляют индикаторы?
2. Как с помощью индикатора обнаружить кислоту и щелочь в растворе?
Список литературы
Габриэлян О.С., Остроумов И.Г. Химия для профессий и специальностей технического профиля. М. Издательский центр «Академия». 2011
Лабораторная работа №9
Тема: Свойства кислот
Цель:изучить реакцию нейтрализации
Оборудование:пробирки с растворами: соляной кислоты, гидроксида калия, карбоната натрия, серной кислоты, цинк в гранулах, фенолфталеин, пустые пробирки, стеклянные трубки колбы с водой.
Краткие теоретические сведения
Кислоты обладают разнообразными химическими свойствами и взаимодействуют с металлами, основаниями, солями и оксидами металлов.
Для взаимодействия кислот с металлом должны выполняться некоторые условия (в отличие от реакций кислот с основаниями и основными оксидами, которые идут практически всегда).
Во-первых, металл должен быть достаточно активным (реакционноспособным) по отношению к кислотам. Например, золото, серебро, медь, ртуть и некоторые другие металлы с выделением водорода с кислотами не реагируют. Такие металлы как натрий, кальций, цинк - напротив - реагируют очень активно с выделением газообразного водорода и большого количества тепла.
HCl + Hg = не образуется
H2SO4 + Zn = ZnSO4 + H2
По реакционной способности в отношении кислот все металлы располагаются в ряд активности металлов. Слева находятся наиболее активные металлы, справа - неактивные. Чем левее находится металл в ряду активности, тем интенсивнее он взаимодействует с кислотами.
Во-вторых, кислота должна быть достаточно сильной, чтобы реагировать с металлом.
Под силой кислоты понимают ее способность отдавать ионы водорода H+.
Например, кислоты растений (яблочная, лимонная, щавелевая и т.д.) являются слабыми кислотами и очень медленно реагируют с такими металлами как цинк, хром, железо, никель, олово, свинец (хотя с основаниями и оксидами металлов они способны реагировать).
Следует помнить, что в реакциях кислот с металлами есть одно важное исключение. При взаимодействии металлов с азотной кислотой водород не выделяется. Концентрированные кислоты с металлами ведут себя иначе, чем разбавленные:
Cu + 4 HNO3(конц.) =Cu(NO3)2 + 2 NO2 + 2 H2O
3 Cu + 8HNO3(разб.) = 3 Cu(NO3)2 + 2 NO + 4 H2O
8 K + 5 H2SO4(конц.) = 4 K2SO4 + H2S + 4 H2O
3 Zn + 4 H2SO4(конц.) = 3 ZnSO4 + S + 4 H2O
Есть металлы, которые реагируют с разбавленными кислотами, но не реагирует с концентрированными (т.е. безводными) кислотами - серной кислотой и азотной кислотой.
Эти металлы - Al, Fe, Cr, Ni и некоторые другие - при контакте с безводными кислотами сразу же покрываются продуктами окисления (пассивируются). Это обстоятельство используют в промышленности. Например, концентрированную серную кислоту хранят и перевозят в железных бочках.
Реакция между кислотой и основанием называется реакцией нейтрализации. Кислотареагируют с основанием с образованием соли, в которой всегда в неизменном виде обнаруживается кислотный остаток. Вторым продуктом реакции нейтрализации обязательно является вода. Кислота + основание =соль +вода
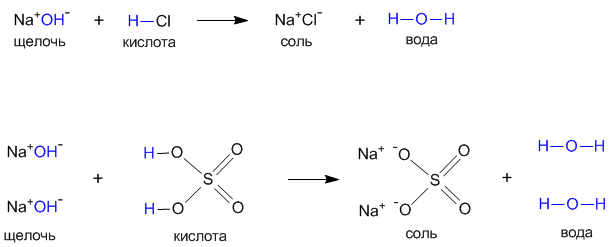
Например:
H2SO4 + Ca(OH)2=CaSO4 +2 H2O
H3PO4+Fe(OH)3 =FePO4+3 H2O
2 H3PO4 +3 Ca(OH)2=Ca3(PO4)2 +6 H2O
Для реакций нейтрализации достаточно, чтобы хотя бы одно из реагирующих веществ было растворимо в воде. Поскольку практически все кислоты растворимы в воде, они вступают в реакции нейтрализации не только с растворимыми, но и с нерастворимыми
основаниями. Исключением является кремниевая кислота, которая плохо растворима в воде и поэтому может реагировать только с растворимыми основаниями - такими как NaOH и KOH.
Кислоты вступают в реакции солями. При химических реакциях кислот с солями обязательно надо учитывать основные признаки химических реакций, а именно, химическая реакция пройдёт, если будет выделяться газ, выпадет осадок, и т.д.
В реакции между карбонатами и кислотами выделяется углекислый газ CO2 :
Например, Nа2CO3 + 2HCl = 2NaCl + CO2 + H2O. Конечно, если говорить точно, то образуется слабая угольная кислота (H2CO3), которая сразу же распадается на углекислый газ и воду. Приведенная реакция является качественной на карбонаты.
При этих реакциях образуется соль и другая кислота (менее слабая). Таким способом в лаборатории получают многие слабые кислоты.
Результатом взаимодействия кислот с солями так же могут быть осадки: например при реакции серной кислоты с солями бария, соляной кислоты с нитратом серебра и другие. Реакции между кислотами и солями часто используют как качественные.
Последовательность выполнения работы:
Внимание:Записи о наблюдаемых явлениях по всем опытам внесите в таблицу по форме:
Что делали
Что наблюдали
Уравнения реакций
Вывод
Уравнения запишите в молекулярном и ионном виде!!!
ОПЫТ 1.
1. В пустую пробирку налейте 1 мл раствора соляной кислоты и опустите гранулу цинка.
2. Опишите наблюдаемое явление
3. Сформулируйте вывод.
ОПЫТ 2.
1. В пробирку с гидроксидом калия добавьте фенолфталеин до появления малиновой окраски индикатора, затем с помощью стеклянной трубки медленно добавляйте соляную кислоту до исчезновения окраски.
2. Опишите наблюдаемое явление
3. Сформулируйте вывод
ОПЫТ 3.
1. В пробирку с раствором карбоната натрия добавьте немного раствора серной кислоты.
2. Опишите наблюдаемое явление.
3. Сформулируйте вывод
Контрольные вопросы:
1. Как называются реакции между кислотой и основанием?
2. С какой целью в реакции используется индикатор?
3. При взаимодействии соляной кислоты с какой солью образуется нерастворимое вещество?
4. Перечислите условия, при которых металлы вступают в реакцию с кислотами
Список литературы
Габриэлян О.С., Остроумов И.Г. Химия для профессий и специальностей технического профиля. М. Издательский центр «Академия». 2011
Лабораторная работа №10
Тема: Свойства оснований
Цель:изучить химические свойства щелочей на примере реакции взаимодействия гидроксида натрия с сульфатом меди и реакции разложения гидроксида меди.
Оборудование:пробирка с раствором гидроксида натрия, пробирка с раствором сульфата меди, спиртовка, держатель для пробирок.
Краткие теоретические сведения
Основаниями называются вещества, в которых атомы металла связаны с гидрокси-группами.
Существует также основание, в котором гидрокси-группа присоединена не к металлу, а к иону NH4+ (катиону аммония). Это основание называется гидроксидом аммония и имеет формулу NH4OH. Гидроксид аммония образуется в реакции присоединения воды к аммиаку, когда аммиак растворяют в воде:
NH3 + H2O = NH4OH (гидроксид аммония).
NaOH - гидроксид натрия, KOH - гидроксид калия, Ca(OH)2 - гидроксид кальция,
Fe(OH)3 - гидроксид железа (III), Ba(OH)2 - гидроксид бария.
Гидрокси-группы одновалентны, поэтому формулу основания легко составить по валентности металла. К химическому символу металла надо приписать столько гидрокси-групп, какова валентность металла. Большинство оснований - ионные соединения.
Основания бывают растворимыми и нерастворимыми. Растворимые основания называются щелочами. Лишь небольшую часть всех оснований называют щелочами. Это, например, KOH - гидроксид калия (едкое кали), NaOH - гидроксид натрия (едкий натр), LiOH - гидроксид лития, Ca(OH)2 - гидроксид кальция (его раствор называется известковой водой), Ba(OH)2 - гидроксид бария. Большинство других оснований в воде нерастворимы и щелочами их не называют.
Растворы щелочей скользкие на ощупь ("мыльные") и довольно едкие. Они разъедают кожу, ткани, бумагу, очень опасны (как и кислоты) при попадании в глаза. Поэтому при работе со щелочами и кислотами необходимо пользоваться защитными очками. Если раствор щелочи все-таки попал в лицо, необходимо промыть глаза большим количеством воды, а затем разбавленным раствором слабой кислоты (например, уксусной). Этот способ медицинской помощи основан на уже известной нам реакции нейтрализации.
NaOH + уксусная кислота (разб.) = соль + вода
Для реакций с солями подходят только щелочи (растворимые основания). В этих реакциях образуется другое основание и другая соль. Важно, чтобы новое основание не было щелочью и не могло реагировать с образовавшейся солью.
Например: 3 NaOH + FeCl3 = Fe(OH)3↓ + 3 NaCl
(осадок)
Нерастворимые в воде основания обычно получают действием щелочей на растворимые соли металлов: CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Многие нерастворимые в воде основания при нагревании разлагаются с образованием оксида данного металла и воды: Ме(OH)n⎯⎯t→ МеO + H2O
другие - даже при комнатной температуре (например, гидроксид серебра - AgOH).
Растворимые основания (щёлочи) разложению не подвергаются.
Последовательность выполнения работы:
Внимание:Записи о наблюдаемых явлениях по всем опытам внесите в таблицу по форме:
Что делали
Что наблюдали
Уравнения реакций
Вывод
Уравнения запишите в молекулярном и ионном виде!!!
ОПЫТ 1.
1. В пробирку с сульфатом меди добавьте раствор гидроксида натрия.
2. Опишите наблюдаемое явление.
3. Сформулируйте вывод.
ОПЫТ 2.
1. Пробирку с полученным гидроксидом меди нагрейте в пламени спиртовки.
2. Опишите наблюдаемое явление.
3. Сформулируйте вывод.
Контрольные вопросы:
1. К какому типу относится проведенная реакция?
2. Какие вещества образуются в реакциях щелочей с солями?
3. Как называются растворимые в воде основания?
Список литературы
Габриэлян О.С., Остроумов И.Г. Химия для профессий и специальностей технического профиля. М. Издательский центр «Академия». 2011
Лабораторная работа №11
Тема: Свойства солей
Цель:изучить реакцию обмена между солями и явление гидролиза солей.
Оборудование:пробирка сраствором хлорида бария, пробирка с раствором сульфата натрия; пробирки с растворами солей:карбоната натрия, хлорида натрия и сульфата меди, универсальная индикаторная бумага.
Краткие теоретические сведения
Солями называются вещества, в которых атомы металла связаны с кислотными остатками.
Исключением являются соли аммония, в которых с кислотными остатками связаны не атомы металла, а частицы NH4+. Примеры типичных солей приведены ниже.
NaCl - хлорид натрия, Na2SO4 - сульфат натрия, СаSO4 - сульфат кальция,
СаCl2 - хлорид кальция, (NH4)2SO4 - сульфат аммония.
Формула соли строится с учетом валентностей металла и кислотного остатка. Практически все соли - ионные соединения, поэтому можно говорить, что в солях связаны между собой ионы металла и ионы кислотных остатков: Na+Cl- - хлорид натрия Ca2+SO42- - сульфат кальция и т.д.
Названия солей составляются из названия кислотного остатка и названия металла. Главным в названии является кислотный остаток.
Все соли разделяются на средние, кислые и основные. Средние соли содержат только атомы металла и кислотного остатка.
Кислые соли образуются многоосновными кислотами. Одноосновные кислоты кислых солей не образуют.
Кислые соли, помимо ионов металла и кислотного остатка, содержат ионы водорода.
Названия кислых солей содержат приставку "гидро" (от слова hydrogenium - водород). Например:
NaHCO3 - гидрокарбонат натрия, K2HPO4 - гидрофосфат калия, KH2PO4 - дигидрофосфат калия.
Основные соли образуются при неполной нейтрализации основания. Названия основных солей образуют с помощью приставки "гидроксо". Ниже приведен пример, показывающий отличие основных солей от обычных (средних):
Mg(OH)2 + 2 HCl= MgCl2 + 2 H2O
хлорид магния (средняя соль)
Mg(OH)2+HCl=Mg(OH)Cl+H2O
гидроксохлорид магния (основная соль)
Основные соли, помимо ионов металла и кислотного остатка, содержат гидроксильные группы. Основные соли образуются только из многокислотных оснований. Одноокислотные основания таких солей образовать не могут.
Например, ни в коем случае нельзя путать соду Na2CO3 и питьевую соду NaHCO3. Если нечаянно использовать в пищу соду вместо питьевой соды, можно получить тяжелый химический ожог.
В химии и в технике до сих пор сохраняется много старинных названий. Например, каустическая сода - вовсе не соль, а техническое название гидроксида натрия NaOH. Если обыкновенной содой можно почистить раковину или посуду, то каустическую соду ни при каких обстоятельствах брать в руки или использовать в быту нельзя!
Соли можно получать различными способами.
Кислые соли могут быть получены в кислой среде: NaOH + H2SO4 (избыток) = NaHSO4 + H2O
Na3PO4 + 2H3PO4 (избыток) = 3NaH2PO4
Основные соли могут быть получены в щелочной среде: H2SO4 + 2Cu(OH)2 (избыток) = (CuOH)2SO4 + Na2SO4, 2CuSO4 + 2NaOH(недостаток) = (CuOH)2SO4 + Na2SO4
Кислые соли при избытке щелочи и основные соли при избытке кислоты переходят в средние соли:
NaHSO4 + NaOH (избыток) = Na2SO4 + H2O, (CuOH)2SO4 + H2SO4 (избыток) = 2CuSO4 + 2H2O
Средние соли могут быть получены:
1) соединением металла и неметалла: 2Na + Cl2 = 2NaCl
2) соединением основного и кислотного оксидов: CaO + CO2 = CaCO3
3) вытеснением активным металлом водорода или менее активного металла:
Zn + 2HCl = H2 + ZnCl2, Zn + CuSO4 = ZnSO4 + Cu
4) реакцией нейтрализации: NaOH + HCl = NaCl + H2O
5) реакциейобмена: Ba(NO3)2 + Na2SO4 = BaSO4 + 2NaNO3
Многие соли подвергаются процессу под названием ГИДРОЛИЗ - реакция обмена растворимых солей-электролитов с водой. Движущей силой процесса является взаимодействие ионов, образующихся при диссоциации этих солей с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).
Различают обратимый и необратимый гидролиз солей:
1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):
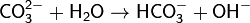
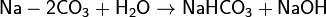
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
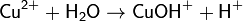
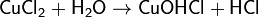
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота:
3. Гидролиз соли слабой кислоты и слабого основания (необратимый):
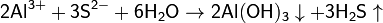
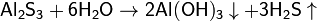
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
Сольсильной кислоты и сильного основания гидролизу не подвергается.
Последовательность выполнения работы:
Внимание:Записи о наблюдаемых явлениях по всем опытам внесите в таблицу по форме:
Что делали
Что наблюдали
Уравнения реакций
Вывод
Уравнения запишите в молекулярном и ионном виде!!!
ОПЫТ 1.
1. В пробирку с раствором сульфата натрия прилейте раствор хлорида бария.
2. Опишите наблюдаемое явление.
3. Сформулируйте вывод.
ОПЫТ 2.
1. Исследуйте с помощью индикатора среду в растворах следующих солей: карбоната натрия, хлорида натрия и сульфата меди.
2. Опишите наблюдаемое явление.
3. Сформулируйте вывод.
Контрольные вопросы:
1. Почему важно знать не только название, но и химическую формулу солей?
2. Взаимодействием каких растворимых солей можно в результате реакции обмена получить следующие соли: хлорид серебра, фосфат кальция?
3. Какие соли подвергаются обратимому гидролизу?
Список литературы
Габриэлян О.С., Остроумов И.Г. Химия для профессий и специальностей технического профиля. М. Издательский центр «Академия». 2011
Лабораторная работа №12
Тема:Взаимодействие оксидов металлов с кислотами
Цель:изучить характер взаимодействия металлов с кислотами
Оборудование: пробирка с оксидом меди, пробирка с серной кислотой, спиртовка.
Краткие теоретические сведения
Основные оксиды образуются только металлами. Некоторые из них легко реагируют с водой, давая соответствующее основание:
Существует, однако, большое количество нерастворимых основных оксидов. Их относят именно к основным оксидам благодаря реакциям с кислотами.
Оксиды, которые взаимодействуют с КИСЛОТАМИ с образованием соли и воды, называются ОСНОВНЫМИ ОКСИДАМИ.
Поскольку основные оксиды - ближайшие родственники оснований - с ними кислоты также вступают в реакции нейтрализации:
Кислота оксид соль вода
2 HCl + CaО= CaCl2+ H2O
2 H3PO4+ Fe2O3 = 2 FePO4 + 3H2O
Как и в случае реакций с основаниями, с основными оксидами кислоты образуют соль и воду. Соль содержит кислотный остаток той кислоты, которая использовалась в реакции нейтрализации.
Например, фосфорную кислоту используют для очистки железа от ржавчины (оксидов железа). Фосфорная кислота, убирая с поверхности металла его оксид, с самим железом реагирует очень медленно. Оксид железа превращается в растворимую соль FePO4, которую смывают водой вместе с остатками кислоты.
Последовательность выполнения работы:
1. В пробирку с черным порошком оксида меди добавьте 1 мл серной кислоты и немного подогрейте в пламени спиртовки.
2. Опишите наблюдаемое явление. Записи внесите в таблицу по форме:
Что делали
Что наблюдали
Уравнения реакций
Вывод
3. Сформулируйте вывод.
Контрольные вопросы:
1. Какое вещество всегда образуется в реакциях кислот с оксидами металлов?
2. Какое практической применение нашли реакции между основными оксидами и кислотами?
Список литературы
Габриэлян О.С., Остроумов И.Г. Химия для профессий и специальностей технического профиля. М. Издательский центр «Академия». 2011
Лабораторная работа №13
Тема:Взаимодействие металлов с солями
Цель:изучить характер взаимодействия металлов с солями
Оборудование: пробирка с раствором сульфата меди, гранула цинка
Краткие теоретические сведения
Соли взаимодействуют с металлами, если свободный металл находится левее металла в составе соли в электрохимическом ряде активности металлов:
Активные металлы вытесняют из солей менее активные. В ряду напряжений металлы расположены в порядке убывания активности:
Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
Последовательность расположения металлов в порядке изменения их химической активности и процессы взаимного вытеснения металлов из растворов и их поверхностное осаждение (например, вытеснение серебра и меди из растворов их солей железом)в общих чертах была известна уже алхимикам. Определенный вклад в изучение этих процессов внес русский ученый Н.Н. Бекетов.
Так как эти реакции протекают в водных растворах, для опытов нельзя применять такие металлы как литий, натрий, калий, барий и другие активные металлы, которые при обычных условиях реагируют с водой.
Если в колбу с раствором сульфата меди II (CuSO4) опустить гранулы цинка Zn, то раствор в колбе начнёт менять цвет. По истечении часа раствор полностью изменит цвет, значит, сульфата меди там совсем не осталось. Активный металл цинк заместил медь в сульфате и образовал новую соль. На цинке медь выделилась в виде рыхлой бурой массы. При этом цинк окислился, а медь восстановилась.
Последовательность выполнения работы:
1. В пробирку с сульфатом меди опустите гранулу цинка.
2. Опишите наблюдаемое явление. Записи внесите в таблицу по форме:
Что делали
Что наблюдали
Уравнения реакций
Вывод
3. Сформулируйте вывод.
Контрольные вопросы:
1. К какому типу относится данная реакция?
2. Составьте уравнение взаимодействия хлорида меди с железом.
Список литературы
Габриэлян О.С., Остроумов И.Г. Химия для профессий и специальностей технического профиля. М. Издательский центр «Академия». 2011
Лабораторная работа №14
Тема:Исследование свойств неметаллов
Цель:исследовать некоторые свойства неметаллов.
Оборудование:пробирки с: графитом, красным фосфором (кусочек намазки спичечного коробка), серой; 3 пустые пробирки, колба с водой.
Краткие теоретические сведения
Неметаллы - химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее. Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов.
При обычной температуре неметаллы могут быть в разном агрегатном состоянии - твердые - S -сера, P-фосфор,I -иод, C-алмаз и графит; жидкие - Br-бром; газообразные- O2-кислород , H2 - водород, N2- азот , Cl2-хлор, F2-фтор.
Многие не проводят электрический ток (кроме графита и кремния), не проводят тепло. В твердом состоянии неметаллы - хрупкие, не имеют металлического блеска
( кроме иода-I2 , графита-C и кремния Si). Цвет охватывает все цвета спектра(красный-красный фосфор, желтый - сера, зеленый - хлор, фиолетовый - пары йода).
Tемператураплавления изменяется в огромном интервале tпл(N2)= -2100C , а tпл(Алмаз) =37300С
Многие неметаллы образуют аллотропые модификации(т.е.формы). Способность атомов одного химического элемента образовывать несколько простых веществ называется аллотропией, а эти простые вещества - аллотропными видоизменениями, или модификациями. Причина аллотропии - строение молекулы или строение кристаллической решетки
В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты.
Неметаллы существенно различаются по распространённости в земной различаются. Наиболее распространёнными являются кислород, кремний и водород, к редким относятся мышьяк, селен, йод.
Химические элементы-неметаллы могут проявлять как окислительные, так и
восстановительные свойства, в зависимости от химического превращения, в котором они принимают участие. Атомы самого электроотрицательного элемента - фтора - не способны отдавать электроны, он всегда проявляет только окислительные свойства, другие элементы могут проявлять и восстановительные свойства, хотя намного в меньшей степени, чем металлы. Наиболее сильными окислителями являются фтор, кислород и хлор, преимущественно восстановительные свойства проявляют водород, бор, углерод, кремний, фосфор, мышьяк и теллур. Промежуточные окислительно-восстановительные свойства имеют азот, сера, йод.
С водородом неметаллы образуют летучие соединения, как, например, фтороводород HF, сероводород H2S, аммиак NH3, метан CH4. При растворении в воде водородные соединения галогенов, серы, селена и теллура образуют кислоты той же формулы, что и сами водородные соединения: HF, HCl, HCl, HBr, HI, H2S, H2Se, H2Te.
С кислородом неметаллы образуют кислотные оксиды. В одних оксидах они проявляют максимальную степень окисления, равную номеру группы (например, SO2, N2O5), а других - более низкую (например, SO2, N2O3). Кислотным оксидам соответствуют кислоты, причем из двух кислородных кислот одного неметалла сильнее та, в которой он проявляет более высокую степень окисления. Например, азотная кислота HNO3 сильнее азотистой HNO2, а серная кислотаH2SO4 сильнее сернистой H2SO3.
Неметаллы могут при определенных условиях реагировать между собой.
Последовательность выполнения работы:
1. Рассмотрите выданные образцы неметаллов, опишите их свойства,внеся записи
в таблицу по форме:
Название, формула
Агрегатное состояние
Цвет
Запах
Растворимость в воде
3. Сформулируйте вывод.
Контрольные вопросы:
1. Перечислите отличия свойств неметаллов и металлов
Список литературы
Габриэлян О.С., Остроумов И.Г. Химия для профессий и специальностей технического профиля. М. Издательский центр «Академия». 2011
Практическая работа №2
Тема: «Получение, собирание ираспознавание газов»
Цель: изучить процессы и химизм получения газов на примере водорода, кислорода и углекислого газа.
Оборудование:цинк в гранулах, раствор соляной кислоты, мел, раствор пероксида водорода, оксид марганца (II); пробирки, спиртовка, лучинка
Краткие теоретические сведения
Строение газообразных веществ отличается от строения веществ в твердом и жидком состояниях. Газы не имеют собственной формы и расширяются до тех пор, пока не заполнят весь сосуд принимая его форму, по этой же причине газы не имеют собственного объема. Объем газа определяется объемам сосуда. Газ оказывает на стенки сосуда одинаковое во всех направлениях давления. Газы легко сжимаются. Благодаря большому расстоянию между молекулами газы смешиваются друг с другом в любом отношении. Основные газы получаемые и используемые в лабораториях это водород, кислород, углекислый газ.
Лабораторные способы получения этих газов:
Водород получают в аппарате Киппа, при взаимодействии соляной кислоты и металлического цинка (в гранулах) - при комнатной температуре:
Zn + 2HCl = ZnCl2 + H2
Оксид углерода (IV) = углекислый газ можно получить, действуя соляной или разбавленной серной кислотой на мрамор (основное вещество - карбонат кальция) или другой карбонат (при комнатной температуре). Сильная кислота (серная или соляная) будет вытеснять слабую угольную кислоту из её солей; угольная кислота нестойкая, поэтому практически сразу разлагается на углекислый газ и воду:
СаСО3 + 2HCl = CaCl2 + CO2 + H2O
Можно получить углекислый газ, сжигая лучину, бумагу или кусочек угля.
Кислород можно получить разложением при нагревании бертолетовой соли или лучше перманганата калия:
2KClO3 = 2KCl + 3O2 (есть опасность взрыва)
2KMnO4 = K2MnO4 + MnO2 + O2
Собирание газов
В устройстве аппарата Киппа предусмотрена газоотводная трубка с краником; для получения углекислого газа и кислорода реактивы помещают в пробирку и закрывают её пробкой с газоотводной трубкой. Пробирку с перманганатом калия закрепляют в штативе и нагревают пламенем спиртовки.
Водород легче воздуха, поэтому его собирают над воздухом, в перевёрнутую пробирку. Кислород и углекислый газ тяжелее воздуха, поэтому их можно собирать вытеснением воздуха, опустив газоотводную трубку на дно пробирки. Кислород, кроме того, малорастворим в воде, поэтому его можно также собирать над водой, в перевёрнутую пробирку (этот способ лучше, т.к. разница молярных масс кислорода (32 г/моль) и воздуха (29 г/моль) невелика).
Чтобы распознать эти газы, нужно знать их свойства.
Так, кислород поддерживает горение - опущенная в пробирку с кислородом тлеющая лучинка начинает ярко гореть; углекислый газ не поддерживает горение - горящая лучинка, опущенная в пробирку с углекислым газом, гаснет.
Углекислый газ, кроме того, мутит известковую воду: при его взаимодействии с гидроксидом кальция ("известковой водой") образуется нерастворимый в воде осадок карбоната кальция:
Са(ОН)2 + СО2 = СаСО3 + Н2О
Чистый водород сгораетс легким звуком «пах», водород с примесью воздуха взрывоопасен «гремучий газ» и в небольшом количестве сгорает с резким лающим звуком.
Последовательность выполнения работы:
Внимание:Записи о наблюдаемых явлениях по всем опытам внесите в таблицу по форме:
Что делали
Что наблюдали
Уравнения реакций
Вывод
Выполните следующие опыты:
Опыт №1.«Получение, собирание и распознавание водорода».
1. В пробирку поместить две гранулы цинка.
2. Прилить 2 мл раствора соляной кислоты. Что наблюдаете? Запишите уравнение реакции с точки зрения окислительно-восстановительного процесса.
3. Накрыть пробирку-реактор пробиркой большего диаметра.
4. Через 4 минуты поднимите большую пробирку и, не переворачивая, поднесите её к пламени спиртовки. Что наблюдаете? Запишите уравнение реакции. Что можете сказать о «чистоте» собранного водорода?
5. Сформулируйте вывод.
Опыт №2.«Получение, собирание и распознавание кислорода».
1. В пробирку прилить 5 мл раствора пероксида водорода.
2. Подготовьте тлеющую лучину.
3. Добавьте в пробирку несколько крупинок оксида марганца (IV). Что наблюдаете? Запишите уравнение реакции с точки зрения окислительно-восстановительного процесса.
4. Внесите тлеющую лучину в пробирку с раствором пероксида водорода. Что наблюдаете? Запишите уравнение реакции.
5. Сформулируйте вывод.
Опыт №3. «Получение, собирание и распознавание углекислого газа».
1. В пробирку поместить кусочек мела.
2. Прилить к мрамору 4 мл.раствора уксусной кислоты. Что наблюдаете? Запишите уравнение химической реакции в молекулярной и ионной форме.
3. Зажгите лучину.
4. Внесите горящую лучину в пробирку-реактор. Что наблюдаете?
5. Сформулируйте вывод.
Контрольные вопросы:
1. Почему водород собирают в перевернутую пробирку?
2. Если через раствор известковой воды посредством стеклянной трубки продувать выдыхаемый воздух, то через некоторое время известковая вода помутнеет. Почему?
3. Какое свойство углекислого газа лежит в основе его применения в углекислотном огнетушителе.
Список литературы
Габриэлян О.С., Остроумов И.Г. Химия для профессий и специальностей технического профиля. М. Издательский центр «Академия». 2011
Практическая работа №3
Тема:«Решение экспериментальных задач по теме
«Металлы и неметаллы».
Цель: применение знаний о химических свойствах и способах получения соединений металлов и неметаллов для решения экспериментальных задач.
Оборудование:в пробирках под номерами 1,2 и 3 кристаллические вещества: нитрат бария, сульфат натрия и карбонат кальция, сульфат железа (II), хлорида меди, гидроксид натрия,гексациано-феррат (III) калия, роданид калия, серная кислота, хлорид бария
Краткие теоретические сведения
Распознавание веществ производится с помощью качественных реакций.
Качественные реакции - это химические реакции, с помощью которых можно определить то, чем одно вещество отличается от другого по элементарному составу, иначе говоря, эти реакции позволяют определить отдельные ионы или молекулы, из которых состоит исследуемое вещество или смесь веществ. В качественном анализе применяют реакции, сопровождающиеся каким-либо эффектом, который можно легко обнаружить органами чувств:
-
Изменение окраски раствора;
-
Выпадение или растворение осадка;
-
Выделение газов (иногда обладающих характерным запахом)
В таблице приведены некоторые из качественных реакций.
Катион
Воздействие или реактив
Наблюдаемая реакция
Na+
Пламя
Желтое окрашивание
К+
Пламя
Фиолетовое окрашивание
Са2+
Пламя
Кирпично-красное окрашивание
Аg+
хлорид
Выпадение белого осадка
Fe2+
гексациано-феррат (III) калия (красная кровяная соль)
Выпадение синего осадка
Fe3+
роданид
Красное окрашивание
Анион
Воздействие или реактив
Наблюдаемая реакция
S042-
соль бария
Выпадение белого осадка
СО32-
кислота
вскипание или пузырьки газа
Cl-
ионы Аg+
Выпадение белого осадка, не растворимого в HN03
Для выполнения опытов отбирается проба (небольшое количество вещества помещается в чистую пробирку) и исследуется реактивом.
Последовательность выполнения работы:
Внимание:Записи о наблюдаемых явлениях по всем опытам внесите в таблицу по форме:
Что делали
Что наблюдали
Уравнения реакций
Вывод
Решите следующие экспериментальные задачи:
1.В выданных трех пробирках под номерами 1,2 и 3 находятся кристаллические вещества: нитрат бария, сульфат натрия и карбонат кальция.
Опытным путем определите, в какой пробирке находится каждое из веществ.
2. Докажите опытным путем, что выданный образец сульфата железа (II) содержит примесь ионов железа (III).
3. Получите оксид меди, исходя из хлорида меди.
Контрольные вопросы:
1.В каких случаях проводятся качественные реакции?
2. О чем свидетельствует выпадение белого осадка в реакции между хлоридом натрия и нитратом серебра?
Список литературы
Габриэлян О.С., Остроумов И.Г. Химия для профессий и специальностей технического профиля. М. Издательский центр «Академия». 2011