- Преподавателю
- Химия
- Алгоэвристическая программа по химии по теме Галогены
Алгоэвристическая программа по химии по теме Галогены
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Цебрик Л.А. |
| Дата | 28.12.2014 |
| Формат | docx |
| Изображения | Есть |
Алгоэвристическая программа для самостоятельного изучения учащимися темы «Галогены»
Cl
F
F
Br
At
IМы изучим непременно,
Элементы галогены
(А по-русски - солероды),
Все от фтора и до йода.
Даже новенький астат
Быть в семействе этом рад.
Тема урока: Галогены.
- В одно время галогены называли солеродами. Почему такое название дано этим веществам? Как это название соотносится с названием поваренной соли?
В 1811 г. И.К.Швейгер предложил химикам называть эти элементы галогенами («галос» - соль, «генес» - рождаю).
- Как вы думаете с чего необходимо начинать изучение любых химических элементов?
-
Характеристика химического элемента.
Заполни таблицу.
1.Положение в периодической системе Д.И.Менделеева.
символ
Название элемента
№ периода
№ группы
Ar
F
Cl
I
At
2. Строение (схема электронного строения) и свойства
символ
Число е на внеш.слое
Число эл.слоев
R атома
неМе
ЭО
Окислительная способность
F
Cl
I
At
- Что общего в строении всех атомов галогенов?
- Чем отличаются атомы галогенов по строению?
- Почему возрастает атомный радиус в группе?
- Какие возможные степени окисления могут быть у галогенов?
- Почему фтор является самым электроотрицательным элементом?
Вставь пропущенные по смыслу слова.
В подгруппе сверху вниз заряд ядра _________________, общее количество электронов в атоме_____________, количество электронов на последнем уровне ____________.
Окислительные свойства _____________________.
Угадай элемент!
-
Открытие данного вещества произошло в 1826г. Антуаном Баларом, двадцатичетырехлетним лаборантом химии.
-
Пары этого вещества очень ядовиты.
-
Его соединения применяют в фотографии в качестве светочувствительного вещества.
-
Многие соединения обладают успокоительным действием
2.Физические свойства
Заполни таблицу
Формулы простых веществ
Агрегатное состояние
Цвет
Запах
Растворимость в воде
t0
плав.
t0
кип.
- Какую закономерность вы выявили при изменении агрегатного состояния и цвета веществ?
- Какова закономерность при изменении температур плавления и кипения?
Угадай элемент!
-
Данное вещество впервые было получено шведским химиком К. Шееле в 1774 г.
-
Во время первой мировой войны это вещество применяли в качестве боевого отравляющего средства. При содержании этого вещества в воздухе количеством 0,9 мл/л смерть наступает в течении пяти минут.
-
Его слабый запах можно ощущать в водопроводной воде (им об еззараживают воду) и при применении отбеливателя
3.Химические свойства
Взаимодействие с металлами
С хлором непосредственно могут соединяться все металлы. Если металлы могут иметь различную степень окисления, то при реакции с хлором они обычно проявляют высшую:
Cu0+Cl20 =Cu+2 Cl2 -1
Запишите уравнения реакций хлора с металлами.
Вывод: галогены _________ в реакции с металлами.
Взаимодействие с водородом
H2 + F2 = 2HF + Q (со взрывом)
H2 + Cl2 = 2HCl + Q (на свету)
H2 + Br2 = 2HBr + Q
H2 + I2 = 2HI - Q
- Что можно сказать о скорости химических реакций? Какой фактор химической реакции оказывает влияние на скорость?
Угадай элемент!В 1811г. Б.Куртуа, сыном известного селитровара, из золы морских водорослей было получено это вещество.
-
Молекулы этого вещества обладают уникальной способностью проникать в организм даже через неповрежденную кожу. Поэтому спиртовую настойку этого вещества применяют для лечения внутрикожных воспалений.
-
Каждый пользовался спиртовой настойкой этого вещества как кровоостанавливающим и обеззараживающим средством
Взаимодействие с солями
Хлор хвалился: "Нет мне равных!",
Галоген я самый главный.
Зря болтать я не люблю:
Все на свете отбелю!"
Йод своей красой гордился,
Твердым был, но испарился.
Фиолетовый, как ночь,
Далеко умчался прочь.
Бром разлился океаном,
хоть зловонным, но - румяным,
Бил себя он грозно в грудь:
"Я ведь бром! Не кто-нибудь…".
Фтор молчал и думал: "Эх!..
Ведь приду - окислю всех …."
Помогите им решить их спор.
Выполнение эксперимента.
Правила по ТБ:
1. Наливать небольшие количества реактивов, не более 1 мл.
2. Запах определять, направляя ладонью к себе поток воздуха.
Экспериментальная работа "Окислительные свойства галогенов"
Порядок выполнения:
1. В пробирки налейте небольшое количество иодида натрия и бромида натрия.
2. Добавьте хлорную воду и крахмал.
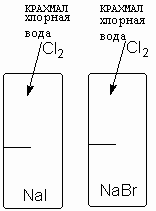
3. Опишите наблюдаемые явления.
4. Запишите уравнения реакции и составьте СЭБ.
NaI + Cl2 -> …….
NaBr + CL2 -> ……
5. Сделайте вывод._________________________________________________________
Учитель:
- А как же будет фтор проявлять себя в растворах солей?
Наиболее активные галогены вытесняют из растворов солей менее активные галогены.
Окислительная способность галогенов снижается в ряду Cl2 - Br2 - I2
Наиболее активные галогены вытесняют из растворов солей менее активные галогены.
- Почему для фтора эта реакция нехарактерна?
Фтор взаимодействует с водой, вытесняя из нее кислород.
2F2 + 2H2O = 4HF + O2
Какие образуются вещества в реакции?
NaCl+ F2 =
KBr +F2 =
NaI + F2 =
(Значит самый главный и важный галоген - фтор, затем хлор, бром и йод).
Сделайте вывод:_________________________________________________________
Угадай элемент!
-
В свободном состоянии это очень ядовитый газ. Некоторые ученые, когда получали и изучали его свойства, поплатились своим здоровьем.
-
В 1886 году А. Муассан (Нобелевская премия) впервые получил это вещество в свободном состоянии
-
Этот химический элемент входит в состав костной ткани и зубной эмали.
-
Его соединения добавляют в зубную пасту


