- Преподавателю
- Химия
- МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ К ПРАКТИЧЕСКИМ ЗАНЯТИЯМ ПО ДИСЦИПЛИНЕ «ХИМИЯ» ДЛЯ ОБУЧАЮЩИХСЯ УЧРЕЖДЕНИЙ СРЕДНЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ К ПРАКТИЧЕСКИМ ЗАНЯТИЯМ ПО ДИСЦИПЛИНЕ «ХИМИЯ» ДЛЯ ОБУЧАЮЩИХСЯ УЧРЕЖДЕНИЙ СРЕДНЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Шарикова А.В. |
| Дата | 16.10.2014 |
| Формат | doc |
| Изображения | Есть |
Государственное автономное образовательное учреждение дополнительного профессионального образования
«Институт развития образования и социальных технологий»
Государственное бюджетное профессиональное образовательное учреждение
«Курганский промышленный техникум»
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ К ПРАКТИЧЕСКИМ ЗАНЯТИЯМ
ПО ДИСЦИПЛИНЕ «ХИМИЯ»
ДЛЯ ОБУЧАЮЩИХСЯ УЧРЕЖДЕНИЙ
СРЕДНЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
Курган 2014
Методические указания к практическим занятиям по дисциплине «Химия» для обучающихся учреждений среднего профессионального образования / авт.-сост.: А.В. Шарикова. - Курган, 2014 - 45 с.
Автор - составитель:
Шарикова Александра Валерьевна - преподаватель химии ГБПОУ «Курганский промышленный техникум»
Рецензенты:
Гальцева Е.Н.- заместитель директора ГБПОУ «Курганский промышленный техникум» по методической работе
Войткевич Н.Н. - проректор по учебной работе ГАОУ ДПО ИРОСТ, к.п.н.
Данное учебно-методическое издание предназначено для оказания помощи обучающимся СПО при выполнении практических занятий по всему курсу дисциплины «Химия». В заданиях для практических занятий изложено четкое описание алгоритма выполнения работы, дан перечень используемого оснащения, список литературы, раскрыты основные теоретические сведения, предложены контрольные вопросы.
© Шарикова А.В. 2014
©Институт развития образования и социальных технологий, 2014
Введение
Методические указания к практическим занятиям по дисциплине «Химия разработаны для обучающихся учреждений среднего профессионального образования.
Целью заданий для практических занятий является оказание помощи обучающимся в изучении и закреплении теоретических знаний по химии, выполнении эксперимента самостоятельно или на занятиях
При выполнении заданий на практических занятиях обучающиеся должны:
Знать:
-
важнейшие химические понятия;
-
классификацию и номенклатуру органических и неорганических веществ;
-
вещества и материалы, используемые в практике;
-
основные приемы работы с оборудованием;
-
правила техники безопасности;
-
химическую посуду и оборудование.
Уметь:
-
называть вещества по «тривиальной» и международной номенклатуре»;
-
определять валентность и степень окисления элементов, пространственное строение молекул, окислитель и восстановитель, изомеры и гомологи, принадлежность веществ к различным классам соединений;
-
выполнять химический эксперимент по распознаванию важнейших неорганических и органических веществ; получению конкретных веществ;
-
пользоваться химическим оборудованием.
Владеть навыками:
-
обращения с посудой, лабораторными принадлежностями; с веществами;
-
сборки приборов из готовых деталей и испытания их на герметичность;
-
проведения химических операций;
-
распознавания изученных веществ по физическим свойствам и характерным реакциям;
-
получения веществ;
-
организации самостоятельной работы.
К практическим занятиям допускаются обучающиеся, прошедшие инструктаж по технике безопасности.
Инструкция по технике безопасности при выполнении заданий на практических занятиях
-
Общие требования безопасности
Работа в химической лаборатории связана с некоторой опасностью, поскольку многие вещества в той или иной степени ядовиты, огнеопасны и взрывоопасны.
Характер предупредительных мер, обеспечивающих безопасность проведения эксперимента, зависит от вида работы. Однако существуют общие правила, выполнение которых обязательно для каждого работающего в лаборатории, независимо от того, какой эксперимент он проводит.
-
Работать одному в лаборатории категорически запрещается.
-
Во время работы в лаборатории необходимо соблюдать чистоту, тишину, порядок и правила техники безопасности.
-
Каждый работающий должен знать, где находятся в лаборатории средства противопожарной защиты и аптечка.
-
Категорически запрещается в лаборатории курить, принимать пищу, пить воду.
-
Нельзя приступать к работе, не усвоив всей техники ее выполнения.
-
Опыты нужно проводить только в чистой химической посуде. После окончания эксперимента посуду сразу же следует помыть.
-
В процессе работы необходимо соблюдать чистоту и аккуратность, следить, чтобы вещества не попадали на кожу лица и рук.
-
Вещества в лаборатории нельзя пробовать на вкус. Нюхать вещества можно, лишь осторожно направляя на себя пары или газы легким движением руки, а не наклоняясь к сосуду и не вдыхая полной грудью.
-
На любой посуде, где хранятся реактивы, должны быть этикетки с указанием названия веществ.
-
Сосуды с веществами или растворами необходимо брать одной рукой за горлышко, а другой снизу поддерживать за дно.
-
Категорически запрещается затягивать ртом в пипетки органические вещества и их растовры.
-
Во время нагревания жидких и твердых веществ в пробирках и колбах нельзя направлять отверстия на себя и соседей. Нельзя заглядывать сверху в открыто нагреваемые сосуды.
-
После окончания работы необходимо выключить воду и электричество.
-
Категорически запрещается выливать в раковину концентрированные растворы кислот и щелочей, а также различные органические растворители, сильно пахнущие и огнеопасные вещества. Все отходы необходимо сливать в специальные бутыли.
-
В каждой лаборатории обязательно должны быть защитные маски и очки.
-
В каждом помещении лаборатории необходимо иметь средства противопожарной защиты: ящик с просеянным песком и совком для него, противопожарное одеяло, заряженные огнетушители.
-
При работе в лаборатории необходимо применять индивидуальные средства защиты, а также соблюдать средства личной гигиены.
2. Требования безопасности перед началом работы
1. Проверить исправность и работу вентиляции вытяжного шкафа.
2. Тщательно проветрить помещение кабинета и лаборантской.
3. Надеть спецодежду. При работе с токсичными и агрессивными веществами подготовить к использованию средства индивидуальной защиты.
4. Подготовить к работе необходимое оборудование, лабораторную посуду, реактивы, приборы.
3. Требования безопасности во время работы
1. Во время работы в кабинете химии необходимо соблюдать чистоту, тишину и порядок на рабочем месте.
2. Запрещается пробовать на вкус любые вещества. Нюхать вещества можно, лишь осторожно направляя на себя пары или газы легким движением руки, а не наклоняясь к сосуду и не вдыхая полной грудью.
3. В прцессе работы необходимо следить, чтобы вещества не попадали на кожу лица и рук.
4.Опыты нужно проводить только в чистой посуде.
5. На любой посуде, где хранятся реактивы, должны быть этикетки с указанием названия веществ. Запрещается хранить реактивы в емкостях без этикеток или с надписями, сделанными карандашом по стеклу, растворы щелочей - в склянках с притертыми пробками, а легковоспламеняющиеся и горючие жидкости - в сосудах из полимерных материалов.
6. Сосуды с веществами или растворами необходимо брать одной рукой за горлышко, а другой снизу поддерживать за дно.
7. Растворы необходимо наливать из сосудов так, чтобы при наклоне этикетка оказывалась сверху. Каплю, оставшуюся на горлышке сосуда, снимают верхним краем той посуды, куда наливается жидкость.
8. При пользовании пипеткой категорически запрещается втягивать жидкость ртом.
9. Твердые сыпучие реактивы разрешается брать из склянок только с помщью совочков, ложечек, шпателей, пробирок.
10. Во время нагревания жидких и твердых веществ в пробирках и колбах нельзя направлять отверстия на себя и соседей. Нельзя заглядывать сверху в открыто нагреваемые сосуды.
11. Категорически запрещается выливать в раковину концентрированные растворы кислот и щелочей, а ткже различные органические растворители, сильно пахнущие и огнеопасные вещества. Все отходы необходимо сливать в специальную стеклянную тару емкостью не менее 3 л с крышкой ( для последующего обезвреживания).
12. Запрещается использовать в работе самодельные приборы и нагревательные приборы с открытой спералью.
13. Не допускается совместное хранение реактивов, отличающихся по химической природе.
4. Требования безопасности после окончания работы
1. Привести в порядок рабочее место, убрать все химические реактивы на свои места в лаборансткую в специальные шкафы и сейфы.
2. Отработанные растворы реактивов слить в специальную стеклянную тару с крышкой, емкостью не менее 3 л.
3. Выключить вентиляцию вытяжного шкафа.
4. Снять спецодежду и средства индивидуальной защиты.
5. Тщательно вымыть руки с мылом.
6. Тщательно проветрить помещение кабинета химии и лаборантской.
5. Требования безопасности в аварийных ситуациях.
1. В случаях с разбитой лабораторной посудой, не собирать ее осколки незащищенными руками, а использовать для этого щетку и совок.
-
Уборку разлитых и рассыпанных реактивов производить, руководствуясь
требованиями инструкции по безопасной работе с соответсвующими химическим реактивами.
-
В случае с разлитой легковоспламеняющейся жидкостью и ее загоранием, немедленно сообщить в ближайшую пожарную часть и приступить к тушению очага возгорания первичными средствами пожаротушения.
-
При получении травмы немедленно оказать первую помощь пострадавшему, сообщить об этом администрации техникума, при необходимости отправить пострадавшего в ближайшее лечебное учреждение.
Практическое занятие № 1
Тема: Изготовление моделей молекул органических соединений
Цель занятия: научиться составлять формулы углеводородов предельного и непредельного строения, их гомологов и изомеров.
Задачи:
1. Развивать представления о шаростержневых и объемных моделях органических соединений различных классов.
2. Закрепить умения, подтверждающие теоретические знания
Оснащение (наглядный материал): набор цветных шаров и стержней (пластмасса) для моделирования, таблицы «Метан», «Алкины», «Цикланы».
Рекомендуемая литература
1. Габриелян, О.С. Химия, 10 класс. Базовый уровень /О.С. Габриелян. - М.: Дрофа, 2010.
-
Теоретическое введение
Основные положения теории строения органических соединений А.М.Бутлерова (1861)
1. Атомы в молекулах органических соединений находятся не в беспорядке, а в определенной последовательности в соответствии с валентностью.
2. Свойства веществ зависят не только от качественного и количественного состава, но и от взаимного расположения атомов, т. е. химической структуры веществ.
3. Зная свойства вещества, можно предсказать структуру этого вещества.
4. Зная структуру вещества, можно предсказать свойства этого вещества.
5. Атомы и группы атомов в молекулах веществ оказывают друг на друга взаимное влияние.
Изомеры - вещества одинакового молекулярного состава (одинаковая молекулярная формула), но различной структуры. Изомеры обладают разными свойствами:
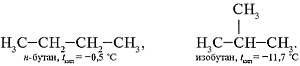
Особенности электронной структуры атомов углерода
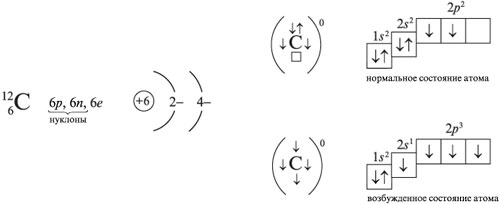
В органических соединениях атомы углерода находятся в возбужденном состоянии (2s12p3). Валентность углерода равна IV, т. е. атом углерода способен образовать четыре ковалентные связи.
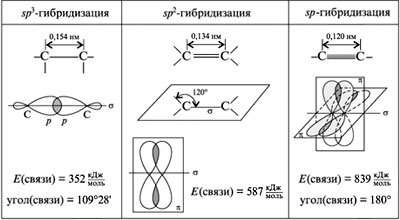
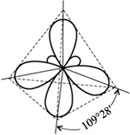
За счет взаимного выравнивания s- и р-электронных облаков в атоме углерода образуются одинаковые электронные облака гантелеобразной формы, оси которых располагаются под углом 109°28'.

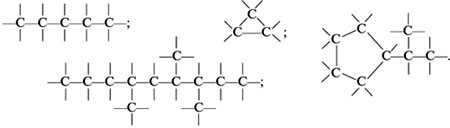
Атомы углерода способны соединяться друг с другом, образуя цепи и циклы:
Ковалентные связи между атомами углерода образуются за счет перекрывания электронных облаков трех видов гибридизации - sp3, sp2 и sp.
НОМЕНКЛАТУРА. В настоящее время для точного обозначения состава и строения органических соединений используют рациональную и систематическую номенклатуры.
Рациональная номенклатура рассматривает предельные углеводороды как производные метана, в котором один или несколько атомов Н замещены на углеводородные радикалы. В структурной формуле выбирают тот углеродный атом, у которого больше заместителей (радикалов). Радикалы перечисляют в порядке усложнения (если имеется несколько одинаковых радикалов, перед их названием ставятся греческие числительные: «ди-» - два, «три-» - три, «тетра-» - четыре, «пента-» - пять, «гекса-» - шесть и т. д.).
Чем сложнее формула вещества, тем труднее (а иногда и невозможно) его назвать по рациональной номенклатуре. Поэтому в 1892 г. в Женеве была принята женевская номенклатура, а с 1947 г. выработана систематическая международная номенклатура «ИЮПАК» (IUPAC - краткое название Международного союза теоретической и прикладной химии). Современная систематическая номенклатура в основном соответствует женевской, но с упрощениями.
При названии по систематической номенклатуре выбирают наиболее длинную углеродную цепь и нумеруют атомы С, начиная с того конца, к которому ближе расположен радикал (заместитель). Затем называют номер атома С, с которым связан заместитель, и через дефис - сам заместитель. В конце пишут название углеводорода, которому соответствует длинная цепь. Если в боковой цепи одинаковый радикал встречается неоднократно, перед его названием ставят «ди-», «три-», «тетра-» и т. д. (число радикалов), а положение каждого обозначают цифрами. Радикалы называют в алфавитном порядке. Например:
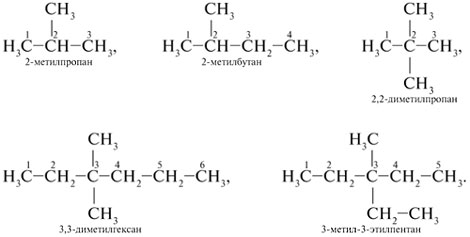
-
Практические задания
Задание 1. Соберите шаростержневую модель молекулы алкана линейного строения, содержащего 5 атомов углерода. Запишите формулу в тетрадь. Назовите вещество.
-
Составьте модели 2-х изомеров данного вещества. Запишите формулы в тетрадь.
-
Назовите вещества.
-
Составьте модели предыдущего и последующего гомологов пентана. Запишите
-
формулы в тетрадь. Назовите вещества.
Задание 2. Соберите шаростержневую модель молекулы алкина линейного строения, содержащего 5 атомов углерода. Запишите формулу в тетрадь. Назовите вещество
Составьте модель изомера цепи для данного вещества. Запишите формулу в тетрадь. Назовите вещество.
Составьте модель изомера положения кратных связей. Запишите формулу в тетрадь. Назовите вещество.
Составьте модель межклассового изомера. Запишите формулу в тетрадь. Назовите вещество.
-
Оформление отчета
№ п/п
Структурная формула вещества
Название вещества
1
1.1
1.2
2.
2.1
2.2
2.3
4. Контрольные вопросы.
1. Какие основные положения теории А.М.Бутлерова вы использовали при изготовлении моделей алканов, алкенов?
2. Почему для изготовления моделей молекул используются шарики атомов раззличных размеров и цветов?
3. В чем преимущества и недостатки шаростерженевых и объемных молекул.
Практическое занятие № 2
Тема: Определение качественного состава углеводородов
Цель занятия: определить опытным путем состав выданного образца органического вещества (парафина, вазелина)
Задачи:
-
Научиться опытным путем определять или подтверждать качественный состав углеводородов.
-
Совершенствовать умения проводить в соответствии с заданием химический эксперимент; наблюдать признаки химических реакций; достигать планируемого результата, оформлять очет о выполненной практической работе
Оснащение (наглядный материал): фарфоровая чашка; парафиновая свеча; предметное стекло; тигельные щипцы; химический стакан.
Рекомендуемая литература
1. Габриелян, О.С. Химия, 10 класс. Базовый уровень /О.С. Габриелян. - М.: Дрофа, 2010.
-
Теоретическое введение
Качественный анализ органического вещества сводится к определению содержания в нем тех или иных элементов. После разрушения молекулы ее атомы образуют характерные минеральные соединения, открываемые обычными качественными реакциями.
О наличии углерода можно судить по обугливанию органических веществ при нагревании. Более общим методом определения С и Н является окисление органического вещества оксидом меди(II) (сжигание с СuO). При этом углерод окисляется до СО2 (обнаружение известковой Са(ОН)2 или баритовой Ba(OH)2 водой по помутнению, а водород образует воду, которая с безводным сульфатом меди(II) дает кристаллогидрат CuSO4•5H2O голубого цвета).
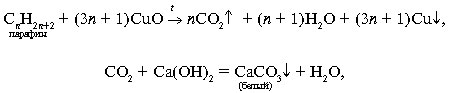
-
Практические задания
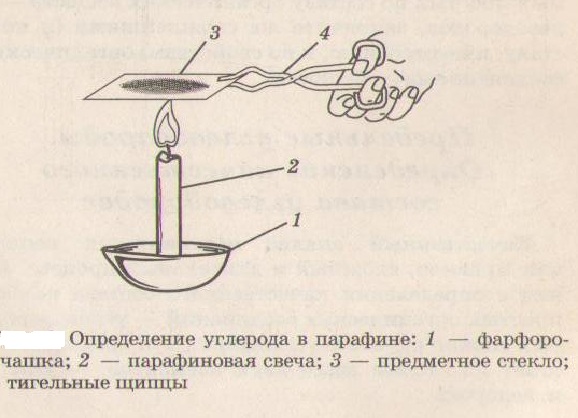
Опыт 1. Определение углерода в составе парафина.
Внесите в пламя свечи, удерживая тигельными щипцами, фарфоровую чащечку или предметное стекло. Запишите свои наблюдения.
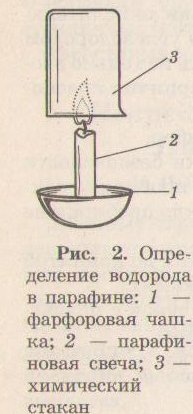
Опыт 2. Определение водорода в составе парафина. Накройте пламя свечи чистым сухим химическим стаканом. Что наблюдаете? Сделайте вывод.
-
Оформление отчета
Что делали (название опыта, рисунок с пояснениями)
Что наблюдали (признаки и условия проводимых реакций, уравнения химических реакций)
Выводы
4. Контрольные вопросы.
1. Какие продукты реакции подтверждают наличие углерода и водорода в составе исследуемого углеводорода.
Практическое занятие № 3
Тема: Получение этилена и изучение его свойств
Цель занятия: освоить лабораторный способ получения этилена и изучить его свойства.
Задачи:
1. Научиться получать в лаборатории этилен и проводить качественные реакции на непредельные углеводороды этиленового ряда.
2. Совершенствовать умения получать газообразные вещества в простейших приборах, соблюдая правила безопасности.
Оснащение (наглядный материал): прибор для получения и собирания нерастворимых газов, жидкостной термометр (до 200 °С) в пробке реактора (пробирки или колбы), хлоркальциевая трубка с натронной известью (для улавливания SO2), штатив железный с лотком, лучина, кристаллизатор с водой, щипцы тигельные, спиртовка, спички, крышка тигля, штатив с пробирками, санитарная склянка; этанол С2Н5ОН, H2SO4 (конц.), пемза, пористый фарфор или песок (мелкозернистый), растворы Br2 (бромная вода), Na2CO3 или NaНCO3, KMnO4, дистиллированная вода.
Рекомендуемая литература
1. Габриелян, О.С. Химия, 10 класс. Базовый уровень /О.С. Габриелян. - М.: Дрофа, 2010.
-
Теоретическое введение
Общая формула алкенов: СnH2n.
Формулы этилена (этена)
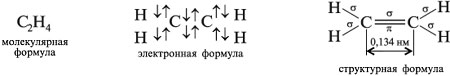
M(С2Н4) = 28 г/моль, VМ(С2Н4) = 22,4 л/моль, Dвозд(С2Н4) = 28/29 = 0,96.
Энергия связи атомов углерода: Есв(С=С) = 587 кДж/моль, Есв = 352 кДж/моль,
Есв = 235 кДж/моль.
Перекрывание орбиталей атомов, связываемых σ - связями
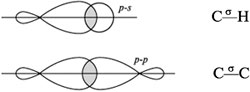
Химические свойства алкенов
Для алкенов наиболее характерны реакции присоединения (галогенов, кислот, воды в присутствии кислот, водорода на катализаторах Pt или Ni). В ходе реакции под действием радикальных, а чаще электрофильных реагентов типа H+ σ -связь разрывается:
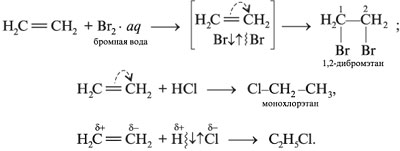
Гомологи этилена присоединяют галогеноводород согласно правилу Марковникова: водород галогеноводорода соединяется с наиболее гидрогенизованным атомом углерода алкена (т. е. содержащим больше атомов H).
При взаимодействии этилена с водой в присутствии концентрированной H2SO4 в зависимости от условий можно получить сложный эфир или спирт:
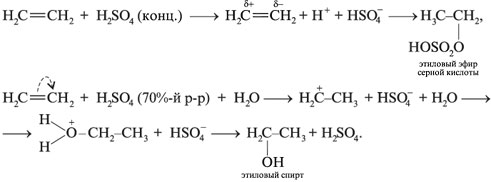
В промышленности гидратацией этилена получают этиловый спирт (этанол):
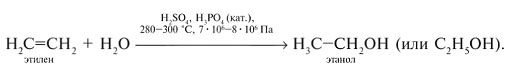
Особым случаем присоединения является полимеризация.
Если алкен реагирует с небольшим количеством концентрированной H2SO4, то карбокатион атакуется не гидроксильной группой, а другой молекулой алкена. В результате многократного присоединения образуется высокомолекулярное вещество - полимер (от греч. - многочисленный, - доля, часть):
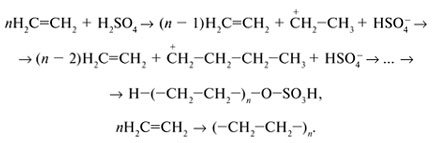
Реакцию соединения большого числа молекул (мономеров) в макромолекулы полимера называют полимеризацией.
Алкены легко окисляются по π-связи. Обесцвечивание, а затем побурение раствора KMnО4 (подщелоченного содой) при пропускании через него алкена - качественная реакция на алкены:
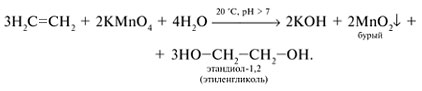
Этилен горит светящимся коптящим пламенем.
Физические свойства алкенов
По физическим свойствам алкены похожи на алканы (т. е. их молекулы тоже практически неполярны).
Получение алкенов
Алкены получают крекингом и дегидрированием алканов, отщеплением воды от спиртов, отщеплением галогеноводородов от алкилгалогенидов. Например:
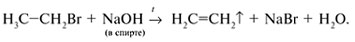
В промышленности алкены получают пиролизом (700 °С) алканов.
Применение алкенов
Присоединением к алкенам галогенов или галогеноводородов получают галогенопроизводные, используемые для синтеза более сложных веществ, а также в качестве растворителей (СН2Cl-СH2Cl и др.). Присоединением воды получают спирты R-OH.
Больше всего С2Н4 и С3Н6 идет на производство высокомолекулярных соединений - полимерных материалов.
Этилен - главное сырье современной химической отрасли промышленности - основного органического синтеза. Из этилена получают этиловый спирт, стирол, уксусный альдегид, винилхлорид, винилацетат, этиленоксид и другие соединения:
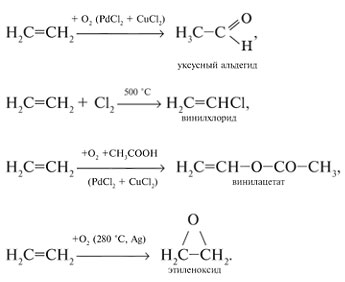
Этилен ускоряет созревание плодов, поэтому его добавляют в атмосферу теплиц
-
Практические задания
Опыт 1. Получение этилена
Соберите прибор так, как показано на рисунке. Приготовьте пробирки с бромной водой и с раствором перманганата калия.
Налейте в пробирку-реактор 1.5 - 2 см3 смеси этилового спирта с концентрированной серной кислотой. Поместите в эту смесь немного речного песка, чтобы смесь разогревалась равномерно и не разбрызгивалась при кипении. Прогрейте сначала всю пробирку - реактор, затем нагревайте пробирку у донышка.
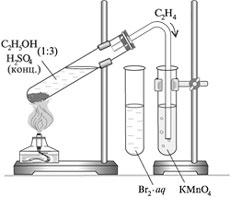
Опыт 2. Определение непредельности этилена
Пропустите образующийся газ через бромную воду. Запишите ваши наблюдения, уравнение химической реакции.
Пропустите этилен через раствор перманганата калия и сравните окраску с контрольным раствором. Запишите ваши наблюдения, уравнение химической реакции.
Опыт 3. Горение этилена.
Поверните газоотводную трубку слегка вверх, не вытаскивая из пробирки. Подожгите выделяющийся этилен при помощи горящей лучинки. Запишите уравнения химических реакций неполного и полного сгорания этилена.
-
Оформление отчета
Что делали (название опыта, рисунок с пояснениями)
Что наблюдали (признаки и условия проводимых реакций, уравнения химических реакций)
Выводы
-
Контрольные вопросы
1. Какова роль серной кислоты в реакции получения этилена?
2. Как опытным путем отличить этилен от этана, если эти газы находятся в цилиндрах без этикеток?
3. Даны две органические кислоты - уксусная и олеиновая. Как экспериментально доказать, что одна из кислот непредельная ( содержит в составе двойную связь)?
Практическое занятие № 4
Тема: Получение уксусной кислоты. Изучение свойств карбоновых кислот.
Цель занятия: получение уксусной кислоты, изучение ее свойств.
Задачи:
1. Научиться получать уксусную кислоту в лаборатории.
2. Опытным путем подтвердить химические свойства органических кислот.
Оснащение (наглядный материал): металлический штатив с лапкой, пробка с газоотводной трубкой, пробиркодержатель, спиртовка, пробирки, пипетка, ватный тампон, ацетат натрия, раствор серной кислоты, лакмус, порошок оксида бария, раствор уксусной кислоты, раствор гидроксида натрия, карбонат натрия.
Рекомендуемая литература
1. Габриелян, О.С. Химия, 10 класс. Базовый уровень /О.С. Габриелян. - М.: Дрофа, 2010.
1.Теоретическое введение
Карбоновые кислоты - вещества с общей формулой
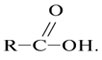
Здесь R - атом Н или углеводородный радикал: - СН3, - С2Н5,- С3Н7 и т.п.
Функциональная группа карбоновых кислот - карбоксильная группа
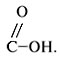
Названия карбоновых кислот по международной номенклатуре образуют от названий предельных углеводородов с таким же углеродным скелетом прибавлением окончания -овая и слова «кислота».
Изомерия карбоновых кислот включает:
а) изменение углеродного скелета радикала при карбоксильной группе, например:
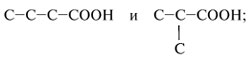
б) межклассовую изомерию, например:
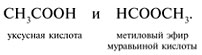
Получение карбоновых кислот:
Из солей карбоновых кислот действием сильных минеральных кислот:
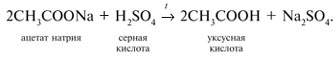
Каталитическое окисление углеводородов:
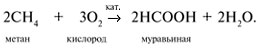
Окисление спиртов под действием ферментов или других катализаторов:
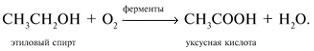
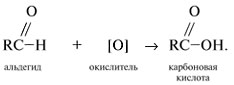
Окисление альдегидов с помощью окислителей:
Карбонилирование спиртов под давлением и в присутствии катализатора:
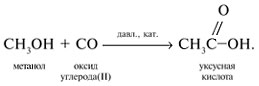
Синтез муравьиной кислоты из монооксида углерода:

Окисление алкилзамещенных ароматических соединений в ароматические (бензойные) карбоновые кислоты:
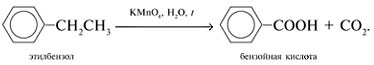
Химические свойства карбоновых кислот:
1. Карбоновые кислоты диссоциируют в водном растворе с отщеплением протонов Н+, обусловливающих кислую среду раствора:
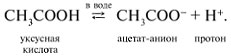
Водные растворы карбоновых кислот изменяют окраску индикаторов и являются электролитами. По сравнению с сильными минеральными кислотами (H2SO4, HNO3, HCl) - это слабые кислоты.
2. Карбоновые кислоты реагируют с активными металлами (примерно от Li до Fe в ряду напряжений металлов), выделяя водород:
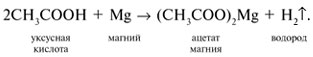
3. Кислоты реагируют с основными оксидами:
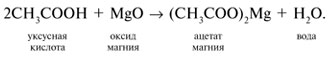
4. Кислоты реагируют с основаниями:
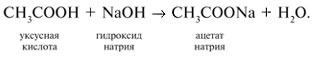
5. Кислоты реагируют с аммиаком на холоду с образованием солей аммония:
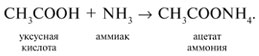
6. Карбоновые кислоты реагируют с солями более слабых и летучих кислот:
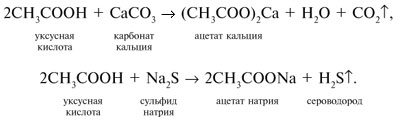
7. Кислоты RCOOH реагируют со спиртами R'OH (реакция этерификации) с образованием сложных эфиров RCOOR'. Это обратимая реакция:
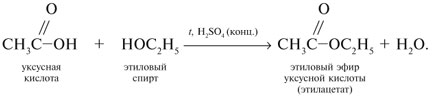
2. Практические задания
Опыт 1. Получение уксусной кислоты.
Cоберите прибор для получения CH3COOH. В пробирку влейте 3г. крист. ацетата натрия и прилейте 3 мл серной кислоты (1:1). Закройте пробирку пробкой с газоотводной трубкой, конец которой опустите в пустую пробирку до дна. Нагревайте смесь до получения 2-3 мл кислоты в пробирке-приемнике.

Опыт 2. Исследование раствора уксусной кислоты индикатором.
К раствору уксусной кислоты прилейте 1 каплю лакмуса. Как изменился цвет индикатора? О чем это свидетельствует? Подтвердите свои наблюдения уравнением реакции диссоциации уксусной кислоты.
Опыт 3. Взаимодействие уксусной кислоты с цинком.
В стеклянную пробирку поместите одну гранулу цинка и добавьте уксусной кислоты. Что наблюдаете? Подогрейте содержимое пробирки на пламени спиртовки. Что изменилось? Почему? Напишите уравнение реакции.
Опыт 4. Взаимодействие уксусной кислоты с основным оксидом.
В пробирку поместите немного порошка оксида бария и добавьте 1-2 мл раствора уксусной кислоты. Что наблюдаете? Напишите уравнение происходящей реакции.
Опыт 5. Взаимодействие уксусной кислоты с солью.
В пробирку налейте 1 мл раствора карбоната натрия и добавьте несколько капель уксусной кислоты. Что наблюдаете? Напишите уравнения реакции.
-
Оформление отчета
Что делали (название опыта, рисунок с пояснениями)
Что наблюдали (признаки и условия проводимых реакций, уравнения химических реакций)
Выводы
4. Контрольные вопросы
1. Почему реакцию нейтрализации уксусной или муравьиной кислоты следует проводить в присутствии индикатора?
2. Напишите три уравнения химических реакций, демонстрирующих:
а) сходство химических свойств муравьиной и уксусной кислот;
б) отличие муравьиной кислоты от уксусной;
в) сходство муравьиной или уксусной кислоты с неорганическими кислотами.
3. Что такое «ледяная» уксусная кислота?
4. При взаимодействии этилового спирта с бромоводородной кислотой получается бромэтан, а при реакции с уксусной кислотой - уксусноэтиловый эфир. Что общего в химизме получения этих веществ? Каковы различия в их составе?
Практическое занятие № 5
Тема: Свойства и распознавание пластмасс
Цель занятия: На основе знания состава и строения полимеров распознать в лабораторных условиях наиболее употребляемые пластмассы.
Задачи:
1. Обобщить знания о пластмассах.
2. Научиться распознавать опытным путем наиболее употребляемые пластмассы
Оснащение (наглядный материал): Справочный набор пластических масс, пинцет, щипцы тигельные, спиртовая горелка, спички, лакмусовая бумажка, стеклянная трубка, медная пластинка 1х2 см (или медная проволока, конец которой скручен ложечкой), штатив с пробирками, прямая и Г-образная газоотводные трубки, склянка для отходов, санитарная склянка; раздаточный материал в пронумерованных конвертах: полиэтилен (ПЭ), полиметилметакрилат (ПМ), полистирол (ПС), целлулоид (Ц), поливинилхлорид (ПВХ), фенопласты (Ф), аминопласты (А), Н2О (дистил.), водный аммиак конц.), AgNO3 (р-р,ω = 1%).
Рекомендуемая литература
1. Габриелян, О.С. Химия, 10 класс. Базовый уровень /О.С. Габриелян. - М.: Дрофа, 2010.
-
Теоретическое введение
Пластмассы - материалы, изготавливаемые на основе полимеров, способные приобретать при нагревании заданную форму и сохранять ее после охлаждения. По масштабу производства занимают 1-е место среди полимеров. Пластмассы состоят из полимера (смола, связывающее вещество), наполнителей (древесная мука, ткань, асбест, стекловолокно, которые улучшают механические свойства и снижают стоимость), пластификаторов (возможны высококипящие сложные эфиры, они придают повышенную эластичность и меньшую хрупкость), стабилизаторов (антиоксиданты, светостабилизаторы, сохраняющие свойства пластмасс при переработке), красителей и др.
Мономер - низкомолекулярное вещество, из которого получается полимер.
Структурные звенья - многократно повторяющиеся в макромолекуле группы атомов.
Степень полимеризации (n) - число молекул мономера, соединяющихся в макромолекулу. Геометрическая форма макромолекул может быть линейной, разветвленной, пространственной или трхмерной, что существенно влияет на свойства.

Кристалличность полимеров - упорядоченное распределение макромолекул. Благодаря упорядоченности цепей молекулы в кристаллах располагаются ближе друг к другу, и притяжение между ними усиливается. Механическая прочность и твердость полимера увеличиваются.
Аморфность - отсутствие упорядоченности. Степень кристалличности может меняться у одного и того же полимера. Молекулярная масса полимера представляет собой среднее значение. У отдельных макромолекул могут быть отклонения в большую или меньшую сторону от средней молекулярной массы.
Особенность линейных полимеров состоит в том, что они при нагревании размягчаются, плавятся, но не перегоняются (разлагаются). Пространственные структуры разлагаются, не переходя в вязкое состояние. Помимо того, полимеры линейной структуры с трудом, но могут растворяться в некоторых растворителях (образуются вязкие растворы), пространственные полимеры нерастворимы (только набухают). Высокая механическая прочность (особенно пространственных полимеров) объясняется наличием больших сил межмолекулярного взаимодействия.
-
Синтез полимеров осуществляется преимущественно двумя способами - полимеризацией (сополимеризацией, если мономеры разных веществ) и поликонденсацией низкомолекулярных веществ. Механизм полимеризации может быть радикальным (с учетом инициатора) и ионным.
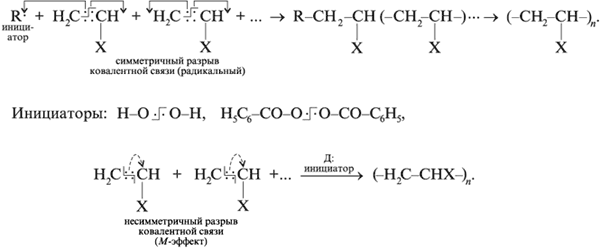
В реакции поликонденсации синтез полимера осуществляется не за счет кратной связи, а благодаря наличию у каждого из реагентов не менее двух функциональных групп атомов. Например, синтез фенолформальдегидной смолы:
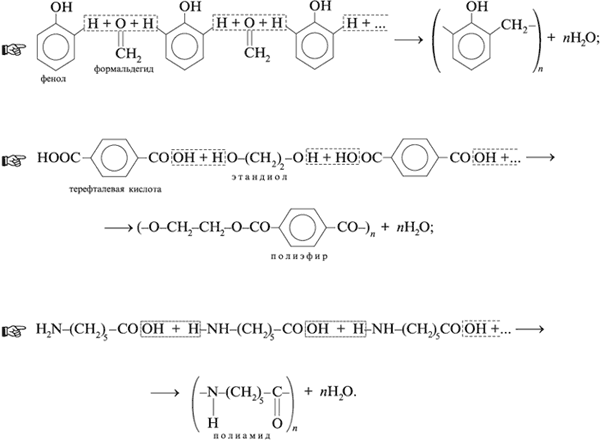
Полимеры могут быт термопластичными или термореактивными.
Термопластичность - способность полимеров при нагревании размягчаться, легко изменять форму, снова затвердевать при охлаждении, сохраняя приданную форму, а при следующем повышении температуры снова размягчаться и менять форму.
Термореактивность - способность полимера при нагревании становиться пластичным веществом, но затем утрачивает это свойство, становится неплавким и нерастворимым веществом из-за приобретения пространственной структуры.
В процессе полимеризации отдельные группы в макромолекуле приобретают (в зависимости от условий) различную пространственную направленность и разный порядок соединения звеньев полимеров («голова-хвост», «голова-голова», смешанный).
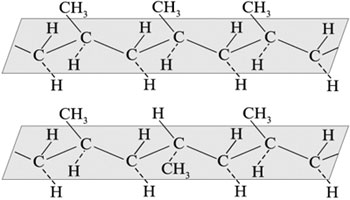
Стереорегулярное строение макромолекулы полипропилена характеризуется высокой степенью кристалличности и регулярным расположением частей макромолекулы в пространстве.
Распознавание пластмасс следует начинать с внешнего осмотра (цвет, твердость, эластичность), затем перейти к изучению характера горения. Если при этом ответ не удается получить, то прибегают к изучению продуктов разложения.
Полиэтилен. Полупрозрачный, эластичный, жирный на ощупь материал. При нагревании размягчается, из расплава можно вытянуть нити. Горит синеватым пламенем, распространяя запах расплавленного парафина, продолжает гореть вне пламени.
Поливинилхлорид. Эластичный или жесткий материал, при нагревании быстро размягчается, разлагается с выделением хлороводорода. Горит коптящим пламенем, вне пламени не горит.
Полистирол. Может быть прозрачным и непрозрачным, часто хрупок. При нагревании размягчается, из расплава легко вытянуть нити. Горит коптящим пламенем, распространяя запах стирола, продолжает гореть вне пламени.
Полиметилметакрилат. Обычно прозрачен, может иметь различную окраску. При нагревании размягчается, нити не вытягиваются. Горит желтоватым пламенем с синей каймой и характерным потрескиванием, распространяя эфирный запах.
Фенолформальдегидная пластмасса. Темных тонов (от коричневого до черного). При нагревании разлагается. Загорается с трудом, распространяя запах фенола, вне пламени постепенно гаснет.
-
Практические задания
Задание 1. Внимательно рассмотреть выданные для распознавания образцы пластмасс в шести пронумерованных пакетах, сравнить с образцами коллекции, при необходимости (и для проверки) подвергнуть опытному обследованию и определению (предложено всего шесть образцов - ПЭ, ПС, ПВХ, ПМ, Ц, Ф).
Задание 2. Определите обарзцы двух пластмасс по плану, предложенному в отчете, пользуясь таблицей «Характерные свойства полимеров» (Приложение)
вариант 1. - образцы под номерами 2 и 4
вариант 2. - образцы под номерами 3 и 5
вариант 3. - образцы под номерами 1 и 6
-
Оформление отчета
Что делали.
Что наблюдали.
Выводы.
Формулы структурных звеньев.
1.
2. Определение образцов двух пластмасс, следуя плану:
1) Физические свойства, определяемые органолептически (внешний вид, прозрачность, эластичность, твердость …)
2) Отношение к нагреванию
3) Характер горения
4. Контрольные вопросы
1. Почему полистирол называют заменителем хрусталя? Какие достоинства или недостатки у изделий из этой пластмассы по сравнению с изделиями из хрусталя или стекла?
2. Что произойдет, если пробирку с небольшим кусочком поливинилхлорида слегка нагреть, а затем к отверстию пробирки поднести:
а) смоченную иодкрахмальную бумажку;
б) фильтроальную бумагу, на которую нанесено несколько капель раствора нитрата серебра?
3. Что такое пенопласт? Где он применяется?
4. Что такое текстолит? Где он применяется?
Практическое занятие № 6
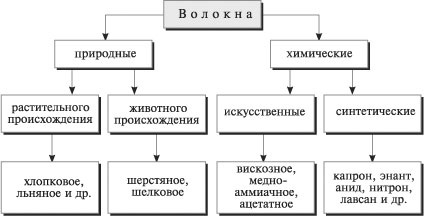
Тема: Свойства и распознавание волокон
Цель занятия: На основе знания полимерного состава наиболее употребляемых натуральных и химических волокон распознать их в лабораторных условиях, соблюдая правила техники безопасности.
Задачи:
1. Обобщить знания о волокнах, проверить в химических опытах наиболее характерные химические свойства волокон.
2. Научиться распознавать волокна, пользуясь табличными данными
Оснащение (наглядный материал): набор натуральных и химических волокон с образцами тканей (коллекция), спиртовая горелка, спички, пинцет, штатив с пробирками, водяная баня (электрическая), щипцы тигельные, санитарная склянка; пакетики № 1-4 с образцами вискозного, ацетатного или натурального шелка, натуральной шерсти, капрона (белого), хлопчатобумажной ткани (полоски 2x3 см), еще могут быть нитрон, энант, анид, хлорин и лавсан, тонкая медная пластинка (если дан хлорин), HNO3 (р-р, ρ = 1,4 г/см3), ацетон, лакмусовая бумажка, NaOH (р-р, ω= 3%, ω = 10%), H2SO4 (р-р, ω = 3%), H2SO4 (конц., ρ = 1,84 г/см3), фенол.
Рекомендуемая литература
1. Габриелян, О.С. Химия, 10 класс. Базовый уровень /О.С. Габриелян. - М.: Дрофа, 2010.
1. Теоретическое введение
Хлопок. Горит быстро, распространяя запах жженой бумаги, после сгорания остается серый пепел.
Шерсть, натуральный шелк. Горит медленно, с запахом жженых перьев, после сгорания образуется черный шарик, при растирании превращающийся в порошок.
Ацетатное волокно. Горит быстро, образуя нехрупкий, спекшийся шарик темно-бурого цвета. В отличие от других волокон растворяется в ацетоне.
Капрон. При нагревании размягчается, затем плавится, из расплава можно вытянуть нити. Горит, распространяя неприятный запах.
Лавсан. При нагревании плавится, из расплава можно вытянуть нити. Горит коптящим пламенем с образованием темного блестящего шарика.
Последовательность анализа волокон. Сначала проводят испытание путем сжигания. Его следует повторить несколько раз и при этом проследить:
а) с какой скоростью происходит горение;
б) каков запах продуктов разложения;
в) какой характер имеет остаток после сгорания.
Т аким образом можно определить принадлежность волокна к определенной группе (целлюлозные, белковые, синтетические волокна).
аким образом можно определить принадлежность волокна к определенной группе (целлюлозные, белковые, синтетические волокна).
Дополнительные испытания основаны на химических свойствах волокон различного происхождения.
Название волокна
Отношение к концентрированным кислотам и щелочам
HNO3
H2SO4
NaOH
Хлопок
Растворяется, раствор бесцветный
Растворяется
Набухает, но не растворяется
Вискозное
Растворяется, раствор бесцветный
Растворяется, раствор красно-коричневый
Растворяется
Шерсть и шелк натуральный
Желтое окрашивание
Разрушается
Растворяется
Ацетатное
Растворяется, раствор бесцветный
Растворяется
Желтеет и растворяется
Капрон
Растворяется, раствор бесцветный
Растворяется, раствор бесцветный
Не растворяется
Лавсан
Не растворяется
Растворяется
Не растворяется
2. Практические задания
Задание 1. Распознать в четырех пронумерованных пакетиках образцы тканей (или волокон). Это могут быть: хлопчатобумажная ткань, вискозный шелк (волокно), ацетатный шелк (волокно), шерсть или натуральный шелк, капрон (белый), лавсан.
Задание 2. Описать получение, свойства и применение волокна, образец которого дан в пакетике № 2.
3. Оформление отчета
Что делали.
Что наблюдали.
Выводы.
Формулы структурных звеньев.
Определение образцов волокон, следуя плану:
1) Характер горения
2) Отношение к кислотам и щелочам:
а) HNO3
б) H2SO4
в) NaOH
4. Контрольные вопросы
1. Какова структура волокнистых веществ и как объяснить их прочность?
2. Какие волокна называют природными, искусственными и синтетическими? Привести примеры.
3. Почему волокно из стекла и асбеста не используют в текстильной промышленности?
4. С каких тканей можно вывести масляное пятно ацетоном или бензином, а с каких - нельзя? Почему?
5. В чем преимущества и недостатки натуральной шерсти по сравнению с синтетической, полученной из нитрона?
Практическое занятие № 7
Тема: Экспериментальное решение задач по курсу органической химии
Цель занятия: совершенствовать умения решать качественные химические задачи, применяя знания органической химии
Задачи:
1. Проверить знания характерных свойств изученных классов органических соединений
2. Уметь распознавать изученные классы органических соединений.
3. Закрепить навыки основ лабораторного эксперимента и техники безопасности.
Оснащение (наглядный материал): водяная баня (электрическая), спиртовая горелка, спички, асбестовая сетка, соединительная резиновая трубка, штатив с пробирками, вата (хлопчатобумажная или стеклянная), пинцет, склянка для отходов, соковыжималка, промывная склянка с дистиллированной водой, санитарная склянка, железный штатив с кольцом и лапкой, шпатель (3 шт.), скальпель, химическая колба на 50-100 мл с отводной трубкой, делительная воронка с хлоркальциевой трубкой, прямая и Г-образная газоотводные трубки с пробкой, широкая стеклянная трубка с двумя пробками, в каждой пробке - отверстие для газоотводной трубки, медная спираль, продетая в пробку (или сетка), мерная пипетка на 5-10 мл, фильтровальная бумага; хлеб белый (кусочек), Н2О (дистил.), Br2 (бромная вода), хромовая смесь (10%-й водн. р-р K2Cr2O7 и равный объем H2SO4, 1:1), CuO (порошок), раствор I2 в йодиде калия, [Ag(NH3)2]OH (аммиачный раствор Ag2O), KMnO4 (разб. р-р), С2Н5ОН (этанол), Са(ОН)2 (известковая вода), NaHCO3 (кристал. и р-р), H2SO4 (разб. и конц.), картофель (часть клубня), Al2O3 (порошок), яблоко свежее (кусочек), Na2CO3 (кристал. и р-р). Вещества для распознавания в пронумерованных пробирках: № 1-3: глицерин, ацетальдегид, глюкоза (водн. р-ры); № 4, 5: машинное масло, растительное масло; № 6-8: крахмал, сахароза, глюкоза (сухие в-ва); № 9-11: глицерин, мыло, крахмал (водн.р-ры).
Рекомендуемая литература
1. Габриелян, О.С. Химия, 10 класс. Базовый уровень /О.С. Габриелян. - М.: Дрофа, 2010.
1.Теоретическое введение
Качественные реакции на органические вещества.
1. Алкены, диены, алкины (кратная связь)
Реакция с бромной водой - обесцвечивание.
2. Тройная связь на конце цепи
Реакция с [Ag(NH3)2]OH - выпадение осадка серебряной соли.
3. Многоатомные спирты
Реакция со свежеосажденным гидроксидом меди (II) - появление ярко-синего раствора комплекса
4. Фенолы
1) Реакция с бромной водой - выпадение осадка 2,4,6-трибромфенола.
2) Реакция с раствором хлорида железа (III) - красно-фиолетовое окрашивание.
5. Альдегиды
5*. Муравьиная кислота.
1) Реакция со свежеосажденным гидроксидом меди при нагревании - выделение красного осадка оксида меди (I).
2) Реакция с аммиачным раствором оксида серебра при нагревании - выпадение осадка металлического серебра.
6. Карбоновые кислоты
Реакция с гидрокарбонатом натрия (содой) - выделение углекислого газа.
7. Анилин
Реакция с бромной водой - выпадение осадка 2,4,6-триброманилина.
8. Аминокислоты
1) Реакция с гидрокарбонатом натрия (содой) - выделение углекислого газа.
2) С азотной кислотой - желтое окрашивание - у аминокислот, содержащих бензольное кольцо.
9. Белки
1) С азотной кислотой - желтое окрашивание - у аминокислот, содержащих бензольное кольцо.
2) Реакция со свежеосажденным гидроксидом меди - фиолетовый раствор.
10. Глюкоза, восстанавливающие дисахариды (мальтоза, лактоза, целлобиоза)
1) Реакция со свежеосажденным гидроксидом меди при нагревании - выделение красного осадка оксида меди (I).
2) Реакция с аммиачным раствором оксида серебра при нагревании - выпадение осадка металлического серебра.
11. Крахмал
Реакция с йодом - синее окрашивание.
2. Практические задания
Задание 1. При помощи одних и тех же реактивов определить в пробирках № 1-3 водные растворы глицерина, уксусного альдегида и глюкозы. Оформить порядок решения и обосновать выводы
Задание 2. Определить с помощью характерных реакций в пробирках № 4, 5 машинное и растительное масло.
Задание 3. Доказать опытным путем, что картофель и белый хлеб содержат крахмал, а яблоко - глюкозу. Записать порядок действий. Представить оптимальный вариант решения и схемы реакций
Задание 4. Определить с помощью характерных реакций следующие вещества: в пробирках № 6-8 - порошки крахмала, сахарозы и глюкозы; в пробирках № 9-11 - разбавленные водные растворы глицерина, мыла (стеарата натрия), крахмала. При выполнении заданий избрать наиболее рациональный способ решения. Составить и записать порядок действий
Задание 5. Исходя из этанола получить:
вариант 1 - простой эфир и сложный эфир;
вариант 2 - альдегид и кислоту.
Составить схемы лабораторных установок. Написать уравнения соответствующих реакций в структурной форме (с указанием условий и признаков). Решение привести согласно заданию варианта 1 или 2.
Задание 6. Доказать опытным путем, что обычный сахар содержит углерод. Составить план решения, зарисовать схему прибора. Записать соответствующее уравнение реакции, пояснить наблюдаемые явления
3. Оформление отчета
Порядок работы
Наблюдения
Выводы
4. Контрольные вопросы
1. Какая разница между карбоновой и карболовой кислотами? Подтвердите ответ химическимим опытами.
2. Составьте схемы, подтверждающие генетические связи между двумя классами органических соединений: вариант 1- альдегиды и одноосновные карбоновые кислоты;
вариант 2- углеводороды и модноатомные спирты.
Практическое занятие № 8
Тема: Получение газообразных веществ и подтверждение химическими опытами их состава и свойств ( аммиака и углекислого газа) .
Цель занятия: получить и собрать лабораторным способом аммиак и углекислый газ, проверить их свойства.
Задачи:
1. Научиться получать и собирать лабораторным способом аммиак и углекислый газ
2. Закрепить понятия о составе и структурах аммиака и оксида углерода(IV)
Оснащение (наглядный материал): фарфоровая ступка, пестик, вата, пробка для пробирки, железный штатив с двумя лапками, штатив с химическими пробирками, спиртовка, спички, кристаллизатор с водой, стеклянные трубки (3 шт.), лучинка, санитарная склянка; красная лакмусовая бумажка, спиртовой раствор фенолфталеина, NH4Cl (крист.), гашеная известь Са(ОН)2, KMnO4 (крист.), HNO3 (конц.), H2SO4 (конц.), HCl (конц.), стеклянная трубка, универсальный прибор для получения газов, Г-образная газоотводная трубка, промывная склянка, санитарная склянка; в пронумерованных пробирках № 1-3 растворы Na2SO4, ZnCl2, K2CO3, СaCO3 (кусочки мела или мрамора), растворы BaCl2, HNO3, HCl, NaOH, Сa(OH)2 (известковая вода), синяя лакмусовая бумажка, набор индикаторов, Н2О (дистиллированная).
Рекомендуемая литература
-
Габриелян, О.С. Химия, 10 класс. Базовый уровень /О.С. Габриелян. - М.: Дрофа, 2010.
1. Теоретическое введение
Аммиак
В обычных условиях аммиак - бесцветный газ, легче воздуха, с едким запахом и вкусом.
M(NH3) = 17 г/моль,
Dвозд(NH3) = 17/29 = 0,59,
VM(NH3) = 22,4 л/моль,
tсжиж = -33,35 °C (при p = 9•105 Па), tзатверд = -77,7 °С.
Хорошо растворим в воде (700 объемов NH3 в 1 объеме воды), спиртах, бензоле, ацетоне.
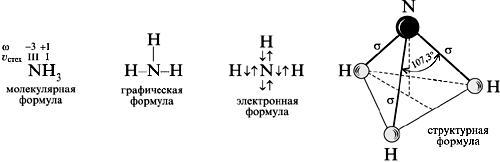
Неподеленная электронная пара атома азота усиливает полярность молекулы аммиака. С этим связана легкость его сжижения и высокая теплота парообразования. Жидкий аммиак, подобно воде, хороший растворитель ионных соединений.
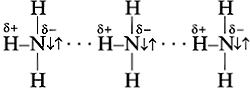
Аммиак - очень реакционноспособное вещество.
Реакции присоединения
За счет неподеленной электронной пары атом азота (донор) способен образовывать координационную связь с атомом-акцептором (имеющим вакантные ячейки в валентном слое). Легче всего прои сходит присоединение протона (Н+) из воды и кислот:
способность молекул NH3 притягивать протоны (Н+) - свойство основания.
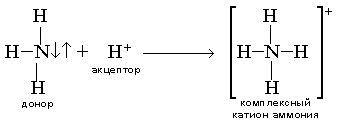
Реакции окисления
Аммиак - сильный восстановитель. При нагревании с хлором, бромом, кислородом, пероксидом водорода образуется свободный азот (N2): 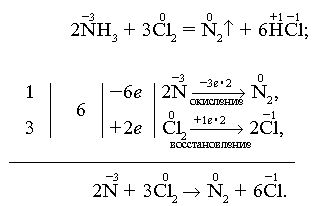
В присутствии катализатора (сплав Pt и Rh) идет процесс:
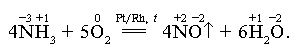
В промышленности аммиак получают прямым синтезом из азота и водорода. Аммиак используется главным образом в производстве азотной кислоты и азотных удобрений - натриевой, калиевой, аммиачной селитры, сульфата аммония (NaNO3, KNO3, NH4NO3, (NH4)2SO4), карбамида (CO(NH2)2), аммофосов (NH4H2PO4, (NH4)2HPO4); применяется как хладагент в холодильных установках.
В лабораторных условиях аммиак получают из солей аммония.
Аммиак требует осторожного обращения из-за физиологической активности, он поражает дыхательные пути (обезвоживание).
Оксид углерода(IV)
Электроны в атоме углерода: 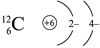
Невозбужденное состояние атома: 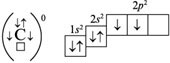
Возбужденное состояние атома: 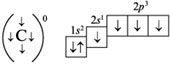
Гибридные электронные орбитали в возбужденном атоме углерода:
Cведения об углекислом газе:
М (CO2) = 44 г/моль,
VМ(CO2) = 22,4 л/моль (н. у.),
Dвозд (СО2) = 44/29 (тяжелее воздуха).
Бесцветный газ со слабокислым запахом и вкусом, ρ = 1,98 г/л. В одном объеме воды (20 °C) растворяется 0,88 объема. При -78,515 °С и нормальном давлении, минуя жидкое состояние, затвердевает в снегообразную массу («сухой лед»). Жидкий CO2 образуется только под давлением 58,46•105 Па при 20 °С.
При содержании в воздухе 4% (по объему) оксид углерода(IV) вызывает болезненные явления, при концентрации больше 10% появляется удушье.
Этот газ - конечный продукт дыхания растений и животных, процессов горения, гниения и брожения. Образование СО2 - одна из стадий круговорота углерода в природе. В промышленности СО2 используется для производства «сухого льда», соды и экономически выгодного энергетического продукта - синтез-газа (H2 + CO).
1. Практические задания
Задание 1. Получение аммиака.
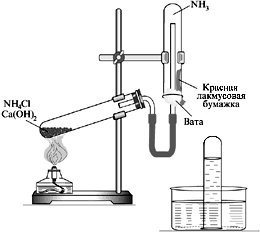
В фарфоровой ступке перемолоть примерно равные объемы кристаллического хлорида аммония NH4Cl и порошка Ca(OH)2. Приготовленную смесь насыпать в пробирку на 1/3 ее объема. Собрать прибор по приведенной схеме, нагревать смесь до появления острого запаха (нюхать осторожно!). Затем пробирку-сборник, не переворачивая, осторожно закрыть пробкой, погрузить в сосуд с водой и открыть пробку. После заполнения сборника водой снова закрыть его пробкой, вынуть из воды, проверить содержимое красной лакмусовой бумажкой, а затем несколькими каплями фенолфталеина. (Прибор не разбирать.)
Задание 2. Поместить в пробирку-реактор несколько кусочков мела (мрамора), прилить немного разбавленной соляной кислоты. Kонец газоотводной трубки вывести в пробирку с 2-3 мл известковой воды и пропускать газообразный продукт до помутнения жидкости в сборнике.
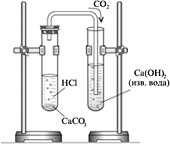
Вынуть конец газоотводной трубки, промыть в дистиллированой воде, поочередно ввести его в: а) пробирку с 2-3 мл дистиллированной воды с листочком синей лакмусовой бумажки (или 2-3 каплями синего лакмуса);
б) пробирку с 2-3 мл разбавленного раствора гидроксида натрия с несколькими каплями спиртового раствора фенолфталеина;
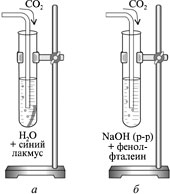
Что происходит при действии сильной кислоты на мел (мрамор)? Почему? Написать уравнение реакции. Почему появляющееся сначала помутнение при последующем газировании исчезает? Объяснить уравнениями реакций, назвать продукты.
Что происходит при пропускании СО2 через дистиллированную воду? Kак это доказать?
Kакие два продукта и при каких условиях должны образоваться при взаимодействии СО2 с раствором щелочи? Уравнения реакций представить в молекулярной и ионной (полной и сокращенной) формах.
3. Оформление отчета
Что делали (название опыта, рисунок с пояснениями)
Что наблюдали (признаки и условия проводимых реакций, уравнения химических реакций)
Выводы
4. Контрольные вопросы
1. Какую воду можно замутить дыханием?
2. Как скажется на концентрации углекислого газа в крови задержка дыхания?
3. Почему горящий магний нельзя тушить углекислым газом?
4. В Италии, близ Неаполя, имеется «Собачья пещера», в которую из расщелин в горных породах поступает углекислый газ. Почему при входе в пещеру людей с собаками животные гибнут, а люди остаются невредимыми?
5. Что такое нашатырь и нашатырный спирт? Какими химическими опытами можно различить эти растворы?
6. Напишите уравнение реакции горения аммиака в присутствии катализатора.
Практическое занятие № 9
Тема: Приготовление раствора заданной молярной концентрации
Цель занятия: Научиться готовить растворы с заданной молярной концентрацией.
Задачи:
1. Повторить и использовать правила ТБ при выполнении практических работ в кабинете химии
2. Повторить и практически применить знания о растворах и концентрациях растворов
3. Повторить устройство лабораторных весов и правила взвешивания
Оснащение (наглядный материал): весы лабораторные, химические стаканы (V = 50мл), стеклянные палочки, керамические ложечки, мерные цилиндры (V = 100мл), мензурки (V =50мл), дистиллированная вода, хлорид натрия (тв.), соляная кислота 20%
Рекомендуемая литература
1. Габриелян, О.С. Химия, 10 класс. Базовый уровень /О.С. Габриелян. - М.: Дрофа, 2010.
1. Теоретическое введение
Концентрация - величина, характеризующая количественный состав раствора.
Согласно правилам ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л), то есть это соотношение неоднородных величин. Те величины, которые являются отношением однотипных величин (отношение массы растворённого вещества к массе раствора, отношение объёма растворённого вещества к объёму раствора) правильно называть долями.
Однако на практике для обоих видов выражения состава применяют термин концентрация и говорят о концентрации растворов.
Молярной концентрацией раствора называют отношение количества растворенного вещества к объему раствора
Молярная концентрация показывает число молей растворённого вещества в одном литре раствора
C = ν / V
Алгоритм приготовления определённого объёма раствора
с заданной молярной концентрацией
-
Рассчитать массу вещества.
-
Для расчетов использовать формулы:
C = ν / V; ν = C V; m = ν M; m = C V M
-
Взвесить на весах рассчитанную навеску.
-
Перенести навеску вещества в мерную колбу.
-
Прилить в колбу немного воды и перемешать стеклянной палочкой до полного растворения вещества.
-
Налить в мерную колбу воды до метки.
-
Чтобы не перелить воду, последние капли добавлять с помощью пипетки.
-
Практические задания
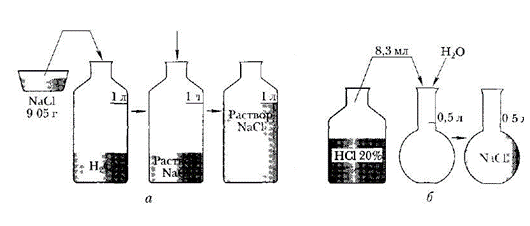
Задание 1. Приготовить 1 л раствора хлорида натрия с молярной концентрацией 0,155 М
Задание 2. Приготовить 0,5 л раствора соляной кислоты с молярной концентрацией 0,10 М из раствора с массовой долей соляной кислоты 20% (р = 1,1 г/см3). Помните: m = ρV
-
Оформление отчета
Номер и содержание задачи
Что делали
Расчеты
Выводы
4. Контрольные вопросы
1. Укажите растворитель и растворимое вещество в следующих растворах:
а) соль (NaCl) и вода; б) кислота (жидкость, H2SO4) и вода;
в) газ (HCl) и вода; г) спирт (жидкость, С2Н5ОН) и щелочь (твердая, КОН).
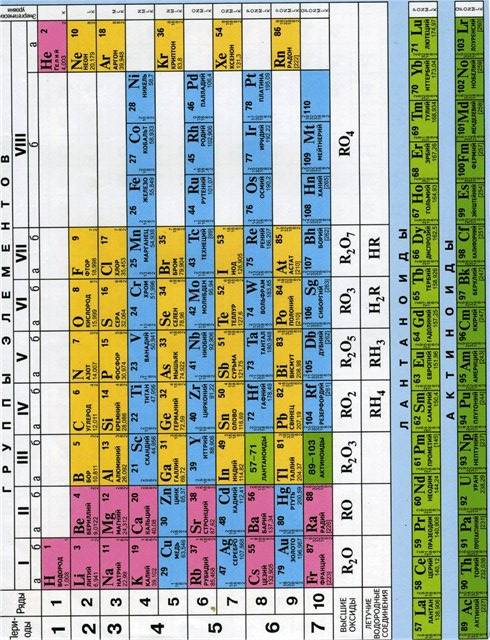
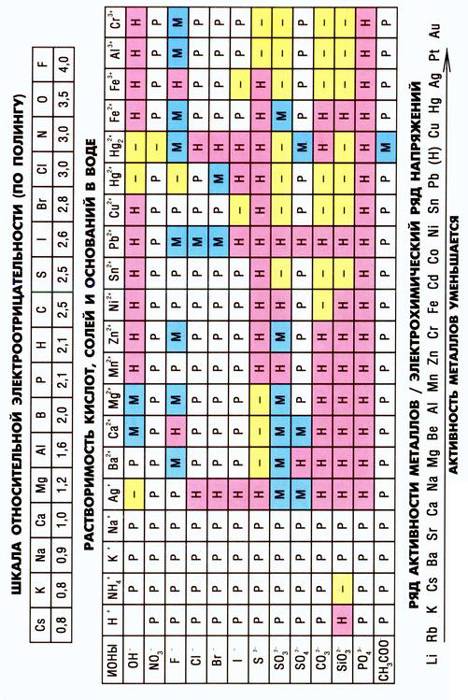
2. Пользуясь таблицей растворимости, определите примерную растворимость при 20 °С в воде веществ: Н2S, Ca(OH)2, PbCl2, PbS, Na2CO3.
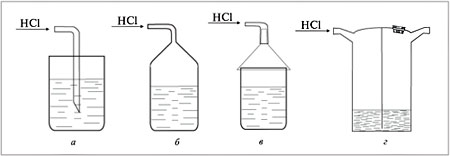
3. Как правильно растворять хлороводород в воде: а - газоотводная трубка опущена в стакан с водой; б - газ поступает в герметичный сосуд с водой; в - газ через воронку над стаканом опускается к воде; г - газ проходит через склянку Тищенко с водой?
4. В мерной колбе растворили 20 г NaОН в 150 мл воды и довели объем до 200 мл. Какова молярная концентрация раствора?
Практическое занятие № 10
Тема: Экспериментальное решение задач по курсу неорганической химии
Цель занятия: продемонстрировать знания характерных свойств некоторых веществ и подтверждение их химических свойств экспериментально
Задачи:
1. Используя знания о качественных реакциях на ионы, опытным путём научиться распознавать химические вещества;
2. Развивать умения наблюдать, самостоятельно анализировать условие задачи, формулировать вопросы, разрабатывать план решения и осуществлять его, соблюдать нормы ТБ, оценивать полученные результаты;
Оснащение (наглядный материал): хлорид аммония, сульфат калия, хлорид меди (II), карбонат натрия, малахит, сульфат аммония, гидроксид меди (II), гидроксид цинка, перманганат калия, гидроксид натрия,гидроксид бария, соляная кислота, сульфат цинка спиртовка, спички, держатель, , пробирки
Рекомендуемая литература
1. Габриелян, О.С. Химия, 10 класс. Базовый уровень /О.С. Габриелян. - М.: Дрофа, 2010.
1. Теоретическое введение
Характерные химические реакции на ионы
ион
Характерные реакции
Ag+
AgNO3 + NaCl = AgCl + NaNO3
+ NaNO3
Выпадает осадок белого цвета.
2AgNO3 + Na2CrO4 = Ag2CrO4 + 2NaNO3
+ 2NaNO3
Выпадает осадок желтого цвета.
Pb2+
Pb(NO3)2 + 2KI = PbI2 + 2KNO3
+ 2KNO3
Выпадает осадок желтого цвета.
Ba2+
BaCl2 + Na2CrO4 = BaCrO4 + 2NaCl
+ 2NaCl
Выпадает осадок белого цвета, нерастворимый в уксусной кислоте.
Ca2+
CaCl2 + H2C2O4 ![]() CaC2O4
CaC2O4 + 2HCl
+ 2HCl
Выпадает осадок белого цвета.
Al3+
Al2(SO4)3 + 6NaOH(недостаток) = 2Al(OH)3 + 3Na2SO4
+ 3Na2SO4
Выпадает осадок белого цвета.
Al(OH)3 +3NaOH(избыток) = Na3[Al(OH)6]
Осадок растворяется в избытке раствора щелочи.
Na3[Al(OH)6] + NH4Cl(нас.р-р) = Al(OH)3 + NH3 + NaCl + NaOH
+ NH3 + NaCl + NaOH
Вновь выпадает осадок белого цвета.
Zn2+
ZnSO4 + 2NaOH(недостаток) = Zn(OH)2 + Na2SO4
+ Na2SO4
Выпадает осадок белого цвета.
Zn(OH)2 + 2NaOH(избыток) = Na2[Zn(OH)4]
Осадок растворяется в избытке раствора щелочи.
Na2[Zn(OH)4] +4NH4Cl(нас.р-р) = [Zn(NH3)4]Cl2+ 2NaCl + 4H2O
Не наблюдается выпадение осадка - этой реакцией катион Zn2+отличается от катиона Al3+ .
Cr3+
CrCl3 + 3NaOH(недостаток) = Cr(OH)3 + 3NaCl
+ 3NaCl
Выпадает осадок зеленого цвета.
Cr(OH)3 + 3NaOH(избыток) = Na3[Cr(OH)6]
Осадок растворяется в избытке раствора щелочи.
Fe2+
FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
+ Na2SO4
Выпадает осадок белого цвета.
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Осадок буреет на воздухе.
FeSO4 + K3[Fe(CN)6] = KFe[Fe(CN)6]  + K2SO4
+ K2SO4
Выпадает осадок синего цвета.
Fe3+
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6]  + 3KCl
+ 3KCl
Выпадает осадок синего цвета.
FeCl3 + 3NH4CNS = Fe(CNS)3 + 3NH4Cl
Роданид железа(III) - темно-красного цвета.
Cu2+
CuSO4 + 4NH4OH = [Cu(NH3)4] SO4 + 4H2O
Образуется комплексная соль фиолетового цвета.
NH4+
NH4Cl + NaOH  NH3
NH3![]() + NaCl + H2O
+ NaCl + H2O
Ощущается неприятный запах.
CO32-
Na2CO3 + 2HCl = CO2 + 2NaCl + H2O
+ 2NaCl + H2O
SiO32-
Na2SiO3 + NH4OH = H2SiO3 + NH4Cl
+ NH4Cl
Выпадает в осадок гель кремниевой кислоты
Cl-
KCl + AgNO3 = AgCl + KNO3
+ KNO3
Выпадает осадок белого цвета.
AgCl + 2NH4OH = [Ag(NH3)2]Cl + 2H2O
Осадок растворяется в избытке раствора аммиака.
I-
2KI + Pb(NO3)2 = PbI2 + 2KNO3
+ 2KNO3
Выпадает осадок желтого цвета.
SO42-
Na2SO4 + BaCl2 = BaSO4 + 2NaCl
+ 2NaCl
Выпадает осадок белого цвета.
S2-
Na2S + 2AgNO3 = Ag2S + 2NaNO3
+ 2NaNO3
Выпадает осадок черного цвета.
2. Практические задания
Задание 1. Определите, в какой из склянок без этикеток находится каждое из перечисленных твердых веществ:
Вариант 1 - хлорид аммония, сульфат калия, хлорид меди (II)
Вариант 2 - карбонат натрия, малахит, сульфат аммония
Задание 2. Получите нерастворимое основание реакцией обмена
Вариант 1 - гидроксид меди (II)
Вариант 2 - гидроксид цинка.
Задание 3.
Вариант 1. Дано твердое кристаллическое вещество А, черного цвета; придобавлении к нему воды образуется малиновый раствор. При нагревании вещество А разлагается; при этом образуется бесцветный газ Б, поддерживающий жизненные процессы. При взаимодействии вещества А с соляной кислотой образуется ядовитый газ В - желтовато-зеленого цвета с резким запахом. Назовите веществ А.Б.В.Составьте схемы уравнений реакций, о которых говорилось в задании. Получите кристаллик вещества А и приготовьте его раствор.
Вариант 2.Дана соль А - твердое белое кристаллическое вещество, растворимое в воде. При нагревании вещества А со щелочью образуеться бесцветный газ Б - легче воздуха, имеет характерный резкий запах. При взаимодействии вещества А с соляной кислотой образуется бесцветный газ В - тяжелее воздуха, не имеет запаха, не поддерживает горения. Назовите вещества А,Б,В. Получите немного вещества А и разотрите его в ступке.
3. Оформление отчета
Что делали
Наблюдения, хим. уравнения
(молекулярные и ионные)
Вывод
4. Контрольные вопросы
1. Предложите лабораторный способ получения гидроксида хрома (III) и подтверждения его амфотерных свойств.
2. Запишите уравнения химических реакций, которые соответствуют схеме:
N

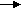 a NaOH Na2 SO4 BaSO4
a NaOH Na2 SO4 BaSO4
Список используемой литературы
Основная
1. Габриелян, О.С. Химия, 10 класс. Базовый уровень /О.С. Габриелян. - М.: Дрофа, 2010.
2. Габриелян, О.С. Химия, 11 класс.Базовый уровень /О.С. Габриелян. - М.: Дрофа, 2010.
3. Маршанова, Г.Л. Техника безопасности в школьной лаборатории: Сборник инструкций и рекомендаций /Г.Л. Маршанова. - М.: АРКТИ, 2002. - 80 с.
Дополнительная
1. Гара, Н.Н. Школьный практикум. Химия. 10-11 кл. /Н.Н. Гара, М.В. Зуева. - М.: Дрофа, 299.- 96 с.
2. Чернобельская, Г.М. Практические занятия и экспериментальные задачи по химии для ПТУ. /Г.М. Чернобельская. - М.: ВШ, 1989. - 127 с.
Интернет - источники
1. Сайт «Учебники XXI века» [Электронный ресурс] / OZON.ru/.
2. Сайт Издательский дом «Первое сентября» [Электронный ресурс] / 1september.ru/.
3. Сайт «Учительская газета» [Электронный ресурс] / ug.ru.ru/.
Содержание
Ведение………………………………………………………………………………..3
Инструкция по технике безопасности………………………………………………4
Практическое занятие №1 «Изготовление моделей молекул органических
соединений» ………………………………………………………………………….7
Практическое занятие №2 «Определение качественного состава углеводородов»………………………………………………………………………10
Практическое занятие №3 «Получение этилена и изучение его свойств»………12
Практическое занятие №4 «Получение уксусной кислоты. Изучение свойств карбоновых кислот» …………….………………………………………………….16
Практическое занятие №5 «Свойства и распознавание пластмасс» …………..19
Практическое занятие №6 «Свойства и распознавание волокон»……………..24
Практическое занятие №7 «Экспериментальное решение задач по курсу органической химии»……………………… ……………………………………..26
Практическое занятие №8 «Получение газообразных веществ и подтверждение химическими опытами их состава и свойств (аммиака и углекислого газа)».…..29
Практическое занятие №9 «Приготовление раствора заданной молярной концентрации»……………………………………………………………………….34
Практическое занятие №10«Экспериментальное решение задач по курсу неорганической химии»…………………..……………………………………….36
Список используемой литературы…….…………………….…….………………..39
Приложение
ПРИЛОЖЕНИЕ
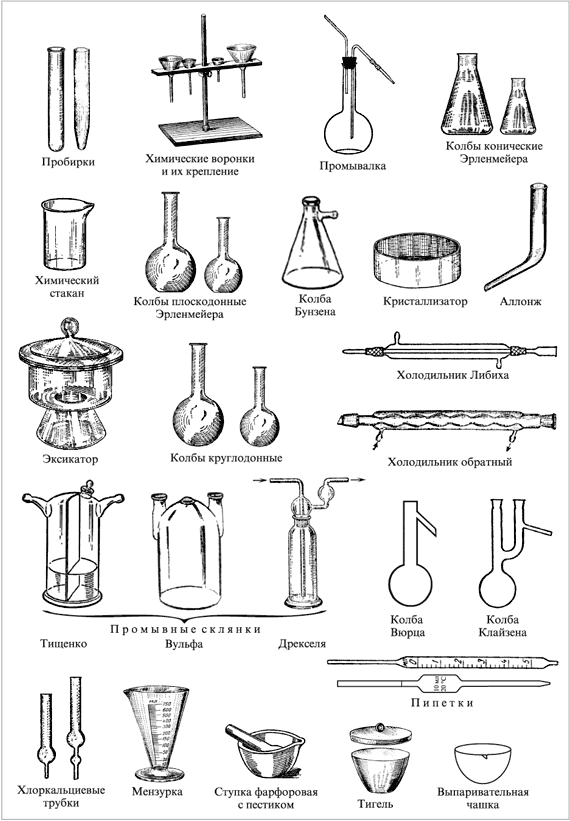
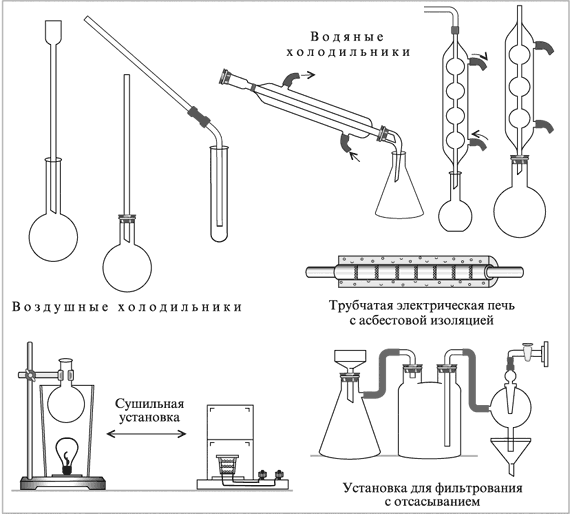
Химическая посуда, приборы и оборудование
Меры предосторожности
при работе с некоторыми веществами
Работа с металлическим натрием
Натрий вынимают из банки (с керосином) пинцетом, отрезают лабораторным ножом необходимое количество, остальное сразу же возвращают в банку. Отрезанный кусочек очищают ножом от корки, отжимают от керосина фильтровальной бумагой и сейчас же вводят в реакцию. Фильтровальную бумагу необходимо сжечь. Нельзя остатки натрия выбрасывать в раковину (возможен взрыв !) или в ведро (урну) для мусора (возможен пожар!). Остатки натрия возвращают в банку, а если они непригодны для работы, то уничтожают растворением в спирте.
Опыты с натрием необходимо вести на некотором удалении от находящихся в помещении людей.
При работе с большим количеством натрия и в случаях, когда реакция ожидается очень бурной (например, при определении азота), глаза необходимо защищать очками.
Работа с концентрированными серной и азотной кислотами
Работы с концентрированными кислотами всегда требуют от работающего максимума внимания и осторожности, особенно при нагревании. Ожоги очень болезненны, сопровождаются долго не заживающими язвами, оставляют рубцы. Особенно следует опасаться поражения глаз. От концентрированных кислот разрушаются одежда и обувь.
Серную кислоту нужно смешивать с водой, приливая кислоту к воде небольшими порциями. Азотную кислоту, смешивая с серной, приливают небольшими порциями. В обоих случаях лучше применять прочную круглодонную колбу, охлаждая ее водой. Небольшие количества (2-3 мл) можно смешивать в пробирке, соблюдая правила техники безопасности. Нельзя перемешивать кислоты с каким-либо веществом, закрывая пробирку пальцем и встряхивая, - неизбежны ожоги. Перемешивать можно легкими ударами пальцами правой руки по нижней части пробирки, удерживаемой верхней своей частью в пальцах левой руки. Жидкость в пробирке также можно легко перемешать, переливая ее в другую пробирку. При всех работах с кислотами в пробирках, а тем более при нагревании отверстие пробирки необходимо держать повернутым в сторону и от себя, и от соседей для предохранения от ожогов (возможно выбрасывание жидкости из пробирки в ходе реакции). Концентрированные кислоты не следует выливать в раковины во избежание порчи канализационных труб - следует сливать их в специальные кислотоупорные керамические банки. При кислотном ожоге немедленно промыть пораженное место под краном большим количеством воды, затем раствором бикарбоната натрия, после чего сделать повязку с мазью от ожогов или обратиться к врачу. В случае поражения глаз - немедленно к врачу.
Работа с эфиром
Необходимо, чтобы поблизости не было открытого пламени. При групповой работе с эфиром все горелки в лаборатории должны быть погашены. Отгонку эфира следует вести на водяной бане, нагретой в стороне от рабочего места. Горелку под баню ставить нельзя, т. к. пары эфира тяжелее воздуха и при выходе из колбы (при неполной герметизации пробки) они опускаются к пламени и дают вспышку. В случае вспышки эфира в пробирке не бросать ее, а накрыть чем-либо (тряпкой, асбестовым полотном) отверстие пробирки.
П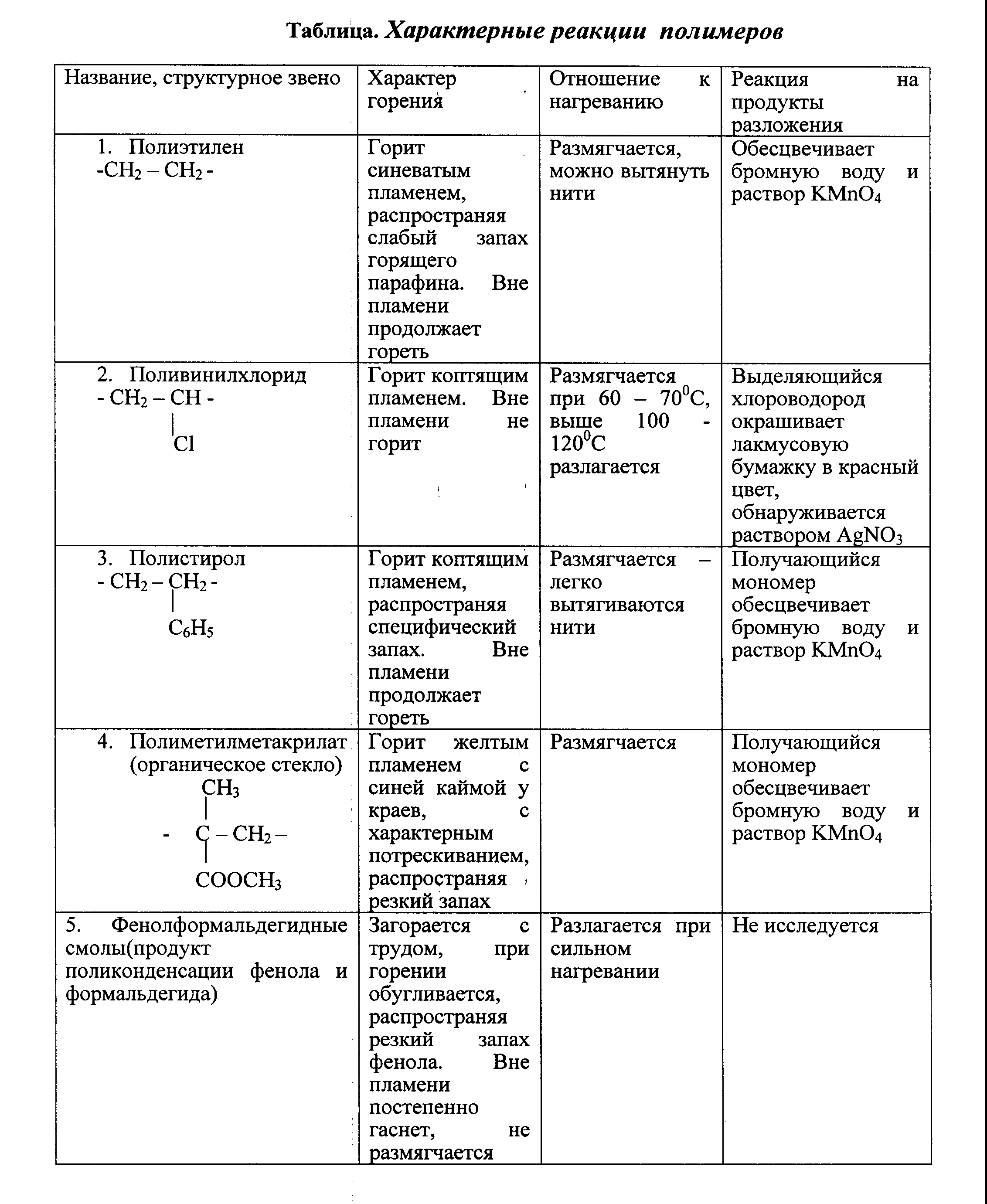 ри возникновении пожара засыпать очаг песком, накрыть влажной плотной тканью, воспользоваться огнетушителем. В случае вспышки одежды плотно обернуть место загорания такой же влажной тканью.
ри возникновении пожара засыпать очаг песком, накрыть влажной плотной тканью, воспользоваться огнетушителем. В случае вспышки одежды плотно обернуть место загорания такой же влажной тканью.