- Преподавателю
- Химия
- Конспект практическая работа получение кислорода
Конспект практическая работа получение кислорода
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Конспекты |
| Автор | Мушрапилова З.Т. |
| Дата | 20.10.2015 |
| Формат | doc |
| Изображения | Есть |
Учитель химии высшей категорий, кандидат педагогических наук:
Мушрапилова З.Т.
План урока по химии для 8 классa
Тема: «Получение и свойства кислород»
Цель: Уметь получать кислород в лаборатории и собирать его вытеснением воздуха; подтвердить опытным путем свойства кислорода; знать правила техники безопасности.
Задачи:
-
Образовательные: Ознакомить учащихся со способами получения кислорода в лаборатории
-
Развивающие: умение наблюдать и затем формулировать свое мнение, взгляд на происходящее; умение экспериментировать и создавать многовариантность результатов. Развивать познавательную активность, логическое и творческое мышление
-
Воспитывающие: Воспитывать исследовательскую активность в познании предметов и явлений; способность продвигать свои идеи и уметь защищать свои исследовательские наработки; чувство коллективизма и взаимопонимания при работе в творческих группах; ответственность, стремление добиваться лучших результатов.
Тип урока: Совершенствование знаний и способов деятельности
Форма организации урока: практическое занятие
Оборудование: Металлический штатив с лапкой, спиртовка, спички, пробирка с газоотводной трубкой, пробирка, комочек ваты, пипетка, химический стакан, лучинка, пероксид водорода, оксид марганца (II) кристаллизатор с водой, две конические колбы с пробками.
Реактивы. KMnO4 кристаллический (5-6 г), пероксид водорода, оксид марганца (II).
Ход урока:
-
Организационный момент 4мин
-
Этап самостоятельного выполнения задания 25 мин
-
Этап рефлексии 5мин
-
Этап информации о домашнем задании 3 мин
-
Этап подведения итогов урока 8мин
Ход урока
-
ОРГАНИЗАЦИОННЫЙ МОМЕНТ 4МИН (проверка готовности учащихся к уроку, отметка отсутствующих, постановка целей урока и сообщение плана проведения занятия).
Учитель: -Здравствуйте, ребята. Садитесь. Кто отмечает отсутствующих в классе? Сегодняшняя тема урока «Получение кислорода в лаборатории».
Учитель: При изучении этой темы:
-
вы узнаете, какие вещества и химические реакции используются для получения кислорода;
-
научитесь получать кислород и доказывать его наличие;
-
научитесь записывать соответствующие уравнения реакций.
Учитель: Все вместе давайте вспомним правила техники безопасности.
Осторожно обращайтесь с химическим оборудованием!
Помните! Пробирку прогревают, держа ее в наклонном положении, по всей длине двумя-тремя движениями в пламени спиртовки. При нагревании направляйте отверстие пробирки в сторону от себя и соседей.
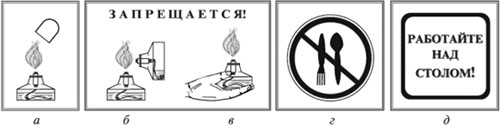
Тушите спиртовку только колпачком (а).
Запрещается зажигать одну спиртовку с помощью другой (б).
Запрещается передавать спиртовку в зажженном виде (в).
Запрещается пробовать вещество на вкус (г).
Работу проводить только над столом (д)
Учитель: я вам давала самостоятельно изучить получение кислорода в лаборатории изучить самостоятельно. Вы прочитали? В тетрадях для практических работ запишите название темы, цель, перечислите оборудование и реактивы, и после оформите таблицу для отчета.
Учитель: написали?
Уч-ся: да написали.
Учитель: Тогда приступаем в практическому занятию. Будете собирать кислород методом вытеснения воздуха и разложением пероксида водорода.
-
ЭТАП САМОСТОЯТЕЛЬНОГО ВЫПОЛНЕНИЯ ЗАДАНИЯ 25 МИН
Получение кислорода
методом вытеснения воздуха
(15 мин)
1. Перманганат калия (КMnO4) поместите в сухую пробирку. У отверстия пробирки положите рыхлый комочек ваты.
2. Закройте пробирку пробкой с газоотводной трубкой, проверьте на герметичность (рис. 1).
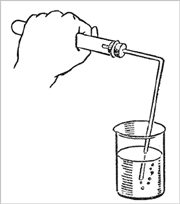
Рис. 1.
Проверка прибора
на герметичность
Для проверки герметичности конец газоотводной трубки опустите в стакан с водой не глубже, чем на 1 см. Пробирку слегка нагрейте на пламени спиртовки. Если при этом в воду выделяются пузырьки воздуха, то прибор собран герметично. После этого можно приступать к опыту. Укрепите прибор в лапке штатива.
3. Газоотводную трубку опустите в стакан, не касаясь дна, на расстоянии 2-3 мм (рис. 2).
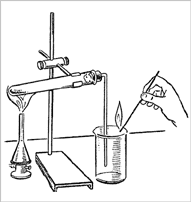
Рис. 2.
Получение из перманганата калия кислорода
и собирание его методом вытеснения воздуха.
Обнаружение кислорода тлеющей лучинкой
4. Подогрейте вещество в пробирке. (Помните правила техники безопасности.)
5. Проверьте наличие газа тлеющей лучинкой (угольком). Что наблюдаете? Почему кислород можно собирать методом вытеснения воздуха?
6. Оформите проделанную работу
Получение кислорода
разложением пероксида водорода
10 мин
Учитель: Налейте в стакан по 8-15 мл раствора пероксида водорода. Добавьте в стакан (на кончике шпателя) оксид марганца (IV). Что наблюдаете? Проверяем наличие кислорода тлеющей лучинкой. Лучинку не макните в пероксид водорода. Напишите уравнение реакции.
2 H2O2 = 2 H2O + O2
пероксид катализатор кислород
водорода
Учитель: Оформите проделанную работу
Таблица 1
Практическая работа №3 Тема «Получение и свойства кислорода»
Реактивы
Что делали?
Что наблюдали?
Уравнение реакции
Выводы
-
Разложение KMnO4
Поместили KMnO4 в пробирку, у отверстия пробирки положили рыхлый комочек ваты, проверили на герметичность, опустили газоотводную трубку в стакан, подогрели вещество, проверили кислород тлеющей лучинкой
При проверке на герметичность выделялись пузырки, это означает что прибор собран правильно.
Выделение кислорода проверили лучинкой.
Тлеющая лучинка загорелась ярким пламенем.
2KMnO4=K2MnO4+
MnO2+O2
С + О2 = СО2
При нагревании перманганат калия начинает разлагаться, выделяющийся кислород поступает по газоотводной трубке в колбу. Кислород тяжелее воздуха, поэтому не покидает колбу и постепенно заполняет ее. Тлеющая лучинка вспыхивает в колбе: значит нам удалось собрать кислород.
2.Разложение пероксида водорода
Налили в стакан пероксид водорода и добавили оксид марганца (IV). Проверили кислород тлеющей лучинкой

Пошла бурная реакция между пероксидом водорода и оксидом марганца (IV).
Тлеющая лучинка загорелась ярким пламенем.
2 H2O2 = 2 H2O + O2
Кислород - газ без цвета и запаха.
Учитель: ВЫВОД. Один из способов получения кислорода в лаборатории - разложение КMnO4. Кислород - газ без цвета и запаха, тяжелее воздуха в 1,103 раза (Mr(O2) = 32, Mr(возд.) = 29, из чего следует 32/29 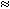 1,103), малорастворим в воде. Вступает в реакции с простыми веществами, образуя оксиды. Приведите рабочее место в порядок. Сдайте тетради на проверку.
1,103), малорастворим в воде. Вступает в реакции с простыми веществами, образуя оксиды. Приведите рабочее место в порядок. Сдайте тетради на проверку.
-
ЭТАП ПОДВЕДЕНИЯ ИТОГОВ УРОКА 8МИН
Учитель: ВЫВОД. Один из способов получения кислорода в лаборатории - разложение КMnO4. Кислород - газ без цвета и запаха, тяжелее воздуха в 1,103 раза (Mr(O2) = 32, Mr(возд.) = 29, из чего следует 32/29 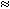 1,103), малорастворим в воде. Вступает в реакции с простыми веществами, образуя оксиды. Приведите рабочее место в порядок. Сдайте тетради на проверку.
1,103), малорастворим в воде. Вступает в реакции с простыми веществами, образуя оксиды. Приведите рабочее место в порядок. Сдайте тетради на проверку.
Учитель: А теперь займемся решением задачи. Пишем условие задачи.
Задача. Определите, какое из соединений железа - Fe2О3 или Fe3О4 - богаче железом?
Дано:
Найти:
Fe2O3,
Fe3O4.
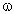 (Fe) в Fe2O3,
(Fe) в Fe2O3,
![]() '(Fe) в Fe3O4
'(Fe) в Fe3O4
Решение
![]() (Х) = n•Ar(X)/Mr, где n - число атомов элемента Х в формуле вещества.
(Х) = n•Ar(X)/Mr, где n - число атомов элемента Х в формуле вещества.
Mr(Fe2O3) = 56•2 + 16•3 = 160,
![]() (Fe) = 56•2/160 = 0,7,
(Fe) = 56•2/160 = 0,7,
![]() (Fe) = 70%,
(Fe) = 70%,
Mr (Fe3O4) = 56•3 + 16•4 = 232,
![]() '(Fe) = 56•3/232 = 0,724,
'(Fe) = 56•3/232 = 0,724,
![]() '(Fe) = 72,4%.
'(Fe) = 72,4%.
Ответ. Fe3O4 богаче железом, чем Fe2O3.
-
ЭТАП ИНФОРМАЦИИ О ДОМАШНЕМ ЗАДАНИИ 3 МИН
Учитель: § стр
-
ЭТАП РЕФЛЕКСИИ 5МИН
Учитель: Насколько вы довольны выполненной работой. Покажите смайлики «веселый» или «грустный».


