- Преподавателю
- Химия
- Сандық есептерді шығару үлгілері (9 сынып)
Сандық есептерді шығару үлгілері (9 сынып)
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Жильжанова Н.Т. |
| Дата | 08.04.2015 |
| Формат | doc |
| Изображения | Есть |
Сандық есептер №1
Тақырыбы: Әрекеттесуші заттардың біреуі артық алынғандағы химиялық реакция теңдеулері бойынша есептеулер
1-мысал: Құрамында 16 г мыс(ІІ) сульфаты бар ерітіндіге 12 г темір үгіндісі қосылды. Осы кезде неше грамм мыс бөлінгенін және қай зат артық қалғанын табыңдар.
Шешуі:
1. Есептің шартында берілген мыс (ІІ) сульфаты мен темірдің зат мөлшерінен
ν = m/M формула арқылы табымыз:
ν (СuSO4)=16г / 160г/моль=0,1 моль; ν (Ғе)=12г / 56г/моль=0,21 моль;
0,1 моль 0,21 моль
2. Реакция теңдеуін құрамыз: СuSO4 + Ғе = ҒеSO4 + Сu
1 моль 1 моль 1 моль
Теңдеуден байқағанымыз мыс (ІІ) сульфаты мен темір әрекеттескенде мольдік қатынастары 1:1 болады. Есептің берілу шартына сай есептелген мыс сульфаты мен темірдің мөлшерін салыстырсақ, ν (СuSO4)<ν (Fe) болғандықтан темір артық алынғанын білеміз. Әрі қарай есептеулер СuSO4 бойынша жүргізіледі:
Түзілген мыстың массасын табамыз:
М(СuSO4)=64 г/моль; ν (СuSO4)= ν(Ғе)=0,1 моль;
m(Сu)=64 г/моль*0,1 моль =64 г
Темірдің массасын табамыз:
ν(СuSO4)=ν(Ғе)=0,1 моль;
Реакцияға темірдің 0,1 молі қатысады. Жұмсалған темірдің массасын табамыз: m(Ғе)=56 г/моль*0,1 моль = 5,6 г. Артық қалған темірді есептесек: m(Ғе)=12 г - 5,6 г = 6,4 г.
Жауабы: 6,4 г мыс алынды, 6,4 г темір артылып қалды.
2-мысал: Массасы 15г калий гидроксиді бар ерітінді мен массасы 30г алюминий хлориді бар ерітіндіні араластырғанда неше грамм алюминий гидроксиді түзіледі.
Б ер: AlCl3 + 3KOH = Al(OH)3 + 3KCl
ер: AlCl3 + 3KOH = Al(OH)3 + 3KCl
m (AlCl3) = 30 г 1.Әрекеттесуші екі заттың да массалары берілгендіктен
m (KOH) = 15 г олардың қайсысы артық, қайсысы кем екендігін анықтау
(KOH) = 15 г олардың қайсысы артық, қайсысы кем екендігін анықтау
Табу керек: m(AlOH)3 - ? керек. Ол үшін заттың берілген массасы оның теңдеу
бойынша қажетті массасына бөліп, мольдік факторын анықтаймыз: 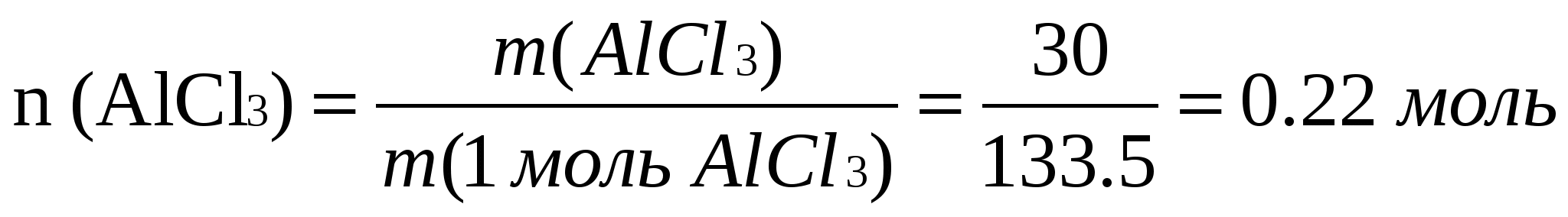 ,
,
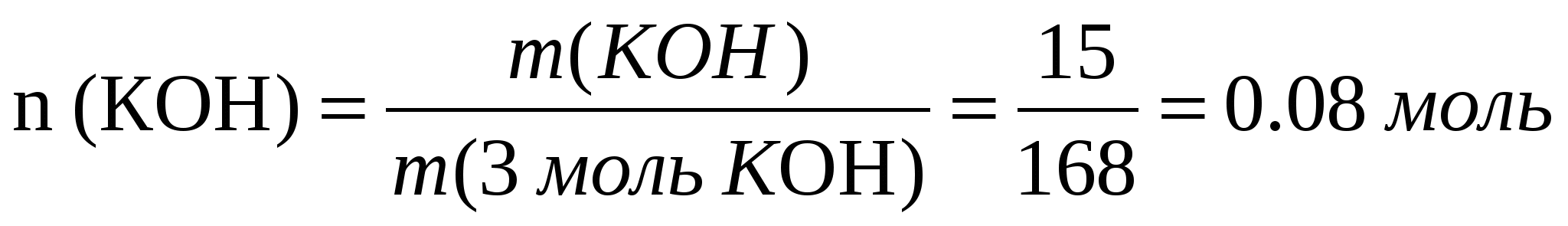
2.Олай болса, калий гидроксиді аз мөлшерде берілген 0,88 ˂ 0,22, ол реакцияда толығымен жұмсалады. Енді реакция нәтижесінде түзілген заттың массасын есептейміз:
m (Al(OH)3 = v * M
m (Al(OH)3 = 0,089 * 78 = 6,9 г (Al(OH)3)
Жауабы: m (Al(OH)3 = 6,9 г
Сандық есептер №2.
Тақырыбы: Теориялық мүмкіндікпен салыстыра отырып, реакция өніміндегі шығымның массалық үлесін есептеу.
Реакция теңдеуі бойынша теория жүзінде алынуға тиісті өнім массасының іс жүзінде (практикалық) шығатын өнімнің массасына қатынасын өнімнің массалық үлесі (η) эта әрпімен белгілейді:
η=mпр./mтеор.*100% (масса бойынша) (1)
немесе
η =Vпр./Vтеор.*100% (көлем бойынша) (2)
формулалары арқылы есептеледі.
1-мысал. Массасы 1г сутек газын хлормен синтездеу арқылы 32г хлорсутек газы алынды. Теориялық мүмкіндікпен салыстырғандағы өнімнің массалық үлесін (%) анықтаңдар.
Шешуі:
1. Алдымен реакция теңдеуін жазып, теңестіреді, есептің шартында берілген сан мәндерін жазады да, теңдеудегі қажетті заттың астын сызып, ν, M, m белгілейді:
х г теориялық
1г 32 г іс жүзінде
Н2 + Сl2= 2 HCl
ν 1 моль 2 моль
M 2 г/моль 36,5 г/моль
m 2 г 73 г
2. Пропорция құрып, оны шешеміз:
1г/2г=хг/73г, х=36,5 г HCl-тің теориялық шығымы.
3. Енді (2) формула бойынша заттың практикалық шығымы (HCl) 87,67% немесе 0,8767 массалық үлеске сәйкес.
2-мысал. Теория жүзіндегімен салыстырғандағы шығымы 25,12 % болса, массасы 3,8 г аммиак алу үшін азот пен сутектің қанша көлемі (қ.ж.) әрекеттесетінің есептеңдер.
Шешуі:
1. Тік формуланы (1) пайдаланып, аммиактың теориялық шығымы бойынша массасын табамыз.
Егер: 3,8 г NH3 ______25,12% болса,
х г NH3 ______100% болады.
х=3,8г * 100% / 25,12% = 15,13%
2. Реакция теңдеуін жазып теңестіріп, сан мәндерін қоямыз:
х л 15,13 г
N2 + 3H2=2NH3
ν 1 моль 2 моль
Vм 22,4 л/моль 17г/моль
V 22,4 л 34 г
3. Пропорция құрып, азоттың көлемін табамыз:
х/22,4=15,13/34; х= 9,96 л =10 л
Жауабы: V(N2)=10 л
Сандық есептер №3.
Тақырыбы: Құрамында белгілі қоспасы бар басқа заттың массасын реакция теңдеуі бойынша есептеу.
1-мысал. Құрамында 8% қоспасы бар 300 кг әктасты өртегенде алынатын сөндірілмеген әктің массасын есептеңдер.
Мұндай есептерді шығарғанда тірек формуласы пайдаланамыз:
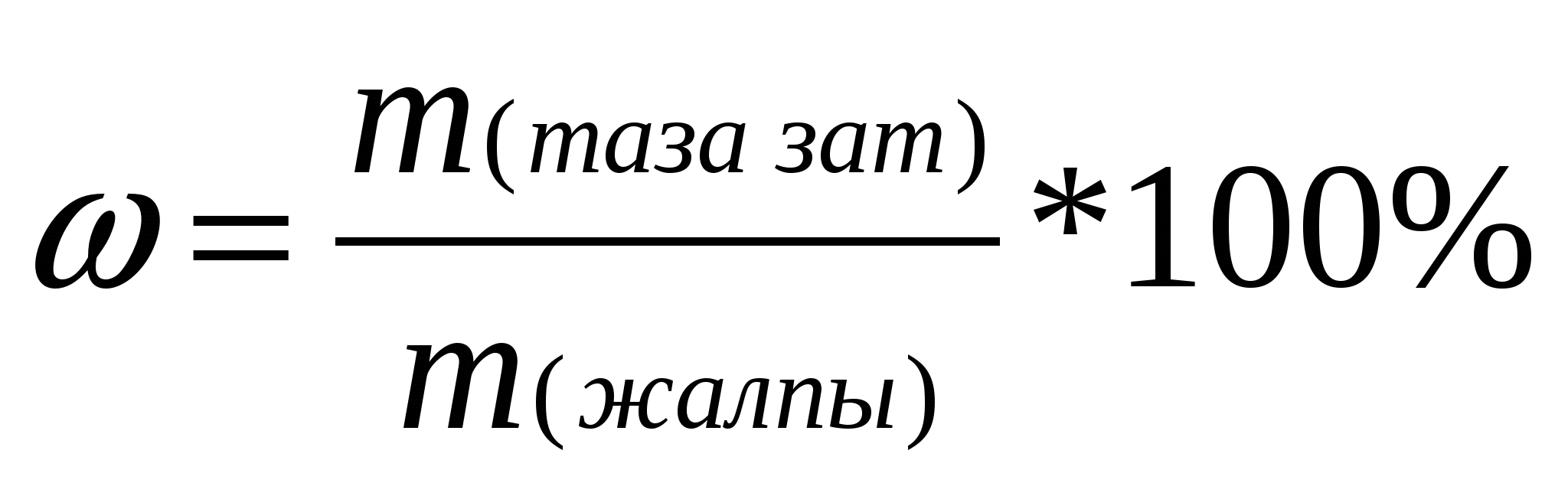 w(таза зат)- минералдың немесе қоспасының құрамындағы таза заттың массалық үлесі; m (таза зат)- заттың массасы; m (жалпы)- минералдың (қоспаның)жалпы массасы;
w(таза зат)- минералдың немесе қоспасының құрамындағы таза заттың массалық үлесі; m (таза зат)- заттың массасы; m (жалпы)- минералдың (қоспаның)жалпы массасы;
Шешуі: 1) Табиғи әктастың құрамындағы таза заттың (кальций карбонаты) массалық үлесін табамыз: w(таза зат)=100%- w(қоспа)=100%-8=92%
-
Тірек формуласын қолданып, таза кальций карбонатының массасын табамыз:
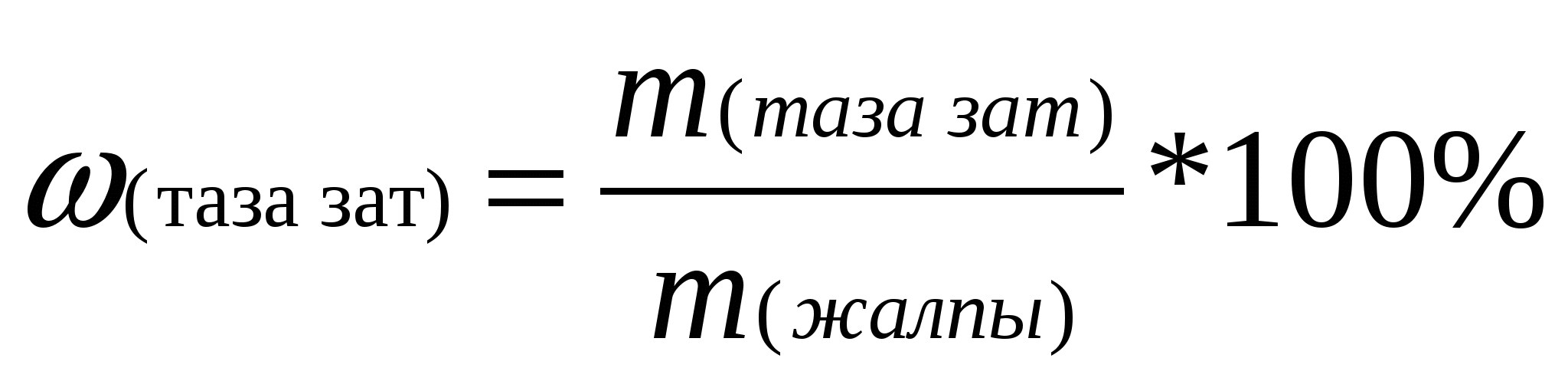
![]() , бұдан
, бұдан
-
Әктасты өртегенде жүретін реакция теңдеуін пайдаланамыз:
276 кг х кг
СаСОЗ = СаО + СО2
ν 1 моль 1 моль
М 100 кг/моль 56 кг/моль
m 100 кг 56 кг
-
Пропорция құрып, кальций оксидінің массасын табамыз:
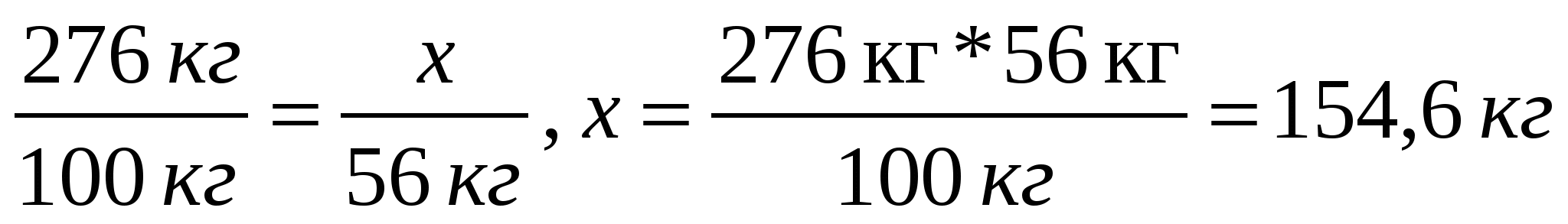 Жауабы: сөндірілмеген әктастың массасы 154,6 кг СаО
Жауабы: сөндірілмеген әктастың массасы 154,6 кг СаО
2-мысал. Құрамында 10% жанбайтын қоспасы бар 20 г көмір жанғанда неше литр (қ.ж.) көмірқышқыл газы бөлінеді?
Б ер: шешуі С+ О2 = CO2
ер: шешуі С+ О2 = CO2
w(қоспа) = 10% Массалық үлесі бойынша реакцияға түсетін таза заттың
m (C) = 20 г массасын есептеу: 100% - 10 % = 90% (С)
(C) = 20 г массасын есептеу: 100% - 10 % = 90% (С)
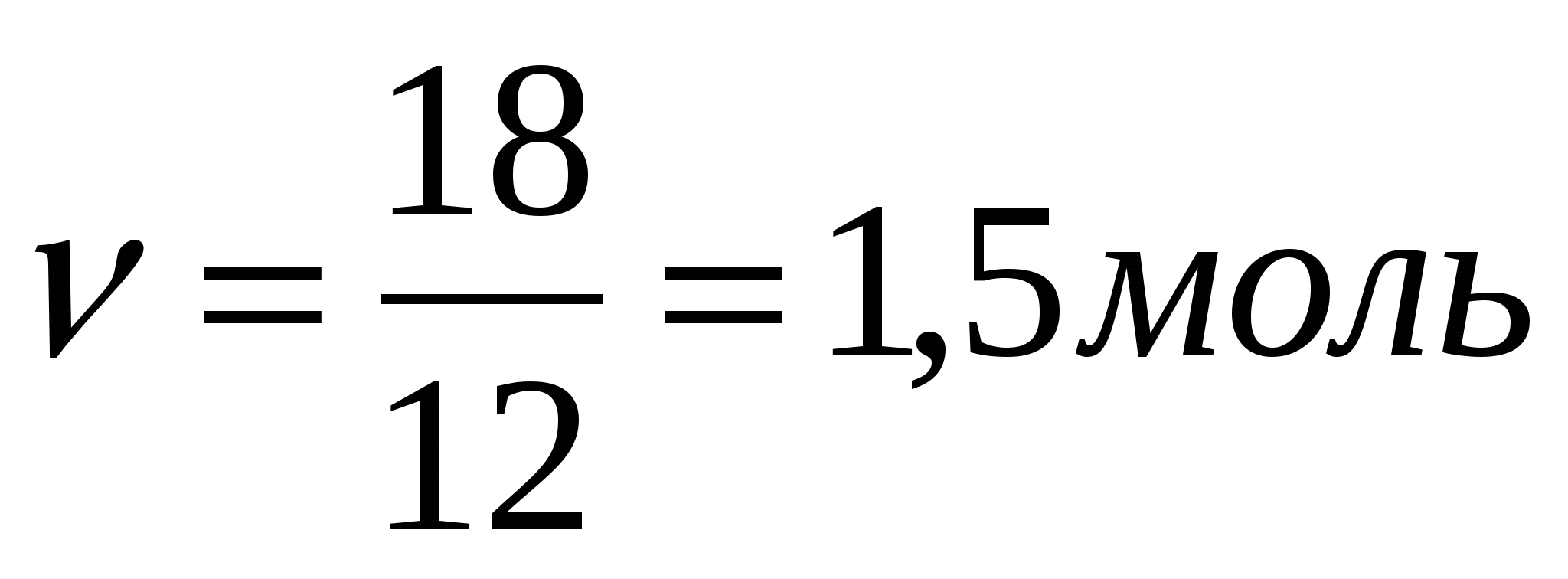
 ,
, 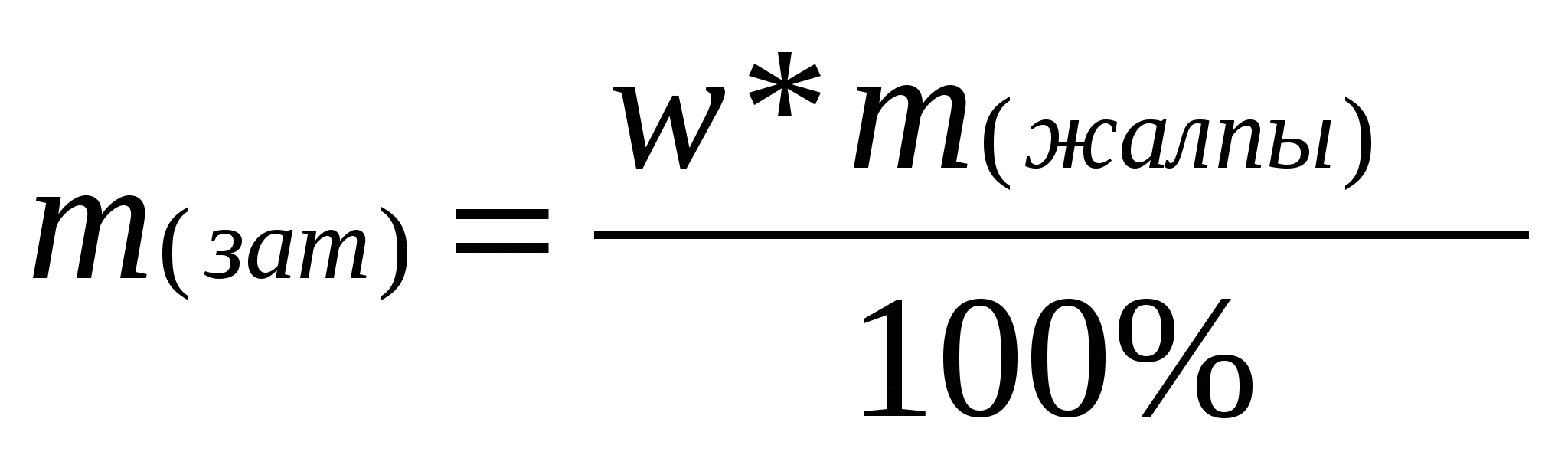 ,
, 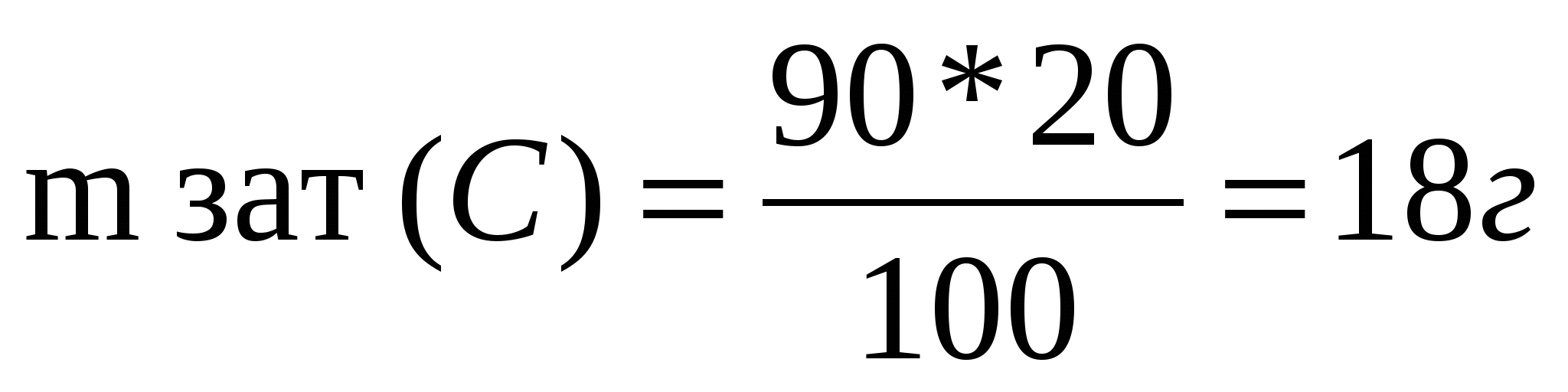
Реакция теңдеуі бойынша бөлінген газдың көлемін есептейміз:
V = 1,5 * 22,4 = 33,6 л Жауабы:V(CO2) = 33,6 л
3-мысал. Массасы 30 кг әктасқа тұз қышқылымен әсер еткенде, 5,6 м3 (қ.ж.) көмірқышқыл газы түзіледі. Табиғи әктастағы қоспаның массалық үлесін есептеңдер.
-
Жүретін химиялық реакцияның теңдеуін құрамыз:
х кг 5,6м3
СаСОЗ + 2НСl = СаСl2 + СО2+ Н2О
ν 1 моль 1 моль
М 100 кг/моль V M 22.4 м3/моль
m 100 кг V 22.4 м3
-
Теңдеуге сәйкес пропорция құрып, әктастағы таза кальций карбонатының массасын табамыз:
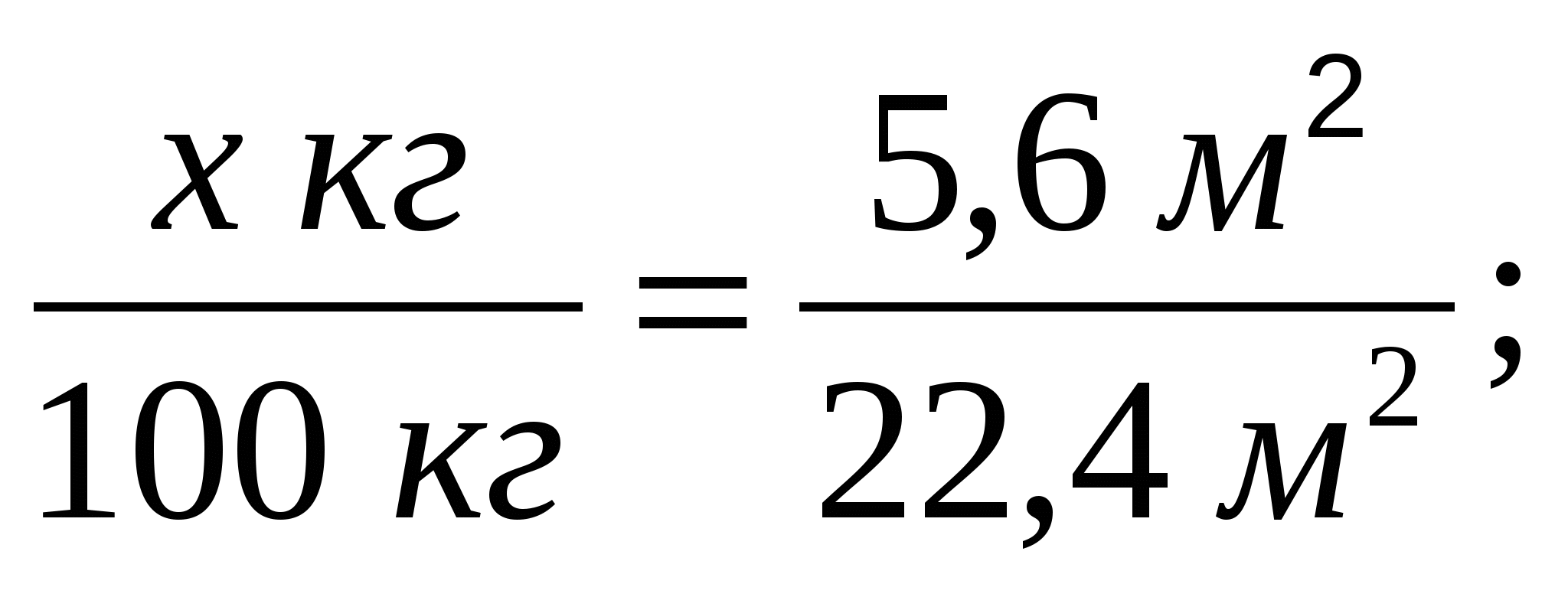
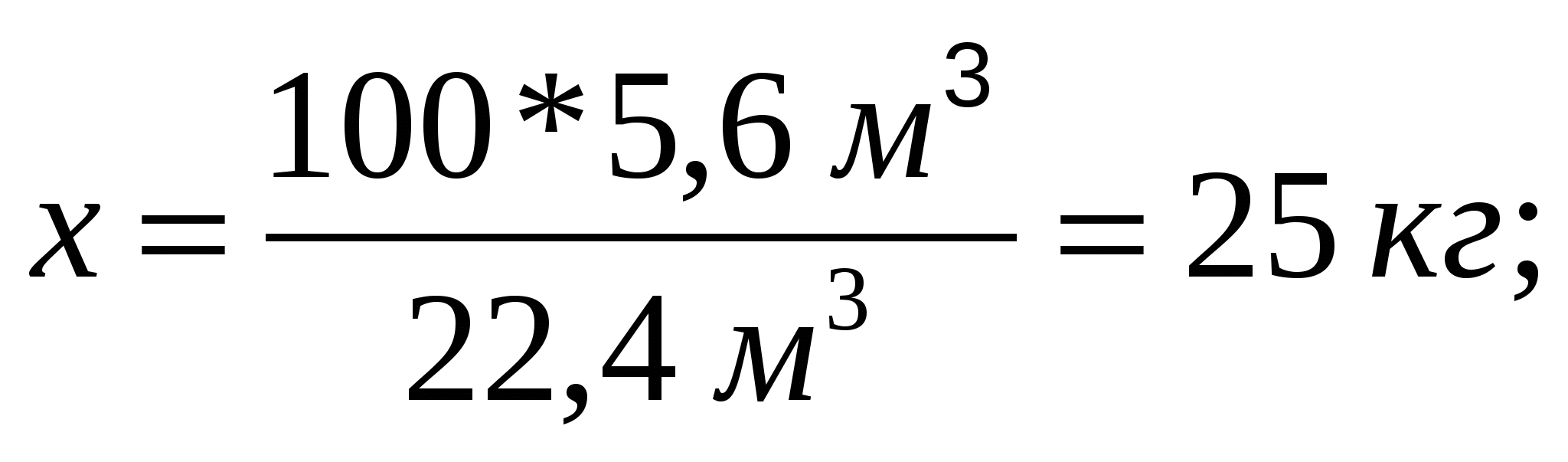
-
Табиғи әктастағы қоспаның массасын тауып, оның массалық үлесін есептейміз:
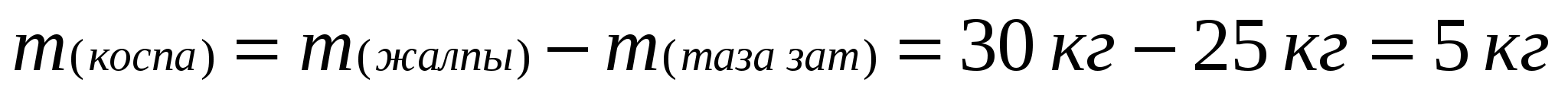
Сандық есептер №4.
Тақырыбы: Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ тектес заттардың молекулалық формуласын анықтау.
1-есеп. Құрамында көміртектің массалық үлесі 85,7%, сутектің массалық үлесі 14,3% болатын, ауа бойынша салыстырмалы тығыздығы 1,93-ке тең көмірсутектің молекулалық формуласын анықтаңдар.
Б ерілгені: Шешуі: 1. Заттың қарапайым формуласы С×Нy
ерілгені: Шешуі: 1. Заттың қарапайым формуласы С×Нy
w (С)=85,7% Заттың 100 г үлгісін қарастырайық. Зат құрамындағы
w (H)=14,3% элементтердің - көміртек пен сутектің массалары, олардың
D (ауа)= 1,93 массалық үлестеріне тең болады: m(С)=85,7 г; m(Н)=14,3 г
(ауа)= 1,93 массалық үлестеріне тең болады: m(С)=85,7 г; m(Н)=14,3 г
Т/к: СхНу=? 2. Әр элементтің зат мөлшерін табу үшін, элементтің массасын
оның молярлық массасына бөлеміз:
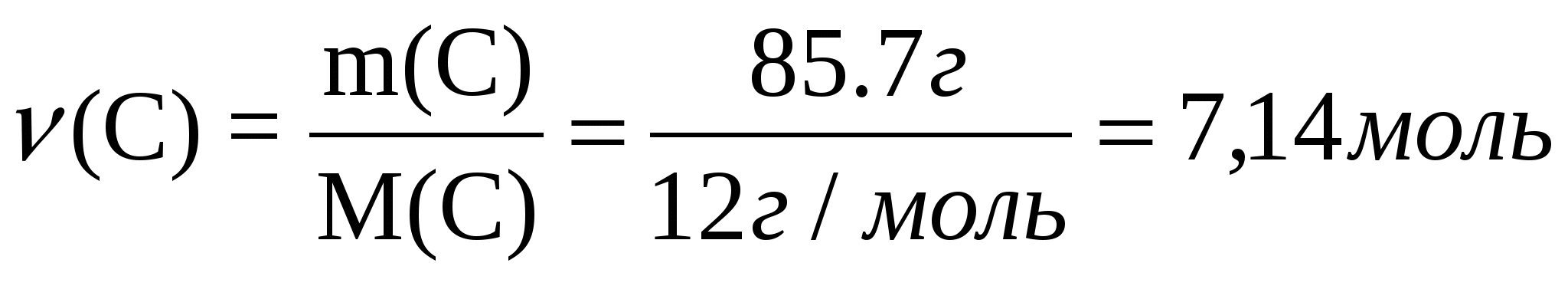
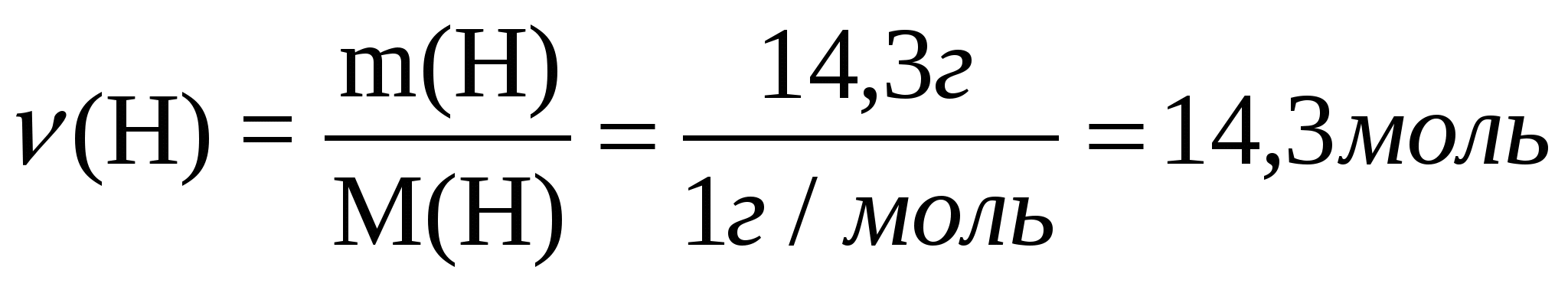
3. Әр элементтің зат мөлшері формуладағы индекстерді көрсетеді. 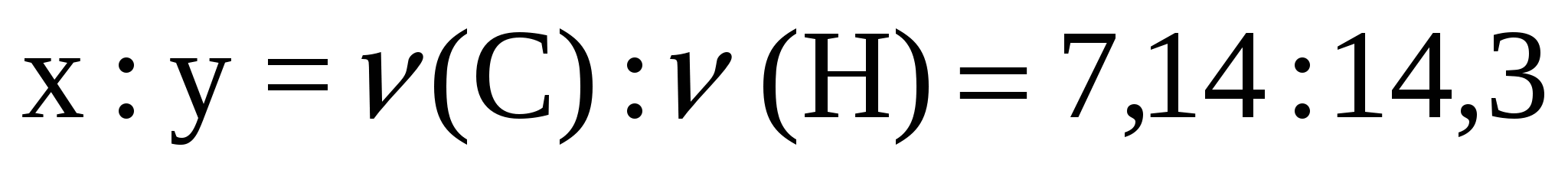 Молекуладағы атомдардың сандары бүтін болуы керек, сондықтан сандардың кішісін (7,14) бірлік ретінде алып, олардың қатынастарын табамыз:
Молекуладағы атомдардың сандары бүтін болуы керек, сондықтан сандардың кішісін (7,14) бірлік ретінде алып, олардың қатынастарын табамыз:
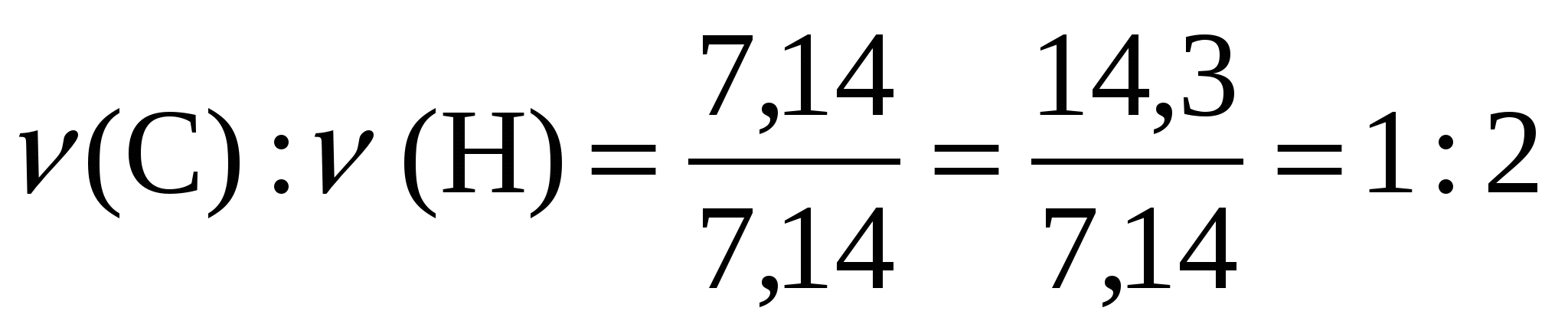 Бұл қатынас қосылыс құрамындағы 1 атом көміртекке 2 атом сутек келетінін көрсетеді. Яғни, заттың қарапайым формуласы СН2 болады, ал оның молекулалық массасы 14-ке тең.
Бұл қатынас қосылыс құрамындағы 1 атом көміртекке 2 атом сутек келетінін көрсетеді. Яғни, заттың қарапайым формуласы СН2 болады, ал оның молекулалық массасы 14-ке тең.
4. Салыстырмалы тығыздығы арқылы берілген көмірсутектің нақты салыстырмалы молекулалық массасын табамыз: Мr(С×Нy) =29*Dауа=29*1.93=56
5. Қарапайым формуланың массасы нақты массадан 4 есе кем екен: 56:14=4. Сондықтан іздеп отырған көмірстутектің молекулалық формуласын шығару үшін қарапайым формула құрамындағы көміртек пен сутектің санын төртке көбейтіп, С4Н8 табамыз.
Жауабы: С4Н8


