- Преподавателю
- Химия
- Обобщающий урок по теме: «Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома»
Обобщающий урок по теме: «Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома»
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Ящук Н.А. |
| Дата | 05.03.2014 |
| Формат | doc |
| Изображения | Есть |
Обобщающий урок по теме:
«Периодический закон и периодическая система
химических элементов Д. И. Менделеева. Строение атома».
Цели:
Образовательная: обобщить знания по пройденной теме, повторить основополагающие вопросы и понятия, отработать умения рассматривать строение атома.
Развивающая: развитие внимания, логического мышления через взаимосвязь: положение в ПС - строение атома - свойства; развитие творческого мышления; развитие навыков работы в группе.
Воспитательная: воспитание настойчивости в достижении знаний, чувства товарищества и коллективизма при работе в группе.
 Тип урока: обобщение. Дидактическое и методическое оснащение урока:
Тип урока: обобщение. Дидактическое и методическое оснащение урока:
1. Презентация
-
Раздаточный материал
-
Карточки с заданиями
Оборудование:
-
Периодическая система химических элементов Д. И. Менделеева
-
Компьютер, телевизор
3.Реактивы
Знания и умения, необходимые учащимся во время урока.
Знать: формулировку периодического закона, структуру и основные закономерности периодической системы химических элементов Д. И. Менделеева, значение периодического закона, строение атома и распределение электронов в атомах химических элементов.
Уметь: разъяснять физический смысл порядкового номера химического элемента, номера периода, номера группы, определять состав атомных ядер, строение электронных оболочек атомов; давать общую характеристику химического элемента по положению в периодической системе и строению атома; сравнивать металлические и неметаллические свойства элементов одного периода и одной группы.
ДЕВИЗ УРОКА: «Чтобы стать настоящим химиком, надо знать, уметь, думать!»
ЭПИГРАФ УРОКА:
"Наши знания не могут иметь конца именно потому, что предмет познания бесконечен" (Паскаль)
ХОД УРОКА.
І. Организационный момент. Приветствие
ІІ. Актуализация и целеполагание
- Несколько уроков мы с вами посвятили изучению очень важного, основополагающего закона, позволяющего упорядочить и классифицировать химические элементы - Периодического закона, сформулированного Д.И. Менделеевым. Познакомились с тем, как устроена периодическая система химических элементов, а самое главное научились пользоваться её данными для каждого элемента, чтобы рассмотреть строение атома и дать ему характеристику.
Цель нашего урока сегодня вспомнить и обобщить полученные знания, по основным понятиям и основополагающим вопросам темы, отработать умения работать с периодической системой. От вас требуется активность на уроке, т.к. оценка будет складываться из устных ответов и выполнения проверочной работы.
Откройте тетради, запишите число, классная работа и тему урока.
Еще алхимики пытались найти закон природы, на основе которого можно было бы систематизировать химические элементы. Но им недоставало надежных и подробных сведений об элементах. К середине XIX в. знаний о химических элементах стало достаточно, а число элементов возросло настолько, что в науке возникла естественная потребность в их классификации.
УЧИТЕЛЬ:
Думаю, вы, ребята, замечали, что
«Мир сложен.
Он полон событий, сомнений,
И тайн бесконечных, и смелых догадок,
Как чудо Природы, является гений
И в хаосе этом находит порядок
Кого вы можете назвать гением в области химии по наведению порядка среди химических элементов?
УЧЕНИК: Гением можно назвать Д. И. Менделеева.
УЧИТЕЛЬ: Какой закон открыл Д.И.Менделеев?
УЧЕНИК: Периодический закон был открыт в 1869 году.
Периодический закон - основа современной химии; его открытие дало мощнейший толчок в развитии химических знаний, были разработаны теории строения атома и химической связи. В свою очередь, эти теории позволили глубже понять сущность и смысл Периодического закона.
УЧИТЕЛЬ: А почему Менделеев назвал открытый им закон законом периодичности. Не могли бы вы его прочесть?
УЧЕНИК:
Современная формулировка периодического закона - свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от зарядов атомных ядер.
УЧИТЕЛЬ: В виде чего предложил Д. И. Менделеев графическое изображение периодического закона?
УЧЕНИК: Графическое изображение периодического закона Менделеев предложил в виде Периодической системы химических элементов.
УЧИТЕЛЬ: Что вы можете сказать о структуре Периодической системы химических элементов?
УЧЕНИК: Периодическая система представлена горизонтальными рядами (их семь) - периодами (большими и малыми) и вертикальными столбцами (их восемь) - группами, состоящими из главных и побочных подгрупп.
Периодическая система постоянно дополняется, достраивается с открытием новых элементов. Сейчас уже их 114.
Д. И. Менделеев писал: «... периодическому закону будущее не грозит разрушением, а только надстройки и развитие обещает».
И это действительно так. В периодической системе всего лишь чуть свыше ста элементов, а многое можно черпать из неё: это, прежде всего, строение атома и свойства элементов и их соединений, а это ещё название небесных тел, географических объектов, имена величайших людей, имена мифологических героев и немного истории.
УЧИТЕЛЬ: Меняются ли свойства элементов в периодах и группах? Объясните, как они меняются?
УЧЕНИК: В периодах с увеличением относительных атомных масс (слева направо) наблюдается ослабление металлических и усиление неметаллических свойств. Группы состоят из двух подгрупп. В главных подгруппах (сверху вниз) с увеличением относительных атомных масс усиливаются металлические свойства элементов и ослабевают неметаллические.
УЧИТЕЛЬ: В чём физический смысл порядкового номера элемента?
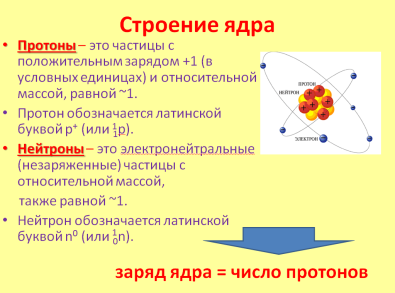
УЧЕНИК: Порядковый номер элемента показывает: заряд ядра атома, количество электронов, вращающихся вокруг ядра, число протонов в ядре.
В этом заключается физический смысл атомного (порядкового) номера элемента в Периодической системе элементов: Атомный (порядковый) номер элемента = число протонов в ядре = заряд ядра атома = число электронов в атоме.
«Современные модели атома»
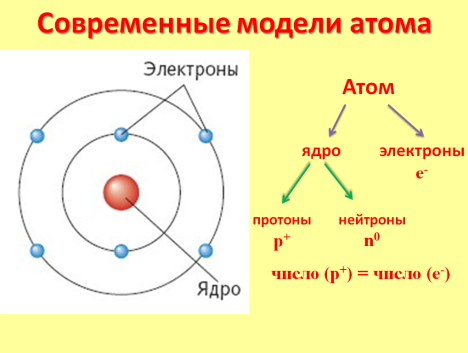
УЧИТЕЛЬ: Давайте вспомним, что называется массовым числом
УЧЕНИК: Сумма чисел протонов и нейтронов в атоме называется массовым числом.
Z + N = A,
где Z - число протонов, N - число нейтронов, A - массовое число.
Из этой формулы можно определить: число нейтронов: N = A - Z.
Задание « Расскажи обо мне»
Ученики работают в тетрадях, у доски 2 ученика
1.Дать характеристику элементу №17.
2.Дать характеристику элементу №11.
План характеристики элемента, по положению его в ПС.
Химический символ
Название элемента
Положение элемента в ПС
Строение атома химического элемента
Свойства атомов элемента
Формула высшего оксида, его характер
Водородные соединения
Формула гидроксида
Сравнение с соседними элементами по периоду и группе
УЧИТЕЛЬ
Сейчас мы проведем викторину «Выбирай вопрос и отвечай!!!»
-
Какой элемент-металл входит в состав костей?
-
Какой элемент-металл входит в состав хлорофилла?
-
Какой элемент-металл входит в состав белка крови - гемоглобина?
-
Какой элемент-металл входит в состав поваренной соли?
-
Какой элемент-металл входит в состав питьевой соды?
-
Какой элемент-металл входит в состав мела и известняка?
-
Какой элемент-металл входит в состав руды гематит?
-
Какой элемент-металл входит в состав корунда?
-
Какой элемент-металл входит в состав минерала пирит?
Класс разделен на 3 группы. Ученики работают в группах. Даны 9 вопросов за 2 минуты необходимо на них ответить. Группы меняются ответами. Капитаны объявляют результат.
П Р О В Е Р Ь Т Е С Е Б Я:
Металл костей - кальций
Металл хлорофилла - магний
Металл белка гемоглобина - железо
Металл поваренной соли - натрий
Металл питьевой соды - натрий
Металл минералла гематита - железо
Металл мела и известняка - кальций
Металл корунда - алюминий
Металл минералла пирита - железо
Учите материал,
трудитесь терпеливо,
тогда все получится…
ХИМИЯ - ЭТО МЫШЛЕНИЕ,
ЭТО ЛОГИКА, ЭТО ЗНАНИЯ…
УЧИТЕЛЬ
Почему же никому, кроме Д. И. Менделеева, не удалось открыть Периодический закон?
УЧЕНИК
Объективных предпосылок, которые у всех были равные, мало. Очень важен субъективный, личностный фактор. У Менделеева он был очень высок. Это и энциклопедичность знаний, уникальное умение обобщать факты, гениальное предвидение на этой основе новых фактов и оправданный научный риск.
-
"Трудитесь, трудясь, вы сделаете всё и для близких и для себя, а если при труде успеха не будет, будет неудача - не беда - попробуйте еще раз!"
(Д.И.Менделеев)
3.Химическая пауза
4.Проектная деятельность
В течении нескольких недель вы готовили свои проекты. Сейчас пришло время их представить.
1 проектная группа «Таблица Менделеева внутри нас»
Виртуальная лаборатория
2 проектная группа «Таблица Менделеева в табаке»
5. Закрепление
Мы с вами закончили изучение темы «Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома» и узнали, что современная наука открыла в природе и изготовила искусственным путём пока 114 химических элементов. А как разнообразны вещества, из которых состоят Земля и звёзды, планеты и другие тела вселенной. Мир веществ очень многообразен. В настоящее время их насчитывается более 10 млн., и каждый год создаются новые вещества. Учёные всё глубже познают строение вещества. Особенно больших успехов человечество достигло после того, как установило, что атом сложная система.
Тесты, взаимопроверка.
-
Подводим итог урока. Рефлексия ( по принципу не законченного предложения).
Прием «А на последок я скажу…».
-
Я выполнял задания…
-
У меня получилось…
-
Я смог …
-
Я понял, что …
-
Было трудно …
-
Было интересно …
Другого ничего в природе нет
Ни здесь, ни там, в космических глубинах
Все - от песчинок малых до планет-
Из элементов состоит единых.
Как формула, как график трудовой,
Строй менделеевской системы строгий.
Вокруг тебя творится мир живой.
Входи в него, вдыхай, руками трогай.
-
Домашнее задание творческое.
Составить кроссворд на тему: «Химические элементы периодической системы Д.И, Менделеева»
Периодический закон в стихах и прозе
1. Для стройности теорий химии
Решил ученый обобщить
Все свойства атомов сравнимые,
Что человек успел открыть.
Взяв за основу известную характеристику атома - атомную массу,
Д.И. Менделеев расположил элементы по возрастанию атомной массы.
2. Чтобы в систему строгую сложится,
Вес атомный не всем порой годится.
Местами элементы переставим,
Немножко правило своё исправим.
Обладая даром предвидения, Д.И. Менделеев сделал 3 исключения из правила, поменяв местами элементы аргон и калий, кобальт и никель, теллур и йод, позднее открытие строения атома, подтвердило его правоту.
3. Приснилась, говорят, ему таблица,
А в ней открытых элементов лица,
Из лиц сложился групповой портрет,
В портрете лишних линий нет.
Существует исторический факт, что ПС приснилась учёному, проснувшись, он зарисовал её, используя горизонтальные линии - периоды и вертикальные линии - группы.
4. Решил ученый даже очень смело,
Пустыми клетками таблица запестрела.
Все просто, гармонично, есть логичность,
Наглядно всем видна периодичность.
Д.И. Менделеев, работая с известными 60 элементами, оставил пустые клетки для неизвестных элементов и предсказал их свойства. Периодическое изменение и повторение свойств прослеживаются по периодам и по группам.
5. Закон всеобщий мир ещё обсудит,
Ему «надстройкой» будущее будет.
Открытию забвенье не грозит,
И славу русскую в науке укрепит.
Периодическим законом, периодической системой пользуются физики и химики всего мира.
Работа с заданиями
Закрепление ФИО КЛАСС
Обобщающий урок по теме: «Периодический закон и периодическая система химических элементов Д.И, Менделеева»
Тестирование
1. Чему равно общее число электронов в атоме кремния.
А. 3 Б. 4 В. 14 Г. 28
2. Сколько нейтронов в атоме брома?
А. 35 Б. 44 В. 45 Г. 80
3. Чему равно массовое число атома меди?
А. 4 Б. 29 В. 63 Г. 64
4. Сколько энергетических уровней в атоме серы?
А. 3 Б. 6 В.16 Г. 32
5. Сколько протонов в атоме хлора?
А. 17 Б. 35 В. 35,5 Г. 52
6. Сколько электронов вращается вокруг ядра в атоме фтора?
А. 2 Б. 7 В. 9 Г. 19
7. Сколько электронов находится на внешнем энергетическом уровне бора.
А. 2 Б. 3 В. 5 Г. 11
8. Сколько электронов максимально может находиться на третьем энергетическом уровне?
А. 2 Б. 8 В. 18 Г. 32
9. Расположить элементы в порядке возрастания металлических свойств. Объяснить, как изменяются свойства в периодах и группах.
а) Ве; О; В; С; б) Ва; Ве; Са; Мg
10. Расположить элементы в порядке возрастания неметаллических свойств. Объяснить, как изменяются свойства в периодах и группах.
а) Аl ; Nа; Р; С ; б) Рв; Si; С; Sn
Тестирование
Верные ответы
1-В 2-В 3-Г 4-А 5-А 6-В 7-Б 8-В 9-
Химическая пауза (ученики показывают опыты)
Химия для ребят, особенно восьмиклассников, - волшебная наука, способная творить настоящие чудеса. Именно возможностью самим творить эти чудеса-превращения и объясняется их повышенный первоначальный интерес к этой науке. Задача учителя - не погасить этот интерес, а направить его в нужное русло, привить основы методики проведения опытов с обязательным соблюдением всех правил техники безопасности. «Безопасность превыше всего!» - вот главное правило химиков.
Помните, ребята, правила просты:
Безопасность вам не помешает.
Лишь тогда вы с химией будете на «ты»,
Это все проблемы разрешает.
Знанья безопасности в жизни так важны!
Каждый за здоровье отвечает.
«Получение кислорода и изучение его свойств» с допущенными ошибками
Пусть зимний день с метелями не навевает грусть!
Таблицу Менделеева я знаю наизусть.
Зачем её я выучил? Могу сказать зачем:
В ней строгость и величие любимейших поэм,
Без многословья книжного в ней смысла торжество,
И элемента лишнего здесь нет ни одного,
В ней пробужденье дерева, весенних льдинок хруст…
Таблицу Менделеева знать надо наизусть!
(по мотивам стихотворения Н.Глазкова)
Домашнее задание творческое:
сочинить загадки о химических элементах;
найти интересные сообщения о значении химических элементов
Благодарю вас за урок!
IV. Выполнение индивидуальных заданий по карточкам
Вариант 1
1. Закончи предложение.
О заряде ядра атома и количестве электронов узнаем по _____________________________
2. Найди ошибку.
3. Сравни элементарный состав изотопов кислорода .
Вариант 2
1. Закончи предложение:
О количестве электронов на внешнем уровне узнаем по _____________________________
2. Найди ошибку.
3. Сравни элементарный состав изотопов натрия .
Вариант 3
1. Закончи предложение:
О количестве энергетических уровней в атоме узнаем по _____________________________
2. Найди ошибку.
3. Сравни элементарный состав изотопов серы .
V. Работа в командах
1. Периодическое изменение и повторение свойств. («Слепой текст»)
Задание: На доске записано строение элементов второго и третьего периодов и свойства веществ.
Восстановите предложение:
1. Горизонтальная закономерность в ПС проявляется в том, что во всех периодах металлические свойства ________________, т.к. возрастает _________________________ на ______________________ уровне.
Сходство в строении атомов элементов одного периода проявляется в одинаковом количестве ____________________________________.
2. Вертикальная закономерность в ПС проявляется в том, что во всех главных подгруппах металлические свойства __________________, т.к. возрастает _____________________________ __________________, а число ________________________ на внешнем уровне остается _____________________________.
Сходство в строении атомов элементов одной главной подгруппы проявляется в одинаковом количестве ____________________________________.
Атомы элементов, имеющие близкие заряды ядра, например Ne +10 и Na +11, резко отличаются по свойствам, потому что появляется _____________________________________.
VI. Творческое домашнее задание: написать мини-сочинение на тему: «Если бы не было ПЗ и ПС».
VII. Подведение итогов урока
- Итак, сегодня мы обобщили наши знания, повторили основные вопросы, связанные с ПЗ, ПС, строением атома, вспомнили причины изменения и повторения свойств элементов.
Выставление оценок.
К нам обратились жители с просьбой о помощи. Некоторые из них потерялись, необходимо найти их вторую половину.
Задание 2 «Расскажи обо мне».
Дать характеристику элементу №17
План характеристики
1. Положение элемента в ПС:
а) порядковый номер;
б) Аr;
в) номер группы;
г) номер периода.
2. Строение атома.
а) заряд ядра;
б) число протонов;
в) число нейтронов;
г) число электронов.
3. Валентность.
4. Электронная формула элемента.
5. Высший оксид, его характер.
6. Написать уравнение подтверждающее характер оксида.
Подводим итоги.
Задание №6 «Составь код»
1. В чем физический смысл номера периода?
а) показывает количество электронов на внешнем электронном уровне;
б) показывает количество электронных уровней;
в) соответствует валентности элемента.
2. В побочные подгруппы периодической системы входят:
а) химические элементы малых периодов;
б) химические элементы больших периодов;
в) химические элементы малых и больших периодов.
3. Какое из следующих свойств атомов химических элементов возрастает в группах по мере возрастания заряда ядра?
а) число электронов на наружном слое;
б) атомный радиус;
в) электроотрицательность.
4. Какое из следующих свойств атомов химических элементов не изменяется в периоде?
а) число электронных слоев в атоме;
б) число электронов в наружном электронном слое;
в) атомные радиусы.
5. Побочные подгруппы составляют:
а) только металлы; в) металлы и неметаллы.
б) только неметаллы;
6. Какое из следующих веществ имеет в твердом состоянии атомную кристаллическую решетку?
а) кислород; в) йод;
б) вода; г) алмаз.
Задание №7. «Что в имени тебе моем».
Определите, в главных подгруппах каких групп периодической таблицы находятся химические элементы, электронные схемы атомы которых приведены в левом столбце таблицы. Буквы соответствующие правильным ответом, образуют название элементарной частицы.
На досуге жители страны химических элементов любят разгадывать кроссворды. Я вам предлагаю один из них.
Задание № 9. Химический кроссворд.
1. Химический элемент с порядковым номером 17.
2. Сложное вещество, в состав которого входят атомы водорода и кислотный остаток.
3. Химический элемент, названный в честь великого русского ученого.
4. Химический элемент, электронная структура которого -) ) ) ).
5. Растворимое в воде основание. 2 8 8 1
6. Химический элемент, атомы которого имеют электронную формулу
1s2 2s2 2p6 3s2 3p4 .
7. Свойство атомов, которое Д.И.Менделеев принял за основное при систематизации химических элементов.
8. Химический элемент, электронная формула которого - ) ) ) .
9. Химический элемент с порядковым номером №3. 2 8 4
10. Элементарные частицы, по числу которых могут отличаться атомы одного и того же химического элемента.
11. Отрицательно заряженные частицы.
12. Простые вещества, обладающие хорошими теплопроводностью, электропроводностью, металлическим блеском.
13. H2 S O4 - … кислота.
14. 1s2 2s2 2p6 3s2 .
15. Химический элемент, название которого произошло от названия планеты.
16. H2 Si O3 - это … кислота.
17. Частица вещества.
Выигрывает тот, кто первый назовет ключевое слово (2).
Теперь подведем итоги.
Этап «Что такое химия?»
Вед. Вам предстоит, ответив на вопросы и решив задания, определить цифру, используя таблицу кодов перевести цифру в букву и составить общую фразу. Побеждает дружная команда, которая быстрее справится с заданиями, в копилку она получит столько баллов-электронов, сколько содержится р-электронов на внешнем уровне атома азота.
1
2
3
4
5
6
7
8
9
10
11
12
13
14
Х
и
м
и
я
-
ч
у
д
о
н
а
у
к
а
Задания:
1.Заряд, который приобретет нейтральный атом азота при присоединении максимально возможного числа электронов на внешний уровень.
2.Какое число электронов содержится на внешнем энергетическом уровне атома углерода?
3. Порядковый номер элемента, атом которого имеет электронную формулу 1S2 2S2 2P6 3S2
4. Число валентных электронов в атоме кремния.
5.Число элементов в 3 периоде.
6.Сумма цифр года, когда был формулирован ПЗХЭ Д.И.Менделеевым.
7.У какого из элементов атом будет иметь больший радиус №5 или №8.
8.Максимальное количество d-электронов на энергетических уровнях атомов d-элементов.
9.Количество малых периодов в ПСХЭ.
10.Число квантовых ячеек, которые заполняют электроны со сферической формой орбитали.
11.Степень окисления, которую приобретает атом магния, в случае отдачи электронов внешнего энергетического уровня.
12.Степень окисления атома алюминия в соединениях.
13.Порядковый номер элемента, который проявляет свойства самого сильного окислителя.
14.Валентность кислорода в большинстве соединений.
Таблица ответов-кодов
- 3
16
2
10
9
-1
- 2
6
и
ч
а
д
к
т
ж
л
4
8
5
12
3
1
- 4
7
х
я
у
м
о
н
с
з
4. Подведение итогов урока (за верные ответы в ходе подведения итогов команды могут заработать дополнительные баллы).
Спасибо вам за урок!
5. Домашнее задание.
После проверки домашнего задания учащихся следует подвести к открытию периодического закона Д. И. Менделеевым. Для этого необходимо подчеркнуть, что в основу классификации Д. И. Менделеев положил главную в то время известную величину - атомный вес (в настоящее время мы рассматриваем изменение свойств в зависимости от относительной атомной массы химического элемента).
Важно обратить внимание учащихся на то, что Д. И. Менделеев в отличие от других ученых сравнивал несходные семейства элементов. Учитель приводит формулировку периодического закона и отмечает, что Д. И. Менделеев пришел к выводу: периодическое изменение свойств простых веществ, а также формы и свойства соединений элементов зависят не столько от относительной атомной массы, сколько от другой величины, которая в то время была неизвестна (с. 122 учебника).
Самостоятельная работа
Тестовые задания
Вариант I
1. В ряду Si Р S Сl неметаллические свойства
1) усиливаются
2) ослабевают
3) не изменяются
4) изменяются периодически
2. В ряду Mg Са Sr Ba металлические свойства
1) усиливаются
2) ослабевают
3) не изменяются
4) изменяются периодически
3. В ряду оксидов MgO СаО SrO BaO основные свойства
1) усиливаются
2) ослабевают
3) не изменяются
4) сначала усиливаются, затем ослабевают
4. В ряду H2SiO3 Н3РО4 H2SO4 НСlО4 кислотные свойства __________________
5. Наиболее ярко выражены неметаллические свойства у простого вещества, образованного атомами, которые имеют строение электронной оболочки
1) 2, 8, 4
2) 2, 8, 5
3) 2, 8, 6
4) 2, 8, 7
6. Наиболее ярко выражены неметаллические свойства у простого вещества, образованного атомами, которые имеют строение электронной оболочки
1) 2, 7
2) 2, 8, 7
3) 2, 8, 8, 7
4) 2, 8, 6
7. Усиление металлических свойств элементов, расположенных в А-группах периодической системы, с увеличением порядкового номера обусловлено
1) увеличением атомной массы элемента
2) увеличением общего числа электронов
3) увеличением атомного радиуса элемента
4) увеличением номера периода
8. Формула летучего водородного соединения химического элемента H3R. Группа химических элементов периодической системы Д. И. Менделеева, к которой принадлежит этот элемент
1) III
2) V
3) VII
4) IV
9. Установите соответствие между массовым числом химического элемента и числом нейтронов в ядре атома этого элемента.1) 56
2) 19
3) 31
4) 24 А. 10
Б. 16
В. 30
Г. 14
Д. 12
1
2
3
4
10. Назовите химические элементы, имеющие сходные свойства, на основании приведенных ниже схем распределения электронов по энергетическим уровням в атомах этих элементов.
1) 2, 2
2) 2, 1
3) 2, 8, 7
4) 2, 8, 8, 1
Ответ: ________________________
Вариант II
1. В ряду Na Mg Al Si металлические свойства
1) усиливаются
2) ослабевают
3) не изменяются
4) изменяются периодически
2. В ряду F Сl Br I неметаллические свойства
1) усиливаются
2) ослабевают
3) не изменяются
4) изменяются периодически
3. В ряду оксидов SiO2 P2O5 SO3 Cl2O7 кислотные свойства
1) усиливаются
2) ослабевают
3) не изменяются
4) сначала усиливаются, затем ослабевают
4. В ряду LiOH NaOH KOH RbOH основные свойства ____________________
5. Наиболее ярко выражены металлические свойства у простого вещества, образованного атомами, которые имеют строение электронной оболочки
1) 2, 1
2) 2, 8, 1
3) 2, 8, 8, 1
4) 2, 8, 2
6. Наиболее ярко выражены металлические свойства у простого вещества, образованного атомами, которые имеют строение электронной оболочки
1) 2, 8, 1
2) 2, 8, 2
3) 2,8, 3
4) 2, 8, 4
7. С увеличением относительной атомной массы химических элементов в периоде периодически изменяется
1) заряд числа
2) число валентных электронов
3) число нейтронов в ядре атома
4) атомный радиус
8. Формула высшего оксида химического элемента R2O7. Группа химических элементов периодической системы Д. И. Менделеева, к которой принадлежит этот элемент
1) III
2) V
3) VI
4) VII
9. Установите соответствие между химическим элементом и числом протонов в ядре атома этого элемента.1) Be
2) Сl
3) Fe
4) Аl A. 26
Б. 4
В. 13
Г. 17
Д. 24
10. Назовите химические элементы, имеющие сходные свойства, на основании приведенных ниже схем распределения электронов по энергетическим уровням в атомах этих элементов.
1) 2, 4
2) 2, 5
3) 2, 8, 5
4) 2, 8, 6
Ответ: ____________________________
11. Установите соответствие между частицей (атомом, ионом) и ее электронным строением.
Число нейтронов (N) в атоме Х элемента можно вычислить, зная массовое число (А) и порядковый номер (Z) элемента, по формуле:
а) А=Z + N б) N= A - Z
Максимальное число электронов (Nе) на энергетическом уровне можно подсчитать, зная номер уровня (n), по формуле:
а) Ne = 2n б) Ne = 2n2
Электронная формула 1S2 2S2 2P6 3S1 отражает строение атома:
а) Na б) Zn
Задания для 2 команды:
Число протонов, нейтронов и электронов в атоме наименее распространенного природного изотопа хлора соответственно равно:
а) 35, 10, 17 б) 17, 20, 17
Выберите металл:
а) натрий б) сера
Укажите химический элемент, образующий амфотерный оксид:
а) сера б) алюминий
Задания для 3 команды:
Укажите неметалл:
а) магний б)водород
Какой ряд химических элементов образует оксиды с общей формулой R O:
а) Na, K, Li б) N, P, As
Ряд химических элементов, в котором от первого к последнему элементу возрастают неметаллические свойства, это:
а) I, Br, CI б) Mg, Ca, Sr
Конкурс «Пропущенные слова, числа и условные обозначения».
Задания для 1 команды:
ПСХЭ состоит из …….. групп химических элементов.
Это число совпадает с числом …….., необходимым для заполнения наружного энергетического ………
Задания для 2 команды:
ПСХЭ состоит из …….. периодов, в том числе из ……. малых и ….. больших периодов.
Последний период называется также ……., потому что ….., которым завершается каждый период, для …… периода еще не открыт.
Задания для 3 команды:
В настоящее время известно …… химических элементов.
В каждой клеточке ПСХЭ Д.И.Менделеева кроме названия элемента приведены ……., ……., ……..
-
Прием «А на последок я скажу…». Ребята по кругу высказываются одним предложением, выбирая начало фразы из рефлексивного экрана на доске.
-
Я выполнял задания…
-
У меня получилось…
-
Я смог …
-
Я понял, что …
-
Было трудно …
-
Было интересно …
-
-
Подводим итог урока. Рефлексия ( по принципу не законченного предложения).
-
- Сегодня я на уроке закрепил и углубил знания по …
-
- Сегодня я на уроке научился …
-
- Сегодня я
-
Задается домашнее задание - подготовится к зачету по теме: «Периодический закон и периодическая система химических элементов Д.И.Менделеева в свете учения о строении атома»


