- Преподавателю
- Химия
- Методичка во выполнению самостоятельных работ
Методичка во выполнению самостоятельных работ
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Сеитумерова В.И. |
| Дата | 23.12.2015 |
| Формат | docx |
| Изображения | Есть |
ДЕПАРТАМЕНТ ВНУТРЕННЕЙ И КАДРОВОЙ ПОЛИТИКИ БЕЛГОРОДСКОЙ ОБЛАСТИ
ОБЛАСТНОЕ ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«РАКИТЯНСКИЙ АГРОТЕХНОЛОГИЧЕСКИЙ ТЕХНИКУМ»
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
для студентов по выполнению самостоятельной внеаудиторной работы
учебной дисциплины
Химия
для специальности среднего профессионального образования
35.02.08 Электрификация и автоматизация сельского хозяйства
Базовый уровень
пос. Ракитное 2015 г.
Данные методические рекомендации помогут студентам ОГАПОУ «РАТТ» выполнить самостоятельную внеаудиторную работу по учебной дисциплине Химия на основе деятельностного и компетентностного подходов к обучению, что соответствует требованиям нового поколения
Составитель: Сеитумерова Виолетта Ивановна, преподаватель
Рецензент: Новикова Ольга Петровна, заместитель директора по учебно-методической работе
Содержание
-
Пояснительная записка.
-
Методические рекомендации по выполнению реферата
-
Методические рекомендации по подготовке сообщения
-
Методические рекомендации по подготовке презентации
-
Методические рекомендации по составлению кроссвордов
-
Методические рекомендации по решению задач
-
Критерии оценки выполненной работы
-
Список литературы
Введение
«… знания можно предложить, но овладеть ими может
и должен каждый самостоятельно»
А. Дистервег
В современном динамично развивающемся обществе существует потребность в инициативных, самостоятельных людях, легко адаптирующихся к новым условиям. Повышаются требования не только к качеству подготовки студентов, как высоко квалифицированных специалистов, но и к развитию их интеллектуальных и творческих способностей, позволяющих им свободно владеть своей профессией, развивать способность критически мыслить, выражать и защищать свою точку зрения, свои позиции, успешно находить выход из сложившихся, зачастую, нестандартных ситуаций.
В традиционном процессе обучения, основанном на передаче готовых знаний от преподавателя к студенту, достичь необходимого уровня развития будущего специалиста практически невозможно. Поскольку основная деятельность студента заключается в решении теоретических и практических задач, с четкой формулировкой и готовым алгоритмом и не требует глубоких творческих размышлений и зачастую сводится к стандартным действиям. Таким образом, проблема заключается в необходимости качественной подготовки будущих специалистов, в формировании целостной и гармоничной личности. Этого можно достичь путем систематического включения студента в самостоятельную деятельность, которая в учебной деятельности выражается в самостоятельной работе и приобретает характер проблемно-поисковой деятельности.
Именно самостоятельную работу ведущие педагоги всегда считали одним из наиболее эффективных путей активизации познавательной деятельности студентов, развития самостоятельности, ответственности и творческих способностей. Студент должен работать на занятии и дома по возможности самостоятельно, а преподаватель должен лишь организовывать, контролировать этот процесс и управлять
Внеаудиторная самостоятельная работа - это деятельность студентов по усвоению знаний и умений, протекающая без непосредственного участия преподавателя, но направляемая им.
Внеаудиторная самостоятельная работа занимает особое место в современном образовательном пространстве и включает в себя учебную, исследовательскую деятельность,творчество во всем его разнообразии, все виды деятельности, которые должны сформировать активного гражданина и компетентного профессионала. Значениевнеаудиторной работы возрастает в условиях информационного общества, быстрогоустаревания информации, когда навыки и готовность к профессиональномусамообразованию стали неотъемлемым признаком специалиста любой отрасли.
Методические рекомендации по выполнению реферата
Открытие химических элементов. Сон Д.И.Менделеева. Жизнь и деятельность Д.И.Менделеева. Вклад Д.И.Менделеева в химию.Д.И.Менделеев-великий ученый.
Спирты. Вред алкоголя. Пагубное влияние алкоголя на организм человека. Спирты в промышленности. Многообразие спиртов. Получение спиртов в лаборатории.
Внеаудиторная самостоятельная работа в форме реферата является индивидуальной самостоятельно выполненной работой студента.
Содержание реферата
Реферат, как правило, должен содержать следующие структурные элементы:
-
титульный лист;
-
содержание;
-
введение;
-
основная часть;
-
заключение;
-
список использованных источников;
-
приложения (при необходимости).
Примерный объем в машинописных страницах составляющих реферата представлен в таблице.
Рекомендуемый объем структурных элементов реферата
Наименование частей реферата
Количество страниц
Титульный лист
1
Содержание (с указанием страниц)
1
Введение
2
Основная часть
15-20
Заключение
1-2
Список использованных источников
1-2
Приложения
Без ограничений
В содержании приводятся наименования структурных частей реферата, глав и параграфов его основной части с указанием номера страницы, с которой начинается соответствующая часть, глава, параграф.
Во введении дается общая характеристика реферата: обосновывается актуальность выбранной темы; определяется цель работы и задачи, подлежащие решению для её достижения; описываются объект и предмет исследования, информационная база исследования, а также кратко характеризуется структура реферата по главам.
Основная часть должна содержать материал, необходимый для достижения поставленной цели и задач, решаемых в процессе выполнения реферата. Она включает 2-3 главы, каждая из которых, в свою очередь, делится на 2-3 параграфа. Содержание основной части должно точно соответствовать теме проекта и полностью её раскрывать. Главы и параграфы реферата должны раскрывать описание решения поставленных во введении задач. Поэтому заголовки глав и параграфов, как правило, должны соответствовать по своей сути формулировкам задач реферата. Заголовка "ОСНОВНАЯ ЧАСТЬ" в содержании реферата быть не должно.
Главы основной части реферата могут носить теоретический, методологический и аналитический характер.
Обязательным для реферата является логическая связь между главами и последовательное развитие основной темы на протяжении всей работы, самостоятельное изложение материала, аргументированность выводов. Также обязательным является наличие в основной части реферата ссылок на использованные источники.
Изложение необходимо вести от третьего лица («Автор полагает...») либо использовать безличные конструкции и неопределенно-личные предложения («На втором этапе исследуются следующие подходы…», «Проведенное исследование позволило доказать...» и т.п.).
В заключении логически последовательно излагаются выводы, к которым пришел студент в результате выполнения реферата. Заключение должно кратко характеризовать решение всех поставленных во введении задач и достижение цели реферата.
Список использованных источников является составной частью работы и отражает степень изученности рассматриваемой проблемы. Количество источников в списке определяется студентом самостоятельно, для реферата их рекомендуемое количество от 10 до 20. При этом в списке обязательно должны присутствовать источники, изданные в последние 3 года, а также ныне действующие нормативно-правовые акты, регулирующие отношения, рассматриваемые в реферате.
В приложения следует относить вспомогательный материал, который при включении в основную часть работы загромождает текст (таблицы вспомогательных данных, инструкции, методики, формы документов и т.п.).
Оформление реферата
При выполнении внеаудиторной самостоятельной работы в виде реферата необходимо соблюдать следующие требования:
-
на одной стороне листа белой бумаги формата А-4
-
размер шрифта-12; TimesNewRoman, цвет - черный
-
междустрочный интервал - одинарный
-
поля на странице - размер левого поля - 2 см, правого- 1 см, верхнего-2см, нижнего-2см.
-
отформатировано по ширине листа
-
на первой странице необходимо изложить план (содержание) работы.
-
в конце работы необходимо указать источники использованной литературы
-
нумерация страниц текста -
Список использованных источников должен формироваться в алфавитном порядке по фамилии авторов. Литература обычно группируется в списке в такой последовательности:
-
законодательные и нормативно-методические документы и материалы;
-
специальная научная отечественная и зарубежная литература (монографии, учебники, научные статьи и т.п.);
-
статистические, инструктивные и отчетные материалы предприятий, организаций и учреждений.
Включенная в список литература нумеруется сплошным порядком от первого до последнего названия.
По каждому литературному источнику указывается: автор (или группа авторов), полное название книги или статьи, место и наименование издательства (для книг и брошюр), год издания; для журнальных статей указывается наименование журнала, год выпуска и номер. По сборникам трудов (статей) указывается автор статьи, ее название и далее название книги (сборника) и ее выходные данные.
Приложения следует оформлять как продолжение реферата на его последующих страницах.
Каждое приложение должно начинаться с новой страницы. Вверху страницы справа указывается слово "Приложение" и его номер. Приложение должно иметь заголовок, который располагается по центру листа отдельной строкой и печатается прописными буквами.
Приложения следует нумеровать порядковой нумерацией арабскими цифрами.
На все приложения в тексте работы должны быть ссылки. Располагать приложения следует в порядке появления ссылок на них в тексте.
Критерии оценки реферата
Срок сдачи готового реферата определяется утвержденным графиком.
В случае отрицательного заключения преподавателя студент обязан доработать или переработать реферат. Срок доработки реферата устанавливается руководителем с учетом сущности замечаний и объема необходимой доработки.
Реферат оценивается по системе:
Оценка "отлично" выставляется за реферат, который носит исследовательский характер, содержит грамотно изложенный материал, с соответствующими обоснованными выводами.
Оценка "хорошо" выставляется за грамотно выполненный во всех отношениях реферат при наличии небольших недочетов в его содержании или оформлении.
Оценка "удовлетворительно" выставляется за реферат, который удовлетворяет всем предъявляемым требованиям, но отличается поверхностью, в нем просматривается непоследовательность изложения материала, представлены необоснованные выводы.
Оценка "неудовлетворительно" выставляется за реферат, который не носит исследовательского характера, не содержит анализа источников и подходов по выбранной теме, выводы носят декларативный характер.
Студент, не представивший в установленный срок готовый реферат по дисциплине учебного плана или представивший реферат, который был оценен на «неудовлетворительно», считается имеющим академическую задолженность и не допускается к сдаче экзамена по данной дисциплине.
Методические рекомендации по подготовке сообщения
История открытия Периодического закона и Периодической системы Д.И.Менделеева. Многообразие химических элементов. Элементы Периодической системы вокруг нас. Вода наше все. Генетическая связь неорганических соединений. Кислота-это опасно. Кислоты содержащиеся в продуктах питания и растениях. Применение солей человеком в своей жизни. А.М.Бутлеров. Вклад А.М.Бутлерова в развитие органической химии. Классификация органических соединений. Органика вокруг нас. Генетическая связь органических соединений. Применение органических соединений. Получение органических соединений.
Регламент устного публичного выступления - не более 10 минут.
Искусство устного выступления состоит не только в отличном знании предмета речи, но и в умении преподнести свои мысли и убеждения правильно и упорядоченно, красноречиво и увлекательно.
Любое устное выступление должно удовлетворять трем основным критериям, которые в конечном итоге и приводят к успеху: это критерий правильности, т.е. соответствия языковым нормам, критерий смысловой адекватности, т.е. соответствия содержания выступления реальности, и критерий эффективности, т.е. соответствия достигнутых результатов поставленной цели.
Работу по подготовке устного выступления можно разделить на два основных этапа: докоммуникативный этап (подготовка выступления) и коммуникативный этап (взаимодействие с аудиторией).
Работа по подготовке устного выступления начинается с формулировки темы. Лучше всего тему сформулировать таким образом, чтобы ее первое слово обозначало наименование полученного в ходе выполнения проекта научного результата (например, «Технология изготовления…», «Модель развития…», «Система управления…», «Методика выявления…» и пр.). Тема выступления не должна быть перегруженной, нельзя "объять необъятное", охват большого количества вопросов приведет к их беглому перечислению, к декларативности вместо глубокого анализа. Неудачные формулировки - слишком длинные или слишком краткие и общие, очень банальные и скучные, не содержащие проблемы, оторванные от дальнейшего текста и т.д.
Само выступление должно состоять из трех частей - вступления (10-15% общего времени), основной части (60-70%) и заключения (20-25%).
Вступление включает в себя представление авторов (фамилия, имя отчество, при необходимости место учебы/работы, статус), название доклада, расшифровку подзаголовка с целью точного определения содержания выступления, четкое определение стержневой идеи. Стержневая идея проекта понимается как основной тезис, ключевое положение. Стержневая идея дает возможность задать определенную тональность выступлению. Сформулировать основной тезис означает ответить на вопрос, зачем говорить (цель) и о чем говорить (средства достижения цели).
Требования к основному тезису выступления:
-
фраза должна утверждать главную мысль и соответствовать цели выступления;
-
суждение должно быть кратким, ясным, легко удерживаться в кратковременной памяти;
-
мысль должна пониматься однозначно, не заключать в себе противоречия.
В речи может быть несколько стержневых идей, но не более трех.
Самая частая ошибка в начале речи - либо извиняться, либо заявлять о своей неопытности. Результатом вступления должны быть заинтересованность слушателей, внимание и расположенность к презентатору и будущей теме.
К аргументации в пользу стержневой идеи проекта можно привлекать фото-, видеофрагметы, аудиозаписи, фактологический материал. Цифровые данные для облегчения восприятия лучше демонстрировать посредством таблиц и графиков, а не злоупотреблять их зачитыванием. Лучше всего, когда в устном выступлении количество цифрового материала ограничено, на него лучше ссылаться, а не приводить полностью, так как обилие цифр скорее утомляет слушателей, нежели вызывает интерес.
План развития основной части должен быть ясным. Должно быть отобрано оптимальное количество фактов и необходимых примеров.
В научном выступлении принято такое употребление форм слов: чаще используются глаголы настоящего времени во «вневременном» значении, возвратные и безличные глаголы, преобладание форм 3-го лица глагола, форм несовершенного вида, используются неопределенно-личные предложения. Перед тем как использовать в своей презентации корпоративный и специализированный жаргон или термины, вы должны быть уверены, что аудитория поймет, о чем вы говорите.
Если использование специальных терминов и слов, которые часть аудитории может не понять, необходимо, то постарайтесь дать краткую характеристику каждому из них, когда употребляете их в процессе презентации впервые.
Самые частые ошибки в основной части доклада - выход за пределы рассматриваемых вопросов, перекрывание пунктов плана, усложнение отдельных положений речи, а также перегрузка текста теоретическими рассуждениями, обилие затронутых вопросов (декларативность, бездоказательность), отсутствие связи между частями выступления, несоразмерность частей выступления (затянутое вступление, скомканность основных положений, заключения).
В заключении необходимо сформулировать выводы, которые следуют из основной идеи (идей) выступления. Правильно построенное заключение способствует хорошему впечатлению от выступления в целом. В заключении имеет смысл повторить стержневую идею и, кроме того, вновь (в кратком виде) вернуться к тем моментам основной части, которые вызвали интерес слушателей. Закончить выступление можно решительным заявлением. Вступление и заключение требуют обязательной подготовки, их труднее всего создавать на ходу. Психологи доказали, что лучше всего запоминается сказанное в начале и в конце сообщения ("закон края"), поэтому вступление должно привлечь внимание слушателей, заинтересовать их, подготовить к восприятию темы, ввести в нее (не вступление важно само по себе, а его соотнесение с остальными частями), а заключение должно обобщить в сжатом виде все сказанное, усилить и сгустить основную мысль, оно должно быть таким, "чтобы слушатели почувствовали, что дальше говорить нечего" (А.Ф. Кони).
В ключевых высказываниях следует использовать фразы, программирующие заинтересованность. Вот некоторые обороты, способствующие повышению интереса:
- «Это Вам позволит…»
- «Благодаря этому вы получите…»
- «Это позволит избежать…»
- «Это повышает Ваши…»
- «Это дает Вам дополнительно…»
- «Это делает вас…»
- «За счет этого вы можете…»
После подготовки текста / плана выступления полезно проконтролировать себя вопросами:
-
Вызывает ли мое выступление интерес?
-
Достаточно ли я знаю по данному вопросу, и имеется ли у меня достаточно данных?
-
Смогу ли я закончить выступление в отведенное время?
-
Соответствует ли мое выступление уровню моих знаний и опыту?
При подготовке к выступлению необходимо выбрать способ выступления: устное изложение с опорой на конспект (опорой могут также служить заранее подготовленные слайды) или чтение подготовленного текста. Отметим, однако, что чтение заранее написанного текста значительно уменьшает влияние выступления на аудиторию. Запоминание написанного текста заметно сковывает выступающего и привязывает к заранее составленному плану, не давая возможности откликаться на реакцию аудитории.
Общеизвестно, что бесстрастная и вялая речь не вызывает отклика у слушателей, какой бы интересной и важной темы она ни касалась. И наоборот, иной раз даже не совсем складное выступление может затронуть аудиторию, если оратор говорит об актуальной проблеме, если аудитория чувствует компетентность выступающего. Яркая, энергичная речь, отражающая увлеченность оратора, его уверенность, обладает значительной внушающей силой.
Кроме того, установлено, что короткие фразы легче воспринимаются на слух, чем длинные. Лишь половина взрослых людей в состоянии понять фразу, содержащую более тринадцати слов. А третья часть всех людей, слушая четырнадцатое и последующие слова одного предложения, вообще забывают его начало. Необходимо избегать сложных предложений, причастных и деепричастных оборотов. Излагая сложный вопрос, нужно постараться передать информацию по частям.
Пауза в устной речи выполняет ту же роль, что знаки препинания в письменной. После сложных выводов или длинных предложений необходимо сделать паузу, чтобы слушатели могли вдуматься в сказанное или правильно понять сделанные выводы. Если выступающий хочет, чтобы его понимали, то не следует говорить без паузы дольше, чем пять с половиной секунд (!).
Особое место в презентации проекта занимает обращение к аудитории. Известно, что обращение к собеседнику по имени создает более доверительный контекст деловой беседы. При публичном выступлении также можно использовать подобные приемы. Так, косвенными обращениями могут служить такие выражения, как «Как Вам известно», «Уверен, что Вас это не оставит равнодушными». Подобные доводы к аудитории - это своеобразные высказывания, подсознательно воздействующие на волю и интересы слушателей. Выступающий показывает, что слушатели интересны ему, а это самый простой путь достижения взаимопонимания.
Во время выступления важно постоянно контролировать реакцию слушателей. Внимательность и наблюдательность в сочетании с опытом позволяют оратору уловить настроение публики. Возможно, рассмотрение некоторых вопросов придется сократить или вовсе отказаться от них. Часто удачная шутка может разрядить атмосферу.
После выступления нужно быть готовым к ответам на возникшие у аудитории вопросы.
Методические рекомендации по подготовке презентации
Витамины. Многообразие витаминов. Значение витаминов для человека. Витамины в нашей еде. Применение витаминов. Классификация витаминов. Обмен витаминов в организме.
Карбоновые кислоты. Получение и применение карбоновых кислот. Нахождение в природе. Химические и физические свойства. Область применения карбоновых кислот. Значение карбоновых кислот.
Компьютерную презентацию, сопровождающую выступление докладчика, удобнее всего подготовить в программе MS PowerPoint. Презентация как документ представляет собой последовательность сменяющих друг друга слайдов - то есть электронных страничек, занимающих весь экран монитора (без присутствия панелей программы). Чаще всего демонстрация презентации проецируется на большом экране, реже - раздается собравшимся как печатный материал. Количество слайдов адекватно содержанию и продолжительности выступления (например, для 5-минутного выступления рекомендуется использовать не более 10 слайдов).
На первом слайде обязательно представляется тема выступления и сведения об авторах. Следующие слайды можно подготовить, используя две различные стратегии их подготовки:
1 стратегия: на слайды выносится опорный конспект выступления и ключевые слова с тем, чтобы пользоваться ими как планом для выступления. В этом случае к слайдам предъявляются следующие требования:
-
объем текста на слайде - не больше 7 строк;
-
маркированный/нумерованный список содержит не более 7 элементов;
-
отсутствуют знаки пунктуации в конце строк в маркированных и нумерованных списках;
-
значимая информация выделяется с помощью цвета, кегля, эффектов анимации.
Особо внимательно необходимо проверить текст на отсутствие ошибок и опечаток. Основная ошибка при выборе данной стратегии состоит в том, что выступающие заменяют свою речь чтением текста со слайдов.
2 стратегия: на слайды помещается фактический материал (таблицы, графики, фотографии и пр.), который является уместным и достаточным средством наглядности, помогает в раскрытии стержневой идеи выступления. В этом случае к слайдам предъявляются следующие требования:
-
выбранные средства визуализации информации (таблицы, схемы, графики и т. д.) соответствуют содержанию;
-
использованы иллюстрации хорошего качества (высокого разрешения), с четким изображением (как правило, никто из присутствующих не заинтересован вчитываться в текст на ваших слайдах и всматриваться в мелкие иллюстрации);
Максимальное количество графической информации на одном слайде - 2 рисунка (фотографии, схемы и т.д.) с текстовыми комментариями (не более 2 строк к каждому). Наиболее важная информация должна располагаться в центре экрана.
Основная ошибка при выборе данной стратегии - «соревнование» со своим иллюстративным материалов (аудитории не предоставляется достаточно времени, чтобы воспринять материал на слайдах). Обычный слайд, без эффектов анимации должен демонстрироваться на экране не менее 10 - 15 секунд. За меньшее время присутствующие не успеет осознать содержание слайда. Если какая-то картинка появилась на 5 секунд, а потом тут же сменилась другой, то аудитория будет считать, что докладчик ее подгоняет. Обратного (позитивного) эффекта можно достигнуть, если докладчик пролистывает множество слайдов со сложными таблицами и диаграммами, говоря при этом «Вот тут приведен разного рода вспомогательный материал, но я его хочу пропустить, чтобы не перегружать выступление подробностями». Правда, такой прием делать в начале и в конце презентации - рискованно, оптимальный вариант - в середине выступления.
Если на слайде приводится сложная диаграмма, ее необходимо предварить вводными словами (например, «На этой диаграмме приводится то-то и то-то, зеленым отмечены показатели А, синим - показатели Б»), с тем, чтобы дать время аудитории на ее рассмотрение, а только затем приступать к ее обсуждению. Каждый слайд, в среднем должен находиться на экране не меньше 40 - 60 секунд (без учета времени на случайно возникшее обсуждение). В связи с этим лучше настроить презентацию не на автоматический показ, а на смену слайдов самим докладчиком.
Особо тщательно необходимо отнестись к оформлению презентации. Для всех слайдов презентации по возможности необходимо использовать один и тот же шаблон оформления, кегль - для заголовков - не меньше 24 пунктов, для информации - для информации не менее 18. В презентациях не принято ставить переносы в словах.
Подумайте, не отвлекайте ли вы слушателей своей же презентацией? Яркие краски, сложные цветные построения, излишняя анимация, выпрыгивающий текст или иллюстрация - не самое лучшее дополнение к научному докладу. Также нежелательны звуковые эффекты в ходе демонстрации презентации. Наилучшими являются контрастные цвета фона и текста (белый фон - черный текст; темно-синий фон - светло-желтый текст и т. д.). Лучше не смешивать разные типы шрифтов в одной презентации. Рекомендуется не злоупотреблять прописными буквами (они читаются хуже).
Неконтрастные слайды будут смотреться тусклыми и невыразительными, особенно в светлых аудиториях. Для лучшей ориентации в презентации по ходу выступления лучше пронумеровать слайды. Желательно, чтобы на слайдах оставались поля, не менее 1 см с каждой стороны. Вспомогательная информация (управляющие кнопки) не должны преобладать над основной информацией (текстом, иллюстрациями). Использовать встроенные эффекты анимации можно только, когда без этого не обойтись (например, последовательное появление элементов диаграммы). Для акцентирования внимания на какой-то конкретной информации слайда можно воспользоваться лазерной указкой.
Диаграммы готовятся с использованием мастера диаграмм табличного процессора MSExcel. Для ввода числовых данных используется числовой формат с разделителем групп разрядов. Если данные (подписи данных) являются дробными числами, то число отображаемых десятичных знаков должно быть одинаково для всей группы этих данных (всего ряда подписей данных). Данные и подписи не должны накладываться друг на друга и сливаться с графическими элементами диаграммы. Структурные диаграммы готовятся при помощи стандартных средств рисования пакета MSOffice. Если при форматировании слайда есть необходимость пропорционально уменьшить размер диаграммы, то размер шрифтов реквизитов должен быть увеличен с таким расчетом, чтобы реальное отображение объектов диаграммы соответствовало значениям, указанным в таблице. В таблицах не должно быть более 4 строк и 4 столбцов - в противном случае данные в таблице будет просто невозможно увидеть. Ячейки с названиями строк и столбцов и наиболее значимые данные рекомендуется выделять цветом.
Табличная информация вставляется в материалы как таблица текстового процессора MSWord или табличного процессора MSExcel. При вставке таблицы как объекта и пропорциональном изменении ее размера реальный отображаемый размер шрифта должен быть не менее 18 pt. Таблицы и диаграммы размещаются на светлом или белом фоне.
Если Вы предпочитаете воспользоваться помощью оператора (что тоже возможно), а не листать слайды самостоятельно, очень полезно предусмотреть ссылки на слайды в тексте доклада ("Следующий слайд, пожалуйста...").
Заключительный слайд презентации, содержащий текст «Спасибо за внимание» или «Конец», вряд ли приемлем для презентации, сопровождающей публичное выступление, поскольку завершение показа слайдов еще не является завершением выступления. Кроме того, такие слайды, так же как и слайд «Вопросы?», дублируют устное сообщение. Оптимальным вариантом представляется повторение первого слайда в конце презентации, поскольку это дает возможность еще раз напомнить слушателям тему выступления и имя докладчика и либо перейти к вопросам, либо завершить выступление.
Для показа файл презентации необходимо сохранить в формате «Демонстрация PowerPоint» (Файл - Сохранить как - Тип файла - Демонстрация PowerPоint). В этом случае презентация автоматически открывается в режиме полноэкранного показа (slideshow) и слушатели избавлены как от вида рабочего окна программы PowerPoint, так и от потерь времени в начале показа презентации.
После подготовки презентации полезно проконтролировать себя вопросами:
-
удалось ли достичь конечной цели презентации (что удалось определить, объяснить, предложить или продемонстрировать с помощью нее?);
-
к каким особенностям объекта презентации удалось привлечь внимание аудитории?
-
не отвлекает ли созданная презентация от устного выступления?
После подготовки презентации необходима репетиция выступления.
Методические рекомендации по составлению кроссвордов
Металлы-простые вещества. Полезные ископаемые. Драгоценные металлы. Металлы-сплавы. Органические соединения. Классы органических соединений. Органические вещества клетки.
Кроссворд - игра-задача, в которой фигура из рядов пустых клеток заполняется перекрещивающимися словами со значениями, заданными по условиям игры.
Кроссворд обладает удивительным свойством каждый раз бросать вызов читателю посоревноваться, выставляет оценку его способностям, и при этом никак не наказывает за ошибки.
Классификация кроссвордов
-
по форме:
-
кроссворд - прямоугольник, квадрат;
-
кроссворд-ромб;
-
кроссворд-треугольник;
-
круглый (циклический) кроссворд;
-
сотовый кроссворд;
-
фигурный кроссворд;
-
диагональный кроссворд и т.д.
-
-
по расположению:
-
-симметричные;
-
асимметричными;
-
с вольным расположением слов и др.
-
-
по содержанию:
-
тематические;
-
юмористические;
-
учебные;
-
числовые.
-
-
по названию страны:
-
скандинавские;
-
венгерские;
-
английские;
-
немецкие;
-
американские;
-
эстонские;
-
итальянские.
-
Общие требования при составлении кроссвордов
При составлении кроссвордов необходимо придерживаться принципов наглядности и доступности.
-
Не допускается наличие "плашек" (незаполненных клеток) в сетке кроссворда.
-
Не допускаются случайные буквосочетания и пересечения.
-
Загаданные слова должны быть именами существительными в именительном падеже единственного числа.
-
Двухбуквенные слова должны иметь два пересечения.
-
Трехбуквенные слова должны иметь не менее двух пересечений.
-
Не допускаются аббревиатуры (ЗиЛ и т.д.), сокращения (детдом и др.).
-
Не рекомендуется большое количество двухбуквенных слов.
-
Все тексты должны быть написаны разборчиво, желательно отпечатаны.
-
На каждом листе должна быть фамилия автора, а также название данного кроссворда.
Требования к оформлению:
-
Рисунок кроссворда должен быть четким.
-
Сетки всех кроссвордов должны быть выполнены в двух экземплярах:
1-й экз. - с заполненными словами;
2-й экз. - только с цифрами позиций.
Ответы на кроссворд. Они публикуются отдельно. Ответы предназначены для проверки правильности решения кроссворда и дают возможность ознакомиться с правильными ответами на нерешенные позиции условий, что способствует решению одной из основных задач разгадывания кроссвордов - повышению эрудиции и увеличению словарного запаса.
Оформление ответов на кроссворды:
-
- Для типовых кроссвордов и чайнвордов: на отдельном листе;
-
- Для скандинавских кроссвордов: только заполненная сетка;
-
- Для венгерских кроссвордов: сетка с аккуратно зачеркнутыми искомыми словами.
Составление условий (толкований) кроссворда:
-
Они должны быть строго лаконичными. Не следует делать их пространными, излишне исчерпывающими, многословными, несущими избыточную информацию.
-
Старайтесь подать слово с наименее известной стороны.
-
Просмотрите словари: возможно, в одном из них и окажется наилучшее определение. В определениях не должно быть однокоренных слов.
Методические рекомендации по составлению уравнений химических реакций
Алгоритм составления уравнения химической реакции
Составим уравнение химической реакции взаимодействия фосфора и кислорода
1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны - H2; N2; O2; F2; Cl2; Br2; I2. Между реагентами ставим знак «+», а затем стрелку:
P + O2 →
2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии). Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов:
P + O2 → P2O5
3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции.
Вначале уравнивают число атомов, которых в реагирующих веществах (продуктах) содержится больше.
В данном случае это атомы кислорода.
Находим наименьшее общее кратное чисел атомов кислорода в левой и правой частях уравнения. Наименьшее кратное для атомов натрия -10:
Находим коэффициенты путём деления наименьшего кратного на число атомов данного вида, полученные цифры ставим в уравнение реакции:
фосфора в реагентах и продуктах реакции не равно, поступаем аналогично ситуации с кислородом:
Получаем окончательный вид уравнения химической реакции. Стрелку заменяем на знак равенства.
4P + 5O2 = 2P2O5
Алгоритм
«Составление уравнения реакции гидролиза соли"
Задание: Составьте уравнение реакции гидролиза карбоната калия
1. Запишите химическую формулу соли
K2CO3
2. Определите каким по силе основанием и кислотой образована данная соль. Определите возможность протекания гидролиза, согласно правил: гидролизу в водных растворах подвергаются соли, содержащие остатки слабых кислот и слабых оснований (к сильным кислотам относят HCl, HBr, HI, H2SO4, HClO4; к сильным основаниям относят гидроксиды щелочных металлов, а также Ba(OH)2 и Sr(OH)2 )
Соль образована сильным основанием и слабой кислотой
3. Подчеркните ион слабого электролита (кислоты или основания)
K2CO3
4. Напишите уравнение электролитической диссоциации данной соли и воды
K2CO3 = 2K+ + CO32-
H2O = 2H+ + CO32-
5. Ион слабой кислоты или основания будет связываться с противоположным по зарядом ионом из молекулы воды, при этом другой её ион освобождается. Отразите это в уравнении реакции.
CO32- + H+OH- =HCO32- + OH-
6. Процесс гидролиза - процесс обратимый[1][1], поэтому в уравнениях следует ставить знак обратимости. Для многозарядных ионов процесс гидролиза ступенчатый и как правило, дальше первой ступени не идёт. На каждой ступени присоединяется лишь одна молекула воды.
7. Напишите уравнение реакции гидролиза в молекулярном виде, учитывая, что противоположные ионы, соединяясь могут образовать молекулы вещества.
K2CO3 + H2O = KHCO3 + KOH
8. Определите характер среды раствора по высвобождаемому иону воды (кислотный или щелочной). Предположите изменение окраски индикатора (лакмус, метиловый оранжевый, фенолфталеин)
Фиолетовый лакмус - синий, метиловый оранжевый - желтый, фенолфталеин - малиновый
Составление уравнений окислительно-восстановительных реакций методом электронного баланс
ПРАВИЛА ОПРЕДЕЛЕНИЯ СТЕПЕНЕЙ ОКИСЛЕНИЯ
(с примерами)
1. У свободных атомов и у простых веществ с. о. равна 0.
Н2, Ва, N2, S, AI, Cu, F2.
2. Металлы во всех соединениях имеют положительную с. о.
(ее максимальное значение равно номеру группы - для элементов главных подгрупп):
а) у металлов главной подгруппы I группы +1;
б) у металлов главной подгруппы II группы +2;
в) у алюминия +3.
K2+О, Ca+2CО3, AI+3CI3, Li3+N, Ba+2S04, Mg+2(N03)2.
3. В соединениях кислород имеет с. о. -2 (исключения: OF2 - +2, и пероксиды: Н202, К202 --1).
Н2С03-2, К2О-2
4. В соединениях с неметаллами у водорода с. о. +1,
а с металлами-1:
H+CI, КН -1, NH3+.
-
В соединениях сумма с. о. всех атомов равна 0.
Образец. Н2+С х 03-2
+1 2 +х + (-2) 3=0
х=+4 (С+4)
Теория окислительно-восстановительных реакций
Атомы, молекулы и ионы, отдающие электроны; называются восстановителями. Во время реакции они окисляются. Например:Al- Зе-→Аl0; Н20- 2е → 2Н+; 2Сl-- 2е- С12°
При окислении степень окисления повышается.
Из простых веществ важнейшими восстановителями являются металлы, водород, уголь и др., среди сложных - восстановительными свойствами будут обладать те, в которых имеются атомы элементов с низшей степенью окисления:
HI-, HCl-, N-3H3, H2S -2идр.
Чем ниже степень окисления элемента, чем меньше его электроотрицательность, тем сильнее восстановительные свойства.
Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями. В ходе реакции они восстанавливаются. Например:
S0 + 2ё → S-2; С12 + 2ё 2Сl-; Fe+3+ ё ->Fe+2
При восстановлении степень окисления понижается.
Из простых веществ важнейшими окислителями являются галогены и кислород, среди сложных веществ окислительными свойствами будут обладать те, в состав которых входят атомы с высшей степенью окисления:
КМп+7О4; К2Сг2+607; Си+2О; Fe+3Cl3 и др.
Чем выше степень окисления элемента и больше его электроотрицательность, тем сильнее окислительные свойства.
Метод электронного баланса
При расстановки коэффициентов методом электронного баланса придерживаются следующего алгоритма:
-
Расставить степени окисления всех элементов.
-
Выбрать элементы, изменившие степень окисления.
-
Выписать эти элементы и показать схематично переход электронов (составить электронный баланс).
-
Число перешедших электронов снести крест накрест и, если нужно, сократить. Эти числа будут коэффициентами в уравнении.
-
Расставить коэффициенты из электронного баланса.
-
Сравнением числа атомов каждого элемента в левой и правой части уравнения реакции определить и проставить недостающие коэффициенты.
Примечание: Индекс в молекулах простых веществ переносится в электронный баланс, индексы из формул сложных веществ в баланс не переносятся.
Пример:
2KMn+7О4 + 16HCl-2Mn+2Cl2+2KCl+5Cl20+ 8H20
Мn+7 +5ё Мn+2 2 - окислитель
2Сl- - 2ё Сl20 5 - восстановитель
Коэффициенты, взятые из электронного баланса, подчеркнуты одной чертой.
Методические рекомендации по решению задач
на нахождение молекулярной формулы органического соединения по массе (объему) продуктов сгорания.
-
При сжигании органического соединения массой 4,2 г получили оксид углерода (IV) массой 13,2 г и воду массой 5,4 г. Относительная плотность этого соединения по воздуху 2,9. Выведите молекулярную формулу органического соединения.
Дано:
m (сгор.в-ва) = 4,2 г
m (СО2) = 13,2 г
m (H2O) = 5,4 г
Dповозд. = 2,9
Найти:
МФ вещества
Решение:
Так как вещество при сгорании превращается в углекислый газ и воду, значит, оно состоит из атомов С, Н и, возможно, О. Поэтому его общую формулу можно записать как СхНуОz.
-
Схему реакции сгорания мы можем записать (без расстановки коэффициентов):
СхНуОz + О2 → CO2 + H2O
Весь углерод из исходного вещества переходит в углекислый газ, а весь водород - в воду.
-
Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
n(CO2) = m / M = 13,2 / 44 = 0,3 моль.
На одну молекулу CO2 приходится один атом С, значит, углерода столько же моль, сколько CO2. n (C) = 0,7 моль
n (Н2О) = m / M = 5,4 / 18 = 0,3 моль.
В одной молекуле воды содержатся два атома Н, значит количество водорода в два раза больше, чем воды.
n(H) = 0,3 • 2 = 0,6 моль.
-
Проверяем наличие в веществе кислорода. Для этого из массы всего исходного вещества надо вычесть массы С и Н.
m(C) = 0,3 • 12 = 3,6 г, m(H) = 0,6 • 1 = 0,6 г
Масса всего вещества 4,2 г.
m(O) = 4,2 - 3,6 - 0,6 = 0, т.е.в данном веществе нет атомов кислорода.
-
Дальнейшие действия вам уже знакомы: поиск простейшей формулы.
С : Н = 0,3 : 0,6 = 1 : 2
Простейшая формула СН2.
-
Истинную молярную массу ищем по относительной плотности газа по воздуху
Mист. = Dповозд • 29 = 2,9 • 29 = 84 г/моль.
Истиная формула СН2, её молярная масса 14.
84 / 14 = 6.
Истинная формула С6Н12.
Ответ: С6Н12.
Влияние различных факторов на скорость химической реакции
Скорость химической реакции- это изменение концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени.
Скорость химической реакции определяется формулой
V= C2-C1/t2-t1
Где С1 и С2 - молярные концентрации реагирующих и образующихся веществ соответственно в момент времени t1и t2.
Скорость химической реакции выражается в моль/(л*с)
Зависимость скорости химической реакции от температуры определяется правилом Вант-Гоффа: при изменении температуры(повышении или понижении) на каждые 100С скорость реакции соответственно изменяется(увеличивается или уменьшается в 2-4 раза.
Математически оно выражается формулой:
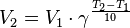
где V1и V2 скорости химической реакции соответственно при температуре Т1 и Т2, γ- температурный коэффициент, который показывает во сколько раз увеличивается скорость химической реакции с повышением температуры реагирующих веществ на каждые 100С.
Пример 1:
Концентрация вещества за 20секунд изменилась 0,6моль/л до 0,004моль/л. Найти скорость реакции.
Решение :
Дано:
С1-0,6моль/л V= C2-C1/t=0,004-0,6/20=0,03моль/(л*с)
С2-0,004моль/л
t-20сек
Найти:
v-?
Ответ :v=0,03моль/(л*с)
Если скорость рассчитывается по исходным веществам, то перед формулой знак '-', т.к. концентрация исходных веществ в результате реакции уменьшается.
Если по продуктам реакции, концентрация которых возрастает, то знак '+'.
Пример 2:
Температурный коэффициент реакции равен 2. Определить во сколько раз увеличилась скорость реакции при новых температурах от 20 до 50 градусов.
Дано: Решение:
γ-2 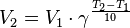
t1-20V2/v1=γt2-t1/10=250-20/10=23=8
t2-50
Найти:
V2/v1-?
Ответ: скорость увеличится в 8 раз.
Решение задач на нахождение массовой доли растворённого вещества
Массовая доля растворённого вещества ω - это отношение массы растворённого вещества m к массе раствора mр:
ω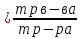 ∙100%
∙100%
Массовую долю выражают в долях единицы или в процентах.
Масса раствора складывается из массы растворённого вещества и массы растворителя:
mр-ра=mр-го в-ва+mр-ля
Если известна плотность раствора ρ и объём V, то массу раствора можно рассчитать по формуле:
mp=ρ∙V
Плотность жидкостей и твёрдых веществ измеряется в г/см3; 1 см3=1 мл.
@Пример:При выпаривании раствора нитрата натрия NaNO3 массой 160г образовался сухой остаток массой 4г. Какова массовая доля нитрата натрия в растворе?
Решение:
Выпаривание - это процесс удаления растворителя. Следовательно, сухой остаток - это масса растворённого вещества. Зная массы раствора и растворённого вещества, рассчитываем массовую долю по формуле:
wр: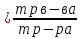
ω (NaNO3)=4/160=0,025 или 2,5%
Ответ: массовая доля NaNO3 в растворе 2,5%.
Составление структурных формул изомеров и названий предельных углеводородов».
Алканы - это предельные углеводороды, в молекулах которых все атомы связаны одинарными связями. Состав их отражает общая формула СnH2n+2.
Для составления названий органических веществ по номенклатуре ИЮПАК необходимо знать формулы и названия радикалов. Радикал - это одновалентная частица, которая получается при отщеплении от молекулы алкана атома водорода, т.е. частица, содержащая неспаренный электрон. Название радикала происходит от названия соответствующего алкана с заменой суффикса -ан на суффикс -ил(см. таблицу).
Название
Формула
Формула радикала
Название радикала
Метан
СН4
СН3-
Метил
Этан
С2Н6
С2Н5-
Этил
Пропан
С3Н8
С3Н7-
Пропил
Бутан
С4Н10
С4Н9-
Бутил
Пентан
С5Н12
С5Н11-
Пентил
Гексан
С6Н14
С6Н13-
Гексил
Гептан
С7Н16
С7Н15-
Гептил
Октан
С8Н18
С8Н17-
Октил
Нонан
С9Н20
С9Н19-
Нонил
Декан
С10Н22
С10Н21-
децил
Изомеры - это вещества, имеющие одинаковые молекулярные, но разные структурные формулы и, следовательно, разные свойства.
Например, у вещества бутана, имеющего формулу С4Н10, есть два изомера, имеющие следующие структурные формулы
СН3 - СН2 - СН2 - СН3 и СН3 - СН - СН3 .
СН3
 Запомни! Чтобы среди веществ найти изомеры, надо структурные формулы свернуть в молекулярные. У изомеров молекулярные формулы будут одинаковые. Например:
Запомни! Чтобы среди веществ найти изомеры, надо структурные формулы свернуть в молекулярные. У изомеров молекулярные формулы будут одинаковые. Например:
а)СН3 - СН2 - СН2 - СН3 (С4Н10); б) СН3 - СН2 - СН - СН3 (С5Н12); в) СН3 - СН - СН3 (С4Н10)
СН3 СН3
Таким образом, вещество а) и в) изомеры, т.к. имеют разное строение, но одинаковую молекулярную формулу - С4Н10.
В соответствии с международной номенклатурой следует придерживаться следующих правил при составлении названия алканов.
1. В структурной формуле выбирают самую длинную цепь атомов углерода (главную цепь).
2. Атомы углерода главной цепи нумеруют, начиная с того конца, к которому ближе разветвление - боковая цепь.
3. В начале названия перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле присутствуют несколько одинаковых радикалов (два, три, четыре и т.д.), то перед их названием ставят соответственно частицы ди-, три-, тетра- и т.д.
4. Основой названия служит наименование предельного углеводорода с тем же числом атомов углерода, что и в главной цепи.
Задание 1.(образец) Назовите вещества
1 2 3 4
СН3 СН СН2 СН3 (С5Н12)
СН3
2- метилбутан
СН3 СН3
1 2 3 4 5 6 5 4 3 2 1
СН3 СН СН2 СН СН2 СН3(С8Н18) СН3 СН СН2 С СН3(С8Н18)
СН3СН3СН3
2,4 - диметилгексан 2,2,4 - триметилпентан
8 7 6 5 4 3 2 1
СН3 СН2 СН СН2СН2СН2 СН СН3 (С11Н24)
С2Н5 СН3
2-метил-6-этилоктан
Найди, есть ли изомеры среди вышеперечисленных веществ.
Приведите три доказательства, что вышеперечисленных вещества гомологи.
Ответ: 2,4 - диметилгексан и 2,2,4 - триметилпентан изомеры, т.к. имеют одинаковую молекулярную формулу С8Н18 .
Вышеперечисленные вещества гомологи, т.к. 1) имеют одинарную связь; 2) гомологическую формулуСnH2n+2; 3) суффикс -ан в названии.
Задание 2.(образец) Напишите структурную формулу 2,4-диметилпентана, составьте структурные формулы: а) гомолога с более длинной углеродной цепью; б) изомера. Назовите их.
Алгоритм.1. 2,4-диметилпентан - корень слова «пентан», пишем главную цепь С-С-С-С-С.
2. Нумеруем главную цепь, в положении 2 и 4 ставим два радикала «метил»
1 2 3 4 5
С-С-С-С-С
СН3 СН3
3. В основной (главной) цепи доставим недостающие атомы Н (в соответствии с валентностью)
1 2 3 4 5
СН3-СН-СН2-СН-СН3
СН3 СН3
а) Запомни! Чтобы составить гомолог надо структурную исходную формулу вещества свернуть в молекулярную. Гомолог будет отличаться на одну или несколько СН2- групп.
Запомни! Чтобы составить гомолог надо структурную исходную формулу вещества свернуть в молекулярную. Гомолог будет отличаться на одну или несколько СН2- групп.
1 2 3 4 5
СН3-СН-СН2-СН-СН3(С7Н16)
СН3 СН3
Следовательно, гомолог с более длинной углеродной цепью, может иметь формулу С8Н18
СН3 СН2СН2СН2СН2СН2СН2 СН3
октан
б) изомер имеет туже формулу С7Н16, но другое строение
СН3 СН2СН2СН2СН2 СН СН3
СН3
2-метилгептан
Критерииоценки реферата
Критерии
Показатели
1.Новизна реферированного текста
Макс. - 20 баллов
- актуальность проблемы и темы;
- новизна и самостоятельность в постановке проблемы, в формулировании нового аспекта выбранной для анализа проблемы;
- наличие авторской позиции, самостоятельность суждений.
2. Степень раскрытия сущности проблемы
Макс. - 30 баллов
- соответствие плана теме реферата;
- соответствие содержания теме и плану реферата;
- полнота и глубина раскрытия основных понятий проблемы;
- обоснованность способов и методов работы с материалом;
- умение работать с литературой, систематизировать и структурировать материал;
- умение обобщать, сопоставлять различные точки зрения по рассматриваемому вопросу, аргументировать основные положения и выводы.
3. Обоснованность выбора источников
Макс. - 20 баллов
- круг, полнота использования литературных источников по проблеме;
- привлечение новейших работ по проблеме (журнальные публикации, материалы сборников научных трудов и т.д.).
4. Соблюдение требований к оформлению Макс. - 15 баллов
- правильное оформление ссылок на используемую литературу;
- грамотность и культура изложения;
- владение терминологией и понятийным аппаратом проблемы;
- соблюдение требований к объему реферата;
- культура оформления: выделение абзацев.
5. Грамотность
Макс. - 15 баллов
- отсутствие орфографических и синтаксических ошибок, стилистических погрешностей;
- отсутствие опечаток, сокращений слов, кроме общепринятых;
- литературный стиль.
Оценивание реферата
Реферат оценивается по 100 балльной шкале, балы переводятся в оценки успеваемости следующим образом:
• 86 - 100 баллов - «отлично»;
• 70 - 75 баллов - «хорошо»;
• 51 - 69 баллов - «удовлетворительно;
• мене 51 балла - «неудовлетворительно».
Баллы учитываются в процессе текущей оценки знаний программного материала.
Критерии оценки сообщений
1. Содержательность, глубина, полнота и конкретность освещения темы (проблемы).
2. Логичность: последовательность изложения, его пропорциональность, обоснование теоретических положений фактами или обобщение фактов и формулирование выводов.
3. Концептуальность изложения: рассмотрены ли различные точки зрения (концепции), выражено ли свое отношение.
4. Риторика (богатство речи): лаконичность, образное выражение мыслей и чувств путем использования различных языковых средств, выбора точных слов, эпитетов и т. п., правильность и чистота речи, владение исторической терминологией.
Критерии оценки презентации
Критерии оценки
Содержание оценки
1. Содержательный критерий
правильный выбор темы, знание предмета и свободное владение текстом, грамотное использование научной терминологии, импровизация, речевой этикет
2. Логический критерий
стройное логико-композиционное построение речи, доказательность, аргументированность
3. Речевой критерий
использование языковых (метафоры, фразеологизмы, пословицы, поговорки и т.д.) и неязыковых (поза, манеры и пр.) средств выразительности; фонетическая организация речи, правильность ударения, четкая дикция, логические ударения и пр.
4. Психологический критерий
взаимодействие с аудиторией (прямая и обратная связь), знание и учет законов восприятия речи, использование различных приемов привлечения и активизации внимания
5. Критерий соблюдения дизайн-эргономических требований к компьютерной презентации
соблюдены требования к первому и последним слайдам, прослеживается обоснованная последовательность слайдов и информации на слайдах, необходимое и достаточное количество фото- и видеоматериалов, учет особенностей восприятия графической (иллюстративной) информации, корректное сочетание фона и графики, дизайн презентации не противоречит ее содержанию, грамотное соотнесение устного выступления и компьютерного сопровождения, общее впечатление от мультимедийной презентации
Критерии оценивания кроссворда
Оценка «5» - 9, 12вопросов
Оценка «4» - 7,8 вопросов
Оценка «3» - 5,6 вопросов
Оценка «2» - меньше 5 вопросов
Критерии оценивания решенных задач
Оценка «5» - все задачи решены верно
Оценка «4» - одна неверно решенная задача
Оценка «3» - 2-3 неверно решенные задачи
Оценка «2» - все задачи решены не верно
Оценка «5» - 9, 12вопросов
Оценка «4» - 7,8 вопросов
Оценка «3» - 5,6 вопросов
Оценка «2» - меньше 5 вопросов
Список литературы
Основная
1. Габриелян О.С. Химия: учеб.для студ. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. - М., 2005.
2. Габриелян О.С. Химия в тестах, задачах, упражнениях: учеб.пособие для студ. сред. проф. учебных заведений / О.С. Габриелян, Г.Г. Лысова - М., 2006.
3.Габриелян О.С. Практикум по общей, неорганической и органической химии: учеб.пособие для студ. сред. проф. учеб. заведений / Габриелян О.С., Остроумов И.Г., Дорофеева Н.М. - М., 2007.
4. Пичугина Г.В. Химия и повседневная жизнь человека. - М., 2004.
Дополнительная
5.Габриелян О.С. Химия: орган.химия: учеб. для 10 кл. общеобразоват. учреждений с углубл. изучением химии / О.С. Габриелян, И.Г. Остроумов, А.А. Карцова - М., 2005.
6. Габриелян О.С. Общая химия: учеб.для 11 кл. общеобразоват. учреждений с углубл. изучением химии / О.С. Габриелян, И.Г. Остроумов, С.Н. Соловьев, Ф.Н. Маскаев - М., 2005.
7. Габриелян О.С., Воловик В.В. Единый государственный экзамен: Химия: Сб. заданий и упражнений. - М., 2004.
8. Титова И.М. Химия и искусство. - М., 2007.
9. Титова И.М. Химия и искусство: организатор-практикум для учащихся 10-11 классов общеобразовательных учреждений. - М., 2007.
10. Габриелян О.С., Остроумов И.Г. Химия: Пособие для поступающих в вузы. - М., 2005.
Приложение 1
Образец оформления сообщения
сообщение
Тема:______________________________________________________________
«_______________________________________________»
выполнил Ф.И.О. студента, курс, группа, специальность
План (схема простого плана):
1.
2.
3.
4.
План (схема сложного плана):
1. ________________________;
________________________:
а) _____________________;
б) _____________________;
в) _____________________.
1.2. _______________________:
а) _____________________;
б) _____________________.
2. ________________________.
2.1. __________________ и т.д.
(далее раскрываются вопросы плана)
1.
1.1.
1.2.
2.


