- Преподавателю
- Химия
- Учебник Химия 8 кл
Учебник Химия 8 кл
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Тугеус В.Я. |
| Дата | 23.10.2014 |
| Формат | doc |
| Изображения | Есть |
§1. Вещество и химический элемент.
1. Тело и вещество. §1-3.
И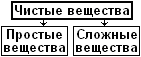 з курса физики вы знаете, что все окружающие предметы называют физическими телами. Примеры физических тел: гвоздь, льдина, стакан, кусок стекла, вода в стакане, песчинка, микроб, человек, Земной шар.
з курса физики вы знаете, что все окружающие предметы называют физическими телами. Примеры физических тел: гвоздь, льдина, стакан, кусок стекла, вода в стакане, песчинка, микроб, человек, Земной шар.
Физические тела состоят из веществ. Например, зерно пшеницы - это физическое тело, которое состоит из множества веществ: белки, жиры, углеводы и др. Физическое тело гвоздь состоит из вещества железо; льдина состоит из вещества вода; книга состоит из вещества бумага.
Задание 1. Из списка выпишите: а) физические тела; б) вещества. Зерно, булавка, железо, вода, лист бумаги, бензин, льдина, лёд, сахар, соль, воздух.
Вещества делятся на органические и неорганические.
Органические вещества образуются в живых клетках растений и животных (белки, жиры, углеводы, нуклеиновые кислоты). К ним относятся также нефтепродукты (бензин, машинное масло) и природный газ, которые получились из живого вещества миллионы лет назад. Человек научился производить органические вещества: бумага, резина, полиэтилен и другие пластмассы. Органических веществ известно более трёх миллионов.
Неорганические вещества (по-другому, минеральные) входят в состав неживой природы - это воздух, вода, металлы, щёлочи, соли, кислоты, почти все горные породы (гранит, мрамор, глина, песок и др.) - неорганических веществ известно сотни тысяч.
Задание 2. Из списка выпишите вещ-ва: а) органические; б) минеральные.
Керосин, лёд, поваренная соль, растительное масло, минеральное масло, бумага, кислород, сахар, углекислый газ, белок, древесина, мел, крахмал, мёд.
Вещества отличаются друг от друга строением (химическим составом) и свойствами. К физическим свойствам веществ относятся агрегатное состояние (твёрдое, жидкое, газообразное), плотность, цвет, запах, вкус, температура плавления и температура кипения, электропроводность.
Задание 3. Назовите физические св-ва а) воды; б) льда; в) поваренной соли.
При физических явлениях состав вещества сохраняется. Например, при плавлении лёд превращается в жидкую воду, а потом в пар, но молекулы льда, воды и пара одинаковы: Н2О.
При химических явлениях (химических реакциях) одни вещества превращаются в другие и их состав изменяется. Например, при сгорании угля происходит реакция с кислородом воздуха, и уголь превращается в углекислый газ.
Химия - это наука о свойствах веществ и об их превращениях.
Задание 4. Выпишите отдельно явления а) физические; б) химические.
Испарение воды; плавление свинца; прокисание молока; прогоркание масла; плавание тел; горение бумаги; ржавление железа; отвердевание жира.
2. Чистые вещества и смеси; простые и сложные вещества.
В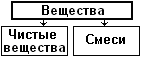 се вещества можно разделить на чистые вещества и смеси. Чистые вещества состоят из одинаковых молекул (или атомов). Например, дистиллированная вода состоит из одинаковых молекул воды Н2О.
се вещества можно разделить на чистые вещества и смеси. Чистые вещества состоят из одинаковых молекул (или атомов). Например, дистиллированная вода состоит из одинаковых молекул воды Н2О.
На самом деле абсолютно чистых веществ в природе не существует, так как всегда есть примеси. Смесями называют вещества, состоящие из различных молекул. Например, молоко представляет собой смесь очень многих веществ: воды, жиров, белков, углеводов, минеральных солей.
Чистые вещества делятся на простые и сложные.
Простыми называют чистые вещества, состоящие только из одного вида атомов (по-другому говоря, из одного химического элемента). Каждому химическому элементу из таблицы Менделеева соответствует простое вещество, а некоторым элементам - даже несколько простых веществ: их называют аллотропными видоизменениями. Например, углероду С (цэ) соответствует три простых вещества: сажа, графит и алмаз, состоящие из одних только атомов углерода, но по-разному соединённых друг с другом. Кислороду О соответствуют два аллотропных видоизменения: простой кислород О2 и озон О3.
Воздух состоит в основном из двух простых веществ: газа кислорода О2 (примерно 1/5 часть) и газа азота N2 (примерно 4/5 части). Все металлы представляют собой простые вещества, состоящие из атомов. Например, чистая медь состоит из атомов меди Cu (купрум), железо - из атомов железа Fe (феррум), свинец - из атомов свинца Pb (плюмбум), олово - Sn (станнум).
Сложными называют чистые вещества, состоящие из атомов нескольких химических элементов. Сложным веществом является вода Н2О, у которой молекулы состоят из двух видов атомов: водорода Н и кислорода О. К сложным веществам относятся оксиды (СО2 - углекислый газ), соли (NaCℓ - поваренная соль), кислоты (Н2SО4 - серная кислота), щёлочи (NaОН - едкий натр) и сотни тысяч других веществ.
Закон Пруста (о постоянстве состава чистых веществ). Каждое чистое вещество имеет один и тот же состав, каким бы способом его не получили.
Например, дождевая вода, вода из колодца или океана, вода из сока любого растения имеет состав Н2О, если её очистить от примесей.
Задание 5. Выпишите из списка вещества а) простые; б) сложные.
Кислород, озон, поваренная соль, соляная кислота, азот, оксид железа, олово, графит, жир, алмаз, алюминий, белок, свинец, сажа.
§2. Химические элементы. §4.
1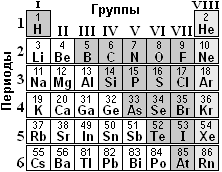 . Периодическая система химических элементов Д.И.Менделеева.
. Периодическая система химических элементов Д.И.Менделеева.
В химии известно 109 химических элементов: их помещают в периодическую систему, которую открыл русский химик Дмитрий Иванович Менделеев в 1869 г.
Периодическая система разбита на строки - 7 периодов и столбцы - 8 групп. Каждому химическому элементу даётся латинское и русское названия, а сам элемент обозначается химическим символом из первых букв его латинского названия.
2. Выучи названия химических элементов.
1. Запомни 6 химических элементов, которые читаются в формулах одной буквой: 1) водород Н (аш) - hydrogenium (гидрогениум) - воду рождающий;
2) кислород О (о) - oxygenium (оксигениум) - кислое рождающий;
3) азот N (эн) - nitrogenium (нитрогениум) - нитраты рождающий;
4) углерод С (цэ) - carboneum (карбонеум);
5) фосфор Р (пэ) - phosphorus (фосфорус); 6) сера S (эс) - sulfur (сульфур).
Задание 1. Прочитай формулы веществ: H2O, H2S, H2SO3, O3, CH4, H2CO3, CO2, N2, N2O, N2O5, HNO3, NH3, P4, P2O5, H3PO4, PH3, CS2, CO, SO2, C2H6.
2. Запомни названия химических элементов, которые в формулах имеют латинские названия (жирные названия выучить в первую очередь):
1) кремний Si - силициум; 2) железо Fe - феррум; 3) медь Сu - купрум;
4) мышьяк As - арсеникум; 5) серебро Ag - аргентум; 6) олово Sn - станнум;
7) сурьма Sb - стибиум; 8) золото Au - аурум; 9) ртуть Hg - гидраргирум.
Задание 2. Прочитай формулы веществ: H2SiO3, FeS, FeCO3, FeSiO3, CuS, CuSO4, Cu(NO3)2, Fe(NO3)3, Ag2O, AgNO3, Ag3PO4, HgO, Hg(OH)2, H3AsO4, Au2O3, Au(NO3)3, Sn(OH)4, Sn3(PO3)2, Sb2O5, H3SbO4, SnCO3, Au(OH)3.
3. Все остальные химические элементы читаются по-русски. Запомни из них
щелочные металлы из I-ой группы: литий Li; натрий Na и калий K;
щелочноземельные металлы из II-ой группы: магний Mg; кальций Ca и барий Ba; галогены из VII-ой группы: фтор F; хлор Сℓ; бром Br и йод I;
инертные газы из VIII-ой группы: гелий Не; неон Ne; аргон Ar; криптон Kr.
4. Запомни также часто встречающиеся металлы: бериллий Ве; хром Cr; алюминий Аℓ; марганец Mn; цинк Zn; кобальт Со.
Задание 3. Прочитай формулы веществ: LiOH; Na3PO4; K2CO3; MgSO4;
CaCO3; CaSO3; Ba(OH)2; HF; F2O; Сℓ2O7; KСℓO4; CaBr2; AℓI3; HIO3.
Задание 4. Прочитай формулы веществ: Аℓ2(SO4)3; MnСℓ2; MgI2; ZnF2; Be(OH)2; H2CrO4; Cr2C; ZnSO4; KMnO4; Mg(BrO3)2; Zn(NO3)2; Co3P2.
Внимание! Подготовьтесь дома писать под диктовку задания 1-4.
Контрольное задание. Под диктовку учителя запишите верно все формулы:
1) H2SO4; 2) K2CO3; 3) CaСℓ2; 4) NaNO3; 5) АℓPO4; 6) CaSiO3; 7) FeSO3;
8) CuF2; 9) AgNO3; 10) HgBr2; 11) ZnSO4; 12) MgCO3; 13) HMnO4; 14) CrI3;
14) BaSiO3; 15) Li3N; 16) HgOH; 17) K2CrO4; 18) Ag3PO4; 19) FeСℓ3.
3. Индексы и коэффициенты в химических формулах. §5.
Индекс показывает, сколько атомов данного химического элемента входит в молекулу или сколько групп атомов входит в молекулу. Например, в формуле H2SO4 индекс 2 показывает, что в молекулу серной кислоты входит 2 атома водорода Н, а индекс 4 показывает, что в молекулу входят 4 атома кислорода О. У атома серы S нет индекса, значит, в молекулу входит 1 атом S.
Коэффициент перед формулой показывает число молекул (или атомов). Например, запись 3Н2О означает три молекулы воды Н2О + Н2О + Н2О. Запись 5Р означает пять атомов фосфора Р + Р + Р+ Р+ Р.
Формула Aℓ(ОН)3 означает, что в молекулу входят три группы ОН, ОН и ОН.
Запись 5Са3(РО4)2 показывает, что в молекулу входит 5∙3 = 15 атомов Са; 5∙2∙1 = 10 атомов фосфора Р и 5∙2∙4 = 40 атомов кислорода О.
Задание 5. Сколько атомов каждого химического элемента входит в запись:
а) Ag3PO4; б) Fe(OН)3; в) 5Н2О; г) Са(Сℓ2О7)2; д) Mg3(PO4)2; е) 3Сu(OH)2;
ж) 5Zn(NO3)2; з) 2Сr(ОН)3; и) 4Ca3(PO4)2.
Задание 6. В какой записи содержится больше всего атомов кислорода О:
а) 5AgNO3; б) 6Hg(OH)2; в) Са(MnO4)2; г) 3Cu(СℓO3)2; д) 3Р2О5.
Контрольное задание. 1. К химическим символам подпиши русские названия:
а) H; б) C; в) О; г) N; д) S; е) K; ж) Ca; з) Si; и) Fe; к) Cu; л) Ag; м) Hg.
2. К русским названиям подпиши химические символы:
а) натрий; б) барий; в) кальций; г) калий; д) фосфор; е) азот; ж) углерод; з) сера; и) хлор; к) хром; л) магний; м) марганец; н) медь; о) железо; п) ртуть.
§3. Атомная и молекулярная масса.
1. Строение атома. §6.
Древнегреческий философ Демокрит впервые выдвинул гипотезу: вещества не сплошные, а состоят из отдельных частиц - атомов, которые уже не делятся на более мелкие частицы (а - не, томос - делимый). В курсе физики 7 класса вы знакомились с основными положениями атомно-молекулярного учения: а) все вещества не сплошные, а состоят из отдельных частиц - атомов; б) между частицами вещества есть промежутки; в) частицы непрерывно и беспорядочно движутся; г) частицы одновременно притягиваются-отталкиваются.
А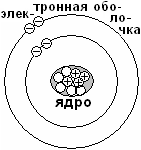 том состоит из ядра и электронной оболочки. Ядро состоит из положительно заряженных протонов и незаряженных нейтронов. Электронная оболочка состоит из отрицательно заряженных электронов. Заряд протона принимают за +1, заряд электрона за -1.
том состоит из ядра и электронной оболочки. Ядро состоит из положительно заряженных протонов и незаряженных нейтронов. Электронная оболочка состоит из отрицательно заряженных электронов. Заряд протона принимают за +1, заряд электрона за -1.
У электронейтрального атома число протонов в ядре равно числу электронов на электронной оболочке.
Массы протона и нейтрона почти одинаковы. Они измеряются в атомных единицах массы (а.е.м.) и примерно равны 1 а.е.м.
Запомни! Число протонов в ядре равно порядковому номеру химического элемента в таблице Менделеева, т.е. равно заряду Z ядра атома. Число нейтронов в ядре N обычно немного больше заряда ядра или равно ему. Общее число протонов Z и нейтронов N в ядре атома называют атомным числом (массовым числом) и обозначают А = Z + N.
Частица
Заряд
Масса
Электрон е-
Протон р+
Нейтрон no
- 1
+ 1
0
0,005 а.е.м.
1 а.е.м
1 а.е.мЭлектрон очень лёгкий: его масса почти в 2000 раз меньше массы протона, поэтому для приблизительных расчётов массы атома электронами можно пренебречь. Почти вся масса атома в ядре!
Задание 1. Сколько протонов р+, нейтронов no и электронов е- содержится в ядре атома железа Fe, если порядковый номер 26 и масса атома 55,847 а.е.м.?
Решение. Порядковый номер Z = 26, значит, в ядре 26 протонов и заряд ядра +26. Тогда вокруг ядра на электронной оболочке 26 электронов с зарядом - 26, поэтому атом не заряжен: +26-26 = 0. Округлим массу атома до целого числа: 55,847 ≈ 56, тогда атомное (массовое) число А = 56.
По формуле А = Z + N найдём число нейтронов: N = А - Z = 56 - 26 = 30.
Задание 1. С помощью таблицы Менделеева найдите число протонов р+, нейтронов no и электронов е- в атомах следующих химических элементов:
а) гелий Не; б) литий Li; в) азот N; г) кальций Са; д) медь Cu; е) свинец Pb.
В курсе химии к атомно-молекулярному учению добавляются 2 положения:
1. Атомы одного вида называют химическим элементом, и они содержат одинаковое число протонов в ядрах. Атомы разных элементов отличаются именно числом протонов в ядре. (Смотри ИЗОТОПЫ)
2. При физических явлениях молекулы сохраняются, а при химических явлениях (реакциях) молекулы разрушаются и образуются новые молекулы.
2. Какие ядра атомов называют ИЗОТОПАМИ. §7.
Рассмотрим подробнее строение ядра атома хлора Сℓ. Порядковый номер Z = 17, значит, в ядре 17 протонов. А вот число нейтронов в ядрах разных атомов хлора оказывается различным: либо 18 нейтронов, либо 20 нейтронов.
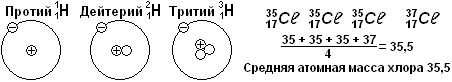
Причём на 3 атома массой 17+18 = 35 а.е.м. приходится 1 атом массой 17 + 20 = 37а.е.м. Поэтому средняя масса атомов Сℓ будет 35,5 а.е.м.
Эти два вида атомов хлора называют изотопами (греч. изос - равный, топос - место), т.к. они занимают одну и ту же клетку в таблице Менделеева.
Изотопами называют атомы одного и того химического элементами, которые отличаются числом нейтронов в ядре.
Большое значение в ядерной физике играют три изотопа водорода (см. рис.): протий, дейтерий (тяжёлый водород) и тритий (сверхтяжёлый водород).
3. Как вычислить массу молекулы (а.е.м.).
Массу атома или молекулы принято обозначать символом mo и рядом в скобках формула атома или молекулы. Атомные массы при решении школьных задач принято округлять до целых чисел, кроме массы атома хлора: mo(Сℓ) = 35,5 а.е.м. Запомните массы самых часто встречающихся элементов:
mo(Н) = 1 а.е.м.; mo(С) = 12 а.е.м.; mo(N) = 14 а.е.м.; mo(O) = 16 а.е.м.
Рассмотрим несколько примеров вычисления атомных и молекулярных масс.
1) mo(Fe) = 55,847 а.е.м. ≈ 56 а.е.м. - округлять надо устно!
2) 4mo(Cu) = 4∙ 63,5 а.е.м. = 254 а.е.м. - масса 4 атомов меди.
3) mo(CaCO3) = 40 + 12 + 16∙3 = 52 + 48 = 100 (а.е.м.) - часто в задачах.
4) mo(Н2СO3) = 1∙2 + 12 + 16∙3 = 14 + 48 = 62 (а.е.м.) - без таблицы Менделеева!
5) mo(Са(OН)2) = 40 + (16 + 1)∙2 = 40 + 34 = 74 (а.е.м.).
6) mo(Са(NO3)2) = 40 + (14 + 16∙3)∙2 = 40 + (14 + 48)∙2 = 40 + 62∙2 = 164 (а.е.м.)
7) 2mo(ВаСℓ2) = 2∙(137 + 35,5∙2) = 2∙(137 + 71) = 2∙208 = 416 (а.е.м.).
Задание 2. Перепишите эти 7 заданий себе на листок и попробуйте сосчитать самостоятельно, потом сверьте ответы.
Задание 3. Вычислите массы молекул:
а) СО2; б) 4SO3; в) Н2SО4; г) Mg(OH)2; д) 2КNO3; е) Na3PO4; ж) Fe(NO3)2;
з) 6С4Н8; и) Са3(РО4)2; к) Aℓ2(SiO3)3; л) 4ZnCℓ2; м) (NH4)2SO4.
4*. Понятие о ядерных реакциях.
При физических явлениях молекулы вещества остаются неизменными. При химических реакциях молекулы разрушаются, но атомы остаются неизменны. Но в ядерной физике рассматривают ядерные реакции, при которых разрушаются даже ядра атомов: из одних химических элементов образуются совершенно другие элементы. Например, металл радий Ra может распадаться на два газа - радон Rn и гелий Не. В химических реакциях такое невозможно! А в ядерной физике пишут: ![]() (запоминать не надо).
(запоминать не надо).
§4. Строение электронных оболочек атомов.
1. Связь строения электронных оболочек с таблицей Менделеева.
Электроны в атоме не стоят на месте - иначе они упали бы на ядро. Электроны движутся вокруг ядра как планеты вокруг Солнца на достаточно большом расстоянии, и все вместе образуют электронную оболочку атома. Число электронов в оболочке нейтрального атома равно числу протонов в ядре, значит, число электронов равно порядковому номеру Z атома в таблице Менделеева.
Правило 1. Электроны в электронной оболочке атома расположены по энергетическим уровням. У атома столько энергетических уровней, в каком периоде атом находится. Например, атом гелия Не находится в I-ом периоде, значит, у него оба электрона расположены на одном (первом) уровне. Атом магния Mg находится в III-ьем периоде, значит, его 12 электронов расположены на трёх уровнях (первый, второй и третий). Атом ртути Hg находится в VI-ом периоде, значит, его 80 электронов размещены по шести уровням.
Правило 2. Будем рассматривать строение электронных уровней только трёх первых периодов, включая калий K и кальций Са из 4-ого периода. Для этих элементов есть ещё одно правило размещения электронов по уровням. На последнем внешнем уровне находится столько электронов, в какой группе атом находится. При этом внутренние уровни заполнены полностью.
Теперь мы можем описать строение электронной оболочки любого атома до номера 20 (кальций). Например, азот N находится во II-ом периоде, значит, у его атома 2 электронных уровня, причём первый уровень полностью заполнен 2-мя электронами, а на втором уровне находится 5 электронов, т.к. азот N находится в V-ой группе. Всего 2 + 5 = 7 электронов. Действительно, порядковый номер азота Z = 7.
Ещё пример. Атом хлора Сℓ находится в III-ем периоде - у него 3 уровня: на 1-ом уровне максимум 2 электрона, на 2-ом уровне максимум 8 электронов, а на 3-ем уровне 7 электронов, т.к. номер группы атома Сℓ равен VII. Действительно, 2 + 8 + 7 = 17 - порядковый номер атома хлора Z = 17.
Задание 1. Проверьте, что а) у атома кальция Са электроны по уровням расположены так: 2 + 8 + 8 + 2 = 20; б) у атома аргона Ar так: 2 + 8 + 8 = 18.
Задание 2. Расположите по энергетическим уровням электроны:
а) атома Li; б) атома С; в) атома О; г) атома Ne; д) атома Аℓ; е) атома К.
2. Группа в таблице Менделеева.
Столбцы химических элементов в таблице Менделеева называют группами. Они делятся две подгруппы: главная подгруппа и побочная подгруппа.
С имволы элементов главной подгруппы расположены слева, а символы элементов побочной подгруппы - справа в клеточке. Например, столбец из элементов Н, Li, Na, K, Rb, Cs, Fr представляет собой главную подгруппу, а столбец из элементов Cu, Ag, Au - побочную подгруппу I-ой группы. Строение электронных оболочек побочных групп изучать не будем. А для элементов главных подгрупп тоже справедливо Правило 2: на внешнем уровне находится столько электронов, в какой группе атом находится. Например, атом олова №50 Sn находится в IV группе главной подгруппы, значит, на последнем внешнем уровне атома олова находится 4 электрона.
имволы элементов главной подгруппы расположены слева, а символы элементов побочной подгруппы - справа в клеточке. Например, столбец из элементов Н, Li, Na, K, Rb, Cs, Fr представляет собой главную подгруппу, а столбец из элементов Cu, Ag, Au - побочную подгруппу I-ой группы. Строение электронных оболочек побочных групп изучать не будем. А для элементов главных подгрупп тоже справедливо Правило 2: на внешнем уровне находится столько электронов, в какой группе атом находится. Например, атом олова №50 Sn находится в IV группе главной подгруппы, значит, на последнем внешнем уровне атома олова находится 4 электрона.
Для элементов побочных групп это правило неверно! Например, атом железа Fe находится в VIII-ой группе, но побочной группы: на внешнем уровне атома железа не 8 электронов, а почему-то всего 2 электрона. И вообще у всех элементов побочной группы на внешнем уровне 1 или 2 электрона.
Задание 3. Определите, а) сколько электронных уровней и б) сколько электронов на внешнем уровне у атомов следующих элементов:
а) бор В; б) фосфор Р; в) мышьяк As; г) криптон Kr; д) стронций Sr;
е) йод I; ж) цезий Cs; з) свинец Pb; и) железо Fe; к) серебро Ag.
Задание 4. Ответьте на следующие вопросы.
а) Сколько элементов входит главную подгруппу II-ой группы?
б) Сколько элементов имеют на внешнем уровне ровно 5 электронов?
в) Сколько элементов входит в побочную подгруппу VIII-ой группы?
г)* Сколько элементов входит в побочную подгруппу III-ей группы? Ответ: 32.
д)* К какой группе и какой подгруппе относится элемент №58 церий Се?
3. Определение состава вещества по химической формуле.
По химической формуле можно определить качественный и количественный состав вещества. Например, по формуле мела СаСО3 можно определить качественный состав: мел состоит из химических элементов кальция Са, углерода С и кислорода О.
Чтобы определить количественный состав, надо сперва найти молекулярную массу мела: mо(СаСО3) = 40 + 12 + 16∙3 = 52 + 48 = 100 (а.е.м.). Теперь нужно найти массовую долю каждого элемента. Для этого надо массу каждого элемента поделить на массу всей молекулы и умножить на 100%:
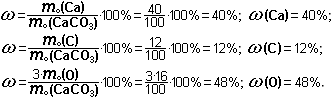
Задание 5. Найти качественный и количественный состав:
а) газа этана С2Н6; б) силиката магния MgSiO3; в) сульфита кальция CaSO3.
Задание 6. Для добычи железа используют три сорта руды, содержащей оксиды железа а) FeO, б) Fe2O3 и в) Fe3O4. В какой руде больше железа?
Ответ: а) ω(Fe) = 78%; б) ω(Fe) = 70%; в) ω(Fe) = 72%.
Задание 7. Самое ценное азотное удобрение - аммиачная селитра NH4NO3. Найдите массовую долю азота в аммиачной селитре.
Задание 8. Найдите массовую долю фосфора в апатите Са3(PO4)2. Отв. 20%
§5. Электронные орбитали.
1. Строение s- и р-орбиталей электронных оболочек. §8.
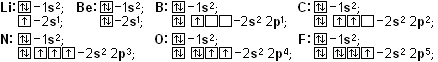
У атома водорода Н ядро состоит всего их одного протона, а вокруг него движется по сферической орбите единственный электрон. От слова sphera такой электрон называют s-электрон. У атома гелия Не в ядре 2 протона и вокруг ядра вращаются на одной орбите 2s-электрона. Эти электроны спариваются и движутся парой. Говорят, что они занимают одну s-орбиталь. На первом энергетическом уровне помещается только одна s-орбиталь, и больше места нет. Электронные формулы водорода Н: 1s1 и гелия Не: 1s2.
атома водорода Н ядро состоит всего их одного протона, а вокруг него движется по сферической орбите единственный электрон. От слова sphera такой электрон называют s-электрон. У атома гелия Не в ядре 2 протона и вокруг ядра вращаются на одной орбите 2s-электрона. Эти электроны спариваются и движутся парой. Говорят, что они занимают одну s-орбиталь. На первом энергетическом уровне помещается только одна s-орбиталь, и больше места нет. Электронные формулы водорода Н: 1s1 и гелия Не: 1s2.
У атома лития Li в ядре 3 протона, и электронная оболочка содержит 3 электрона: 2 из них занимают первый энергетический уровень ближе к ядру, а оставшийся 1 электрон занимает s-орбиталь на втором уровне: 1s22s1. У следующего атома, бериллия Ве, на внешнюю s-орбиталь добавляется ещё один s-электрон: 1s22s2. Элементы I и II группы Н, Не, Li и Ве называют s-элементами.
На втором уровне ещё есть место для 6 электронов, которые располагаются по трём перпендикулярным друг к другу орбиталям: вверх-вниз, влево-вправо и вперёд-назад. От слова perpendicular их называют р-орбитали.
В отличие от s-орбиталей сперва по очереди появляются все 3 р-орбитали с неспаренным р-электроном и только потом спариваются. Элементы В, С, N, O, F и Ne - это шесть р-элементов.
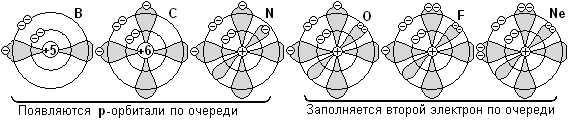
Приведём электронные формулы элементов 2-го периода:
Третий уровень состоит тоже из одной s- орбитали и трёх р-орбиталей, но остаётся место ещё для пяти d-орбиталей, которые пока пустуют! Элементы 3-го периода от натрия Na до аргона Ar заполняются электронами точно так же, как элементы 2-го периода. Атомы Na и Mg - это s-элементы; а от алюминия Аℓ до аргона Ar - р-элементы.
Четвёртый уровень состоит из одной s-орбитали, трёх р-орбиталей, пяти d-орбиталей и ещё есть место для семи f-орбиталей, которые пока пустуют. Элементы IV периода начинают заполняться электронами с s-орбитали: у К один s-электрон, у Са второй s-электрон (калий К и кальций Са - s-элементы).
С элемента №21 скандия Sc начинается заполнение d-орбиталей.
Задание 1. Назовите все s-элементы I-ой группы (от водорода Н до франция Fr). Как устроены их внешние электронные уровни водорода Н; б) лития Li; в) натрия Na и г) калия K? Напишите электронную формулу последней внешней оболочки атома цезия Cs.
Задание 2. Назовите все s-элементы II-ой группы (не забудьте гелий Не!). Сколько всего s-элементов в таблице Менделеева? Напишите электронные формулы: а) гелия Не; б) бериллия Ве; в) магния Mg; г) кальция Са. Напишите электронную формулу последней внешней оболочки атома бария Ва.
Задание 3. Назовите все р-элементы III-ей группы. Напишите электронные формулы атомов а) бора В; б) алюминия Аℓ; в) внешнего уровня атома Ga.
Задание 4. Назовите все р-элементы V-ой группы. Напишите электронные формулы атомов а) азота N; б) фосфора Р; в) внешнего уровня сурьмы Sb.
Задание 5. Назовите все р-элементы VIII-ой группы (гелий Не не входит!). Напишите электронные формулы атомов а) неона Ne; б) аргона Ar; в) последнего уровня ксенона Хе.
Задание 6. Назовите все р-элементы 3-его периода (не путать с группой!). Почему их именно 6 штук? В каких подгруппах расположены все р-элементы? Сколько всего р-элементов в таблице Менделеева? Назовите р-элементы с самым маленьким и самым большим порядковым номером Z.
2 . Электроотрицательность химических элементов. §9.
. Электроотрицательность химических элементов. §9.
Э лектроотрицательностью называют свойство атомов данного элемента притягивать к себе электроны от атомов других элементов.
лектроотрицательностью называют свойство атомов данного элемента притягивать к себе электроны от атомов других элементов.
Н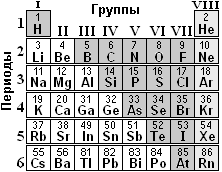
![]() аибольшей электроотрицательностью обладают неметаллы, которые притягивают к себе "чужие" электроны. Самый электроотрицательный элемент №9 фтор F, его электроотрицательность условно принимают за 4.
аибольшей электроотрицательностью обладают неметаллы, которые притягивают к себе "чужие" электроны. Самый электроотрицательный элемент №9 фтор F, его электроотрицательность условно принимают за 4.
Ч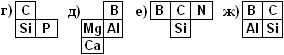 ем ближе элемент расположен к фтору F, т.е. чем элемент правее в периоде и выше в группе, тем его электроотрицательность больше и тем больше элемент проявляет неметаллические свойства.
ем ближе элемент расположен к фтору F, т.е. чем элемент правее в периоде и выше в группе, тем его электроотрицательность больше и тем больше элемент проявляет неметаллические свойства.
Для неметаллов полезно помнить ряд активности, где неметаллические свойства у неметаллов убывают от 4 до 2:
F O Cℓ N Br S C Р Si I H.
Все 16 неметаллов выделены тёмно-серым цветом: они делят таблицу Менделеева по диагонали Н→В→Si→As→Te→At.
Светло-серые элементы от гелия Не до радона Rn являются инертными газами - они почти ни в какие химические реакции не вступают (их не изучаем!), но их обычно тоже относят к неметаллам, хотя они не притягивают электроны от других атомов.
В противоположном от диагонали углу таблицы Менделеева находится самый электроположительный металл франций Fr №87, его электроотрицательность 0,8 - наименьшая из всех элементов. Атомы франция легче всего отдают свой электрон с внешней оболочки другим атомам. За ним - цезий Cs.
Запомни! Металлы всегда отдают электроны неметаллам.
Чем ближе элемент расположен к францию Fr, т.е. чем элемент левее в периоде и ниже в группе, тем он легче отдаёт электроны и его электроотрицательность меньше, т.е. тем сильнее элемент проявляет металлические свойства. Электроотрицательность металлов меняется от 2 до 0,8. Во всех побочных группах таблицы Менделеева содержатся только металлы.
По таблице Менделеева легко сравнить Э.-О. двух элементов в одном периоде или в одной группе и по диагонали от фтора F к францию Fr.
Пример 1. Сравните активность металлов (или неметаллов).
а) Т.к. Na левее, чем Mg, то Na более активный металл, чем Mg.
Т.к. К ниже, чем Na, то К более активный металл, чем Na.
Самый активный металл К, за ним Na и самый пассивный Mg.
б) Т.к. Na ниже, чем Li, и левее, чем Mg, то Na самый активный из трёх металлов. Но что активнее: Li или Mg - ответить нельзя.
в) Ближе всех ко фтору азот N и дальше всех кремний Si, значит самый активный неметалл N и самый пассивный Si, а углерод С средний.
Задание 7. Сравните активность металлов (неметаллов) по рис.г), д), е), ж).
Задание 8. Среди неметаллов F, S, As назовите самый активный и самый пассивный неметаллы.
Задание 9. Среди неметаллов N, S, Br назовите самый активный и самый пассивный неметаллы (используйте ряд активности неметаллов).
Задание 10. Среди металлов Na, Аℓ, Rb назовите самый активный и самый пассивный металлы.
Задание 11. Какой из элементов Mg, Aℓ, Si обладает самыми слабыми металлическими свойствами? Какой из элементов Si, P, S обладает самыми сильными металлическими свойствами?
Запомни! 1. Металлы I-ой группы главной подгруппы Li, Na, K, Rb, Cs и Fr называются щелочными металлами - это самые активные металлы!
2. Металлы II-ой группы Mg, Ca, Sr, Ba и Ra называются щелочно-земельными металлами - тоже довольно активные металлы.
3. Неметаллы VII-ой группы F, Cℓ, Br, I и At называют галогенами.
§6. Типы химических связей.
Атомы соединяются в молекулу при помощи химических связей. При этом электрон с внешнего уровня одного атома спаривается с электроном внешнего уровня другого атома. Образуется общая электронная пара, которая и связывает атомы в молекулу.
Химическая связь между атомами - это общая электронная пара, при помощи которой атомы соединяются в молекулу.
Рассмотрим три типа химической связи за счёт электронных пар.
1. Ковалентная неполярная и полярная связи. §10-11.
Ковалентная связь между двумя атомами образуется за счёт общей электронной пары, которая движется вокруг ядер обоих атомов.
При этом один из электронов ранее принадлежал одному атому, а другой электрон - другому атому, но пара электронов стала уже общей. Ковалентная связь бывает неполярная и полярная.
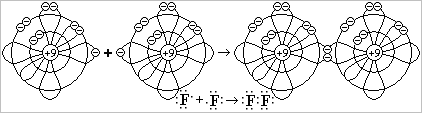
а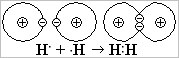 ) Неполярная ковалентная связь образуется между двумя атомами неметаллов с одинаковой электроотрицательностью: Н2, О2, N2, F2, Cℓ2, Br2, I2 и др.
) Неполярная ковалентная связь образуется между двумя атомами неметаллов с одинаковой электроотрицательностью: Н2, О2, N2, F2, Cℓ2, Br2, I2 и др.
Т.к. электроотрицательность атомов одинакова, то общая электронная пара вращается вокруг обоих атомов одинаковое время. При этом общий заряд каждого атома остаётся равным 0, поэтому такую ковалентную связь называют неполярной. У двух атомов водорода Н:Н спарились s-электроны: атомы соединились в молекулу водорода Н-Н при помощи химической связи из пары s-электронов. По рис. разберитесь, как образуется неполярная связь из пары р-электронов в молекуле фтора F2.
б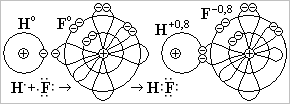 ) Полярная ковалентная связь образуется между двумя атомами неметаллов с разной электроотрицательностью, а также между атомами металлов и неметаллов, у которых электроотрицательность отличается не сильно (разница меньше, чем на 2 единицы): H2O, HF, SO2; FeS, AℓP, CuO и т.д.
) Полярная ковалентная связь образуется между двумя атомами неметаллов с разной электроотрицательностью, а также между атомами металлов и неметаллов, у которых электроотрицательность отличается не сильно (разница меньше, чем на 2 единицы): H2O, HF, SO2; FeS, AℓP, CuO и т.д.
На рис. приведён механизм образования полярной ковалентной связи в молекуле фтороводорода HF. Неспаренный s-электрон атома Н и неспаренный р-электрон атома F спариваются. Более электроотрицательный атом F перетягивает общую электронную пару к себе так, что она больше времени вращается вокруг ядра атома F. Атом фтора получает частичный отрицательный заряд F-0,8, атом водорода - положительный Н+0,8.
Для простоты частичные заряды заменяют целыми числами - 1 и + 1, но тогда им дают название - степень окисления. Поэтому степень окисления атома Н+1 и атома F-1. Молекула Н+1F-1 имеет два полюса, и её поэтому называют диполем (двухполюсником).
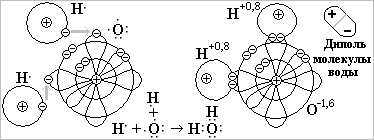
Разберитесь по рисунку, как образуется полярная ковалентная связь в молекуле воды Н2О и почему молекула представляет собой диполь Н+1О2-2. Диполи воды играют очень важную роль в химии!
2. Ионная связь. §9.
Ионная связь образуется между атомами активных металлов и сильно электроотрицательных неметаллов (когда разница в электроотрицательности больше 2 единиц).
Таковыми являются щелочные (Li, К, Na и др.) и щелочноземельные металлы (Mg, Ca, Ba и др.) с одной стороны и неметаллы O, N, F, Cℓ, Br с другой стороны. В ионной связи общая электронная пара почти полностью смещается на орбиту атома неметалла: атомы металла превращаются в положительные ионы, атомы неметалла - в отрицательные ионы.
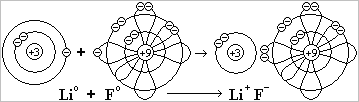
Ионы удерживаются друг около друга не за счёт общей электронной пары, а за счёт притяжения частиц с противоположными зарядами (за счёт кулоновских сил притяжения). Ионы выстраиваются в кристаллическую решётку, поэтому все ионные соединения - это твёрдые вещества. Ионную кристаллическую решётку имеют соединения щелочных и щелочноземельных металлов: Na2O, CaO, NaOH, Ca(OH)2, NaCℓ, CaCℓ2, LiF, Na3N и т.д.
3. Металлическая связь. §12.
Металлическая связь образуется между атомами металлов за счёт общих свободных электронов. В металлах электроны с внешних электронных слоёв легко отщепляются и свободно беспорядочно блуждают, становятся общими для всего куска металла, т.е. образуют как бы электронный газ. А атомы металла при этом превращаются в положительные ионы, которые колеблются на месте, образуя кристаллическую решётку. Общие электроны довольно прочно удерживают ионы металла в кристаллической решётке.
Задание 1. Запишите в тетради столбиком три типа химической связи:
а) ковалентная неполярная; б) ковалентная полярная; в) ионная. Распределите все формулы к "своему" типу связи: Cℓ2; HCℓ; NaCℓ; O2; CaO; H2O; P4; P2O5; AℓP; BaF2; CO2; S8; KBr; ZnS; Mg3N2; Li2O; N2; FeCℓ3; F2O; SiO2; CsF.
Задание 2. Выпишите в две строки а) все щелочные металлы и б) галогены. Составьте 5 формул соединений между этими веществами так, чтобы ни один элемент не повторялся, например, RbAt. Сколько всего разных формул можно написать. Какой тип связи будет во всех этих соединениях? Почему?
4. Периодическая система. §9.
Если все химические элементы расположить в один ряд в порядке возрастания числа протонов в ядре, то можно заметить, что свойства элементов периодически повторяются от щелочного металла до инертного газа.
Периодическая система получается, если периодически повторяющиеся ряды элементов расположить друг под другом так, чтобы щелочные металлы были под щелочными металлами (Li, Na и т.д.), галогены - под галогенами и инертные газы - под инертными газами (He, Ne, Ar и т.д.).
Периодом называют ряд химических элементов, расположенных по возрастанию заряда ядра Z от щелочного металла до инертного газа.
Среди 7 периодов различают неполные периоды: 1-ый и 7-ой;
малые периоды по 8 элементов: 2-ой и 3-ий (только главные подгруппы);
большие периоды - 4, 5 и 6-ой - содержат главные и побочные подгруппы).
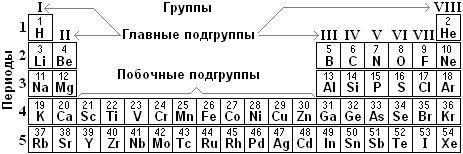
Группой называют вертикальный столбец химических элементов, расположенных друг под другом и обладающих схожими свойствами.
Запомните! Щелочные металлы: Li, Na, K; щелочноземельные Mg, Ca, Ba;
галогены: F, Cℓ, Br, I; инертные газы: He, Ne, Ar, Kr, Xe, Rn.
Металлические и неметаллические свойства меняются по периодам и группам следующим образом.
а) По периодам. Чем больше номер элемента в периоде (от Li до Ne), тем больше заряд ядра, а значит, положительное ядро сильнее притягивает электроны. От этого радиус атома в периоде постепенно уменьшается, поэтому атом сильнее притягивает электроны от других атомов. Значит, неметаллические свойства в периоде усиливаются, а металлические - ослабляются.
б) По группам (главные подгруппы). Чем больше номер периода в группе (от лития Li к францию Fr), тем больше число электронных уровней, а значит, радиус атома резко (скачками) увеличивается. Но чем дальше электроны от ядра, тем легче их атом отдаёт: металлические свойства усиливаются.
Задание 3. Почему неметаллические свойства у атома фосфора Р выражены сильнее, чем у атома мышьяка As, но слабее, чем у атома азота N?
Задание 4. Почему неметаллические свойства у атома фосфора Р выражены сильнее, чем у атома кремния Si, но слабее, чем у атома серы S?
Задание 5. Почему металлические свойства у магния Mg выражены слабее, чем натрия Na, но сильнее, чем у алюминия Aℓ? Сравните металлические свойства у металлов бериллия Be, магния Mg и кальция Ca.
Задание 6. Назовите две причины, по которым кислород О является более активным неметаллом, чем фосфор Р.
Задание 7. Почему калий К является более активным металлом, чем Mg?
§7. Простые вещества. Количество вещества.
1. Металлы и неметаллы. §13-14.
Все химических элементов в периодической системе делят на металлы и неметаллы по диагонали Н→В→Si→As→Te→At. По химическим свойствам их главное отличие в том, что атомы металлов легко отдают электроны, а атомы неметаллов притягивают электроны от других атомов. Каждому химическому элементу соответствует простое вещество (одно или несколько аллотропных видоизменений). Рассмотрим, какими физическими свойствами обладают простые вещества.
а) Металлы. Простые вещества металлы имеют металлическую кристаллическую решётку, в которой ионы металла соединены общими электронами. Благодаря такой решётке кусок металла обладает пластичностью, т.е. металлы можно ковать под ударами молота, особенно в нагретом состоянии, вытягивать из металлов тонкий провод или прокатывать в тонкие листы, особенно золото. Благодаря общим электронам металлы хорошо проводят тепло и электрический ток: золото, серебро, медь, алюминий. Металлы имеют металлический блеск, например, зеркала делают из серебра.
Физические свойства металлов: пластичность, ковкость, тягучесть, электро- и теплопроводность, металлический блеск.
При обычных условиях все металлы твёрдые, кроме ртути Hg (гидраргирум), который твердеет только на морозе при -39ºС.
В щелочных и щелочноземельных металлах кристаллическая решётка слабая, поэтому эти металлы мягкие, легко режутся ножом. Они легко плавятся. Но есть очень твёрдые и прочные металлы, как хром, и очень тугоплавкие, как вольфрам, из которого делают нити накала электролампочек.
б) Неметаллы. Запомните простые вещества-газы: водород Н2, азот N2, кислород О2 и его аллотропное видоизменение озон О3, два галогена фтор F2 и хлор Сℓ2, а также 6 инертных газов: гелий Не, неон Ne, аргон Ar, криптон Kr, ксенон Хе и радон Rn.
Среди простых веществ-неметаллов единственное жидкое вещество бурого цвета бром Br2. Остальные - твёрдые вещества.
Углерод С образует несколько аллотропных видоизменений (уголь-сажа, графит, алмаз и др.). Сера S также имеет несколько аллотропий, чаще всего кристаллическая сера в виде кусочков или порошка жёлтого цвета. Фосфор Р бывает красный (используется в спичках) и белый Р4 (ядовитый). Твёрдый кристаллический йод I2 и графит С имеют даже металлический блеск.
Задание 1. Назовите два простых вещества, которые являются жидкими при обычных условиях. Можно ли ртутным термометром измерить - 45ºС?
Задание 2. По таблице Менделеева назовите все 11 химических элементов, которым соответствуют простые вещества - газы. К металлам или неметаллам они относятся? Назовите формулы всех 12 газов.
Задание 3. По таблице Менделеева назовите все 10 химических элементов-неметаллов, которым соответствуют твёрдые простые вещества. Почему на самом деле простых твёрдых веществ намного больше десяти?
2. Количество вещества. §15.
В физике масса тела m измеряется в килограммах (граммах, тоннах). Масса атомов и молекул, измеренная в даже граммах, даёт очень маленькую величину, которой неудобно пользоваться, например, масса атома водорода равна m(Н) = 1,66∙10-24 г. Поэтому мы измеряли массу атомов и молекул в более удобных единицах - атомных единицах массы а.е.м., где mo(Н) = 1 а.е.м.
Напомним массы атомов: mo(С) = 12 а.е.м.; mo(N) = 14 а.е.м.; mo(О) = 16 а.е.м.
При химических реакциях нужно знать не столько массу, сколько число атомов, вступающих в реакцию. Например, для соединения железа Fe и серы S надо, чтобы число атомов Fe и S было одинаково, иначе одно из веществ останется в избытке: Fe + S → FeS (сульфид железа). По таблице Менделеева видим, что атомные массы mo(Fe) = 56 а.е.м. и mo(S) = 32 а.е.м. Но какую массу железа и какую массу серы для этого надо отвесить на весах?
Оказывается, если взять 6∙1023 атомов железа и столько же атомов серы, то их массы в граммах будут равны своим атомным массам в а.е.м., то есть в железе массой m(Fe) = 56 г и сере массой m(S) = 32 г будет одинаковое число атомов по 6∙1023 штук. Значит, 56 г железа и 32 г серы прореагируют друг с другом полностью!
Порцию атомов (или молекул) по 6∙1023 штук называют термином моль и обозначают греческой буквой "ню" 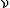 = 1 моль. В молях измеряется физическая величина, которую называют количеством вещества. Массу одного моля вещества называют молярной массой и обозначают буквой М. Число частиц в 1 моле называют числом Авогадро и обозначают буквами NA = 6∙1023 1/моль. Молярная масса вещества измеряется в единицах "грамм, делённый на моль", например, молярная масса железа М(Fe) = = 56 г/моль; молярная масса воды: М(Н2О) = (1∙2 + 16) г/моль = 18 г/моль.
= 1 моль. В молях измеряется физическая величина, которую называют количеством вещества. Массу одного моля вещества называют молярной массой и обозначают буквой М. Число частиц в 1 моле называют числом Авогадро и обозначают буквами NA = 6∙1023 1/моль. Молярная масса вещества измеряется в единицах "грамм, делённый на моль", например, молярная масса железа М(Fe) = = 56 г/моль; молярная масса воды: М(Н2О) = (1∙2 + 16) г/моль = 18 г/моль.
Для решения задач на количество вещества удобно пользоваться таблицей:
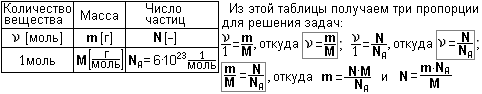
Некоторые задачи легко сосчитать устно. Например, известно, что
1 моль воды Н2О содержит 6∙1023 молекул и имеет массу 18 г. Тогда
2 моль воды Н2О содержит 12∙1023 молекул и имеет массу 36 г, а
0,5 моль воды Н2О содержит 3∙1023 молекул и имеет массу 9 г; чуть труднее
1,5 моль воды Н2О содержит 9∙1023 молекул и имеет массу 27 г.
Задание 4. Известно, что 1 моль углерода С содержит 6∙1023 атомов и имеет массу 12 г. Найдите устно число атомов и массу а) 3 моль С; б) 0,5 моль С;
в) 1,5 моль С; г) 2,5 моль С.
Задание 5. Какое количество вещества составляет а) 36 г воды; б) 9 г воды; в) 36 г углерода С; г) 18 г углерода; д) 64 г серы; е) 28 г железа?
Задание 6. Какое количество вещества составляет а) 3∙1023 молекул сахара; б) 12∙1023 молекул углекислого газа; г) 18∙1023 атомов железа?
Образцы оформления задач по теме "Количество вещества".
Пример 1. Какова масса 1,5 кмоль серной кислоты H2SO4?
Дано: 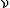 = 1,5 кмоль = 1 500 моль; М(H2SO4) = 1∙2 + 32 + 16∙4 = 98 (г/моль).
= 1,5 кмоль = 1 500 моль; М(H2SO4) = 1∙2 + 32 + 16∙4 = 98 (г/моль).
Найти: m(H2SO4).
Решение.
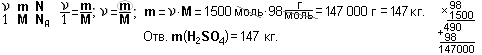
Пример 2. Какое количество газа бутана С4Н10 содержится в баллоне, если масса газа равна 29 кг?
Дано: m(С4Н10) = 29 кг = 29 000 г; М(С4Н10) = 12∙4 + 1∙10 = 58 (г/моль).
Найти: 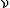 (С4Н10).
(С4Н10).
Решение.
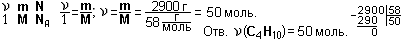
Пример 3. Сколько молекул содержится в глюкозе С6Н12О6 массой 340 г?
Какое количество вещества это составляет?
Дано: М(С6Н12О6) = 12∙6 + 1∙2 + 16∙6 = 72 + 2 + 96 = 170 (г/моль);
m(С6Н12О6) = 340 г.
Найти: N(С6Н12О6); 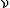 (С6Н12О6).
(С6Н12О6).
Решение.
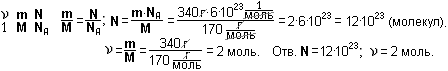
Задание 7. Найти массу 2,5 кмоль азотной кислоты HNO3.
Задание 8. Какое количество пропана С3Н8 составляет 8,8 кг пропана?
Задание 9. Сколько молекул оксида фосфора Р2О5 содержится в 710 г?
Задание 10. Сколько молекул содержится в 85 г глюкозы? Какое количество вещества это составляет?
Задание 11. Какова масса 3∙1023 молекул воды? Какое количество вещества это составляет?
Задание 12. Какое количество вещества составляет 18∙1023 молекул газа азота? Какова масса такого количества азота?
Задание 13. Во сколько раз молярная масса сернистого газа SО2 больше молярной массы газа водорода? Ответ. В 32 раза.
Задание 14. Что тяжелее: 2 моля газа хлора или 3 моля газа аргона?
3. Молярный объём газов. §16.
Нормальными условиями (н.у.) в физике принято называть температуру 0ºС и атмосферное давление 760 мм рт.ст. или 100 кПа. Оказывается при этих условия 1 моль любого газа занимает объём 22,4 литра (следует из закона Авогадро, который изучается в физике 10 класса). Этот объём называют молярным объёмом газа и обозначают Vm = 22,4 л/моль.
При преобразовании единиц объёма нужно переносить запятую:
1 м3 = 1 000 л; 1 л = 1 дм3 = 0,001 м3; 1 мл = 1 см3 = 0, 001 л.
Для решения задач продолжим таблицу из прошлой темы.

Образцы оформления задач по теме "Молярный объём газа".
Пример 4. Какое количество вещества составляет 112 м3 кислорода при н.у.?
Дано: V(О2) = 112 м3 = 112 000 л; Vm = 22,4 л/моль. Найти: 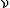 .
.
Решение.
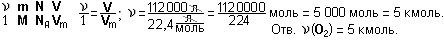
Пример 5. Какова масса 1 м3 воздуха при н.у., если средняя молярная масса воздуха равна 29 г/моль? Какова плотность воздуха при н.у.?
Дано: V(возд.) = 1 м3 = 1 000 л; М(возд.) = 29 г/моль; Vm = 22,4 л/моль.
Найти: m(возд.)
Решение.
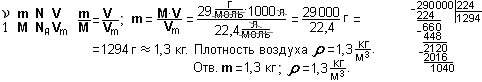
Пример 6. Найти объём и массу 18∙1023 молекул газа хлора Сℓ2 при н.у.?
Дано: N = 18∙1023; М(Сℓ2) = 35,5∙2 г/моль = 71 г/моль; Vm = 22,4 л/моль;
NA = 6∙1023 1/моль. Найти: V; m.
Решение.
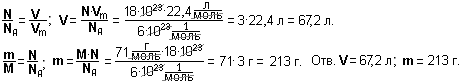
Задание 15. Какое количество вещества составляет 4,48 м3азота при н.у.?
Задание 16. Какова масса 1 м3 газа бутена С4Н8 при н.у. и его плотность?
Задание 17. Какой объём займёт 40 г водорода при н.у.?
Задание 18. Сколько молекул содержится в 4,48 л газа при н.у.?
Задание 19. Найти объём и массу 2,4∙1023 молекул азота.
Задание 20. Какой объём займёт 6,4 кг кислорода и сколько это молекул?
§8. Степень окисления и валентность.
1. Три вида химических формул.
1. Молекулярные формулы записывают с помощью индексов - это самая краткая запись, но по ней трудно судить, как устроена молекула на самом деле. Например, по молекулярной формуле H2SO4 не видно, что атомы Н на самом деле соединены с атомами О, а не с атомами S, как кажется.
2. Электронные формулы самые подробные - здесь точками указывают все электроны внешних слоёв всех атомов. Тогда понятно, какие электроны перекрываются, а какие электронные пары свободны.
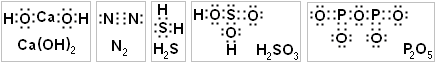
3. Графические (структурные) формулы. Если в электронной формуле каждую общую электронную пару заменить чёрточкой, а остальные электроны не показывать, то получится структурная формула.

Совет: если хочешь химию понимать, а не зубрить, учись писать уравнения реакций в структурных формулах!!!
Задание 1. По электронной формуле запишите структурную и молекулярную формулы веществ (в молекулярной формуле металл - спереди!).
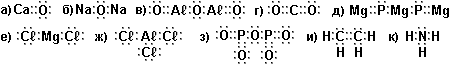
2. Валентность атома.
Как видно по графическим формулам, атомы соединяются в молекулы не как попало, а последовательно друг с другом согласно валентности атомов.
Валентностью называют число электронов данного атома, которые участвуют в химической связи с соседними атомами.
По графическим формулам легче всего определить валентность атома (см. рис. выше). Видно, что во всех формулах водород Н одновалентен, атомы кислорода О и кальция Са двухвалентны, атомы азота трёхвалентны, атом серы бывает 2-валентен и 4-валентен, атом фосфора 5-валентен.
Задание 2. По структурным формулам из Задания 1 определите валентности всех входящих в формулы атомов (Са, О, Na, Aℓ, C, H, Mg, Сℓ, P, N).
3. Степень окисления химических элементов. §17.
Степенью окисления называют число, которое показывает, сколько электронов смещается от атома данного элемента (+) или притягивается к нему (-).
По таблице Менделеева легко понять и запомнить основные степени окисления.
Как определить степень окисления химического элемента (только в главной подгруппе!).
1. Атомы металлов могут только отдавать электроны. При этом они превращаются в положительные ионы. Щелочные металлы: Li0 - 1e → Li+1, поэтому степень окисления щелочных металлов может быть только +1, валентность щелочных металлов всегда равна 1. Для водорода Н+ и Н-.
Щелочноземельные металлы: Mg0 - 2e → Mg+2, степень окисления +2, валентность 2. Точно также для бериллия Ве и цинка Zn.
Металлы III-группы: Аℓ0 - 3е → Аℓ+3, степень окисления +3, валентность 3.
2. Неметаллы IV-ой группы углерод С и кремний Si могут отдавать все 4 электрона с внешнего уровня: С0 - 4е → С+4 либо принимать 4 электрона для завершения внешнего уровня до восьми электронов: С0 + 4е → С-4. Степени окислений С и Si могут быть +4 или -4, а валентность 4.
Неметаллы V-ой группы азот N, фосфор Р и мышьяк As могут отдать все 5 электронов с внешней оболочки: Р0 - 5е → Р+5 либо принять 3 электрона для завершения внешнего уровня до 8 электронов: Р0 + 3е → Р-3. Степени окислений могут быть +5 или -3, валентности 5 или 3.
Неметаллы VI-ой группы сера S, селен Se и теллур Те могут отдать либо 4 электрона: S0 - 4е → S+4 либо все 6 электронов: S0 - 6е → S+6, а также могут принять недостающие 2 электрона: S0 + 2е → S-2. Степени окислений +4, +6 и -2, а валентности 4, 6 и 2.
Внимание! Кислород О может только принять 2 электрона: О0 + 2е → О-2.
3. Неметаллы VII-ой группы чаще всего принимают 1 электрон: F0 + 1е → F-1, поэтому степень окисления у фтора всегда -1 и валентность 1. Но другие галогены хлор Сℓ, бром Br и йод I могут отдавать либо 1, либо 3, либо 5, либо 7 электронов, например, Сℓ0 - 5е → Сℓ+5. Поэтому степени окислений у галогенов чаще всего - 1, но могут быть +1, +3, +5, +7.
4. Инертные газы VIII-ой группы и гелий Не не образуют молекул, поэтому степень окисления и валентность у них всегда 0 (мы их не изучаем).
5. У простых веществ, состоящих из молекул, степень окисления всегда равна 0, т.к. электроны в химических связях не смещаются ни к одному из атомов, а вот валентность бывает разная. Рассмотрим структурные формулы газов: водород Н-Н одновалентный, азот N≡N трёхвалентный, кислород O=O двухвалентный, фтор F-F и хлор Сℓ-Сℓ одновалентные.
6. Запомните степени окисления следующих металлов:
медь Cu и ртуть Hg чаще всего +2, но бывают +1; железо Fe бывает +2 и +3;
серебро Ag всегда +1; хром бывает +2, +3, +6; марганец Mn +2, +4, +7;
олово Sn и свинец Pb чаще +4, но бывают +2.
Правило. В любом соединении сумма степеней окисления всех атомов равна 0, т.к. число отданных электронов равно числу принятых электронов. Пользуясь этим правилом, можно найти неизвестную степень окисления одного элемента, если степени окислений остальных элементов известны.
Пример. Найти степень окисления хрома Cr в соли K2Cr2O7.
Калий - щелочной металл из 1-ой группы, поэтому К+1. Кислород всегда О-2. Составим уравнение: 2·(+1) + 2·х + 7·(-2) = 0; 2 + 2х - 14 = 0; 2х = 12; х = +6.
Задание 1. Найти степени окисления серы S по формулам: SO2, SO3, H2SO4.
Задание 2. Найти степени окисления и валентность углерода С по формулам СО, СО2, Н2СО3.
Задание 3. Найти степень окисления а) хрома в Н2CrO4; б) железа в Fe2O3;
в) свинца в PbO2; г) марганца в KMnO4; д) хлора в НСℓО, НСℓО3 и НСℓО4.
Задание 4. Найти степень окисления каждого элемента:
а) Na3P; б) Ca2Si; в) ZnCℓ2; г) Aℓ2O3; д) Ва2N3; е) Р2О5; ж) CaS; з) LiBr;
и) Ag2Se; к) HgF2; л) K2Te; м) Mg3P2; н) As2O5; о) SnS2; п) Mn2O7.
4. Алгоритм составления формулы бинарного соединения.
Как составить формулу вещества из двух элементов? Два металла не могут образовать соединение, т.к. оба металла "хотят" отдавать электроны, а кто же тогда их будет принимать?! Поэтому остаётся два случая.
а) Металл + неметалл. Например, алюминий Аℓ и сера S.
1) Металл отдаёт электроны - пишем слева со знаком "+", неметалл принимает электроны - пишем справа со знаком "-". Пока получаем Аℓ+S-.
2) Алюминий в III-ей группе, на внешнем слое 3 электрона - все их отдаёт, значит, Аℓ+3. Сера S в VI-ой группе, на внешнем слое 6 электронов; до завершения слоя атом серы может принять 8 - 6 = 2 электрона, значит, S-2. Пока получаем Аℓ+3S-2.
3) Наименьшее число делится на 3 и на 2 - это 6. Значит, все атомы Аℓ должны отдать всем атомам серы 6 электронов: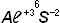 .
.
4) Делим 6:3 = 2 атома алюминия; 6:2 = 3 атома серы. Получим: Аℓ2S3 - это сульфид алюминия (у бинарных соединений суффикс -ид).
а) Неметалл + неметалл. Например, сера S и кислород O.
1) Выясним, кто кому отдаёт электроны. Кислород О выше серы, то есть ближе к фтору, более электроотрицательный, забирает электроны: S+O-.
2) Сера S в VI-ой группе, на внешнем слое 6 электронов, допустим, отдаёт все электроны: S+6. Кислород тоже в VI-ой группе, на внешнем слое 6 электронов; до завершения слоя атом О может принять 8 - 6 = 2 электрона: О-2. Пока получаем S+6О-2.
3) Наименьшее число делится на 6 и на 2 - это 6. Значит, все атомы серы S должны отдать всем атомам О всего 6 электронов: ![]() .
.
4) Делим 6:6 = 1 атом серы S; 6:2 = 3 атома кислорода О. Получим SО3 - оксид серы (VI). Т.к. у серы переменная валентность, то у названия вещества надо в скобках указать, какая именно валентность у серы. У серы бывает ещё и 4-валентный оксид SО2 - оксид серы (IV).
Внимание! Чтобы давать названия химическим соединениям, надо знать латинские названия элементов. Запомните латинские корни неметаллов:
Н - гидрид, В - борид, С - карбид, N - нитрид, О - оксид, F - фторид,
Si - силицид, Р - фосфид, S - сульфид, Сℓ - хлорид, Br - бромид,
As - арсенид, Se - селенид, Те - теллурид, I - йодид.
Задание 5. Составить формулы высших оксидов (по алгоритму) для элементов: а) Na; б) Са; в) Аℓ; г) Si; д) N; е) S; ж) Сℓ; з) Fe; и) Mn; к) Pb.
Задание 6. Составить формулы соединений металлов и неметаллов и дать им названия: а) Na и N; б) Са и P; в) Аℓ и S; г) Ba и Cℓ; д) Mg и N; е) K и S; ж) Zn и Сℓ; з) Na и Si; и) Са и Se; к) Аℓ и As; л) Аℓ и Br; м) Ag и F; н) Mg и С.
Задание 7. Составьте формулы веществ:
а) оксид железа (III); б) хлорид меди (II); в) оксид хрома (VI);
г) сульфид марганца (IV); д) силицид железа (II); е) нитрид марганца (III).
Задание 8. Составьте формулы водородных соединений неметаллов второго периода B; C; N; O; F и третьего периода Si; P; S; Cℓ.
Задание 9. Используя ряд H I Si Р C S Br N Cℓ O F, составьте формулы бинарных соединений неметалла с неметаллом:
а) C и Cℓ; б) Si и S; в) P и S; г) Br и N; д) N и O.
Контрольное задание. 1. С помощью таблицы Менделеева составьте формулы высших оксидов элементов II периода: Na, Mg, Aℓ, Si, P, S и Cℓ.
2. Составьте формулы соединений металлов и неметаллов и дайте им названия: а) К и Р; б) Ва и N; в) Аℓ и Р; г) Са и Сℓ; д) Li и S; е) Аℓ и Br.
3. Составьте формулы веществ по названиям: а) хлорид железа (III);
б) оксид хлора (V); в) сульфид натрия; г) фосфид кальция; д) нитрид магния.
§9. Оксиды.
1. Реакции получения оксидов.
Оксидами называются сложные вещества, состоящие из двух элементов, один из которых кислород О.
Оксиды получаются при сгорании металлов и неметаллов в кислороде О2. Например, если красный порошок фосфора Р в ложечке внести в пламя спиртовки, то образуется густой белый дым из кристалликов оксида фосфора.
1) Составим схему уравнения реакции горения фосфора: Р + О2 → РО.
2) Теперь составим формулу оксида, учитывая степени окисления Р+5 и О-2.
Получим схему уравнения Р + О2 → Р2О5. Теперь уравняем кислород.
3) Перед О2 поставим коэффициент 5, а перед Р2О5 поставим 2. Получим схему уравнения Р + 5О2 → 2Р2О5, где в левой части 5∙2 = 10 и в правой части 2∙5 = 10 - атомов кислорода стало одинаково.
4) Остаётся уравнять фосфор. Т.к. справа фосфора 2∙2 = 4, то слева перед фосфором поставим коэффициент 4. Окончательно получаем уравнение:
4Р + 5О2 → 2Р2О5.
Мы составили первое уравнение реакции в химии, научились его уравнивать!
2. Классификация оксидов.
Металлам соответствуют основные оксиды (также амфотерные и кислотные оксиды, но их мы трогать не будем). Неметаллам соответствуют кислотные оксиды (также несолеобразующие, но их трогать не будем).

Уравнения реакций получения оксидов:
а) 4Li + O2 → 2Li2O; б) 2Mg + O2 → 2MgO; в) 4Аℓ + 3О2 → 2Аℓ2О3;
г) С + О2 → СО2; д) S + O2 → SO2; е) SO2 + 2O2 → 2SO3.
Оксиды получаются при сгорании некоторых сложных веществ. В кухонных плитах сгорает либо природный газ метан СН4, либо смесь газов пропан С3Н8 и бутан С4Н10. При этом получается два оксида: углекислый газ СО2 и вода Н2О.
СН4 + О2 → СО2 + Н2О; углерод С уравнен, уравняем следующий элемент водород: СН4 + О2 → СО2 + 2Н2О; осталось уравнять кислород. Справа кислорода 2 + 2∙1 = 4, а слева кислорода 2. Значит, СН4 + 2О2 → СО2 + 2Н2О.
Значительно сложнее уравнять горение бутана: С4Н10 + О2 → СО2 + Н2О. Уравняем углерод и водород С4Н10 + О2 → 4СО2 + 5Н2О. Справа кислорода 4∙2 + 5∙1 = 13, поэтому слева ставим дробный коэффициент 13/2 = 6,5:
С4Н10 + 6,5О2 → 4СО2 + 5Н2О. Чтобы избавиться от дробных коэффициентов, умножим обе части уравнения на 2: 2С4Н10 + 13О2 → 8СО2 + 10Н2О.
Задание 1. Составьте уравнения реакций сгорания щелочных и щелочноземельных металлов: Na, K, Ca и Ва.
Задание 2. Уравняйте уравнения реакций: а) Fe + O2 → Fe2O3;
б) Cu + O2 → CuO; в) H2 + O2 → H2O; г) N2 + O2 → NO; д) Cs + O2 → Cs2O.
Задание 3. Составьте уравнения реакций горения а) этана С2Н6; б) пропана.
3. Важнейшие оксиды. §18.
Большинство оксидов - твёрдые вещества, например, все оксиды металлов (основные оксиды) являются твёрдыми веществами. Среди них, железная руда - это оксид железа Fe2O3 (III) или смеси оксидов железа FeO и Fe2O3.
Оксид кремния SiO2 - обычный песок (с примесями), глина - это большей частью оксид алюминия Аℓ2О3. Оксид фосфора Р2О5 - белое кристаллическое вещество.
Среди оксидов неметаллов много газов. Самый известный из них углекислый газ - оксид углерода СО2 (IV), а также угарный газ СО - оксид углерода (II). Газами являются сернистый газ SO2 - оксид серы (IV) с запахом горелых спичек. Многие оксиды хлора и азота являются газами.
Жидкостей среди оксидов немного, но среди очень распространённое на Земле вещество вода - это оксид водорода Н2О. Тяжёлую маслянистую жидкость представляет собой оксид серы SO3 (VI).
Задание 4. Распределите в две строки оксиды: а) оксиды неметаллов и б) оксиды металлов: а) Р2О5; б) Fe2O3; в) SiO2; г) CuO; д) СО2; е) Li2O; ж) CuO; з) N2O3; и) Аℓ2О3; к) SeO3; л) Br2O5; м) Ag2O; н) SnO2.
§10. Основания, или гидроксиды.
1. Свойства гидроксидов.
Основаниями называются сложные вещества, состоящие из атома металла и одной или нескольких гидроксид-ионов ОН-. Основания по-другому называют гидроксидами.
Каждому металлу, точнее оксиду металла, соответствует основание. Оксиды щелочных и щелочноземельных металлов реагируют с водой Н2О, при этом получаются растворимые основания, которые называются щелочами. Остальным металлам соответствуют нерастворимые основания.
Na2O + Н2О → 2NaOH - гидроксид натрия (едкий натр) - твёрдое белое кристаллическое вещество, хорошо растворимо в воде. Раствор гидроксида обладает щелочными свойствами: мылкий на ощупь, разъедает кожу (плохо заживающие раны), одежду, окрашивает индикаторы.
Аналогично реагируют с водой и дают едкие щёлочи Li2O, K2O, Cs2O, Rb2O.
О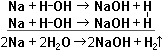
![]() ксиды щелочноземельных металлов хуже реагируют с водой и дают менее активные щёлочи: MgO + 2Н2О → Mg(OH)2 - гидроксид магния очень слабо растворим. Оксид кальция СаО называется негашёной известью. Если куски СаО залить водой, начнётся бурная реакция с выделением тепла: СаО + 2Н2О → Са(OH)2 - получается гидроксид кальция, который называют гашёная известь - ею белят стены. Раствор гидроксида кальция называют известковой водой. Аналогично реагирует с водой ВаО, даёт Ва(ОН)2.
ксиды щелочноземельных металлов хуже реагируют с водой и дают менее активные щёлочи: MgO + 2Н2О → Mg(OH)2 - гидроксид магния очень слабо растворим. Оксид кальция СаО называется негашёной известью. Если куски СаО залить водой, начнётся бурная реакция с выделением тепла: СаО + 2Н2О → Са(OH)2 - получается гидроксид кальция, который называют гашёная известь - ею белят стены. Раствор гидроксида кальция называют известковой водой. Аналогично реагирует с водой ВаО, даёт Ва(ОН)2.
Остальные основные оксиды с водой не реагируют, но гидроксиды им всё равно соответствуют. Например, оксиду железа FeO (II) соответствует гидроксид железа Fe(OH)2 (II), а оксиду Fe2O3 (III) соответствует гидроксид Fe(OH)3.
Например, реакция соединения FeO + Н2О → Fe(OH)2 не идёт, зато при нагревании идёт обратная реакция разложения: Fe(OH)2 → FeO + Н2О. На схеме внизу эти реакции показаны стрелками + Н2О и - Н2О.

2. Как щёлочи окрашивают индикаторы.
К
 аждое вещество в химии требуется распознать. Для этого существуют качественные реакции. Например, для распознавания углекислого газа СО2 используют известковую воду Са(ОН)2. Если углекислый газ, например, из лёгких человека, пропускать по трубочке сквозь прозрачную известковую воду, то вода в стакане помутнеет.
аждое вещество в химии требуется распознать. Для этого существуют качественные реакции. Например, для распознавания углекислого газа СО2 используют известковую воду Са(ОН)2. Если углекислый газ, например, из лёгких человека, пропускать по трубочке сквозь прозрачную известковую воду, то вода в стакане помутнеет.
Щёлочи легче всего распознать с помощью индикаторов - веществ, которые способны изменять цвет. Запомните собственный цвет индикатора и на какой цвет он меняется в щёлочи!
Индикаторы
Лакмус
Фенолфталеин
Метилоранж
Собственный цвет
фиолетовый
бесцветный
оранжевый
Цвет в щёлочи
синий
малиновый
жёлтый
3. Взаимодействие металлов с водой.
О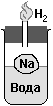 пыт. Отрежем кусочек металлического натрия Na и положим в пробирку с водой, куда капнем бесцветного фенолфталеина. Натрий будет бурно реагировать с водой и бегать по поверхности воды из-за выделения газа водорода Н2. Закроем пробирку газоотводной трубкой и поднесём горящую спичку: слышен звук "Пах!"
пыт. Отрежем кусочек металлического натрия Na и положим в пробирку с водой, куда капнем бесцветного фенолфталеина. Натрий будет бурно реагировать с водой и бегать по поверхности воды из-за выделения газа водорода Н2. Закроем пробирку газоотводной трубкой и поднесём горящую спичку: слышен звук "Пах!"
Кусочек натрия расплавится и превратится в блестящий шарик, т.к. при реакции выделяется много тепла. Наконец, раствор начнёт окрашиваться в красивый малиновый цвет, т.к. образуется щёлочь NaOH.
Атомы натрия замещают по одному атому водорода из молекулы воды. Выделяющиеся атомы водорода Н соединяются попарно в молекулы Н2. Выделяющийся газ Н2 в пламени спички взрывается со звуком "пах!" и потом горит бесцветным пламенем: 2Н2 + О2 → 2Н2О.
Аналогично реагируют с водой другие щелочные металлы: LI, K, Cs, Rb. Менее бурно реагируют с водой щелочноземельные металлы:
Аналогично реагируют с водой Mg и Ва. Другие металлы при обычных условиях с водой не реагируют.
Задание 1. Напишите уравнения реакций получения двумя способами:
а) гидроксида калия КОН; б) гидроксида бария Ва(ОН)2.
Задание 2. Напишите уравнения реакций разложения при нагревании:
а) гидроксида алюминия; б) гидроксида железа (II); в) гидроксида железа (III);
г) гидроксида хрома Сr(OH)2; д) гидроксида хрома Сr(OH)3; е) Pb(OH)4.
Задание 3. Каждому оксиду напишите формулу соответствующего основания: а) Li2O; б) MgO; в) Аℓ2О3; г) FeO; д) Fe2O3; е) CuO; ж) Cu2O; з) Ag2O.
Задание 4. Каждому основанию напишите формулу соответствующего оксида:
а) HgOH; б) CsOH; в) Zn(OH)2; г) Sn(OH)4; д) Mn(OH)3; е) Cu(OH)2.
§11. Кислоты.
1. Классификация кислот. §20.
Кислотами называются сложные вещества, содержащие атомы Н, способные замещаться на атомы металлов.
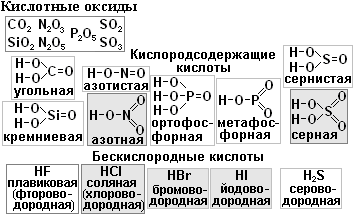
Кислоты делятся на кислородсодержащие и бескислородные. Каждому кислотному оксиду соответствует кислородсодержащая кислота. Например, кислотному оксиду СО2 соответствует угольная кислота Н2СО3 (см. табл.).
Некоторым кислотным оксидам может соответствовать две кислоты. Например, оксиду фосфора Р2О5 соответствует две кислоты: метафосфорная НРО3 и ортофосфорная Н3РО4.
Четырёхвалентному оксиду серы SO2 соответствует сернистая кислота H2SO3, а 6-валентному оксиду SO3 соответствует серная кислота H2SO4.
Кислоты делятся на сильные, средние и слабые. Запомните три сильные кислоты: азотная HNO3, серная H2SO4 и соляная НСℓ и три слабые кислоты угольная Н2СО3, кремниевая H2SiO3 и сероводородная H2S.
2. Получение кислот из кислотных оксидов.
Большинство кислотных оксидов реагируют с водой, образуя кислоты. Так, углекислый газ под давлением растворяется в воде: СО2 + Н2О → Н2СО3, образуя слабую угольную кислоту (газированная вода). Если сосуд с угольной кислотой оставить открытым, то кислота "выдыхается": Н2СО3 → Н2О + СО2↑.
Аналогично растворяется в воде сернистый газ SО2 + Н2О → Н2SО3, образуя сернистую кислоту, которая также выдыхается в открытом сосуде. Маслянистая жидкость SО3 реагирует с водой: SО3 + Н2О → Н2SО4, образуя сильную серную кислоту, которая, наоборот, поглощает пары воды из воздуха.
Оксиду азота (III) N2O3 соответствует азотистая кислота N2O3 + Н2О → 2HNO2.
Твёрдые вещества оксид азота (V) N2O5 и оксид фосфора (V) Р2О5 поглощают воду и дают кислоты: N2O5 + Н2О → 2HNO3 и Р2О5 + 3Н2О → 2Н3РО4.
Оксид кремния SiO2 (песок) с водой не реагирует, но кислота этому оксиду соответствует: Н2SiO3 - очень слабая нерастворимая кремниевая кислота, которая легко разлагается при нагревании: Н2SiO3 → Н2О + SiО2.
Задание 1. По формулам кислот научитесь быстро давать их названия:
Н2SО4; НСℓ; HNO3; Н2СО3; H2SiO3; H2S; Н3РО4; HF; Н2SО3; HBr; НРО3; HNO2.
Задание 2. По названиям кислот под диктовку научитесь писать формулы:
а) серная; б) сернистая; в) сероводородная; г) фосфорная (ортофосфорная); д) метафосфорная; е) азотная; ж) азотистая; з) соляная; и) фтороводородная; к) бромоводородная; л) плавиковая; м) хлороводородная, н) кремниевая.
Задание 3. Напишите уравнения реакций кислотных оксидов с водой:
а) СО2; б) SО2; в) Р2О5; г) N2O5; д) SО3; е) N2O3.
Задание 4. Напишите уравнения реакций разложения кислот:
а) угольной кислоты; б) сернистой кислоты.
Задание 5. Напишите формулу оксида, соответствующего кислоте:
Н2SО4; HNO3; Н2СО3; H2SiO3; Н3РО4; Н2SО3; НРО3; HNO2.
3. Свойства кислот. §20.
1. Все кислоты кислые на вкус. Сильные кислоты разъедают кожу, ткань. Серная кислота обугливает древесину. Концентрированная серная кислота H2SO4 - это тяжёлая маслянистая жидкость, при разбавлении водой сильно нагревается. Поэтому если воду лить в кислоту, то вода на поверхности кислоты закипает и разбрызгивает капельки кислоты, которые могут попасть на окружающие предметы. Нужно кислоту лить в воду тонкой струйкой, тогда тяжёлая кислота опустится на дно сосуда с водой.
2. Кислоты, как и щёлочи, окрашивают индикаторы.
Индикаторы
Лакмус
Фенолфталеин
Метилоранж
Собственный цвет
фиолетовый
бесцветный
оранжевый
Цвет в щёлочи
синий
малиновый
жёлтый
Цвет в кислоте
красный
бесцветный
розовый
Задание 6. В штативе стоят пробирки с а) раствором NaOH, б) чистой водой; в) раствором НСℓ. Каким будет цвет лакмуса в каждой из пробирок?
Задание 7. В пробирке №1 лакмус окрасился в красный цвет, в пробирке №2 фенолфталеин стал малиновым и в пробирке №3 метилоранж остался оранжевым. В какой из пробирок были а) раствор КОН, б) вода; в) раствор НF?
§12. Соли.
1. Номенклатура солей. §21.
Солями называются сложные вещества, состоящие из атомов металла и кислотных остатков.
Если в молекуле кислоты атомы Н заменить на атомы металла, то получится соль. Например, в молекуле соляной кислоты НСℓ атом Н заменить на атом натрия Na, то получится поваренная соль - хлорид натрия NaСℓ. Вот почему соляная кислота получила такое название!
Ещё пример. Если в угольной кислоте Н2СО3 два атома Н заменить на атом кальция Са, то получится карбонат кальция СаСО3 - это обычный мел! А если 2 атома Н заменить на 2 атома Na, то получится карбонат натрия Nа2СО3 - сода.
Чтобы научится составлять формулы солей и давать им названия, надо повторить §8 пункт 4 (особенно Задание 6). Соль состоит из положительных ионов металла и отрицательных ионов кислотного остатка. Нужно помнить заряды ионов щелочных металлов Na+, Li+, K+; щелочноземельных металлов Ca+2, Mg+2, Ba+2 и других металлов: Aℓ+3, Zn+2, Cu+2 (бывает Cu+), Fe+2 или Fe+3; Ag+, Hg+2 (бывает Hg+), Pb+2 и Sn+2 (реже Pb+4 и Sn+4); Cr+2 или Cr+3.
Заряды ионов кислотного остатка равны числу атомов Н в молекуле кислоты: т.к. кислота НСℓ содержит 1 атом Н, то заряд хлорид-иона Сℓ-1 или Сℓ-. Аналогично у азотной кислоты HNO3 заряд нитрат-иона NO3-.
Кислоты HNO3, НСℓ, HF, HBr, НРО3 называют однооснόвными кислотами.
Т.к. серная кислота Н2SО4 содержит 2 атома Н, то сульфат-ион SО4-2 имеет заряд -2. Кислоты Н2SО4, Н2SО3, Н2СО3; H2S называют двухосновными.
Фосфорная кислота Н3РО4трёхосновная, поэтому фосфат-ион РО4-3.
Кислота
Ион
Пример
Плавиковая HF
F-- фторид
NaF; СаF2; AℓF3
Соляная НСℓ
Сℓ-- хлорид
NaCℓ; СаСℓ2; AℓСℓ3
Бромоводородная HBr
Br-- бромид
NaBr; СаBr2; AℓBr3
Сероводородная H2S
S-2 - сульфид
Na2S; СаS; Aℓ2S3
Угольная Н2СО3
СО3-2 - карбонат
K2СО3; CaCO3; Aℓ2(CO3)3
Кремниевая H2SiO3
SiO3-2- силикат
K2SiО3; CaSiO3; Aℓ2(SiO)3
Серная Н2SО4
SО4-2 - сульфат
K2SО4; CaSO4; Aℓ2(SO4)3
Сернистая H2SO3
SO3-2 - сульфит
K2SО3; CaSO3; Aℓ2(SO3)3
Азотная HNO3
NO3- - нитрат
KNО3; Ca(NO3)2; Aℓ(NO3)3
Азотистая HNO2
NO2- - нитрит
KNО2; Ca(NO2)2; Aℓ(NO2)3
Фосфорная (орто) Н3РО4
РО4-3 - фосфат
K3PО4; Ca3(PO4)2; AℓPO4
Метафосфорная НРО3
РО3- - метафосфат
KPО3; Ca(PO3)2; Aℓ(PO3)3
Пример. Составьте формулу сульфита железа (III).
Сначала пишем ион трёхвалентного железа Fe+3 и рядом сульфит-ион SO3-2. Получим Fe+3SO3-2. Наименьшее общее кратное чисел 3 и 2 будет 6 - пишем сверху между ионами: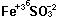 . Делим 6:2 = 3 и пишем индекс Fe3; делим 6:3 = 2 и пишем индекс 2. Получим
. Делим 6:2 = 3 и пишем индекс Fe3; делим 6:3 = 2 и пишем индекс 2. Получим ![]() , т.е. Fe2(SO3)3 - сульфит железа (III).
, т.е. Fe2(SO3)3 - сульфит железа (III).
Задание 1. Составьте формулы нитратов а) натрия; б) магния; в) железа (III).
Задание 2. Составьте формулы сульфатов а) лития; б) цинка; в) хрома (III).
Задание 3. Составьте формулы фосфатов а) калия; б) бария; в) алюминия.
Задание 4. Составьте формулы солей меди (II):
а) хлорид; б) сульфид; в) карбонат; г) фосфат.
Задание 5. Составьте формулы а) сульфида серебра; б) сульфата хрома (II); в) сульфита железа (III); нитрата свинца (IV); нитрита олова (II).
Задание 6. Дайте названиям солям (с учётом переменной валентности):
а) К2СО3; б) ZnSiO3; в) FeBr3; г) BaF2; д) CuS; е) FeSO4; ж) Ag2SO3; з) HgСℓ2;
и) HgNO3; к) Pb(NO3)4; л) Ba(NO3)2; м) Sn3(PO4)2; н) Ca(PO3)2; о) CrPO4.
2. Реакции замещения металлов с кислотами.
Из определения кислот (§10, п.1) следует, что атомы водорода в молекулах кислот могут замещаться атомами металлов. При этом получается соль и водород Н2. Но не каждый металл может реагировать с каждой кислотой.
Активность металлов уменьшается согласно ряду активности металлов: активные металлы: Li, K, Ba, Ca, Na, Mg; средние:, Mn, Zn, Cr, Fe, Sn, Pb и пассивные металлы (после водорода Н): Cu, Hg, Ag, Au.
Прежде всего, исключим концентрированную серную кислоту H2SO4 (конц.) и азотную кислоту HNO3 (любую), свойства которых рассмотрим позднее!
1. Активные щелочные и щелочноземельные металлы реагируют со всеми кислотами, причём активные металлы с сильными кислотами реагируют бурно:
а) 2Na + 2HCℓ → 2NaCℓ + H2↑ - хлорид натрия;
б) 2К + Н2СО3 → К2СО3 + H2↑ - карбонат калия;
в) 6Li + 2H3PO4 → 2Li3PO4 + 3H2↑ - фосфат лития;
г) Mg + 2HBr → MgBr2 + H2↑ - бромид магния;
д) Са + H2SO4 (разбав.) → CaSO4 + H2↑ - сульфат кальция;
е) 3Ва + 2H3PO4 → Ва3(PO4)2 + 3H2↑ - фосфат бария.
2. Металлы, стоящие в ряду активности после водорода (Н), с кислотами не реагируют. Заметим, что с Н2SО4 (конц.) и HNO3 реагируют все металлы, но водород Н2не выделяется, и уравнения реакций мы пока писать не умеем!
Cu + HCℓ - не реагирует; Cu + HNO3 - реагирует, но мы не умеем писать.
3. Средней активности металлы Aℓ, Zn, Cr, Fe, Sn реагируют только с сильными кислотами H2SO4 (разбав.), HCℓ, HBr, HI.
2Aℓ + 3H2SO4 (разбав.) → Аℓ2(SO4)3 + 3H2↑ - сульфат алюминия;
2Аℓ + 6НСℓ → 2АℓСℓ3 + 3H2↑ - хлорид алюминия;
Fe + 2НСℓ → FeСℓ2 + H2↑ - хлорид железа (II). Заметим, что металлы с переменной валентностью Cr, Fe, Sn с кислотами дают только 2-валентные соли.
Задание 7. Допишите уравнения, уравняйте их и напишите название соли:
а) К + НСℓ → ; б) Na + H2S → ; в) Ва + Н2SО3 → ; г) Mg + Н2SО4 (разб.) → ;
д) К + Н3РО4 → ; е) Са + Н3РО4 → ; ж) Аℓ + НСℓ → ; з) Са + НРО3 → .
Задание 8. Допишите уравнения, уравняйте их и напишите название соли:
а) Cr + H2SO4 (разбав.) → ; б) Fe + HBr → ; в) Zn + H2SO4 (разбав.) → ;
г) Аℓ + HI → ; д) Sn + HCℓ → ; е) Fe + Н2СО3 - ; ж) Zn + H2S - .
Задание 9. Устно назовите пары Ме + К-та, когда реакция не идёт:
Металлы: Na, Ca, Aℓ, Fe, Cu, Ag; кислоты: Н2SiО3; НСℓ; Н2S; Н2SО4 (разб.).
§13. Кристаллические решётки.
1. Аморфные и кристаллические вещества.
Большинство веществ существует во всех трёх агрегатных состояниях. Например, вещество вода Н2О а) лёд - твёрдое состояние ниже 0ºС; б) жидкая вода - от 0º до 100ºС; в) пар - выше 100ºС.
Например, кислород О2 бывает не только газообразным, но и жидким и твёрдым при очень низких температурах. Железо Fe бывает не только твёрдым, но и жидким и газообразным при очень высоких температурах.
Твёрдые тела делятся на аморфные и кристаллические. У аморфных тел частицы вещества расположены без особого порядка. При нагревании они становятся всё мягче и мягче, пока не превратятся в жидкость - у аморфных тел нет определённой температуры плавления. Примеры аморфных тел: мёд, пластилин, смола, стекло.
У кристаллических тел частицы вещества (атомы, ионы, молекулы) расположены в строгом порядке в виде кристаллов. При нагревании они остаются твёрдыми до температуры плавления. Если при температуре плавления будем продолжать нагревание, то температура повышаться не будет, но тело будет плавиться - превращаться из твёрдого состояния в жидкое. У кристаллических тел есть температура плавления.
2. Четыре вида кристаллических решёток. §22 и таблица 6.
1. Атомную кристаллическую решётку имеют простые вещества, состоящие из отдельных атомов неметаллов, которые прочно соединены друг с другом в определённом порядке. Яркий пример атомной кристаллической решётки - это аллотропные видоизменения углерода С. В кристалле алмаза каждый атом С прочно соединён с 4-мя соседними атомами, поэтому алмаз - самое твёрдое вещество. В кристалле графита атом С соединён только с тремя соседними атомами, поэтому твёрдость графита во много раз меньше.
Атомную решётку имеют кристаллы бора В, кремния Si, германия Ge и др., а также кристаллы сложных веществ, например, оксид кремния SiO2.
2. Молекулярную кристаллическую решётку имеют простые вещества газы при сильном охлаждении: Н2, N2, O2, F2, Cℓ2 (а также инертные и другие газы), простые вещества фосфор Р4, сера S8, бром Br2 (при охлаждении) и многие сложные вещества, например, лёд, нафталин, сахар. Молекулярные решётки, как правило, очень слабые, вещества легко плавятся.
3. Металлическую решётку имеют все простые вещества - металлы. Так как атомы металла легко отщепляют по электрону с внешнего уровня, то кристаллы металлов состоят из ионов металла, между которыми блуждают свободные коллективные электроны. Ионы металла удерживаются в узлах кристаллической решётки с помощью коллективных электронов с разной силой. Поэтому прочность металлической кристаллической решётки бывает очень разной: щелочные металлы легко режутся ножом, а металл хром, например, очень твёрдый и прочный.
5. Ионную кристаллическую решётку имеют вещества ионного строения: многие оксиды, большинство солей и гидроксидов, некоторые кислоты. Например, в кристалле хлорида натрия NaCℓ каждый ион Na+c шести сторон окружен ионами Сℓ-, а ион хлора окружён ионами натрия. Решётка прочная.
Задание 1. Выпишите столбиком классы веществ:
а) основные оксиды; б) кислотные оксиды; в) основания; г) кислоты; д) соли. Рассортируйте все вещества по соответствующим классам: HF, SO3, Zn(OH)2, BaSO4, Na2O, AℓCℓ3, HNO3, CO2, KOH, FeS, SnO, N2O5, H2S, Cr2O3, Aℓ(OH)3.
Задание 2. Выпишите столбиком типы кристаллических решёток:
а) атомная; б) молекулярная; в) металлическая; г) ионная. Рассортируйте вещества по типам кристаллических решёток (в твёрдом состоянии):
графит С, сера S8, золото Au, хлорид калия КСℓ, фосфор Р4, песок SiO2, NaOH, барий Ва, бор В, кислород О2, сульфид кальция СаS, ртуть Hg.
Задание 3. Допишите уравнения, уравняйте их и напишите названия вещ-в:
а) К + О2 → ; б) S + О2 → ; в) Mg + Н2О → ; г) SО3 + Н2О → ; д) Li + Н2О → ;
е) Ва + Н2О → ; ж) Na + Н2SО3 → ; з) Са + HF → ; и) Zn + НСℓ → .
Задание 4. Допишите уравнения, уравняйте их и напишите названия вещ-в:
а) Аℓ + О2 →; б) Р + О2 →; в) N2О5 + Н2О →; г) Р2О5 + Н2О → ; д) Аℓ + НСℓ →;
е) Аℓ + Н2SО4 (разб.) →; ж) К + Н3РО4 → ; з) Ва + НРО3 → ; и) Mg + Н3РО4 →.
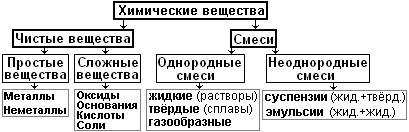
§14. Чистые вещества и смеси.
1. Чистые вещества.
Прочитайте §1 пункт 2. Хотя абсолютно чистых веществ в природе не бывает, но часто бывает нужно максимально очистить вещество от примесей. Среди простых чистых веществ (металлов и неметаллов) в современной технике, радиоэлектронной аппаратуре требуются сверхчистые вещества, где один атом примеси приходится на миллиард атомов вещества, например, кристаллы кремния для процессоров. Медь для изготовления проводов тоже должна быть достаточно чистой: 1 атом примеси на 1 000 атомов меди уже резко увеличивает электрическое сопротивление медной проволоки.
Среди сложных чистых веществ отметим дистиллированную воду Н2О. В природе вода всегда содержит примеси, особенно морская вода, которая содержит до 4% солей, в основном, поваренную соль NaСℓ. Более чистая дождевая вода содержит меньше примесей, но в технике часто нужна ещё более чистая вода, которую получают с помощью перегонки, или дистилляции. Например, в аккумуляторы автомобилей для разбавления серной кислоты H2SO4 можно использовать только дистиллированную воду.
2. Смеси. §23.
Смеси веществ делятся на однородные и неоднородные смеси.
В однородных смесях вещества перемешаны на молекулярном уровне, поэтому в них никогда не происходит самопроизвольного разделения смесей на отдельные вещества. Например, растворим в воде сахар или соль.
Сколько бы ни простоял раствор, в нём не осядут растворённые вещества (сахар или соль). Однородными являются любые смеси газов. Воздух - это смесь газа кислорода О2 (примерно 1/5 часть) и азота N2 (4/5 части), а также немного других газов (аргон, углекислый газ и др.) и водяного пара.
Если два металла в расплавленном состоянии перемешать и остудить, то получится твёрдая смесь - сплав. Например, ещё древние люди умели получать бронзу - сплав меди и олова.
В неоднородных смесях мельчайшие крупинки твёрдых примесей или капельки жидких примесей не перемешаны на молекулярном уровне, поэтому они могут со временем осаждаться или всплывать. Например, если известь Са(ОН)2 смешать с водой, то получится жидкость известковое молоко, которой белят стены. Но со временем крупинки извести осядут на дно, а сверху соберётся прозрачный раствор щелочи - известковая вода. Известковая вода - это пример однородного раствора, а известковое молоко - это пример неоднородной суспензии.
Если растительное масло (или бензин) налить в сосуд с водой и энергично перемешать, то образуется эмульсия из мельчайших капелек масла в воде. Но очень скоро масло всплывёт, и два вещества разделятся.
3. Способы разделения смесей. §25.
1. Неоднородные смеси разделяют а) отстаиванием и б) фильтрованием.
Если плотность частичек вещества больше плотности жидкости, то твёрдые частицы со временем осаждаются на дно. Например, при отстаивании известкового молока частички извести Са(ОН)2 осаждаются. Смесь растительного масла с водой быстро отстаивается, и масло всплывает на поверхность воды, т.к. плотность масла меньше плотности воды.
Чтобы разделить смесь песка с поваренной солью, нужно её растворить в воде. Песок осядет на дно, а раствор соли можно слить и пропустить через фильтр. Ионы соли и молекулы воды легко пройдут сквозь любой фильтр, а нерастворимые частицы примеси останутся на фильтре. Из чистого раствора соли воду можно выпарить на огне, а на дне сосуда останется чистая соль.
Смесь железных опилок с древесными опилками можно разделить, высыпав смесь в воду: железные опилки осядут, древесные - всплывут. Эту же смесь можно разделить с помощью магнита.
Некоторые вещества удаётся очистить с помощью возгонки (сублимации). Так получают чистый йод I2. Кристалл грязного йода нагревают. При этом молекулы йода легко испаряются, а потом осаждаются на холодной поверхности в виде чистого йода. Примеси же не испаряются.
2. Однородные растворы разделяют а) выпариванием, б) дистилляцией.
Растворы солей и щелочей наливают в сосуд и ставят на огонь: вода испаряется, а в сосуде остаётся твёрдая соль или щёлочь. Этот способ разделения веществ смеси называют выпариванием.
Смесь из двух жидкостей, которые растворяются друг в друге, разделяют с помощью дистилляции. Например, смесь спирта с водой нагревают на огне. Спирт испаряется при более низкой температуре, чем вода. Пары спирта над водой удаляют по трубам и охлаждают - получается жидкий спирт. А вода остаётся в сосуде.
Чтобы получить очень чистую воду, её дистиллируют: доводят до кипения, полностью испаряют, а пары воды охлаждают. Примеси остаются на дне сосуда.
Нефть представляет собой смесь нескольких жидкостей, растворённых друг в друге. На нефтеперерабатывающем заводе нефть разделяют на несколько отдельных продуктов - фракций. Сперва нефть нагревают в специальных печах без доступа воздуха свыше 300ºС. Кипящую нефть заливают в ректификационную колонну, состоящую из нескольких тарелок. На каждой тарелке осаждается определённая фракция: бензин, керосин и другие. На дне остаётся густая жидкость мазут.
Задание 1. Выпишите столбиком 1) чистые вещества; 2) однородные смеси; 3) неоднородные смеси. Распределите вещества по этим пунктам:
а) кремний; б) сладкий чай; в) извёстка для побелки; г) смесь кислорода и хлора; д) смесь воды и керосина; е) дистиллированная вода; ж) молоко; з) водка; и) бронза.
Задание 2. Выпишите столбиком способы разделения смесей:
1)отстаивание; 2) фильтрование; 3) выпаривание; 4) дистилляция.
Распределите по этим пунктам разделение следующих смесей:
а) сливки из молока; б) твёрдый гидроксид из раствора щёлочи; в) бензин из нефти; г) раствора соли от твёрдых примесей; д) смесь растительного масла и воды; е) твёрдую соль из водного раствора; ж) уксусную кислоту из уксуса.
§15. Массовая доля и концентрация раствора.
1. Массовая доля растворённого вещества (концентрация). §24.
Опыт. В стакане со 180 г воды растворили 20 г соли. Какую часть от всей массы раствора составляет соль? По-другому: какова концентрация раствора?
Очевидно, что надо найти общую массу раствора m(р-ра) = 180 г + 20 г = 200 г. Теперь составим и решим пропорцию:
всю массу раствора 200 г примем за 100%,
тогда массу соли 20 г примем за х%.
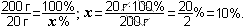
Массовой долей растворённого вещества ω называется отношение массы растворённого вещества m(в-ва) к массе всего раствора m(р-ра).
Предыдущую задачу можно решить без пропорции по формуле:
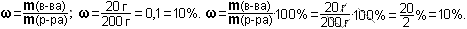
Если массовую долю 0,1 выразить в процентах (перенести запятую на 2 цифры вправо), то 10% называют по-другому концентрацией раствора.
Пример 1. В 1,5 кг раствора содержится 30 г соли. Найти концентрацию раствора (массовую долю растворенной соли).
Дано: m(р-ра) = 1,5 кг = 1 500 г; m(в-ва) = 30 г. Найти: ω.
Решение.
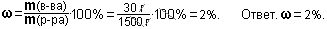
Пример 2. В организме человека примерно 6 кг крови, которая представляет собой 0,9% раствор поваренной соли NaСℓ. Найти массу соли в крови.
Дано: m(р-ра) = 6 кг = 6 000 г; ω = 0,9% = 0,009. Найти: m(в-ва).
Решение.
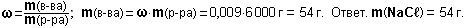
Пример 3. Какой концентрации получится раствор щёлочи, если 50 г едкого натра растворить в 200 мл воды?
Дано: V(Н2О) = 200 мл; m(NaOH) = 50 г. Найти: ω.
Решение.
Т.к. плотность воды ρ = 1 г/мл, то 200 мл воды имеет массу m(Н2О) = 200 г.
Масса всего раствора m(р-ра) = m(Н2О) + m(NaOH) = 200 г + 50 г = 250 г.
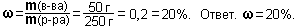
Пример 4. (Лабораторная работа) Надо приготовить 200 г раствора поваренной соли 5%-ой концентрации. Сколько надо взять воды и соли?
Дано: m(р-ра) = 200 г; ω = 5% = 0,05. Найти: m(Н2О); m(NaСℓ).
Решение.
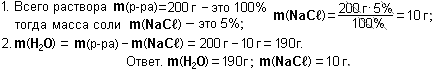
Задание 1. В 200 г раствора при н.у. может максимально содержаться 40 г хлорида калия. Какова концентрация раствора? Какова масса воды в р-ре?
Задание 2. Водка - это 40%-ный раствор этилового спирта в воде. Какова масса спирта в 500 мл водки (0,5 литра). Плотность водки возьмите 1 г/мл.
Задание 3. Какую массу раствора 5%-ой концентрации можно получить из 25 г соли? Какой объём воды для этого потребуется?
Задание 4. Какой концентрации получится раствор, если 60 г твёрдой фосфорной кислоты Н3РО4 полностью растворить в 240 мл воды?
Задание 5. Надо приготовить 500 г раствора сахара 12%-ой концентрации. Какой объём воды и какую массу сахара надо взять?
2. Задачи на смешивание растворов.
Пример 5. К 120 г раствора соли 10%-ой концентрации добавили 80 г воды. Какова будет концентрация нового раствора?
Решение.

Пример 6. К 180 г раствора соли 10%-ой концентрации добавили 20 г соли. Какова будет концентрация нового раствора?
Решение.
1) Масса соли была 0,1∙180 г = 18 г; масса соли стала 18 г + 20 г = 38 г.
2) Масса раствора стала 180 г + 20 г = 200 г.
3) Концентрация раствора стала ω = 38 г : 200 г = 0,19 = 19%.
Пример 7. Слили два раствора поваренной соли: 120 г 10%-го и 380 г 5%-го. Какой стала массовая доля соли в образовавшемся растворе?
Решение.
1) Найдём массы соли в каждом растворе: 0,1∙120 г = 12 г; 0,05∙380 г = 19 г.
2) Общая масса соли 12 г + 19 г = 31 г.
3) Общая масса раствора 120 г + 380 г = 500 г.
4) ω = 31 г : 500 г = 0,062 = 6,2%.
Задание 1. К 80 г раствора соли 10%-ой концентрации добавили 120 г воды. Какова будет концентрация нового раствора?
Задание 2. К 240 г раствора соли 5%-ой концентрации добавили 60 г соли. Какова будет концентрация нового раствора?
Задание 3. Из 200 г 15%-ого раствора хлорида калия выпарили 50 мл воды. Какой стала массовая доля соли в образовавшемся растворе?
Задание 4. Слили два раствора серной кислоты: 320 г 60%-ой и 180 г 10%-ой. Какой стала концентрация раствора? Ответ. 42%.
§16. Химические реакции.
1. Признаки химических реакций. §26.
В §1 пункт 1 говорилось о физических и химических явлениях. Решите снова Задание 4 из этого пункта.
Мы не можем видеть даже в сильный микроскоп, как изменяются молекулы при химических реакциях. Например, если смешать железные опилки Fe с жёлтым порошком серы, то их можно снова разделить (два способа!). Но если эту смесь подогреть, то начнётся бурная реакция: смесь раскалится и образуется серое вещество: Fe + S FeS - сульфид железа, который уже не притягивается магнитом и тонет в воде! По каким же признакам мы узнаём, что произошла химическая реакция? Рассмотрим 6 признаков реакции.
1. Выделение теплоты. При протекании многих реакций выделяется тепло, а иногда и свет. Например, при горении серы S + O2 SO2 + Q выделяется теплота Q и свет.
2. Изменение окраски. Например, индикаторы метилоранж и лакмус в кислоте меняют свой цвет и становятся красными. Индикаторы для того и добавляют в растворы веществ, чтобы увидеть протекание реакции. Ещё пример изменения цвета без индикаторов. Медный купорос CuSO4 содержит в себе воду и имеет поэтому голубой цвет. Но если его сильно нагреть, то вода испаряется, и сульфат меди станет белого цвета.
3. Появление запаха. Если к раствору соли сульфид натрия Na2S прилить соляной кислоты, то будет слышен запах газа сероводорода H2S (тухлых яиц):
Na2S + 2HCℓ 2NaCℓ + H2S. Появление запаха говорит о хим.реакции.
4. Образование осадка. Во многих реакциях в осадок выпадают нерастворимые вещества. Например, если сквозь прозрачную известковую воду Са(ОН)2 пропустить углекислый газ СО2, то раствор мутнеет и выпадает осадок.
5. Выделение пузырьков газа. Если кусочек мела СаСО3 облить соляной кислотой НСℓ, то начнётся бурное выделение пузырьков углекислого газа СО2:
СаСО3 + 2НСℓ СаСℓ2 + Н2О + СО2 + Н2О.
6. Бурная реакция. Если слить растворы щёлочи NaOH и кислоты HCℓ, то произойдёт бурная реакция, похожая на кипение (при этом выделяется тепло):
NaOH + HCℓ NaCℓ + Н2О.
2. Условия возникновения и течения химических реакций. §26.
1. Очевидно, что реакция между двумя и более веществами возможно только при соприкосновении этих веществ. Многие реакции начинаются и протекают сами собой, достаточно только соприкоснуть вещества. Например, если кусочек металлического натрия Na бросить в воду, начнётся бурная реакция: 2Na + 2H2O 2NaOH + H2.
2. Металлический цинк Zn реагирует с водой только при сильном нагревании с раскалённым водяным паром: Zn + 2H2O Zn(OH)2 + H2. Известняк СаСО3 обжигают в печах при высокой температуре, при этом идёт реакция разложения СаСО3 СаО + СО2 - Q и поглощается много теплоты.
3. Чтобы началась реакция горения, необходимо нагреть вещества до температуры воспламенения. Например, спичку надо за счёт трения сперва нагреть до воспламенения, а потом горение идёт за счёт тепла, выделяющегося при горении. Таким же образом горит уголь: С + О2 СО2.
4. Некоторые реакции идут под действием электрического тока. Например, нальём в стакан голубой раствор соли хлорида меди CuCℓ2 и опустим туда два угольных стержня (электрода), подключенных к источнику тока. Через несколько минут на отрицательном стержне осядет красная металлическая медь Сu, а на положительном стержне осядут пузырьки газа хлора Cℓ2. Происходит реакция электролиза: CuCℓ2 Cu + Cℓ2.
5. Все реакции идут много быстрее, если вещества измельчить. Тогда увеличивается площадь поверхности реагирующих веществ.
6. Многие реакции идут лишь в присутствии веществ, которые ускоряют реакции. Такие вещества называют катализаторами.
7. Многие газы реагируют значительно лучше, если в закрытом сосуде увеличить давление газов.
3. Задачи на расчёты по химическим уравнениям. §28.
По химическому уравнению можно рассчитать массу m, объём V и количество неизвестного вещества 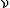 по одному известному данному веществу. Рассмотрим алгоритм решения задач по химическому уравнению.
по одному известному данному веществу. Рассмотрим алгоритм решения задач по химическому уравнению.
Пример 1. Какая масса фосфорной кислоты Н3РО4 потребуется для полного реагирования 1,2 кг кальция?
Решение.
1) Составим ур-ние реакции и уравняем его:3Са + 2H3PO4 → Са3(PO4)2 + 3H2↑
2) Подпишем над Са известную массу 1,2 кг и над H3PO4 неизвестную х:
1,2 кг х кг
3Са + 2H3PO4 → Са3(PO4)2 + 3H2↑
3) Вычислим массу 3 молей кальция: 3М(Са) = 3моль∙40 г/моль = 120 г
и массу 2 молей фосфорной кислоты: 2М(Н3РО4) =
= 2 моль∙(1∙3 + 31 + 16∙4) г/моль = 2(34 + 64) г = 2∙98 г = 196 г.
Подпишем эти массы под уравнением:
1,2 кг х кг
3Са + 2H3PO4 → Са3(PO4)2 + 3H2↑
120 г 196 г
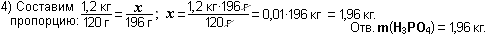
Пример 2. Какой объём водорода при н.у. можно получить при реакции 5,4 кг алюминия с соляной кислотой?
Решение.
Обратим внимание, что в этой задаче массу алюминия нельзя оставлять в килограммах, т.к. в пропорции г и кг не сократятся: 5,4 кг = 5 400 г.
5400 г х л
1) 2Аℓ + 6НСℓ → 2АℓСℓ3 + 3H2↑
2) Масса 2 молей алюминия 2 моль∙27 г/моль = 54 г;
объём 3 молей водорода 3 моль∙22,4 л/моль = 67,2 л.
5400 г х л
2Аℓ + 6НСℓ → 2АℓСℓ3 + 3H2↑
5 4 г 67,2 л
4 г 67,2 л
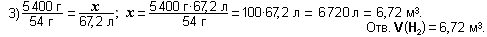
Пример 3. Какой объём кислорода при н.у. потребуется для полного сгорания 4,48 м3 бутана С4Н10?
Решение.
Когда известен объём одного газа и для другого газа нужно тоже найти объём, то достаточно снизу подписать только количества вещества в молях!
4,48 м3 х м3
2С4Н10 + 13О2 → 8СО2 + 10Н2О
2 моль 13 моль
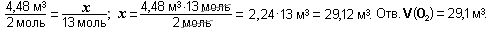
Пример 4. По уравнению 3Са(ОН)2 + 2Н3РО4 → Са3(РО4)2 + 6Н2О рассчитайте, сколько граммов Са(ОН)2 нужно для получения 62 г фосфата кальция.
Решение.
Масса 3 молей гидроксида: 3 моль∙(40 + (16 + 1)∙2) г/моль = 3(40 + 34) г = 222 г;
масса 1 моля Са3(РО4)2: 1 моль∙(40∙3 + (31 + 16∙4)∙2) г/моль = 120 + 95∙2 г =
= 120 + 190 г = 310 г.
х г 62 г
3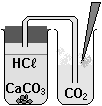 Са(ОН)2 + 2Н3РО4 → Са3(РО4)2 + 6Н2О
Са(ОН)2 + 2Н3РО4 → Са3(РО4)2 + 6Н2О
222 г 310 г
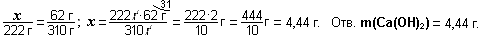
Задание 1. Какая масса карбоната калия получится при растворении 39 г калия в угольной кислоте? Ответ. 69 г.
Задание 2. Кальций растворяют в соляной кислоте. Какая масса кислоты потребуется для получения 4,44 кг хлорида кальция? Ответ. 730 г.
Задание 3. Какой объём водорода выделится при реакции натрия с 1,96 кг фосфорной кислоты? Ответ. 672 л.
Задание 4. На сгорание алюминия потратилось 22,4 л кислорода. Какая масса оксида алюминия получилась? Ответ. 66 г.
Задание 5. Сколько гашёной извести Са(ОН)2 получится при гашении 5,6 кг негашёной извести СаО водой? Ответ. 7,4 кг.
Задание 6. Какой объём кислорода нужен для сгорания 8,5 л метана СН4?
Задание 7. По уравнению реакции получения аммиака 3H2 + N2 → 2NH3 вычислите, какой объём аммиака получится из 12 м3 азота.
Задание 8. По уравнению реакции сгорания газа пропана С3Н8 вычислите, какой объём углекислого газа получится, если расходуется 150 л кислорода.
Задание 9. По уравнению 3Mg(ОН)2 + 2Н3РО4 → Mg3(РО4)2 + 6Н2О рассчитайте, какая масса фосфата магния получится из 174 г гидроксида магния.
Задание 10. Какой объём кислорода потребуется для сжигания 8 моль фосфора Р? Какая масса оксида фосфора при этом получится? 224 л; 284 г.
§17. Получение газов.
1. Опыты по получению водорода, кислорода и углекислого газа.
1. Получение водорода Н2. В пробирку с соляной кислотой НСℓ опустим несколько гранул цинка Zn и закроем пробкой с газоотводной трубкой. Начинается бурная реакция Zn + 2НСℓ → ZnСℓ2 + H2↑ выделения водорода. Зажжённую спичку поднесём к газоотводной трубке - слышен хлопок "пах!" - это взрывается смесь водорода Н2 с воздухом: 2Н2 + О2 → 2Н2О.
Опыт взаимодействия водорода с оксидом меди CuO проделайте, как описано в учебнике Опыт 3 на стр.114, рис.36. Чёрный порошок оксида меди восстанавливается водородом до чистой красной меди при нагревании: CuO + Н2 → Cu + Н2О.
2. Получение кислорода О2. Для этого соберите установку по рис.37 или 38 на стр.115-116 учебника. Проверить кислород можно тлеющей лучинкой: лучинка ярко вспыхивает! KMnO4 → KMnO2 + O2↑.
Для второго опыта кислород надо собрать под водой. На кончик нетолстой железной проволоки наденьте маленький кусочек угля или кусочек спички и внесите в пламя спиртовки. Быстро, чтобы уголёк или спичка не сгорели, внесите проволочку в колбу с собранным кислородом. От уголька загорится железная проволока 3Fe + 2O2 → Fe3O4, разбрызгивая искры железной окалины - это смесь оксидов железа FeO и Fe2O3.
3. Получение углекислого газа СО2. В пробирку опустим кусочки мела (лучше мрамора) СаСО3 и зальём соляной кислотой НСℓ начнётся бурное выделение углекислого газа СО2↑. Закроем пробирку пробкой с газоотводной трубкой и соберём углекислый газ прямо в открытой пробирке. Т.к. плотность СО2 почти в 1,5 раза больше плотности воздуха, то углекислый газ не сразу "выльется" из пробирки. Внесём в пробирку горящую лучинку - личинка быстро погаснет, т.к. СО2 не поддерживает горение. СаСО3 + 2НСℓ → СаСℓ2 + Н2О + СО2↑.
2. Задачи на объёмную долю газов. §24 (3 и 4).
Пример 1. Воздух содержит 21% кислорода О2. Какой объём кислорода можно получить из 800 м3 воздуха?
Дано: V(возд.) = 800 м3; ω(О2) = 21% = 0,21. Найти: V(О2).
Решение.
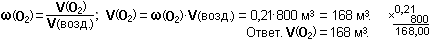
Пример 2. Сколько воздуха надо взять, чтобы получить 39 л азота, если объёмная доля азота в воздухе 78%.?
Решение.
В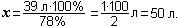 оздуха 100% - это х л,
оздуха 100% - это х л,
азота N2 78% - это 39 л; Ответ. V(возд.) = 50 л.
Пример 3. Какой объём воздуха нужен для сгорания 42 л метана СН4, если объёмная доля кислорода в воздухе 21%.?
Дано: V(СН4) = 42 л; ω(О2) = 21% = 0,21. Найти: V(возд.).
Решение.
1) Найдём объём кислорода V(О2) по уравнению:
42 л х л
СН4 + 2О2 → СО2 + 2Н2О, отсюда устно видно, V(О2) = 84 л.
1 моль 2 моль
2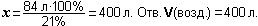 ) Кислород 84 л - это 21%,
) Кислород 84 л - это 21%,
воздух х л - это 100%;
Задание 1. В воздухе содержится 1% инертного газа аргона. Какой объём аргона Ar можно получить максимально из 250 м3 воздуха?
Задание 2. Сколько воздуха надо взять, чтобы получить 6,3 л кислорода, если объёмная доля кислорода в воздухе 21%?
Задание 3. По уравнению реакции получения аммиака 3H2 + N2 → 2NH3 вычислите, какой объём воздуха необходим, чтобы получить 520 м3 аммиака. Объёмная доля азота в воздухе 78%. Ответ. V(возд.) = 1 000 л.
Задание 4. Какой объём воздуха нужен для сгорания 12,6 л пропана С3Н8, если объёмная доля кислорода в воздухе 21%.? Ответ. V(возд.) = 300 л.
§18. Растворимость веществ в воде.
1. Растворимость веществ. Насыщенность растворов. §34.
Опыт. Нальём в стакан 100 г воды при комнатной температуре 20ºС и начнём понемногу насыпать поваренную соль NaСℓ, тщательно перемешивая. Соли сможет раствориться примерно 36 г. Если насыпать больше, соль останется на дне нерастворённой. Говорят, что у поваренной соли при 20ºС растворимость равна 36 г на 100 г растворителя (воды). Если такой же опыт провести, например, с хлоридом бария ВаСℓ2, то его растворимость будет немного больше: 42 г на 100 г воды. Значит, у разных веществ растворимости будут различными. В обоих случаях получаются насыщенные растворы.
Растворимость вещества показывает, сколько граммов вещества максимально может раствориться в 100 г растворителя при данной температуре.
Насыщенным называется раствор, в котором при данной температуре данное вещество больше не растворяется.
Если в предыдущем опыте поваренной соли NaСℓ насыпать меньше 36 г, то раствор будет ненасыщенным. Если насыщенный раствор осторожно, не встряхивая, охладить, то можно получить пересыщенный раствор, но он очень неустойчивый и легко переходит в насыщенный раствор. При этом "лишняя" соль осаждается, например, на нитке, опущенной в раствор, вырастут кристаллы соли.
Ненасыщенным называется раствор, в котором при данной температуре данное вещество ещё может растворяться.
2. График зависимости растворимости вещества от температуры.
Р астворимость поваренной соли мало зависит от температуры. Поэтому рассмотрим, как зависит растворимость хлорида калия КСℓ от температуры. В 100 г воды при 0ºС растворится 20 г, при 30ºС - 40 г, при 60ºС - 50 г, при 100ºС - 55 г. Видим, что график растворимости КСℓ - это некоторая возрастающая кривая. Такие графики у большинства солей: у некоторых солей графики идут полого, как у NaСℓ, у некоторых солей очень круто, как у KNO3.
астворимость поваренной соли мало зависит от температуры. Поэтому рассмотрим, как зависит растворимость хлорида калия КСℓ от температуры. В 100 г воды при 0ºС растворится 20 г, при 30ºС - 40 г, при 60ºС - 50 г, при 100ºС - 55 г. Видим, что график растворимости КСℓ - это некоторая возрастающая кривая. Такие графики у большинства солей: у некоторых солей графики идут полого, как у NaСℓ, у некоторых солей очень круто, как у KNO3.
Не путайте растворимость вещества и концентрацию раствора. Рассмотрим пример вычисления концентрации насыщенного раствора.
Пример 1. Вычислите с помощью графика растворимости концентрацию насыщенного раствора хлорида калия КСℓ при 60ºС.
Решение.
По графику видим, что при 60ºС в 100 г воды растворяется 50 г соли КСℓ. Тогда масса раствора m(р-ра) = 100 г + 50 г = 150 г, а масса растворённого вещества m(в-ва) = 50 г. Отсюда концентрация ω = 50 г : 150 г = 0,33 = 33%.
Задание 1. Вычислите концентрацию насыщенного раствора хлорида бария ВаСℓ2 при температуре 90ºС.
Задание 2. Вычислите концентрацию насыщенного раствора нитрата бария Ba(NO3)2 при температуре 50ºС.
Задание 3. Сравните концентрации насыщенных растворов KNO3 и КСℓ при а) 0ºС; б) 30ºС в) 100ºС.
Задание 4. В 100 г воды приготовили насыщенный раствор ВаСℓ2 при 0ºС. Какую массу соли надо добавить, чтобы раствор стал насыщенным при 40ºС?
3. Таблица растворимости солей, оснований и кислот.
Соли, основания и кислоты по их растворимости делятся на три группы:
(Р) хорошо растворимые - в 100 г воды растворяется более 1 г вещества;
(М) малорастворимые - в 100 г воды растворяется от 0,01 г до 1 г вещ-ва;
(Н) нерастворимы - в 100 г воды растворяется менее 0,01 г вещества.
Совершенно нерастворимых веществ не бывает. Например, металлическое серебро Ag растворяется в воде, и атомы серебра убивают микробов, поэтому вода в серебряном сосуде долго не портится.
Растворимость солей можно определить приблизительно по буквам Р, М и Н в таблице растворимости. Но следует помнить наизусть следующие растворимые вещества:
1) Все кислоты растворимы, кроме кремниевой кислоты H2SiO3.
2) Гидроксиды растворимы для щелочных металлов Li, Na, K, Cs, Rb (для щелочноземельных металлов считайте растворимыми Ва(ОН)2 и Са(ОН)2.
3) Растворимы соли сильных кислот НNO3, HCℓ, HBr (кроме AgCℓ и AgBr) и соли серной кислоты H2SO4 (кроме ВаSО4 и PbSO4).
Задание 5. Не пользуясь таблицей растворимости, выпишите из списка все растворимые вещества: KNO3, K2S, ZnCO3, ZnSO4, BaSO4, BaCℓ2, Cu(NO3)3,
AℓPO4, Na3PO4, FeSiO3, HF, LiOH, Ba(OH)2, Cu(OH)2, AgCℓ, H2SiO3, H2CO3.
§19. Электролитическая диссоциация.
1. Диссоциация электролитов. §35.
Электролитами называют растворы (или расплавы) веществ, которые проводят электрический ток.
Э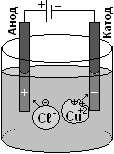 лектролитами являются, например, растворы щелочей, кислот и солей. Рассмотрим опыт с электролитом. В стакан с раствором соли (например, CuCℓ2) опустим два угольных стержня-электрода: один присоединим к -полюсу источника (анод), другой к Ө-полюсу источника (катод).
лектролитами являются, например, растворы щелочей, кислот и солей. Рассмотрим опыт с электролитом. В стакан с раствором соли (например, CuCℓ2) опустим два угольных стержня-электрода: один присоединим к -полюсу источника (анод), другой к Ө-полюсу источника (катод).
Соль растворится и диссоциирует на ионы Cu2+ и 2Cℓ-. Положительные ионы меди Cu2+ будут притягиваться к Ө-катоду, а отрицательные ионы хлора Cℓ- к -аноду. По цепи потечёт электрический ток.
Диссоциацией электролитов называется расщепление вещества на ионы под действием растворителя (воды и др.) или при сильном нагревании.
Рассмотрим подробно, как происходит процесс диссоциации.
1. Механизм диссоциации ионных соединений - солей и щелочей.
П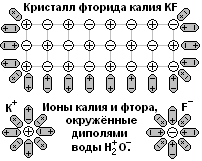 оместим в воду кристалл растворимого ионного соединения, например, фторида калия K+F-. Молекулы воды имеют два полюса, т.е. являются диполями. Диполи воды Н2О окружают ионы калия К+ отрицательными полюсами, а Ө ионы фтора F- положительными полюсами и вырывают их из кристаллической решётки. Окружённые диполями воды ионы К+ и F- свободно плавают в воде:
оместим в воду кристалл растворимого ионного соединения, например, фторида калия K+F-. Молекулы воды имеют два полюса, т.е. являются диполями. Диполи воды Н2О окружают ионы калия К+ отрицательными полюсами, а Ө ионы фтора F- положительными полюсами и вырывают их из кристаллической решётки. Окружённые диполями воды ионы К+ и F- свободно плавают в воде:
KF К+ + F-
Так происходит диссоциация соли KF на свободные ионы в воде, при этом получается раствор электролита. Аналогично диссоциируют все твёрдые растворимые соли и щёлочи, например, щелочь NaOH - на ионы натрия Na+ и гидроксид ионы ОН-. Ионы образуются также при сильном нагревании. Но многие основания и соли не выдерживают нагревания и разлагаются, например, 2Fe(OH)3 → Fe2O3 + 3H2O; СаСО3СаО + СО2.
2. Механизм диссоциации кислот, имеющих молекулярное строение.
Е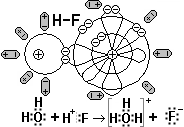 сли газ фтороводород растворить в воде, то диполи воды разорвут молекулы НF на ионы Н+ и F-. Ион Н+ присоединится к молекуле воды, образуя ион гидроксония Н3О+:
сли газ фтороводород растворить в воде, то диполи воды разорвут молекулы НF на ионы Н+ и F-. Ион Н+ присоединится к молекуле воды, образуя ион гидроксония Н3О+:
Н+ + Н2О Н3О+.
Фторид-ион F- со всех сторон будет окружён диполями воды. Уравнение диссоциации фтороводорода: НF + Н2О Н3О+ + F- или сокращённо НF Н+ + F-.
Из газа фтороводорода получился раствор плавиковой кислоты, состоящий из ионов гидроксония Н3О+ и фторид-ионов F-.
Многосоставные кислоты диссоциируют по ступеням.
Н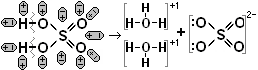 альём в пробирку с водой немного концентрированной серной кислоты H2SO4. (Наливать кислоту в воду, а не наоборот!) Диполи воды со всех сторон окружают молекулу кислоты и отрывают от неё сперва один ион Н+, который образует ион гидроксония: Н+ + Н2О Н3О+, потом и второй ион Н+ образует гидроксоний.
альём в пробирку с водой немного концентрированной серной кислоты H2SO4. (Наливать кислоту в воду, а не наоборот!) Диполи воды со всех сторон окружают молекулу кислоты и отрывают от неё сперва один ион Н+, который образует ион гидроксония: Н+ + Н2О Н3О+, потом и второй ион Н+ образует гидроксоний.
В растворе получились сульфат-ионы SO42- и ионы гидроксония Н3О+, окружённые диполями воды, которые свободно перемещаются по раствору - получился электролит. Процесс диссоциации серной кислоты по ступеням 1) и 2):
1) H2SO4 + Н2О Н3О+ + HSO4-; 2) HSO4- + Н2О Н3О+ + SO42-;
Общее уравнение: H2SO4 + 2Н2О 2Н3О+ + SO42-.
Упрощёно можно писать так: H2SO4 2Н+ + SO42-.
2. Уравнения диссоциаций кислот, щелочей и солей. §36.
Пример 1. Напишите структурную формулу ортофосфорной кислоты и напишите уравнения диссоциации в три ступени и общее упрощенное уравнение.
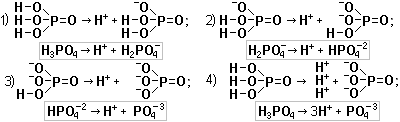
Пример 2. Напишите структурную формулу гидроксида кальция и уравнения диссоциации (щёлочи и соли не диссоциируют по ступеням!).
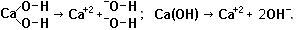
Кислоты диссоциируют на ионы водорода Н+ (точнее ионы гидроксония Н3О+) и ионы кислотного остатка. Ионы гидроксония обладают кислотными свойствами: кислые на вкус, окрашивают индикаторы.
Щёлочи диссоциируют на ионы металла и гидроксид-ионы ОН-. Гидроксид-ионы обладают щелочными свойствами: мылкие на ощупь, окрашивают индикаторы.
Пример 3. Напишите уравнения диссоциации Li2SO3 и Mg(NO3)2 и дайте названия ионам.
Обе соли растворимы, т.к. Li - щелочной металл, а HNO3 - сильная кислота.
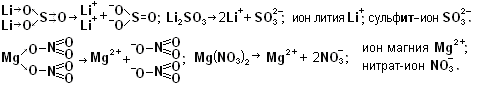
Задание 1. Запишите структурные формулы всех оснований, потом уравнение диссоциации только для растворимых и малорастворимых оснований.
а) NaOH; б) Mg(OH)2; в) Ва(ОН)2; г) Са(ОН)2; д) AgOH; е) Аℓ(ОН)3; ж) КОН.
Задание 2. Запишите структурные формулы всех кислот, потом уравнения полной диссоциации (кроме нерастворимой кислоты).
а) НСℓ; б) HNO2; в) H2S; г) Н3РО4; д) НРО3; е) H2SO3; ж) H2SO4; з) HBr;
и) H2CO3; к) H2SiO3.
Задание 3. Запишите уравнения диссоциации солей и дайте названия ионам.
а) NaСℓ; б) MgBr2; в) КNO3; г) Ва(NO3)2; д) Li2SO4; е) ZnSO4; ж) Na3PO4;
з) Аℓ(NO3)3; и) Аℓ2(SO4)3; к) AgNO3; л) FeCℓ3; м) FeSO4; н) K2S; о) MgSO3.
§20. Реакция нейтрализации.
1. Реакция нейтрализации между кислотой и щёлочью.
Опыт. Нальём треть пробирки гидроксида натрия NaOH и несколько капель фенолфталеина - раствор окрасится в малиновый цвет, т.к. среда щелочная. Будем тонкой струйкой приливать соляную кислоту НСℓ и перемешивать: в какое-то мгновение раствор обесцветится. Кислота нейтрализовала щелочь, и среда стала нейтральная, а фенолфталеин - бесцветный.
Уравнение реакции нейтрализации: основание + кислота → соль + Н2О.
NaOH + НСℓ → NaСℓ + Н2О.
Реакцией нейтрализации называется реакция между основанием и кислотой, при которой получается соль и вода.
Пример 1. В пробирке налито немного фосфорной кислоты Н3РО4 и несколько капель метилоранжа. Какой будет цвет раствора? По капельке добавляют раствор щёлочи КОН. Как изменится цвет раствора, когда щёлочь нейтрализует кислоту? Как изменится цвет, если продолжать капать щёлочь?
Решение.
1) В кислой среде метилоранж был розовый. Произошла реакция нейтрализации: 3КОН + Н3РО4→ К3РО4 + 3Н2О. В нейтральной среде метилоранж стал оранжевый. В избытке щёлочи метилоранж станет жёлтым.
Задание 1. В пробирке налито немного азотной кислоты HNO3, несколько капель лакмуса. По каплям приливают известковую воду Са(ОН)2. Каким был и как дважды менялся цвет индикатора? Напишите уравнение реакции.
Задание 2. В пробирку налили немного разбавленной серной кислоты и добавили пару капель фенолфталеина. Затем начинают по каплям добавлять гидроксид натрия. Опишите изменения цвета и напишите уравнение реакции.
2. Алгоритм составления реакции нейтрализации.
Прежде всего надо знать, что реакция нейтрализации идёт достаточно быстро, если хотя бы одно вещество активное (либо основание, либо кислота, либо оба вещества). Если основание нерастворимое (не щёлочь) и кислота слабая (Н2S; H2CO3; H2SiO3), то реакция практически не идёт. Например, реакция Zn(OH)2 + H2CO3 → не идёт!
Пример 2. Рассмотрим реакцию Аℓ(ОН)3 + Н2SО4. Т.к хотя бы серная кислота сильная, то реакция идёт по схеме: Аℓ(ОН)3 + Н2SО4 → Аℓ+3SO4-2 + H2O.
Наименьшее число, которое делится на 3 и 2 - это 6: отсюда найдём индексы в формуле соли: Аℓ(ОН)3 + Н2SО4 → Аℓ2+3(SO4-2)3 + H2O. Уравняем Аℓ (поставим слева коэффициент 2) и уравняем SO4 (поставим коэффициент 3).
Получим пока уравнение: 2Аℓ(ОН)3 + 3Н2SО4 → Аℓ2(SO4)3 + H2O.
Теперь сосчитаем слева атомы Н: их будет 2∙3 + 3∙2 = 6 + 6 = 12, значит справа перед Н2О поставим коэф. 6: 2Аℓ(ОН)3 + 3Н2SО4 → Аℓ2(SO4)3 + 6H2O.
Осталось проверить кислород: слева атомов О: 2∙3 + 3∙4 = 6 + 12 = 18; справа атомов О: 3∙4 + 6∙1 = 12 + 6 = 18. Сошлось: 18 = 18, уравнение верно!
Запомни алгоритм составления уравнения!
1) Напиши левую часть Аℓ(ОН)3 + Н2SО4 и проверь: пойдёт ли реакция!
2) Если реакция идёт, то составь схему: Аℓ(ОН)3 + Н2SО4 → Аℓ+3SO4-2 + H2O (очень просто: т.к. групп ОН было 3, то Аℓ+3; т.к. у кислоты было Н2, то SO4-2).
3) Уравняй слева металл Аℓ и кислотный остаток SО4.
4) Сосчитай слева Н и уравняй справа воду H2O.
5) Обязательно проверь кислород О: слева и справа одинаково!
6) Подпиши название получившейся соли!
Уравнение должно выглядеть так:
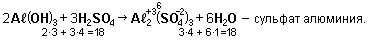
Это самое главное уравнение в курсе химии 8 класса!!! Все учащиеся должны обязательно уметь составлять подобные уравнения.
Задание 3. Допишите уравнения, уравняйте и напишите название соли на "3".
1) NaOH + HNO3 → 2) KOH + H2SO4 → 3) Ca(OH)2 + HNO3 →
4) Ba(OH)2 + HCℓ → 5) NaOH + H2S → 6) Mg(OH)2 + H2SO3 →
Задание 4. Допишите уравнения, уравняйте и напишите название соли на "4".
1) NaOH + Н3РО4 → 2) Аℓ(ОН)3 + HBr → 3) Fe(OH)3 + H2SO4 →
4) Fe(OH)3 + HNO3 → 5) Ca(OH)2 + Н3РО4 → 6) Аℓ(ОН)3 + Н3РО4 →
Задание 5. Спишите все уравнения. Допишите те уравнения, реакции которых идут. Почему реакция идёт (подчеркните активное вещество)? (на "5")
1) Zn(OH)2 + HCℓ → 2) Cu(OH)2+ H2S → 3) Fe(OH)3 + HBr →
4) NaOH + H2SiO3 → 5) HgOH + H2SiO3 → 6) Hg(OH)2 + HCℓ →
7) Ca(OH)2 + НРО3 → 8) Ba(OH)2 + HNO3 → 7) Cu(OH)2+ Н2СО3 →
Задание 6. С какими кислотами не реагирует основание Fe(OH)2?
а) H2SO4; б) H2SO3; в) H2S; г) HNO3; д) HNO2; е) НРО3; ж) Н3РО4; з) HBr.
Задание 7. С какими основаниями не будет реагировать кислота Н2СО3?
а) LiOH; б) Fe(OH)3; в) Mn(OH)2; г) CsOH; д) Ва(ОН)2; е) Ве(ОН)2; ж) AgOH.
Задание 8. Напишите все возможные реакции м/у:NaOH; Cu(OH)2; H2S; HNO3.
§21. Свойства основных и кислотных оксидов.
1. Классификация оксидов (повторение).
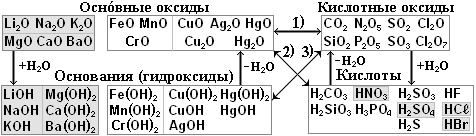
По схеме видно, что каждому основному оксиду соответствует основание:
Na2O NaOH; СаО Са(ОН)2; Ag2O AgOH; Cu2O СuОН (I);
CuO Сu(ОН)2(II); CrO Cr(OН)2(II); FeO Fe(ОН)2(II); MnO Mn(OH)2 (II).
В §10, пункт 1, было рассмотрено взаимодействие щелочных основных оксидов с водой Н2О: К2О + Н2О 2КОН; СаО + Н2О Са(ОН)2.
В §11, пункт 2, было рассмотрено взаимодействие кислотных оксидов с Н2О:
SO2 + H2O H2SO3 - сернистая к-та; SO3 + H2O H2SO4 - серная к-та;
Р2О5 + 3Н2О 2Н3РО4 - ортофосфорная кислота. SiO2 + H2O - не идёт!
2. Основные и кислотные свойства оксидов.
Рассмотрим по схеме уравнения реакций 1), 2) и 3) между классами веществ. Эти реакции идут в основном в тех случаях, когда хотя бы одно из реагирующих веществ активное (активные вещества выделены на схеме тенью).
1) Основный оксид + кислотный оксид = соль. Чтобы понять, какая соль получится, надо под кислотным оксидом подписать соответствующую ему кислоту! Рассмотрим несколько примеров.
Li2O + SO2 → Li2SO3 - сульфит лития; Na2O + N2O5 → 2NaNO3 - нитрат натрия;
H2SO3 HNO3
ВаО + Р2О5 → Ва3(РО4)2 - фосфат бария; СаО + SO3 → CaSO4 сульфат кальция.
Н3РО4 Н2SO4
Реакции типа FeO + СО2 → или Ag2O + P2O5 → не идут, т.к. оба вещества пассивные!
2) Основной оксид + кислота = соль + Н2О.
3Na2O + 2H3PO4→ 2Na3PO4 + 3H2O - фосфат натрия;
Cu2O + H2SO4 → Cu2SO4 + H2O - сульфат меди (I).
MnO + 2HNO3 → Mn(NO3)2 + H2O - нитрат марганца (II).
Реакции типа FeO + H2 СО2 → или Ag2O + Н3РО4 → не идут!
3) Щёлочь + кислотный оксид = соль + Н2О (под оксидом подписать к-ту!).
2NaOH + N2O5 → 2NaNO3 + H2O; Ca(OH)2 + SiO2 → CaSiO3 + H2O - силикат Са.
HNO3 H2SiO3
Реакции типа Fe(OН)2 + СО2 → или AgOH + P2O5 → не идут.
3*. Разложение некоторых солей при нагревании.
Соли, образованные активными металлами и сильными кислотами при очень сильном нагревании диссоциируют на ионы, подобно тому, как они диссоциировали бы в водных растворах: NaCℓ → Na+ + Cℓ-.
Соли многих слабых кислородсодержащих кислот при сильном нагревании распадаются обратно на составляющие их оксиды:
СаСО3 → СаО + СО2; Fe2(SO3)3 → Fe2O3 + 3SO2.
Задание 1. Допишите уравнения реакций, дайте названия веществам (на "3").
а) К2О + H2O → ; б) SO2 + H2O → ; в) ВаО + H2O → ; г) SO3 + H2O → ;
д) Na2O + СО2 → ; е) К2О + SO2 → ; ж) СаО + SiO2 → ; з) ВаО + SO3 → .
Задание 2. Допишите уравнения, уравняйте и дайте названия веществам.
а) N2O5 + H2O → ; б) Р2О5 + H2O → ; в) СаО + H2O → ; г) Li2O + N2O5 → ;
д) СаО + Р2О5 → ; е) К2О + Р2О5→ ; ж) ВаО + N2O5 →; з) Аℓ2О3 + SO3 → .
Задание 3. Допишите уравнения, уравняйте и дайте названия веществам.
а) Na2O + Н2SiO3 → ; б) К2О + H2S → ; в) CuO + HNO3 → ; г) ВаО + НСℓ → ;
д) Li2O + HF → ; е) СаО + H2SO3 → ; ж) Fe2O3 + HBr → ; з) MgO + H3PO4.
Задание 4. Допишите уравнения, уравняйте и дайте названия веществам.
а) NaOH + SiO2 →; б) КОН + SO2 →; в) Са(ОН)2 + СО2 →; г) Ва(ОН)2 + SO3 →;
д) LiOH + N2O5 →; е) Са(ОН)2 + Р2О5 →; ж) КОН + Р2О5 →; з) Ва(ОН)2 + N2O5 →.
Задание 5. С какими оксидами не будет реагировать угольная кислота:
а) К2О; б) Ag2O; в) P2O5; г) ВаО; д) CuO; е) SiO2; ж) Na2O; з) SO3.
Задание 6. С какими оксидами не будет реагировать гидроксид натрия:
а) СО2; б) FeO; в) N2O5; г) SO3; д) ВаО; е) SiO2; ж) Сℓ2О7; з) Hg2O.
Задание 7. Напишите уравнения реакций разложения веществ при нагревании: а) Fe(OH)2; б) Fe(OH)3; в) H2SiO3; г) H2SO3; д) ZnCO3; е) CaCO3.
§22. Ионные уравнения.
1. Ионные уравнения реакции нейтрализации.
Повторите §18 и выполните снова Задания 1, 2 и 3 на уравнения диссоциации.
Запомните! Диссоциируют только растворимые вещества (Р). Малорастворимые вещества (М) до реакции тоже можно диссоциировать, но после реакции их не надо расписывать на ионы: они выпадают в осадок↓.
Пример 1. Напишите ионное уравнение реакции нейтрализации между щёлочью NaOH и кислотой Н3РО4.
1) Сперва пишем молекулярное уравнение реакции:
NaOH + Н3РО4 → Na3+ PO4-3 + Н2О, уравняем 3NaOH + Н3РО4 → Na3PO4 + 3Н2О.
Щёлочь NaOH, кислота Н3РО4 и соль Na3PO4 - все растворимы, поэтому они диссоциируют на ионы. Запомни! У свободных ионов, окружённых молекулами воды, знак заряда иона пишут после цифры: например, РО43- (а не РО4-3). А вода очень мало диссоциирует (всего одна молекула из 10 000 000 молекул), поэтому 3Н2O оставляем в молекулярном виде. Получим ионное уравнение:
3Na+ + 3ОН- + 3Н+ + РО43- → 3Na+ + РО43- + 3Н2О - это полное уравнение.
Ионы натрия 3Na+ и фосфат-ионы РО43- как были свободно плавающими в растворе, так и остались, т.е. в реакции не участвовали. Поэтому эти ионы вычёркиваем из реакции - остаётся краткое ионное уравнение:
3ОН- + 3Н+ → 3Н2О, обе части которого можно поделить на 3 (сократить):
ОН- + Н+ → Н2О. Реакция нейтрализации сводится к соединению ионов водорода Н+ (кислота) с гидроксид-ионами ОН- (щёлочь) и образованию нейтральной воды Н2О.
Пример 2. Рассмотрим нейтрализацию нерастворимого основания Аℓ(ОН)3 сильной кислотой H2SO4. Запишем и уравняем молекулярное уравнение:
2Аℓ(ОН)3 + 3Н2SО4 → Аℓ2(SO4)3 + 6H2O. Т.к. Аℓ(ОН)3 не диссоциирует - оставляем в молекулярной форме, а соль Аℓ2(SO4)3 растворима - расписываем на ионы: 2Аℓ(ОН)3 + 6Н+ + 3SО42- → 2Аℓ3+ + 3SO42- + 6H2O. В полном ионном уравнении можно зачеркнуть ионы 3SО42-, которые не участвовали в реакции. Остаётся краткое ионное уравнение: 2Аℓ(ОН)3 + 6Н+ → 2Аℓ3+ + 6H2O.
Пример 3. Рассмотрим случай, когда после реакции соль выпадет в осадок.
Ва(ОН)2 + Н2SО4 → ВаSО4↓ + 2H2O. Сульфат бария ВаSО4 нерастворимая соль, выпадает в осадок, поэтому не диссоциирует на ионы:
Ва+2 + 2ОН- + 2Н+ + SО42- → ВаSО4↓ + 2H2O. Никакие ионы не вычёркиваются, поэтому краткого ионного уравнения нет.
Задание 1. Напишите молекулярное, полное и краткое ионные уравнения:
а) КОН + H2S → ; б) Са(ОН)2 + H2SiO3 → ; в) Aℓ(ОН)3 + НСℓ → .
Задание 2. Напишите ионные уравнения для случаев выпадения осадков.
а) AgOH + HCℓ → ; б) Са(ОН)2 + H2S → ; в) Pb(OH)2 + H2SO4 →
г) Са(ОН)2 + Н3РО4 → ; д) LiOH + Н3РО4 → ; е) Ва(ОН)2 + H2SiO3 → .
Задание 3. Спишите все уравнения. Если реакция не идёт, напишите не идёт. Допишите те уравнения, реакции которых идут (почему реакция идёт - подчеркните активное вещество). Составьте ионные уравнения (на "5").
1) Zn(OH)2 + HCℓ → 2) Cu(OH)2+ H2S → 3) Fe(OH)3 + HBr →
4) NaOH + H2SiO3 → 5) HgOH + H2SiO3 → 6) Hg(OH)2 + HCℓ →
7) Ca(OH)2 + НРО3 → 8) Ba(OH)2 + HNO3 → 7) Cu(OH)2+ Н2СО3 →
2. Уравнения реакций солей со щелочами, солями и кислотами.
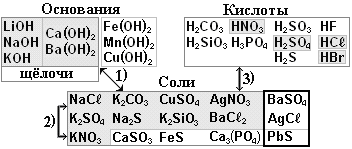
1. Соль + щёлочь = новая соль + основание.
Реакции солей с основаниями не идут, если хотя бы одно вещество нерастворимо. По-другому: щёлочи реагируют только с растворимыми солями, при этом хотя бы одно вещество после реакции должно выпасть в осадок.
Пример 4. Рассмотрим случай, когда щёлочь реагирует с растворимой солью и в осадок выпадает основание:
2КОН + Cа(NO3)2 → 2KNO3 + Cа(OH)2↓;
2K+ + 2OH- + Cа2+ + 2NO3- → 2K+ + 2NO3- + Cа(OH)2↓; сократим 2K+ и 2NO3-
2OH- + Cа2+ → Cа(OH)2↓ - краткое ионное уравнение.
Внимание! Так как Cа(OH)2 мало растворимое основание, то осадок будет выпадать или хотя бы произойдёт помутнение раствора, т.е. реакция идёт!
Пример 5. Рассмотрим случай, когда щёлочь реагирует с растворимой солью и в осадок выпадает соль:
Ba(OH)2 + Na2SO4 → BaSO4↓ + 2NaOH;
Ba2+ + 2OH- + 2Na+ + SO42- → BaSO4↓ + 2Na+ + 2OH-; сократим 2OH- и 2Na+.
Ba2+ + SO42- → BaSO4↓.
Пример 6. Рассмотрим случай, когда щёлочь реагирует с растворимой солью и в осадок выпадают и соль, и основание:
Ba(OH)2 + CuSO4 → BaSO4↓ + Cu(OH)2↓.
Ba2+ + 2OH- + Cu2+ + SO42- → BaSO4↓ + Cu(OH)2↓ - ничего не сокращается!
Пример 7. Если после реакции ничего в осадок не выпадает, то реакция не идёт: образуется просто смесь ионов четырёх типов. Возьмём прозрачную известковую воду Cа(OH)2 и прозрачный раствор поваренной соли NaCℓ. По пытаемся написать уравнение реакции: Cа(OH)2 + 2NaCℓ → CаCℓ2 + 2NaOH.
Cа2+ + 2OH- + 2Na+ + 2Сℓ- → Cа2+ + 2Сℓ- + 2Na+ + 2OH-. Все ионы можно вычеркнуть - реакция не идёт.
2. Соль + соль = новая соль + новая соль.
Соль с солью реагирует по тому же правилу, что и щелочь с солью.
До реакции обе соли должны быть растворимы, после реакции одна соль должна выпасть в осадок. В таблице растворимые соли затенённые!
Пример 8. Рассмотрим пример, когда соль после реакции выпадает в осадок.
NaCℓ + AgNO3 →NaNO3 + AgCℓ↓; Na+ + Cℓ- + Ag+ + NO3- → Na+ + NO3- + AgCℓ↓;
сокращённое ионное уравнение: Ag+ + Cℓ-→ AgCℓ↓.
Пример 8. Реакция между солями NaCℓ + КNO3 не идёт, т.к. ни одна из солей КCℓ или NaNO3 не выпадает в осадок.
Реакция NaNO3 + AgCℓ не идёт, т.к. соль AgCℓ нерастворима.
Задание 4. Допишите уравнения реакций щелочей с солями. Напишите полные и краткие (если можно) ионные уравнения.
а) NaOH + CuCℓ2 → ; б) Са(ОН)2 + Na3PO4 → ; в) Ва(ОН)2 + Аℓ2(SО4)3 →
Задание 5. Напишите полные и краткие ионные уравнения соли с солью.
а) AgNO3 + CuCℓ2 → ; б) Na2S + Pb(NO3)3 → ; в) Fe2(SО4)3 + NaF → .
Задание 6. Объясните, почему не идут следующие уравнения реакций.
а) Cu(OH)2 + NaCℓ; б) NaOH + BaSO4; в) K2S + Fe2SiO3; г) Na2SO4 + CuCℓ2.
Задание 7. С какими веществами будет реагировать соль CuSO4:
а) Na2SO4; б) Zn(OH)2; в) ZnCℓ2; г) Са(ОН)2; д) К3РО4; е) Ва(NO3)2?
Задание 8. Напишите все возможные реакции между веществами:
а) NaOH; б) FeCℓ3; в) CuCO3; г) Ва(NO3)2.
3. Соль + кислота = новая соль + новая кислота (или газ).
Реакции солей с кислотами сильно отличаются от реакций солей со щелочами или солей с солями. Здесь главным правилом является следующее.
Более сильная кислота вытесняет из солей более слабую кислоту!
При этом соль может быть и нерастворимой. Соли BaSO4, AgCℓ и PbS очень устойчивы и не реагируют с кислотами.
Силу кислот определяют по схеме, которую надо выучить. Из изученных в курсе 8 класса самая сильная серная кислота H2SO4 и самая слабая H2SiO3.
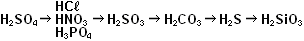
Пример 9. Если концентрированной серной кислотой H2SO4 облить твёрдую поваренную соль и нагреть, то начнёт выделяться газ хлороводород НСℓ:
2NaCℓ + H2SO4 (конц.) → Na2SO4 + 2НСℓ↑, т.к. более сильная серная кислота вытесняет из соли более слабую соляную кислоту.
Пример 10. Если мел СаСО3 облить соляной кислотой НСℓ, то начнёт выделяться углекислый газ СО2, который образуется при разложении слабой угольной кислоты Н2СО3 → Н2О + СО2↑: СаСО3 + 2НСℓ → СаСℓ2 + Н2О + СО2↑. Более сильная соляная кислота вытеснила из соли слабую угольную кислоту. Аналогично идёт разложение сернистой кислоты: Н2SО3 → Н2О + SО2↑.
Пример 11. Если в раствор сульфида Na2S прилить любой сильной кислоты, то будет выделяться сернистый газ H2S с запахом тухлых яиц:
Na2S + Н2СО3 → Na2СО3 + H2S↑.
Пример 12. При действии более сильной кислоты на силикаты выпадает студенистый осадок кремниевой кислоты: Na2SiO3 + 2HNO3 → 2NaNO3 + H2SiO3↓.
Задание 9. Напишите ионные уравнения реакций кислот с солями:
а) КСℓ + Н2SО4 (конц.) → ; б) СаСО3 + HNO3 → ; в) НСℓ + СаSO3 → ;
г) Н2SО3 + СаS → ; д) Н3РО4 + СаSiО3 → ; е) H2SO4 + Ва(NO3)2 → .
Задание 10. Объясните, почему все эти реакции не идут:
а) Na2CO3 + H2S; б) Na2S + Н2SiО3; в) АgСℓ + H2SO4; г) CuCℓ2 + HNO3?
Задание 11. С какими веществами будет реагировать угольная кислота:
а) Са; б) СuО; в) LiOH; г) Na2SO3; д) Na2S; е) Na2SiO3?
Задание 12. Напишите все возможные реакции между веществами:
а) HNO3; б) КСℓ; в) АgСℓ; г) Cu(ОН)2; д) FeCO3.
4. Когда ионные реакции идут до конца?
Ионные реакции идут до конца в трёх случаях, когда получается:
а) мало диссоциирующее вещество, например, вода Н2О:
2NaOH + N2O5 → 2NaNO3 + H2O; 2Na+ + 2OH- + N2O5 → 2Na- + 2NO3- + H2O;
б) выпадает осадок:
BaСℓ2 + К2SO4 → BaSO4↓ + 2КСℓ;
Ba2+ + 2Сℓ- + 2К+ + SO42- → BaSO4↓ + 2К+ + 2Сℓ-; Ba2+ + SO42- → BaSO4↓.
в) выделяется газ СО2, SO2 или Н2S:
K2S + 2HCℓ → 2KCℓ + H2S↑; 2К+ + S2- + 2H+ + 2Cℓ- → 2К+ + 2Cℓ- + H2S↑.
Задание 13. Напишите ионное уравнение реакции и объясните, почему оно идёт до конца.
а) К2О + Н3РО4 → ; б) Аℓ(ОН)3 + НBr → ; в) Cu(NO3)2 + КОН → ;
г) AgNO3 + FeCℓ3 → ; д) NaOH + P2O5 → ; е) HNO3 + PbCO3 → ;
ж) FeCℓ2 + H2SO4 (конц.) → ; з) ZnSO3 + HNO3 → ; и) K2SiO3 + H3PO4 → .
§23. Задачи на расчёты по химическим уравнениям.
1. Задачи на процентную концентрацию. §28.
Пример 1. Какая масса 15%-ого раствора соляной кислоты требуется для полного растворения 9,9 г гидроксида цинка?
Решение.
9,9 г х г
Zn(OH)2 + 2HCℓ → ZnCℓ2 + 2H2O
99 г 73 г

Пример 2. Какая масса концентрированной серной кислоты нужна для нейтрализации 160 г раствора гидроксида натрия 20%-ной концентрации?
Решение.
160 г х г
2NaOH + H2SO4 → Na2SO4 + 2H2O
80 г 98 г
Найдём массы 2m(NaOH) = 80 г и m(H2SO4) = 98 г.
Из пропорции найдём массу серной кислоты, которая нужна была бы для нейтрализации 160 г чистого гидроксида натрия:
х = 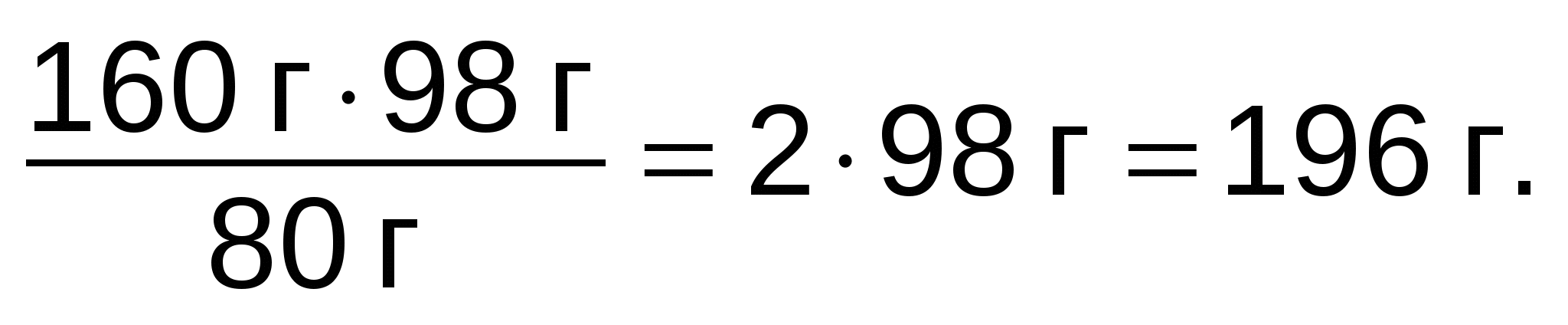
Для 100% раствора NaOH нужно было бы 196 г H2SO4,
а для 20%-ого раствора NaOH нужно у г H2SO4;
у = 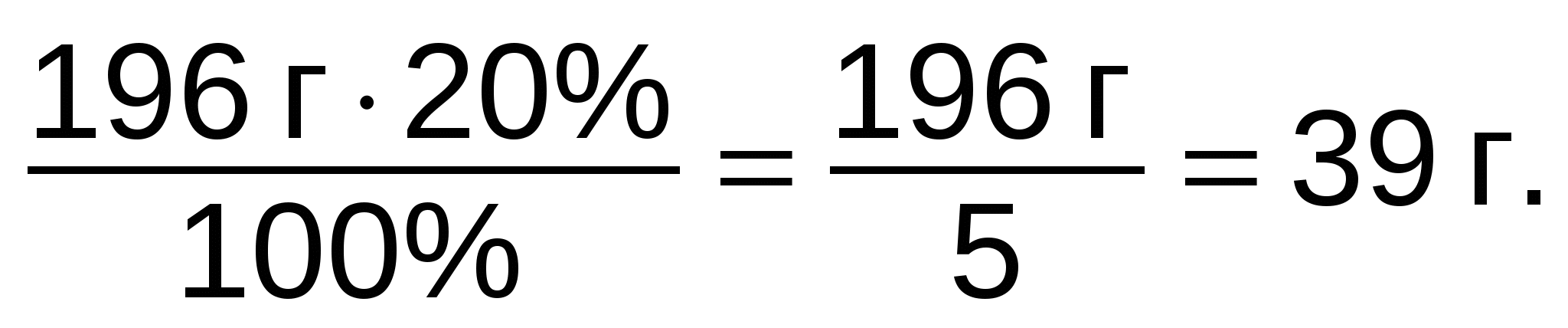
Примечание. Эту задачу можно, конечно, решить по-другому. Сперва найти 20% чистого NaOH от 160 г - это будет 0,2∙ 160 г = 32 г. Составить уравнение:
3
у = 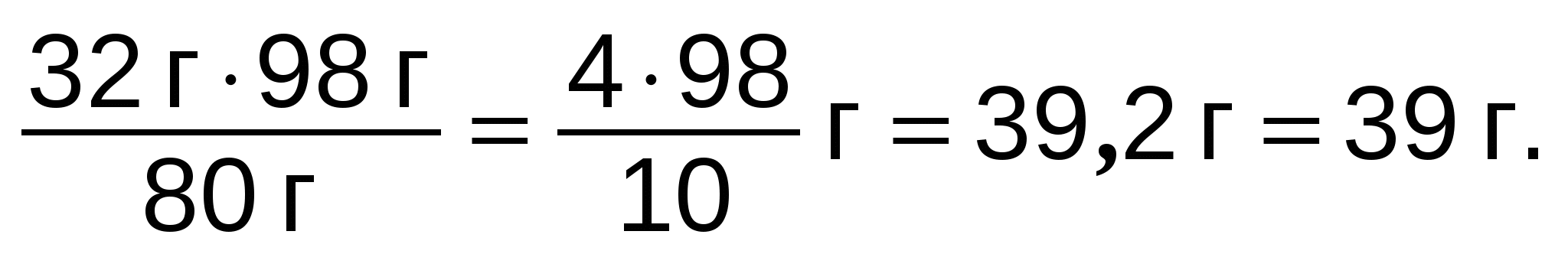 2 г х г
2 г х г
2NaOH + H2SO4 → Na2SO4 + 2H2O
80 г 98 г
2. Задачи на примеси.
Пример 3. Известняк содержит 85% чистого карбоната кальция СаСО3. Сколько негашёной извести СаО можно получить при обжиге 2 тонн известняка?
Решение.
2
m(СаСО3) = 1 моль∙(40 + 12 + 16∙4) г/моль = 100 г;
m(СаО) = 1 моль∙(40 + 16) г/моль = 56 г;000 кг х кг
СаСО3 → СаО + СО2↑
100 г 56 г
Если бы известняк весь был чистый, то негашёной извести СаО получилось бы:
х
у = 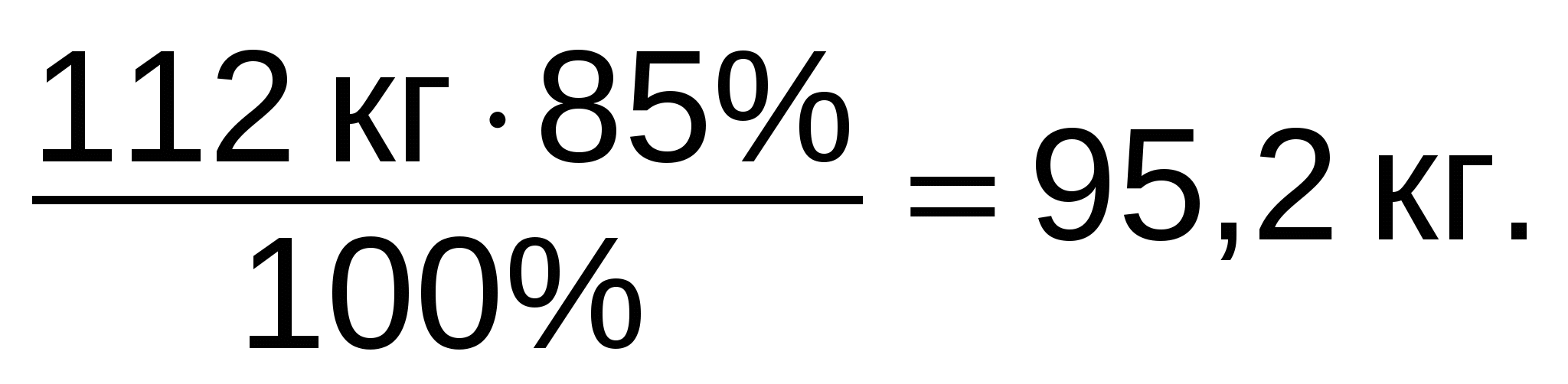 =
= 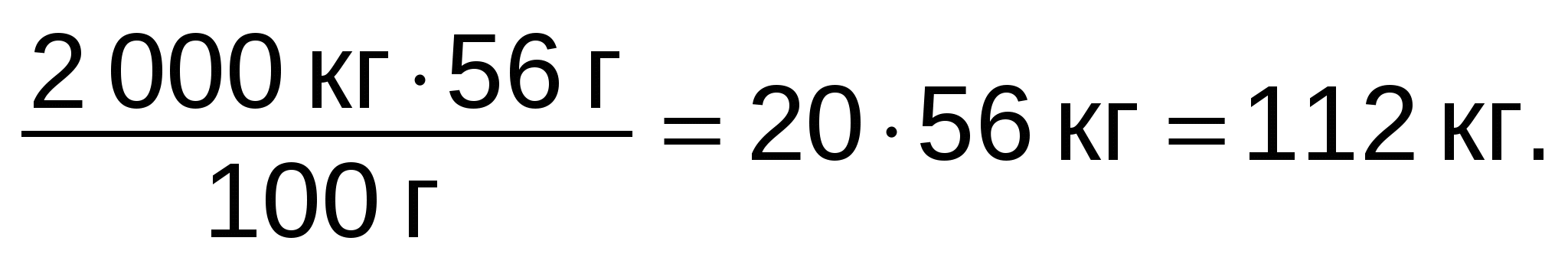
Негашёной извести 112 кг - это 100%,
негашёной извести у кг - это 85%;
Примечание. Задачу можно решить по-другому. Сперва найти 85% чистого карбоната кальция СаСО3: 0,85∙2 000 кг = 1 700 кг. Составить уравнение:
1
х = 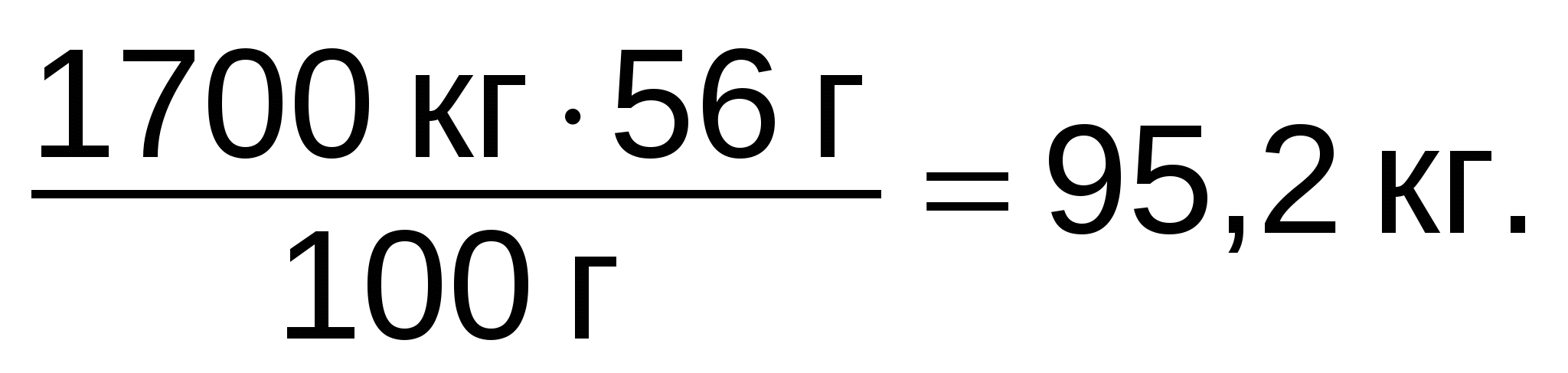 700 кг х кг
700 кг х кг
СаСО3 → СаО + СО2↑
100 г 56 г
Пример 4. Известняк содержит 15% примеси. При обжиге выделилось 448 л углекислого газа. Какая масса известняка была взята?
Решение.
х г 448 л
С
m(СаСО3) = 1 моль∙(40 + 12 + 16∙4) г/моль = 100 г;аСО3 → СаО + СО2↑
100 г 22,4 л
Массу чистого карбоната кальция СаСО3 в известняке найдём по пропорции:
х = 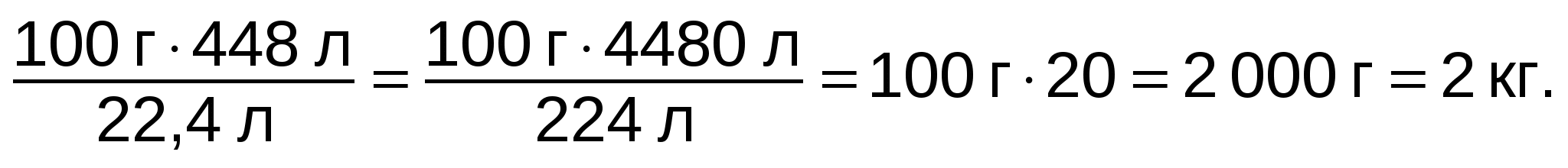
Если примеси в известняке 15%, то чистого карбоната 100% - 15% = 85%.
Ч
х = 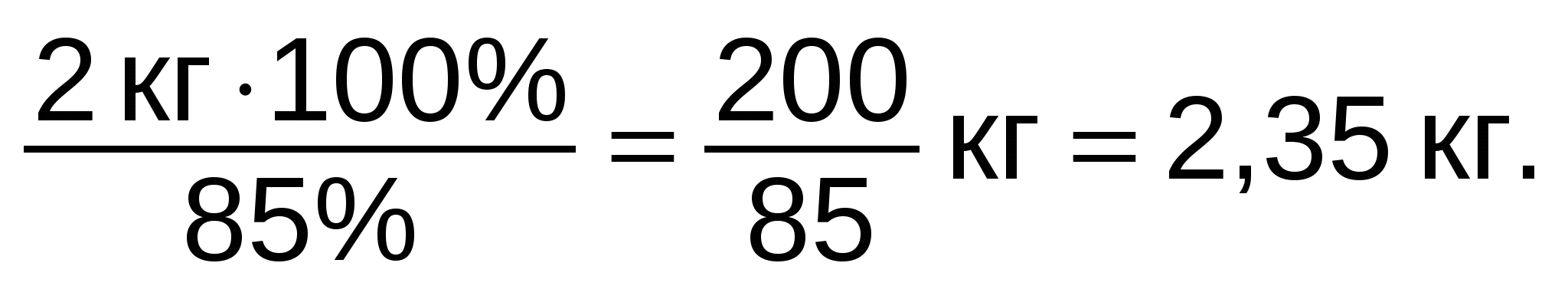 истого СаСО3 2 кг - это 85%,
истого СаСО3 2 кг - это 85%,
известняка х кг - это 100%;
Задание 1. Какая масса оксида магния MgO потребуется для нейтрализации 680 г 15%-ого раствора сероводородной кислоты H2S? Ответ. 120 г.
Задание 2. Какая масса 15%-ого раствора сероводородной кислоты потребуется для реагирования со 120 г оксида магния? Ответ. 680 г.
Задание 3. Какая масса 25%-ой плавиковой кислоты HF потребуется для нейтрализации 489 г гидроксида лития LiOH? Ответ. 1,6 кг.
Задание 4. Какая масса кальция Са может прореагировать с 730 г 20%-ой соляной кислоты НСℓ? Ответ. 80 г.
Задание 5. Какой объём водорода Н2 выделится при реакции натрия Na с 25%-ой серной кислотой массой 490 г? Ответ. 5,6 л.
Задание 6. Известняк содержит 90% чистого карбоната кальция СаСО3. Сколько негашёной извести СаО можно получить при обжиге 5 тонн известняка?
Задание 7. Известняк содержит 5% примеси. При обжиге выделилось 112 л углекислого газа. Какая масса известняка была взята? При вычислениях используйте калькулятор. Ответ. 526 л.
Задание 8. Сероводород горит по уравнению 2H2S + 3O2 → 2H2O + 2SO2. Какой объём воздуха нужен для сгорания 120 л H2S, если содержание кислорода в воздухе примерно 20%? Как устно найти объём получившегося сернистого газа?
§24. Окислительно-восстановительные реакции.
1. Электронный баланс при О.-В. реакциях. §43.
В ионных реакциях происходит взаимодействие готовых ионов, поэтому в течение реакции степени окислений отдельных химических элементов не изменяются. Например, в ионной реакции Ca+2O-2 + S+4O2-2 → Ca+2S+4O3-2 степени окислений всех элементов до реакции и после реакции одинаковы.
В окислительно-восстановительных реакциях обязательно меняются степени окисления одного или нескольких химических элементов. Чаще всего один элемент отдаёт электроны и при этом окисляется, а другой элемент принимает электроны и восстанавливается. Рассмотрим пример о.-в. реакции горения фосфора: Р0 + О20 → Р2+5О5-2.
Атом фосфора меняет степень окисления от Р0 до Р+5, т.е. он отдаёт 5 отрицательных электронов: Р0 - 5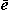 → Р+5. Атом кислорода меняет степень окисления от О0 до О-2, т.е. получает 2 электрона: О0 + 2
→ Р+5. Атом кислорода меняет степень окисления от О0 до О-2, т.е. получает 2 электрона: О0 + 2 → О-2. Но т.к. в молекуле О2 было 2 атома, то получаем О20 + 4
→ О-2. Но т.к. в молекуле О2 было 2 атома, то получаем О20 + 4 → 2О-2. Это уравнение часто встречается, поэтому надо его выучить наизусть!
→ 2О-2. Это уравнение часто встречается, поэтому надо его выучить наизусть!
Получаем два уравнения электронного баланса: Р0 - 5 → Р+5;
→ Р+5;
О20 + 4 → 2О-2.
→ 2О-2.
Здесь отдано 5 электронов, а принято только 4 электрона. Чтобы уравнять число электронов, обе части первого уравнения умножаем на 4, а второго уравнения на 5. Тогда число отданных и принятых электронов будет поровну, по 20 электронов: 4Р0 - 20![]() → 4Р+5;
→ 4Р+5;
5О20 + 20 → 10О-2.
→ 10О-2.
Следовательно, в левой части уравнения надо взять 4Р + 5О2 и чтобы уравнять уравнение, в правой части поставить коэффициент 2Р2О5. Тогда четыре атома фосфора отдают пяти молекулам кислорода 20 электронов. Коротко весь окислительно-восстановительный процесс пишут так:

2. Что нужно помнить при составлении О.-В. реакций. §43
1. Если степень окисления элемента повышается (от "-" к "+"), то элемент окисляется. Примеры окислений: Р0 → Р+5; S-2 → S0; S-2 → S+4; Cr+2 → Cr+6. Сам элемент при этом является восстановителем. Запомните несколько хороших восстановителей: металлы; водород Н2; уголь С; угарный газ CO; сероводород H2S; аммиак NH3 и другие вещества.
а) При получении стали в доменных печах с помощью угля и угарного газа восстанавливают чистое железо из руды: Fe+2O-2 + C+2O-2→ Fe0 + C+4O2-2.
б) Восстановление меди Cu из оксида меди CuO (см. §17, пункт 1.1):
Cu+2O + Н20 → Cu0 + Н2+О (медь восстановилась из оксида).
2. Наоборот, если степень окисления элемента понижается (от "+" к "-"), то элемент восстанавливается, а сам является окислителем. Запомните хорошие окислители: кислород О2; галогены F, Cℓ, Br; азотная к-та HNO3; концентрированная серная к-та H2SO4; перманганат калия KMnO4 и другие. С помощью кислорода окисляется топливо: С0 + О20→ С+4О2-2.
3. В §12, пункт 2 мы рассматривали взаимодействие металлов с кислотами, которое происходило соответственно ряду активности (напряжений) металлов:
активные металлы: Li, K, Ba, Ca, Na, Mg; средние:, Mn, Zn, Cr, Fe, Sn, Pb и пассивные металлы (после водорода Н): Cu, Hg, Ag, Au.
Взаимодействие солей с металлами тоже происходит согласно этому ряду.
Более активный металл вытесняет из растворимой соли более пассивный металл (с нерастворимыми солями реакции не идут).
Например, если железный гвоздь Fe опустить в пробирку с голубым раствором медного купороса CuSO4, то он быстро покроется слоем чистой красной меди Сu. А в раствор будет переходить зелёный железный купорос FeSO4:
Fe + CuSO4→ Cu + FeSO4. Здесь Fe0 - 2 → Fe+2 - железо окисляется, а медь Cu+2 + 2
→ Fe+2 - железо окисляется, а медь Cu+2 + 2![]() → Cu0 - восстанавливается. Более активное железо вытеснило из соли менее активную медь!
→ Cu0 - восстанавливается. Более активное железо вытеснило из соли менее активную медь!
А вот с раствором сульфата цинка железный гвоздь реагировать не будет, т.к. железо не может вытеснить более активный цинк: Fe + ZnSO4 - не идёт!
С нерастворимой солью CuCO3 железо тоже реагировать не будет. Для щелочных и щелочноземельных металлов сперва надо написать уравнение реакции с водой, а потом с солью! Например, нельзя писать реакцию натрия с сульфатом меди 2Na + CuSO4→ Na2SO4 + Cu, т.к. сперва натрий прореагирует с водой 2Na + 2H2O → 2NaOH + Н2↑, а потом 2NaOH + CuSO4→ Cu(OH)2↓ + Na2SO4.
4. Рассмотрим, наконец, как реагируют с металлами концентрированные азотная кислота HNO3 и серная кислота H2SO4. Эти кислоты могут реагировать даже с металлами, стоящими после водорода, например, с медью Cu, но при этом выделяется не водород Н2, а другие газы, например, SO2 и NO2.
Cu0 + 2H2S+6O4→ Cu+2SO4 + S+4O2↑ + 2H2O - слышен запах сернистого газа.
Cu0 - 2 → Cu+2 - ок-тся; восс-тель;
→ Cu+2 - ок-тся; восс-тель;
S+6 + 2 → S+4 - вос-тся; ок-тель.
→ S+4 - вос-тся; ок-тель.
С медью в концентрир. азотной к-те выделяется ядовитый бурый газ NO2↑:
Cu0 + 4HN+5O3→ Cu+2(NO3)2 + 2N+4O2↑ + 2H2O
Cu0 - 2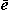 → Cu+2 - ок-тся; восс-тель;
→ Cu+2 - ок-тся; восс-тель;
2N+5 + 2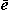 → 2N+4 - вос-тся; окис-тель.
→ 2N+4 - вос-тся; окис-тель.
Задание 1. Составьте уравнения электронного баланса для реакций горения и покажите стрелочкой сверху, сколько электронов передано кислороду:
а) 4Li + O2 → 2Li2O; б) 2Mg + O2 → 2MgO; в) 4Аℓ + 3О2 → 2Аℓ2О3;
г) С + О2 → СО2; д) S + O2 → SO2; е) 2SO2 + O2 → 2SO3.
Задание 2. Составьте уравнения электронного баланса и с их помощью уравняйте уравнения реакций. Покажите передачу электронов.
а) К + Р → К3Р; б) Аℓ + S → Aℓ2S3; в) Na + Cℓ2→ NaCℓ; г) Ca + F2→ CaF2;
д) Aℓ + Br2 → AℓBr3; е) Na + N2 → Na3N; ж) Ва + N2 → Ba3N2.
Задание 3. Составьте уравнения реакций металлов с водой, с кислотами и с солями и уравняйте их с помощью электронного баланса.
а) Na + H2O → ; б) Са + Н2О → ; в) Ва + НСℓ → ; г) Na + Н3РО4→ ;
д) Аℓ + Н2SO4→ ; е) Са + Н3РО4→ ; ж) Cu + Hg(NO3)2→ ; з) Aℓ + FeSO4→ .
§25. Генетическая связь.
1. Генетическая связь между классами веществ. §42.
Генетическая связь между классами неорганических веществ (сверху вниз) для металлов: металл → оснόвный оксид → основание (щёлочь) → соль и для неметаллов: неметалл → кислотный оксид → кислота → соль.
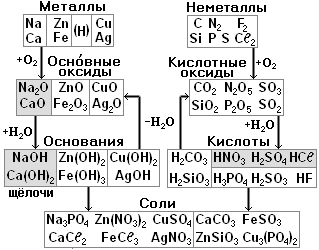
Пример 1. Напишите уравнения реакций: Ca → СаO → Са(OH)2→ Са(NO3)2.
Решение.
2Ca + О2→ 2СаО; СаО + Н2О → Са(ОН)2; Са(ОН)2 + 2HNO3→ Са(NO3)2 + Н2О.
Пример 2. Напишите уравнения реакций: С → СО2→ Н2СО3→ Na2CO3.
Решение.
С + О2→ СО2; СО2 + Н2О → Н2СО3; Н2СО + 2NaOH → Na2CO3 + 2Н2О.
Пример 3. Осуществите превращения:
Cu → CuO → CuCℓ2→ Cu(OH)2→ CuO → Cu.
Решение.
1) 2Cu + О2→ 2СuО; 2) СuО + 2HCℓ → СuCℓ2 + Н2О;
3) СuCℓ2 + 2NaOH → Сu(OH)2 + 2NaCℓ; 4) Сu(OH)2→ CuO + Н2О;
5) CuO + Н2→ Cu + Н2О.
Задание 1. Осуществите превращения:
а) Na → Nа2O → Nа(OH)2→ Nа2SO3; б) S → SО2→ Н2SО3→ BaSO3;
в) Fe → Fe2O3→ FeCℓ3→ Fe(OH)3→ Fe2O3→ Fe;
г) Р → Р2О5 → Н3РО4 → К3РО4; д) Si → SiO2 → Na2SiO3 → H2SiO3 → SiO2.
2. Генетическая связь между металлами и неметаллами.
В курсе химии 8 класса в первую очередь должны быть усвоены эти 10 реакций: без них невозможно изучение химии в 9 классе!
1) В результате реакции "Металл + Неметалл" получаются бинарные соединения (с суффиксом "-ид"), среди них оксиды и некоторые соли: сульфиды, фториды, хлориды, бромиды и др. соли (см.§24, Задание 2).
2) При реакции "Металл + Кислота" получаются соли и выделяется Н2 и другие газы (см. §12, пункт 2 и Задания 7,8,9, а также §24, пункт 4).
3) Реакции "Металл + Соль" рассмотрены в §24, пункт 2(3).
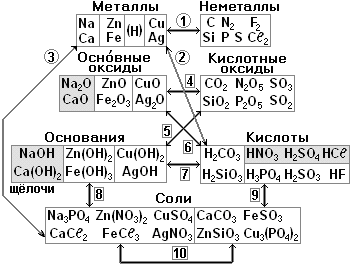
Реакции 4) "Основной оксид + Кислотный оксид → Соль";
5) "Основание + Кислотный оксид → Соль + Н2О" и
6) "Основной оксид + Кислота → Соль + Н2О" см. всё §21.
7) Реакция нейтрализации "Основание + Кислота → Соль + Н2О" см. §20.
Реакции 8) "Щёлочь + Соль", 9) "Кислота + Соль" и 10) "Соль + Соль" описаны в §22, пункт 2.
Задание 2. Пользуясь схемой, напишите уравнения реакции цинка Zn
1) с хлором Сℓ2; 2) с разбавленной серной кислотой Н2SO4; 3) с раствором медного купороса CuSO4; 4) с кислородом О2.
Задание 3. Пользуясь схемой генетической связи, осуществите превращения:
а) Na → Na3PO4→ Na2SO4→ BaSO4; б) Mg → MgS → MgCℓ2→ AgCℓ;
в) S → SO2→ CaSO3→ Ca(NO3)2→ CaSO4; г) K → KOH → K2SiO3→ CaSiO3.
Задание 4. Получите сульфат меди CuSO4 из а) CuO; б) Cu(OH)2; в) CuCℓ2.
Задание 5. Напишите уравнения: FeCO3→ FeO → Fe → FeCℓ2→ Fe3(PO4)2.
Задание 6. С какими веществами будет реагировать соляная кислота:
а) CuO; б) Cu; в) AgNO3; г) Na3PO4; д) Na2CO3; е) P2O5; ж) Aℓ; з) Fe(OH)3?
§26. Типы химических реакций.
1. Реакции соединения-разложения, замещения и обмена. §27.
1) Реакциями соединения наз. реакции, при которых из двух веществ образуется одно вещество.
СаО + СО2 СаСО3 (ионное); 2Са + О2 2СаО (окислительно-восстан.);
Na2O + H2O → 2NaOH (ионное); SO2 + H2O → H2SO3 (ионное).
2) Реакциями разложения наз. реакции, при которых из одного вещества образуются два или более веществ.
Н2СО3 Н2О + СО2 (ионное); 2HgO 2Hg + O2 (окислительно-восстанов.).
3) Реакциями замещения наз. реакции, при которых простое вещество замещает какой либо химический элемент в сложном веществе.
Fe + CuSO4 Cu + FeSO4 (о.-в.); 2Na + 2H2O → 2NaOH + H2↑ (о.-в.);
4) Реакциями обмена (ионного обмена) наз. реакции, при которых два сложных вещества обмениваются готовыми ионами (степени окисления не изменяются).
Са(ОН)2 + CuSO4 CaSO4+ Cu(OH)2; СаО + Н2СО3→ СаСО3 + Н2О.
5) Реакцией нейтрализации наз. реакция ионного обмена между основанием и кислотой.
Ca(OH)2 + H2SO4 CaSO4 + 2Н2О (ионное).
2. Окислительно-восстановительные реакции и реакции обмена.
По другой классификации уравнения реакции делятся на две группы:
а) окислительно-восстановительные:
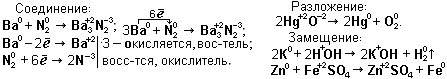
б) ионные: Соединение: Ca+2O-2 + S+4O2-2 → Ca+2S+4O3-2;
Разложение: Ca+2С+4O3-2→ Ca+2O-2 + С+4O2-2↑;
Ионный обмен: 2КОН + Cа(NO3)2 → 2KNO3 + Cа(OH)2↓;
2K+ + 2OH- + Cа2+ + 2NO3- → 2K+ + 2NO3- + Cа(OH)2↓.
З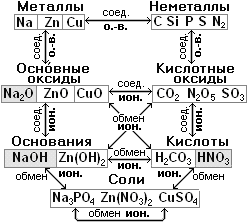 адание 1. На схеме приведены 12 стрелок. Придумайте к каждой стрелке по 1 примеру уравнения.
адание 1. На схеме приведены 12 стрелок. Придумайте к каждой стрелке по 1 примеру уравнения.
Задание 2. Из приведённых уравнений выпишите сперва все 1) окислительно-восстановительные, затем все 2) ионные и уравняйте их.
а) Na + O2→; б) Si + O2→;
в) Na2O + H2O →; г) N2O5 + H2O →;
д) Na2O + HNO3 →; е)NaOH + SO3 →;
ж) Zn(OH)2 + HNO3 →;
з) NaOH + Zn(NO3)2 →;
и) Na2CO3 + HNO3 →;
к) Na3PO4 + CuSO4 →.
Задание 3. На схеме к заданиям 1 и 2 не хватает двух окислительно-восстановительных "стрелок" (Металл + Кислота и Металл + Соль) и двух ионных уравнений (разложение слабых оснований и слабых кислот). Придумайте эти 4 примера реакций и запишите уравнения.
3. Качественные реакции на некоторые ионы.
Качественные реакции проводят для того, чтобы обнаружить, из каких ионов состоит неизвестное сложное вещество: щёлочь, кислота, соль и др.
Вещество, с помощью которого исследуют неизвестное вещество, называют реактивом на это неизвестное вещество. Например, в одной из двух пробирок налита кислота, а в другой - раствор щёлочи. Как определить, где кислота, а где щёлочь?
Используем как реактив - фиолетовый лакмус. Капнем лакмус в обе пробирки: в той пробирке, где лакмус стал красным, там кислота, а где синим, там щёлочь. Точно так же реактивом на кислоту и щёлочь является метилоранж, который изменит оранжевый цвет в кислоте - на розовый, в щёлочи - на жёлтый.
1. Повторите цвета индикаторов §11, пункт 3, как реактивы на ионы Н+ и ОН-.
2. Реактивами друг на друга являются ионы бария Ва2+ и сульфат-ионы SO42-. Например, надо доказать, что в пробирке налит раствор какой-то соли бария. Тогда надо прилить туда любой раствор, содержащий сульфат-ионы SO42-, например, серную кислоту H2SO4 или сульфат натрия Na2SO4. Мгновенно выпадет белый осадок BaSO4↓, который не растворим в сильной кислоте, т.е. надо ещё прилить HNO3, и осадок не должен исчезнуть. Чтобы обнаружить ионы SO42-, надо, наоборот, приливать раствор, содержащий ионы Ва2+.
Абсолютно так же реактивами друг на друга являются ионы Ag+ и Сℓ-.
Ионы Ag+ и фосфат-ионы РО43- также являются реактивами друг на друга, т.к. дают жёлтый осадок Ag3PO4.
3. Ионы щелочных и щелочноземельных металлов узнают по цвету пламени. Если в раствор поваренной соли, содержащей ионы Na+, макнуть чистой стеклянной палочкой и потом внести в пламя спиртовки, то пламя окрасится в жёлтый цвет. Также окрашивают пламя ионы К+ - в фиолетовый, Са2+ - в кирпично-красный, Ва2+ - в жёлто-зелёный цвет.
4. Повторите §17: как обнаружить газы Н2, О2 и СО2.
Чтобы обнаружить в растворе карбонат-ионы СО32-, надо прилить любой сильной кислоты: СО32- + НСℓ → Сℓ- + Н2О + СО2↑, тогда выделится углекислый газ, который по газоотводной трубке пропускают через известковую воду: Са(ОН)2 + СО2→ СаСО3↓ + Н2О, т.е. известковая вода мутнеет из-за осадка. Наоборот, ионы Са2+ можно обнаружить в растворе с помощью углекислого газа: дуть в раствор через трубочку (у нас в лёгких содержится достаточно СО2).
С помощью сильной кислоты можно обнаружить сульфит-ионы SO32-, будет слышен запах сернистого газа (запах горелых спичек).
Аналогично, сильные кислоты вытесняют из раствора сульфид-ионы S2-, тогда слышен запах сероводорода H2S (запах тухлых яиц - осторожно: ядовит!).
5. Ионы меди Cu2+ в растворе имеют голубой цвет - реактив практически не нужен. Но если всё же прилить любой щёлочи ОН-, то выпадёт голубой осадок Cu(OH)2↓. Аналогично, ионы Fe2+ со щёлочью дают зеленоватый осадок Fe(OH)2, который со временем буреет, т.к. превращается в бурый Fe(OH)3.
4. Таблица качественных реакций. Задачи практикума.
Качественные реакции на нитрат-ион NO3- и ионы амфотерных металлов будут изучены в 9 и 11 классах, а также цветные реакции на ионы Fe2+ и Fe3+.
Какой ион
Реактив
Что наблюдаем
Какой ион
Реактив
Что наблюдаем
Н+
Индикат.
Изменяет цвет
ОН-
Индикат.
Изменяет цвет
Ва2+
SO42-
Белый осадок
SO42-
Ва2+
Белый осадок
Ag+
Cℓ-
Белый осадок
Cℓ-
Ag+
Белый осадок
PO43-
Ag+
Жёлтый осадок
Br-
Ag+
Желтоватый осадок
СО32-
Н+
СО2↑ + Са(ОН)2
Са2+
СО2
Помутнение р-ра
SO32-
Н+
SO2↑ запах спичек
NO3-
H2SO4
Cu→NO2 бурый газ
Na+
пламя
жёлтое пламя
К+
пламя
фиолетовое пламя
Cu2+
ОН-
голубой осадок
Cu2+
S2-
чёрный осадок
Fe2+
ОН-
зеленоватый осадок
Fe3+
ОН-
бурый осадок
Аℓ3+
ОН-
студенистый осадок, растворяется в NaOH
Zn2+
ОН-
белый осадок, растворяется в NaOH
Задание 1. Работа с индикаторами. Возьмите 6 пробирок: №1, №2 и №3 с раствором щёлочи NaOH и №4, №5 и №6 - с соляной кислотой НСℓ (на донышке пробирки по 1 см3). Капните в пробирки индикаторы: №1 и №4 лакмус, №2 и №5 - метилоранж, №3 и №6 - фенолфталеин. Рассмотрите и запишите цвета в таблицу. Сливайте по каплям кислоту в щёлочь: №4 в №1, №5 в №2 и №6 в №3. Как изменяется цвет индикатора?
Задание 2. Окрашивание пламени. В пробирках приготовьте растворы солей NaCℓ, KCℓ, СаСℓ2 и ВаСℓ2 и 4 чистые стеклянные палочки. Зажгите спиртовку. Макните палочки в растворы солей, вносите в пламя и наблюдайте изменение цвета пламени (в классе должно быть затемнение).
Задание 3. Осаждение солей. Приготовьте в трёх пробирках растворы солей Ва(NO3)2, AgNO3 и Zn(NO3)2 (по 1 мл). В первую пробирку налейте несколько капель серной кислоты Н2SO4, во вторую - соляной кислоты НСℓ и в третью раствора соли Na2СО3. Сравните вид осадка. Добавьте во все три пробирки азотной кислоты HNO3. В какой пробирке осадок исчезнет? Напишите все 4 уравнения реакции (последнее уравнение ZnCO3 + HNO3).
Задание 4. Выделение газов. На дно 3 пробирок насыпьте совсем немного твёрдых солей СаСО3 (мел), Na2SO3 (или любого сульфита) и Na2S (или любого сульфида). По очереди приливайте соляную кислоту и осторожно, махая рукой в сторону носа, нюхайте запах выделившихся газов. Напишите уравнения всех трёх реакций.
Задание 4. Цветные осадки. Приготовьте в пробирках №1 и №2 раствор медного купороса CuSO4, в пробирке №3 - раствор железного купороса FeSO4 и в пробирке №4 раствор FeСℓ3. Рассмотрите цвета растворов. В пробирки №1, №3 и №4 добавьте немного раствора щелочи NaOH, а в №2 раствора соли Na2S. рассмотрите цвета осадков и напишите уравнения реакций.
Задание 4. Экспериментальная задача. В трёх пробирках выданы три раствора BaCℓ2, Na2SO3 и NaOH, но неизвестно, где какой раствор. Во все три пробирки добавьте 1 мл серной кислоты H2SO4 и по признакам реакций узнайте, где какой раствор. Напишите уравнения реакций.
§27. Термохимические уравнения.
1. Экзотермические и эндотермические реакции. §26.
Если куски негашёной извести СаО облить водой, то начнётся бурная реакция соединения: СаО + Н2О → Cа(ОН)2 + Q , при этом выделяется так много тепла Q, что вода закипает, разбрызгивая горячую известь.
Экзотермическими наз. реакции, которые идут с выделением тепла +Q.
Экзотермическими являются все реакции горения: С + О2→ СО2 + Q. При реакциях нейтрализации щёлочи и кислоты пробирка слегка нагревается, т.к. выделяется тепло: NaOH + HCℓ → NaCℓ + H2O + Q.
При обжиге известняка СаСО3, наоборот нужно известняк сильно нагревать, только тогда идёт разложение: СаСО3→ СаО + СО2 - Q, т.е. теплота при этом поглощается и накапливается в виде химической энергии в СаО.
Эндотермическими наз. реакции, которые идут с поглощением тепла -Q.
При молнии в воздухе происходит эндотермическая реакция соединения азота с кислородом: N2 + O2→ 2NO - Q, где в молекулах оксида азота NO накапливается энергия молнии.
2. Термохимические уравнения.
Уравнения реакций, в которых указана теплота, которая выделяется (+Q) или поглощается (-Q) при реакции, называют термохимическими уравнениями. Количество теплоты указывают в килоджоулях на столько молей вещества, какой коэффициент стоит в уравнении.
Например, при сгорании 2 молей водорода 2Н2 + О2→ 2Н2О + 570 кДж образуется 2 моля водяного пара и выделяется примерно 570 кДж теплоты. По термохимическим уравнениям можно рассчитать теплоту сгорания топлива.
Пример 1. Сколько тепла выделится при сгорании 320 г метана СН4?
Решение.
320 г х кДж
СН4 + 2О2→ СО2 + 2Н2О + 890 кДж; М(СН4) = 1 моль∙(12 + 1∙4) г/моль = 16 г.
16 г
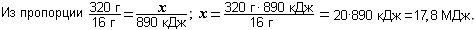
Пример 1. При сжигании 1,2 г магния Mg выделяется 30 кДж теплоты. Составьте термохимическое уравнение горения магния.
1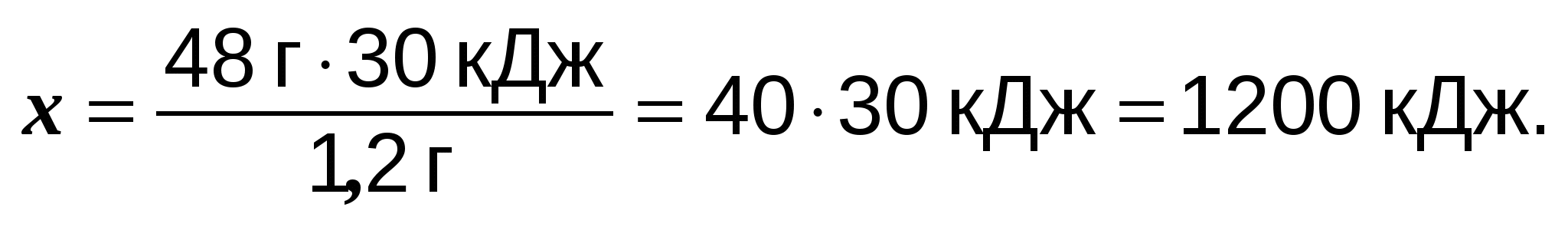 ,2 г 30 кДж
,2 г 30 кДж
2Mg + О2→ 2MgО + Q
48 г х кДж
Термохимическое уравнение: 2Mg + О2→ 2MgО + 1 200 кДж.
Задача 1. Сколько теплоты выделится при сгорании 320 г водорода?
Задача 2. Устно ответьте, сколько тепла выделится при сгорании (при н.у.)
а) 22, 4 л метана; б) 44,8 л водорода; в) 20 молей метана?
Задача 3. По уравнению 2NaOH + H2SO4→ Na2SO4 + 2H2O + 130 кДж вычислите, сколько тепла выделится при нейтрализации 20 г чистого NaOH.
Задача 4. При сгорании 80 г метана выделилось 4 450 кДж теплоты. Составьте термохимическое уравнение горения метана.
Задача 5. По термохимическому уравнению разложения бертолетовой соли 2КСℓО3→ 2КСℓ + 3О2 - 90 кДж вычислите, какой объём кислорода выделится, если потратить 180 кДж теплоты.
§28. Химическая кинетика.
1. Что изучает раздел химии "Химическая кинетика". §30, 31.
Химическая кинетика - это раздел химии, изучающий скорость течения химических реакций и какими способами можно изменить скорость реакции.
Некоторые реакции происходят мгновенно, например, взрыв пороха в патроне. Другие реакции протекают годами, например, кусок каменного угля окисляется кислородом воздуха С + О2→ СО2 без пламени, железо ржавеет. От чего зависит скорость химической реакции?
а) От рода реагирующих веществ. Бросим в соляную кислоту НСℓ кусочек натрия Na, кусочки цинка Zn и опустим железный гвоздь Fe. Натрий реагирует очень бурно и даже загорается; кусочки цинка довольно быстро реагируют с кислотой, а железный гвоздь - едва заметно. В этом примере скорость реакции зависит от активности металла.
б) От площади соприкосновения (измельчения) веществ. Если крупную гранулу цинка Zn измельчить до мельчайших крупинок, то площадь поверхности увеличится во много раз. Поэтому крупинки цинка очень бурно реагируют с соляной кислотой, а гранула - медленно. В химической промышленности этот способ увеличения скорости реакции применяется часто, например, руду перед обжигом измельчают на специальных шаровых мельницах.
в) От концентрации реагирующих веществ. Нальём в 2 пробирки немного соляной кислоты НСℓ и в одну из них дольём полпробирки воды. В обе пробирки опустим по грануле цинка Zn: в концентрированной кислоте реакция течёт быстро, а в разбавленной - очень медленно. Значит, чем больше концентрация веществ, тем больше скорость реакции. Но бывает и наоборот, например, концентрированные серная H2SO4 и азотная HNO3 кислоты не реагируют с железом Fe и алюминием Аℓ, поэтому их перевозят в железных и алюминиевых цистернах.
г) От температуры реагирующих веществ. Воздух состоит из смеси кислорода О2 и азота N2, но при обычной температуре они не реагируют. А в стволе молнии при температуре несколько тысяч градусов происходит реакция: N2 + О2→ 2NO, благодаря чему почва обогащается соединениями азота. Чем больше температура реагирующих веществ, тем больше скорость реакции.
д) От наличия катализатора, фермента, ингибитора. Жидкое вещество пероксид водорода внешне похож на воду (его применяют для обеззараживания ран и обесцвечивания волос). Пероксид разлагается на воду и кислород:
2Н2О2→ 2Н2О + О2↑. Но если поднести горящую лучинку, то лучинка не вспыхнет, т.к. кислород выделяется очень медленно. Насыплем в пероксид немножко чёрного порошка оксида марганца (IV) MnO2: начнётся бурное выделение кислорода, и горящая лучинка ярко вспыхнет. В этой реакции MnO2 сам не расходуется: он только помогает разложению пероксида. Здесь MnO2 является катализатором реакции разложения пероксида.
Катализаторами наз. вещества, которые увеличивают скорость реакции, но сами при этом не расходуются. Применение катализаторов называют катализом, а сами реакции называют каталитическими.
В химической промышленности многие реакции проводят в присутствии катализаторов, при этом экономическая стоимость реакции резко снижается.
Ферментами наз. биологические катализаторы, которые резко увеличивают скорость биохимических реакций в живых организмах. Если долго жевать во рту корочку хлеба, можно почувствовать сладкий вкус: под действием слюны крахмал хлеба разложится на глюкозу. В слюне содержится фермент птиалин, который многократно ускоряет процесс разложения крахмала в глюкозу.
В живой клетке практически ни одна сложная реакция не происходит без участия ферментов. Число ферментов тысячи, т.к. для каждой реакции нужен свой определённый фермент.
Иногда скорость химической реакции надо тормозить. Например, при перевозке многих веществ в цистернах надо, чтобы вещество не разъедало металл. Для этого добавляют ингибиторы - это вещества, замедляющие реакции. Особенно важно замедлять реакции коррозии (ржавления) металлов.
2. Гомогенные и гетерогенные химические реакции. §29.
Есть три агрегатных состояния вещества: твёрдое, жидкое и газообразное. Отсюда можно получить 6 разных случаев смешения веществ: Т+Т, Т+Ж, Т+Г и Ж+Ж, Ж+Г, Г+Г.
Гомогенными (однородными) наз. реакции, при которых вещества смешаны на уровне отдельных атомов и молекул.
Это могут быть две смешивающиеся жидкости и любые два газа. Т.к. вещества хорошо смешаны, то скорость реакции между ними обычно очень большая. Например, сливая два однородных водных раствора гидроксида бария Ва(ОН)2 и серной кислоты Н2SO4, практически мгновенно выпадает осадок BaSO4↓. Аналогично, смесь двух газов водорода Н2 и кислорода О2 мгновенно взрывается, если поднести спичку. Но в холодном состоянии эти газы могут реагировать медленно.
Гетерогенными (разнородными) наз. реакции, при которых вещества смешиваются лишь на уровне кусочков или капелек, между которыми есть поверхность соприкосновения.
Гетерогенными являются реакции твёрдых веществ с любыми другими веществами, т.к. у твёрдых веществ всегда есть поверхность, а также между двумя несмешивающимися жидкостями (вода и масло - капельки имеют поверхность) и между жидкостями и газами. Если твёрдое вещество измельчить до пыли, то гетерогенные реакции тоже могут идти очень быстро, например, мучная пыль в воздухе взрывоопасна. В химической промышленности используется проведение реакции "в кипящем слое". Для этого твёрдое вещество измельчают до пыли, а газ продувают снизу вверх. Тогда пылинки твёрдого вещества летают и максимально окружены молекулами газа, что увеличивает скорость реакции между твёрдым веществом и газом.
3. Измерение скорости реакции. §29.
Молярная концентрация вещества в растворе. Растворим в 1 литре воды 2 моля поваренной соли NaCℓ - это 2∙(23 + 35,5) г = 117 г соли. Тогда получим раствор с молярной концентрацией с = 2 моль/л. Ещё пример. В воздухе содержится приблизительно 20% кислорода, т.е. концентрация О2 в воздухе около 0,2 моль/л.
Пример 1. В смеси газов Н2 и О2 молярная концентрация водорода за время 0,3 с уменьшилась от 2 моль/л до 0,5 моль/л. Найти скорость реакции.
Дано: 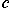 1 = 2 моль/л;
1 = 2 моль/л; 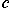 2 = 0,5 моль/л;
2 = 0,5 моль/л; 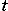 = 0,3 c. Найти:
= 0,3 c. Найти: 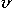 - ?
- ?
Решение.
Происходит реакция 2Н2 + О2→ 2Н2О, где концентрация Н2 уменьшилась на ∆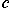 = |
= |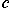 2 -
2 - 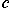 1| = |0,5 моль/л - 2 моль/л| = |- 1,5| моль/л за время
1| = |0,5 моль/л - 2 моль/л| = |- 1,5| моль/л за время 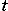 = 0,3 c.
= 0,3 c.
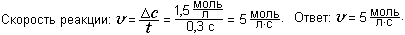
Скорость химической реакции равна отношению изменения молярной концентрации вещества ∆ = |
= | 2 -
2 -  1| ко времени
1| ко времени 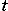 , за которое это изменение произошло. Скорость реакции считают всегда положительной.
, за которое это изменение произошло. Скорость реакции считают всегда положительной.

Решим этот же пример по О2. Пусть концентрация О2 была 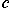 1 = 4 моль. По уравнению видно: если водорода израсходовалось 1,5 моль, то кислорода должно израсходоваться в 2 раза меньше, т.е. 0,75 моль, т.е.
1 = 4 моль. По уравнению видно: если водорода израсходовалось 1,5 моль, то кислорода должно израсходоваться в 2 раза меньше, т.е. 0,75 моль, т.е. 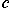 2 = 3,25 моль/л. Тогда ∆
2 = 3,25 моль/л. Тогда ∆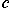 = |
= |![]() 2 -
2 - 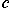 1| = |3,25 моль/л - 4 моль/л| = 0,75 моль/л. Скорость реакции:
1| = |3,25 моль/л - 4 моль/л| = 0,75 моль/л. Скорость реакции:
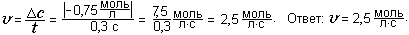
Видно, что кислород расходуется в 2 раза медленнее, чем водород. Скорость образования воды Н2О такая же, как скорость расходования Н2, и тоже положительна: ![]() (Н2О) = + 5 моль/л∙с.
(Н2О) = + 5 моль/л∙с.
4. Закон действующих масс. §30.
Скорость химической реакции не постоянна, а со временем уменьшается, т.к. реагирующие вещества расходуются и при этом их концентрации уменьшаются. Ведь в разбавленных растворах реакции текут медленнее. Предыдущая формула позволяет найти лишь среднюю скорость реакции за какой-то промежуток времени. А как найти мгновенную скорость при данных концентрациях веществ? На этот вопрос отвечает основной закон химической кинетики, открытый норвежскими химиками Гульдбергом и Вааге. Он называется закон действующих масс.
Рассмотрим смысл этого закона на примере синтеза аммиака NН3.
Пусть концентрация водорода Н2 была 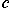 1 = 6 моль/м3 и концентрация азота
1 = 6 моль/м3 и концентрация азота 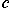 2 = 4 моль/м3. Составим уравнение синтеза аммиака: 3Н2 + 1N2→ 2NН3.
2 = 4 моль/м3. Составим уравнение синтеза аммиака: 3Н2 + 1N2→ 2NН3.
Тогда скорость реакции 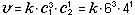 , где коэффициент k находят по специальной таблице: он для каждой реакции свой и зависит от температуры. В общем случае для уравнения mA + nB → D, где сА - концентрация вещества А и сВ - концентрация вещества В, скорость реакция при данной температуре
, где коэффициент k находят по специальной таблице: он для каждой реакции свой и зависит от температуры. В общем случае для уравнения mA + nB → D, где сА - концентрация вещества А и сВ - концентрация вещества В, скорость реакция при данной температуре 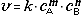 - это формула закона действующих масс.
- это формула закона действующих масс.
Коэффициент k в таблице даётся для какой-то одной температуры t1, тогда можно вычислить скорость реакции  1 при этой температуре. Чтобы вычислить скорость реакции при любой другой температуре t2, пользуются правилом Вант-Гоффа:
1 при этой температуре. Чтобы вычислить скорость реакции при любой другой температуре t2, пользуются правилом Вант-Гоффа:
При повышении температуры на каждые 10ºС скорость реакции увеличивается в γ = 2-4 раза, "гамма" γ - это температурный коэффициент.
Как видим, правило Вант-Гоффа даёт очень приблизительный результат.
Задание 1. К каждому заданию подберите из пункта 1 данного параграфа соответствующую причину (а-д) изменения скорости реакции:
1) Цинк в соляной кислоте реагирует бурно, а в фосфорной - медленно.
2) В чистом кислороде вещества горят энергичнее, чем на воздухе.
3) Кусок сахара, посыпанный сигаретным пеплом, хорошо горит.
4) Цинковая пыль реагирует с кислотой много быстрее, чем гранулы цинка.
5) Почему продукты питания хранят в холодильнике?
6) Для чего в продукты питания добавляют консерванты?
7) Для чего в печени вырабатывается желчь и поступает в 12-перстную кишку?
Задание 2. Выпишите 1) гомогенные и 2) гетерогенные реакции:
а) гранулы Zn в соляной кислоте; б) цинковая пыль в соляной кислоте;
в) раствор щёлочи и кислоты; г) горение стружек магния в воздухе;
д) взрыв бытового газа; е) горение спирта в спиртовке;
ж) растительное масло с бромной водой; з) железные опилки с серой.
Задание 3. В баллоне содержится смесь из двух газов: водорода с концентрацией 6 моль/л и кислорода с концентрацией 3 моль/л. В ходе реакции за 0,2 с концентрация водорода уменьшилась до 2 моль/л. Найти скорость реакции. Какой будет концентрация кислорода после 0,2 с?
Задание 4. В реакции соединения между газами 2А + В → 2С концентрация газа А равна 0,6 моль/л и газа В равна 0,4 моль/л. Найти скорость реакции, если коэффициент k = 25 л/моль∙с.
Задача 5. Как изменится скорость реакции между газами 2А + В → 2С, если а) концентрацию газа А увеличить в 3 раза; б) концентрацию газа В увеличить в 2 раза; в) концентрацию обоих газов увеличить в 3 раза?
Задача 6. Скорость реакции при 10ºС равна 5 л/моль∙с и температурный коэффициент реакции равен 3. Какой станет скорость реакции при 30ºС?
Задача 7. Как изменится скорость реакции с температурным коэффициентом γ = 4, если температура понизится от 60ºС до 40ºС?
§29. Химическое равновесие.
1. Обратимые и необратимые реакции. §32.
Рассмотрим пример необратимой реакции. Если в соляную кислоту поместить гранулы цинка, то реакция Zn + 2НСℓ → ZnCℓ2 + Н2↑ будет идти до тех пор, пока не закончится либо кислота, либо цинк (либо оба исходных в-ва). Но если через раствор получившейся соли ZnCℓ2 пропускать водород Н2, то обратная реакция не пойдёт.
Необратимыми наз. реакции, при которых хотя бы одно из исходных веществ (или все) полностью превращается в конечный продукт.
Необратимые реакции в растворах изучил французский химик Бертоллé. Он пришёл к выводу, что ионные реакции идут до конца, если а) выпадет осадок, б) выделится газ или в) получится вода (см. §22 пункт 4 и задание 13 к нему). Эти три случая необратимых реакций называют правилом Бертоллé.
Но большинство реакций могут идти как в прямом, так и в обратном направлении. Например, при растворении под давлением углекислого газа в воде получается угольная кислота: СО2 + Н2О → Н2СО3. Но эта реакция легко идёт в обратном направлении, если сосуд открыт: Н2СО3→ Н2О + СО2↑.
Эти две реакции пишут коротко так: СО2 + Н2О  Н2СО3, и такая реакция называется обратимой.
Н2СО3, и такая реакция называется обратимой.
Обратимыми наз. реакции, которые могут одновременно протекать в противоположных направлениях (в прямом и обратном).
2. Химическое равновесие и три способа его смещения. §33.
В закрытой бутылке газировки постоянно идёт реакция СО2 + Н2О  Н2СО3. В каждую секунду сколько молекул углекислого газа СО2 соединяется с водой, столько же молекул угольной кислоты Н2СО3 распадается. При этом число молекул СО2 над водой и число молекул Н2СО3 в воде остаётся постоянным! Наступает динамическое (подвижное) равновесие. При этом скорость прямой реакции
Н2СО3. В каждую секунду сколько молекул углекислого газа СО2 соединяется с водой, столько же молекул угольной кислоты Н2СО3 распадается. При этом число молекул СО2 над водой и число молекул Н2СО3 в воде остаётся постоянным! Наступает динамическое (подвижное) равновесие. При этом скорость прямой реакции  пр равна скорости обратной реакции
пр равна скорости обратной реакции  обр.
обр.
Химическим равновесием наз. такое состояние обратимой реакции, когда скорость прямой реакции равна скорости обратной реакции:  пр =
пр =  обр.
обр.
Но это равновесие легко можно нарушить. Если увеличить давление газа над водой, то скорость прямой реакции СО2 + Н2О → Н2СО3 увеличится, но ненадолго: вскоре снова установится равновесие. Только концентрация угольной кислоты Н2СО3 будет больше. Наоборот, если открыть бутылку с газировкой, то скорость обратной реакции увеличится: из воды будут выделяться пузырьки СО2, пока снова не установится равновесие.
Значит, равновесие химической реакции можно сместить либо вправо - в сторону образования продуктов реакции, либо влево - в обратную сторону образования исходных веществ.
Рассмотрим три способа смещения равновесия реакции синтеза аммиака вправо - в сторону образования аммиака: 3Н2 + 1N2 2NН3 + Q.
2NН3 + Q.
1) Увеличение концентрации реагирующих веществ. Со временем молекулы Н2 и N2 расходуются, их концентрация уменьшается, а значит, скорость прямой реакции тоже уменьшается. Чтобы этого не произошло, надо постоянно отводить готовый продукт NН3 из реактора и добавлять смесь Н2 и N2 в реактор.
2) Увеличение (уменьшение) давления реагирующих веществ. По закону Авогадро 1 моль любого газа при одинаковых условиях занимает одинаковый объём. Значит, 3 моля Н2 и 1 моль N2 до реакции занимали 4 объёма, а 2 моля газа аммиака NН3 занимают только 2 объёма. Чтобы "помочь" объёму уменьшаться, надо газы сжать, т.е. увеличить давление. Следовательно, если реакция идёт с уменьшением объёма, то для смещения равновесия вправо надо увеличить давление.
Наоборот, реакция превращения газа озона О3 в кислород: 2О3 3О2 идёт с увеличением объёма: от 2 объёмов до 3 объёмов. Значит, чтобы сместить равновесие вправо, надо давление уменьшать.
3О2 идёт с увеличением объёма: от 2 объёмов до 3 объёмов. Значит, чтобы сместить равновесие вправо, надо давление уменьшать.
В реакции Н2 + Сℓ2 2НСℓ объём исходных продуктов 1+1=2 и конечного продукта 2 объёма - объём не меняется, значит, изменение давления на смещение равновесия этой реакции не влияет.
2НСℓ объём исходных продуктов 1+1=2 и конечного продукта 2 объёма - объём не меняется, значит, изменение давления на смещение равновесия этой реакции не влияет.
3) Увеличение (уменьшение) температуры в реакторе. Реакция синтеза аммиака идёт с выделением тепла Q, поэтому для смещения равновесия реакции вправо это выделяющееся тепло надо всё время отводить, т.е. реактор надо охлаждать.
В экзотермических реакциях А + В → С + Q тепло Q надо отводить, поэтому температуру в реакторе надо уменьшать. В эндотермических реакциях типа А + В → С - Q теплота расходуется на образование продукта С, поэтому тепло надо подводить к реактору, т.е. температуру надо увеличивать. Например, тёплая газировка выдыхается быстрее, т.к. реакция СО2 + Н2О ![]() Н2СО3 - Q эндотермическая: при подводе тепла равновесие смещено влево, в сторону образования СО2.
Н2СО3 - Q эндотермическая: при подводе тепла равновесие смещено влево, в сторону образования СО2.
Эти три способа смещения равновесия обратимых реакций открыл французский химик Ле Шателье, поэтому их называют принципом Ле Шателье. Запомните! Принципом Ле Шателье можно воспользоваться только для обратимых реакций!
Внимание! При наличии катализатора увеличивается скорость как прямой реакции, так и обратной реакции. Поэтому равновесие реакции от катализатора не зависит.
Задание 1. Найдите среди реакций а) необратимые и б) обратимые.
1) N2 + O2 2NO - Q; 2) 2Li + O2→ Li2O + Q; 3) CaCO3
2NO - Q; 2) 2Li + O2→ Li2O + Q; 3) CaCO3  CaO + CO2 - Q;
CaO + CO2 - Q;
4) 2SO2 + O2  2SO3 + Q; 5) Ca + 2HCℓ → CaCl2 + H2↑ + Q.
2SO3 + Q; 5) Ca + 2HCℓ → CaCl2 + H2↑ + Q.
Объясните, в какой из обратимых реакций для смещения равновесия вправо надо уменьшать температуру.
Задание 2. Как тремя способами надо смещать равновесие реакции вправо:
а) 2SO2 + O2 2SO3 + Q; б) С2Н6
2SO3 + Q; б) С2Н6 С2Н4 + Н2 + Q;
С2Н4 + Н2 + Q;
в) 2СО + 2Н2 СН4 + СО2 - Q.
СН4 + СО2 - Q.
Задание 3. Как сместится равновесие а) при понижении температуры; б) при повышении давления:
1) 2СО + О2 2СО2 + Q; 2) N2 + O2
2СО2 + Q; 2) N2 + O2 2NO + Q; 3) С2Н4 + Н2
2NO + Q; 3) С2Н4 + Н2 С2Н6 - Q.
С2Н6 - Q.
Учебный год
Фамилия и имя ученика
2011 - 2012 уч.год.
2012 - 2013 уч.год.
2013 - 2014 уч.год.
МКОУ "Гауфская СОШ" Тугеус В.Я.
с.Гауф, 2011 год
Оглавление
§1. Вещество и химический элемент.
§2. Химические элементы. §4.
§3. Атомная и молекулярная масса.
§4. Строение электронных оболочек атомов.
§5. Электронные орбитали.
§6. Типы химических связей.
§7. Простые вещества. Количество вещества.
§8. Степень окисления и валентность.
§9. Оксиды.
§10. Основания, или гидроксиды.
§11. Кислоты.
§12. Соли.
§13. Кристаллические решётки.
§14. Чистые вещества и смеси.
§15. Массовая доля и концентрация раствора.
§16. Химические реакции.
§17. Получение газов.
§18. Растворимость веществ в воде.
§19. Электролитическая диссоциация.
§20. Реакция нейтрализации.
§21. Свойства основных и кислотных оксидов.
§22. Ионные уравнения.
§23. Задачи на расчёты по химическим уравнениям.
§24. Окислительно-восстановительные реакции.
§25. Генетическая связь.
§26. Типы химических реакций.
§27. Термохимические уравнения.
§28. Химическая кинетика.
§29. Химическое равновесие.


