- Преподавателю
- Химия
- Методическая разработка на тему: Рекомендации по организации самостоятельной работы студентов по дисциплине химия
Методическая разработка на тему: Рекомендации по организации самостоятельной работы студентов по дисциплине химия
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Волобоева .М. |
| Дата | 08.11.2014 |
| Формат | doc |
| Изображения | Есть |
Бюджетное учреждение
среднего профессионального образования
Ханты - Мансийского автономного округа - Югры
«Советский политехнический колледж»
Методическая разработка на тему:
Рекомендации по организации самостоятельной работы студентов по дисциплине химия
общеобразовательного цикла
технический профиль
23.01.03 Автомеханик
15.01.09 МАШИНИСТ ЛЕСОЗАГОТОВИТЕЛЬНЫХ
И ТРЕЛЕВОЧНЫХ МАШИН
18.01.27 Машинист технологических насосов и компрессоров
15.01.05 СВАРЩИК(ЭЛЕКТРОСВАРОЧНЫЕ И ГАЗОСВАРОЧНЫЕ РАБОТЫ)
19.02.10 Технология продукции общественного питания
Пояснительная записка
Составлены на основании Методических рекомендации по организации самостоятельной работы обучающихся БУ «Советский политехнический колледж», рабочей программы ОДБ.06 «ХИМИЯ»
Разработчики:
бюджетное учреждение профессионального образования Ханты-Мансийского автономного округа - Югры «Советский политехнический колледж»
Преподаватель Волобоева Марина Анатольевна
Ф.И.О.
РАССМОТРЕНА
на заседании ЦМК
Протокол №__ от «___»_____2014 г.
Председатель _____/Дрокина Л.Н.
ОДОБРЕНА
научно-методическим советом Протокол №____ от «____»___2014 г.
Председатель ________/Куимова Г.Р./
Содержание
стр
1.Общие положения…………………………………………………………………….…………..3
2. Виды самостоятельных работ……………………………………...……………….……….….4
3. Требование к студентам по подготовке и презентации доклада на занятиях химии……….5
4. Порядок сдачи и защиты рефератов……………………………………………………………..6
5. Содержание и оформление разделов реферата……………… ………………………………7
6. Перечень самостоятельных работ по химии……………………… ………………………….8
7. Вывод…………………………………………………………………… ……………………….9
Общие положения
В связи с введением в образовательный процесс нового Государственного образовательного стандарта все более актуальной становится задача организации самостоятельной работы студентов. Самостоятельная работа определяется как индивидуальная или коллективная учебная деятельность, осуществляемая без непосредственного руководства педагога, но по его заданиям и под его контролем. Самостоятельная работа студентов является одной из основных форм внеаудиторной работы при реализации учебных планов и программ. По дисциплине химии практикуется следующие виды и формы самостоятельной работы студентов:
-
Лабораторные и практические работы (по разделам общей и неорганической, органической химии);
-
индивидуальные задания (решение задач, подготовка сообщений, докладов, исследовательские работы и др.);
-
тестирование в учебных компьютерных классах разработанных преподавателем;
-
подготовку к контрольным работам, зачетам и экзаменам.
-
отработку изучаемого материала по печатным и электронным источникам, конспектам лекций;
-
Изучение лекционного материала по конспекту с использованием рекомендованной литературы;
-
подготовка к практическим, лабораторным занятиям;
-
выполнение контрольных, самостоятельных работ;
-
выполнение семестровых индивидуальных заданий;
-
подготовка кратких сообщений, докладов, рефератов, исследовательских работ, самостоятельное составление задач по изучаемой теме (по указанию преподавателя);
-
работа над выполнением наглядных пособий (схем, таблиц и др.);
Самостоятельная работа может проходить в лекционном кабинете, лаборатории химии, во время внеклассных мероприятий, дома.
Целью самостоятельной работы студентов является овладение фундаментальными знаниями, профессиональными умениями и навыками деятельности по профилю, опытом творческой, исследовательской деятельности.
Самостоятельная работа студентов способствует развитию самостоятельности, ответственности и организованности, творческого подхода к решению проблем учебного и профессионального уровня.
Студент в процессе обучения должен не только освоить учебную программу, но и приобрести навыки самостоятельной работы. Студенту предоставляется возможность работать во время учебы более самостоятельно, чем учащимся в средней школе. Студент должен уметь планировать и выполнять свою работу. Удельный вес самостоятельной работы составляет по времени 30% от всего времени изучаемого цикла. Самостоятельная работа студентов является обязательной для каждого студента и определяется учебным планом.
При определении содержания самостоятельной работы студентов следует учитывать уровень самостоятельности абитуриентов и требования к уровню самостоятельности выпускников для того, чтобы за период обучения искомый уровень был достигнут
Для организации самостоятельной работы необходимы следующие условия:готовность студентов к самостоятельному труду; наличие и доступность необходимого учебно-методического и справочного материала; консультационная помощь.
Формы самостоятельной работы студентов определяются при разработке рабочих программ учебных дисциплин содержанием учебной дисциплины, учитывая степень подготовленности студентов.
2. Виды самостоятельных работ
В учебном процессе выделяют два вида самостоятельной работы:
- аудиторная;
- внеаудиторная.
Аудиторная самостоятельная работа по дисциплине выполняется на учебных занятиях под непосредственным руководством преподавателя и по его заданию.
Внеаудиторная самостоятельная работа выполняется студентом по заданию преподавателя, но без его непосредственного участия.
Содержание внеаудиторной самостоятельной определяется в соответствии с рекомендуемыми видами заданий согласно примерной и рабочей программ учебной дисциплины.
Видами заданий для внеаудиторной самостоятельной работы являются:
- для овладения знаниями: чтение текста (учебника, первоисточника, дополнительной литературы), составление плана текста, графическое изображение структуры текста, конспектирование текста, выписки из текста, работа со словарями и справочниками, ознакомление с нормативными документами, учебно-исследовательская работа, использование аудио- и видеозаписей, компьютерной техники и Интернета и др.
- для закрепления и систематизации знаний: работа с конспектом лекции, обработка текста, повторная работа над учебным материалом (учебника, первоисточника, дополнительной литературы, аудио и видеозаписей, составление плана, составление таблиц для систематизации учебною материала, ответ на контрольные вопросы, заполнение рабочей тетради, аналитическая обработка текста (аннотирование, рецензирование, реферирование, конспект-анализ и др), подготовка мультимедиа сообщений/докладов к выступлению на семинаре (конференции), подготовка реферата, составление библиографии, тематических кроссвордов, тестирование и др.
- для формирования умений: решение задач и упражнений по образцу, решение вариативных задач, выполнение чертежей, схем, выполнение расчетов (графических работ), решение ситуационных (профессиональных) задач, подготовка к деловым играм, проектирование и моделирование разных видов и компонентов профессиональной деятельности, опытно экспериментальная работа, рефлексивный анализ профессиональных умений с использованием аудио- и видеотехники и др.
Самостоятельная работа может осуществляться индивидуально или группами студентов в зависимости от цели, объема, конкретной тематики самостоятельной работы, уровня сложности, уровня умений студентов.
Контроль результатов внеаудиторной самостоятельной работы студентов может осуществляться в пределах времени, отведенного на обязательные учебные занятия по дисциплине и внеаудиторную самостоятельную работу студентов по дисциплине, может проходить в письменной, устной или смешанной форме.
Виды внеаудиторной самостоятельные работы студентов по химии:
1. Подготовка и написание рефератов, на заданные темы, причём студенту предоставляется право выбора темы.
2. Самостоятельное решение ситуационных задач с использованием условий из задачников, имеющихся в кабинете, составление задач с представлением эталонов ответов.
3. Подбор и изучение литературных источников, работа с периодической печатью, подготовка тематических обзоров по периодике.
4. Подготовка к участию в научно-практических конференциях как внутри, так и вне колледжа
5. Оформление мультимедийных презентаций учебных разделов и тем, слайдового сопровождения докладов.
6. Подготовка схем, таблиц, кроссвордов, тестовых заданий.
7. Изготовление наглядных пособий, макетов, муляжей.
Чтобы развить положительное отношение студентов к внеаудиторной самостоятельные работы студентов, следует на каждом ее этапе разъяснять цели работы, контролировать понимание этих целей студентами, постепенно формируя у них умение самостоятельной постановки задачи и выбора цели.
3. Требование к студентам по подготовке и презентации доклада на занятиях химии.
1. Доклад-это сообщение по заданной теме, с целью внести знания из дополнительной литературы, систематизировать материл, проиллюстрировать примерами, развивать навыки самостоятельной работы
с научной литературой, познавательный интерес к научному познанию.
2. Тема доклада должна быть согласованна с преподавателем и соответствовать теме занятия.
3. Материалы при его подготовке, должны соответствовать научно-методическим требованиям и быть указанны в докладе.
4. Необходимо соблюдать регламент, оговоренный при получении задания.
5. Иллюстрации должны быть достаточными, но не чрезмерными.
6. Работа студента над докладом-презентацией включает отработку навыков ораторства и умения организовать и проводить диспут.
7. Студент в ходе работы по презентации доклада, отрабатывает умение ориентироваться в материале и отвечать на дополнительные вопросы слушателей.
8. Студент в ходе работы по презентации доклада, отрабатывает умение
самостоятельно обобщить материал и сделать выводы в заключении.
9. Докладом также может стать презентация реферата студента, соответствующая теме занятия.
10. Студент обязан подготовить и выступить с докладом в строго отведенное время преподавателем, и в срок.
Инструкция докладчикам и содокладчикам
Докладчики и содокладчики - основные действующие лица. Они во многом определяют содержание, стиль, активность данного занятия. Сложность в том, что докладчики и содокладчики должны знать и уметь очень многое:
-
сообщать новую информацию
-
использовать технические средства
-
знать и хорошо ориентироваться в теме всей презентации (семинара)
-
уметь дискутировать и быстро отвечать на вопросы
-
четко выполнять установленный регламент: докладчик - 10 мин.; содокладчик - 5 мин.; дискуссия - 10 мин
-
иметь представление о композиционной структуре доклада.
Необходимо помнить, что выступление состоит из трех частей: вступление, основная часть и заключение.
Вступление помогает обеспечить успех выступления по любой тематике. Вступление должно содержать:
- название презентации (доклада)
- сообщение основной идеи
- современную оценку предмета изложения
- краткое перечисление рассматриваемых вопросов
- живую интересную форму изложения
- акцентирование оригинальности подхода
Основная часть, в которой выступающий должен глубоко раскрыть суть затронутой темы, обычно строится по принципу отчета. Задача основной части - представить достаточно данных для того, чтобы слушатели и заинтересовались темой и захотели ознакомиться с материалами. При этом логическая структура теоретического блока не должны даваться без наглядных пособий, аудио-визуальных и визуальных материалов.
Заключение - это ясное четкое обобщение и краткие выводы, которых всегда ждут слушатели.
4. Порядок сдачи и защиты рефератов.
1. Реферат сдается на проверку преподавателю за 1-2 недели до зачетного занятия
2. При оценке реферата преподаватель учитывает
-
качество
-
степень самостоятельности студента и проявленную инициативу
-
связность, логичность и грамотность составления
-
оформление в соответствии с требованиями ГОСТ.
3. Защита тематического реферата может проводиться на выделенном одном занятии в рамках часов учебной дисциплины или конференции или по одному реферату при изучении соответствующей темы, либо по договоренности с преподавателем.
4. Защита реферата студентом предусматривает
-
доклад по реферату не более 5-7 минут
-
ответы на вопросы оппонента.
На защите запрещено чтение текста реферата.
5. Общая оценка за реферат выставляется с учетом оценок за работу, доклад, умение вести дискуссию и ответы на вопросы.
5.Содержание и оформление разделов реферата
Титульный лист. Является первой страницей реферата и заполняется по строго определенным правилам.
В верхнем поле указывается полное наименование учебного заведения.
В среднем поле дается заглавие реферата, которое проводится без слова " тема " и в кавычки не заключается.
Далее, ближе к правому краю титульного листа, указываются фамилия, инициалы студента, написавшего реферат, а также его курс и группа. Немного ниже или слева указываются название кафедры, фамилия и инициалы преподавателя - руководителя работы.
В нижнем поле указывается год написания реферата.
После титульного листа помещают оглавление, в котором приводятся все заголовки работы и указываются страницы, с которых они начинаются. Заголовки оглавления должны точно повторять заголовки в тексте. Сокращать их или давать в другой формулировке и последовательности нельзя.
Все заголовки начинаются с прописной буквы без точки на конце. Последнее слово каждого заголовка соединяют отточием / …………… / с соответствующим ему номером страницы в правом столбце оглавления.
Заголовки одинаковых ступеней рубрикации необходимо располагать друг под другом. Заголовки каждой последующей ступени смещают на три - пять знаков вправо по отношению к заголовкам предыдущей ступени.
Введение. Здесь обычно обосновывается актуальность выбранной темы, цель и содержание реферата, указывается объект / предмет / рассмотрения, приводится характеристика источников для написания работы и краткий обзор имеющейся по данной теме литературы. Актуальность предполагает оценку своевременности и социальной значимости выбранной темы, обзор литературы по теме отражает знакомство автора реферата с имеющимися источниками, умение их систематизировать, критически рассматривать, выделять существенное, определять главное.
Основная часть. Содержание глав этой части должно точно соответствовать теме работы и полностью ее раскрывать. Эти главы должны показать умение исследователя сжато, логично и аргументировано излагать материал, обобщать, анализировать, делать логические выводы.
Заключительная часть. Предполагает последовательное, логически стройное изложение обобщенных выводов по рассматриваемой теме.
Библиографический список использованной литературы составляет одну из частей работы, отражающей самостоятельную творческую работу автора, позволяет судить о степени фундаментальности данного реферата.
В работах используются следующие способы построения библиографических списков: по алфавиту фамилий, авторов или заглавий; по тематике; по видам изданий; по характеру содержания; списки смешанного построения. Литература в списке указывается в алфавитном порядке / более распространенный вариант - фамилии авторов в алфавитном порядке /, после указания фамилии и инициалов автора указывается название литературного источника, место издания / пишется сокращенно, например, Москва - М., Санкт - Петербург - СПб ит.д. /, название издательства / например, Мир /, год издания / например, 1996 /, можно указать страницы / например, с. 54-67 /. Страницы можно указывать прямо в тексте, после указания номера, пода которым литературный источник находится в списке литературы / например, 7 / номер лит. источника/ , с. 67- 89 /. Номер литературного источника указывается после каждого нового отрывка текста из другого литературного источника.
В приложении помещают вспомогательные или дополнительные материалы, которые загромождают текст основной части работы / таблицы, карты, графики, неопубликованные документы, переписка и т.д. /. Каждое приложение должно начинаться с нового листа / страницы / с указанием в правом верхнем углу слова " Приложение" и иметь тематический заголовок. При наличии в работе более одного приложения они нумеруются арабскими цифрами / без знака " № " /, например, " Приложение 1". Нумерация страниц, на которых даются приложения, должна быть сквозной и продолжать общую нумерацию страниц основного текста. Связь основного текста с приложениями осуществляется через ссылки, которые употребляются со словом " смотри " / оно обычно сокращается и заключается вместе с шифром в круглые скобки - (см. прил. 1) /.
6. Перечень самостоятельных работ по химии
№
Наименование темы самостоятельной работы
Рекомендуемая литература
Кол-во часов
Формы выполнения
1
Генетическая связь между классами неорганических соединений. Превращение веществ.
Рудзитис Г.Е. "Химия" 11 кл "Просвещение", 2011
Габриелян О.С. Химия для профессий и специальностей технического профиля: / О.С. Габриелян, И.Г. Остроумов. - М., 2010. .
2
Составление уравнений.
2
Составление электронных электрографических формул атомов Х.Э.
Рудзитис Г.Е. "Химия" 11 кл "Просвещение", 2011
Габриелян О.С. Химия для профессий и специальностей технического профиля: / О.С. Габриелян, И.Г. Остроумов. - М., 2010. ..
2
Составление электронных электрографических формул.
4
Составление уравнений гидролиза солей.
Рудзитис Г.Е. "Химия" 11 кл "Просвещение", 2011
Габриелян О.С. Химия для профессий и специальностей технического профиля: / О.С. Габриелян, И.Г. Остроумов. - М., 2010. ..
2
Составление уравнений.
5
Составление схем электролиза.
Габриелян О.С. Химия для профессий и специальностей технического профиля: / О.С. Габриелян, И.Г. Остроумов. - М., 2010. ..
2
Составление уравнений.
6
Создание презентации: «Аморфные вещества в природе, технике, быту».(на выбор)
Рудзитис Г.Е. "Химия" 10 кл "Просвещение", 2011
Рудзитис Г.Е. "Химия" 11 кл "Просвещение", 2011
Габриелян О.С. Химия для профессий и специальностей технического профиля: / О.С. Габриелян, И.Г. Остроумов. - М., 2010.
2
Сообщение
7
Решение задач: определение массовой доли выхода продукта в % от теоретически возможного».
Рудзитис Г.Е. "Химия" 11 кл "Просвещение", 2011
Габриелян О.С. Химия для профессий и специальностей технического профиля: / О.С. Габриелян, И.Г. Остроумов. - М., 2010.
2
Решение задач
8
Сообщение «Коррозия металлов и способы защиты от коррозии».
Издания журнала « Химия и жизнь.
2
9
Решение задач.
Рудзитис Г.Е. "Химия" 10 кл "Просвещение", 2011
Рудзитис Г.Е. "Химия" 11 кл "Просвещение", 2011
Габриелян О.С. Химия для профессий и специальностей технического профиля: / О.С. Габриелян, И.Г. Остроумов. - М., 2010.
2
Решение задач.
11
Генетическая связь по теме: Непредельные УВ.
Рудзитис Г.Е. "Химия" 10 кл "Просвещение", 2011
Габриелян О.С. Химия для профессий и специальностей технического профиля: / О.С. Габриелян, И.Г. Остроумов. - М., 2010.
2
Составление уравнений
12
Генетическая связь превращения У.В.
Рудзитис Г.Е. "Химия" 10 кл "Просвещение", 2011
Габриелян О.С. Химия для профессий и специальностей технического профиля: / О.С. Габриелян, И.Г. Остроумов. - М., 2010.
2
Составление уравнений
13
"О вреде алкоголя".
Издания журнала
«Химия и жизнь»
2
Сообщение
РАЗДЕЛ 1. ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ
Тема 1.1. Основные понятия и законы химии
Типовые примеры решения задач
Пример 1. Вычислите относительную молекулярную массу серной кислоты, химическая формула которой Н2SO4.
Решение. Для вычисления относительной молекулярной массы необходимо суммировать относительные атомные массы элементов (их взять из периодической таблицы Д.И.Менделеева), образующих соединение с учетом числа атомов:
Мr (Н2SO4) = 1×2+32+16×4=98
Ответ: Мr (Н2SO4) =98
Пример 2. Вычислите массовую долю кислорода в веществе, формула которого SО3.
Решение. Массовая доля элемента в веществе (w) показывает, какую часть относительной молекулярной массы вещества составляет относительная атомная масса элемента, умноженная на индекс (n) при знаке элемента в формуле. Массовая доля - величина безразмерная. Выражается в долях от единицы или в процентах.
-
Вычисляем относительную молекулярную массу SО3:
Мr (SO3) = 32+16×3=80
-
Вычисляем массовую долю кислорода.
Относительная атомная масса кислорода из периодической таблицы Д.И.Менделеева Аr(О) =16
Составим пропорцию: Мr (SO3) 80 - 100%
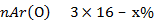
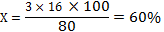
w(О)=60%
Ответ: w(О)=60%
Пример 3. Какое количество вещества оксида меди (II) содержится в 120 г его массы?
Решение. Используем формулу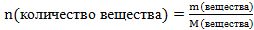 ,
,
где n- количество вещества;
m- масса вещества;
М - молярная масса вещества, численно равна относительной молекулярной массе
-
Относительная молекулярная масса Мr(СuО)=64+16=80, следовательно, молярная масса
М (СuО)=80г/моль.
-
Пользуясь соотношением
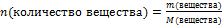
находим количество вещества: n(СuО)= 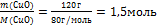
Ответ: n(СuО)= 1,5 моль
Пример 4. Определите массу гидроксида натрия количеством вещества 2 моль.
Решение. Используем формулу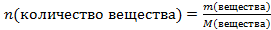 , находим
, находим
-
Молярная масса М(NаOH)= 23+16+1=40г/моль.
-
m=nM
-
m(NаOH)= 2
 40г/моль=80г.
40г/моль=80г.
Ответ: m(NаOH)=80 г.
Пример 5. Какой объем занимает 4 моль углекислого газа СО2.
Решение. Используем формулу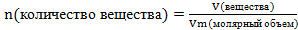 , где Vm=22,4 л/моль
, где Vm=22,4 л/моль
-
V(СО2)=n(CO2)
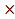 Vm= 4
Vm= 4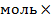 22,4л/моль= 89,6л.
22,4л/моль= 89,6л.
Ответ: V(СО2)=89,6 л
Пример 6. Вычислите массу осадка, полученного действием раствора, содержащего 8г гидроксида натрия с раствором сульфата меди(II).
Последовательность действий
Пример выполнения действий
1.Запишите условие и требование задачи с помощью общепринятых обозначений
Дано:
m(NаOH)=8г
Найти:
m(Cu(OH)2)-?
2.Составьте уравнение химической реакции
Решение:
CuSO4+2 NаOH= Cu(OH)2+Na2SO4
3.В уравнении подчеркните формулы веществ, которые записаны в «Дано» и «Найти»
CuSO4+2 NаOH= Cu(OH)2+Na2SO4
-
Под подчеркнутыми формулами подписать по коэффициентам «моли»
CuSO4+2 NаOH=Cu(OH)2+Na2SO4
2 моль 1 моль
-
Вычислите количество вещества n, которое записано в «Дано»
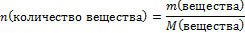
n(NаOH) =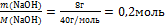
-
Подпишите найденное n под формулой этого вещества
CuSO4+2 NаOH= Cu(OH)2+Na2SO4
2 моль 1 моль
0,2 моль
-
Под формулой вещества, массу которого надо найти, поставьте х моль
CuSO4+2 NаOH= Cu(OH)2+Na2SO4
2 моль 1 моль
0,2 моль х моль
-
Из полученной пропорции выразите х
2 моль 1 моль
0,2 моль х моль
х =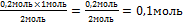 -
-
это количество вещества n( Cu(OH)2)
-
Зная n(Cu(OH)2) найдите массу Cu(OH)2
m=nM
m(Cu(OH)2)= n Cu(OH)2 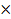 M Cu(OH)2
M Cu(OH)2
M Cu(OH)2 =64+(16+1)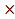 2=98г/моль
2=98г/моль
m(Cu(OH)2)=0,1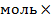 98г/моль=9,8г
98г/моль=9,8г
-
Запишите ответ
Ответ: m(Cu(OH)2)=9,8г
Контрольные задания
Подготовьте сообщения
-
Аллотропные модификации углерода (алмаз, графит), кислорода (кислород, озон), олова (серое и белое олово). (Указание: в сообщении написать о физических свойствах указанных модификаций и их применении, материал можно оформить в виде таблицы).
-
Понятие о химической технологии, биотехнологии и нанотехнологии. (Указание: в сообщении отразить их суть, т.е дать определение и привести конкретные примеры применения).
Решите задачи
ВНИМАНИЕ! Условие задач необходимо списывать.
Задача 1. Вычислите относительную молекулярную массу….
-
Азотной кислоты
-
Оксида алюминия
-
Гидроксида железа (III)
-
Сульфата бария
-
Гидроксида алюминия
-
Угольной кислоты
-
Соляной кислоты
-
Карбоната натрия
-
Оксида калия
-
Хлорида железа (II)
-
Фосфорной кислоты
-
Сульфата натрия
-
Оксида серы (IV)
-
Нитрата бария
-
Сульфата меди (II)
-
Аммиака
-
Карбоната кальция
-
Оксида фосфора (V)
-
Гидроксида кальция
-
Оксида серебра
-
Нитрата магния
-
Гидроксида магния
-
Карбоната бария
-
Сульфата калия
-
Оксида меди (II)
-
Нитрата натрия
-
Хлорида цинка
-
Нитрата серебра
-
Оксида магния
-
Фосфата алюминия
-
Сульфида натрия
-
Гидроксида цинка
-
Хлорида железа (III)
-
Хлорида бария
Чему равна молярная масса вещества из вашего варианта?
Задача 2. Расчитайте массовую долю (%) для первого элемента в веществе ….
-
СО2
-
Н2S
-
NH3
-
Н3РО4
-
СН4
-
Н2О
-
Na2SO4
-
Na2S
-
HNO3
-
HBr
-
С2Н4
-
СаF2
-
К2СО3
-
SO2
-
Ag2O
-
NO2
-
C2H6
-
HF
-
Nа3РО4
-
Н2СО3
-
CuO
-
Ag2O
-
Ва(ОН)2
-
СаО
-
N2O5
-
ZnO
-
K2SO3
-
CO
-
Fe2O3
-
HCl
-
Al2O3
-
H2SiO3
-
K2О
-
KOH
Задача 3.
-
Юный радиотехник при травлении омедненной платы опустил ее в раствор хлорида железа (III).Какая масса меди перейдет в раствор, если в результате реакции, идущей согласно уравнению 2FeCl3 + Сu = 2FeCl2 + СuСl2, выделилось 1,35г хлорида меди(II).
-
Какое количество вещества (n) воды можно получить, если сжечь 3 моль газа водорода.
-
Какой объем кислорода (н.у.) потребуется для сжигания 2,4г магния?
-
Сколько литров водорода (н.у.)можно получить при действии избытка разбавленной серной кислоты на цинк массой 24г?
-
Сколько граммов гидроксида калия потребуется для взаимодействия с 70г серной кислоты?
-
4,6г натрия растворили в воде с образованием щелочи и водорода. Вычислите объем газа (н.у).
-
Какова масса соли, получившейся при взаимодействии оксида кальция массой 28 г с соляной кислотой?
-
Сколько литров оксида углерода (IV) (н.у.) можно получить при прокаливании известняка СаСО3, массой 200г?
-
При растворении цинка в соляной кислоте выделился газ объемом 6,72л. Вычислите массу растворившегося цинка.
-
Сколько граммов серной кислоты прореагирует с цинком, если получается 4 моль сульфата цинка?
-
Сколько литров водорода (н.у.) сгорело, если образовалось 72 г воды?
-
Сколько граммов сульфата цинка можно получить, имея 0,5 моль серной кислоты взаимодействующей с цинком?
Тема 1.2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева и строение атома
Контрольные задания
Подготовьте конспект:
-
Рентгеновское излучение и его использование в технике и медицине. (Указание: в сообщении дать понятие рентгеновскому излучению и привести несколько примеров по его использованию).
-
Моделирование как метод прогнозирования ситуации на производстве.( Указание: в сообщении приведите любой пример моделирования ситуации на производстве)
Тема 1.3. Строение вещества
Типовой пример решения задачи
Задача. Какую массу оксида кальция можно получить при термическом разложении 600 г известняка, содержащего 10% примесей?
Последовательность действий
Пример выполнения действий
1.Запишите условие и требование задачи с помощью общепринятых обозначений
Дано:
m(СаСО3)=600г
W(примесей)=10%
Найти:
m(CаO)-?
2.Составьте уравнение химической реакции
Решение:
СаСО3 = СаО+СО2
3.В уравнении подчеркните формулы веществ, которые записаны в «Дано» и «Найти»
СаСО3 = СаО+СО2
4.Найдите массу чистого вещества (освободиться от примесей)
600г - 100%
Х г - 10% Х=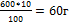 - масса примесей,
- масса примесей,
Тогда масса чистого СаСО3 равна 600-60=540г
5.Под подчеркнутыми формулами подпишите по коэффициентам «моли»
СаСО3 = СаО+СО2
1 моль 1 моль
6.Вычислите количество вещества n, которое записано в «Дано». Для расчета берите уже массу чистого вещества
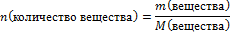
n(СаСО3) =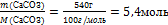
7.Подпишите найденное n под формулой этого вещества
СаСО3 = СаО+СО2
1 моль 1 моль
5,4 моль
8.Под формулой вещества, массу которого надо найти, поставьте х моль
СаСО3 = СаО+СО2
1 моль 1 моль
5,4 моль х моль
9.Из полученной пропорции выразите х
1 моль 1 моль
5,4 моль х моль
х =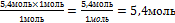 -
-
это количество вещества n(СаО)
10.Зная n( CаО) найдите массу CаO
m=nM
m(CаO)= n (CаO)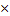 M (СаО)
M (СаО)
M (CаО)=40+16=56г/моль
m(СаО)=5,4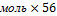 г/моль=302,4г
г/моль=302,4г
11.Запишите ответ
Ответ: m(СаО)=302,4г
Контрольные задания
Подготовьте сообщения
-
Аморфные вещества в природе, технике, быту. (Указание: дать определение этим понятиям).
-
Конденсация. Текучесть. Возгонка. Кристаллизация. Сублимация и десублимация. (Указание: дать определение этим понятиям).
-
Аномалии физических свойств воды. (Указание: конкретно какие?).
-
Жидкие кристаллы. Приборы на жидких кристаллах. (Указание: понятие жидких кристаллов и несколько примеров конкретных приборов на жидких кристаллах).
-
Минералы и горные породы как природные смеси. (Указание: любые конкретные примеры минералов и горных пород и их состав).
-
Эмульсии и суспензии. Золи (в том числе аэрозоли) и гели. Коагуляция. Синерезис. (Указание: дать определение этим понятиям).
Решите задачи
ВНИМАНИЕ! Условие задач необходимо списывать.
Задача 1.
-
Какой объем (н.у.) углекислого газа можно получить при термическом разложении 200 г известняка СаСО3, содержащего 20% примесей?
-
Какая масса СаО образуется при обжиге 400 кг известняка СаСО3, содержащего 6% примесей?
-
Какой объём (л) оксида углерода (IV) (н.у.) получится при обжиге 500 г известняка СаСО3, содержащего 8% примесей.
-
Какой объем оксида углерода (IV) (н.у.) выделится при сжигании 500 г угля С, содержащего 8% негорючих примесей?
-
Какой объем оксида углерода( IV) (н.у.) можно получить при взаимодействии с избытком соляной кислоты 60 г известняка, содержащего 25%примесей?
-
Какой объем углекислого газа выделится при сжигании 500 г угля, содержащего 8% негорючих примесей?
-
100 г оксида кальция, содержащего 3% примесей обработали азотной кислотой. Какая масса соли при этом образовалась?
-
Сколько граммов гидроксида калия потребуется для взаимодействия с 70г серной кислоты, содержащей 4% примесей ?
-
Какой объем кислорода (н.у.) потребуется для сжигания 60г магния, содержащего 15% примесей?
-
Сколько граммов водорода можно получить при взаимодействии цинка массой 54г, содержащего 2% примесей с соляной кислотой?
-
Сколько литров водорода (н.у.) выделится при разложении электрическим током воды массой 72 г, содержащей 2% примесей?
-
Вычислите массу осадка, полученного действием серной кислоты на раствор хлорида бария массой 80г, содержащего 6% примесей.
-
Какое количество вещества (моль) водорода выделится при взаимодействии магния массой 140 г, содержащего 18% примесей с соляной кислотой?
-
Какова масса нитрата меди, образующегося при взаимодействии оксида меди(II) массой 40г, содержащего 8% примесей с азотной кислотой?
-
Какое количество вещества (n) воды можно получить, если сжечь 60 г газа водорода, содержащего 4% примесей?
Тема 1.4. Вода. Растворы. Электролитическая диссоциация
Типовой пример решения задачи
Задача. Определите массовую долю (в %) КОН в растворе, если КОН массой 40 г растворен в воде массой 160 г.
Последовательность действий
Пример выполнения действий
1.Запишите условие и требование задачи с помощью общепринятых обозначений
Дано:
m(КОН)=40 г
m(воды)=160 г
Найти:
W (КОН)-?
2. Запишите формулу нахождения массовой доли вещества в растворе
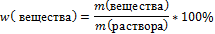
3.Вычислите общую массу раствора
m(раствора)=m(КОН)+m(Н2О)
m(раствора)=40+160=200г
4.Подставьте известные величины в формулу
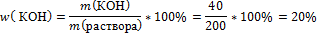
5.Запишите ответ
Ответ: 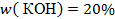
Решите задачи
ВНИМАНИЕ! Условие задач необходимо списывать.
Задача 1.
-
Имеется раствор хлорида натрия массой 250 г, в котором содержится 50 г хлорида натрия. Вычислите массовую долю соли в этом растворе.
-
Сколько граммов гидроксида натрия содержится в 150 г раствора с массовой долей гидроксида натрия в нём 6%?
-
Сахар массой 90 г растворили в 500 г воды. Вычислите массовую долю сахара в получившемся растворе.
-
При выпаривании 50 г раствора нитрата калия получили твердый остаток этой соли массой 0,5 г. Вычислите массовую долю нитрата калия в данном растворе.
-
В 190 г воды растворили 10 г сахара. Какова массовая доля сахара в этом растворе?
-
Какова масса серной кислоты, содержащейся в 200 г 7%-ного ее раствора.
-
Какая масса для приготовления 5%-ного раствора хлорида натрия массой 120 г потребуется соли.
-
Приготовлен 10%-ный раствор хлорида кальция. Вычислите массы воды и хлорида кальция, содержащиеся в 200 г такого раствора.
-
Дано 200 г 20%-ного раствора гидроксида натрия. Вычислите массу щелочи и воды в данном растворе.
-
Для полоскания горла используют 2%-ный раствор гидрокарбоната натрия (пищевой соды.) Вычислите массы соды и воды, которые потребуются для приготовления 50 г такого раствора?
-
Дано 400 г 16%-ного раствора сульфата меди(II).Вычислите массу этой соли и воды в данном растворе.
-
Определите массовую долю (в %) КОН в растворе, если КОН массой 40 г растворен в воде массой 160 г.
-
Приготовлен 20%-ный раствор хлорида магния. Вычислите массы воды и хлорида магния, содержащиеся в 200 г такого раствора.
-
Имеется раствор хлорида калия массой 250 г, в котором содержится 50 г хлорида калия. Вычислите массовую долю соли в этом растворе.
-
Имеется 10%-ный раствор азотной кислоты. Вычислите массу кислоты, содержащейся в 100 г такого раствора.
Тема 1.5. Классификация неорганических соединений и их свойства
Типовой пример решения задачи
Задача. Какая масса воды образуется при взаимодействии серной кислоты со 100 г 10%-ного раствора гидроксида натрия?
Последовательность действий
Пример выполнения действий
1.Запишите условие и требование задачи с помощью общепринятых обозначений
Дано:
Mр-ра(NаОН)=100г
W(NаОН)=10%
Найти:
m(Н2О)-?
2.Составьте уравнение химической реакции
Решение:
2NаОН + Н2SO4 = Nа2SO4+2Н2О
3.В уравнении подчеркните формулы веществ, которые записаны в «Дано» и «Найти»
2NаОН + Н2SO4 = Nа2SO4+2Н2О
4.Найдите массу NаОН в растворе
100г - 100%
Х г - 10% Х=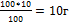 - масса NаОН
- масса NаОН
5.Под подчеркнутыми формулами подписать по коэффициентам «моли»
2NаОН + Н2SO4 = Nа2SO4+2Н2О
2 моль 2 моль
6.Вычислите количество вещества n, которое записано в «Дано».
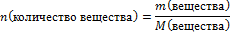
n(NаОН) =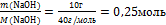
7.Подпишите найденное n под формулой этого вещества
2NаОН + Н2SO4 = Nа2SO4+2Н2О
2 моль 2 моль
0,25 моль
8.Под формулой вещества, массу которого надо найти, поставьте х моль
2NаОН + Н2SO4 = Nа2SO4+2Н2О
2 моль 2 моль
0,25 моль х моль
9.Из полученной пропорции выразите х
2 моль 2 моль
0,25 моль х моль
х =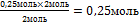 -
-
это количество вещества n(Н2О)
10.Зная n(Н2О) найдите массу Н2О
m=nM
m (Н2О)= n (Н2О)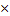 M (Н2О)
M (Н2О)
M (Н2О)=1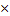 2+16=18г/моль
2+16=18г/моль
m(Н2О)=0,25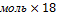 г/моль=4,5г
г/моль=4,5г
11.Запишите ответ
Ответ: m(Н2О)=4,5г
Решите задачи
ВНИМАНИЕ! Условие задач необходимо списывать.
Задача 1.
-
Какой объем газа (н.у.) выделится, если к раствору карбоната натрия, прилить 400 г азотной кислоты с массовой долей кислоты 20%?
-
Определите массу осадка, которая образуется при сливании 15 г 5%-ного раствора хлорида бария с раствором сульфата бария.
-
Какая масса нитрата цинка образуется при взаимодействии оксида цинка со 100 г 10%-ного раствора азотной кислоты?
-
Слили 40 г 10%-ного раствора серной кислоты с раствором нитрата бария. Рассчитайте массу образовавшегося осадка.
-
Рассчитайте массу сульфата бария, образующегося при взаимодействии
200 г 7%-ного раствора серной кислоты с раствором хлорида бария.
-
Определите массу осадка, которая образуется при сливании хлорида бария с 10г 8%-ного раствора сульфата натрия.
-
Какова масса осадка, образующегося при сливании 200г 20%-ного раствора гидроксида натрия с раствором сульфата меди (II) ?
-
Какой объем газа (н.у) выделится при сливании 150 г 30%-ной соляной кислоты с раствором карбоната калия?
-
К 400 г 5%-ного раствора сульфата железа (II) прилили раствор гидроксида натрия. Вычислите массу образовавшегося осадка.
-
Какая масса соляной кислоты потребуется для полной нейтрализации 60 г 2% раствора гидроксида натрия?
-
Какой объем газа (н.у.) выделится, если к 100 г 20 %- ного раствора карбоната калия, прилить азотную кислоту?
-
К раствору сульфата железа (II) прилили 200 г 3%-ного раствора гидроксида натрия. Вычислите массу образовавшегося осадка.
-
Определите массу соли полученную при взаимодействии 300г 30%-ного раствора азотной кислоты с гидроксидом калия.
-
Определите массу осадка, которая образуется при сливании 20 г 5%-ного раствора хлорида алюминия с раствором гидроксида натрия.
-
Какая масса нитрата магния образуется при взаимодействии оксида магния с 200 г 20%-ного раствора азотной кислоты?
-
Слили 60 г 10%-ного раствора сульфата натрия с раствором нитрата бария. Рассчитайте массу образовавшегося осадка.
Тема 1.6. Химические реакции
Типовые примеры решения задач
Задача 1. Какое количество теплоты выделится при сгорании в кислороде 12 г водорода. Термохимическое уравнение горения водорода:
2Н2 + О2 → 2Н2О + 571,6 кДж
Последовательность действий
Пример выполнения действий
1.Запишите условие и требование задачи с помощью общепринятых обозначений
Дано:
m(Н2)=12 г
Найти:
Q - ?
2.Составьте уравнение химической реакции.
Решение:
2Н2 + O2 = 2Н2О+ 571,6 кДж
3.В уравнении подчеркните, что записано в «Дано»
2Н2 + O2 = 2Н2О+ 571,6 кДж
4.Под подчеркнутой формулой подпишите число моль:
2Н2 + O2 = 2Н2О+ 571,6 кДж
2 моль
5.Вычислите количество вещества n, которое записано в «Дано».
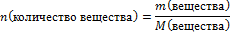
n(Н2) =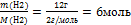
6.Подпишите найденное n под формулой этого вещества
2Н2 + O2 = 2Н2О+ 571,6 кДж
2 моль
6 моль
7.Составьте пропорцию:
при сгорании 2 моль выделится 571,6 кДж теплоты
при сгорании 6 моль выделится х кДж теплоты
8.Из полученной пропорции выразите х
1 моль 571,6 кДж
6 моль х кДж
х =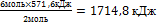 - это Q
- это Q
9. Запишите ответ
Q=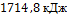
Задача 2. Составьте термохимическое уравнение, если известно, что при сгорании
1 г магния выделяется 25,6 кДж теплоты.
Последовательность действий
Пример выполнения действий
1.Запишите условие и требование задачи с помощью общепринятых обозначений
Дано:
m(Мg)=1 г
Q=25,6 кДж
Найти:
Q' - ?
2. Чтобы составить термохимическое уравнение реакции, нужно вычислить тепловой эффект реакции, написать уравнение горения магния и указать в нем значение этой величины.
3.Составьте уравнение химической реакции.
Решение:
2Мg + O2 = 2МgО
4.При анализе условия и уравнения горения магния делают вывод, что, для того чтобы найти тепловой эффект реакции, нужно вычислить количество теплоты, которое выделится при сгорании 2 моль
5.В уравнении подчеркните, что записано в «Дано»
2Мg + O2= 2МgО
6.Под подчеркнутой формулой подпишите число моль:
2Мg + O2= 2МgО
2 моль
7.Вычислите количество вещества n, которое записано в «Дано».
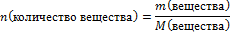
n(Мg) =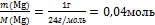
8.Подпишите найденное n под формулой этого вещества
2Мg + O2= 2МgО
2 моль
0,04 моль
9.Составьте пропорцию:
при сгорании 0,04 моль магния выделится 25,6 кДж теплоты
при сгорании 2 моль магния выделится х кДж теплоты
10.Из полученной пропорции выразить х
0,04 моль 25,6 кДж
2 моль х кДж
х =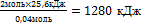
11. Запишите ответ
2Мg + O2= 2МgО + 1280 кДж
Задача 3. На гидроксид натрия, взятый в необходимом количестве, подействовали раствором, содержащим 252 г азотной кислоты. Вычислите массу полученной соли, если практический выход составляет 90 % от теоретического.
Количество продукта, рассчитанное по уравнению, является максимально возможным значением (теоретическое значение,mтеор). На практике из-за потерь обычно получают меньшее количество (практическое значение,mпракт.,mпракт < mтеор).
Практический выход продукта определяется отношением его практического количества к теоретическому: ᶮ =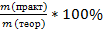
При получении продукта в газообразном или жидком состоянии часто определяют отношение не масс, а объемов готового вещества. В этом случае вычисляют объемную долю выхода продукта: ᶮ=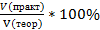
Последовательность действий
Пример выполнения действий
1.Запишите условие и требование задачи с помощью общепринятых обозначений
Дано:
m(НNО3)=252 г
ᶮ(соли)=90%
Найти:
m(соли)-?
2.Составьте уравнение химической реакции.
Рассчитайте массу соли по уравнению - это теоретическая масса соли
Решение:
NаОН + НNO3 = NаNO3+Н2О
3.В уравнении подчеркните формулы веществ, которые записаны в «Дано» и «Найти»
NаОН + НNO3= NаNO3+Н2О
5.Под подчеркнутыми формулами подпишите по коэффициентам число моль
NаОН + НNO3= NаNO3+Н2О
1 моль 1 моль
6.Вычислите количество вещества n, которое записано в «Дано».
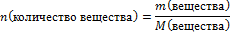
n(НNO3) =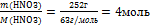
7.Подпишите найденное n под формулой этого вещества
NаОН + НNO3= NаNO3+Н2О
1 моль 1 моль
4 моль
8.Под формулой вещества, массу которого надо найти, поставьте х моль
NаОН + НNO3= NаNO3+Н2О
1 моль 1 моль
4 моль х моль
9.Из полученной пропорции выразите х
1 моль 1 моль
4 моль х моль
х =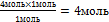 -
-
это количество вещества n(NаNO3)
10.Зная n(NаNO3) найдите массу NаNO3
m=nM
m (NаNO3)= n (NаNO3)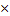 M (NаNO3)
M (NаNO3)
M (NаNO3=23+ 14+16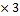 =85г/моль
=85г/моль
m(NаNO3)=4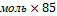 г/моль=340г - теоретическая масса соли
г/моль=340г - теоретическая масса соли
11.Вычислите практическую массу полученной соли
340 г - 100%
Х г - 90%
х =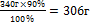 - практическая масса NаNO3
- практическая масса NаNO3
11.Запишите ответ
Ответ: m (NаNO3) =306 г
Решите задачи
ВНИМАНИЕ! Условие задач необходимо списывать.
Задача 1.
-
При соединении 4,2 г железа с серой выделилась теплота, соответствующая 7,15 кДж. Составьте термохимическое уравнение этой реакции.
-
Термохимическое уравнение реакции разложения известняка:
СаСО3→ СаO+СО2 - 157 кДж. Какое количество теплоты затрачивается на разложение 20 г известняка?
-
При сжигании 6,5 г цинка выделилась теплота, соответствующая 34,8 кДж. Составьте термохимическое уравнение этой реакции.
-
Термохимическое уравнение реакции горения фосфора:4Р+5О2→2Р2О5 +3010 кДж. Сколько теплоты выделится при сгорании 31 г фосфора?
-
При соединении 18 г алюминия с кислородом выделяется 547 кДж теплоты. Составьте термохимическое уравнение этой реакции.
-
Термохимическое уравнение реакции оксида меди (II) с соляной кислотой:
СuО + 2НСl→ СuCl2+Н2О +63,6 кДж. Какое количество теплоты выделится при растворении 200 г оксида меди с соляной кислотой?
-
Путем сжигания серы получено 32 г оксида серы (IV), причем выделилась теплота, соответствующая 146,3 кДж. Составьте термохимическое уравнение этой реакции.
-
Термохимическое уравнение реакции горения метана:
СН4 + 2О2→ СО2+2Н2О+878 кДж. Какое количество теплоты выделится при сгорании 4,48 л (н.у.) метана?
-
При сжигании 6,08 г магния выделилась теплота, соответствующая 152,5 кДж. Составьте термохимическое уравнение образования оксида магния.
Тема 1.7. Металлы и неметаллы
Типовой пример решения задачи
Задача. Вычислите массу осадка, полученного действием раствора, содержащего
8 г сульфата меди (II), на раствор, содержащий 10 г гидроксида натрия.
Количества, массы и объемы (для газов) реагентов не всегда берутся стехиометрическими, т.е. в соответствии с уравнением реакции и расчетным уравнением.
Чаще один реагент берется в избытке, а следовательно, другой реагент окажется в недостатке. Избыток реагента вступать в реакцию не будет.
Расчет получаемых количеств, масс и объемов (для газов) продуктов проводят только по реагенту в недостатке.
Последовательность действий
Пример выполнения действий
1.Запишите условие и требование задачи с помощью общепринятых обозначений
Дано:
m(СuSO4)=8г
m(NaOH)=10г
Найти:
m(Cu(OН)2)-?
2.Составьте уравнение химической реакции
Решение:
СuSO4 + 2NaOH = Cu(OН)2 + Na2SO4
3.В уравнении подчеркните формулы веществ, которые записаны в «Дано» и «Найти»
СuSO4 + 2NaOH = Cu(OН)2 + Na2SO4
4.Под подчеркнутыми формулами подпишите по коэффициентам число моль
СuSO4+ 2NaOH = Cu(OН)2+ Na2SO4
1 моль 2 моль 1 моль
5.Под формулой вещества, массу которого надо найти поставьте х моль
СuSO4+ 2NaOH = Cu(OН)2+ Na2SO4
1 моль 2 моль 1 моль
х моль
6.Вычислите количество веществ n, которые записаны в «Дано».
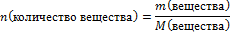
n(СuSO4) =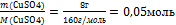 - то, что есть по условию задачи
- то, что есть по условию задачи
n(NaOH) =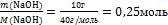 - то, что есть по условию задачи
- то, что есть по условию задачи
7.Подпишите найденное n под формулами этих веществ
СuSO4+ 2NaOH = Cu(OН)2+ Na2SO4
1 моль 2 моль 1 моль
0,05 моль 0,25 моль х моль
8. Найдите, какое из исходных веществ СuSO4или NaOH взято в избытке, составив пропорцию (х можно подставить или под СuSO4или NaOH)
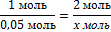
Х=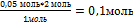 - должно быть NaOH, а его 0,25 моль, значит NaOH дан в избытке. Далее расчет ведем по недостатку, т.е по СuSO4.
- должно быть NaOH, а его 0,25 моль, значит NaOH дан в избытке. Далее расчет ведем по недостатку, т.е по СuSO4.
9.Выразите х уже через СuSO4.
СuSO4+ 2NaOH = Cu(OН)2+ Na2SO4
1 моль 2 моль 1 моль
0,05 моль 0,25 моль х моль
10.Из полученной пропорции выразите х
1 моль 1 моль
0,05 моль х моль
х =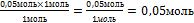 -
-
это количество вещества n(Cu(OН)2)
11.Зная n(Cu(OН)2) найдите массу Cu(OН)2
m=nM
m(Cu(OН)2)= n (Cu(OН)2)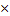 M (Cu(OН)2)
M (Cu(OН)2)
M (Cu(OН)2)=64+17 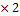 =98г/моль
=98г/моль
m(Cu(OН)2)=0,05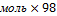 г/моль=4,9г
г/моль=4,9г
12.Запишите ответ
Ответ: m(Cu(OН)2)=4,9г
Контрольные задания
Решите задачи
ВНИМАНИЕ! Условие задач необходимо списывать.
-
Рассчитайте массу осадка, которая образуется при сливании растворов, один из которых содержит 260 г нитрата бария, а второй 220 г сульфата калия.
-
К раствору, в котором находится 42,6 г нитрата алюминия, прилили раствор, содержащий 16 г гидроксида натрия. Рассчитайте массу образовавшегося осадка.
-
Какой объём газа (н.у.) выделяется, если к раствору, содержащему 53 г карбоната натрия, прилить раствор, содержащий 80 г азотной кислоты?
-
Рассчитайте, какая масса нитрата магния получится при взаимодействии 20 г оксида магния с раствором, содержащим 94,5 г азотной кислоты.
-
К раствору, содержащему 40 г сульфата меди (II) прибавили 12 г железных опилок. Рассчитайте массу выделившейся меди.
-
Определите массу осадка, которая образуется при сливании раствора, содержащего 0,75 г хлорида бария и раствора, содержащего 0,8 г сульфата натрия.
-
К раствору, в котором находится 20 г сульфата железа (III) прилили раствор, содержащий 6г гидроксида натрия. Вычислить массу образовавшегося осадка.
-
К раствору, содержащему 16 г сульфата меди (II), прибавили 12 г железных опилок. Какая масса меди выделится при этом?
-
Какова масса осадка, образующегося при сливании раствора содержащего 40 г гидроксида натрия с раствором, содержащим 3 моль сульфата меди (II)?
-
Какой объём газа(н.у.) выделится при сливании раствора, содержащего 45 г соляной кислоты с раствором карбоната натрия, содержащим 0,5 моль этой соли?
РАЗДЕЛ 2. ОРГАНИЧЕСКАЯ ХИМИЯ
Тема 2.2. Углеводороды и их природные источники
Типовой пример решения задачи
Задача. Относительная плотность органического вещества по водороду равна 27. Вещество содержит 89% углерода и 11% водорода. Определите формулу вещества.
Последовательность действий
Пример выполнения действий
1.Запишите условие и требование задачи с помощью общепринятых обозначений
Дано:
W(С)=89%
W(Н)= 11%
dН2(в-ва)= 27
Найти:
СхНу
2.Запишите формулу вычисления массовой доли элемента в веществе
Решение:
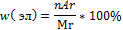
Где n-число атомов элемента в веществе;
Ar - относительная атомная масса элемента;
Мr - молярная масса вещества
3. Запишите формулу вычисления молярной массы вещества через относительную плотность газов
Мr(вещества) = D(газа) • Mr(газа)
-
Вычислите молярную массу вещества
Мr= dН2×М(Н2)
Мr(вещества)= 27×2=54
5.Подставьте все значения в формулу
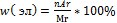 и найдите n углерода и водорода
и найдите n углерода и водорода
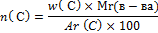
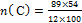 =4
=4
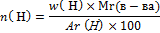
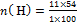 =6
=6
6.Запишите ответ
Ответ: С4Н6
Контрольные задания
Подготовьте сообщения
-
Реакция полимеризации винилхлорида. Поливинилхлорид и его применение.(Указание: написать уравнение реакции полимеризации винилхлорида, физические свойства поливинилхлорида, его применение).
-
Тримеризация ацетилена в бензол. Понятие об экстракции. Восстановление нитробензола в анилин. Гомологический ряд аренов
-
Толуол. Нитрование толуола. Тротил.
-
Основные направления промышленной переработки природного газа.
-
Попутный нефтяной газ, его переработка.
-
Процессы промышленной переработки нефти: крекинг, риформинг.
-
Октановое число бензинов и цетановое число дизельного топлива.
-
Коксохимическое производство и его продукция.
Решите задачи
ВНИМАНИЕ! Условие задач необходимо списывать.
Задача 1.
-
Выведите молекулярную формулу вещества, содержащего 85,7 % углерода и 14,3% водорода. Плотность паров по водороду равна 21.
-
Определите молекулярную формулу газообразного вещества, если его плотность по воздуху равна 2, а массовая доля углерода 82,76% и водорода 17,24%.
-
Найти молекулярную формулу газообразного вещества, содержащего 93,75% углерода и 6,25% водорода, если плотность этого вещества по воздуху равна 4,41.
-
Найдите молекулярную формулу углеводорода, массовая доля углерода в котором составляет 80%, относительная плотность вещества по водороду равна 15.
-
Найдите молекулярную формулу алкена, массовая доля водорода в котором составляет 14,3%, относительная плотность этого вещества по водороду равна 21.
-
Найдите молекулярную формулу углеводорода, содержащего 82,8% углерода и 17,2% водорода. Относительная плотность вещества по воздуху равна 2.
-
Найдите молекулярную формулу углеводорода, массовая доля углерода в котором составляет 75%, относительная плотность углеводорода по азоту равна 0,572.
-
Найдите молекулярную формулу углеводорода, содержащего 15,79 % водорода. Относительная плотность паров этого вещества по воздуху равна 3,93.
-
Найдите молекулярную формулу углеводорода, массовая доля водорода в котором составляет 25%, относительная плотность углеводорода по кислороду равна 0,5.
-
Найдите молекулярную формулу углеводорода, массовая доля водорода в котором составляет 20%, относительная плотность углеводорода по воздуху равна 1,035.
-
Найдите молекулярную формулу алкена, массовая доля углерода в котором составляет 85,7%, относительная плотность этого алкена по азоту равна 2.
-
Найдите молекулярную формулу углеводорода, массовая доля углерода в котором составляет 85,7%, относительная плотность этого углеводорода по оксиду углерода (IV) равна 1,593.
Тема 2.3 Кислородосодержащие органические соединения
Решите задачи
ВНИМАНИЕ! Условие задач необходимо списывать.
Задача 1. Глюкозу массой 50 г растворили в 100 г воды. Вычислите массовую долю глюкозы в получившемся растворе.
Задача 2.Вычислите массу уксусной кислоты, затраченную на реакцию с раствором гидроксида натрия массой 120 г с массовой долей щелочи 25%.
Задача 3. Какой объем водорода (н.у.) выделится при взаимодействии уксусной кислоты с 10 г магния, содержащего 20% примесей?
Задача 4. Какая масса фенолята натрия может быть получена при взаимодействии фенола массой 4,7 г с раствором гидроксида натрия, содержащего 2,4 г NаОН.
Задача 5. Какой объем углекислого газа (н.у.) образуется при спиртовом брожении глюкозы массой 250г, если объемная доля выхода газа составляет 95%?
Литература.
-
Габриелян О.С., Остроумов И.Г. Химия (10 кл.). М. ОЛМА, 2010
-
Габриелян О.С., Остроумов И.Г. Химия (11 кл.). М. ОЛМА, 2010
3.Габриелян О.С. Химия: учеб. для студ. проф. учеб. заведений / О.С.Габриелян, И.Г. Остроумов. - М., 2012.
ПРИЛОЖЕНИЕ 1
Периодическая система химических элементов Д.И.Менделеева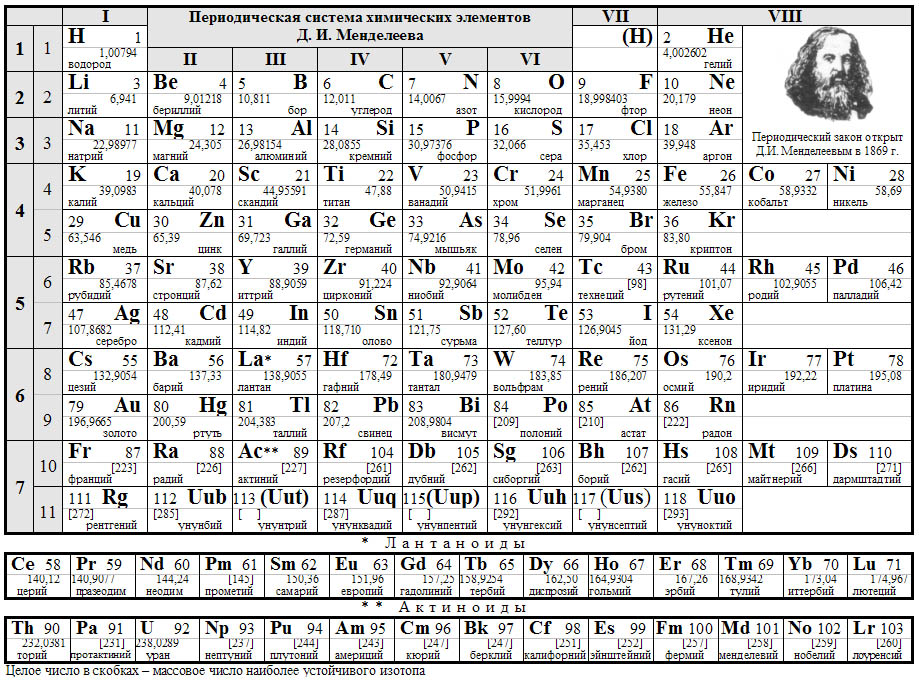
ПРИЛОЖЕНИЕ 2
Растворимость кислот, оснований и солей в воде
ионы
H+
Li +
NH 4+
K +
Na +
Ag +
Ba 2+
Ca 2+
Mg 2+
Zn 2+
Mn 2+
Cu 2+
Cu +
Hg +
Hg 2+
Pb 2+
Fe 2+
Fe 3+
Al 3+
Cr 3+
Bi 3+
Sn 2+
Sr 2+
OH -
Р
Р
Р
Р
-
Р
М
Н
Н
Н
Н
Н
-
-
Н
Н
Н
Н
Н
Н
Н
М
NO 3-
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
-
Р
F -
Р
Р
Р
Р
Р
Р
М
Н
Н
М
М
Н
-
Н
М
Н
М
Р
Р
Р
Н
Р
М
Cl -
Р
Р
Р
Р
Р
Н
Р
Р
Р
Р
Р
Р
Р
Н
Р
М
Р
Р
Р
Р
-
Р
Р
Br -
Р
Р
Р
Р
Р
Н
Р
Р
Р
Р
Р
Р
-
Н
М
М
Р
Р
Р
Р
-
Р
Р
I -
Р
Р
Р
Р
Р
Н
Р
Р
Р
Р
Р
-
-
Н
-
Н
Р
Р
Р
-
-
М
Р
S 2-
Р
Р
Р
Р
Р
Н
-
-
-
Н
Н
Н
-
Н
Н
Н
Н
Н
-
-
Н
Н
Р
SO 32-
Р
Р
Р
Р
Р
М
М
М
М
М
Н
-
Н
Н
-
Н
М
-
-
-
Н
Н
Н
SO 42-
Р
Р
Р
Р
Р
М
Н
М
Р
Р
Р
Р
Р
М
-
М
Р
Р
Р
Р
Р
Р
Н
CO 32-
Р
Р
Р
Р
Р
М
М
Н
М
-
Н
-
-
Н
Н
Н
Н
-
-
-
Н
-
Н
SiO 32-
Н
Р
Р
Р
Р
Н
Н
М
-
Н
Н
-
-
-
-
Н
Н
-
-
-
Н
-
Н
PO 43-
Р
Н
Р
Р
Р
Н
Н
Н
М
Н
Н
Н
Н
Н
Н
Н
Н
М
Н
Н
Н
Н
Н
CrO 42-
Р
Р
Р
Р
Р
Н
Н
М
Р
Н
Н
Н
-
-
-
Н
-
-
-
-
Н
-
М
CH 3 COO -
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р - растворимые
М - малорастворимые
Н - нерастворимые
- разлагаются водой или не существуют


