- Преподавателю
- Химия
- Методические указания по выполнению лабораторных работ и практических занятий по учебной дисциплине ОУД. 09 ХИМИЯ по специальности 35. 02. 07 «Механизация сельского хозяйства»
Методические указания по выполнению лабораторных работ и практических занятий по учебной дисциплине ОУД. 09 ХИМИЯ по специальности 35. 02. 07 «Механизация сельского хозяйства»
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Радчук С.В. |
| Дата | 24.12.2015 |
| Формат | doc |
| Изображения | Есть |
методические указания
по выполнению лабораторных работ и практических занятий
по учебной дисциплине общеобразовательного цикла
ОУД.09 ХИМИЯ
по специальности
35.02.07 «Механизация сельского хозяйства»
2015 г.
Методические указания по выполнению лабораторных работ и практических занятий составлены на основе рабочей программы по учебной дисциплине общеобразовательного цикла ОУД. 09 Химия.
РАССМОТРЕНО
РЕКОМЕНДОВАНО
на заседании цикловой методической комиссии ОД, ОГСЭ и ЕН дисциплин
Председатель ЦМК комиссии
С.В. Радчук
подпись
Протокол заседания ЦМК
№ 1 от«____»____________20___г
Научно-методическим советом ОГБОУ СПО СТТ
Протокол № ___ от «____»______________20___г.
Разработчик:
Радчук С.В. - преподаватель химии
Ф.И.О.,
Эксперты:
_______________________________________________________________
Ф.И.О.,
_______________________________________________________________
Ф.И.О.,
Введение
При изучении химии и других естественнонаучных дисциплин выполняются лабораторные и практические работы. Для того чтобы их проведение было успешным, необходимо соблюдать ряд условий.
Инструкция по проведению опытов содержит план наблюдения. Изучив инструкцию, обучающиеся должны четко определить предмет наблюдения - то, на что будет обращено внимание (конкретное вещество, его свойства, то или иное превращение вещества и т.д.)
Проводя эксперимент, необходимо строго соблюдать все правила техники безопасности при работе в химической лаборатории. Их нужно повторять перед выполнением лабораторной или практической работы. В методических указаниях специальными значками указаны правила техники безопасности, на которые следует обратить особое внимание при выполнении каждого эксперимента.
Эксперимент нужно завершать формулировкой вывода. Вывод должен соответствовать цели эксперимента и содержать наиболее значимые сведения об изученных веществах и процессах.
Методические указания помогут обучающимся эффективно подготовиться к выполнению лабораторных и практических работ, повторить правила техники безопасности. Используя методические указания, обучающиеся смогут совершенствовать практические умения и навыки обращения с лабораторным оборудованием, веществами.
Указания составлены в соответствии с программой курса «Химия».
В методических указаниях изложен порядок и основные требования к выполнению лабораторных и практических работ, их теоретическая и практическая база, задания для самостоятельной подготовки к работе, форма представления результатов её выполнения.
Предназначены для обучающихся по специальности 35.02.07 «Механизация сельского хозяйства»
Цели химического образования
-
овладение умениями применять полученные знания для объяснения разнообразных химических явлений и свойств веществ, оценки роли химии в развитии современных технологий и получении новых материалов;
-
развитие познавательных интересов и интеллектуальных способностей в процессе самостоятельного приобретения химических знаний с использованием различных источников информации, в том числе компьютерных;
-
воспитание убежденности позитивной роли химии в жизни современного общества, необходимости химически грамотного отношения к собственному здоровью и окружающей среде;
-
применение полученных знаний и умений для безопасного использования веществ и материалов в быту, на производстве и в сельском хозяйстве, для решения практических задач в повседневной жизни, для предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
Общие компетенции
Целью химии становится:
ОК 2. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество.
ОК 4. Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития.
ОК 5. Использовать информационно-коммуникационные технологии в профессиональной деятельности.
ОК 6. Работать в коллективе и в команде, эффективно общаться с коллегами, руководством, потребителями.
ОК 7. Брать на себя ответственность за работу членов команды (подчиненных), за результат выполнения заданий.
ОК 8. Самостоятельно определять задачи профессионального и личностного развития, заниматься самообразованием, осознанно планировать повышение квалификации.
ОК 9. Ориентироваться в условиях частой смены технологий в профессиональной деятельности.
Студенты при выполнении данного вида работ осваивают экспериментальные основы химии
-
Правила безопасности при работе с едкими, горючими и токсичными веществами.
-
Проведение химических реакций в растворах.
-
Проведение химических реакций при нагревании.
-
Качественный и количественный анализ веществ.
-
Определение характера среды.
-
Индикаторы.
-
Качественные реакции на неорганические вещества и ионы.
-
Качественные реакции на органические вещества.
Требования к знаниям и умениям при выполнении лабораторных работ
При выполнении лабораторных работ студент должен:
уметь:
- проводить реакции ионного обмена и качественные реакции ионов, определять реакцию среды растворов солей;
- охарактеризовывать свойства металлов на основании их положения в Периодической системе химических элементов Д. И. Менделеева;
- строения атомов и электрохимическом ряду напряжений металлов;
- проводить реакции лабораторных способов получения углеводородов: метана и этилена, альдегидов, карбоновых кислот и сложных эфиров;
- распознавать органические вещества (изученные по программе) на основе их строения и свойств;
- описывать свойства органических веществ, составлять уравнения реакций.
знать:
- основные классы неорганических соединений и их свойства, строение атома, типы химических реакций и связей;
- теорию электролитической диссоциации;
- периодический закон и периодическую систему химических элементов Д. И. Менделеева;
- теорию химического строения органических соединений А. М. Бутлерова;
- названия представителей гомологических рядов органических соединений, строение и свойства их, способы получения;
- правила по технике безопасности при работе в химической лаборатории.
Правила выполнения лабораторных работ
1. Студент должен придти на лабораторное занятие подготовленным по данной теме.
2. Каждый студент должен знать правила по технике безопасности при работе в химической лаборатории (и при работе с реактивами в данной работе).
3. После проведения работы студент представляет письменный отчет.
4. До выполнения лабораторной работы у студента проверяют знания по выявлению уровня его теоретической подготовки по данной теме.
5. Отчет о проделанной работе следует выполнять в тетради для лабораторных работ. Содержание отчета указано в описании лабораторной работы.
6. Таблицы и рисунки следует выполнять карандашом, записи - синим или чёрным цветом пасты или чернил. Рисунки выполняются в левой половине листа, наблюдения и выводы в правой части листа. Уравнения реакций записываются во всю строку (после наблюдений и выводов).
7. Зачет по данной лабораторной работе студент получает при положительных оценках за теоретические знания и отчет по лабораторной работе, общий зачет - при наличии зачетов по всем лабораторным работам.
ЧТОБЫ ОПЫТ ПОЛУЧИЛСЯ…
…ознакомьтесь с каждым пунктом правил и старайтесь точно их выполнять
-
В химический кабинет заходите только после того, как разрешит преподаватель. Не трогайте и не переставляйте на столе приготовленные реактивы и оборудование - это может затруднить вашу дальнейшую работу.
-
Прежде чем приступить к выполнению химических опытов, обязательно изучите описание лабораторной работы и внимательно выслушайте объяснения преподавателя. Проверьте, все ли необходимое для работы есть на вашем столе.
-
В ходе выполнения работы координируйте свои действия с действиями группы. Разговаривайте шепотом, чтобы не мешать работать другим. Если возникнут какие-либо затруднения, которые вы не можете разрешить самостоятельно, обратитесь за помощью к преподавателю.
-
Вещества берите только шпателем или ложечкой и в тех количествах, которые указаны в описании работы; если таких указаний нет, то объемы веществ не должны превышать 1 мл. (3-4 капли)
Чтобы не перепутать пробки, не открывайте одновременно несколько склянок.
-
Если вы случайно взяли вещества больше, чем нужно для данного опыта, лишнее вылейте в специальную склянку для слива веществ или, если вещество твердое, отсыпьте в коробку для мусора.
-
В химической лаборатории (кабинете) очень важно быть предельно аккуратным во всем - тут нет мелочей. Прежде чем начать работать руками, продумайте, как разместить оборудование на столе, чтобы было удобно, и работать, и наблюдать за ходом эксперимента.
Не забывайте, что за этим же столом с этими же реактивами и оборудованием будут работать студенты других групп, - не создавайте им дополнительных трудностей, оставив свое рабочее место в беспорядке.
Правила по технике безопасности при проведении лабораторных и практических работ
-
Работая в химической лаборатории, необходимо соблюдать большую осторожность.
-
Приступать к выполнению задания после указания преподавателя.
-
Химические реакции выполнять с такими количествами и концентрациями веществ, в таких приборах и посуде, как указано в описаниях работ.
-
Производить опыты в чистой посуде.
-
Внимательно прочесть надпись на этикетке, прежде чем взять вещество для опыта.
-
Все опыты с выделением ядовитых, летучих и неприятно пахнущих веществ проводить с особой осторожностью.
-
Выполнять опыты с взрывчатыми, легковоспламеняющимися веществами или кислотами и щелочами с соблюдением мер предосторожности, работая стоя. Поджигать газы и пары после проверки их на чистоту, смесь горючего газа с воздухом взрывается.
-
Нюхать выделяющиеся газы издали, помахивая рукой от сосуда к себе.
-
Реактивы не пробовать на вкус, так как большинство из них ядовиты.
-
Держать дальше от огня легко воспламеняющиеся вещества: эфир, бензин, спирт, бензол и др., если эти вещества воспламеняются, накрыть пламя брезентом или засыпать песком.
-
Не зажигать горючее зажигалкой. Гасить горючее, накрывая ее колпачком.
-
В случае возникновения пожара в лаборатории вызвать пожарную охрану, а до прибытия гасить огонь песком, огнетушителем.
-
В случае ожога лица, рук кислотой или щелочью необходимо оказать пострадавшему помощь.
Правила выполнения лабораторной работы
Лабораторная работа выполняется в три этапа:
Этап
Содержание работы
Выполнение пунктов №
Первый
Подготовка к эксперименту.
1, 2, 3
Второй
Выполнение эксперимента.
4
Третий
Подготовка отчёта по работе и выполнение заданий.
5, 6 ,7, 8
Правила оформления отчёта по лабораторной работе
1) Запишите название номер и тему лабораторной работы.
Лабораторная работа №__.
Тема:_______________________________________________________________.
Цели работы: _______________________________________________________.
Реактивы и оборудование: ___________________________________________.
2) Ознакомьтесь самостоятельно с целями работы и списком оборудования и реактивов.
3) Запишите номер и название опыта из методической рекомендации. Самостоятельно определите его цель и содержание эксперимента.
Опыт № __. __________________________________________________________.
1. Что делали?
2. Что наблюдали?
3. УХР и выводы
Проба № 1
Проба № 2
Проба № 3
4) Проведите запланированный эксперимент, и кратко запишите всё, что вы делали и что при этом наблюдали, то есть опишите условия протекания и признаки химических реакций.
5) Напишите уравнение реакций, которые вы провели. Если в ходе опыта протекало несколько химических реакций, для каждой запишите уравнение. Не забудьте расставить коэффициенты.
6) Нарисуйте прибор, которым вы пользовались. Постарайтесь, чтобы рисунок получился четким. Обязательно сделайте на нем пояснительные надписи. Для изображения окрашенных веществ пользуйтесь цветными карандашами или фломастерами.
7) Сделайте вывод после каждого опыта (или работы). Напомним: повторное описание своих действий или наблюдений не может считаться выводом.
8) Ответьте на вопросы и выполните все задания.
Полезные советы. Каждую лабораторную работу и каждый опыт начинайте с нового листа.
Практическая работа №1.
Приготовление раствора заданной концентрации.
Правила по технике безопасности к практической работе №1
I. Требования безопасности перед началом работы
-
Подготовить своё рабочее место, убрать со стола всё лишнее: книги, тетради, другие предметы, не используемые при выполнении данной работы
-
Ознакомиться с порядком выполнения работы, безопасными приёмами работы
-
Работу начинайте тогда, когда ознакомитесь с инструкцией по её выполнению
-
Практическую работу проводить только в присутствии и по указанию преподавателя, строго следуя инструкции по её выполнению
II. Требования безопасности во время работы
-
Получив задание, изучите порядок проведения работы
-
Для опытов берите вещества в указанных количествах
-
Не оставляйте открытыми склянки с реактивами
-
Наливайте реактивы только над столом, сливать оставшиеся вещества в сосуд, из которого они были взяты, запрещается
-
О пролитом реактиве немедленно доложите преподавателю. Удалите разлив, следуя указанию преподавателя
-
При выполнении опыта №1 нельзя низко наклонять над пробиркой с раствором соляной кислоты и цинком. Наблюдайте за ходом реакции в пробирке через её стенки
III. Требования безопасности по окончании работы
-
Уберите рабочее место
-
Протрите рабочее место
-
Все отработанные реактивы поместите в лоток и сдайте лаборанту или преподавателю
-
Вымойте руки с мылом
Практическое занятие №1
Приготовление раствора заданной концентрации
Цель: приготовить растворы солей определенной концентрации.
Оборудование и реактивы:
- стакан объемом 50 мл;
- стеклянная палочка с резиновым наконечником;
- весы;
-стеклянная лопаточка;
- мерный цилиндр; мерная колба
-соли;
- холодная кипяченая вода.
Краткие теоретические сведения
Концентрация - величина, характеризующая количественный состав раствора.
Согласно правилам ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л), то есть это отношение неоднородных величин.
Те величины, которые являются отношением однотипных величин (отношение массы растворённого вещества к массе раствора, отношение объёма растворённого вещества к объёму раствора), правильно называть «долями». Однако на практике для обоих видов выражения состава применяют термин «концентрация» и говорят о концентрации растворов.
Массовая доля - отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах:
![]() ,
,
где:
-
m1 - масса растворённого вещества, г;
-
m - общая масса раствора, г .
Массовое процентное содержание компонента, m%
m%=(mi/Σmi)*100
Молярная концентрация - количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации ![]() , которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным.
, которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным.
Примечание: единица «моль» не склоняется по падежам. После цифры пишут «моль», подобно тому, как после цифры пишут «см», «кг» и т. п.
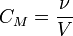 ,
,
где:
-
ν - количество растворённого вещества, моль;
-
V - общий объём раствора, л.
Ход работы:
1. Приготовление раствора соли с определенной массовой долей вещества.
-
Произведите расчеты: определите, какую массу соли и воды потребуется взять для приготовления раствора, указанного в условии задачи.
Задача: приготовьте 20 г водного раствора поваренной соли с массовой долей соли 5 %.
-
Отвесьте соль и поместите ее в стакан.
-
Отмерьте измерительным цилиндром необходимый объем воды и вылейте в колбу с навеской соли.
Внимание! При отмеривании жидкости глаз наблюдателя должен находиться в одной плоскости с уровнем жидкости. Уровень жидкости прозрачных растворов устанавливают по нижнему мениску.
-
Отчет о работе:
- проведите расчеты;
- последовательность ваших действий;
2. Приготовление раствора с заданной молярной концентрацией.
Задача. Приготовьте 25 мл раствора хлорида калия, молярная концентрация которого 0,2 моль/л.
-
Рассчитайте массу растворенного вещества в 1000 мл раствора заданной молярной концентрации.
-
Рассчитайте массу растворенного вещества в предложенном объеме раствора.
-
В соответствии с расчетами возьмите навеску соли, поместите ее в мерный стакан и добавьте немного воды (примерно 7-10 мл). помешивая стеклянной палочкой, растворите полностью соль, а затем прилейте воды до необходимого по условию задачи объема.
-
Отчет о работе:
- приведите расчеты;
- последовательность важных действий;
Вывод
Контрольные вопросы
1) Решить задачи по выбору преподавателя.
1. Приготовлено 300 г 5%-ного раствора иода в этаноле. Рассчитайте массу (в граммах) использованного спирта
2. Какой объем (в литрах, н. у.) метаналя необходимо растворить в 500 мл воды, чтобы приготовить 30 %-ный формалин.
3. Приготовлен раствор из 219 г кристаллогидрата СаCl2 6Н2O и 1 л воды. Рассчитайте массовую долю (в %) безводной соли в этом растворе.
4. Определите количество гидроксида калия (моль), содержащееся в 3 л 25 %-ного раствора (плотность 1,24 г/мл).
2) Какие применяются способы выражения концентрации растворов?
3) От чего зависит растворимость веществ?
4) Почему при открывании бутылки с газированной водой начинается обильное выделение газа, тогда как в закрытой бутылке этого не наблюдается.
Шкала оценки образовательных достижений:
Критерии оценки: Выполнение работы более 90% -оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2».
Список литературы:
1. Габриелян О.С. Химия: учеб. для студ. сред. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. - М., 2008.
2. Габриелян О.С. Химия в тестах, задачах, упражнениях: учеб. пособие для студ. сред. проф. учебных заведений / О.С. Габриелян, Г.Г. Лысова - М., 2010.
3. Габриелян О.С. Практикум по общей, неорганической и органической химии: учеб. пособие для студ. сред. проф. учеб. заведений / Габриелян О.С., Остроумов И.Г., Дорофеева Н.М. - М., 2009.
4. Габриелян О.С. Химия. 10 класс. Базовый уровень: учеб. для общеобразоват. учреждений. - М., 2010.
5. Габриелян О.С. Химия. 11 класс. Базовый уровень: учеб. для общеобразоват. учреждений. - М., 2010.
Практическая работа №2.
Решение экспериментальных задач
Правила по технике безопасности к практической работе №2
І. Требования безопасности перед началом работы
-
Подготовить своё рабочее место, убрать все лишнее: книги, тетради, неиспользуемые при выполнении данной работы
-
Ознакомиться с порядком выполнения работы, безопасными приёмами работы
-
Работу начинайте тогда, когда ознакомитесь с инструкцией по её выполнению
-
Практическую работу проводить только в присутствии и по указанию преподавателя, строго следуя инструкции по её выполнению
II. Требования безопасности во время работы
-
Получив задание, изучите порядок проведения работ
-
Для опытов берите вещества в строго указанных количествах
-
Наливайте реактивы только над столом, сливать оставшиеся вещества в сосуд, из которого они были взяты, запрещается
-
Не оставляйте открытыми склянки с реактивами
-
О пролитом реактиве немедленно доложите преподавателю. Удалите разлив, следуя указаниям преподавателя
-
Будьте осторожны в обращении с раствором щелочи и раствором нитрата серебра. Раствор щелочи разъедает ткани, а раствор нитрата серебра оставляет черные пятна на одежде, руках, столе
-
При попадании веществ в глаза, на кожу или одежду, других несчастных и непредвиденных ситуациях немедленно сообщите преподавателю
-
Встряхивать пробирку, закрывая отверстие пальцем, запрещается
-
Нюхать выделившийся аммиак, при выполнении заданий второго и третьего, можно только направляя к себе движением руки струю газа, держа отверстие пробирки с веществом на некотором расстоянии от лица. Вдыхать осторожно
III. Требование безопасности по окончании работы
-
Уберите рабочее место
-
Протрите рабочее место
-
Все отработанные реактивы поместите в лоток и сдайте преподавателю
-
Вымойте руки с мылом
Практическая работа №2. Решение экспериментальных задач
Цель работы: продолжить формирование умений и навыков в обращении с реактивами, закрепить знания о качественных реакциях на катионы и анионы.
Теоретическая часть:
Экспериментальные задачи называются так, потому что для их решения надо выполнить тот или иной химический опыт. В данной работе предлагается три опыта.
Первый опыт на распознавание веществ.
Второй и третий опыт на доказательство качественного состава вещества.
Для успешного выполнения первого задания необходимо знать, что реактивом на ионы СL- и ионы РO4-3 является раствор АgN03. При взаимодействии с ионом СL- образуется белый осадок, а при взаимодействии с ионом РО4-3 осадок жёлтого цвета.
При выполнении заданий второго и третьего необходимо знать качественные реакции: на ионы NН4+ - является взаимодействие с р-ром щёлочи, в результате реакции образуется гидроксид аммония (NH4OH) его можно обнаружить по запаху или если к отверстию пробирки поднести влажную лакмусовую бумагу, то она посинеет, ионы Na+ изменяют цвет пламени на жёлтый. Качественной реакцией на ионы SO4-2 является взаимодействие с ВаСl2 появляется осадок белого цвета.
Оборудование: пробирки, штатив, спиртовка, стеклянная палочка;
Реактивы: растворы- АgNО3, NаСl, Nа3РО4, NаОН, NН4Сl, Nа2SО4, ВаСl2
Ход работы:
Задание 1: определите с помощью характерных реакций каждое неорганическое вещество: NаСl и Nа3Р04.
Выполнение работы:
В выданные пробирки с растворами NаСl и Nа3РО4 добавьте по 1 мл. раствора АgNО3; т.к. реактивом на ионы Сl- и РО4-3 является АgNО3. Наблюдайте за изменениями, происходящими в пробирках.
Отчет о работе:
Исходные вещества
Наблюдение
Выводы
Растворы:
NаСl
NaзPO4
AgNO3
При добавлении в пробирки с растворами NаСl и
NазРО4, раствора АgNОз в одной появляется осадок белого цвета, в другой -жёлтого
Качественной реакцией на ионы Сl- является взаимодействие с раствором АgNОз - выпадает белый осадок. Качественной реакцией на ионы РО43- является взаимодействие с раствором АgNОз- выпадает жёлтый осадок.
Задание 2: проведите реакции, подтверждающие качественный состав неорганического вещества NH4Cl
Выполнение работы:
В выданной пробирке находится вещество NH4Cl,
Разделите содержимое пробирки пополам.
В одну пробирку добавьте 1-2 мл. раствора NаОН,
в другую пробирку добавьте 1 мл. раствора АgNОз.
Наблюдайте за изменениями, происходящими в пробирках.
Отчет о работе:
Исходные вещества
Наблюдение
Выводы
Растворы:
АgNО3
NаОН
NH4CL
После добавления в пробирку с
раствором NH4Cl, раствора NаОН можно почувствовать запах аммиака. После добавления в другую пробирку с раствором NH4Cl раствора АgNОз-
появляется осадок белого цвета.
Качественной реакцией на ионы NH4+ является взаимодействие с раствором щёлочи, в результате реакции выделяется аммиак, который можно обнаружить по запаху или если к отверстию пробирки поднести влажную лакмусовую бумагу, то она посинеет.
Качественной реакцией на ионы Сl- является взаимодействие с АgNО3. В результате реакции выпадает осадок белого цвета.
Задание 3: проведите реакции, подтверждающие качественный состав неорганического вещества Nа2S04
Выполнение работы:
В выданной пробирке находится вещество Nа2SО4.
Внесите в пламя спиртовки стеклянную палочку, смоченную раствором Na2SO4.
Наблюдайте за изменением цвета пламени спиртовки.
В пробирку добавьте 1-2 мл. раствора ВаСl2 ,
наблюдайте за изменениями, происходящими в пробирке.
Отчет о работе:
Исходные вещества
Наблюдение
Выводы
Растворы: Nа2SО4
ВаС12
При внесении в бесцветное пламя спиртовки стеклянной палочки, смоченной раствором Na2S04, оно становится жёлтым. После добавления в пробирку с раствором Na2SО4 раствора ВаС12, появляется осадок белого цвета.
Качественной реакцией на ионы Nа+ является изменение цвета пламени спиртовки на жёлтый.
Качественной реакцией на ионы SO4-2 является взаимодействие с ВаС12 - появляется осадок белого цвета.
Допишите уравнения химических реакций:
1)NаСl+АgNОз -> .... + .... ↓
2)Nа3Р04+АgN03 ->.... + .... ↓
3)NН4С1+ NаОН -> .... + .... + .... ↑
4)NН4ОН -> .... + .... ↑
5)Na2S04 + ВаСl2 -> .... + .... ↓
Контрольные вопросы
-
Какова качественная реакция на ионы Сl?
-
Какова качественная реакция на ионы Р04-3?
-
Какова качественная реакция на ионы NН4+?
-
Как можно определить, что в результате реакции выделился аммиак?
-
Какова качественная реакция на ионы SО42- ?
Шкала оценки образовательных достижений:
Критерии оценки:
Выполнение работы более 90% -оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2»
Рекомендуемые информационные материалы:
Интернет,
Учебники:
-
Габриелян О.С. Химия: учеб. для студ. сред. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. - М., 2008.
-
Габриелян О.С. Химия в тестах, задачах, упражнениях: учеб. пособие для студ. сред. проф. учебных заведений / О.С. Габриелян, Г.Г. Лысова - М., 2010.
-
Габриелян О.С. Практикум по общей, неорганической и органической химии: учеб. пособие для студ. сред. проф. учеб. заведений / Габриелян О.С., Остроумов И.Г., Дорофеева Н.М. - М., 2009.
-
Габриелян О.С. Химия. 11 класс. Базовый уровень: учеб. для общеобразоват. учреждений. - М., 2010.
Практическая работа №3.
Получение, собирание и распознавание газов
Правила по технике безопасности к практической работе № 3
I. Требования безопасности перед началом работы
-
Подготовить своё рабочее место, убрать со стола всё лишнее: книги, тетради, другие предметы, не используемые при выполнении данной работы
-
Ознакомиться с порядком выполнения работы, безопасными приёмами работы
-
Работу начинайте тогда, когда ознакомитесь с инструкцией по её выполнению
-
Практическую работу проводить только в присутствии и по указанию преподавателя, строго следуя инструкции по её выполнению
II. Требования безопасности во время работы
-
Получив задание, изучите порядок проведения работы
-
Для опытов берите вещества в строго указанных количествах
-
Наливайте реактивы только над столом, сливать оставшиеся вещества в сосуд, из которого они были взяты, запрещается
-
Не оставляйте открытыми склянки с реактивами
-
О пролитом реактиве немедленно доложите преподавателю.
-
Удалите разлив, следуя указанию преподавателя
-
При опускании газоотводной трубки в пробирку с известковой водой следите, чтобы газоотводная трубка опустилась до дна пробирки
-
При работе с водородом очень важно проверить его чистоту, смесь воздуха и водорода взрывоопасна
-
При получении аммиака нюхайте его осторожно
III. Требования безопасности по окончании работы
-
Разберите приборы
-
Уберите рабочее место
-
Протрите рабочее место
-
Все отработанные реактивы поместите в лоток и сдайте преподавателю
-
Вымойте руки с мылом
Практическая работа №3. Получение, собирание и распознавание газов
Цель работы: продолжить формирование умений и навыков в обращении с реактивами, повторить способы получения в лабораторных условиях некоторые из газов (водород, оксид углерода (IV), аммиак) и обнаружение их.
Теоретическая часть:
Водород горюч, с кислородом или воздухом образует взрывоопасные смеси. Поэтому его надо получать в малых количествах, не допускать образования взрывчатых смесей, поэтому перед использованием водорода необходимо проверять его «на чистоту». Водород получают реакцией взаимодействия цинка с разбавленной соляной кислотой.
Углекислый газ получают при взаимодействии мрамора с раствором соляной кислоты. Выделяющийся углекислый газ обнаруживают, пропуская его через известковую воду, при этом раствор мутнеет от получаемого нерастворимого карбоната кальция. Надо помнить, что при длительном пропускании углекислого газа через известковую воду происходит превращение карбоната кальция в гидрокарбонат и тогда осадок растворяется.
Аммиак получают при взаимодействии растворов хлорида аммония и гидроксида натрия. Выделяющийся аммиак обнаруживают по резкому запаху или если поднести к отверстию пробки влажную лакмусовую бумагу, то она посинеет.
Оборудование: пробирки, пробка с газоотводной трубкой, штатив, спиртовка.
Реактивы: соляная кислота, гидроксид натрия, известковая вода, хлорид аммония, цинк, мрамор, лакмусовая бумага.
Ход работы:
Опыт № 1- Получение, собирание и распознавание водорода
В пробирку поместите 1-2 гранулы цинка, добавьте 2мл. разбавленной соляной кислоты и закройте пробкой с газоотводной трубкой.
Поставьте пробирку в гнездо штатива.
Выделяющийся водород соберите в опрокинутую вверх дном пробирку.
Её держите над трубкой около минуты, после чего плавным движением снимите с трубки, не меняя положения, и держа за донышко, поднесите отверстием к пламени спиртовки.
Что наблюдаете?
Опыт№2- Получение, собирание и распознавание оксида углерода(IV)
В пробирку, закрепленную в штативе, поместите кусочек мрамора и добавьте к нему 1-2 мл. разбавленной соляной кислоты, пробирку быстро закройте пробкой с газоотводной трубкой, пропустите полученный газ в пробирку с известковой водой.
Что наблюдаете?
Опыт№3- Получение, собирание и распознавание аммиака.
В пробирку налейте 1-2 мл. раствора хлорида аммония, а затем такой же объём раствора гидроксида натрия, осторожно нагрейте. Осторожно понюхайте выделяющийся газ. Поднесите к отверстию пробирки влажную лакмусовую бумагу. Что наблюдаете?
Отчет о работе
Исходные вещества
Наблюдение
Выводы
Цинк,
раствор HCl
Мрамор,
раствор HCl,
известковая вода
Растворы: NH4Cl, NaOH, лакмусовая бумага
Опыт №1: Получение, собирание и распознавание водорода. При взаимодействии цинка с раствором соляной кислоты выделяются пузырьки газа. При поднесении пробирки с газом к открытому огню слышим «лающий звук».
Опыт №2:Получение, собирание и распознавание оксида углерода(IV). При взаимодействии мрамора с соляной кислотой выделяются пузырьки газа. При пропускании газа через известковую воду она мутнеет.
Опыт №3: Получение, собирание и распознавание аммиака. При взаимодействии растворов NH4Cl и NaOH выделяется газ с резким запахом. При поднесении влажной лакмусовой бумаги к отверстию пробирки - она синеет.
Характерный «лающий звук» свидетельствует о наличии в пробирке смеси водорода и воздуха - гремучая смесь, она взрывоопасна. Чистый водород горит еле заметным голубым пламенем.
Помутнение известковой воды свидетельствует о наличии углекислого газа, происходит химическая реакция, образуется карбонат кальция.
Газ с резким характерным запахом - аммиак. Аммиак взаимодействует с водой, образуется NH4OH, который изменяет цвет лакмусовой бумаги на синий.
Допишите уравнения химических реакций:
1)Zn + HCl → 5)NH4Cl + NaOH→
2)H2 + O2 → 6)NH3 + H2O →
3)CaCO3 + HCl →
4)CO2 + Ca(OH)2 →
Контрольные вопросы
1. Как в лабораторных условиях можно получить газ водород?
2. Как доказать, что данный газ водород?
3. Запишите уравнение реакции получения водорода.
4. Как в лабораторных условиях можно получить оксид углерода(IV)?
5. Как доказать, что данный газ оксид углерода(IV)?
6. Запишите уравнение реакции получения оксида углерода(IV)?
7. Как в лабораторных условиях получить аммиак?
8. Как доказать что данный газ аммиак?
9. Запишите уравнение реакции получения аммиака.
Шкала оценки образовательных достижений:
Критерии оценки:
Выполнение работы более 90% -оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2»
Рекомендуемые информационные материалы:
Интернет,
Учебники:
-
Габриелян О.С. Химия: учеб. для студ. сред. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. - М., 2008.
-
Габриелян О.С. Химия в тестах, задачах, упражнениях: учеб. пособие для студ. сред. проф. учебных заведений / О.С. Габриелян, Г.Г. Лысова - М., 2010.
-
Габриелян О.С. Практикум по общей, неорганической и органической химии: учеб. пособие для студ. сред. проф. учеб. заведений / Габриелян О.С., Остроумов И.Г., Дорофеева Н.М. - М., 2009.
-
Габриелян О.С. Химия. 11 класс. Базовый уровень: учеб. для общеобразоват. учреждений. - М., 2010.
Практическая работа №4.
Получение этилена и опыты с ним
Правила по технике безопасности к практической работе №4
Ι. Требования безопасности перед началом работы
-
Подготовить своё рабочее место, убрать со стола всё лишнее:
-
книги, тетради, другие предметы, не используемые при выполнении
-
данной работы
-
Ознакомиться с порядком выполнения работы, безопасными приёмами
-
работы
-
Работу начинайте тогда, когда ознакомитесь с инструкцией
-
по её выполнению
-
Практическую работу проводить только в присутствии и по указанию
-
преподавателя, строго следуя инструкции по её выполнению
ΙΙ. Требования безопасности во время работы
-
Получив задание, изучить порядок проведения работы
-
Для опытов берите вещества в строго указанных количествах
-
Наливайте реактивы только над столом, сливать оставшиеся вещества в сосуд, из которого они были взяты, запрещается
-
Не оставляйте открытыми склянки с реактивами
-
О пролитом реактиве немедленно сообщите преподавателю. Удалите разлив, следуя указанию преподавателя
-
При нагревании смеси этилового спирта с серной кислотой не трогайте руками пробирку-реактор, чтобы в случае поломки прибора не получить ожог, не наклоняйтесь над пробиркой, берегитесь выбросов жидкости. Наблюдайте за ходом реакции в пробирке через её стенки
-
При опускании газоотводной трубки в пробирку с бромной водой и раствором перманганата калия, следите, чтобы она опустилась до дна пробирки. Следите при этом, чтобы нагревание смеси не прекращалось, иначе жидкость из пробирки перебросится в прибор
-
Поджигайте выделившийся этилен только при разрешении преподавателя
-
Подготовленный прибор покажите преподавателю и только после этого приступайте к работе
-
Следите за тем, чтобы ничего не мешало выделению этилена, т.е. чтобы не закупоривалась газоотводная трубка, т.к. это может привести к повышению давления в пробирке, что может разорвать её!
ΙΙΙ.Требования безопасности по окончании работы
-
Уберите рабочее место
-
Протрите рабочее место
-
Все отработанные реактивы поместите в лоток и сдайте лаборанту или преподавателю
-
Вымойте руки с мылом
Практическая работа №4. Получение этилена и опыты с ним
Цель работы: освоить лабораторный способ получения этилена, изучить его свойства сравнить их со свойствами метана
Теоретическая часть:
Этилен - непредельный углеводород - родоначальник соответствующего гомологического ряда. Особенность строения молекулы этилена заключается в наличии двойной связи между атомами углерода, которая обуславливает химические свойства.
Структурная формула этилена - 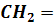
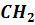
Этилен вступает в реакцию присоединения с галогенами, водородом, галогеноводородами, водой. При этом одна из двух связей между атомами углерода разрывается. Качественной реакцией на этилен является: обесцвечивание бромной воды и раствора перманганата калия при пропускании через них этилена.
Оборудование: пробирки, пробка с газоотводной трубкой, электронагреватель, спички.
Реактивы: смесь этилового спирта с концентрированной серной кислотой, бромная вода (светло-жёлтая), раствор перманганата калия (розовый).
Электронагреватель должен быть наклонен под углом 45 .
.
Ход работы:
Опыт №1: В пробирку налейте смесь этилового спирта и концентрированной серной кислоты 1мл. Затем всыпьте немного предварительно прокалённого песка, чтобы избежать толчков жидкости при кипении. Закройте пробирку пробкой с газоотводной трубкой. Поместите пробирку со смесью в электронагреватель. Нагревайте смесь.
СО СМЕСЬЮ ОБРАЩАТЬСЯ ОСТОРОЖНО
Когда начнётся реакция, переходите к следующим опытам
Опыт №2: В чистую пробирку налить 1-2 мл. бромной воды. Полученный газ пропускайте через бромную воду, опустив газоотводную трубку до дна пробирки.
Следите при этом, чтобы нагревание смеси не прекращалось, иначе жидкость из пробирки переброситься в прибор.
Какие изменения происходят с бромной водой?
Опыт №3: В пробирку налейте 1-2мл. разбавленного раствора перманганата калия, подкисленного серной кислотой. Пропустите газ через данный раствор.
Что наблюдаете?
Опыт №4: Вынув газоотводную трубку из раствора и повернув её отверстием кверху, подожгите выделившийся газ.
Каким пламенем горит этилен?
Отключите электронагреватель. Выделение этилена постепенно прекратится.
Отчет о работе:
Исходные вещества
Наблюдение
Выводы
1) Смесь этилового спирта с концентрированной серной кислотой (1/3)
2) Бромная вода
3)Раствор перманганата калия
Опыт № 1
При нагревании смеси этилового спирта и концентрированной серной кислоты выделяется газ
Если нагреть смесь этилового спирта и концентрированной серной кислоты, то выделяется газ - этилен
Опыт №2
При пропускании этилена через бромную воду она обесцвечивается.
Бромная вода обесцвечивается, т.к. этилен взаимодействует с бромом, протекает реакция присоединения
Опыт №3
При пропускании этилена через раствор перманганата калия он обесцвечивается.
Этилен окисляется кислородом перманганата калия, поэтому раствор обесцвечивается
Опыт№4
Этилен горит светящимся пламенем.
Этилен горит светящимся пламенем потому, что в его молекуле повышенное содержание углерода. Углерод сгорает не сразу, частички его сначала раскаляются, вызывая светимость пламени, а лишь затем полностью сгорают в наружной его части
Контрольные вопросы:
-
Какой газ выделяется при нагревании смеси этилового спирта с концентрированной серной кислотой?
-
Что происходит при пропускании этилена через бромную воду?
-
Как можно объяснить результаты этой химической реакции?
-
Что происходит при пропускании этилена через раствор перманганата калия?
-
Почему этилен горит светящимся пламенем?
-
Чем отличаются химические свойства этилена, как представителя непредельных углеводородов, от свойств предельных углеводородов?
-
Как это можно объяснить?
-
Почему серная кислота, применяемая в опыте, должна быть концентрированная?
Допишите уравнения химических реакций:
1) Получение этилена
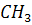 -
- 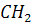 - OH →
- OH →
2) Взаимодействие этилена с бромной водой
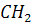 =
=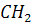 +
+ 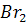 →
→
3) Взаимодействие этилена с перманганатом калия (окисление)
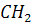 =
=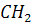 +
+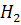 O +
O +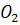 →
→
4) Горение этилена
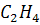 +
+ 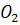 →
→
Шкала оценки образовательных достижений:
Критерии оценки:
Выполнение работы более 90% -оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2»
Рекомендуемые информационные материалы:
Интернет,
Учебники:
-
Габриелян О.С. Химия: учеб. для студ. сред. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. - М., 2008.
-
Габриелян О.С. Химия в тестах, задачах, упражнениях: учеб. пособие для студ. сред. проф. учебных заведений / О.С. Габриелян, Г.Г. Лысова - М., 2010.
-
Габриелян О.С. Практикум по общей, неорганической и органической химии: учеб. пособие для студ. сред. проф. учеб. заведений / Габриелян О.С., Остроумов И.Г., Дорофеева Н.М. - М., 2009.
-
Габриелян О.С. Химия. 10 класс. Базовый уровень: учеб. для общеобразоват. учреждений. - М., 2010.
Практическая работа №5.
Качественное определение углерода и водорода в дизельном топливе (смазочных материалах)
Правила по технике безопасности к практической работе №5
I. Требования безопасности перед началом работы
-
Подготовить своё рабочее место, убрать со стола всё лишнее: книги, тетради, другие предметы, не используемые при выполнении данной работы
-
Ознакомиться с порядком выполнения работы, безопасными приемами работы
-
Работу начинайте тогда, когда ознакомитесь с инструкцией по ее выполнению
-
Практическую работу проводить только в присутствии и по указанию преподавателя, строго следуя инструкции по выполнению работы
II. Требования безопасности во время работы
-
Подготовленный прибор покажите преподавателю, а затем приступайте к работе
-
Для выполнения опыта берите вещества в указанных количествах
-
Насыпайте и наливайте реактивы только над столом, сливать оставшиеся вещества в сосуд из которого они были взяты запрещается
-
Не оставляйте открытыми склянки с реактивами
-
О пролитом реактиве немедленно доложите преподавателю. Удалите разлив, следуя указанию преподавателя
-
Электронагреватель укрепите горизонтально, а затем подключите его, дотрагиваться до нагревающегося элемента запрещается, т.к. можно получить ожог
-
Не накланяйтесь над пробиркой. Наблюдайте за ходом реакции в пробирке через ее стенки
-
Когда вы придете к заключению, что реакция окончилась, выньте из известковой воды конец газоотводной трубки и после этого прекратите нагревание
-
Продукты реакции рассматривайте после того как пробирка остынет
III. Требования безопасности по окончании работы
-
Разберите прибор
-
Уберите рабочее место
-
Протрите рабочее место
-
Все оставшиеся реактивы поместите в лоток и сдайте преподавателю
-
Вымойте руки с мылом
Практическая работа №5. Качественное определение углерода и водорода в дизельном топливе (смазочных материалах)
Цель работы: доказать практически, что дизельное топливо (смазочные материалы) - это смесь углеводородов, а углеводороды содержат атомы углерода и водорода
Теоретическая часть:
Дизельное топливо - это смесь углеводородов. Необходимо доказать, что углеводороды это органические вещества, состоящие из атомов углеводорода и водорода. Для доказательства нужно окислить углерод, содержащийся в углеводородах до оксида углерода (IV) а водород до воды. Окислителем является оксид меди. Для доказательства того, что в результате реакции образовался углекислый газ необходимо полученный газ пропустить через раствор гидроксида кальция (известковую воду), если раствор помутнеет, то действительно это газ - оксид углеводорода (IV).
Если в результате реакции окисления водорода образовалась вода, то доказать ее наличие можно следующим образом. При прохождении паров воды над безводной солью CuSO4 должна произойти химическая реакция - образование кристаллогидрата СuSO4 *2H2O. При этом белый цвет CuSO4 изменится на голубой. В пробирке после проведения реакции, можно обнаружить коричневый налет - это медь.
Оборудование: пробирки, пробка с газоотводной трубкой, лопаточка для насыпания сухих веществ, электронагреватель
Реактивы: дизельное топливо или смазочные материалы, оксид меди (II), сульфат меди, известковая вода
Ход работы:
Качественный состав дизельного топлива (смазочных материалов) - смесь различных углеводородов, можно установить путем окисления их оксидом меди (II).
Поместите в сухую пробирку 1г смеси дизельного топлива и порошка оксида меди (II), придав пробирке горизонтальное положение в электронагревателе, внесите в нее немного обезвоженного сульфата меди и закройте пробкой с газоотводной трубкой, так чтобы порошок сульфата меди находился возле пробки.
Конец газоотводной трубки опустите в пробирку с известковой водой.
Нагревайте несильно смесь вещества 5 - 7 минут. После окончания выньте из известковой воды конец газоотводной трубки и после этого прекратите нагревание. После остывания пробирки, удалите из нее сульфат меди и извлеките продукты реакции, рассмотрите их.
Что произошло с известковой водой, сульфатом меди, продуктами реакции? Опишите и объясните причину этих изменений. Составьте уравнение реакции.
Отчет о работе:
Исходные вещества
Наблюдение
Выводы
Дизельное топливо,
оксид меди(II), СuSO4,
известковая вода
При нагревании смеси дизельного топлива и оксида меди (II) на стенках пробирки появились капельки воды, сульфат меди изменил свою окраску на ярко голубую, известковая вода помутнела.
На продукте реакции в пробирке появился коричневый налет
Обезвоженный сульфат меди после присоединения воды превращается в кристалло - гидрат, поэтому цвет изменился на ярко голубой. Это свидетельствует о том, что в дизельном топливе имеется водород, который взаимодействует с кислородом, образуя воду.
Известковая вода помутнела так как произошло взаимодействие с углекислым газом, в результате реакции, образовался карбонат кальция. Это свидетельствует о том, что в дизельном топливе содержится углерод, который окисляется до углекислого газа. На продукте реакции восстановилась медь в свободном состоянии.
Допишите уравнения химических реакций:
Пусть в дизельном топливе содержится углеводород С18H38.
Какие изменения происходят с ним в нашем опыте? Какие изменения происходят с известковой водой, сульфатом меди?
1. С18H38 + CuO
2. Ca(OH)2 + CO2
3. CuSO4 + 2H2O
Контрольные вопросы
-
С какой целью к дизельному топливу прибавляют оксид меди (II) в нашем опыте?
-
Почему изменяется цвет у сульфата меди?
-
О содержании какого элемента в дизельном топливе свидетельствует изменение цвета сульфата меди?
-
Почему помутнела известковая вода?
-
О содержании какого элемента свидетельствует помутнение известковой воды?
-
Что образовалось из оксида меди (II) и какие наблюдения это подтверждают?
Шкала оценки образовательных достижений:
Критерии оценки:
Выполнение работы более 90% -оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2»
Рекомендуемые информационные материалы:
Интернет,
Учебники:
-
Габриелян О.С. Химия: учеб. для студ. сред. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. - М., 2008.
-
Габриелян О.С. Химия в тестах, задачах, упражнениях: учеб. пособие для студ. сред. проф. учебных заведений / О.С. Габриелян, Г.Г. Лысова - М., 2010.
-
Габриелян О.С. Практикум по общей, неорганической и органической химии: учеб. пособие для студ. сред. проф. учеб. заведений / Габриелян О.С., Остроумов И.Г., Дорофеева Н.М. - М., 2009.
-
Габриелян О.С. Химия. 10 класс. Базовый уровень: учеб. для общеобразоват. учреждений. - М., 2010.
Практическая работа №6.
Решение экспериментальных задач
Правила по технике безопасности к практической работе №6
Ι. Требования безопасности перед началом работы
-
Подготовить своё рабочее место, убрать со стола всё лишнее: книги, тетради, другие предметы, не используемые при выполнении данной работы
-
Ознакомиться с порядком выполнения работы, безопасными приемами работы
-
Работу начинайте тогда, когда ознакомитесь с инструкцией по её выполнению
-
Практическую работу проводить только в присутствии и по указанию преподавателя, строго следуя инструкции по её выполнению
II.Требования безопасности во время работы
-
Для выполнения опыта берите вещества в указанных количествах
-
По возможности раствор из склянок отбирают пипеткой. Нужно следить за тем, чтобы не спутать пипетки от склянок
-
Перенося раствор в пробирку нельзя касаться пипеткой стенок пробирки
-
После использования, пипетку следует немедленно возвращать на место в «свою» склянку
-
Отбирают реактивы только над столом, сливать остатки реактива в сосуд из которого они были взяты запрещается
-
Не оставляйте открытыми склянки с реактивами
-
О пролитом реактиве немедленно сообщите преподавателю. Удалите разлив, следуя указанию преподавателя
-
При нагревании смеси глюкозы с гидроксидом меди (ΙΙ) и глицерина с гидроксидом меди (ΙΙ) нельзя наклоняться над пробирками с кипящими жидкостями, наблюдайте за ходом реакции через стекло пробирки
ΙΙΙ.Требования безопасности после окончании работы
-
Уберите рабочее место
-
Протрите рабочее место
-
Все отработанные реактивы поместите в лоток и сдайте лаборанту или преподавателю
-
Вымойте руки с мылом
Практическая работа №6. Решение экспериментальных задач
Цель работы: Повторить и закрепить знания о качественных реакциях на глицерин, представитель многоатомный спиртов, и глюкозу, представитель углеводов. Убедиться практически, что свойства веществ зависят от их строения.
Теоретическая часть:
Глицерин - это многоатомный спирт. Его молекула содержит три гидроксильных группы. Качественной реакцией на глицерин является взаимодействие со свежеприготовленным гидроксидом меди, реакция идёт без нагревания, в результате образуется раствор глицерата меди ярко-синего цвета.
Глюкоза - это углевод (альдегидоспирт) молекула глюкозы содержит пять гидроксильных групп и одну альдегидную группу. Поэтому глюкоза проявляет свойства многоатомных спиртов и альдегидов. Как многоатомный спирт глюкоза взаимодействует со свежеприготовленным гидроксидом меди- образуется раствор ярко-синего цвета. В реакцию вступают две гидроксильные группы. Если раствор нагреть, то он становится оранжевым, т.е. при нагревании вступает в реакцию альдегидная группа. В данном случае глюкоза ведёт себя как альдегид. То есть благодаря одному и тому же реактиву можно доказать наличие двух функциональных групп, реакция идёт по разным группам при разных условиях.
Оборудование: пробирки, электронагреватель.
Реактивы: растворы - глицерин, глюкоза, гидроксид натрия, сульфат меди.
Ход работы:
Опыт №1: Получение свежеприготовленного гидроксида меди (ΙΙ).
Реактивом на глицерин и глюкозу является свежеприготовленный гидроксид меди (ΙΙ) в избытке щёлочи. Налейте в пробирку 4 капли раствора CuS![]() и добавьте 8 капель раствора NaOH. Что наблюдаете?
и добавьте 8 капель раствора NaOH. Что наблюдаете?
Опыт №2: Полученный в предыдущем опыте осадок голубого цвета поделите пополам между двумя выданными пробирками с растворами глицерина и глюкозы. Следите за изменением окраски.
Опыт №3: Обе пробирки нагрейте в электронагревателе. Следите за изменениями.
Отчет о работе
Исходные вещества
Наблюдения
Выводы
Растворы:
1)Глицерин
2)Глюкоза
3)Сульфат меди
4)Гидроксид натрия
1) При взаимодействии растворов сульфата натрия и гидроксида меди образовался голубой осадок
2) При добавлении гидроксида меди ΙΙ в пробирки с растворами глицерина и глюкозы, образуются растворы ярко-синего цвета.
3)При нагревании обеих пробирок в одной, никаких изменений не произошло, т.е. раствор ярко-синего цвета так и остался. А в другой пробирке раствор того же цвета изменился на оранжевый.
1) Реактивом на растворы глицерина и глюкозы является свежеприготовленный гидроксид меди.
2) Реакции протекают за счёт наличия в молекулах глицерина и глюкозы гидроксильных групп, т.е. глицерин и глюкоза ведут себя как многоатомные спирты.
3)При нагревании смеси реакция протекает по альдегидной группе,
а она имеется только у глюкозы. Следовательно, раствор, который изменил свою окраску на оранжевый и есть раствор глюкозы. А другой- раствор глицерина.
Допишите уравнения химических реакций:
1) NaOH + CuS![]() → …+…
→ …+…
2) C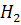 - OH
- OH
|
CH - OH + Cu (O![]() →
→
|
C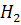 -OH
-OH
Глицерин
3) O
// 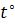
C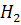 - CH - CH - CH - CH - C + 2Cu (OH
- CH - CH - CH - CH - C + 2Cu (OH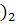 →
→
| | | | | \
OH OH OH OH OH Н
Глюкоза
Контрольные вопросы:
-
Как можно получить гидроксид меди в лабораторных условиях?
-
Как доказать, что данный раствор - раствор глицерина?
-
Как доказать, что данный раствор - раствор глюкозы?
-
Почему глицерин как представитель многоатомных спиртов, и глюкоза, как представитель углеводов, реагируют с гидроксидом меди и образуют раствор ярко - синего цвета?
-
Назовите функциональные группы глицерина.
-
Назовите функциональные группы глюкозы.
Шкала оценки образовательных достижений:
Критерии оценки:
Выполнение работы более 90% -оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2»
Рекомендуемые информационные материалы:
Интернет,
Учебники:
-
Габриелян О.С. Химия: учеб. для студ. сред. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. - М., 2008.
-
Габриелян О.С. Химия в тестах, задачах, упражнениях: учеб. пособие для студ. сред. проф. учебных заведений / О.С. Габриелян, Г.Г. Лысова - М., 2010.
-
Габриелян О.С. Практикум по общей, неорганической и органической химии: учеб. пособие для студ. сред. проф. учеб. заведений / Габриелян О.С., Остроумов И.Г., Дорофеева Н.М. - М., 2009.
-
Габриелян О.С. Химия. 10 класс. Базовый уровень: учеб. для общеобразоват. учреждений. - М., 2010.
Практическая работа №7 .
Распознавание пластмасс и волокон
Правила по технике безопасности к практической работе №7
I.Требования безопасности перед началом работы
-
Подготовить своё рабочее место; убрать со стола все лишнее: книги, тетради, другие предметы, не используемые при выполнении данной работы
-
Ознакомиться с порядком выполнения работы, безопасными приёмами работы.
-
Работу начинайте тогда, когда ознакомитесь с инструкцией по её выполнению.
-
Практическую работу проводить только в присутствии и по указанию преподавателя, строго следуя инструкции по её выполнению
II.Требования безопасности во время работы
-
Получив задание, изучите порядок проведения работы
-
Вам предстоит сжигать и нагревать вещества на открытом пламени. Сжигая вещества, держите их тигельными щипцами
-
Подставляйте под горящее вещество чашку с песком
-
Для наблюдения за размягчением и изменением формы вещества помещайте его на асбестовую сетку
-
При работе с концентрированными серой и азотной кислотами работайте осторожно, берите малые их количества, каплями, не проливайте
-
Не оставляйте открытыми склянки с реактивами
-
Наливайте реактивы только над столом, сливать оставшиеся вещества в сосуд, из которого они были взяты запрещается
-
О пролитом реактиве немедленно доложите преподавателю, удалите разлив, следуя указанию преподавателя
III.Требования безопасности по окончании работы
-
Уберите рабочее место
-
Протрите рабочее место
-
Все отработанные реактивы поместите в лоток и сдайте преподавателю
-
Вымойте руки с мылом
Практическая работа №7. Распознавание пластмасс и волокон
Цель работы: продолжить формировать практические умения и навыки, умение применять теоретические знания на практике, научить распознавать пластмассы и волокна
Теоретическая часть:
Высокомолекулярные соединения (полимеры) называются органические вещества, молекулы которых состоят из множества повторяющихся звеньев. К высокомолекулярным веществам относятся пластмассы и волокна.
Молекулярная масса полимеров достигает сотен тысяч и миллионов единиц. С увеличением молекулярной массы повышается температура плавления полимеров, уменьшается растворимость, возрастает вязкость, эластичность и прочность.
Существуют два способа получения полимеров: реакция полимеризации и реакция полконденсации.
Реакция полимеризации - это процесс соединения друг с другом большого числа низкомолекулярных соединений (мономеров) в макромолекулу.
При полимеризации элементарный состав продукта совпадает с элементарным составам исходных веществ.
Высокомолекулярные соединения, полученные таким образом, могут быть деполимеризованы (разложены) до исходных низкомолекулярных веществ.
Реакция полконденсации - это процесс образования высокомолекулярного вещества (вследствие соединения друг с другом большого числа молекул низкомолекулярных соединений) и низкомолекулярных веществ (воды, галогеноводородов и др).
Оборудование: спиртовка, пинцет, тигельные щипцы, пробирки, чашки с песком, асбестовая сетка
Материалы и реактивы: образцы пластмасс и волокон; ацетон, дихлорэтан, бензол, азотная кислота (концентрированная), серная кислота (концентрированная), щелочь
Ход работы:
I. Распознавание пластмасс
-
В трех пакетах находятся пластмассы:
A)полиэтилен,
Б) полистирол
B)полиметилметакрилат.
Рассмотрите их внешний вид. Что они из себя представляют?
-
Исследуем, как относятся эти материалы к нагреванию. Кусочек пластмассы внесем в пламя спиртовки.
-
Исследуем, как относятся образцы пластмасс к растворителям (ацетон, бензол, дихлорэтан). Кусочки пластмассы поместим в пробирки с растворителями.
-
Определите, какая пластмасса находится в каждом из пакетов
Отчет о работе:
Образцы пластмасс
Внешние признаки
Отношение к нагреванию
Действие растворителей
Образец №1
Полупрозрачный, эластичный, жирный на ощупь материал
При нагревании размягчается - можно вытянуть нити, горит синим пламенем, при этом плавится и образует капли, продолжает гореть вне пламени
Не растворяется ни в ацетоне, ни в дихлорэтане, ни в бензоле
Образец №2
Непрозрачный, хрупкий, твердый
При нагревании размягчается - легко вытягивается в нити, горит коптящим пламенем, распространяя запах стирола, горит все пламени
В ацетоне - набухает, в дихлорэтане и бензоле - растворяется
Образец №3
Твердый, прозрачный материал
При нагревании размягчается - нити не вытягиваются, горит желтым с синей каймой у краев пламенем с характерным потрескиванием, распространяя специфический запах сложных эфиров
В ацетоне - набухает, в дихлорэтане и бензоле - растворяется
Сравните полученные данные с данными таблиц « Распознавание пластмасс ». Сделайте вывод.
Вывод: Образец №1- полиэтилен.
Образец №2- полистирол.
Образец №З- полиметилметакрилат
II. Распознавание волокон
-
В трех пакет находятся волокна:
А) шерсть
Б) ацетатное волокно
В) капрон
Определите, какое вещество находится в каждом из пакетов.
-
Исследуем образцы волокон на горение . Для этого поджигаем виданные волокна, обращая внимание:
А) на скорость горения,
Б) исследуем запах продуктов разложения,
В) свойства остатка, который образуется после сгорания.
-
Проверяем действие на волокна кислоты, щелочей, растворителей
Отчет о работе:
Образцы
Волокон
Сжигание
Действие кислот,
щелочей,
растворителей
Образец № 1
Горит медленно с запахом жженых волос, образуя шарик, черного цвета, который при растирании превращается в черный порошок.
При действии азотной кислоты набухает и окрашивается в желтый цвет, при действии серной кислоты .разрушается, при действии щелочей раство ряется, растворители (ацетон) не действуют
Образец № 2
Горит быстро, образуя нехрупкий, спекшийся шарик темно - бурого цвета, вне пламени не горит
При действии кислот -
растворяется, при действии щелочи образуется желтоватый раствор, в ацетоне растворяется
Образец № 3
При нагревании размягчается, затем плавится, из расплава можно вытянуть нити, горит, распространяя неприятный запах. При горении образуется твердый, бесцветный шарик темного цвета.
В кислотах растворяется, в щелочах не растворяется, в ацетоне растворяется
Сравните полученные данные с данными таблицы «Распознание волокон». Сделайте вывод.
Вывод: Образец № 1 - шерсть
Образец №2 - ацетатное волокно
Образец №3 - капрон
Контрольные вопросы:
-
Каким пламенем горят полиэтилен, полистирол и полиметилметакрилат?
-
В результате, какой реакции можно получить полиэтилен?
-
В чем можно растворить полистирол?
-
В результате, какой реакции получают капрон?
-
Если вам выдадут продукты горения шерсти и капрона, то смогли бы вы их различить?
-
Вам нужно растворить капрон, в чем бы вы его растворили?
-
Можно ли растворить ацетатное волокно в ацетоне?
Шкала оценки образовательных достижений:
Критерии оценки:
Выполнение работы более 90% -оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2»
Рекомендуемые информационные материалы:
Интернет,
Учебники:
-
Габриелян О.С. Химия: учеб. для студ. сред. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. - М., 2008.
-
Габриелян О.С. Практикум по общей, неорганической и органической химии: учеб. пособие для студ. сред. проф. учеб. заведений / Габриелян О.С., Остроумов И.Г., Дорофеева Н.М. - М., 2009.
-
Габриелян О.С. Химия. 10 класс. Базовый уровень: учеб. для общеобразоват. учреждений. - М., 2010.