- Преподавателю
- Химия
- Гидролиз солей. Степень гидролиза
Гидролиз солей. Степень гидролиза
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Закирова О.Т. |
| Дата | 18.11.2014 |
| Формат | doc |
| Изображения | Есть |
" Гидролиз солей. Степень гидролиза"
Закирова Олися Тельмановна -учитель химии.
МБОУ "Арская средняя общеобразовательная школа №7"
11 класс
Цели: Дать определение понятия "гидролиз".Познакомить с химическими процессами, протекающими в водных растворах солей. Научить записывать уравнения реакций гидролиза, предсказывать и объяснять изменение кислотности среды и образование кислых и основных солей в этом процессе. Познакомиться с ролью гидролиза солей в природе, хозяйственной деятельности и повседневной жизни человека.
Тип урока: комбинированный урок.
Оборудование: Мультимедийный проектор, компьютер, таблицы.
Реактивы : карбоната натрия, хлорид меди, сульфид алюминия, хлорид натрия, лакмус.
Ход урока:
1 этап. Организационный.
1.Приветствие.
2. Организация рабочих мест.
3. Оглашение цели урока учащимся
2 этап: Проверка знаний (мотивационный момент)
1. Какие ионы образуются при диссоциации оснований? Какова среда раствора в данном случае?
3. Какие ионы образуются при диссоциации кислот? Какова среда раствора?
5. Сделайте вывод, присутствие каких ионов обуславливает щелочную и кислотную реакцию среды.
6. Как изменится цвет лакмуса в щелочной и кислотной среде?
3 этап. Подготовка учащихся к сознательному усвоению нового материала. Мобилизация и настрой учащихся на изучение новой темы.
Химический эксперимент. При работе не забывайте о правилах ТБ при обращении с химическими веществами.
С помощью индикатора определите среду в растворах следующих солей: карбоната натрия, хлорида меди, сульфида алюминия, хлорида натрия. Какую среду показывает индикатор в каждом случае? Запишите уравнения реакций в молекулярном виде и объяснение происходящее.
4 этап: Усвоение новых знаний
Гидролиз солей - это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц. Гидролиз, дословно, - это разложение водой. Давая такое определение реакции гидролиза солей, мы подчеркиваем, что соли в растворе находятся в виде ионов, и что движущей силой реакции является образование малодиссоциирующих частиц (общее правило для многих реакций в растворах).
Всегда ли ионы способны образовывать с водой малодиссоциирующие частицы? Разбирая этот вопрос, отмечаем, что катионы сильного основания и анионы сильной кислоты таких частиц образовать не могут, следовательно, в реакцию гидролиза не вступают.
Какие типы гидролиза возможны? Поскольку соль состоит из катиона и аниона, то возможно три типа гидролиза:
-гидролиз по катиону (в реакцию с водой вступает только катион);
-гидролиз по аниону (в реакцию с водой вступает только анион);
-совместный гидролиз (в реакцию с водой вступает и катион, и анион);
1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):
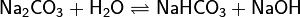
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
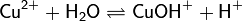
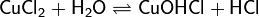
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
3. Гидролиз соли слабой кислоты и слабого основания:
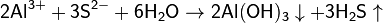
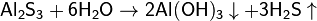
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
4. Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален. Хлорид натрия гидролизу не подвергается, так как в составе соли нет иона, который мог бы при взаимодействии с водой образовывать слабый электролит. Раствор соли, образованной сильным основанием и сильной кислотой, имеет нейтральную реакцию, так как в растворе равное количество катионов водорода и гидроксид-ионов. Продукты гидролиза зависят от соотношения констант диссоциации основания и кислоты.Зачастую гидролиз в данном случае идет необратимо, соль полностью разлагается водой. В этом случае в таблице растворимости в ячейке соответствующей
соли стоит прочерк.
Степень гидролиза
Под степенью гидролиза понимается отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. Обозначается α (или hгидр);
α = (cгидр/cобщ)·100 %
где cгидр - число молей гидролизованной соли, cобщ - общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Степень гидролиза является количественной характеристикой гидролиза.
Гидролиз - это реакция обмена между некоторыми солями и водой приводящая к образованию слабого электролита.
5 этап: Закрепление нового материала
1. Гидролиз солей - это: А) обменная реакция соли с водой; Б) растворение соли в воде; В) диссоциация соли в воде.
2. Сущность гидролиза заключается: А) в диссоциации молекул соли на ионы; Б) в образовании слабодиссоциирующих веществ; В) в образовании молекул сильных электролитов.
3. Раствор нитрата магния Mg(NO3)2имеет А) кислотную среду; Б) щелочную среду; В) нейтральную среду.
-
этап: Подведение итогов урока. Домашнее задание
1 уровень . Заполните таблицу:
Название соли Уравнение гидролиза Среда раствора Окраска лакмусовой бумаги
Нитрат железа (///)
Сульфат лития
Сульфид калия
2 уровень. Почему дистиллированная вода имеет нейтральную реакцию, а водопроводная - слабощелочную? Выясните из дополнительных источников: какие соли находятся в нашей водопроводной воде и составьте уравнения их гидролиза.
3 уровень. Вспомните, какие соли входят в состав крови человека. Используя знания о гидролизе, объясните, почему среда плазмы слабощелочная. Составьте уравнения соответствующих реакций гидролиза.


