- Преподавателю
- Химия
- Конспект урока химии по теме Ферменты
Конспект урока химии по теме Ферменты
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Богомолова В.С. |
| Дата | 21.10.2014 |
| Формат | doc |
| Изображения | Есть |

Муниципальное общеобразовательное учреждение
средняя общеобразовательная школа с. Красная Горка
Заседание МО учителей химии
Колышлейского района
Урок химии в 10 классе.
Тема.
Ферменты.
Богомолова В.С.,
учитель химии МОУ СОШ с. Красная Горка
27 апреля 2011 года
Тема: Ферменты (Энзимы)
Задачи:
- образовательные: сформировать знания учащихся о ферментах - их особенностях, строении, механизме их действия; познакомить учащихся с классификацией ферментов, их ролью в клетке, практическим значением ферментов, реализовать межпредметные связи;
- развивающие: развивать познавательный интерес, самостоятельную активность учащихся в ходе выполнения исследовательских работ, развивать логическое мышление, умение делать выводы; развивать интерес к предмету, любознательность;
- воспитательные: воспитывать ответственность, аккуратность, бережное обращение с химическими реактивами, экологическую грамотность, прививать культуру общения в ходе совместной деятельности.
Оборудование:
1) На столах учащихся - оборудование и вещества к лабораторной работе «Специфичность действия ферментов амилазы и сахаразы»:
- крахмал (2 пробы),
- сахароза (2 пробы),
- растворы амилазы и дрожжевой сахаразы.
2) Таблицы: «Механизм действия ферментов», «Свойства ферментов».
3) Опорные конспекты «Ферменты» на столах учащихся.
4) Результаты исследовательских работ «Действие ферментов слюны на крахмал», «Действие желудочного сока на белки».
5) Презентации:
- «Ферменты»,
- «Каталитическая активность фермента каталазы».
6) Эпиграф урока: «Фермены - возбудители жизни». И.П.Павлов.
7) Перчатка (для демонстрации взаимодействия субстрата и фермента).
Подготовительный этап: класс делится на 6 групп, каждая из групп предварительно получает задание экспериментального, творческого характера, результаты выполнения которого освещаются на данном уроке.
План урока:
1) Ферменты. Строение ферментов.
2) Механизм действия ферментов.
3) Свойства ферментов. Лабораторная работа «Каталитическая активность ферментов».
4) Многообразие ферментов, их классификация.
5) Практическое использование ферментов.
Ход урока:
I.Организационный этап. Подготовка к восприятию нового материала.
Изучая химический состав клетки и процессы, которые в ней протекают, мы постоянно отмечаем, что химические реакции в клетке идут очень быстро. Например, синтез одной молекулы белка инсулина, состоящего из 51 аминокислотного остатка, завершается за 1-2 минуты, тогда как в лабораторных условиях для этого требуется много усилий, времени, средств: когда в 50-е годы этот белок был синтезирован искусственно, в этой работе принимали участие 10 человек в течение 3-х лет.
Проблема: почему же в клетке химические реакции протекают быстрее? (в клетке химические реакции катализируются ферментами).
Наш урок будет проходить под девизом Д. Хевеши:
«Мыслящий ум не чувствует себя счастливым, пока ему не удаётся связать воедино разрозненные факты, им наблюдаемые».
Прежде чем начать изучение нового материала, послушаем небольшую притчу.
Умирая, старый араб завещал своим сыновьям 17 прекрасных белых верблюдов: старшему - половину, среднему - третью часть, младшему - девятую часть. Когда араб умер, сыновья принялись делить свое наследство, но 17 верблюдов не делится ни на 2, ни на 3, ни на 9.
В это время через пустыню шел бедный ученый, дервиш и вел за собой старого черного верблюда, нагруженного книгами. Он подошел к братьям и спросил, о чем они горюют. Братья поведали о своем наследстве и невозможности его поделить. Тогда дервиш подарил им своего верблюда. У них стало 18 верблюдов и все получилось: старший получил 9 верблюдов, средний - 6, младший - 2 верблюда, остался старый верблюд ученого.
«Что с ним делать?» - спросили братья.
«Отдайте мне назад моего верблюда за то, что я помог разделить вам наследство, а то мне придется самому нести книги через пустыню» - попросил ученый, и братья вернули ему верблюда.
Вот этот черный верблюд и подобен ферменту. Он сделал возможным такой процесс, который без него был бы немыслим, а сам остался без изменений. И это, действительно, основное свойство ферментов.
II. Цели и задачи урока.
Задачи сегодняшнего урока: изучить особенности строения, механизм действия ферментов, их свойства, научиться классифицировать ферменты, понимать их практическое назначение.
Итак, запишите тему урока «Ферменты» (или Энзимы).
Какие же вещества мы называем ферментами? (это белки, катализирующие химические реакции). Это катализаторы обмена веществ. Дыхание, сокращение мышц, передача сигналов по нервным волокнам, свертывание крови - все эти процессы осуществляются при участии ферментов. Не случайно И.П.Павлов назвал ферменты «возбудителями жизни».
Готовясь к уроку, мы разделили класс на 6 групп, и каждая группа получила определённое задание:
1 группа: «История вопроса о ферментах».
2 группа: «Строение ферментов».
3 группа: «Механизм действия ферментов».
4 группа: «Свойства ферментов».
5 группа: «Многообразие ферментов, их классификация».
6 группа: «Практическое использование ферментов».
III. Изучение нового материала.
А начнем знакомство с ферментами с исторической справки.
- Слово предоставляется 1 группе.
Все обменные процессы протекают при участии биологических катализаторов - ферментов.
Термин «фермент» (от лат. fermentum - закваска) был предложен в начале XVII века голландским ученым Ван Гельмондом.
Длительное время шел спор между французским ученым Луи Пастером и немецким химиком Либихом о природе ферментов. Пастер считал ферменты живыми, и только искусственным получением ферментов дрожжей спор был разрешен в пользу Либиха. В конце XIX века из дрожжей был выделен сок, который вызывал брожение, как и дрожжи. В трактате знаменитого европейского алхимика Василия Валентина (XV в) брожение описывается как результат действия некоего духа, и этот дух назвали fermentum (лат. "закваска"). Постепенно происходила материализация ферментов: с духами было покончено.
В XIX веке большинство ученых уже считали процесс брожения совокупностью реакций, вызванных ферментами. Было предложено называть ферменты энзимами (от греч. "энзим"- "в дрожжах"). Сегодня термины фермент и энзим - синонимы. Еще в XVIII - XIX вв. некоторые ученые предполагали, что основой фермента является белок, но эта мысль не была услышана научным обществом. Лишь в 30-х годах ХХ в., когда американским биохимиком Нортропом были получены кристаллические ферменты пепсин и трипсин, их белковая природа была окончательно признана, и в 50-х годах подтверждена рентгеноструктурным анализом. На сегодняшний день известно более двух тысяч ферментов, а сколько еще не изучено?!
2. Какое строение имеют ферменты?
- отчёт 2 группы.
Ферменты - это белковые молекулы, синтезируемые живыми клетками. В каждой клетке имеются сотни различных ферментов. С их помощью осуществляются многочисленные химические реакции, которые проходят с большой скоростью при температурах, подходящих для данного организма, то есть в пределах от 5 до 40 градусов.
По строению ферменты делят на 2 группы:
- работа с опорным конспектом
А) ферменты-протеины (однокомпонентные, т.е. состоят только из белка).
Б) ферменты-протеиды (двухкомпонентные, состоящие из белка и небелковой части).
Что же является небелковой частью?
- это могут быть ионы металла - они называются кофактор.
- органическое вещество, непрочно связанное с белком - кофермент.
- органическое вещество, прочно связанное с белком - простетическая группа.
Вывод: все ферменты - белки. Но не все белки - ферменты.
Первичное закрепление: в чем же отличие протеинов от протеидов? Запишите схему классификации ферментов в тетрадь.
3 группа. Механизм действия ферментов.
Ферменты обладают чрезвычайно высокой каталитической активностью, они ускоряют реакции в десятки и сотни миллионов раз. Но интересно вот что! Чаще всего ферменты катализируют превращение веществ, размеры молекул которых по сравнению с размерами молекул ферментов очень малы. Например, фермент каталаза имеет молекулярную массу 250 тыс., а Н2О2, распад которого катализирует каталаза - всего 34, Такое соотношение между размерами фермента и субстрата (S) наводит на мысль, что каталитическая активность фермента определяется не всей его молекулой, а только небольшим его участком - активным центром фермента (небольшая часть молекулы фермента (3-5 аминокислотных остатков). Как мы знаем, реакция между веществами происходит при условии тесного сближения их молекул.
Взаимодействие субстрата (S) c ферментом впервые изучил немецкий ученый Эмиль Фишер. Он высказал гипотезу (1880 г.), согласно которой субстрат подходит активному центру фермента как «ключ к замку» или как «рука к перчатке»:
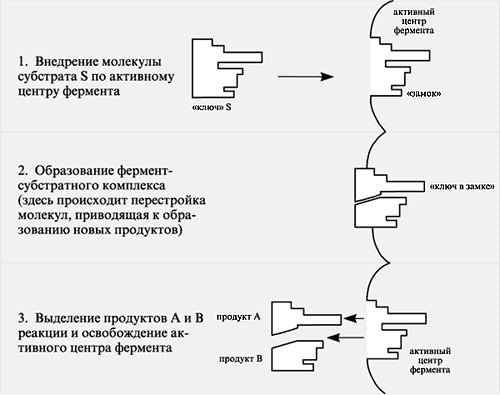
Е + S → Е S → Е S 1 → ЕР → Е + Р
фермент субстрат фермент- преобразованный фермент- фермент продукт
субстратный фермент- продуктивный
комплекс субстратный комплекс
комплекс
Схема каталитического действия фермента
с образованием фермент-субстратного комплекса
Образовавшиеся продукты по форме уже не соответствуют активному центру. Они отделяются от «замка» фермента и поступают в окружающую среду, после этого освободившийся активный центр может принимать новые молекулы субстрата.
При денатурации фермента его каталитическая активность исчезает, т.к. нарушается структура активного центра.
Кроме активного центра в молекуле фермента выделяют еще аллостерический центр, который способен присоединить низкомолекулярные вещества - активаторы или ингибиторы. В результате этого нарушается третичная структура фермента и взаимодействие фермента и субстрата не происходит.
Ингибиторами являются ионы тяжёлых металлов, сильные кислоты, щёлочи, спирт - они блокируют деятельность фермента. Хлорид-ионы повышают активность фермента, являясь активаторами.
4 группа. Свойства ферментов.
Ферменты отличаются рядом свойств.
1. Термолабильность - изменчивость фермента под влиянием температуры.
При возрастании температуры активность фермента сначала растет, а затем, выше
определенной температуры, начинает снижаться.
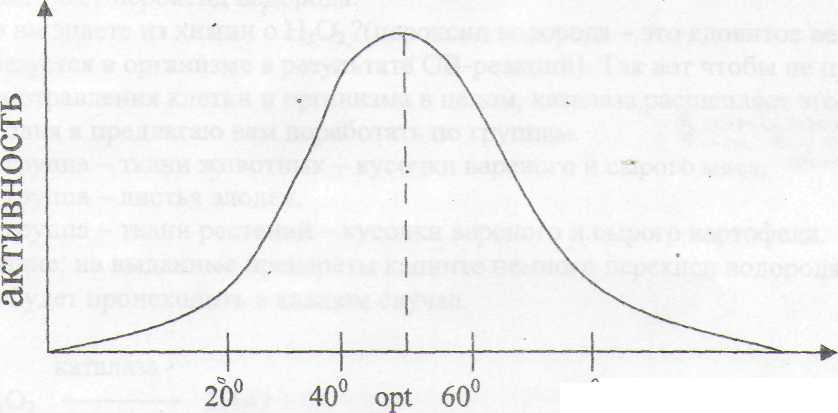
При t= 70° и выше большинство ферментов полностью утрачивают свою активность из-за денатурации белка.
Каждый фермент характеризуется температурным оптимумом. Для ферментов животного происхождения topt = 40-50°, для ферментов растительного происхождения -50-60°, для человека ~ 37°.
При понижении t° ферменты теряют свою активность, но при создании нормальных условий они вновь начинают функционировать.
Вывод учащихся: Активность ферментов лежит в температурном пределе 38-60°С. С повышением температуры до 70-80°С активность фермента падает, что связано с изменением природной структуры фермента и разрушением его центров. При повышении температуры более 80°С происходит инактивация фермента вследствие денатурации белка.
2. Влияние РН на активность ферментов.
Различные ферменты имеют различное значение РН:
А) амилаза слюны: РН = 7 (нейтральная среда);
Б) пепсин желудочного сока действует в кислой среде (РН=1,5-2,5),
В) трипсин кишечного сока имеет РН = 8-9 (щелочная среда).
Результаты исследовательской работы
«Действие ферментов желудочного сока на белки»
В пробирку с полусваренным куриным белком долили немного натурального желудочного сока и поместили ее в теплую воду (38-39 °С). Через 20-30 мин хлопья белка исчезли.
Условия опыта
Наблюдения
Вывод
1. Температура 37˚, HCl
Произошло расщепление белка
Пищеварение в желудке происходит только при температуре тела (35-37˚) и в присутствии HCl (в кислой среде)
2. Температура 37˚, добавили NaOH
Белок не расщепляется
3. Пробирка в стакане со льдом
Белок не расщепляется
3. Специфичность действия фермента.
В отличие от неорганических катализаторов действие ферментов строго специфично. Например, фермент лактаза расщепляет только молочный сахар - лактозу - с образованием глюкозы и галактозы.
- уравнение реакции на слайде.
Фермент действует строго на определенный вид связи. В качестве примера давайте рассмотрим реакцию расщепления мочевины:
О
║ уреаза
H2N -С -NH2 +H2O → 2NH3↑ + СО2↑
Этот пример знаком всем владельцам кошек: мочевина, содержащаяся в моче кошек, разлагается на аммиак и СО2 - именно аммиаком и пахнет кошачий ящик с песком, если песок долго не меняли.
Уреазу образуют бактерии, попадающие в песок из воздуха и начинающие расти и размножаться. За 1 секунду 1 молекула уреазы расщепляет 30.000 молекул мочевины. Если бы не было уреазы, то на это потребовалось бы 3 млн. лет.
И еще. Данный пример затрагивает одну очень серьезную экологическую проблему, которая касается и нашего села: повышенное содержание аммиака в воде. В результате этого отмечается повышенное число женских заболеваний и повышенная заболеваемость кариесом.
В 2010-2011 учебном году в МОУ СОШ с. Красная Горка обучается 154 учащихся, из них
- здоровых детей - 26%,
- детей с I группой здоровья - 66%
- стоящих на Д-учете - 8%.
Наибольший показатель среди заболеваний имеет кариес:
Учебный год
Количество учащихся в школе
Количество учащихся с заболеванием кариес
2008-2009 учебный год
173
116 - 67%
2009-2010 учебный год
155
78 - 50%
2010-2011 учебный год
154
68 - 44%
Снижение количества школьников с заболеваемостью кариес мы связываем с деятельностью реабилитационного центра на базе школы, учащиеся своевременно проходят лечение и профилактические мероприятия.
Что ещё можно сделать для снижения этих заболеваний? (кипячение воды - при кипячении воды аммиак улетучивается).
Исследовательская работа
«Специфичность действия ферментов амилазы и сахаразы»
№ пробы
Субстрат
Фермент
Результат опыта
1
Крахмал
Амилаза слюны
Гидролиз крахмала до мальтозы. Реакция с йодом отрицательная (результаты домашней исследовательской работы)
2
Крахмал
Дрожжевая сахараза
Реакция с йодом положительная. Гидролиз крахмала не произошёл
3
Сахароза
Амилаза слюны
Реакция с фелинговой жидкостью (1 мл NaOH + несколько капель CuSO4) отрицательная - гидролиз не идёт
4
Сахароза
Дрожжевая сахараза
Реакция с фелинговой жидкостью положительная. Произошёл гидролиз сахарозы до глюкозы. Глюкоза окисляется до глюконовой кислоты: появляется жёлтое CuOH, а затем красное окрашивание Cu2O
Вывод: амилаза слюны катализирует расщепление крахмала, но не действует на сахарозу. Дрожжевая сахараза катализирует расщепление сахарозы, но не действует на крахмал.
Общий вывод: ферменты обладают высокой специфичностью действия. Каждый фермент выполняет строго отведённые ему функции, не влияя на течение многих десятков и сотен других реакций. Это объясняется точным взаимным пространственным соответствием молекул субстрата и активного центра фермента.
Результаты домашней исследовательской работы
«Действие ферментов слюны на крахмал».
Налейте в посуду стакан холодной воды и разведите в ней пол-ложки крахмала. На небольшом огне доведите жидкость до кипения и варите еще 5~10 мин, постоянно помешивая, до образования однородной клейкой массы. Смочите в крахмальном клейстере бинт и дайте ему просохнуть.
Приготовьте реактив на крахмал - йодную воду (налейте в блюдце немного воды и добавьте несколько капель йода, чтобы получилась жидкость цвета крепко заваренного чая).
Исследуйте ферменты своей слюны. Намотайте на спичку вату, смочите ее слюной, а затем на накрахмаленном бинте слюной напишите букву или сделайте рисунок. Расправленный бинт зажмите в руках и подержите его некоторое время (1-2 мин), чтобы он нагрелся.
Опустите бинт в йодную воду, тщательно расправив его. Участки, где остался крахмал, окрасятся в синий цвет, а места, обработанные слюной, останутся белыми, так как крахмал в них распался до глюкозы, которая с йодом синего окрашивания не дает. Если все сделано верно, на синем фоне появится белая буква или рисунок.
Какова каталитическая активность ферментов? Этот вопрос мы рассмотрим на примере изучения работы фермента каталазы.
В каждой растительной и животной клетке имеется фермент каталаза, который
расщепляет пероксид водорода.
Пероксид водорода - это ядовитое вещество, которое образуется в организме в результате ОВ-реакций. Так вот чтобы не произошло самоотравления клетки и организма в целом, каталаза расщепляет это вещество до воды и кислорода:
каталаза
2Н2О2 -----------> 2Н2О + О2↑
- отчёт 4 группы.
Защита проекта
«Каталитическая активность ферментов».
- презентация
Вывод: общие свойства ферментов:
-
способны к растворению в воде и образованию коллоидных растворов;
-
увеличивают скорость реакции;
-
не расходуются в реакции;
-
амфотерны;
-
их присутствие не влияет на свойства продуктов реакции;
-
характерно протекание цветных реакций;
-
изменяют энергию активации, при которой может произойти реакция;
-
не изменяют сколько-нибудь значительно температуру, при которой происходит реакция;
-
способны к денатурации и гидролизу.
5 группа. Многообразие ферментов, их классификация.
Названия ферментов производят от названий субстратов, на которые они действуют, по схеме: тип катализируемой данным ферментом реакции + название одного из продуктов реакции (или одного из ее участников) с прибавлением окончания -аза. Окончание -аза служит для обозначения ферментной природы. Например: фермент молочная оксидаза (другое название - дегидрогеназа) катализирует превращение молочной кислоты в уксусную.
По названию фермента можно понять сущность реакции.
Почти каждая химическая реакция в клетке катализируется особым ферментом. Число реакций в клетке достигает нескольких тысяч. Соответственно, в клетке обнаружено несколько тысяч ферментов. И чтобы не запутаться в их многообразии, их классифицируют.
Давайте поработаем с опорным конспектом и учебником: назовите группу ферментов и укажите их функцию (фронтальная работа - по цепочке)
Группа
Катализируемая реакция
Оксидо-редуктазы
480 ферментов. Катализируют ОВ-реакции в живой клетке - дыхание, брожение, гликолиз.
Трансферазы
Перенос определенных групп атомов от одного вещества к другому
Гидролазы.
460 ферментов, к ним относятся пищеварительные ферменты, входящие в состав лизосом и других органоидов, где они способствуют распаду более крупных биомолекул на простые.
Катализируют реакции гидролиза, при которых из субстрата образуются два продукта.
Лиазы.
230 ферментов. Катализируют реакции негидролитического расщепления. Различают
С-С-лиазы
С-О-лиазы
C-N-лиазы
Изомеразы.
80 ферментов Ферменты, катализирующие превращения в пределах одной молекулы (реакции изомеризации), они вызывают внутримолекулярные перестройки.
Лигазы (синтетазы)
Около 80 ферментов. Катализируют реакции синтеза.
6 группа. Практическое использование ферментов.
Существует наука, которая занимается изучением ферментов - энзимология.
Ферменты получили широкое применение в легкой, пищевой и химической промышленности, а также в медицинской практике.
1. В пищевой промышленности ферменты используют при приготовлении безалкогольных напитков, пива, сыров, консервов, колбас, копченостей.
2. В животноводстве ферменты используют при приготовлении кормов для с/х животных, особенно молодняка.
Мы беседовали с главным ветеринарным врачом ООО «Красная Горка» Зелинским Виктором Владимировичем и он рассказал нам о том, что для животноводства выпускают ферментные препараты 2-х групп - грибные и бактериальные. Например: пектавомарин - культура плесневого гриба; амилоризин - высушенная культура плесневого гриба.
Как же вводятся ферментные препараты и какова их норма введения?
Наиболее современный способ применения препаратов - введение их в состав
премиксов или комбикормов. Нормы введения ферментов рассчитывают исходя из возраста и планируемого прироста животных. Например, для телят молочного возраста ферментные препараты вводят в молоко, а после 4-х месяцев - в концентратную смесь. Норму ввода ферментных препаратов в комбикорм исчисляют из количества кормовых единиц и удельного веса комбикорма в рационе. Например, при общей потребности животного в 10 кормовых единиц в сутки требуется ввести в рацион 20 грамм глюкавомарина.
- таблица «Нормы введения ферментных препаратов в комбикорма для свиней (в %).
3. Ферменты используют при изготовлении фотоматериалов.
4. Ферменты используют при обработке овса и конопли.
5. Ферменты используют для смягчения кожи в кожевенной промышленности.
6. Ферменты входят в состав стиральных порошков, зубных паст.
7. В медицине ферменты имеют диагностическое значение - определение отдельных ферментов в клетке помогает распознаванию природы заболевания (например, вирусный гепатит - по активности фермента в плазме крови) их используют для замещения недостающего фермента в организме.
Вывод учащихся 6 группы: ферменты применяются более чем в 25 отраслях промышленности, медицине, ведутся разработки по применению ферментов для превращения химической энергии в электрическую. И это лишь малая часть того поля деятельности, которое отвел ферментам человек.
III. Закрепление изученного материала.
1) Итак, какой вывод можно сделать по изученной теме?
Общий вывод: ферменты - катализаторы и для них характерны все принципы катализа, но ферменты обладают и рядом уникальных свойств, которые их отличают от неорганических катализаторов. Это отличие объясняется белковой природой фермента.
2) Как вы понимаете выражение: «Все ферменты - белки, но не все белки - ферменты»?
3) Тест.
I. Выбери правильный ответ:
1. Ферменты - это катализаторы:
а) углеводной природы;
б) белковой природы;
в) неорганической природы;
г) липидной природы.
2. Участок молекулы фермента, отвечающий за присоединение вещества:
а) каталитический центр;
б) субстратный центр;
в) аллостерический центр;
г) активный центр.
3. Почему под влиянием высокой температуры ферменты теряют свою активность?
а) понижается активность субстрата;
б) изменяется пространственная структура молекул;
в) изменяется содержание ферментов в клетке.
4. При какой температуре наступает оптимальная активность ферментов у животных?
а) 40-50˚;
б) 30-40˚;
в) 50˚.
5. Что происходит с ферментом при его взаимодействии с субстратом?
а) фермент мутирует;
б) фермент не изменяется;
в) фермент превращается в новое вещество.
- Взаимопроверка (анализ теста)
Число правильных ответов
Вывод
5
Тему усвоил
4
Тему усвоил достаточно
3
Тему усвоил плохо
2
Тему не усвоил, приходишь на дополнительное занятие
II. Дайте ответ в форме: А =Б; А> Б; А<Б.
1.
А. Скорость гидролиза крахмала в присутствии 10% соляной кислоты, при 100°;
Б. Скорость гидролиза крахмала в присутствии амилазы, при 37°. (А < Б)
2.
А. Каталитическая активность каталазы в реакции разложения Н2О2 ;
Б. Каталитическая активность железа в реакции разложения Н2О2. (А > Б)
3.
А. Температурный оптимум для ферментов.
Б. Температурный оптимум для неорганических катализаторов. (А < Б)
IV. Итог урока, оценка и учет знаний.
V. Домашнее задание:
1) Изучить § 30,
2) Задача 8 (с.256),
3) Творческое задание: подготовить презентацию. Реферат по теме «Области применения ферментов»,
4) Индивидуальные задания: подготовить опережающие задания по теме «Гормоны»
VI. Рефлексия.
Жизнь на самом деле состоит
Из невероятных комбинаций.
Если все Отечество грустит,
Не переставайте улыбаться!
Это, разумеется, не путь
Вовремя остановить ошибки.
Но ведь должен, должен кто-нибудь
Просто так дарить свою улыбку!
- Спасибо вам за урок и хорошего вам настроения!
Приложения
Исследовательская работа.
Действие ферментов слюны на крахмал.
Налейте в посуду стакан холодной воды и разведите в ней пол-ложки крахмала. На небольшом огне доведите жидкость до кипения и варите еще 5~10 мин, постоянно помешивая, до образования однородной клейкой массы. Смочите в крахмальном клейстере бинт и дайте ему просохнуть.
Приготовьте реактив на крахмал - йодную воду (налейте в блюдце немного воды и добавьте несколько капель йода, чтобы получилась жидкость цвета крепко заваренного чая).
Исследуйте ферменты своей слюны. Намотайте на спичку вату, смочите ее слюной, а затем на накрахмаленном бинте слюной напишите букву или сделайте рисунок. Расправленный бинт зажмите в руках и подержите его некоторое время (1-2 мин), чтобы он нагрелся.
Опустите бинт в йодную воду, тщательно расправив его. Участки, где остался крахмал, окрасятся в синий цвет, а места, обработанные слюной, останутся белыми, так как крахмал в них распался до глюкозы, которая с йодом синего окрашивания не дает. Если все сделано верно, на синем фоне появится белая буква или рисунок.
Мы провели исследовательскую работу
«Действие ферментов слюны на крахмал».
В приготовленном крахмальном клейстере смочили бинт и дали ему просохнуть.
Затем приготовили реактив на крахмал - йодную воду (в воду добавили несколько капель йода, чтобы получилась жидкость цвета крепко заваренного чая).
Намотали на спичку вату, смочили её слюной, а затем на накрахмаленном бинте слюной сделали рисунок. Расправленный бинт зажали в руках и подержали 1-2 мин, чтобы он нагрелся.
Затем опустили бинт в йодную воду, тщательно расправив его. Участки, где остался крахмал, окрасились в синий цвет, а места, обработанные слюной, остались белыми, так как крахмал в них распался до глюкозы, которая с йодом синего окрашивания не дает. В результате на синем фоне появился белый рисунок.
Исследовательская работа.
Действие ферментов желудочного сока на белки
В пробирку с полусваренным куриным белком долейте немного натурального желудочного сока и поместите ее в теплую воду (38-39 °С). Через 20-30 мин хлопья белка исчезнут. Объясните, почему это произошло.
3. Лабораторный опыт
«Открытие фермента каталазы»
Цель. Доказать присутствие ферментов в животных и растительных клетках.
Оборудование и реактивы. Штатив с пробирками, микроскоп, предметное стекло, лучинка, спички; стакан с Н2О2 (3%-й р-р), песок, ткани растительные и животные.
Ход работы
Ферменты содержатся в каждой животной и растительной клетках. Большая часть ферментов связана с определенными клеточными структурами (ядро, цитоплазма, пластиды, лизосомы и т. д.), где и осуществляется их функция. Каталаза содержится в микротельцах (пероксисомах). Эти тельца имеют овальную форму, зернистую структуру, находятся в цитоплазме.
Пероксисомы имеют размеры 0,3-1,5 мкм
и содержат внутри кристаллические ферменты
Пероксисомы имеют размеры 0,3-1,5 мкм и содержат внутри кристаллические ферменты. Фермент каталаза катализирует расщепление пероксида водорода с образованием молекул воды и кислорода: Расщепляя Н2О2, каталаза играет защитную роль. Она обезвреживает ядовитое вещество (пероксид водорода), которое непрерывно образуется в клетке в процессе жизнедеятельности. Активность фермента очень высока: при 0 °С - 1 молекула катализатора разлагает за 1 секунду до 40 000 молекул Н2О2 .
Практическая часть.
1. Прилейте по 2 мл Н2О2 в пять пробирок с:
а) сырой печенью;
б) вареной печенью;
в) сырым картофелем;
г) вареным картофелем;
д) песком.
2. На предметное стекло в каплю воды положите лист бегонии и рассмотрите его под микроскопом.
3. Нанесите на лист элодеи две капли пероксида водорода и под микроскопом наблюдайте бурное выделение пузырьков кислорода из клеток листа элодеи.
4. Результаты эксперимента:
Образцы
Наблюдения
Вывод
Сырое мясо
Сырая рыба
Сырой картофель
Наблюдается выделение пузырьков газа
В образцах живых тканей происходит реакция расщепления пероксида водорода.
Варёное мясо
Варёная рыба
Варёный картофель
Изменений не происходит
В тканях образцов, подвергнутых термической обработке, реакция не происходит.
5. Ответьте на вопросы.
-
Чем обусловлено расщепление пероксида водорода в пробирках с кусочками сырой печени, сырого картофеля и при действии пероксида водорода на лист элодеи?
-
Какие уровни организации молекулы белка-фермента каталазы разрушаются при варке картофеля и печени в нашем опыте и разрыв каких молекулярных связей привел к денатурации этого белка?
-
Почему расщепление пероксида водорода в пробирках с кусочками вареного картофеля и печени, а также в пробирке с песком не наблюдалось?
Объяснение результатов опытов:
В тканях и клетках живых организмов присутствуют специальные белки, выполняющие роль биологических катализаторов - ферментов.
В тканях и клетках, подвергнутых термической обработке, белки денатурировали, разрушилась их структура.
Изменение условий опытов:
Провели опыты, идентичные предыдущим, но предварительно измельчили образцы тканей при помощи пестика, ступки и речного песка, увеличив площадь соприкосновения реагирующих веществ. Результат тот же, но увеличилась скорость химической реакции.
Выводы:
Биологические катализаторы - ферменты - дают возможным протекание химических реакций при нормальных условиях: комнатной температуре и без использования каких-либо сильнодействующих химических веществ.
Увеличение площади соприкосновения реагентов увеличивает скорость химической реакции.
ЛИТЕРАТУРА
Батуев А.С., Гуленкова М.А. и др. Биология. Большой справочник для школьников и поступающих в вузы. М.: Издательский дом «Дрофа», 1999, с. 116; Биология (приложение к газете «Первое сентября»), 1999, № 15;
Грин Н., Стаут У., Тейлор Д. Биология. М.: Мир, 1990, т. 1, с. 195-209;
Демьяненков Е.Н. Биология в вопросах и ответах. М.: Просвещение, 1996, с. 38;
Ермолаев М.В. Биологическая химия. М.: Медицина, 1983, с. 92-114;
Кемп П., Арис К. Введение в биологию. М.: Мир, 1988, с. 251-253;
Корсунская В.М., Мироненко Г.Н., Мокеева З.А., Верзилин Н.М. Уроки общей биологии. М.: Просвещение, 1986,
с. 137-141;
Муртазин Г.М. Задачи и упражнения по общей биологии. М.: Просвещение, 1981, с. 81-82, 91-92;
Овчинников Ю.А., Шамин А.Н. Строение и функции белков. (Библиотека Детской энциклопедии.) М.: Педагогика, 1983, с. 49-74;
Рудзитис Г.Е., Фельдман Ф.Г. Химия-11. М.: Просвещение, 1998.



