- Преподавателю
- Химия
- Конспект урока по химии по теме Решение расчетных задач
Конспект урока по химии по теме Решение расчетных задач
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Савинская Т.А. |
| Дата | 10.02.2015 |
| Формат | docx |
| Изображения | Есть |
Класс 9.Тема урока: Решение расчетных задач.
Цель урока: учащиеся смогут производить расчеты по уравнениям химических реакций.
Критерии успеха: учащиеся решают расчетные задачи на нахождение массы или объема продукта реакции по известной массе исходного вещества, содержащего примеси и рассчитывать практический выход продукта реакции по известной массе исходного вещества и массовой доле выхода продукта реакции.
Тип урока: комбинированный.
Технологическая карта урока.
Этапы
Деятельность учителя
Деятельность учащихся
1.организационный этап
Приветствие, позитивный настрой. Предложение разделиться на группы случайным способом
Приветствие, готовность к уроку. Делятся на группы по картинкам цветов. Получают листы самооценивания.
2. Стадия вызова.
Предлагает разгадать интерактивный кроссворд по теме «Металлы»
Разгадывают кроссворд.
3.стадия осмысления.
Прием «Найди ошибку»
Раздает задачи с решенной задачей, в которой допущена ошибка. Какая группа быстрее найдет ошибку. (Приложение1)
Знакомятся с условием задачи, ее решением. Находят ошибку. Задание оценивается на скорость нахождения ошибки.
Предлагает решить задачи на нахождение массы или объема продукта реакции по известной массе исходного вещества. Группы получают разные задачи.(Приложение 2)
Работают в группах, решают на листах задачи.
Проводят оценивание решенных задач других групп по критериям, предложенных учителем, передавая листы с решением по кругу.
Аргументируют свои оценки.
Предлагает решить задачи на расчет практического выхода продукта реакции по известной массе исходного вещества и массовой доле выхода продукта реакции.(приложение 3)
Все группы получают одинаковые задачи и критерии оценивания (Приложение 4)
Анализируют, логически мыслят, решают.
Проводят оценивание решенных задач других групп по критериям, предложенных учителем, передавая листы с решением по кругу.
4. Рефлексия.
«Сигнал рукой»
Предлагает провести самооценку в листах самооценивания. (Приложение 5)
Поднимают большой палец.
Оценивают свою работу на листах оценивания в %
5. Домашнее задание.
Две задачи на дом. По желанию придумать и решить свою задачу
Записывают Д/З
Приложение 1.
«Найди ошибку»
Задача. Какой объем углекислого газа (н.у.) выделится при сжигании 500г угля, содержащего 8 % негорючих примесей. Найдите ошибку в решении задачи
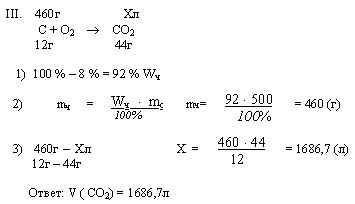
Приложение 2.
Задача №1. Вычислите массу хлорида кальция, полученного при взаимодействии соляной кислоты с оксидом кальция массой 50г, содержащего 5% примесей.
Задача № 1.Вычислите массу оксида кальция, который может быть получен при разложении карбоната кальция массой 5о кг, массовая доля примесей в котором составляет 20 %.
Задача № 1Сколько граммов оксида кальция можно получить из 400г известняка, содержащего 20% примесей?
Задача № 1. Сколько граммов железа можно получить алюминотермическим способом из 40 г. оксида железа (III), содержащего 20 % примесей?
Задача № 1.Вычислить объем углекислого газа (н.у.) , получившегося при обжиге 300 г известняка (СаСО3), содержащего 10 % примесей.
Приложение 3.
Задача № 2. 64,8г оксида цинка восстановили избытком углерода. Определите массу образовавшегося металла, если выход продукта реакции равен 65%.
Приложение 4
Критерии оценивания решения задачи
1.Правильное оформление (Дано, найти)
2. В решении записано уравнение реакции
3. Соблюден порядок действий.
4. Произведены математические расчеты, записан ответ
Оценка «5» - все выполнено правильно
Оценка «4» - есть ошибки в математических расчетах
Оценка «3» - есть дано, найти, уравнение реакции, выполнено одно действие из двух
Приложение 5.
Лист самооценивания. Оцени свою работу в от 1 до 100%
Фамилия, имя ____________________________________________________
1 задание «лови ошибку»
Задача на примеси
Задача на выход продукта
итоговая
Задача № 2. Вычислите объем водорода (н.у.), который может быть получен при взаимодействии 105г калия с водой, если выход газа составляет 75% от теоретически возможного.
Задача № 2. Над 16 г серы пропустили водород при нагревании. Определите объем (н.у.) полученного сероводорода, если выход продукта реакции составляет 85% от теоретически возможного.
Задача № 2 Какая масса железа образуется , если взяли для восстановления оксидом углерода (II) оксид железа (III)массой 20 г. , если выход железа 80% от теоретически возможного.
Задача № 2. 64,8г оксида цинка восстановили избытком углерода. Определите массу образовавшегося металла, если выход продукта реакции равен 65%.
Задача №2. Сколько граммов железа можно получить с помощью угарного газа из 50,2 г. красного железняка, содержащего оксида железа (III), если практический выход железа составляет 85% от теоретического?
Задача № 2. Вычислите объем водорода (н.у.), который может быть получен при взаимодействии 105г калия с водой, если выход газа составляет 75% от теоретически возможного.
Задача № 2. Над 16 г серы пропустили водород при нагревании. Определите объем (н.у.) полученного сероводорода, если выход продукта реакции составляет 85% от теоретически возможного.
Задача № 2 Какая масса железа образуется , если взяли для восстановления оксидом углерода (II) оксид железа (III)массой 20 г. , если выход железа 80% от теоретически возможного.
Задача № 2. 64,8г оксида цинка восстановили избытком углерода. Определите массу образовавшегося металла, если выход продукта реакции равен 65%.
Задача №2. Сколько граммов железа можно получить с помощью угарного газа из 50,2 г. красного железняка, содержащего оксида железа (III), если практический выход железа составляет 85% от теоретического?
Задача № 2. Вычислите объем водорода (н.у.), который может быть получен при взаимодействии 105г калия с водой, если выход газа составляет 75% от теоретически возможного.
Задача № 2. Над 16 г серы пропустили водород при нагревании. Определите объем (н.у.) полученного сероводорода, если выход продукта реакции составляет 85% от теоретически возможного.
Задача № 2 Какая масса железа образуется , если взяли для восстановления оксидом углерода (II) оксид железа (III)массой 20 г. , если выход железа 80% от теоретически возможного.
Задача № 2. 64,8г оксида цинка восстановили избытком углерода. Определите массу образовавшегося металла, если выход продукта реакции равен 65%.
Задача №2. Сколько граммов железа можно получить с помощью угарного газа из 50,2 г. красного железняка, содержащего оксида железа (III), если практический выход железа составляет 85% от теоретического?
Задача № 2. Вычислите объем водорода (н.у.), который может быть получен при взаимодействии 105г калия с водой, если выход газа составляет 75% от теоретически возможного.
Задача № 2. Над 16 г серы пропустили водород при нагревании. Определите объем (н.у.) полученного сероводорода, если выход продукта реакции составляет 85% от теоретически возможного.
Задача № 2. 64,8г оксида цинка восстановили избытком углерода. Определите массу образовавшегося металла, если выход продукта реакции равен 65%.
Задача № 2. 64,8г оксида цинка восстановили избытком углерода. Определите массу образовавшегося металла, если выход продукта реакции равен 65%.
Задача № 2. 64,8г оксида цинка восстановили избытком углерода. Определите массу образовавшегося металла, если выход продукта реакции равен 65%.
Задача № 2. 64,8г оксида цинка восстановили избытком углерода. Определите массу образовавшегося металла, если выход продукта реакции равен 65%.
Задача № 2. 64,8г оксида цинка восстановили избытком углерода. Определите массу образовавшегося металла, если выход продукта реакции равен 65%.
Задача № 2. 64,8г оксида цинка восстановили избытком углерода. Определите массу образовавшегося металла, если выход продукта реакции равен 65%.
Задача № 2. 64,8г оксида цинка восстановили избытком углерода. Определите массу образовавшегося металла, если выход продукта реакции равен 65%.
Задача № 2. 64,8г оксида цинка восстановили избытком углерода. Определите массу образовавшегося металла, если выход продукта реакции равен 65%.
Задача № 2. 64,8г оксида цинка восстановили избытком углерода. Определите массу образовавшегося металла, если выход продукта реакции равен 65%.
Задача № 2. 64,8г оксида цинка восстановили избытком углерода. Определите массу образовавшегося металла, если выход продукта реакции равен 65%.
Критерии оценивания решения задачи
1.Правильное оформление (Дано, найти)
2. В решении записано уравнение реакции
3. Соблюден порядок действий.
4. Произведены математические расчеты, записан ответ
Оценка «5» - все выполнено правильно
Оценка «4» - есть ошибки в математических расчетах
Оценка «3» - есть дано, найти, уравнение реакции, выполнено одно действие из двух
Критерии оценивания решения задачи
1.Правильное оформление (Дано, найти)
2. В решении записано уравнение реакции
3. Соблюден порядок действий.
4. Произведены математические расчеты, записан ответ
Оценка «5» - все выполнено правильно
Оценка «4» - есть ошибки в математических расчетах
Оценка «3» - есть дано, найти, уравнение реакции, выполнено одно действие из двух
Критерии оценивания решения задачи
1.Правильное оформление (Дано, найти)
2. В решении записано уравнение реакции
3. Соблюден порядок действий.
4. Произведены математические расчеты, записан ответ
Оценка «5» - все выполнено правильно
Оценка «4» - есть ошибки в математических расчетах
Оценка «3» - есть дано, найти, уравнение реакции, выполнено одно действие из двух
Металлы - простые вещества
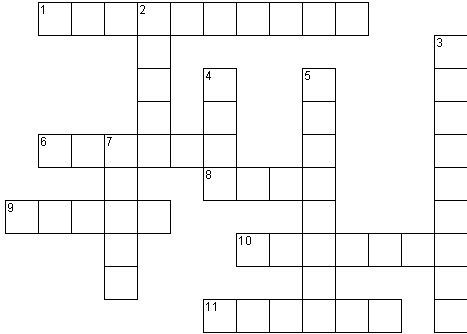
1. Способность атомов одного химического элемента образовывать несколько простых веществ.
2. Металл, который при низких температурах способен изменять свою аллотропную модификацию, превращаясь в серый мелкокристаллический порошок.
3. Элементарные частицы, придающие металлам свойство электропроводности.
4. Один из наиболее твердых металлов.
5. Самый неэлектропроводный и тугоплавкий металл.
6. Самый пластичный металл
7. Самый легкий металл.
8. Металл, из которого отливают колокола, благодаря его способности хорошо звенеть.
9. Металл, который при обычных условиях является жидкостью.
10. Наиболее блестящий и электропроводный металл.
11. Металл, имеющий наибольшую плотность.
Задача №1. Вычислите массу хлорида кальция, полученного при взаимодействии соляной кислоты с оксидом кальция массой 50г, содержащего 5% примесей.
Задача № 1.Вычислите массу оксида кальция, который может быть получен при разложении карбоната кальция массой 5о кг, массовая доля примесей в котором составляет 20 %.
Задача № 1Сколько граммов оксида кальция можно получить из 400г известняка, содержащего 20% примесей?
Задача № 1. Сколько граммов железа можно получить алюминотермическим способом из 40 г. оксида железа (III), содержащего 20 % примесей?
Задача № 1.Вычислить объем углекислого газа (н.у.) , получившегося при обжиге 300 г известняка (СаСО3), содержащего 10 % примесей.
Задача №1. Вычислите массу хлорида кальция, полученного при взаимодействии соляной кислоты с оксидом кальция массой 50г, содержащего 5% примесей .
Задача № 1.Вычислите массу оксида кальция, который может быть получен при разложении карбоната кальция массой 5о кг, массовая доля примесей в котором составляет 20 %.
Задача № 1Сколько граммов оксида кальция можно получить из 400г известняка, содержащего 20% примесей?
Задача № 1. Сколько граммов железа можно получить алюминотермическим способом из 40 г. оксида железа (III), содержащего 20 % примесей?
Задача № 1.Вычислить объем углекислого газа (н.у.) , получившегося при обжиге 300 г известняка (СаСО3), содержащего 10 % примесей.
Лист самооценивания. Оцени свою работу в от 1 до 100%
Фамилия, имя ____________________________________________________
1 задание «лови ошибку»
Задача на примеси
Задача на выход продукта
итоговая
Лист самооценивания. Оцени свою работу в от 1 до 100%
Фамилия, имя ____________________________________________________
1 задание «лови ошибку»
Задача на примеси
Задача на выход продукта
Итоговая
Лист самооценивания. Оцени свою работу в от 1 до 100%
Фамилия, имя ____________________________________________________
1 задание «лови ошибку»
Задача на примеси
Задача на выход продукта
Итоговая
Лист самооценивания. Оцени свою работу в от 1 до 100%
Фамилия, имя ____________________________________________________
1 задание «лови ошибку»
Задача на примеси
Задача на выход продукта
Итоговая
Лист самооценивания. Оцени свою работу в от 1 до 100%
Фамилия, имя ____________________________________________________
1 задание «лови ошибку»
Задача на примеси
Задача на выход продукта
Итоговая
Лист самооценивания. Оцени свою работу в от 1 до 100%
Фамилия, имя ____________________________________________________
1 задание «лови ошибку»
Задача на примеси
Задача на выход продукта
Итоговая


