- Преподавателю
- Химия
- Конспект урока химии Соединения химических элементов (8 класс)
Конспект урока химии Соединения химических элементов (8 класс)
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Конспекты |
| Автор | Яковлева О.А. |
| Дата | 05.10.2015 |
| Формат | doc |
| Изображения | Есть |
КОНСПЕКТ УРОКА ПО ТЕМЕ
"СОЕДИНЕНИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ"
(8 КЛАСС, УРОК РАЗВИВАЮЩЕГО КОНТРОЛЯ)
Яковлева Ольга Алексеевна,
учитель химии МАОУ СОШ №28
г. Балаково Саратовской области
Деятельностная цель: формирование способности учащихся к осуществлению контрольной функции.
Образовательная цель: контроль и самоконтроль изученных понятий по теме "Соединения химических элементов", алгоритмов составления химических формул, решения задач.
Тип урока: урок развивающего контроля
Формируемые общеучебные действия:
-
самостоятельное выделение и формулирование познавательной цели;
-
поиск и выделение необходимой информации;
-
знаково-символические действия;
-
умения структурировать знания;
-
умение осознанно и произвольно строить речевое высказывание;
-
выбор наиболее эффективных способов решения задач;
-
контроль и оценка процесса результатов деятельности.
Оборудование:
Карточки с заданиями, оборудование для лабораторного опыта: штатив с пробирками, натрий, вода, растворы: соляной кислоты, гидроксида натрия, лакмуса, метилоранжа, фенолфталеина.
Урок проходит в виде турнира, в котором участвуют 3 команды (по рядам). За каждый правильный ответ учение получает жетон. От числа жетонов зависит оценка за урок.
Ход урока:
Вступительное слово учителя: В своё время философ Конфуций сказал "Учиться, а время от времени повторять изученное, разве неприятно?" Эти слова и будут эпиграфом к нашему уроку . Сегодня мы проведём химический турнир, в котором будут участвовать три команды. Чтобы узнать тему турнира, мы проведём 1 конкурс "Определение - шаг в познании", где вам нужно будет отгадать загадки.
Конкурс 1 "Определение - шаг в познании"
Загадка 1. «Их получают путем горения
Или сложных веществ разложения.
В них два элемента, один - кислород.
Относится к ним и известь, и лед». (Команда, отгадавшая загадку. получает название "Оксиды")
Вопрос команде: Дать определение оксидов.
2 человека из команды получают задание (у доски):
Задание 1 (за правильно выполненное задание 3 балла). Выписать оксиды и распределить их в два столбика: оксиды металлов и неметаллов. Дать названия:
Na2O, N2O5, NaOH, HNO3, CuO, SO2, FeS, Cu2O, P2O5, Mn2O7, Fe2O3, H2O2, Pb(OH)2, H2CO3, SiO2.
Загадка 2. Водород в состав их входит,
За собой остаток водит,
И опасны для работы
Эти жгучие... (Команда, отгадавшая загадку, получает название "Кислоты")
Вопрос команде: Дать определение кислот.
2 человека из команды получают задание (у доски):
Задание 2 (за правильно выполненное задание 3 балла). Выписать формулы кислот и распределить их в 2 столбика: кислородсодержащие и бескислородные, дать названия.
HNO3, NaOH, HCl, H2SO4, H2S, NH3, Al(OH)3, H3PO4, HBr, HMnO4, SO3, HI, H2SiO3, H2O, KF.
Команда, не получившая названия, отгадывает загадку 3.
Загадка 3. Учитель проводит опыт взаимодействия натрия с водой и одновременно читает загадку.
Берём стакан, а в нём вода;
Теперь кладём металл сюда.
Хлопок! И взрыв! И сноп огня!
И вы получите меня.
Хоть польза от меня огромная,
Натура я довольно скромная.
Вот индикатор влей сюда,
И я краснею от стыда…»
О каком классе соединений идет речь? (3 команда получает название "Основания")
Вопрос команде: Дать определение оснований.
2 человека из команды получают задание (у доски):
Задание 3 (за правильно выполненное задание 3 балла). Выпишите формулы оснований, разделив их на 2 столбика: щелочей и нерастворимых оснований
NaOH, Fe(OH)2, Fe(OH)3, Ca(OH)2, KOH, H2SO4, NaCl, Ba(OH)2, PbO, CuO, Cu(OH)2, Zn(NO3)2, Zn(OH)2
С названиями команд мы определились, а теперь загадка для всех:
Загадка 4.
«Хлориды и нитраты,
Сульфаты, карбонаты
Мы без труда и боли
Объединим в класс...»
Вопрос командам: Дать определение солей.
Учитель: Каким общим термином можно объединить оксиды, основания, кислоты и соли? (классы неорганических соединений). Итак, тема нашего химического турнира: "Основные классы неорганических соединений".
Задание 4. (на местах)
Команда "Оксиды" (2 чел.): Составьте формулы солей, входящих в состав поливитамина «Компливит»: фосфат кальция, сульфат железа (II), сульфат цинка, фосфат магния.
Команда Кислоты (2 чел.): Составьте формулы солей, входящих в состав минеральной воды: хлорид натрия, сульфат натрия, хлорид магния, гидрокарбонат натрия.
Команда Основания (2 чел.): Составьте формулы солей, входящих в состав почвы: карбонат кальция, фосфат алюминия, нитрит натрия, нитрат калия.
Пока команды выполняют задание, происходит проверка заданий у доски. Проверка задания 4 осуществляется по мере выполнения заданий (учащиеся читают составленные формулы вслух. За каждую правильно составленную формулу 1 балл.
Конкурс 2. Эстафета "Четвёртый лишний".
Технология игры:
-
На карточках написаны пять строчек химических формул различных веществ. В каждой строчке по четыре формулы.
-
В каждой строчке следует определить признак, объединяющий 4 формулы веществ и вычеркнуть лишнюю.
-
Задание выполняют учащиеся, используя принцип "эстафеты". Задания передаются с 5 парты на 1 (кто быстрее). За правильный ответ максимум 5 баллов, за скорость 1 место - 2 балла, 2 место - 1 балл, 3 место - 0 баллов.
Команда "Оксиды"
1) KOH, NaOH, Cu(OH)2, Ba(OH)2
2) HCl, Na2SO4, H2SO4, HNO3
3) SO3, BaSO4, KClO3, CaCO3
4) Ca(OH)2, MgOHCl, Al(OH)3, Fe(OH)2
5) CrO3, Mn2O7, HClO, N2O5
Команда "Кислоты"
1) H2SO3, H2S, HBrO4, H3PO4
2) MgCO3, Al2(SO4)3, FeCl3, H2SO4
3) Zn(OH)2, Ca(NO3)2, Cr(OH)3, LiOH
4) Fe2O3, Cl2O7, Al2O3, CaO
5) HNO3, HNO2, KHCO3, H2CO3
Команда "Основания"
1) Ba(OH)2, BaSO4, Ba(HSO4)2, Ba(NO3)2
2) HF, HBr, NaCl, H2SiO3
3) Mn(OH)2, MnO, Mn2O7, MnO2
4) Cr(OH)3, H2CrO4, Cr(OH)2, Hg(OH)2
5) NO2, SO3, SiO2, MgO
Конкурс 3. Лабораторный опыт «Определение среды раствора»
В пробирках под номерами находятся кислота и щелочь, с помощью индикаторов определите их. Для того чтобы вы успешно справились с экспериментальным заданием, предлагаю вам отгадать "загадки лаборанта". Они вам помогут вспомнить, как изменяется окраска индикаторов в щелочах и кислотах. Слушайте внимательно!
Опыт выполняют 2 человека от команды на местах, затем объясняют результат опыта.
Загадка 1.
Попасть в кислоту для других - неудача,
Но он перетерпит без вздохов, без плача.
Зато в щелочах не жизнь, а малина
У индикатора (фенолфталеина).
Что брали
Что наблюдали
Вывод
Пробирка №1 + фенолфталеин
Раствор стал малинового цвета
В пробирке щелочь
Пробирка №2 + фенолфталеин
Раствор не изменил окраску
В пробирке кислота
Загадка 2.
Ах, что же я поделаю с собой,
Ведь в щёлочи я сине-голубой.
А в кислоте быть синим я не смею.
Запомните - в кислотах я краснею. (лакмус)
Что брали
Что наблюдали
Вывод
Пробирка №1 + лакмус
Раствор приобрёл красный цвет
В пробирке кислота
Пробирка №2 + лакмус
Раствор приобрёл синий цвет
В пробирке щелочь
Загадка 3.
От щёлочи я жёлт как в лихорадке.
Краснею от кислот как от стыда.
Но я бросаюсь в воду без оглядки,
И здесь уж не заест меня среда. (метилоранж)
Что брали
Что наблюдали
Вывод
Пробирка №1 + метилоранж
Раствор стал желтого цвета
В пробирке щелочь
Пробирка №2 + метилоранж
Раствор приобрел розовый цвет
В пробирке кислота
Конкурс 4. Химический лабиринт
А теперь по 2 человека от каждой команды отправляются в путешествие в Царство неорганических соединений (схема «Лабиринт»). Если формула вещества соответствует приведенному под ней названию, то вы переходите к следующему пункту по стрелке «да», если не соответствует - по стрелке «нет».
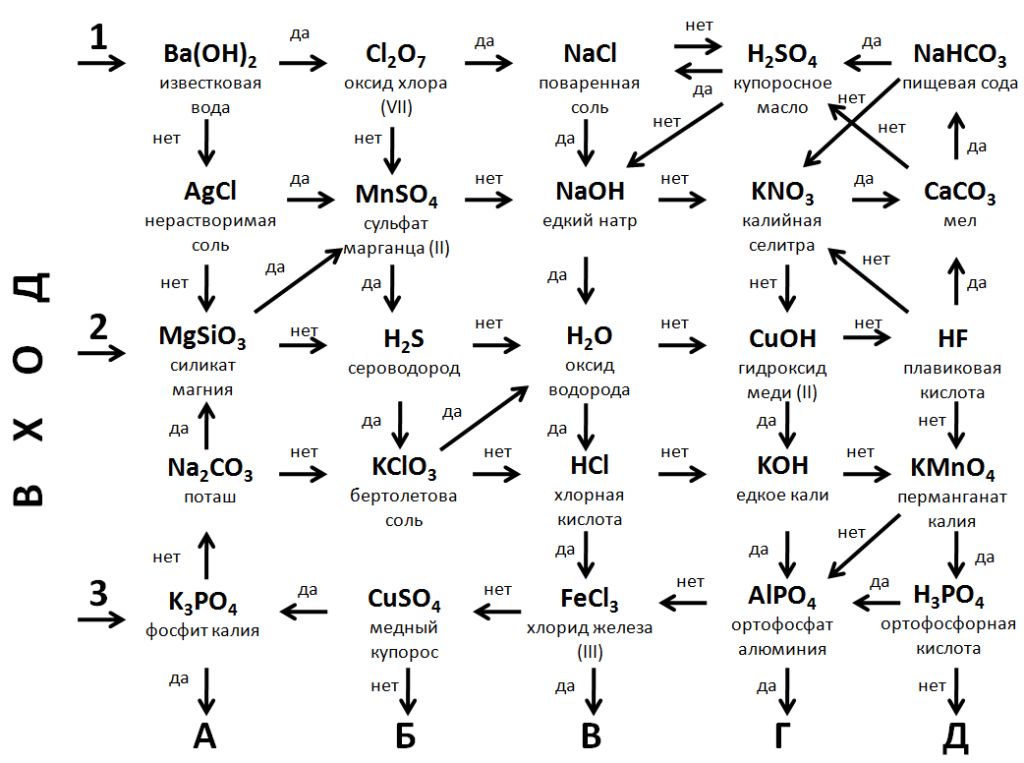
Конкурс 5. Правильный расчёт - залог успеха
Нам без расчетов никуда не деться,
Иначе в урну выкинут стихи,
Плотины рухнут, ржа сожрет железо,
Да вырастут пырей и лопухи...
По 2 представителя каждой команды решают расчётные задачи.
1. В реанимацию попадают больные, потерявшие много крови. В этих случаях используют 0,85%-й раствор поваренной соли, который называется физиологическим раствором. Представьте, что вы медсестра реанимационного отделения и должны срочно приготовить 800 мл такого раствора (ρраствора = 1,01 г/мл). Как вы на месте медсестры приготовили бы такой раствор?
2. Какое из азотных удобрений наиболее богато азотом:
а) хлорид аммония NH4Cl
б) сульфат аммония (NH4)2SO4
в) мочевина (NH2)2CO
г) калийная селитра KNO3
Ответ подтвердите расчётом.
3. Перед посадкой томатов весной почву нужно хорошо перекопать и полить марганцовкой (раствором перманганата калия, приготовленным из расчёта 5 г на 12 л воды). Рассчитайте процентную концентрацию приготовленного раствора.
Подведение итогов (Рефлексия)
Слово предоставляется жюри. Жюри подводит итоги конкурсов. Обучающимся предлагается ответить на вопросы анкеты:
1. Что такое команда?
2. Добилась ли ваша команда сегодня успеха?
3. какие трудности вы испытали. Удалось ли их преодолеть?
Источники информации
-
"Я иду на урок. Химия. Неорганическая химия 5-11 классы" под редакцией О.Г. Блохиной. ООО "Издательство "Первое сентября" 2003.
-
О.С. Габриелян, Т.В. Смирнова "Изучаем химию в 8 классе". Москва: "Блик и Ко" 2004.
-
Стихи.ру stihi.ru/2008/01/15/804


