- Преподавателю
- Физика
- Методическая разработка на тему Газовые законы
Методическая разработка на тему Газовые законы
| Раздел | Физика |
| Класс | - |
| Тип | Конспекты |
| Автор | Лименько Е.В. |
| Дата | 04.09.2015 |
| Формат | doc |
| Изображения | Есть |
| ГБОУ СПО « Унечский индустриальный техникум имени Героя России А.В. Рассказы»
Методическая разработка открытого урока по теме: «Газовые законы».
Разработала преподаватель физики: Лименько Елена Валентиновна Унеча 2015 год
|
|
Вид урока: Лекция с элементами беседы.
Тип урока: Изучение и первичное закрепление нового материала
.
Тема: Газовые законы.
Цели:
Образовательная - Ввести понятие изопроцесса, изучить газовые законы; формировать умение объяснять законы с молекулярной точки зрения
Развивающая - Обобщить и систематизировать занятия учеников о свойствах газов.
Развивать логическое мышление, наблюдательность.
Воспитательная - Формировать интерес к физике и вырабатывать умение работать в
группе.
Оборудование: Прибор для изучения газовых законов ( манометр технический, цилиндр), компьютер, мультимедиа, презентация.
План урока.
Вступительное слово учителя (1мин).
1. Фронтальный опрос на тему «Уравнение состояние идеального газа» (4 мин)
2. Изучение нового материала на тему «Газовые законы» (30 мин)
2.1. Стихотворения ( выступление уч-ся) (2 мин)
2.1. Рассказ преподавателя.
2.3.Сообщения о физиках: Ж.Шарле, Э.Мариотте, Ж. Гей-Люссаке, Р Бойле.
2.4.Тестовые задания. (4 мин)
3. Подведение итогов.
3.1. Вывод учителя.
3.2. Выставления оценок. (2 мин)
3.3. Домашнее задание. (2 мин)
Ход урока.
На предыдущих уроках вы познакомились с моделью идеального газа и уравнением, описывающим его состояние.
Напомните: 1. Какое уравнение называется уравнением состояние идеального газа?
Уч-ся Уравнение, связывающее термодинамические параметры состояния P,V и T идеального газа.
Препод-ль. 2. Кем было получено уравнение состояния идеального газа?
Уч-ся Б. Клапейронам и Менделеевым
Препод-ль 3. Как выглядит уравнение Менделеева - Клапейрона?
Уч-ся: PV= ![]() RT (Ответ записывается на доске)
RT (Ответ записывается на доске)
Препод-ль Почему это уравнение называется уравнением Менделеева- Клапейрона.
Уч-ся Уравнение устанавливающее связь между давлением, объемом и температурой газа было получено французским физиком Бенуа Клапейроном (1799-1864г.). Это уравнение впервые применил русский ученый Дмитрий Иванович Менделеев (1834-1907 г.) поэтому уравнение состояния газа называется уравнением Менделеева- Клапейрона.
Изложение нового материала
Слайд 1: Изучение нового материала мы начинаем с чтения отрывка из стихотворения Ан. Жигулина « Дирижабль»
Уч-ся И все доступно, все открыто,
И ничего еще не жаль
И надо мной плывет, как рыба.
Огромный сонный дирижабль
Куда он плыл светло прямо-
На дальний полюс, на парад-
Забытый, вымерший, как мамонт,
Несовершенный аппарат.
Препод-ль Вопрос: Каким газом наполняют дирижабль?
Уч-ся Гелием.
Препод-ль Правильно, гелием, который при обычных условиях по своим свойствам близок к идеальному газу. О законах, которым подчиняется идеальный газ, мы поговорим на этом уроке.
Слайд 2. Записать темы в тетради.
Слайд3. Поставить перед уч-ся цели.
Слайд 4. Процессы, в которых масса газа и один из трех параметров его состояния остаются неизменными называются изопроцессами.
Уравнение описывающие их наз-ся - газовыми законами.
Слайд5.
Уравнение m
PV= м RT показывает, что возможно одновременное изменение пяти параметров, характеризующих состояние идеального газа. Однако многие процессы в газах, происходящие в природе и осуществляемые в технике, можно рассматривать приближенно как процессы в которых изменяются лишь два параметра из пяти.
Слайд 6. Особую роль в физике и технике играют три процесса - изотермический, изохорный и изобарный.
Выводим слайды на экран с помощью мультимедиа, изотермического, изохорного, изобарного процессов их графики.
Слайд 7. 1.Изотермический.
Изотермический процесс - это процесс изменения состояния термодинамической системы макроскопический тел при постоянной температуре.
Слайд 8. Анимация: изотермический процесс.
Согласно уравнению состояния идеального газа в любом состоянии с неизменной температурой произведения давления газа на его объем остается постоянным:
PV= const; при Т= const
Этот закон экспериментально был открыт английским ученым Робертом Бойлем (1627-1691г) и несколько позже французским ученым Эдмом Мариоттом (1620-1684). Поэтому он носит название закона Бойля - Мариотта.
Показ портретов Бойля и Мариотта
Сообщение уч-ся
Слайд 9. Роберт Бойль - английский химик, физик и философ, член лондонского королевского общества. Физические работы посвящены молекулярной физике, изучению световых и электрических явлений, гидростатике, акустике, теплоте, механике. Он высказал мысль о сложности белого света. В 1663г открыл цветные кольца в тонких слоях, названные впоследствии ньютоновскими.
Значительны заслуги Бойля в химии. Сформулировал в 1661г понятие химического элемента и ввел в химию.
Слайд10. ЭДМ Мариотт - французский физик, член Парижской АН. Был игуменом монастыря святого Мартина вблизи Дижона.
Работы относятся к механике, теплоте, оптике. В 1676г установил закон изменения объема данной массы газа от давления при постоянной температуре. Предсказал разнообразные применения этого закона. Исследовал подъема фонтанов. Доказал увеличение объема воды при замерзании. Обнаружил в 1666 году слепое пятно в глазу, исследовал цвета, в частности цветные кольца вокруг Солнца и Луны, изучал радугу, дифракцию света, лучистую теплоту, показал отличие между тепловыми и световыми лучами.
Изготовил немало различных физических приборов.
Экспериментальный метод, положив тем самым начало становлению химии как науки.
Этот закон справедлив для любых газов; а также их смесей, например для воздуха лишь при давлениях, в несколько сотен раз больших атмосферного, отклонения от этого закона становятся существенными.
Слайд11. Зависимость давления газа от объема при постоянной температуре графически изображается кривой. Эта кривая называется изотермой.

Изотермический процесс можно осуществить, например, путем изменения объема газа при постоянной температуре.
Опыт: Оборудование: цилиндр переменного объема,
манометр демонстрационный закрытый
трубка резиновая.
Для проведения опыта соединяют сильфон резиновой трубкой с манометром. Открывают у манометра оба крана и с помощью винта растягивают или сжимают цилиндр так, чтобы объем воздуха в нем стал например 7,5 условных единиц, затем закрывают свободный кран манометра и приступают к демонстрации.
Несколько раз медленно изменяют объем воздуха в приборе и (наоборот) наблюдают за показаниями манометра. С уменьшением объема увеличивается давление и наоборот.
Вывод: при m = const, и Т= const произведения VP- есть величина постоянная.
Слайд12. Определение. Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется.
PV = const.
Слайд13.
-
Давление газа зависит от числа ударов молекул о стенки сосуда.
-
При сжатии газа объем уменьшается, число ударов увеличивается и, следовательно, давление газа увеличивается.
-
При расширении газа объем увеличивается, число ударов молекул о стенки сосуда уменьшается и, следовательно, давление газа уменьшается.
Слайд 14. 2. Изохорный
Изохорный процесс -- это процесс изменения состояния термодинамической системы макроскопический тел при постоянном объеме.
Слайд 15. Анимация - изохорный процесс.
Из уравнения состояния PV=m RT вытекает, что в любом состоянии газа с неизменным
м
объемом отношение давление газа к его температуре остается постоянным.
P= const; при V = const
V
Этот газовый процесс был установлен в 1787г французским физиком Жак Шарлем (1746-1823г) поэтому уравнение называется законом Шарля.
(демонстрация портрета)
Слайд 16. Сообщение уч-ся
Жак Шарль французский физик, член Парижской АН. Учимся самостоятельно. Профессор экспериментальной физики в Консерватории искусств и ремесел в Париже. Построил воздушный шар из прорезиненной ткани и первый использовал для его наполнения водород. Осуществил полет на этом шаре 1783г изобрел ряд приборов.
Слайд17. Изохорный процесс можно осуществить нагреванием воздуха при постоянном объеме.
Согласно уравнению давление газа линейно зависит от температуры при постоянном объеме. Р= const Т.
Эта зависимость изображается прямой и называется изохорой.

Пример: Нагревание чайника со свистком и т.д.
С лайд18. Для данной массы газа отношение давления к температуре постоянно, если объем не меняется.
лайд18. Для данной массы газа отношение давления к температуре постоянно, если объем не меняется.
P/T=const при V = const
Слайд19.
Давление газа зависит от числа ударов молекул о стенки сосуда.
При повышении температуры скорость движения молекул увеличивается, число ударов молекул о стенки сосуда увеличивается, и, следовательно, давление повышается.
При понижении температуры скорость движения молекул уменьшается, число ударов молекул о стенки сосуда уменьшается, и, следовательно, давление понижается.
Слайд20. 3. Изобарный.
Изобарный процесс- это процесс изменения состояния термодинамической системы макроскопический тел при постоянном давлении.
Слайд21. Анимация- изобарный процесс.
Согласно уравнению PV=m RT в любом состоянии газа с неизменным давлением
м
отношение объема газа к его температуре остается постоянным.
V = const при Р = const
Т
Этот закон был установлен экспериментально французским ученым Жозеформ Гей-Люссаком (1778-1850). Поэтому этот закон называется законом Гей-Люссаком.
(Демонстрация портрета).
Сообщение уч-ся.
Слайд 22.Жозеф Гей-Люссак - французский физик и химик, член Парижской АН. Окончил политехническую школу, где работал с 1802 по 1809г-профессором химии.
Одновременно с 1808-32- профессором физики Парижского университета. С 1832г профессор химии Парижского ботанического сада.
Физические работы в области молекулярной физики и теплоты. Был приверженцем корпускулярной теории света. В области химии разработал способ получения калия и натрия, получил ряд химических соединений, в частности синильную кислоту, циан, положил начало объему анализу. Изобрел ряд приборов (гидрометр, спиртометр, барометр, термометры, насос).
Слайд23.

Согласно уравнению V = const объем газа линейно зависит от температуры при Р = const
Т
Зависимость графически изображается которая называется изобарой.
Слайд24.
Для данной массы газа при постоянном давлении отношение объема газа к его температуре постоянно.
V/T=const при P= const
(Вопрос.) Изобарный процесс происходит, например при нагревании или охлаждении воздуха в стеклянной колбе, соединенной со стеклянной трубкой, отверстие в которой закрыто небольшим столбом жидкости.
Изотермический процесс
Изохорный процесс
Изобарный процесс
определение
Процесс протекающий при постоянной температуре
Процесс протекающий при постоянном объеме.
Процесс протекающий при постоянном давлении
Закон
Т= const; PV= const
Р1 = V2
Р2 V1
з-н Бойля-Мариотта
V= const; P= const
Т
Р1 = Т1
Р2 Т2
з-н Шарля
Р= const; V = const
Т
V 1 = Т1
V 2 Т2
з-н Гей - Люссака
График
 Р
Р
 V
V

 V P
V P




T T
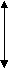
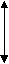

 P P
P P



V T
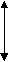 V
V


 T
T
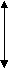
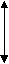 P P
P P






V T
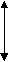
 V
V

 T
T
Вопрос: Встречаемся ли мы в жизни с проявлением газовых законов?
Всегда ли мы задумываемся, какой закон выполняется в той или иной ситуации.
Уч-ся. Чайник вскипает, надувание резинового шара. В двигателях работающих на сжатом газе, газ при расширении совершает работу почти при постоянном давлении. Сжатый воздух оказывал давление на поршень, открывает двери в автобусах и электропоездах. Сжатым воздухом приводят в движение поршни воздушных тормозов железнодорожных вагонов и грузовиков и т.п.
Применим знания, которые вы получили на уроке, для решения теста.
А теперь ответьте на вопросы теста.
Тест выводим на экран с помощью мультимедиа уч-ся дают ответ на специальных бланках и в конце урока их сдают.
1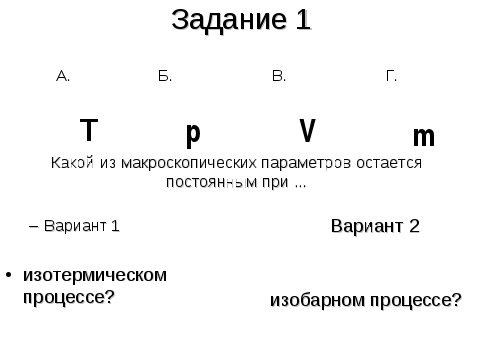
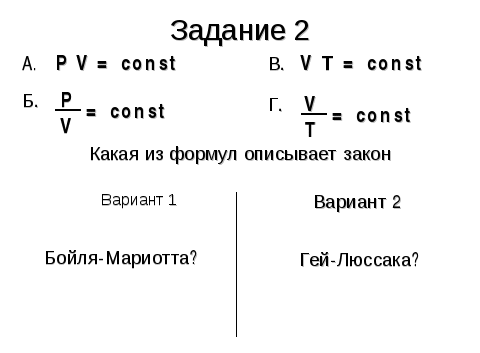
Задание3
А. Б. В. Г.
Меделеев, Шарль Бойль, Мариотт Гей-Люссак
Клапейрон
Каким ученым принадлежит закон, описывающий….
Вариант 1 Вариант2
Изобарный процесс Изотермический процесс


В заключении хочу сказать, что, применяя полученные знания, человек изобрел множество машин и устройств для удовлетворения собственных потребностей, средств передвижения, приборов для изучения окружающего мира.
Стихотворения. Уч-ся:
Я еще не устал удивляться
Чудесам, что есть на Земле
Телевизору, голосу рации
Вентилятору на столе
Самолеты летят сквозь тучи,
Ходят по морю корабли
Как до этих вещей могучих
До мечтаться люди могли
Я вверяю себя трамваю
Я гляжу на экран кино
Эту технику понимая,
Изумляюсь ей все равно.
Ток по проволоке струится
Спутник ходит по небесам,
Человеку стоит дивиться
Человеческим чудесам
Так писал поэт В.Шефнер о созданиях человеческого разума. А в основе их - законы физики.
III. Подведение итогов
IV. Домашнее задание
§76 стр.114. Сборник задач Т.И Трофимова. А.В. Фирсов. № 2.19,2.13.
Ответить на вопросы в конце параграфа.
Привести примеры, где мы в жизни встречаемся с газовыми законами.


