- Преподавателю
- Физика
- Исследование Удивительный мир воды
Исследование Удивительный мир воды
| Раздел | Физика |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Фефелова Т.К. |
| Дата | 21.01.2015 |
| Формат | doc |
| Изображения | Есть |
РАЙОННАЯ НАУЧНО-ПРАКТИЧЕСКАЯ КОНФЕРЕНЦИЯ
СЕКЦИЯ «ВОКРУГ НАС МИР»
Автор: Мелков Сергей Олегович.
Место учёбы: муниципальное казённое общеобразовательное учреждение «Кондинская средняя общеобразовательная школа».
Адрес образовательного учреждения: 641971, Шатровский район, с. Кондинское, ул. Центральная, д.9.
Тема работы: «Удивительный мир воды».
Секция: «ВОКРУГ НАС МИР»
Руководитель: Фефелова Татьяна Кузьминична, учитель физики и математики МКОУ «Кондинская средняя общеобразовательная школа».
Место работы: МКОУ «Кондинская средняя общеобразовательная школа».
Адрес учреждения: 641971, Шатровский район, с. Кондинское, ул. Центральная, д.9.
Содержание:
-
Введение…………………………………………………………….3 стр.
-
Физика воды………………………………………………………...4 стр.
-
Исследование зависимости температуры кристаллизации воды от её минерализации……………………………………………………..9 стр.
-
Заключение………………………………………………………..10 стр.
-
Список литературы……………………………………………….11 стр.
-
Приложение……………………………………………………….12 стр.
УДИВИТЕЛЬНЫЙ МИР ВОДЫ.
«Нельзя сказать, что ты необходима для Жизни, ты сама Жизнь... Ты самое большое богатство в мире»
Антуан де Сент-Экзюпери
1. ВВЕДЕНИЕ.
Хотя все в природе взаимосвязано и каждая деталь важна, все же отдельные явления и предметы более существенны, а другие менее при естественном равновесии как живой, так и неживой природы.
Какое вещество является самым главным, самым важным для нас в окружающем материальном мире? Ответ на этот вопрос можно дать уверенно и однозначно: это природная вода. Такой ответ, бесспорно, справедлив, во всяком случае, для нашей планеты Земля.
Большая часть поверхности нашей планеты, около 71%, покрыта Мировым океаном, составляющим 97% всех поверхностных вод Земли и около половины всех вод литосферы. Глубина Мирового океана достигает 11 км. Если срезать сушу и заполнить ею дно океанической чаши, то вся планета покроется слоем воды глубиной около 3 км.
Да и мы с вами на 70% состоим из воды. Чего больше всего в нашей твердой и жидкой пище - в овощах, мясе, рыбе, хлебе, крупе, молоке? Природной воды! Где лучше всего во время отдыха чувствует себя здоровый человек? Конечно, во время купанья в теплой морской, озерной или речной воде. Недаром некоторые биологи предполагают, что колыбелью жизни на Земле были мелководные лагуны, даже и в том случае, если жизнь зародилась не на планете Земля, а была занесена на нее из межпланетного пространства в форме спор одноклеточных организмов.
Лучше всех из современных мыслителей значение воды определил крупнейший ученый, основоположник ряда новых научных дисциплин, биохимик и минералог, академик В. И. Вернадский: «Вода стоит особняком в истории нашей планеты. Нет природного тела, которое могло бы сравниться с ней по влиянию на ход основных, самых грандиозных, геологических процессов. Нет земного вещества - минерала, горной породы, живого тела, которое ее бы не заключало. Все земное вещество… ею проникнуто и охвачено» [1960, с. 16].
Объект исследования: вода, Н2О.
Цель исследования: Изучить свойства воды и выяснить зависимость температуры кристаллизации воды от её минерализации.
Задачи исследования:
1. Изучить в литературе удивительные свойства воды.
2. Провести практические исследования и выяснить зависимость температуры кристаллизации воды от её минерализации.
3. Обработать полученную информацию.
4. Интерпретировать результаты практических исследований.
5. Наглядно представить полученную информацию.
Методы исследования: изучение литературы, проведение опытов, обработка полученных данных, анализ, сравнение полученных результатов.
Этапы работы:
-
Изучение учебной и дополнительной литературы по данному вопросу.
-
Проведение опытов.
-
Обработка полученных данных.
2. ФИЗИКА ВОДЫ
Что же представляет собой идеальная «чистая» вода Н2О с физической точки зрения? Как и большинство веществ, вода состоит из молекул, а последние из атомов. Структура атома следующая: вокруг положительно заряженного протонного ядра на определенных уровнях по различным орбитам движутся отрицательно заряженные электроны, образующие электронное облако. Число электронов в каждой оболочке для атома каждого элемента строго определенное. Так, у атома водорода лишь одна оболочка с единственным электроном, а у атома кислорода - две оболочки: внутренняя с двумя электронами и внешняя с шестью. Два атома водорода замещают вакансию двух недостающих (до восьми) электронов наружной оболочки для ее устойчивости. (см.приложение, рис.1)
Несмотря на то, что вода - вещество, принятое в
качестве эталона меры плотности, объема и т. Д. для других веществ, сама вода, как это ни странно, является самым аномальным среди них. Этих удивительных аномалий у воды много, рассмотрим лишь основные из них.
Плотность. Общеизвестно, что все вещества при нагревании увеличивают свой объем и уменьшают плотность. У воды наблюдается то же самое, за исключением интервала от 0 до 4°С, когда с возрастанием температуры объем воды не увеличивается, а, наоборот, сокращается. Максимальная плотность отмечается при 4°С. Таким образом, для воды зависимость между объемом и температурой не однозначна (как в нормальных условиях для других веществ), а двузначна. Например, при 3 и 5°С масса воды занимает один и тот же объем, так же как и при 0оС, 2оС и 8°С и т.д. (см. приложение рис.2). Несмотря на указанную аномалию, вода служит эталоном плотности при 4°С, когда 1 см3 ее имеет массу 1 г.
Что же будет происходить с объемом воды при дальнейшем понижении температуры? Оказывается, что ниже 0°С он продолжает увеличиваться, но
только при условии переохлаждения. Однако переохлаждение требует исключительных условий: полной неподвижности воды и отсутствия центров кристаллизации льда (пыли, кристалликов льда и т. п.)
Вода, лишенная растворенных газов, может быть переохлаждена до минус 70°С без превращения в лед. При легком встряхивании либо при введении льдинки или другого центра кристаллизации она мгновенно превращается в лед, и температура ее подскакивает до 0°С (на 70°С). Вода также может быть доведена до +150°С без закипания. При введении в такую перегретую воду пузырька воздуха она мгновенно вскипает, и температура ее падает до 100оС.
При замерзании объем воды возрастает внезапно примерно на 11% и так же внезапно, скачком, уменьшается в обратном направлении при таянии льда при 0°С.. Увеличение объема воды при замерзании имеет громадное значение, как в природе, так и в технике. При замерзании воды в замкнутом пространстве и превращении ее в лед происходит расширение объема, что приводит к возникновению избыточного давления, достигающего, как показывают наблюдения, 2500 кгс/см2 (2500 атм.). Именно этим объясняются как разрушительная сила замерзающей воды в замкнутых пустотах, трещинах горных пород, откалывающая подчас многотонные глыбы и дробящая их в дальнейшем на мелкие осколки, так и страшные взрывы наледей, а также разрывы водопроводных труб при замерзании в них воды.
Здесь следует сделать одну существенную оговорку. Все рассмотренные выше процессы происходят при указанных температурах лишь при условии абсолютного давления, равного 1 атм. Что же будет происходить с водой при повышении давления? С увеличением давления температура замерзания воды понижается примерно на 1°С через каждые 130 атм. Так, при давлении 500 атм. Замерзание наступает при температуре минус 4°С, а при давлении 2200 атм. - при минус 22°С. Эта зависимость для воды аномальна, так как у других веществ, наоборот, с ростом давления температура замерзания повышается. Подобная аномалия воды очень важна в природе. Даже без учета растворенных в воде солей на больших глубинах в океане вода не замерзает, например при температуре минус 3°С, она не замерзнет даже на глубине около 4000 м, а на больших глубинах тем более. С повышением температуры жидкой воды ее плотность понижается: на интервале от максимальной плотности при 4°С, равной 1, до точки кипения воды 100°С - на 4% (от 1 до 0,95838).
С повышением минерализации воды (т. Е. количества содержащихся в ней минеральных веществ) повышается и температура, при которой вода имеет максимальную плотность. Так, на поверхности Мирового океана плотность воды 1,02813, а на глубине 10 км 1,07104 (разница 0,04291, или 4%). Таким образом, установившееся мнение о практической несжимаемости воды справедливо только для сравнительно малых давлений. Если бы вода была совершенно несжимаема, уровень океана поднялся бы на 30 м.
Важным обстоятельством в природе является то, что максимальная плотность воды, как отмечалось выше, наблюдается при 4°С, а лед оказывается легче жидкой воды и поэтому плавает на ее поверхности. Если бы этого не было, то водоемы и водотоки промерзали бы зимой до самого дна, что было бы настоящей катастрофой для всего живого в них. Впрочем, эта особенность воды при некоторых условиях имеет исключения. Речь идет о возможности образования донного или внутриводного льда.
Точки кипения и замерзания (плавления). Что касается температуры кипения, то она находится в прямой зависимости от давления: с увеличением давления она возрастает. Это свойство воды раньше использовалось для определения высоты местности в горах. Температура кипения повышается также с увеличением содержания в воде растворенных веществ.
Иная зависимость наблюдается между давлением и точкой замерзания (плавления) воды, с повышением давления она падает (но только до давления 2200 атм.). При дальнейшем увеличении давления точка замерзания воды начинает расти: при давлении 3530 атм. Вода замерзает при минус 17о; при 6380 атм. - при +30оС, при 16 500 атм. - при +60о, а при 20 670 атм. - при +70°С.
В последних двух случаях мы уже имеем горячие льды. Возможно ли существование в земных недрах сочетания таких температур и давлений? В свободно циркулирующих в породах Земли водах, безусловно, нет, так как даже на границе нижней литосферы и верхней мантии, называемой границей Мохоровичича, где давление приблизительно 10000 атм., температура никак не может быть равна 30оС, а всегда и везде будет значительно выше. Таким образом, встреча горячего льда здесь исключается. Выше же границы Мохоровичича совершенно исключаются давления выше 6000 атм., которые необходимы для образования горячего льда.
При нормальном давлении вода может «замерзать» и при положительной температуре. Это наблюдается, например, и газопроводе, когда проходящий по нему газ (в основном метан) плохо осушен, т.е. в нем присутствует вода. Объем молекулы метана по сравнению с объемом молекулы воды значительно больше, что приводит к понижению внутреннего давления и к повышению температуры замерзания от нескольких градусов до 20 °С. Выпадающий «лед» содержит много газа (газогидрат).
Сам факт существования воды в обычных для земной поверхности термодинамических условиях во всех трех фазах (твердой, жидкой и газообразной) делает это вещество крайне удивительным и необыкновенным.
Поверхностное натяжение и прилипание. Поверхностное натяжение - это способность пограничных молекул воды, а так же твёрдых тел сцепляться, «стягиваться», самоуплотняться. На поверхности воды образуются сцепления молекул, создающие плёнку натяжения, для разрыва которой потребуется немалая сила. На этой плёнке могут лежать, не погружаясь в воду, тела, которые в 8 и более раз тяжелее воды, например, лезвие безопасной бритвы, иголка и др. (см. приложение, фото №1, 2, 3). Теоретически установлено, что для разрыва столбика чистой воды диаметром 2,5см потребуется приложить усилие 950 кН. Поскольку совершенно чистой воды в природе нет, да и в лабораторных условиях получить ее почти невозможно, то в условиях эксперимента с не совсем чистой водой для разрыва столбика воды диаметром 2,5см потребуется усилие в пределах «только» 10 кН, что близко к прочности стали.
У воды есть и еще одно удивительное свойство - «прилипание» (адгезии), которое можно наблюдать в узких стеклянных трубках (капиллярах), где вода поднимается вверх вопреки силам притяжения (гравитации). В таких трубках сочетаются силы сцепления молекул воды в пограничном с воздухом слое со способностью воды смачивать стекло, «прилипать» к нему. В результате в капилляре образуется вогнутая поверхность выше естественного уровня воды. У ртути, обладающей более высоким поверхностным натяжением, адгезия отсутствует, поэтому ртуть в капиллярной трубке имеет не вогнутую, а выпуклую поверхность. Необходимо заметить, что к поверхностям, покрытым жировым слоем, например парафином, вода не прилипает и мениск ее в капилляре, подобно мениску ртути, будет не вогнутый, а выпуклый.
поднимается вверх вопреки силам притяжения (гравитации). В таких трубках сочетаются силы сцепления молекул воды в пограничном с воздухом слое со способностью воды смачивать стекло, «прилипать» к нему. В результате в капилляре образуется вогнутая поверхность выше естественного уровня воды. У ртути, обладающей более высоким поверхностным натяжением, адгезия отсутствует, поэтому ртуть в капиллярной трубке имеет не вогнутую, а выпуклую поверхность. Необходимо заметить, что к поверхностям, покрытым жировым слоем, например парафином, вода не прилипает и мениск ее в капилляре, подобно мениску ртути, будет не вогнутый, а выпуклый.
Существует понятие капиллярной постоянной, которая равна произведению высоты подъема жидкости на радиус капилляра. Капиллярная постоянная для чистой воды линейно уменьшается с увеличением температуры, а при достижении критической становится равной нулю. Предельная высота капиллярного подъема воды при 15°С составит в крупном песке около 2м, в мелком 1,2м, а в чистой глине 12 м, причем продолжительность подъема для крупных капилляров - 5-10 суток, а для мелких до 16 месяцев!
Теплоемкость воды. Остановимся на следующей аномалии воды, которая связана с ее теплоемкостью. Теплоемкость воды сама по себе не аномальна, но она в 5-30 раз выше, чем у других веществ. Только водород и аммиак обладают большей, чем вода, теплоёмкостью. У всех тел, кроме ртути и жидкой воды, удельная теплоемкость с повышением температуры возрастает. У воды же удельная теплоемкость в интервале температур от 0 до 35°С падает, а затем начинает возрастать.
Удельная теплоемкость воды при 16°С условно принята за 1 и служит, таким образом, эталоном меры для других веществ. Как и плотность, удельная теплоемкость воды в зависимости от температуры не однозначна, а двузначна. Например, при 25 и при 50оС она одинакова - 0,99800 кал/(г·°С). Теплоемкость льда на интервале от 0 до минус 20 °С в среднем 0,5 кал/(г·°С), т. е. в два раза меньше, чем у воды.
3. ИССЛЕДОВАНИЕ ЗАВИСИМОСТИ
ТЕМПЕРАТУРЫ КРИСТАЛЛИЗАЦИИ
ВОДЫ ОТ ЕЁ МИНЕРАЛИЗАЦИИ.
Изучив некоторые свойства воды, решил выяснить на опыте, как влияют примеси на свойства воды. Известно, что на практике применяют поваренную соль для того, чтобы удалить наледь с тротуаров, дорог, т.е. наличие соли понижает температуру кристаллизации воды
Для проведения эксперимента потребовалось следующее лабораторное
оборудование: весы лабораторные, термометр электронный (см.фото №7), мензурка, стаканы из полимерного материала, поваренная соль, вода.
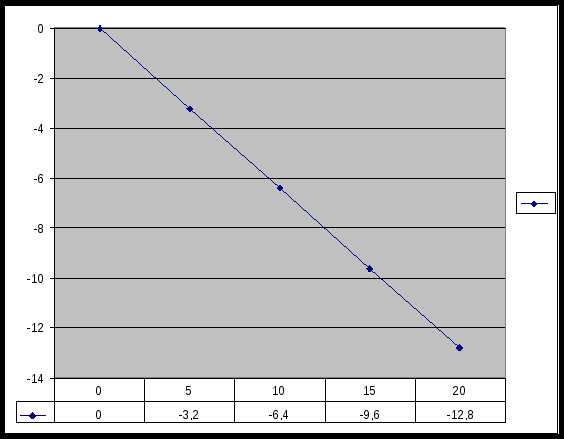
Для опытов взяли талую снеговую воду, чтобы уменьшить изначальную минерализацию. Затем получили 5%, 10%, 15%, 20% растворы поваренной соли. (см. приложение, фото №4) В зимних условиях пронаблюдали, при какой температуре происходит процесс кристаллизации в этих растворах. (см. фото №5 и 6). Теоретически мы предполагали, что растворы будут замерзать при более низких температурах, чем чистая вода, но не ожидали что настолько. Гипотеза была такова, что на каждые 5% соли в растворе температура кристаллизации понизится на 1оС максимум, а эксперимент показал, что понижается на 3,2оС! (см. приложение таблица №1 и график №1).
Вывод по экспериментальной составляющей работы: Результат эксперимента показал, что зависимость температуры кристаллизации воды зависит от её минерализации прямопропорционально. На каждые дополнительные 5% соли, температура кристаллизации понижается на 3,2оС, т.е. на каждый 1% понизится на 0,64оС. Если обозначим концентрацию соли в растворе переменной φ, температуру кристаллизации раствора - переменной t, то зависимость t от φ выразится формулой: t(φ)= - 0,64 φ.
-
ЗАКЛЮЧЕНИЕ.
В результате работы над рефератом, пришлось просмотреть и изучить много учебной, научно-популярной литературы, ознакомиться с Интернет-ресурсами. Я узнал для себя много нового и не просто интересного, а удивительного о веществе, которое нас окружает, является нашей частью - о воде. Я провёл эксперимент и выявил зависимость температуры кристаллизации воды от её минерализации, она выражается формулой: t(φ)= - 0,64 φ.
Цель, которая была поставлена передо мной, достигнута. Я изучил свойства воды и выяснил зависимость температуры кристаллизации воды от её минерализации, полученные результаты представил наглядно в виде таблицы и графика зависимости температуры кристаллизации от минерализации воды, проанализировал данные и вывел формулу зависимости этих величин.
Практическая значимость воды и её физических и химических свойств огромна. Взять хотя бы теплоёмкость - самая большая из всех веществ (не считая водород и аммиак), это свойство широко используется в охладительных и отопительных системах. Результаты моих практических исследований тоже можно применить в этой области. Если в отопительную систему города залить солёную воду, причём взять максимальную концентрацию, то во время каких-либо аварий в системе теплоснабжения раствор в трубах застынет не при 0оС, а при - 18оС, что даёт дополнительное время для устранения аварии. Допустить образования льда в трубах нельзя, т.к. это ведёт к разрушению системы теплоснабжения, вода, застывая в лёд, увеличивается резко в объёме и разрывает трубы. Раньше использовать это предложение было невозможно, т.к. трубы изготавливались из железа, солёный раствор ускоряет коррозию этого металла, если же теплопровод изготовить из пластиковых или металлопластиковых труб, то можно воспользоваться этим предложением.
5. СПИСОК ЛИТЕРАТУРЫ.
1. Арабаджи И.И. Загадки простой воды. М:- общество «Знание», 1979г.
2. Большая российская энциклопедия. Т. 5. М.:- Научное издательство «Большая российская энциклопедия», 2006г.
3. Буховцев Б.Б., Мякишев Г.Я.. Физика 9. Учебник для 9 класса. М: Просвещение 1983г
4. Кириллова И.Г. Книга для чтения по физике: Учебное пособие для учащихся. - М.: Просвещение. 1980.
5. Перышкин А.В. Физика: Учебник для 8 кл. общеобразовательных учреждений / А.В. Перышкин .- М.: Дрофа, 2006.
6. Спасский Б.И. Хрестоматия по физике: Учебное пособие для учащихся / под ред. Б.И. Спасского. - М.: Просвещение, 2002.
7. Универсальная школьная энциклопедия. Т 1.А -Л/ ред. группа: М. Аксёнова, Е. Журавлёва, Д. Володихин, С. Алексеев. - М.: Мир энциклопедий. Аванта+, 2007.
8. Физический энциклопедический словарь. Главный редактор А.М. Прохоров. М.: «Российская энциклопедия», 2003.
6. ПРИЛОЖЕНИЕ
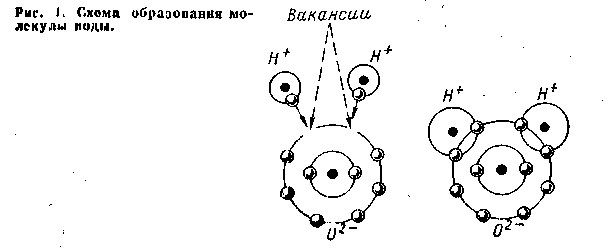 рис.1. Строение молекулы воды.
рис.1. Строение молекулы воды.
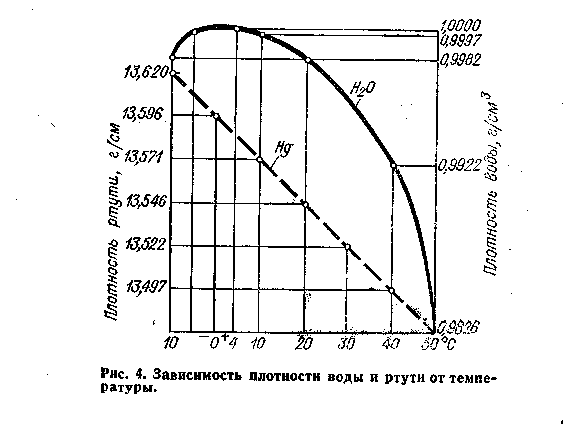 рис. 2. Зависимость плотности воды от температуры.
рис. 2. Зависимость плотности воды от температуры.
Поверхностное натяжение воды.
Ф ото №1. На поверхности воды - плёнка, которая прогибается под тяжестью листа, но не смачивает его
ото №1. На поверхности воды - плёнка, которая прогибается под тяжестью листа, но не смачивает его
Фото №2. На поверхности воды лежит металлическая скрепка.

Фото №3. Под действием сил поверхностного натяжения капля воды имеет идеальную сферическую форму.

Проведение эксперимента.
Фото №4. Готовлю растворы соли заданной концентрации.

Фото №5 и 6. В зимних условиях пронаблюдал, при какой температуре происходит процесс кристаллизации в этих растворах.


Фото №7. Электронный термометр даёт большую точность измерений.

Результаты эксперимента.
Таблица №1. Зависимость температуры кристаллизации воды от её минерализации.
Процентное содержание соли в растворе.
0%
5%
10%
15%
20%
Температура кристаллизации.
-0,0
-3,2
-6,4
-9,6
-12,8
График №1 Зависимость температуры кристаллизации воды от её минерализации