- Преподавателю
- Физика
- Интегрированный урок по физике, тема: Основные понятия и законы молекулярной физики и химии
Интегрированный урок по физике, тема: Основные понятия и законы молекулярной физики и химии
| Раздел | Физика |
| Класс | - |
| Тип | Конспекты |
| Автор | Фоминых О.Ю. |
| Дата | 07.12.2014 |
| Формат | doc |
| Изображения | Есть |
Интегрированный урок по теме "Основные понятия и законы
молекулярной физики и химии "
/МОУ СОШ №82 Фоминых О. Ю./
Урок затрагивает материал двух наук: физики и химии, сопровождается презентацией.
Цели урока:
а) дидактическая: сформировать комплексную систему знаний по теме "Основные понятия и законы молекулярной физики и химии" на основе составления СЛС (Структурно логических схем).
б) развивающая: продолжить формирование научного мышления учащихся.
в) воспитательная: совершенствовать навыки индивидуальной, коллективной работы и рефлексивной деятельности по достижению результата.
Результат деятельности: учащиеся должны научиться составлять СЛС (структурно логическую схему) и использовать ее в решении дифференцированных задач.
План.
-
Актуализация знаний (просмотр слайдов).
-
Решение интегрированной задачи.
-
Составление СЛС.
-
Контроль знаний (разноуровневые тесты).
-
Рефлексия.
Цель
Деятельность учителя
Деятельность ученика
Создание межпредметной познавательной задачи
Учитель направляет внимание, волю учащихся на развитие умений переноса и синтеза, способностей и интересов.
Учащиеся осознают межпредметную сущность задачи, осуществляют анализ ее условий, отбор знаний из предметов химии, физики и биологии.
В курсах физики, химии и биологии изучается более 1000 понятий, они сводятся примерно к 50 частным законам, которые можно объединить в нескольких важнейших фундаментальных законах природы. И если человек чувствует и осознает связь понятий с частными и общими законами природы, у него выстраивается общая ЕНКМ (естественнонаучная картина мира).
Давайте посмотрим на схему:
1 слайд
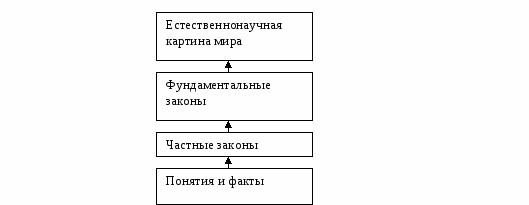
Фундаментом ЕНКМ являются понятия и факты, понятия образуют частные законы и закономерности, частные законы и закономерности, частные законы образуют фундаментальные. И все это - ЕНКМ.
Естественно, на одном уроке связать все понятия , изучаемые в курсах физики, химии и биологии, с законами природы нельзя, но на одной теме урока это возможно. Этой темой будет " Основные понятия молекулярной физики и химии " на примере газовых систем.
В данной теме вам нужно будет выделить основные понятия, частные и фундаментальные законы и связать их воедино в СЛС этого типа.
Работать на уроке мы будем по следующему плану (план урока написан на доске):
-
актуализация знаний (просмотр слайдов);
-
решение интегрированной задачи в группе;
-
составление СЛС в группе;
-
контроль (разноуровневые тесты);
-
подведение итогов урока.
Мотив
Формирование познавательного интереса
к знаниям
с учетом ЗБР
Учитель стимулирует познавательный интерес учащихся к проблеме, к обобщенным понятиям из физики, химии, биологии, подчеркивает практическую значимость для учащихся успехов в предлагаемой деятельности.
Учащиеся актуализируют познавательные мотивы учения, мобилизуют волевые усилия.
Комментарии слайдов.
2 слайд - Нас окружают вещества, состоящие из молекул, молекулы из атомов, которые, в свою очередь, тоже имеют сложное строение. Важнейшие элементарные частицы, входящие в состав атомов - протоны, нейтроны и электроны. Строение атомов связано с положением элементов в периодической системе химических элементов. Периодическая система, как известно, является графическим изображением великого закона природы - периодического закона Д. И. Менделеева.
3 слайд - Вещества бывают разные: газообразные, жидкие и твердые, различающиеся по форме, объему, упругости и т. д. Кроме того, вещества делят на простые и сложные. Это 2 классификации по агрегатному состоянию и составу. Сегодня мы обращаемся к простым и сложным веществам газообразного агрегатного состояния.
4 слайд - Для понимания газовых законов необходимо знать следующие понятия: "элемент", "аллотропия", относительная атомная масса (отношение массы атома элемента к 1/12 массы атома углерода), относительная молекулярная масса.
5 слайд - Одно из важнейших понятий в химии и молекулярной физике - это количество вещества, определяется в единицах моль. На слайде представлены формулы для подсчета количества вещества через количество частиц, отнесенных к числу Авогадро и через отношение объема газа к его молярному объему, который является постоянной величиной при нормальных условиях.
6 слайд - С веществами в природе постоянно происходят физико-химические явления. Обратите внимание на то, чем они отличаются, и на то, что они сопровождают друг друга.
7 слайд - Эти слайды напоминают о великих законах, которые важны при изучении процессов, связанных с любыми веществами. Закон сохранения массы веществ открыл М. В. Ломоносов, мы , например, его применяем всегда, когда расставляем коэффициенты при написании уравнений химических реакций. Закон постоянства состава открыл другой ученый физико - химик Антуан Лавуазье.
8 слайд - Идеальная модель для определения структуры вещества это газ. Газовые системы достаточно хорошо изучены. Сейчас мы повторим важнейшие газовые законы.
9 слайд - Для описания газа вводится дополнительная величина - относительная плотность ( отношение молярной массы одного газа к молярной массе другого газа ).
10 слайд - Очень древний и важный газовый закон - это закон Авогадро. Мы пользуемся 3-мя его главными следствиями: 1 моль любого газа при нормальных условиях всегда имеет постоянный объем, равный 22,4 л; отношение масс двух газов равно отношению их молярных масс; количество вещества газа равно отношению объема газа к
молярному объёму.
11 - Объединенный газовый закон описывается уравнением Менделеева - Клапейрона или уравнением идеального газа. На слайде представлены разные его записи, а также нормальные условия, при котором это уравнение справедливо. Уравнение Менделеева - Клапейрона имеет 3 важных следствия.
12 - При постоянной температуре произведение давления на объем является величиной постоянной - это изотермический процесс или закон Бойля - Мариотта.
13 - При постоянном давлении отношение объема к температуре является величиной постоянной - это изобарический процесс или закон Гей - Люссака.
14 - При постоянном объеме отношение давления к температуре есть величина постоянная - это изохорический процесс или закон Шарля.
Содержание
Создание условий для усвоения общепредметного понятия.
Учитель вводит новый учебный материал, одновременно актуализируя опорные знания из других предметов, осуществляя перспективные связи на уровне общих фактов, понятий, суждений, законов.
Учащиеся участвуют в объяснительной беседе, ищут пути решения проблемы в группах.
15 - Повторяемые законы не существуют сами по себе, они реальны и жизненны. Примером этому является процесс фотосинтеза. Ознакомимся со следующей задачей. Текст задачи читается вслух, и учащиеся решают её в группах.
В процессе фотосинтеза зеленые растения поглощают 200 млрд. тонн углекислого газа в год. Какой объем кислорода выделяется при этом и какая средняя температура будет на планете
( без учета других факторов).
Время истекло, проверяем решение задачи.
-
Кто желает прокомментировать решение задачи?
-
Есть ли другие способы решения задачи?
-
А теперь смотрим на экран и проверяем задачу, при этом руководители групп в балловом соотношении оцените результат работы на листках контроля.
16 - (Решение задачи открывается для проверки.)
Дано:
m (СО2) = 200 млрд. т =
= 21014г
---------------------------------
V(O2) = ?; Т = ?
Решение:
21014г свет х
1. nCO2 + mH2O Cn(H2O)m + nO2
44г/моль 22,4л/моль
х = 11014 л = 1011 м3 - V (O2)
2. = V/Vm = 1014/22,4 = 0,0451014моль - (O2)
3. PV = RT; P = 1атм = 105Па = 105Дж/м3;
R = 8,31Дж/мольК
VP 1011м3105Дж/м3
T = ------ = ------------------------------------- 270К
R 0,0451014моль8,31Дж/мольК
-
t = 270 - 273 = -3С
Задача убедила нас в том, что изучаемые законы применяются в природе, например в процессе фотосинтеза.
Назовите другие примеры использования изучаемых понятий и законов. ( Дыхание, питание, метаболизм, закономерности многих химических реакций изучаются на основе газовых законов).
А теперь попытайтесь построить структурно логическую схему СЛС, вставляя в схему необходимые слова, буквенные обозначения или формулы, используемые на нашем уроке. Ваша задача, разобраться в иерархии повторяемых понятий и законов, т. е. определить, какие законы являются важнейшими, фундаментальными, а какие им подчиняются, их составляют, и, наконец, какие понятия служат для составления этих законов. /Учащимся раздаётся памятка для составления СЛС. Процесс обсуждения и составления схемы происходит в группах./
Памятка по изучаемой теме
Основные понятия и законы молекулярной физики и химии.
-
Периодический закон и периодическая система химических элементов Д. И. Менделеева.
-
Вещество: газообразное, жидкое, твердое ( по агрегатному состоянию ); простое и сложное ( по составу ).
-
Химический элемент. Ar , Mr.
-
- количество вещества (моль): = m/М; = /А; А = 6,021023моль-1
5. Физические явления ( изменяется форма, физическое состояние или образуются новые вещества за счет изменения атомных ядер ); химические явления ( одни вещества превращаются в другие, отличающиеся от исходных составом и свойствами, при этом не происходит изменения состава атомных ядер ).
-
Закон сохранения массы. Закон постоянства состава.
-
Газовые законы:
-
Закон Авогадро и следствия из него:
= V/Vm ; Vm = 22,4л/моль; m1 / m2 = М1 / М2
Нормальные условия: Тнорм. = 273К = 0С; Рнорм.= 101 кПа = 760мм рт. ст.
-
Относительная плотность газа : D = М1/М2.
-
Закон Менделеева - Клапейрона : PV = RT ; следствия из него:
-
Закон Бойля - Мариотта: при Т = const, PV = const
( изотермический процесс ).
-
Закон Гей - Люссака: при P = const, V/T = const ( изобарический процесс ).
-
Закон Шарля: при V = const, Р/Т = const
( изохорический процесс ).
Задача.
В процессе фотосинтеза зеленые растения поглощают 200 млрд. тонн углекислого газа в год. Какой объем кислорода выделяется при этом и какая средняя температура будет на планете (без учета других факторов).
По окончании работы проводится обсуждение полученной закономерности. Коллегиально приходим к следующей СЛС, которая записывается на доске:
Закономерности химических реакций,
дыхание, питание,
фотосинтез, метаболизм.
↑
Закон сохранения.
Закон периодичности.
↑
Закон Авогадро и следствия.
Закон Менделеева - Клапейрона и следствия.
↑
Вещества
Явления
Макропараметры: m, V, P, T, D, .
Микропараметры: Ar, Mr, .
Средства
Создание условий для переноса, обобщения общепредметного понятия при решении задач
Учитель предлагает применить ранее усвоенные знания и умения и выработать новые общепредметные умения: речевые, коммуникативные, творческие, практические, оценочные.
Учащиеся решают, объясняют и оценивают предложенные общепредметные задачи.
Выполняется тест № 1 , который проверит знание и умение применять понятия и законы газовых систем на первом уровне.
По истечении отведенного времени проверяется решение 1-го теста на компьютере, в листе самоконтроля делается отметка.
После выполнения этого теста, проверяются знания на более сложном уровне. Решается тест № 2 и тест № 3.
Аналогично проводится самопроверка и ставится соответствующая отметка в лист самоконтроля.
/Вопросы теста находятся в приложении./
Результат
Обеспечить системность знаний, умений обобщения, целостность мировоззрения.
Учитель побуждает к формулированию выводов, обобщению, систематизации знаний по межпредметному понятию.
Учащиеся формулируют выводы, обобщения, фиксируют достижения в овладении новыми знаниями, умениями, связями за счет особенностей предметов.
Ещё раз проговаривается тема урока, основные выводы по уроку в составлении с СЛС.
Закономерности химических реакций,
дыхание, питание,
фотосинтез, метаболизм.
↑
Закон сохранения.
Закон периодичности.
↑
Закон Авогадро и следствия.
Закон Менделеева - Клапейрона и следствия.
↑
Вещества
Явления
Макропараметры: m, V, P, T, D, .
Микропараметры: Ar, Mr,
Контроль
Создание условий для оценки и самооценки знаний и умений по разным предметам и умений их синтеза.
Учитель проверяет качество усвоенных знаний: систематичность, полноту, гибкость, оперативность.
Учащиеся выполняют предложенные задания и осуществляют самопроверку знаний, заполняют карту контроля и самоконтроля.
Учащимся даётся контрольный тест по новому материалу./Вопросы находятся в приложении /. Далее он проверяется, и осуществляется самоконтроль знаний.
Заполняются листы рефлексии. Руководители групп озвучивают результаты.
- Вновь обратимся к плану урока. Он нами выполнен? Как вы думаете, что осталось?
- Д/З: Составить СЛС по теме Основы молекулярно - кинетической теории и ее межпредметных связей.
Приложение к Интегрированному уроку по теме "Основные понятия и законы
молекулярной физики и химии "
-
Карта контроля знаний
1
2
3
4
5
6
7
-
Лист самоконтроля
Ф. И.
1. Усвоил тему
2. Усвоил понятие
3. Решил задачу
4. Был активен на уроке и предлагал правильные ответы
5. Выполнил тест
Шкала оценок за урок ( записывается на доске)
"5" - 22 - 27 бал.
"4" - 19 - 21 бал.
"3" - до 18 бал.
-
Ф. И.
Усвоил понятия
и законы
Решил задачу
Построил СЛС
Решил тест 1
Решил тест 2
Решил тест 3
Оценка за урок
Максимальный балл
5
5
5
3
4
5
27
Задание на дом:
Составить СЛС «Основы молекулярно - кинетической теории» и ее межпредметных связей.
Тест 1.
-
При протекании химической реакции
А) сохраняется суммарная масса веществ;
Б) сохраняются молекулы веществ;
В) сохраняются атомы веществ, вступивших в реакцию;
Г) происходят физические явления.
Выберите неверное утверждение.
2. Наибольшее число молекул содержится при обычных условиях в 1 л
А) сероводорода; Б) воды;
В) водорода; Г) аммиака.
3. Какое выражение соответствует определению массы одной молекулы?
А) mNA/VM Б) M/m0
В) М/NA Г) m/М
Тест 2.
1. Какое из указанных ниже утверждений справедливо:
А) при н. у. в 22,4 л НNO3 содержится 6,021023 молекул;
Б) при н. у. в 22,4 л О2 содержится 6,02104 молекул;
В) при н. у. в 22,4 л F2 содержится 6,021023 молекул;
Г) при н. у. в 22,4 л Al содержится 6,021023 атомов.
2. При некоторой температуре относительная плотность паров серы по азоту равна 9,14. Сколько атомов серы в ее молекуле при этой температуре?
А) 1 (S); Б) 2 (S2); В) 6 (S6); Г) 8 (S8).
3 . На диаграмме V - T представлен V 1
. На диаграмме V - T представлен V 1
график зависимости объема данной
массы идеального газа от температуры.
Как изменялось давление газа при
переходе из состояния 1
в состояние 2? 2
 0
0
А) все время увеличивалось ; Т
Б) все время уменьшалось;
В) сначала увеличивалось, затем уменьшалось;
Г) сначала уменьшалось, затем увеличивалось.
Тест 3.
1. В сосуде объемом 8,3 м3 находится 0,02 кг водорода при температуре 27С. Определите его давление.
А) 3 Па Б) 270 Па
В) 3103 Па Г) 6103 Па
2 . Какой точке на графике Р 2
. Какой точке на графике Р 2
изменения состояния идеального 
газа в координатных осях P - V 3
соответствует минимальное 4
значение температуры газа?
1
V
 0
0
А) 1 Б) 2; В) 3; Г) 4.
3. В каком количестве вещества оксида серы (IV) содержится такое же число атомов серы, что и в пирите FeS2 массой 24 г?
А) 0,4 моль; Б) 1 моль; В) 4 моль; Г) 0,4 моль.
Тесты по теме
"Основные понятия и законы молекулярной
физики и химии".
1. К химическим процессам относится:
А) горение магниевой ленты;
Б) вытягивание медной ленты;
В) перегонка нефти;
Г) испарение воды.
-
На основании химической формулы нельзя определить
А) массовые доли элементов в соединении;
Б) малярную массу вещества;
В) изотопный состав вещества;
Г) принадлежность вещества к определенному классу.
3. При одинаковых температурах и давлении 1 л газообразного кислорода и 1 л газообразного водорода имеют равные
А) массы; Б) плотности;
В) число молекул; Г) растворимость.
4. Какая из нижеприведенных формул является уравнением состояния идеального газа?
А) = / А Б) Е = 3/2*Т
В) PV = m/М*RT Г) М = moNA
5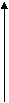 . Какому процессу соответствует график, изображенный на рисунке? Р
. Какому процессу соответствует график, изображенный на рисунке? Р
--------------------
 А) изохорному; Б) изотермическому, 0 Т
А) изохорному; Б) изотермическому, 0 Т
В) изобарному; Г) адиабатному.
6. С помощью понятия "моль" можно описать
А) количество песчинок в 1 т песка;
Б) массу молекул вещества в 1 л раствора;
В) объем, занимаемый газом при н. у.
Г) плотность вещества.
7. В сосуде емкостью 80 л находится 42 г азота. Вычислите, сколько моль азота содержится в 1 л.
А) 0,019 моль; Б) 0,19 моль; В) 0,038 моль; Г) 0,075 моль.
8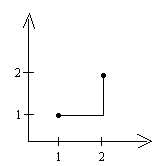 . Состояние идеального газа изменилось в соответствии с графиком, изображенным на рисунке.
. Состояние идеального газа изменилось в соответствии с графиком, изображенным на рисунке.
В состоянии 1 температура газа
была равна Т0. Определите Р
температуру газа в состоянии 2.
1
А) Т0; Б) 2Т0; В) 3Т0; Г) 4Т02 T
0
9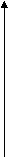 . Какой точке на графике Р 2
. Какой точке на графике Р 2
изменения состояния идеального 
газа в координатных осях P - V 3
соответствует минимальное 4
значение температуры газа?
1
 V
V
0
А) 1 Б) 2; В) 3; Г) 4.
10. Как изменится температура идеального газа, если увеличить его объем в 4 раза при осуществлении процесса, в котором давление и объем газа связаны соотношением PV2 = const?
А) Температура газа увеличится в 4 раза;
Б) Температура газа уменьшится в 4 раза;
В) Температура газа увеличится в 16 раз;
Г) Температура газа уменьшится в 16 раз.
11. Относительная плотность галогеноводорода по воздуху равна 4,4. Определите относительную плотность этого газа по водороду и назовите его.
А) фтороводород; Б) хлороводород;
В) бромоводород; Г) иодоводород.


