- Преподавателю
- Физика
- Урок Идеальный газ. Основное уравнение МКТ
Урок Идеальный газ. Основное уравнение МКТ
| Раздел | Физика |
| Класс | 10 класс |
| Тип | Конспекты |
| Автор | Федица А.В. |
| Дата | 27.09.2015 |
| Формат | docx |
| Изображения | Есть |
|
| ||
| Тема занятия | Идеальный газ. Основное уравнение молекулярно-кинетической теории. | |
| Тип урока | изучение нового материала, решение задач | |
| Источники и оборудования | компьютер, презентация, карточки с задачами, таблица Менделеева. | |
| Общая цель | познакомиться с понятием идеального газа, рассмотреть основное уравнение молекулярно-кинетической теории газов | |
| Задачи | - усвоить понятия идеального газа, основное уравнение МКТ; - на основе МКТ установить количественную зависимость давления газа от массы одной молекулы и среднего квадрата скорости ее движения; - учить устанавливать причинно-следственные связи в изучаемых явлениях, формулировать эмпирические закономерности; - воспитывать ответственное отношение к учебе, положительное отношение к предмету физики. | |
| Результаты обучения для учащихся. | Знать | уравнения молекулярно-кинетической теории, знать определение идеального газа, закон Авогадро, постоянную Больцмана. |
| Понимать | алгоритм решения задач по теме, идеальный газ это - модель, | |
| Уметь | работать в группах, работать с материалом, предоставленным учителем | |
Ход урока
Деятельность учащихся
Деятельность учителя
1. Орг. момент
Психологический тренинг, создание коллаборативной среды
Приветствие.
- Доброе утро, солнце! (все поднимают руки, затем опускают).
- Доброе утро, небо! (аналогичное движение).
- Доброе утро, всем нам! (все разводят руки в стороны, затем опускают).
2.Актуализация знаний. Самостоятельная работа.
1. Проверка домашнего задания (решение задач у доски и в тетради).
2. Фронтальный опрос «Забей гол».
3. Формулировка целей и задач урока.
1. Решают задачи 1 учащийся у доски, 2 учащихся в тетрадях - задачи трёх уровней сложности А - высокий уровень, В - средний и С - низкий.
Вариант А.
Какую массу имеет 3·1023 атомов ртути?
Вариант В.
Сколько молекул содержится в 1 г углекислого газа?
Вариант С.
Определить молярную массу меди (Cu), водорода (H2), воды (H2O), серной кислоты (H2SO4)?
2. Отвечают на вопросы.
-
Что такое молекулярно-кинетическая теория? Сформулируйте ее основные положения.
-
Какие наблюдения и эксперименты подтверждают основные положения молекулярно-кинетической теории?
-
Что называют броуновским движением? Каковы его особенности?
-
Что называют диффузией? Приведите примеры диффузии в газах, жидкостях и твердых телах.
-
От чего зависит скорость диффузии? О чем свидетельствует явление диффузии?
-
Что называют количеством вещества? Какая формула выражает смысл этого понятия? Какова единица количества вещества? Сформулируйте определение этой единицы.
-
Что называют постоянной Авогадро? Чему она равна?
-
Что такое молярная масса вещества? Какая формула выражает связь молярной массы вещества с числом Авогадро? Какова единица молярной массы?
3. Баллы за ответы и решения задач ставят в бланк ответов.
4. Определение задач урока.
1. Контролирует решение задач.
2. Задаёт вопросы.
3. Мы с вами продолжаем изучение основ молекулярно-кинетической теории. На предыдущих уроках мы рассмотрели основные положения МКТ, научились определять размеры и массу молекул. Сегодня на уроке необходимо на основе МКТ установить количественную зависимость давления газа от массы одной молекулы и среднего квадрата скорости ее движения. Поэтому тема урока: «Идеальный газ. Основное уравнение МКТ»
3. Изучение нового материала
1. Деление на группы (картинки молекул: водород, кислород, азот, гелий) - 4 группы.
2. Работа в группах составление презентаций.
3. Критерии оценивания.
4. Выступление учащихся.
1. Задания по группам, презентации не более 5 слайдов, рисунки, графики, текст не более 10 строк.
- Термодинамические параметры газа.
- Идеальный газ.
- Давление и его характеристика.
- Основное уравнение МКТ.
2. Выбор в группах спикера, секретаря (работает с презентацией)
3. Выбор критериев оценивания (наглядность, полнота и научность, доступность) - заполнение таблицы.
4. Учащиеся выступают, использую все возможности класса.
5. Оценивают в бланках оценок работу групп.
1. Раздаёт различные молекулы и учащиеся рассаживаются по группам.
2. Даёт задания по группам, делая пояснения.
3. Контролирует процесс работы.
4. Оценивает группы.
4. Закрепление изученного материала, решение задач
1. Решение задач по новой теме.
2. Мини-тест с взаимопроверкой.
1. Решение задач у доски и на опережение.
Задачи для решения у доски.
1. Определить кинетическую энергию 105 атомов гелия при температуре 47 ºС. (6,62· 10-16 Дж)
2. Найти концентрацию молекул кислорода, если его давление 0,2 МПа, а средняя квадратичная скорость молекул равна 700 м/с.
Решение задач на опережение.
3. Определите температуру газу, если средняя кинетическая энергия равна 5,6 ·10-21 Дж.
4. Сколько молекул содержится в 2 м3 газа при давлении 150 кПа и температуре 27 ºС.(7,2·1025 )
5. На сколько процентов увеличивается средняя кинетическая энергия молекул газа при увеличении его температуры от 7 до 35 ºС? ( На 10%)
2. Выполнение минитеста с взаимопроверкой результатов.
Мини-тест
1. Давление газа на стенку сосуда обусловлено
А. притяжением молекул друг к другу
Б. столкновениями молекул со стенками сосудов
В. столкновением молекул газа между собой
Г. проникновением молекул сквозь стенки сосуда
2. Как изменилось давление идеального газа, если в данном объеме скорость каждой молекулы газа увеличилась в 2 раза, а концентрация молекул осталась без изменения?
А. увеличилось в 2 раза
Б. увеличилось в 4 раза
В. уменьшилось в 2 раза
Г. уменьшилось в 4 раза
3. При повышении температуры идеального газа в запаянном сосуде его давление увеличивается. Это объясняется тем, что с ростом температуры...
А. увеличиваются размеры молекул газа
Б. увеличивается энергия движения молекул газа
В. увеличивается потенциальная энергия молекул газа
Г. увеличивается хаотичность движения молекул газа
4. Как изменится концентрация молекул газа при уменьшении объема сосуда в 2 раза?
А. увеличится в 2 раза
Б. уменьшится в 2 раза
В. не изменится
Г. уменьшится в 4 раза
5. При уменьшении температуры средняя кинетическая энергия молекул
А. увеличится
Б. уменьшится
В. не изменится
Г. иногда увеличится, иногда уменьшится
1 - Б, 2 - Б, 3 - Б, 4 - А, 5 - Б
5. Рефлексия
«Три М».
Учащимся предлагается назвать три момента, которые у них получились хорошо в процессе урока, и предложить одно действие, которое улучшит их работу на следующем уроке.
6. Домашнее задание
§4.4 - читать, стр 117-120, упр 8 (8,9)
| Задачи Вариант А. Какую массу имеет 3·1023 атомов ртути? Вариант В. Сколько молекул содержится в 1 г углекислого газа? Вариант С. Определить молярную массу меди (Cu), водорода (H2), воды (H2O), серной кислоты (H2SO4)?
|
| Задачи Вариант А. Какую массу имеет 3·1023 атомов ртути? Вариант В. Сколько молекул содержится в 1 г углекислого газа? Вариант С. Определить молярную массу меди (Cu), водорода (H2), воды (H2O), серной кислоты (H2SO4)?
|
| Задачи Вариант А. Какую массу имеет 3·1023 атомов ртути? Вариант В. Сколько молекул содержится в 1 г углекислого газа? Вариант С. Определить молярную массу меди (Cu), водорода (H2), воды (H2O), серной кислоты (H2SO4)?
|
Таблица оценки
Группа ___________
критерии
1
2
3
4
Таблица оценивания
ответ у доски
фронтальный опрос
работа в группе
решение задач
мини-тест
дополнительная работа на уроке
Задание для 1 группы
Термодинамические параметры.
Мы с вами прекрасно знаем, что окружающий нас мир многолик и многогранен. Он состоит из огромного количества разнообразных тел, которые поражают своеобразием размеров и форм. Эти тела в физике называются макроскопическими телами, или просто макротелами. Для характеристики макротел в науку вводят особые физические величины, которые в термодинамике называются термодинамическими параметрами. Под термодинамическими параметрами понимают физические величины, которые характеризуют свойства макротела (макросистемы) в целом. К ним относятся давление газа, объем, температура. Когда термопараметры макротела (макросистемы) не изменяются, то говорят об определенном состоянии этого тела. При переходе тела из одного состояния в другое его термопараметры изменяются. В этом случае говорят не о состоянии, а о процессе, т.е. термодинамический процесс представляет собой явление изменения какого-то термопараметра или переход системы из одного состояния в другое.
Все макротела состоят из микротел (атомов и молекул). Микротела тоже имеют свои характеристики (микропараметры). К ним относятся объем V0 молекулы (атома), масса т0 молекулы (атома), скорость v0 молекулы (атома), концентрация п молекул (атомов). Понятно, что процессы, происходящие с макротелами, обусловлены изменением параметров микротел, из которых данное макротело состоит.
Напоминаем, что каждая физическая величина несет определенную информацию, т.е. имеет физический смысл. Так, например, масса макротела показывает нам, какое количество вещества содержится в данном теле, объем - какое место в пространстве занимает тело, давление газа характеризуется силой, с которой газ действует на единицу площади.
Параметр
Обозначение
Единицы в СИ
Способ измерения (косвенный способ)
Масса газа
M
Кг
Весы
Объем сосуда
V
М3
Мерный цилиндр с водой; измерение размеров и расчет по формулам геометрии
Давление
P
Па
Манометр
Температура
T
К
Термометр
Плотность
Кг/м3
Измерение массы, объема и расчет
Концентрация
N
1/м3 = м-3
Измерение плотности и расчет с учетом молярной массы
Cостав (молярная масса и соотношение количеств )
М1, М2,
1: 2
Кг/моль
безразмерная
Приготовление газа смешением заданных масс или объемов
Задание для 2 группы
Идеальный газ
Идеальный газ - это модель реального газа, которая обладает следующими свойствами:
-
Молекулы пренебрежимо малы по сравнению со средним расстоянием между ними.
-
Молекулы ведут себя подобно маленьким твердым шарикам: они упруго сталкиваются между собой и со стенками сосуда, никаких других взаимодействий между ними нет.
-
Молекулы находятся в непрекращающемся хаотическом движении.
Все газы при не слишком высоких давлениях и при не слишком низких температурах близки по своим свойствам к идеальному газу. При высоких давлениях молекулы газа настолько сближаются, что пренебрегать их собственными размерами нельзя. При понижении температуры кинетическая энергия молекул уменьшается и становится сравнимой с их потенциальной энергией, следовательно, при низких температурах пренебрегать потенциальной энергией нельзя.
При высоких давлениях и низких температурах газ не может считаться идеальным. Такой газ называют реальным. (Поведение реального газа описывается законами, отличающимися от законов идеального газа.)
Основные отличия идеального газа от реального газа:
1. Частицы идеального газа - сферические тела очень малых размеров, практически материальные точки.
2. Между частицами отсутствуют силы межмолекулярного взаимодействия.
3. Соударения частиц являются абсолютно упругими.
Реальные разреженные газы действительно ведут себя подобно идеальному газу. Воспользуемся моделью идеального газа для объяснения происхождения давления газа.
Задание для 3 группы
Давление и его характеристики
Из изученного материала вы знаете, что газы, в отличие от твердых тел и жидкостей, занимают весь предоставленный им объем. Например, газ полностью заполняет стальной баллон для хранения газов, камеры автомобильной машины или волейбольного мяча и т. д. При этом газ оказывает давление на стенки сосуда, в котором он находится.
Известно, что молекулы газа непрерывно и беспорядочно движутся с большой скоростью. При этом они сталкиваются с другими молекулами, а также со стенками сосуда, в котором находится газ. В одном кубическом сантиметре воздуха содержится очень много молекул, поэтому и число ударов огромно. Например, установлено, что в воздухе, находящемся в комнате, число ударов молекул за 1 с на площадь 1 см2 выражается двадцатизначным числом. Хотя удар отдельной молекулы слаб, но действие ударов всех молекул о стенки сосуда значительно. Оно и является причиной давления газа. Итак, давление газа на стенки сосуда (и на помещенное в газ тело) вызывается ударами молекул газа.
Рассмотрим такой опыт. Под колокол воздушного насоса помещают завязанный резиновый шар, в котором имеется небольшое количество воздуха. Затем насосом откачивают воздух из-под колокола. Оболочка шара, вокруг которой воздух становится все более разреженным, постепенно раздувается и в конце концов принимает форму шара.
Как можно объяснить этот опыт? В начале движущиеся молекулы газа непрерывно ударяются о стенки шара внутри и снаружи. При откачивании воздуха число молекул вокруг шара уменьшается. Но внутри завязанного шара число молекул не изменяется, поэтому число ударов молекул о внешние стенки оболочки шара становится меньше числа ударов о внутренние стенки.
Шар будет раздуваться до тех пор, пока сила упругости его резиновой оболочки не станет равной силе давления газа. Форма шара, которую принимает раздутая оболочка, показывает, что газ оказывает одинаковое давление на ее стенки по всем направлениям. Одинаковое давление по всем направлениям - характерное свойство газов. Оно является следствием беспорядочного движения огромного числа молекул. Чем чаще молекулы газа ударяются о стенки сосуда, тем больше давление газа.
Следовательно, в случае, когда объем газа не меняется, давление газа в закрытом сосуде тем больше, чем выше его температура.
Из этого опыта можно сделать следующий вывод: чем чаще и сильнее молекулы газа ударяются о стенки сосуда, тем больше давление газа.
Для перевозки и хранения газов их сильно сжимают. Вследствие этого давление газа возрастает, поэтому газы заключают в очень прочные стальные баллоны.
В СИ за единицу давления принимают 1 Па.
Давление, при котором на площадь 1 м2 действует сила давления в 1 Н, называется Паскалем.
1мм.рт.ст. = 133 Па
1атм = 1105 Па
Задание для 4 группы
Основное уравнение МКТ
Одной из основных задач молекулярно-кинетической теории газа является установление количественных соотношений между макроскопическими параметрами, характеризующими состояние газа (давлением, температурой), и величинами, характеризующими хаотическое тепловое движение молекул газа (скоростью молекул, их кинетической энергией). Одним из таких соотношений является зависимость между давлением идеального газа и средней кинетической энергией поступательного движения его молекул. Эту зависимость называют основным уравнением молекулярно-кинетической теории идеального газа:
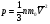 или
или 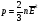 (1)
(1)
где р - давление газа; n - концентрация молекул газа (число его молекул в единичном объеме): m0 - масса молекулы газа, 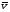 - средняя квадратичная скорость движения газовых молекул;
- средняя квадратичная скорость движения газовых молекул; 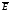 -средняя квадратичная энергия поступательного движения молекул идеального газа.
-средняя квадратичная энергия поступательного движения молекул идеального газа.
Давление идеального газа пропорционально средней кинетической энергии поступательного движения молекул и концентрации молекул.
Это давление тем больше, чем больше средняя кинетическая энергия поступательного движения молекул.
Средней квадратической скоростью называют величину, равную корню квадратному из среднего арифметического значения квадратов скоростей N молекул газа:
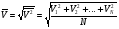
Средней кинетической энергией поступательного движения молекул идеального газа называют величину
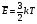
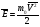 С учетом основного уравнения МКТ имеем:
С учетом основного уравнения МКТ имеем:
Из этой формулы видно, что средняя кинетическая энергия поступательного движения молекул газа пропорциональна абсолютной температуре.
В этой формуле k=1,3810-23 Дж/К - постоянная Больцмана.
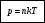 Давление газа зависит от концентрации молекул. Эта зависимость выражается формулой:
Давление газа зависит от концентрации молекул. Эта зависимость выражается формулой:
Давление газа не зависит от его природы, а определяется только концентрацией молекул и температурой газа.
Численное значение средней квадратичной скорости получим из формулы
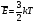 , т.к.
, т.к. 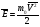 , то
, то 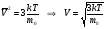



 10 «А» класс
10 «А» класс