- Преподавателю
- Физика
- Урок Электрический ток в электролитах
Урок Электрический ток в электролитах
| Раздел | Физика |
| Класс | 10 класс |
| Тип | Конспекты |
| Автор | Крестинина И.В. |
| Дата | 06.08.2015 |
| Формат | doc |
| Изображения | Есть |
8
Автор: Крестинина Ирина Викторовна, учитель высшей категории ГБОУ СОШ № 35 города Севастополя
Тема: Электрический ток в жидкостях. Законы электролиза.
Цель:
1. Определить характер проводимости электролитов и законы протекания тока в них.
2. Отработать навыки установления причинно-следственных связей, умения анализировать результаты экспериментов.
3. Формировать культуру научной речи с использованием соответствующей терминологии, навыки работы в группе.
Тип урока: изучение нового материала.
Форма проведения: традиционный урок с элементами проблемной деловой игры.
Оборудование: видеоаппаратура, мультимедийная техника, 5 установок для демонстрации электролиза (растворы соли, сахара, лимонной кислоты, соды, медного купороса), лабораторный амперметр, лабораторные лампочки на стойке, соединительные провода.
План урока:
1. Организационный момент (установление психологического контакта с аудиторией).
2. Актуализация материала и мотивация к изучению новой темы.
3. Изучение нового материала с поэтапным введением элементов деловой игры.
4. Закрепление изученного материала как заключительный этап деловой игры.
5. Домашнее задание.
6. Рефлексия.
На вспомогательной доске написаны вопросы к уроку:
1. Какие жидкости проводят электрический ток?
2. Почему электролиты проводят электрический ток?
3. Что представляет собой электрический ток в электролитах?
4. Что происходит в результате протекания тока через электролит?
5. Что влияет на результаты электролиза?
Ход урока:
1. Организационный момент (установление психологического контакта с аудиторией).
Здравствуйте! Сегодня мы с вами оказались в необычной ситуации, и поэтому для снятия напряжения и волнения я предлагаю вам начать урок с игры.
2. Актуализация материала и мотивация к изучению новой темы.
Поскольку мы изучаем большую тему «Электрический ток в различных средах», то наверняка вы помните, что есть вещества, которые проводят электрический ток, и вещества, которые не проводят его. Сейчас я буду перечислять различные вещества, а вы, в зависимости от того, проводят эти вещества ток или нет, будете либо сжимать руку в кулак, либо открывать ладонь. Итак: стекло, серебро, медь, пластмасса, железо, дерево, резина, алюминий, вода , сахар…
Учащиеся начинают сомневаться, как ответить на вопрос о воде или сахаре.
Чтобы ответить на этот вопрос, давайте проверим на практике, проводит вода электрический ток или нет.
Фронтально проводится эксперимент по проводимости чистой воды, по проводимости сухой соли, и, наконец, по проводимости раствора соли. Учащиеся убеждаются, что чистая вода не проводит электрический ток, а раствор соли является проводником.
Итак, мы с вами увидели, что одни жидкости проводят электрический ток, а другие - нет. Поэтому темой нашего сегодняшнего урока как раз и будет изучение электрического тока в жидкостях.
На доске высвечивается слайд №2 и объявляются задачи урока. Ученики записывают тему урока в тетради.
3. Изучение нового материала с поэтапным введением элементов деловой игры.
Весь урок мы будем работать как экспертная группа по изучению проводящих свойств жидкости. Вы разделены на три рабочих отдела, каждый из которых будет выполнять свои эксперименты, и находить ответы на поставленные вашему отделу вопросы. В работе отдела прошу вас учитывать мнение каждого участника и выбрать одного человека, который будет выступать в роли руководителя отдела.
Первое исследование будет посвящено определению жидкостей, которые проводят и не проводят электрический ток. Каждая группа проводит свой эксперимент по предоставленному плану и должна дать ответ, какие из представленных жидкостей являются проводниками.
1-ый отдел проводит опыты с лимонной кислотой
2-ой отдел проводит опыт с раствором сахара
3-ий отдел проводит опыт с раствором щелочи
А я вместе с вами проведу эксперимент с раствором медного купороса- соли меди.
После проведения опытов обобщаются их результаты. На доске высвечивается слайд №3. Учащиеся записывают в тетради определение электролитов. Учитель обращает внимание на то, что получен ответ на первый вопрос урока.
Итак, почему же электролиты обладают свойством проводимости, и что произошло с веществами после растворения в воде? Вспомните, какие необходимы условия для протекания электрического тока?
Учащиеся отвечают, что для существования электрического тока необходимо выполнение двух условий: наличие свободных заряженных частиц и наличие электрического поля.
Откуда же в электролите появляются свободные заряженные частицы? Рассмотрим процесс растворения подробнее.
На дополнительной доске заготовлен рисунок с изображением электролитической ванны с электродами. В качестве молекул вещества используются магниты двух цветов.
Когда молекулы электролита попадают в воду, на них начинают действовать полярные молекулы воды (диполи воды). Они нарушают связи ионов молекулы и «разрывают» ее. В результате образуются два вида ионов: положительные и отрицательные. Таким образом, при растворении солей, кислот, щелочей в воде происходит распад их молекул на ионы. Этот процесс носит название электролитической диссоциации
Высвечивается слайд №4
Очевидно, что в растворе остаются и нераспавшиеся молекулы, кроме того, часть ионов снова объединяются, поэтому в растворе устанавливается динамическое равновесие. Чем выше концентрация соли в растворе, тем больше свободных ионов в нем образуется.
Высвечивается слайд №5. Обращается внимание на то, что получен ответ на второй вопрос исследования. Далее продолжается работа с механической моделью электролиза.
Итак, первое условие существования электрического тока выполнено- свободные заряды появились. Выполним второе условие- создадим электрическое поле, подключим электроды к источнику тока.
На рисунке в механической модели учитель указывает положение анода и катода.
Положительные ионы начнут направленное движение к катоду, а отрицательные - к аноду.
Учитель распределяет на механической модели магниты в соответствии с движением ионов.
В результате на каждом из электродов скапливается один вид ионов, и они могут вступать в реакцию с электродами (отбирая или отдавая им «недостающие или» «лишние»электроны). При этом на электродах выделяются чистые вещества.
Высвечивается слайд №6. Дается определение электролиза.
Особенно широко электролиз применяется для выделения чистого металла из его соли. Например, выделение чистой меди из раствора медного купороса:
диссоциация: CuSO4 ↔ Cu2+ + SO42-
электролиз: катод: Cu2+ + 2e- → Cu
Аналогично можно выделять чистые металлы из солей алюминия, серебра, хрома, никеля, цинка и т.д. Только количество выделившегося металла будет разным, т. к. ионы разных веществ имеют разную массу.
Обращается внимание на то, что получен ответ на третий вопрос.
А теперь мы продолжим работу экспертных отделов. Я предлагаю вам видеозапись проведения эксперимента по электролизу меди из медного купороса в различных условиях опыта. Ваша задача - внимательно просмотреть ее и ответить на поставленный вопрос: от чего зависит масса выделившегося на электроде вещества?
Для каждого отдела вопрос конкретизирован:
1) как зависит масса выделившегося вещества от силы тока?
2) как зависит масса выделившегося вещества от времени протекания тока?
3) зависит ли масса выделившегося вещества от вида вещества (типа его молекул)?
Идет просмотр видеосюжета, обсуждение в отделах и сообщение результатов исследования.
Итак, масса выделившегося вещества прямо пропорциональна силе тока, протекающего через электролит, промежутку времени, в течение которого проходил электролиз, и коэффициенту пропорциональности, характеризующему электрохимические особенности каждого вещества:
m = kIΔt = kΔq
Высвечивается слайд №7. Учащимся предлагается определить физический смысл электрохимического эквивалента k. Для этого он выражается из математической формулы закона электролиза:
![]() ы
ы
Таким образом, электрохимический эквивалент вещества показывает, какая масса вещества в килограммах выделяется на электроде при протекании тока, переносящего заряд, равный одному кулону (1 Кл).
Электрохимический эквивалент указан в таблицах сборников для решения задач (предлагается открыть страницу сборника задач и просмотреть таблицу электрохимических эквивалентов).
В ходе нашей работы мы пришли к выводу, что на значение электрохимического эквивалента влияют характеристики вещества. Как вы думаете, какие именно характеристики влияют на значение k? Чем именно отличаются вещества друг от друга?
Учащиеся, направляемые учителем, приходят к выводу, что главное отличие заключается в относительной молекулярной массе вещества: чем больше масса молекулы (соответственно и иона), тем большая масса в итоге выделяется на электроде. Также отличие может заключаться и в валентности вещества - чем больше валентность, тем больше электронов присоединит ион.
В тетрадях записывается математическое выражение второго закона электролиза и высвечивается слайд №8:
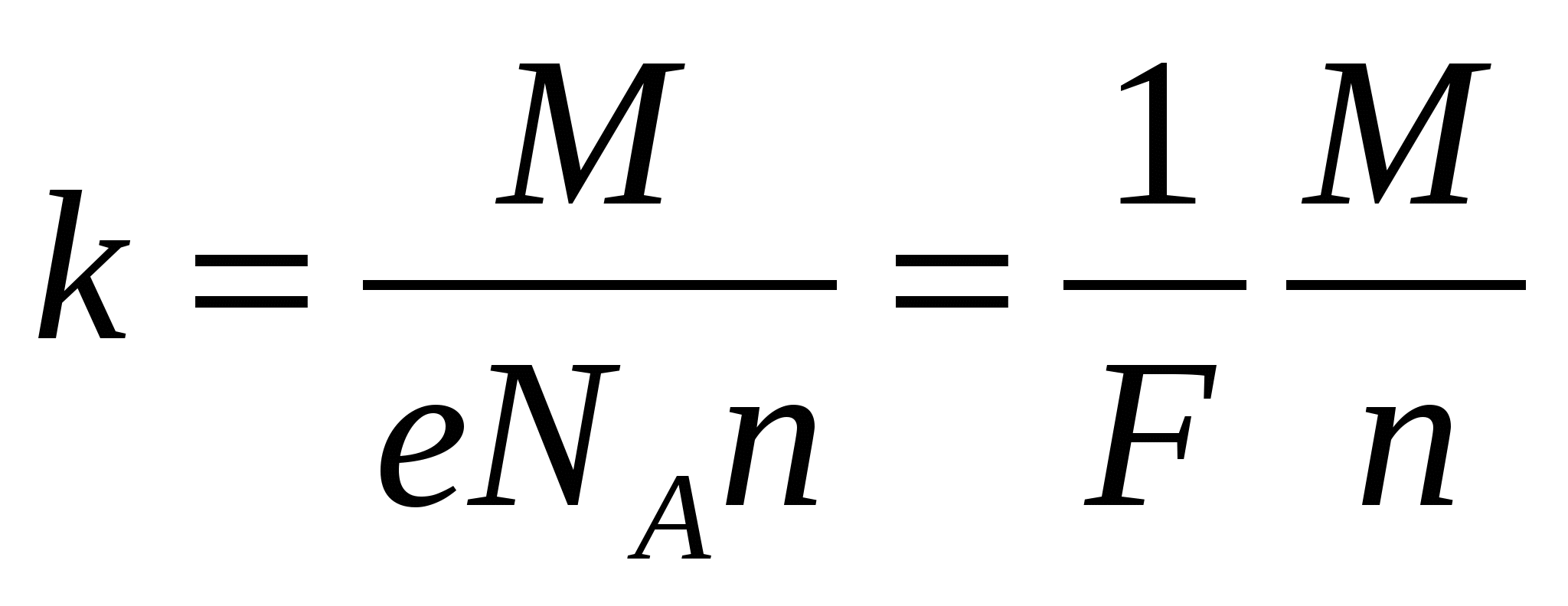
Электрохимический эквивалент вещества прямо пропорционален его молярной массе и обратно пропорционален его валентности.
Обращается внимание на то, что получен ответ на четвертый вопрос исследования.
4. Закрепление изученного материала как заключительный этап деловой игры.
Заключительным этапом работы экспертных отделов будет прогнозирование результатов эксперимента при различных условиях опыта.
Высвечивается слайд №9 с общей задачей, но у каждого отдела свои условия проведения опыта: электрический ток пропускают через электролитическую ванну, наполненную раствором медного купороса. Как изменится количество меди, выделяющееся на катоде за один и тот же промежуток времени, если …
1-ый отдел - … если увеличить напряжение на электродах?
2-ой отдел - … если увеличить концентрацию раствора?
3-ий отдел - … если нагреть раствор электролита?
По мере того, как учащиеся отвечают на поставленные вопросы, высвечиваются слайды №№10,11,12. Обращается внимание на то, что получен ответ на пятый вопрос исследования.
5. Домашнее задание.
Экспертная группа справилась с заданием и ответила на все вопросы исследования. На протяжении всего урока проходил электролиз меди из медного купороса, и я предлагаю вам посмотреть результат этого эксперимента.
Учитель демонстрирует угольный электрод с рыжим налётом меди как результат выделения чистого вещества при протекании электрического тока через электролит. После этого учитель проводит подведение итогов урока и задает задание на дом. Высвечивается слайд №13.
Осталось только показать вам, насколько широкое применение в современной технике получили изученные нами явления.
Высвечивается слайд №14. ( рафинирование металлов- очищение от примесей; гальванопластика; гальваностегия; электрометаллургия- получение металлов из руд)
Но это уже тема совсем другого урока.
6. Рефлексия.
Наш урок завершается. У вас на столах лежат полоски цветной бумаги. Я предлагаю вам создать букет ваших впечатлений по итогам урока - вставить в вазы полоски бумаги, которые соответствуют вашему впечатлению от урока. Если вам было интересно - опустите полоску оранжевой бумаги в эту вазу; если скучно, то выберите зеленую полоску. Если урок был вам непонятен, то опустите в вазу полоску синей бумаги. Ярких вам букетов после каждого урока.
НАШ УРОК ОКОНЧЕН. ДО СВИДАНИЯ!
Задание для первого отдела
1. Проверить проводимость раствора лимонной кислоты.
Для этого насыпьте кислоту в стакан с водой и хорошо размешайте, вставьте в стакан электроды, включите источник тока в сеть и замкните ключ. Сделайте вывод о проводимости тока данным раствором.
2. Просмотреть видеосюжет и ответить на вопрос как зависит масса выделившегося на катоде вещества от силы тока, протекающего через электролит?
3. Электрический ток пропускают через электролитическую ванну, наполненную раствором медного купороса. Как изменится количество меди, выделяющейся на катоде за один и тот же промежуток времени, если увеличить напряжение на электродах?
Задание для второго отдела
1. Проверить проводимость раствора сахара в воде.
Для этого насыпьте сахар в стакан с водой, хорошо размешайте, вставьте в стакан электроды, включите источник тока в сеть и замкните ключ. Сделайте вывод о проводимости тока данным раствором.
2. Просмотреть видеосюжет и ответить на вопрос как зависит масса выделившегося на катоде вещества от промежутка времени протекания тока через электролит?
3. Электрический ток пропускают через электролитическую ванну, наполненную раствором медного купороса. Как изменится количество меди, выделяющейся на катоде за один и тот же промежуток времени, если увеличить концентрацию раствора?
Задание для третьего отдела
1. Проверить проводимость раствора щелочи.
Для этого приготовьте щелочной раствор в стакане, вставьте в стакан электроды, включите источник тока в сеть и замкните ключ. Сделайте вывод о проводимости тока данным раствором.
2. Просмотреть видеосюжет и ответить на вопрос зависит ли масса выделившегося на катоде вещества от его вида? Почему?
3. Электрический ток пропускают через электролитическую ванну, наполненную раствором медного купороса. Как изменится количество меди, выделяющейся на катоде за один и тот же промежуток времени, если нагреть раствор электролита?
Задание для первого отдела
1. Проверить проводимость раствора лимонной кислоты.
Для этого насыпьте кислоту в стакан с водой и хорошо размешайте, вставьте в стакан электроды, включите источник тока в сеть и замкните ключ. Сделайте вывод о проводимости тока данным раствором.
2. Просмотреть видеосюжет и ответить на вопрос как зависит масса выделившегося на катоде вещества от силы тока, протекающего через электролит?
3. Электрический ток пропускают через электролитическую ванну, наполненную раствором медного купороса. Как изменится количество меди, выделяющейся на катоде за один и тот же промежуток времени, если увеличить напряжение на электродах?
Задание для второго отдела
1. Проверить проводимость раствора сахара в воде.
Для этого насыпьте сахар в стакан с водой, хорошо размешайте, вставьте в стакан электроды, включите источник тока в сеть и замкните ключ. Сделайте вывод о проводимости тока данным раствором.
2. Просмотреть видеосюжет и ответить на вопрос как зависит масса выделившегося на катоде вещества от промежутка времени протекания тока через электролит?
3. Электрический ток пропускают через электролитическую ванну, наполненную раствором медного купороса. Как изменится количество меди, выделяющейся на катоде за один и тот же промежуток времени, если увеличить концентрацию раствора?
Задание для третьего отдела
1. Проверить проводимость раствора щелочи.
Для этого приготовьте щелочной раствор в стакане, вставьте в стакан электроды, включите источник тока в сеть и замкните ключ. Сделайте вывод о проводимости тока данным раствором.
2. Просмотреть видеосюжет и ответить на вопрос зависит ли масса выделившегося на катоде вещества от его вида? Почему?
3. Электрический ток пропускают через электролитическую ванну, наполненную раствором медного купороса. Как изменится количество меди, выделяющейся на катоде за один и тот же промежуток времени, если нагреть раствор электролита?


